Laboratorio - 3 - Cuestionario
Anuncio

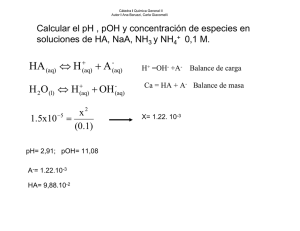
Cuestionario (Solubilidad) 1) Enumerar las posibles causas de error que a su juicio pueden producirse. Al realizar la experiencia puede haber varios factores que lleven a los errores, uno de ellos es medir mal la cantidad de agua vertida en el tubo de ensayo, el no ver la aparición de los primeros cristales esto llevaría a que cuando se mida la temperatura sea en realidad otra, y desde luego el medir mal la temperatura en el termómetro. 2) ¿Qué entiende por solución? Una solución es un sistema homogéneo formado por dos o más sustancias. 3) Defina: Solución saturada, no saturada, concentrada y diluida. Solución saturada: Solución que contiene la máxima cantidad de soluto que el solvente puede disolver a esa presión y esa temperatura. Si se le agrega más soluto no lo disuelve: si es un sólido en un solvente líquido, el exceso precipita; si es un líquido en solvente líquido, el exceso queda separado del solvente por encima o por debajo según su densidad relativa; si es un gas en un solvente líquido, el exceso de soluto escapa en forma de burbujas. Solución no saturada: Solución que contiene una cantidad de soluto menor que la que el solvente puede disolver a esa presión y esa temperatura. Solución concentrada: Tienen la mayor cantidad posible de soluto para una temperatura y presión dadas. En estas existe un equilibrio entre el soluto y el solvente. Solución diluida: Es aquella en donde la cantidad de soluto que interviene está en mínima proporción en un volumen determinado. 4) En el gráfico confeccionado en papel milimetrado señale, para una temperatura dada: a) Un punto correspondiente a una solución saturada. b) Otro que corresponda a una solución NO saturada. c) Un tercer punto que corresponda a una solución sobresaturada. 5) Explique como se consigue obtener una solución sobresaturada, partiendo de la solución saturada a una temperatura dada. Para obtener una solución sobresaturada partiendo de la solución saturada se enfría sin agitar. 6) ¿Cómo se varía generalmente la solubilidad de las sales en agua, respecto de la temperatura? La relación es directamente proporcional, “a mayor temperatura, mayor solubilidad”. 7) Mencione ejemplos en los que la solubilidad se aparte de los casos generales mencionados en el punto 6. La Solubilidad solutos sólidos disminuye al aumentar la temperatura, como por ejemplo con el Sulfato Sódico (Na2SO4) y el Hidróxido de Calcio (Ca(OH)2) 8) ¿Cómo varia la solubilidad de un soluto gaseoso con la temperatura y la presión? Cita Ejemplos. La solubilidad de los gases es directamente proporcional a la presión e inversamente proporcional a la temperatura. Ejemplo: una botella de gaseosa pierde mas rápidamente el gas cuando está caliente que cuando está fría, y al destaparla la presión sobre la superficie del líquido se reduce y cierta cantidad de burbujas de dióxido de carbono suben a la superficie. 9) Una solución acuosa de 30g de AgN03 en 100g de solución tiene una densidad de 1,32g/cm3. Expresar la concentración en: a) g de sal/ 100g de agua b) g de sal/ L de solución c) g de sal / dm3 de agua d) Molaridad 2 a) Masa de soluto(st)+ masa de solvente(sv) = masa de solución(sl) 30g+ M sv = 100g M sv= 70g 30g st ______70g sv X= 42,8g st ______100g sv 42,8g de sal /100g de agua b) Densidad= m/v V=100/1,32 V= 75,8cm3 sl 30g st _____ 75,8 cm3 X= 395,8g st___1000 cm3 sl 395,8g de sal /L de agua c) Densidad= m/v Densidad del agua: 1g/ cm3 V=70/1 V=70 cm3 30g st ____70g sv X= 428,6g ____1000 cm3 sv 428,6g de sal / dm3 de agua d) nº de moles __________ 1000 cm3 de solución 30g st____ 75,8 cm3 sl X=395,8g st_____ 1000 cm3 de sl Mr= 170g n= m/MR n= 395,8/170 n= 2,33 M=2,33 3 10) Se requiere preparar una solución de NaCl en agua de manera que la concentración sea: 15g / 100g de agua. Se dispone de 50g de sal. ¿Qué cantidad de solución se puede preparar? ¿Cuánta agua se precisa? 15 g. de sal ------------ 100 g de agua 50 g. de sal ------------ X = 333,33 g de agua Se pueden preparar 383,3 g de solución y se necesitan 333,3 g de agua. 11) La solubilidad del KClO3 en agua a 80ºc es de 38,5g/100g H2O y a 20ºc es de 7,4g/100g H2O. Calcular cuanta sal se separa al enfriar 1Kg de solución que está saturada, desde 80ºc hasta llegar a 20ºc. mSc = mSto + mSv → mSc = 38,5g + 100g → mSc = 138,5g A 80ºc 138,5g Sc→38,5g Sto 1000g Sc →x = 278g Sto → masa Sv= (1000 – 278)g = 722g A 10ºc 100g Sv→7,4g Sto 722g Sv→53,42g Sto 4 Cuestionario (Soluciones) 1) Definir: equivalente gramo de un ácido, de una base y de una sal. Equivalente gramo de un ácido: Es la masa de ácido que en solución acuosa libera 1 mol de iones H+.(1 eq g = Mr/nº H+). Equivalente gramo de una base: Es la masa de base que en solución acuosa libera 1 mol de iones OH-1.(1 eq g = Mr/nº OH-1). Equivalente gramo de una sal: Es la masa de sal que en solución proporciona 1 mol de metal. (1 eq g = Mr/nº oxido metal). 2) ¿Como se evita el error de paralaje el leer el volumen del la bureta? El ojo se debe encontrar a la misma altura que la superficie libre del líquido. De otro modo si se encuentra más alto el líquido pareciera marcar más de lo que contiene, y al estar más bajo el líquido marcaria de menos. Es por eso que para medir el líquido se debe colocar el ojo a la misma altura que la superficie del líquido para así mirar horizontalmente. 3) ¿Cuántos moles de H2SO4 están contenidos en 500 ml de solución 0.5 N? 1 Lt ------------ 0,5 eq-gr 0,5 Lt ------------ 0,25 eq-gr 2 eq-gr ------------ 1 mol H2SO4 0,25 eq-gr ------------ X = 0.125 moles H2SO4 4) Se emplean 18,0 ml. De HCI 0,1050 N para titular 20,0 ml de una solución de NaOH. Calcular la normalidad de la solución de NaOH. HCl + NaOH NaCl + H2O 18ml 20 ml 0,1050 N=18*0,1050 = 0,0945 N 20 5 5) ¿Cuántos gramos de NaCl se forman en el problema 4? VHCl . NHCl = VNaCl . NNaCl = 0,018 lt . 0,105 N = 1,89 x 10-3 nº equiv g. 1 equiv g. ------------- 58,5 g 1,89 x 10-3 equiv. g ------------- X = 0,1106 g 6 Cuestionario (pH) 1) ¿Qué entiende por pH y pOH? pH: es una medida de la concentración del ión de hidrógeno en la disolución. pOH: es una medida de la concentración del ión oxidrilo en la disolución. 2) En función del pH defina cuando una solución es ácida, básica o neutra. Si pH > 7 es un medio básico = Base (fuerte) + Ácido (débil) Si pH < 7 es un medio ácido = Base (débil) + Ácido (fuerte) Si pH = 7 es neutro = Base (débil) + Ácido (débil) = Base (fuerte) + Ácido (fuerte) 3) Calcular el PH y el POH de una solución de HCl 0.1 N y una solución NaOH 0.1 N suponiendo que su disociación es total. HCl H+ + Cl - 0.1N, por lo tanto 0.1 M, [H+]=10-1 por lo cual el PH es –log[H+]= 1. Partiendo de la formula [H+]+[OH-]=10-14. Por lo tanto si [H+] es 10-1 ,[OH-]=10-13 y -log[OH-]=13, en conclusión PH=1, POH=13 NaOH Na+ + OH- Si posee 0.1 N entonces posee 0.1 M y su [OH-]= 10-1 y su POH = -log[OH-]=1 y Partiendo de la Formula [H+]+[OH-]=10-14, [H+]=10-14 – 10-1=10-13, en conclusión PH=13, POH=1 4) Calcular la [OH- ] y el pOH en una solución donde: [H+] = 4.10-4 [OH -]: 2,5 x 10-11 [pOH ]: 10,6 5) Calcular la concentración de iones hidrógeno [H+] para una solución de pH 3,0 y la concentración de iones hidróxidos [OH] para la solución pH 8,0. pH= -log [H+] 3= -log [H+] -3= log[H+] 10-3= [H+] pH + PoH = 14 8+pOH =14 PoH = 6 6 = -log [OH] 10-6= [OH] 7 6) Indicar si las soluciones acuosas de las siguientes sales son ácidas, básicas o neutras, fundamentando las respuestas. K2SO4 Base (fuerte) + Ácido (fuerte) = Neutro NH4NO3 Base (débil) + Ácido (fuerte) = Ácido AlCl3 Base (débil) + Ácido (fuerte) = Ácido CH3-COONH4 Base (débil) + Ácido (débil) = Neutro Na2S Base (fuerte) + Ácido (débil) = Base 8