NOMENCLATURA DE COMPUESTOS QUÍMICOS Compuestos
Anuncio
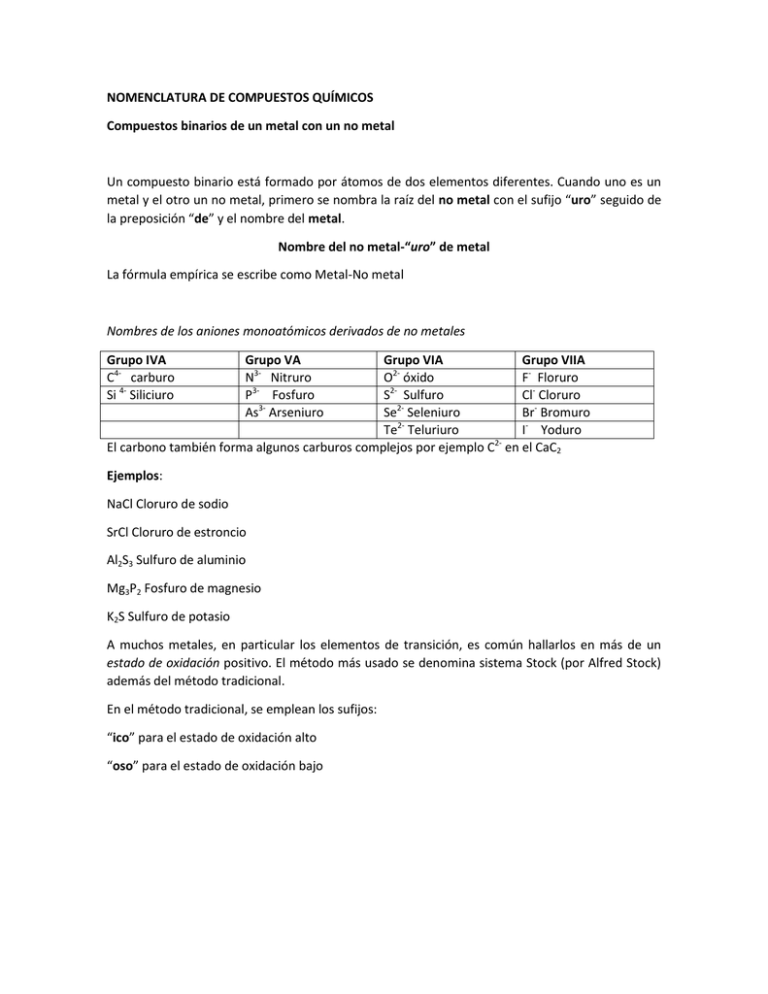
NOMENCLATURA DE COMPUESTOS QUÍMICOS Compuestos binarios de un metal con un no metal Un compuesto binario está formado por átomos de dos elementos diferentes. Cuando uno es un metal y el otro un no metal, primero se nombra la raíz del no metal con el sufijo “uro” seguido de la preposición “de” y el nombre del metal. Nombre del no metal-“uro” de metal La fórmula empírica se escribe como Metal-No metal Nombres de los aniones monoatómicos derivados de no metales Grupo IVA C4- carburo Si 4- Siliciuro Grupo VA N3- Nitruro P3- Fosfuro As3- Arseniuro Grupo VIA Grupo VIIA 2O óxido F- Floruro S2- Sulfuro Cl- Cloruro 2Se Seleniuro Br- Bromuro Te2- Teluriuro I- Yoduro 2El carbono también forma algunos carburos complejos por ejemplo C en el CaC2 Ejemplos: NaCl Cloruro de sodio SrCl Cloruro de estroncio Al2S3 Sulfuro de aluminio Mg3P2 Fosfuro de magnesio K2S Sulfuro de potasio A muchos metales, en particular los elementos de transición, es común hallarlos en más de un estado de oxidación positivo. El método más usado se denomina sistema Stock (por Alfred Stock) además del método tradicional. En el método tradicional, se emplean los sufijos: “ico” para el estado de oxidación alto “oso” para el estado de oxidación bajo Metales que comúnmente forman dos iones Cromo Cr2+ Cromoso Cr3+ Cromico Cobre Cu+ Cuproso Cu2+Cúprico Manganeso Mn2+ Manganoso Mn3+ Mangánico Estaño Sn2+ Estañoso Sn4+ Estáñico Hierro Fe2+ Ferroso Fe3+ Férrico Mercurio Hg2+ Mercuroso Hg2+ Mercúrico Cobalto Co2+ Cobaltoso Co3+ Cobáltico Plomo Pb2+ Plumboso Pb4+ Plúmbico Ejemplos FeCl2 Cloruro ferroso (sistema stock: cloruro de hierro (II) FeCl3 Cloruro ferr4ico (sistema stock: Cloruro de hierro (III) Cu2O óxido de cobre (I) óxido cuproso CuO óxido de cobre (II) óxido cúprico A pesar de que a la fecha se prefiere usar el sistema Stock, es necesario conocer también el sistema antiguo. Compuestos binarios de no metales Para nombrar a los compuestos binarios formados por dos no metales se utiliza el tercer sistema de nomenclatura. Este sistema usa prefijos para indicar el número de átomos contenidos en la molécula de la sustancia. Tales prefijos, con sus significados son: ditritetra- dos Tres cuatro pentahexahepta- Cinco seis Siete OctaNonaDeca- ocho Nueve diez Para nombrar el compuesto primero se especifica la raíz del nombre del segundo elemento con el prefijo “ido” o “uro”, a continuación se usa la preposición “de” y, por último el nombre completo del primer elemento con su prefijo correspondiente. Por ejemplo la siguiente sustancia P4O10 Deca óxido Por lo tanto de se nombra decaóxido de tetrafósforo de tetra fósforo Ejemplos NO2 dióxido de nitrógeno N2O4 tetroxido de dinitrogeno (la letra a de tetra se suprime para facilitar la pronunciación) N2O5 pentoxido de dinitrógeno PCl3 Tricloruro de fósforo PCl5 Pentacloruro de fósforo S2Cl2 dicloruro de diazufre En algunos casos también se emplea el prefijo mono, que significa uno, para evitar confusiones CO2 dióxido de carbono CO monóxido de carbono Compuestos que contienen iones poliatómicos Algunos iones poliatómicos comunes Cationes Terminación + NH4 Amonio “nio” H3O+Hidronio Aniones (nombres alternativos entre paréntesis) CO32Carbonato HCO3 Carbonato de hidrógeno (bicarbonato) C2O4Oxalato CN Cianuro NO3Nitrato NO2 Nitrito OHHidróxido SO4 Sulfato HSO4Sulfato de hidrógeno (bisulfato) 2SO3 Sulfito HSO3Sulfito de hidrógeno (bisulfito) -1 FO Hipofluorito FO2-1 Fluorito FO3-1 Fluorato -1 FO4 Perfluorato BrO-1 Hipobromito -1 BrO2 Bromito BrO3-1 Bromato ClO4ClO3ClO2ClOPO43HPO42H2PO4CrO42Cr2O72MnO4CH3COOCO3-2 OH1O2-2 CN-1 SCN-1 S2O32HS1- Perclorato Clorato Clorito Hipoclorito Fosfato Fosfato de hidrogeno Fosfato de dihidrogeno Cromato Dicromato Permanganato Acetato Carbonato Hidróxido Peroxido Cianuro Tiocianato Tiosulfato Bisulfuro BrO4-1 IO-1 IO2-1 IO3-1 IO4-1 BO3-3 Fe[CN]63Fe[CN]64SnO22SnO32- Perbromato Hipoyodito Yodito Yodato Peryodato Borato Ferricianuro Ferrocianuro Estañito Estañato O2AsO33AsO43HAsO32H2AsO31SiO32SiO44AlO33SbO33SbO43- Oxido Arsenito Arseniato Arsenito monoácido Arsenito diácido Metasilicato Silicato Aluminato Antimonito Antimoniato Ácidos binarios Cuando un compuesto binario de hidrogeno se combina con un no metal se forma una clase de ácido llamado binario o a veces se llaman hidrácido. Sus nombres se forman como sigue: Ejemplo: HF ácido fluorhídrico HCl ácido clorhídrico HBr ácido bromhídrico HI ácido iodhídrico H2S ácido sulfhídrico H4C ácido carbonhídrico H4Si ácido silishídrico H3P ácido fosforhídrico H2Se ácido selenhídrico H2Te ácido telurhídrico Las sales formadas a partir de ácidos que tengan terminación “hídrico” contienen aniones monoatómicos que terminan con el sufijo “uro” por ejemplo del HCl (ácido clorhídrico se formará una sal llamada NaCl (cloruro de sodio) Oxiácidos Los oxiácidos son ácidos que contienen hidrógeno, oxígeno y, al menos, algún otro elemento (por lo general un no metal). Para nombrar los oxiácidos que tienen El elemento en estado de oxidación más alto se le aplica el sufijo “ico” El elemento en estado de oxidación más bajo se le aplica el sufijo “oso” H2SO4 ácido sulfúrico H2SO3 ácido sulfuroso Los compuestos producidos por neutralización de oxiácidos contienen los iones poliatómicos. El anión que proviene del ácido sigue la siguiente regla: Acido con terminación “ico” (oxidación mayor) con terminación “oso”(oxidación menor) Anión Terminación “ato” Terminación “ito” Ejemplos: Acido H2SO4 H2SO3 HNO3 HNO2 H3PO4 H3PO3 H2CO3 H2CrO4 H3SbO3 H3SbO4 Nombre Ácido sulfúrico Ácido sulfuroso Ácido nítrico Ácido nitroso Ácido fosfórico Acido fosforoso Ácido carbónico Ácido crómico Ácido antimonioso Ácido antimonico Anión SO42SO32NO3NO2PO43PO33CO32CrO42SbO33SbO43- Nombre Sulfato Sulfito Nitrato Nitrito Fosfato Fosfito Carbonato Cromato Antimonito Antimoniato Algunos no metales (en especial los halógenos) forman más de dos oxiácidos. Este es el caso del cloro, bromo, y yodo. Para nombrarlos se aplica el prefijo “hipo” en el ácido que tiene menos oxigeno que el ácido “oso” y se emplea el prefijo “per” en ácido que tiene más oxígenos que el ácido “ico”. Por ejemplo: Acido HClO HClO2 HClO3 HClO4 Nombre Ácido hipocloroso Ácido cloroso Ácido clórico Ácido perclorico Anión ClOClO2ClO3ClO4- Nombre hipoclorito clorito clorato Perclorato Sales ácidas La neutralización parcial de un ácido capaz de proporcionar más de un H+ (protón) por molécula del ácido produce sales conocidas como sales ácidas y se nombran añadiendo el prefijo bi al nombre del anión del ácido. Ejemplo: Ácido predecesor H2SO4 H2CO3 H3PO4 Sales ácidas típicas HSO4HCO3H2PO4- Nombre de la sal Bisulfato Bicarbonato Bifosfato








