Tema1.DiagramaFeC.1
Anuncio

CLASIFICACIÓN DE LOS MATERIALES (Composición).
Desde el punto de
vista mecánico son
resistentes, tenaces y
dúctiles.
Desde el punto de vista
mecánico son duros y muy
frágiles.
Desde el punto de vista
mecánico tienen una
resistencia y rigidez
bajas
ESTE ESQUEMA SE BASA EN LA COMPOSICIÓN QUÍMICA Y EN LA ESTRUCTURA A ESCALA
ATÓMICA.
POR LO GENERAL, LA MAYORÍA DE LOS MATERIALES ENCAJAN EN UN GRUPO U OTRO,
AUNQUE HAY MATERIALES INTERMEDIOS.
Además, existen otros dos grupos de materiales técnicos importantes : materiales
compuestos (composites) y semiconductores.
Los materiales compuestos constan de combinaciones de dos o más materiales diferentes,
mientras que
los semiconductores se utilizan por sus extraordinarias características eléctricas.
HOY EN DIA: “EDAD DE LA TECNOLOGIA”
NO HAY UN MATERIAL PREDOMINANTE
-CERAMICAS DE ALTA TECNOLOGIA / MATERIALES SUPERCONDUCTORES
-FIBRAS OPTICAS
-SUPERALEACIONES
-TECNOPOLIMEROS
• Los materiales deben dar respuesta a unas exigencias concretas de servicio o de
producción.
• Es imprescindible que el ingeniero conozca la MICROESTRUCTURA de los
materiales y su correlación con sus PROPIEDADES.
• Los materiales presentan propiedades intrínsecas, ajenas a su microestructura,
y propiedades dependientes de su microestructura
En la actualidad se dice que existen más de 50000 materiales disponibles para el
ingeniero, el cual debe conocer sus PROCESOS DE FABRICACIÓN, así como sus
PROPIEDADES, con el fin de elegir entre un menú tan amplio el material más adecuado
para una determinada aplicación→LOS ERRORES PUEDEN CAUSAR DESASTRES
Algunas propiedades (INTRÍNSECAS) o características de los
materiales, tales como: la expansión térmica, el módulo de Young, la
conductividad eléctrica y térmica, el punto de fusión, la densidad, el
calor específico,…..
SON POCO SENSIBLES A LA MICROESTRUCTURA
SIN EMBARGO, EN OTRAS PROPIEDADES (NO INTRÍNSECAS), COMO
LA TENACIDAD, DUCTILIDAD, DUREZA, CARGA DE ROTURA,… LA
MICROESTRUCTURA SI QUE JUEGA UN PAPEL MUY IMPORTANTE
LA OPTIMIZACIÓN DE UNA PROPIEDAD REQUIERE UNA
DETERMINADA MICROESTRUCTURA.
Incomplete removal of the porosity
during solid-state sintering of CeO2
results in a microstructure consisting
of grains, grain boundaries, and pores.
MICROESTRUCTURAS PARA OPTIMIZAR PROPIEDADES
Elongated exaggerated
grain in Al2O3.
Temperatura de fusión
Resistencia al choque térmico
Ductilidad
ENLACE METALICO
W: PF 3410 ºC, PE: 5930 ºC
Sn PF 232 º , PE: 2602 ºC
SEMICONDUCTORES
CERÁMICOS
ENLACES
SECUNDARIOS
ENLACE IONICO
ENLACE COVALENTE
DIAMANTE
MOLECULA METANO
LOS ENLACES SECUNDARIOS DE VAN DER WAALS O FÍSICOS SON DÉBILES EN COMPARACIÓN CON LOS PRIMARIOS, PERO
TIENEN GRAN IMPORTANCIA DADO QUE EN LA MAYORÍA DE LOS CASOS, LA FUERZA NECESARIA PARA ROMPER EL
POLÍMERO ES LA REQUERIDA PARA SEPARAR LAS MOLÉCULAS, ES DECIR, PARA VENCER LOS ENLACES INTERMOLECULARES.
LA DEFORMACIÓN
PLÁSTICA DE UN
POLÍMERO,
PRINCIPALMENTE
UN
TERMOPLÁSTICO,
OCURRE POR LA
ROTURA DE
ESTOS ENLACES,
LO QUE PERMITE
EL
DESLIZAMIENTO
DE UNA CADENA
SOBRE OTRA
Ilustración esquemática del enlace de
tipo Van der Waals entre dos dipolos.
ELECTRONES DESLOCALIZADOS
LOS MATERIALES METALICOS TIENEN UN GRAN NÚMERO DE
ELECTRONES DESLOCALIZADOS, QUE NO PERTENECEN A
NINGÚN ÁTOMO EN CONCRETO, FORMANDO UNA NUBE
ELECTRONICA QUE POR SER ELECTRONEGATIVA
COHESIONA A LOS ATOMOS CARGADOS POSITIVAMENTE
(NUBE ELECTRONICA ELECTRONEGATIVA )
ÁTOMO
(Carga +)
(ATOMOS UNIDOS POR UNA NUBE LECTRÓNICA)
LA MAYORÍA DE LAS PROPIEDADES DE LOS METALES SE
ATRIBUYEN A LA MOVILIDAD DE ESTOS ELECTRONES
DENTRO DE LA NUBE ELECTRÓNICA
ES ESPECIFICO DEL ENLACE METÁLICO EL CARÁCTER ANONIMO DE LA UNIÓN DE LOS ATOMOS
ENTRE SI: CADA ATOMO CONCRETO NO QUEDA FIRMAMENTE LIGADO A OTRO DETERMINADO, A
DIFERENCIA DE LO QUE OCURRE CON LOS OTROS TIPOS DE ENLACE QUÍMICO.
ELECTRONEGATIVIDAD (EN).
TENDENCIA RELATIVA DE LOS DISTINTOS ÁTOMOS A
ATRAER HACIA SÍ EL PAR DE ELECTRONES QUE
COMPARTE CON OTRO EN UN ENLACE COVALENTE
Se trata de un índice por lo que no tiene unidades
Gráfica que relaciona el carácter iónico de un enlace con la diferencia de electronegatividad de
los dos átomos enlazados, según una formula propuesta por Pauling. El carácter iónico aumenta
con la diferencia entre las electronegatividades
0.25( X X ) 2
B
A
Carácter iónico 100 1 e
Elevada resistencia al impacto
Resistencia:
• Tracción baja
• Compresión alta
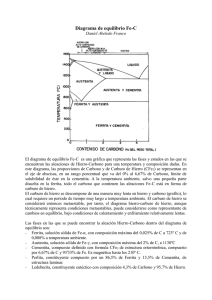
DIAGRAMA Fe-C (Sistema de aleaciones binario más importante)
El hierro y sus aleaciones (aceros y fundiciones) representan el 95 % del
consumo mundial de metales, correspondiendo el 5 % restante a los no férreos.
La producción mundial de acero bruto aumentó 1,2% en 2012, alcanzando un nuevo récord de
1550 millones de toneladas. Aluminio: 20 millones, cobre 10 millones, Zinc 7 millones , Plomo
6 millones y Ni, Cr,… que tienen el consumo equivalente hasta el 5 % de los no férreos.
China, de lejos, es el primer productor mundial, produciendo 716,5 millones de toneladas (Mt)
(46.3 % de la producción mundial) en 2012 (+3,1%). Los grandes productores asiáticos, con la
excepción de Japón, segundo productor mundial con 107,2 Mt (-0,3%), aumentaron sus
producciones: India, cuarto mundial, registró un alza de 4,3% a 76,7 Mt. Corea del Sur, sexto,
registró un aumento de 1,2% a 69,3 Mt. En total, la producción del continente asiático crece
un 2,6% con respecto a 2011.
En el resto del mundo, la situación parece más contrastada.
Estados Unidos, tercer productor mundial, aumentó su
producción de 2,5% a 88,6 Mt, así como Rusia, quinto mundial
con 70,6 Mt (+2,5%) y Turquía, octavo mundial con 35,9 Mt
(+5,2%). En cambio Alemania, séptimo mundial con 42,7 Mt (3,7%), Brasil, noveno mundial con 34,7 Mt (-1,5%) y Ucrania,
décimo con 32,9 Mt (-6,9%) vieron caer su producción. La
producción total en la Unión Europea cayó un 4,7% y la de
Sudamérica 3%.
ESPAÑA: 13,6 millones de toneladas en 2012
able 1: Top 10 steel-producing countries
World steel capacity utilisation ratio
World steel capacity utilisation ratio
Rank
Country
2011
2010
%2011/2010
1
China
695.5
638.7
8.9
2
Japan
107.6
109.6
-1.8
3
United States
86.2
80.5
7.1
4
India
72.2
68.3
5.7
5
Russia
68.7
66.9
2.7
6
South Korea
68.5
58.9
16.2
7
Germany
44.3
43.8
1.0
8
Ukraine
35.3
33.4
5.7
9
Brazil
35.2
32.9
6.8
10
Turkey
34.1
29.1
17.0
Company
Tonnage
Company
Tonnage
1ArcelorMittal
Nippon Steel & Sumitomo Metal
2
Corporation (*) (1)
3Hebei Group (**)
4Baosteel Group (*)
5POSCO (*)
6Wuhan Group (*)
7Shagang Group
8Shougang Group (*)
9JFE (*)
10Ansteel Group (*)
11Shandong Group
Tata Steel (*)
12U. S. Steel (*)
13Nucor (*)
14Gerdau (*)
15Maanshan
16Hyundai Steel (*)
93.6
23IMIDRO (*)
13.6
47.9
24SAIL (*)
13.5
42.8
42.7
39.9
36.4
32.3
31.4
30.4
30.2
23.0
23.0
21.4
20.1
19.8
17.3
17.1
13.2
13.0
12.7
12.5
10.2
10.1
10.1
9.1
9.1
9.1
8.7
8.7
8.5
8.5
8.0
17RIVA Group (*)(2)
16.0
18Evraz Group (*)
19Severstal (*)
ThyssenKrupp (*)
Benxi Steel
20NLMK (*)
21Valin Group
22Jianlong Group
15.9
15.1
15.1
15.1
14.9
14.1
13.8
25Rizhao
26MMK (*)
27China Steel Corporation (*)
28Metinvest (*)
29Baotou
30Taiyuan
Jiuquan
31Pinxiang
Zongheng
Jinxi
32 Techint Group (*)
Xinyu
33ISD
JSW Steel (*)
34Guofeng
Ereğli Demir ve Çelik Fabrikalari TAS
35
(*)
36Anyang
37 CELSA Group (*)
Zenith
38voestalpine (*)
39Jingye
40 Nanjing
Usiminas (*)
7.9
7.7
7.6
7.6
7.5
7.3
7.2
7.2
El hierro químicamente puro es un elemento cuyo peso atómico es de 55.84, su densidad oscila entre 7.84 y 8.14 g/cm3 y su
punto de fusión es de 1538 ºC. Aspecto blanco brillante, blando y no endurece al templarlo. NO TIENE APLICACIÓN PRÁCTICA.
TIENE UNA SOLUBILIDAD LIMITADA CON ALGUNOS ELEMENTOS E ILIMITADA CON OTROS
TIENE CAPACIDAD DE TRANSFORMARSE ALOTRÓPICAMENTE
VARIEDADES ALOTRÓPICAS DEL Fe
Alotropía: Un sólido elemental (misma composición) puede presentar más de una estructura cristalina.
Transformaciones alotrópicas: Son transformaciones de fase sin cambio de composición, pero si con cambio de red cristalina,
en función de la temperatura.
El Fe presenta tres variedades alotrópicas: delta (Feδ) , gamma (Feγ) y alfa (Feα)
El Fe puro solidifica a 1538 °C en forma de Fe delta, cuya celda elemental es cúbica centrada en el cuerpo. A 1394 ºC el Fe delta se
transforma en Fe gamma cuya celda elemental es cúbica centrada en las caras, con un parámetro que disminuye con la temperatura
(para 913 ºC es 3.639 Å). A 912 ºC se produce un nuevo cambio alotrópico: el Fe gamma pasa a Fe alfa. Este cristaliza en el sistema cúbico
centrado en el cuerpo (igual que el Fe delta), pero de menor parámetro (2.898 Å a 910 ºC).
Líquido
1538 ºC
Fe delta
(BCC)
2.93 Å
Fe gamma
(FCC)
1394 ºC
3.639 Å
913 ºC
Fe alfa
(BCC)
912 ºC
2.898 Å
910 ºC
Las transformaciones alotrópicas del Fe se producen por nucleación y crecimiento,
en las juntas de grano. Son transformaciones reversibles. Por variar la estructura
cristalina, varia el empaquetamiento y, por tanto, la densidad (ρ).
Al estudiar el diagrama T-t del Fe se observan dos transformaciones alotrópicas
F+L=2
F=1
F=2
F=1
F=2
F=1
T >1538 ºC
T =1538 ºC
1538 ºC <T <1394 ºC
F=2
t
DIAGRAMA T - t
F=1
T = 1394 ºC
Regla de las fases: F+L = Co+2, si P = Cte,
F+L = Co+1
Co= Componentes = Fe F + L = 2
(Diagrama Fe-C, Co = 2, Fe y C F + L = 3)
Las solidificaciones y los cambios
alotrópicos son a
Temperatura = Cte.
1394 ºC <T <912 ºC
T = 912 ºC
Transformación (Feγ) (Feα)
4 átomos de Fe
2 átomos de Fe
V
V f Vi
Vi
Celda
100
23 3
3
2 2.898 3.639
3
V
2 Celda
1 Celda
Celda
(Feγ) (Feα)
Dilatometría
100
3
100 1.01%
3.639
3
Aumento de volumen
Transformación (Feδ) (Feγ)
2 átomos de Fe
4 átomos de Fe
V
V f Vi
Vi
Celda
Celda
100
2 Celda
1 Celda
3 23
23
3.639 2 2.93
V
3
2 2.93
3
(Feδ) (Feγ)
100
3
100 4.21 %
Disminución de volumen
ASÍ, POR ENFRIAMIENTO Y CALENTAMIENTO DE UN MATERIAL DE FE TIENEN LUGAR DILATACIONES Y CONTRACCIONES,
DANDO LUGAR A UN FALLO DE LA PIEZA POR FATIGA TÉRMICA
FCC
Constituyentes simples del sistema Fe-C
Hay dos posibilidades de diagrama Fe-C, cada uno de ellos
con sus respectivos constituyentes simples
Diagrama Fe-C metaestable: Austenita (γ), Ferrita (α y δ) y
Cementita (Fe3C) (6.70 % C corresponde al 100 % de Fe3C)
La cementita es un compuesto intermetálico
Constituyentes de los aceros y de las fundiciones blancas
Diagrama Fe-C estable: Austenita, Ferrita y Grafito(C)
Constituyentes de las fundiciones grises
La diferencia entre el carácter estable y el carácter
metaestable depende de varios factores, especialmente de la
velocidad de enfriamiento y los elementos de aleación.
En el caso de los aceros, la forma que se presenta, en
general, es la metaestable.
ri
2
1 0.414
rs
2
ri
3
1 0.225
rs
2
BCC
La austenita y la ferrita se caracterizan por ser
soluciones sólidas, de inserción octaédrica de C en
Fe gamma (FCC) y Fe alfa (BBC), respectivamente.
Todos los metales pueden formar soluciones sólidas, ya sea
de sustitución (un elemento sustituye a otro) o de inserción
(un elemento se introduce en los huecos de la red cristalina)
ri
2
1 0.155
rs
3
ri
5
1 0.291
rs
3
SOLUCIONES SÓLIDAS SUSTITUCIONALES
EL SOLUTO O LAS IMPUREZAS REEMPLAZAN A ÁTOMOS ORIGINALES. ESTO SE DA
CUANDO LOS ÁTOMOS QUE CONSTITUYEN EL SOLUTO Y EL SOLVENTE CUMPLEN LOS
SIGUIENTES REQUERIMIENTOS (REGLAS DE HUME-ROTHERY):
LOS RADIOS ATÓMICOS NO DIFIERAN MÁS DEL 15%
SINO LOS ÁTOMOS DEL SOLUTO CREAN
GRANDES DISTENSIONES EN LA RED Y APARECE
UNA NUEVA FASE
LAS ESTRUCTURAS CRISTALINAS DEBEN SER
LAS MISMAS
LAS ELECTRONEGATIVIDADES DEBEN SER
SIMILARES YA QUE DE OTRA MANERA
REACCIONARÍAN Y SE FORMARÍAN NUEVOS
COMPUESTOS
DEBEN TENER LA MISMA VALENCIA
rSOLUTO rSOLVENTE
100 15%
rSOLVENTE
SOLUCION SÓLIDA INTERSTICIAL
LA LOCALIZACIÓN DE UN ÁTOMO EXTRA EN UN LUGAR INTERSTICIAL ES TANTO MÁS FÁCIL
CUANTO MENOR SEA EL FACTOR DE EMPAQUETAMIENTO DE LA ESTRUCTURA CRISTALINA Y
CUANTO MENOR SEA EL TAMAÑO DEL ÁTOMO.
LA DISTORSIÓN QUE SE PRODUCE SERÁ TANTO MAYOR CUANTO MAYOR SEA EL ÁTOMO Y
MENOR SEA EL TAMAÑO DEL LUGAR INTERSTICIAL. EL TAMAÑO DE LOS LUGARES
INTERSTICIALES ES MENOR QUE EL TAMAÑO DE LOS ÁTOMOS SOLVENTES.
LA SOLUBILIDAD INTERSTICIAL TIENE
LUGAR DE UNA FORMA SIGNIFICATIVA
CUANDO LA RELACIÓN ENTRE LOS
DIÁMETROS DE LOS ÁTOMOS DE SOLUTO
Y DE SOLVENTE ES MENOR DE 0,59
RELACIÓN CRÍTICA
DSOLUTO
0.59
DSOLVENTE
COMO CUANDO EL C, O, N, H, … SE INTRODUCEN EN LOS
LUGARES INTERSTICIALES DE LA RED DEL HIERRO
INSERCION OCTAEDRICA EN EL SISTEMA FCC (CCP)
2rs 2ri a
4rs a 2
a
4rs
2
2
2rs 2ri
, 2ri 2rs
1
2
2
4rs
ri
2
1 0.414
rs
2
INSERCION TETRAEDRICA EN EL SISTEMA FCC (CCP)
4r
3
, 4rs a 2 , a s
4
2
3
3 4rs
3
rs ri
rs , ri rs
1
4 2
2
2
rs ri a
ri
3
1 0.225
rs
2
INSERCION OCTAEDRICA EN EL SISTEMA BCC (CCC)
2rs 2ri a
4rs a 3
a
4rs
3
2rs 2ri
2
, 2ri 2rs
1
3
3
4rs
ri
2
1 0.155
rs
3
INSERCION TETRAEDRICA EN EL SISTEMA BCC (CCC)
rs ri
AB
2
2
AB BC
a
a
, BC
2
4
2
a 2 a 2 5a 2
rs ri
4 16 16
4r
4rs a 3, a s
3
a 5 4rs 5 rs 5
rs ri
,
4
3 4
3
ri
5
1 0.291
rs
3
2
5
ri rs
1
3
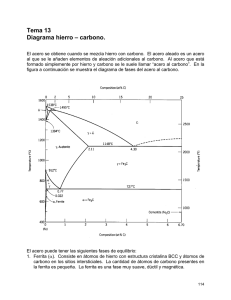
DIAGRAMA METAESTABLE Fe-C
El hierro puro, al calentarse, experimenta dos cambios de la estructura cristalina antes de fundir. A temperatura ambiente la forma estable se llama ferrita o
hierro α y tiene la estructura BCC. La ferrita experimenta a 912°C una transformación polimórfica a austenita FCC o hierro γ. La austenita persiste hasta
1394°C, temperatura a la que la austenita vuelve a convertirse en una fase BCC conocida como ferrita δ, que funde a 1538°C. Todos estos cambios aparecen a
lo largo del eje vertical izquierdo del diagrama de fases.
El eje de composición de la figura sólo llega hasta
6.70% en peso de C, concentración que coincide con
la del compuesto intermedio carburo de hierro o
cementita (Fe3C) representado por una línea vertical
en el diagrama de fases.
Así, el sistema hierro-carbono se puede dividir en
dos partes: una parte rica en hierro, que coincide
con la mostrada en el figura y otra parte (no
mostrada) de composición comprendida entre 6.70 y
100 % C (grafito puro).
Prácticamente todos los aceros y fundiciones tienen
porcentajes de carbono inferiores a 6.70 % C, por lo
tanto, sólo se considera la parte rica en hierro del
sistema hierro-carburo de hierro. La figura muestra,
propiamente, el diagrama Fe-Fe3C, ya que el Fe3C se
considera un componente.
La convención y la conveniencia imponen expresar la
concentración en "% C" en lugar del "% Fe3C";
6.70% en peso C corresponde al 100 % en peso de
Fe3C.
DIAGRAMA METAESTABLE Fe-C
Pueden identificarse las tres reacciones siguientes:
Reacción peritéctica. Un líquido corroe a un sólido
dando otro sólido diferente.
(0.17 % C )
Liq (0.53 % C ) (0.09 % C )
1493 ºC
Reacción eutéctica: Un líquido se transforma en dos
fases sólidas
LEDEBURITA
(2.11 % C ) Fe C (6.67 % C )
Liq (4.3 % C )
3
1148 ºC
Reacción eutectoide:Un sólido se transforma en
dos fases sólidas
PERLITA
(0.0218 % C ) Fe C
(0.77 % C )
3
727 ºC
Puntos críticos del diagrama:
A3: Indica el inicio de la transformación γ α en el enfriamiento
DIAGRAMA METAESTABLE Fe-C
Acm: Indica el inicio de la transformación γ Fe3C
A1: Indica el final de la transformación de γ en el enfriamiento
A2: Cambio de ferrita de la variedad amagnética a ferromagnética (770 ºC)
A123: (A1, A2, A3) En los aceros hipereutectoides (0.77%<C<2.11%) los puntos de transformación alotrópica de la austenita se
denominan A123 para señalar coincidencia de γ α y transformación magnética (A3 y A2) , así como con A1 (Estas son constantes e
igual a 727 ºC)
A4: Indica el inicio de la transformación δ γ en el enfriamiento y γ δ en el calentamiento
DIAGRAMA METAESTABLE Fe-C
A3 puede ser: A3r (enfriamiento) A3c (calentamiento).
La explicación se obtiene viendo lo que ocurre por dilatometría
en ambos procesos. Los valores son mayores en el
calentamiento que en el enfriamiento. A mayor velocidad de
calentamiento y menor de enfriamiento hay mayor diferencia
(mayor es la histéresis térmica). Histéresis térmica Puntos
críticos desplazados sobre sus homólogos)
A1
A3
Fe( )
Fe( )
V 1 %
Fe( )
Fe( )
V 1 %
Enfriamiento: A3r < A3, A1r < A1
Calentamiento: A3c > A3, A1c > A1
PERITÉCTICO
EUTÉCTICO
Línea
solidus
EUTECTOIDE
Las dos aleaciones
de Fe más usadas
son:
Aceros al carbono
Fundiciones
blancas
(0.09 % C) + Líquido (0.53% C) (0.17 % C) (1493ºC)
LEDEBURITA
L(4.3 %C ) (2.11 %C ) Fe3C (6.67 %C )
Eutéctico
Punto Eutéctico: Composición del 4.3 % de C y temperatura
de 1147 ºC. Esta composición cae en el dominio de las
fundiciones férreas. Metalográficamente adopta la forma de
LEDEBURITA. Por debajo del 4.3 % solidifica la fase gamma y
por encima la cementita (Fe3C).
Punto Peritéctico: En las proximidades del Fe puro, a 1493ºC
y 0.17 % de C. Se forma mediante la segregación de una
estructura de Fe delta (0.09 %C) ,cúbico centrado en el
cuerpo y la solidificación de una fase sólida con estructura
cúbica centrada en caras o fase gamma
(transformación de carácter expansivo).
PERLITA
(0.77 %C ) (0.0218 %C ) Fe3C (6.67 %C )
ACEROS
FUNDICIONES
ESFEROIDALES
PERLITICAS
Punto Eutectoide: Variación de fases en forma sólida, a
723ºC y 0.77 %C. Esta composición se denomina PERLITA
(láminas de ferrita y cementita). Por debajo del 0.77 % se
segrega ferrita y perlita, y por encima del eutectoide perlita y
cementita .
6.67 0.77
100 88.75 %
6.67 0.0218
0.77 0.0218
% CementitaPERLITA
100 11.25 %
6.67 0.0218
% FerritaPERLITA
DIAGRAMA Fe-C METAESTABLE
[Fe-Carburo de hierro (Fe3C), cementita].
Constituyentes simples:
-AUSTENITA
-FERRITA
-CEMENTITA
Constituyentes compuestos:
-PERLITA (Ferrita+cementita; 86.5% de Ferrita y
13.5% de Cementita, de estructura laminar)
-LEDEBURITA (No es un constituyente de los
aceros, sino de las fundiciones. Se forma al enfriar
una fundición líquida de carbono (de composición
alrededor del 4.3% de C) desde 1147 ºC, siendo
estable hasta 723ºC, descomponiéndose a partir de
esta temperatura en ferrita y cementita)
DIAGRAMA Fe-C ESTABLE
ACEROS
Constituyentes simples:
-AUSTENITA
-FERRITA
-GRAFITO
Constituyentes compuestos:
-PERLITA
PERLITICAS -LEDEBURITA
FUNDICIONES
ESFEROIDALES
AUSTENITA (γ)
La austenita se forma por inserción al azar del C en los huecos octaédricos de la red cristalina del Fe(γ) (FCC). El
enlace es metálico (nube electrónica), no se comparten electrones. No es estable por debajo de 727 ºC
Tomamos la figura de inserción octaédrica según el plano {1,1,0} y suponemos la saturación completa, es decir
que todos los huecos octaédricos de la red FCC están ocupados por el C.
Átomos de Fe = 4; Átomos de C = 4 % atómico Fe = 50; % atómico de C = 50
% peso Fe = 4x55.8x100/(4x12+4x55.8) = 82.31 ; % peso C = 4x12x100/(4x12+4x55.8) = 17.69 % SATURACIÓN
MÁXIMA. Este no es el grado de ocupación (se ha supuesto saturación completa).
La relación entre los radios del elemento insertado en el hueco octaédrico y el elemento soluto, para que no
se produzca distorsión de la red cristalina FFC, debe ser:
rC
(Relación de
0.63 rC 0.63rFe
La relación entre los radios del C y del Fe es:
Goldschmidt)
rFe
Distorsión nula
(Parámetro de referencia)
Por tanto, como 0.63>0.414 la inserción de un átomo de C en la austenita produce una importante distorsión en
su red, proporcional a la cantidad de C disuelto. Indice de distorsión de la celda Fe( ) 0.63 0.414 100 34.3 %
0.63
El parámetro de la austenita varía en función del contenido en C, aproximadamente, según la expresión:
a(Å) = 0.0448 [%C] + 3.548 (Fórmula válida hasta el 2.11 %C)
Al aumentar la concentración de C se llega (a causa de la distorsión producida) a una alteración de la red de la
austenita, que ésta es incapaz de soportar. Un aumento de temperatura, al dilatar la malla, compensa en parte las
diferencias de tamaño y, por lo tanto, la solubilidad aumentará con la temperatura. La saturación de C en la
austenita (máxima solubilidad del C) se verifica a 1148 ºC para un contenido de 2.11% en peso [Empiricamente
Cmax(γ) = 2.11 %C]. Esta solubilidad es aproximadamente 100 veces superior que la máxima para la ferrita BCC
(0.0218 %C a 727 ºC), ya que las posiciones intersticiales de la estructura FCC tienen la forma adecuada para que al
llenarse de átomos de carbono la deformación impuesta a los átomos de hierro vecinos sea mucho menor. Algunos
autores señalan 1.7 % C como límite de saturación de la austenita a 1130°. La imprecisión en los resultados es debida
a que ambos valores se obtienen por extrapolación de medidas efectuadas sobre austenitas saturadas a
temperatura inferior a 1148 ºC. LA SATURACIÓN MÁXIMA EN C VISTA DE 17.69 % NO ES POSIBLE.
ri
2
1 0.414
rs
2
ri 0.414rs
AUSTENITA (γ)
Las aleaciones binarias Fe-C con contenidos en C inferiores al límite
máximo de saturación de la austenita a 1148 ºC
[Cmax(γ) = 2.11 %C], reciben el nombre de ACEROS.
En los aceros binarios Fe-C no es posible tener austenita a la temperatura
ambiente por enfriamiento lento, aunque puede lograrse en algunos
aceros aleados (con 12 %Mn o 8 %Ni, etc.).
La austenita no es estable por debajo de la temperatura eutéctica (727 ºC)
a menos que sea enfriada rápidamente
PROPIEDADES DE LA AUSTENITA
• Las propiedades de la austenita son similares a las del Fe(γ), aunque
la primera es más resistente
• Amagnética (no se puede magnetizar), como el Fe(γ), lo cual permite
en ocasiones su fácil identificación. Útil para chapas de hornos de
fusión
• Relativamente blanda (300 HB de dureza)
• Dúctil (alargamientos totales antes de la rotura del orden del 30-60 %
• Carga de rotura elevada (880 a 1100 MPa)
• Tenaz
• Constituyente más denso de los aceros
• Conduce peor el calor y la electricidad que el Fe(α)
• La austenita al microscopio presenta una estructura de granos
poligonales con unas bandas típicas en algunos granos (maclas)
x325
FERRITA (α, δ)
La ferrita es una solución sólida de inserción intersticial octaédrica de C en Fe(α) o Fe(δ) (BCC).
Los átomos de C pueden situarse al azar en el centro de las aristas o en posiciones equivalentes,
como son los centros de las caras de la celda elemental. Cada átomo de C es tangente a dos de Fe.
Los átomos de Fe son
tangentes según la
diagonal del cubo
Tomamos la figura de inserción octaédrica según el plano {1,1,0} y suponemos la saturación
completa, es decir que todos los huecos octaédricos de la red BCC están ocupados por el C.
Átomos de Fe = 2; Átomos de C =6x(1/2)+12x(1/4) = 6 % atómico Fe = 25; % atómico de C = 75%
% peso Fe = 2x55.8x100/(6x12+2x55.8) = 60.79 ; % peso C = 6x12x100/(6x12+2x55.8) = 39.21 % (Este sería el % C
en peso supuesta la saturación completa en C de la celda). ESTE NO ES EL GRADO DE OCUPACIÓN.
La relación entre radios atómicos de C y Fe requerida para formar la solución sólida de inserción
octaédrica es 0.155, en tanto que la relación real de diámetros es 0.63. Una primera consecuencia de ello
es que la austenita admite un contenido en C muy superior al de la ferrita. Concretamente, la ferrita alfa
admite a 727 ºC un máximo de 0.0218 % en peso de C y a temperaturas menores el contenido es casi nulo ( T
= 20 ºC %C = 0.005). Estos valores se pueden ver en el diagrama Fe-C metaestable. La ferrita δ admite un
0.09 % C a 1154 ºC
Esta pequeña solubilidad se explica teniendo en cuenta la forma y el tamaño de las posiciones intersticiales de la
estructura BCC, que dificultan la acomodación de los átomos de carbono. Aunque presente en muy baja
proporción, el carbono ejerce gran influencia en las propiedades mecánicas de la ferrita.
Indice de distorsión de la celda Fe( )
0.63 0.414
100 34.3 %
0.63
0.63 0.154
Indice de distorsión de la celda Fe( )
100 75.5 %
0.63
Para la ferrita (δ) las conclusiones serían similares
rC
0.63 rC 0.63rFe
rFe
(Relación de Goldschmidt)
ri
2
1 0.155 ri 0.155rs
rs
3
ri
2
1 0.414
rs
2
Posición intersticial de
tamaño pequeño, lo que
dificulta la acomodación
de los átomos de carbono
PROPIEDADES DE LA FERRITA
La ferrita, al igual que el Fe(α), es magnética por debajo de 770 ºC y amagnética por encima de esta temperatura. Es la razón por la
que algunos autores distinguían entre ferrita alfa (α) y ferrita delta (δ), según sea o no magnética. Sin embargo, como
cristalográficamente se trata del mismo constituyente, no tendremos en cuenta esta distinción y denominaremos a ambas,
sencillamente, ferrita. Esto es interesante, pues limita el calentamiento de la chatarra para poder ser recogida por un puente grúa (ha de
ser < 770 ºC)
La ferrita es el constituyente MÁS BLANDO de los aceros. Es menos dura que la austenita, por su menor contenido en C y MÁS
PLÁSTICA que ella, aunque cristaliza en un sistema - el cúbico centrado en el cuerpo - que no presenta planos compactos.
•
•
•
•
Sus características mecánicas son:
Dureza: 90 HB
Carga de rotura pequeña (Rm): 300 Mpa
Alargamiento: 40 %.
Densidad: 7.88 g/cm 3
Photomicrograph
of a 0.38 wt% C
steel having a
microstructure
consisting of
pearlite
and proeutectoid
ferrite
Ferrita
proeutectoide
Perlita
En los aceros
hipoeutectoides la ferrita
se presenta como
proeutectoide junto con
la perlita y como
eutectoide mezclado con
la cementita para formar
perlita.
CEMENTITA (Fe3C). Contenido en C = 6.67 %
Se forma cementita (Fe 3C) cuando se excede el límite de solubilidad del carbono en la ferrita por debajo de 727 °C (la
composición está comprendida en la región de fases α+Fe3C). La cementita también coexiste con la fase γ entre 727 y
1147°C, cuando se excede el límite de solubilidad del carbono en la austenita.
La cementita es un COMPUESTO INTERMETÁLICO de fórmula
Fe3C, Los enlaces son heteroatómicos (covalentes, y metálicos).
Cristalográficamente se presenta en celdas ortorrómbicas
formada por paralelogramos con a≠b≠c, donde los átomos
de Fe pueden, a veces, ser sustituidos por otros átomos
de Cr, Mo, W, Mn, etc. Puesto que la cementita es un
compuesto intermetálico cuyo enlace predominante no es
metálico, sino que es covalente (cerámicos), parece lógico
pensar que sea frágil (no resiste a los impactos). Además,
es el constituyente más duro de los aceros (68 HRC),
superando al cuarzo en la escala de Mohs.
Como aplicación se puede usar en molinos de carbón
Es ferromagnética por debajo de los 210 ºC. Su punto de fusión es casi indeterminable (1227 ºC), porque a elevadas
temperaturas se descompone antes de alcanzar la fusión. Su densidad es 7.694 g/cm3. Es un poco más ligera que el
hierro (7.97 g/cm3 )
Su resistencia a tracción es limitada pero presenta una muy elevada resistencia a compresión.
CEMENTITA (Fe3C) Contenido en C = 6.67 %
En los aceros aparece como proeutectoide con la perlita en los
hipereutectoides, como eutectoide con laminas intercaladas de ferrita
formando perlita y como proeutectica con la ledeburita en las
fundiciones hipereutecticas.
Perlita
Cementita
proeutectoide
Photomicrograph of a 1.4 wt % C
steel having a microstructure
consisting of a white proeutectoid
cementite network
surrounding the pearlite colonies.
Schematic representations of the
microstructures for an iron–carbon
alloy of hypereutectoid composition
(containing between 0.76 and 2.14
wt% C), as it is cooled from within the
austenite phase region to below the
eutectoid temperature.
CEMENTITA (Fe3C) 6.67 % de C
Hasta la TF (1227 ºC) el material aguanta bien la temperatura, pero cuando permanece a una temperatura muy inferior un
tiempo prolongado se verifica la descomposición de la cementita (T > 450 ºC) Fe3C 3Fe C REACCION DE GRAFITIZACIÓN
Estrictamente hablando, la cementita es metaestable, esto es, permanece como compuesto a temperatura ambiente indefinidamente.
Pero si se calienta entre 650 y 700 °C durante varios años, cambia gradualmente o se transforma en hierro y carbono, en forma de grafito,
que permanece al enfriar hasta temperatura ambiente. Es decir, el diagrama de fases Fe-Fe3C, no está verdaderamente en equilibrio porque
la cementita no es un compuesto estable. Sin embargo, teniendo en cuenta que la velocidad de descomposición de la cementita es
extraordinariamente lenta, en la práctica todo el carbono del acero aparece como Fe3C en lugar de grafito y el diagrama de fases Fe-Fe3C es,
en la práctica, válido.
Así pues, la cementita termodinámicamente es inestable y en determinadas condiciones puede
descomponerse, Fe3C 3Fe+C(Grafito) (Reacción de grafitización). Las condiciones cinéticas requeridas
para que ésta descomposición tenga lugar, requieren un número tan elevado de horas que, en la práctica,
no se presentan nunca en los aceros binarios Fe-C. Sin embargo, por prolongada permanencia (miles de
horas a T>450 ºC) los aceros de bajo carbono o débilmente aleados (por ejemplo, C<0.15%, 0.5 %Mn)
grafitizan parcialmente por descomposición de la cementita en ferrita y grafito.
Reacción de grafitización
La reacción de grafitización, por una parte es mala ya que la reacción Fe3C 3Fe + C + (Fe3C no transformada) se da con un aumento de
volumen produciendo hinchamiento, lo que da lugar a agrietamiento y rotura de la pieza, luego no se debe usar en esos casos. En las fundiciones
blancas, la matriz se agrieta. No son aptas a los tratamientos ≥ 450 ºC, ya que se producen agrietamientos. Rompen por hinchamiento térmico
a través de la grafitización.
Pero también es bueno, ya que para aceros de bajo contenido en C (C < 0.15%, 0.5% Mn), con POCA CEMENTITA y dispersa a 450 ºC se verificará
la descomposición sin agrietamiento (por la baja cantidad de cementita y su dispersión en el acero). Como producto de la descomposición se
obtiene grafito y los aceros así obtenidos se denominan ACEROS GRAFITICOS (Carbono en forma de grafito dispersado en la matriz) y son aceros
propensos a la lubricación en seco (el grafito es un lubricante) y se usan en aplicaciones donde no se puede refrigerar el aceite o no puede haber
aceite Aplicaciones: en sondeos, cojinetes autolubricantes.
DIAGRAMA METAESTABLE Fe-C
1.-
(0.17 % C )
REACCIÓN PERITÉCTICA: Liq(0.53 % C ) (0.09 % C )
1493 ºC
Desde el punto de vista cinético está más impedida que la eutéctica
2.-
TL
P
Para la composición C0 al ir enfriando se alcanza TL a partir de la cual aumenta el %
de C de la fase líquida y el contenido de fase δ. Además va creciendo la fracción de
fase sólida y bajando la de fase líquida (regla de los segmentos inversos). Cuando
se llega al 100 % de fase sólida (Fase δ), ya no hay desprendimiento de calor
(SOLIDIFICACIÓN) y se produce un cambio de concavidad.
NOTA: A menor intervalo de solidificación (TL-TS) mejoran la compacidad y la
colabilidad. Luego estas propiedades son mejores para CP
En C’0 la fase γ y el liquido van creciendo su composición en C. Crece más rápido en
el líquido, el cual a su vez disminuye su proporción con respecto al sólido
X
DIAGRAMA METAESTABLE Fe-C Composición CP (Peritéctica)
Cp: el contenido en C de la fase δ y de la liquida va creciendo. Crece más rápido en el líquido, el cual a su vez disminuye su
proporción con respecto al sólido.
Un dT antes de llegar a la temperatura de 1495 ºC, la composición de la fase líquida es 0.53 % C y la de la fase δ 0.09 % C.
Existe afinidad peritéctica que determina que habrá corrosión periférica con la aparición de un sólido nuevo.
A 1495 ºC todo acaba siendo fase γ con un 0.17 % de C
L
L+
REGLA DE LAS FASES
+
F+L = C+1
DIAGRAMA METAESTABLE Fe-C
Composición hipoperitectica C1.
1.- Primero, a partir del líquido aparece la fase δ.
2.- Al alcanzar la temperatura peritéctica Tp, la fase δ
reacciona con el liquido apareciendo la fase γ, quedando
parte de la fase δ que poco a poco va despareciendo.
(0.17 % C )
Liq (0.53 % C ) (0.09 % C )
1495 ºC
Esta reacción hacer desaparecer todo la fase líquida
0.17 0.09
0.53 0.17
100, f ( )
100
0.53 0.09
0.53 0.09
C 0.09
0.53 C1
C1 a 1495 º C; f' (L) 1
100, f' ( )
100
0.53 0.09
0.53 0.09
f' (L) f (L), ya que C1 0.17 %, por tan to falta líquido
C P a 1495 º C; f (L)
L
L+
+
No hay fase nueva →no hay
desprendimiento de calor
DIAGRAMA METAESTABLE Fe-C Composición hiperperitectica C2.
1- A 1495 ºC el liquido comienza a corroer a la fase δ.
2.- La estructura resultante de la fase γ es una estructura discontinua gradualmente en C, igual que la hipoperitectica, pero esta es más
fácilmente homogeneizable que la C1 (hipoperitéctica) mediante forja
(0.17 % C )
Liq (0.53 % C ) (0.09 % C )
1495 ºC
0.17 0.09
0.53 0.17
100,f ( )
100
0.53 0.09
0.53 0.09
C 0.09
0.53 C2
C2 a 1495 º C; f' (L) 2
100, f' ( )
100
0.53 0.09
0.53 0.09
f' (L) f (L), ya que C2 0.17 %, por tan to sobra líquido
CP a 1495 º C; f (L)
L
L+
L+
CADA CRISTAL TIENE UNA PORCION CENTRAL
DE ALTO PUNTO DE FUSION , QUE VA SIENDO
RODEADA POR CAPAS DE UN PUNTO DE
FUSION CADA VEZ MÁS BAJO
TRANSFORMACIÓN AUSTENITA – FERRITA (γ α)
Las microestructuras de los ACEROS son el resultado de las transformaciones de
la austenita. Esta transformación, a parte de ΔV>0 (aumento de volumen),
experimenta una reacción entre el C y el Fe para formar cementita Fe 3C, carburo de
hierro).
La transformación de la austenita durante un enfriamiento de equilibrio (muy
lento), está asociada a la transformación alotrópica GAMMA ALFA por
movimiento de átomos de Fe y difusión del C. Los movimientos de átomos de Fe
tienen como consecuencia la creación de agrupaciones de diferente simetría: cúbica
centrada en el cuerpo. Estas agrupaciones pueden ser efímeras (si la temperatura
no es adecuada) o permanentes (núcleos) cuya formación requiere un tiempo de
nucleación. Formados los gérmenes de ferrita, su crecimiento se efectúa con
difusión simultánea de los átomos de C hacia la austenita circundante.
γ + Fe3C
FUNDICIONES
ACEROS
○
En las transformaciones de la austenita por enfriamiento lento debe tenerse en
cuenta, además, el carácter gammágeno -o estabilizante de la fase gamma (γ)- que
presenta el C ( ↑ C γ es más estable. Se amplia el campo de estabilidad de ).
Con C en solución sólida la temperatura de la transformación de Fe(δ) a Fe(γ) varía y
tiene lugar por encima de 1394° C; siendo tanto más alta esta temperatura cuanto
mayor sea el contenido en C - dentro de ciertos límites - que el Fe presenta en solución
sólida. La transformación de austenita a ferrita se inicia por debajo de 912 ºC; a
temperatura tanto menor, cuanto mayor sea el contenido en C de la austenita.
Por tanto, la amplitud del campo de estabilidad de γ aumenta.
Para contenidos en C superiores a 0.77 % la estabilización de la fase gamma es tal que
su transformación alotrópica GAMMA ALFA no tiene lugar por lento enfriamiento
hasta alcanzar los 727 ºC, cualquiera que sea el contenido en C superior a 0.77 %.
F+L=C+1 (P=Cte)
F=3 (γ, α y Fe3C)
C=2 (Fe y C)
F+L=3
F=3
L=0
Transformación a
temperatura constante
TRANSFORMACIÓN AUSTENITA – FERRITA (γ α)
En función del % de C hay 3 posibilidades de acero en la
transformación γ α. Para ilustrarlo, pueden considerarse los
siguientes ejemplos de transformación de la austenita por
enfriamiento de equilibrio (infinitamente lento):
—
—
—
Austenita de 0.3%C (hipoeutectoide)
Austenita de 1 %C (hipereutectoide)
Austenita de 0.77%C (eutectoide)
Se observa que para contenidos de C menores del 0.77 %, a
medida que aumenta el % de C, la temperatura A3 de aparición
de la fase α de a partir de la γ disminuye ( A3).
Al contrario, cuando el contenido en C es mayor del 0.77 %, a
medida que se tiene más C en la estructura, la temperatura (Acm)
de inicio de la transformación γ Fe3C, aumenta (Acm).
Los cambios de fases descritos por la reacción
(0.77 %C ) (0.022 %C ) Fe3C (6.67 %C )
referidos a las transformaciones de fases del eutectoide, son
fundamentales para los tratamientos térmicos del acero
Acm
TRANSFORMACIÓN AUSTENITA – FERRITA (γ α) /// Austenita de 0.77 % C. (El C ejerce el máximo poder gammageno).
Una austenita con un contenido inicial de C igual a 0.77 % (Punto a), no experimenta
ninguna transformación por enfriamiento lento hasta alcanzar los 727 °C.
• Para t<tI la fase γ es estable, sin transformar
•
ENFRIAMIENTO MUY LENTO
(condiciones de equilibro)
F+L=C+1 = 2+1 = 3
F+L = 3
F=3 (γ, α y Fe3C)
Para t = tI, (T = 727 ºC) se inicia la transformación de γ en .
γ0.77 → α0.0218 +Fe3C (6.67 %C), Reacción eutectoide
Este cambio de fase necesita la difusión del carbono porque las 3 fases tienen
distintas composiciones. A esta temperatura, el C en solución sólida
sobresaturada e inestable, emigra y (después de un período de incubación)
empieza a formar NÚCLEOS DE CEMENTITA (GERMEN QUE RIGE LA
TRANSFORMACIÓN) , generalmente en los contornos de grano de la austenita. Las
zonas próximas a los gérmenes de cementita se empobrecen en C (% C < 0.77
dentro de la zona rayada contigua al Fe3C ) y se transforman alotrópicamente en
gérmenes de ferrita. La austenita empobrecida en C se transforma en ferrita.
Los gérmenes de cementita continúan creciendo a expensas del C absorbido de
la austenita contigua. El resultado final son unas láminas de cementita
flanqueadas por ferrita. Estas láminas conjuntas ( α + Fe3C) forman un
constituyente complejo de reflejos nacarados denominado, por Sorby, PERLITA.El
crecimiento transcurre entre tI y tII.
RESUMEN.- La reacción eutectoide es análoga a la eutéctica, pero en este
caso todas las especies de la reacción son sólidas. Da una estructura de
ferrita+cementita en láminas denominada perlita (α+Fe3C). La temperatura
constante a la que tiene lugar se denomina Ae (y también A123).
Mecánicamente las perlitas tienen las propiedades
intermedias entre la BLANDA Y DÚCTIL FERRITA y
la DURA Y QUEBRADIZA CEMENTITA.
La relación de los
espesores de las dos
capas es de 8 (Ferrita) a 1.
La disposición
A mayor velocidad de
alternada de capas
enfriamiento, menor
-Fe3C se debe a que
distancia interlaminar.
Si el enfriamiento no es el que corresponde al equilibrio, esta transformación
isotérmica de la austenita binaria eutectoide, se realiza del modo que se verá más
adelante (Transformaciones de inequilibrio en el enfriamiento de la austenita).
el carbono necesita
difundir durante una
distancia
relativamente corta
para originar esta
microestructura
http://www-g.eng.cam.ac.uk/mmg/teaching/typd/addenda/eutectoidmicrostructure1.html
Photomicrograph of a eutectoid
steel showing the pearlite microstructure consisting of alternating layers of ferrite
(the light phase) and Fe3C (thin layers most of which appear dark). (x500)
La perlita aparece en granos denominados "colonias"; dentro de cada colonia las capas están
orientadas esencialmente en la misma dirección y esta dirección varía de una colonia a otra. Las
capas delgadas claras son de ferrita y la cementita aparece como capas delgadas más oscuras.
TRANSFORMACIÓN AUSTENITA – FERRITA (γ α) /// Austenita de 0.3 %C
En el diagrama de la figura 1, se señalan temperaturas y %C en ordenadas y abscisas,
respectivamente. Sobre dicho esquema pueden seguirse los distintos estados de
equilibrio que experimenta una aleación Fe-C de 0.3 %C, enfriada lentamente desde el
estado gamma (γ). Al ir realizando un enfriamiento muy lento en cada punto la
composición es homogénea. La presencia de C hace que la transformación ocurra una T
< 912 ºC (C gammágeno)
F+L=3
A temperaturas superiores a 912 ºC, la aleación se halla por completo en estado
gamma. Disminuyendo la temperatura por debajo de 912 ºC, la austenita sigue aún
sin transformarse, como consecuencia del carácter gammágeno del C, siendo
necesario llegar a una temperatura inferior A 3 para que pueda iniciarse la
transformación γ α. Este comienzo de transformación tiene lugar con incremento
de volumen y ello permite determinar dicha temperatura A 3 por medidas
dilatométricas.
Para t<tI la austenita es estable. Al disminuir la temperatura el valor del parámetro de red
disminuye volviéndose cada vez más inestable.
Para t = tI (T = 912 ºC) el C estabiliza a la fase γ
Figura 1
0.3 %C
A3
La mayoría de las partículas α se generan en los límites de los granos
originales.
Para tI <t <tII como el C es gammageno la austenita es estable.
Para t = tII y T = A 3 (Temperatura a la que se inicia la transformación) se produce el inicio de la transformación
alotrópica γ→α con la aparición de gérmenes de α en puntos triples y en las juntas del grano austenítico, que son zonas
de nucleación heterogénea (Los radios críticos resultan estabilizados). Como la fase α no admite tanto C en solución como la
γ, el C es expulsado de los núcleos de α al interior de los granos de γ (Hay una migración del C -por difusión- hacia el
interior del grano austenítico). Por tanto, la fase γ se enriquece en C y requerirá una temperatura aún más baja para
poder transformarse en .
Al descender la temperatura, aumentará la proporción de ferrita en los contornos del grano y disminuirá la
cantidad de austenita no transformada enriquecida en C. Como se esta enfriando en condiciones de equilibrio toda la
fase γ es homogénea.
Schematic representations of the
microstructures for an iron–
carbon alloy of hypoeutectoid
composition (containing less
than 0.77 wt %C) as it is cooled
from within the austenite phase
region to below the eutectoid
temperature.
Fijandonos en el diagrama T-t
Δt : situación de búsqueda del equilibrio. El sistema tarda el tiempo Δt en alcanzar el equilibrio hasta
que γ se estabiliza homogeneizándose en C. La temperatura continua bajando aumentando el
contenido en α y expulsando C.
Por le Chatelier – Brown la aparición de una nueva fase en el sistema produce desprendimiento de
calor, luego la transformación γ→α desprende calor, de ahí el cambio de concavidad.
Para t ↑≈ tIII → γ0.77 y a t = tIII la γ tiene un carácter eutectoide donde T = Ae (temperatura
eutectoide). A la temperatura de 727 ºC quedara sin transformar una tercera parte de la austenita
original (ahora con un contenido en C de 0.77 %, que se conoce como austenita binaria eutectoide)
γ0.3 → γ0.7 + α0.0218 a 727 ºC, (γ0.7 experimentará la reacción eutectoide)
La dilatación observada en el enfriamiento continua hasta 727 ºC empezando en A3.
Zona enriquecida en C
debido a la aparición
de fase
Fase homogeneizada
(Mayor contenido en C que
originalmente)
HOMOGENEIZACIÓN
t
INEQUILIBRIO
Zona original
(menor contenido en C
EQUILIBRIO
0.3 %C
Cuando se enfría un acero a través de la región de fases α + γ, la composición de la ferrita
varía según la línea MN, del límite de fase α/(α + γ) y se enriquece ligeramente en carbono.
Al mismo tiempo, la composición, de la austenita cambia de modo mucho más drástico,
pues la composición frente a la temperatura sigue la línea MO del límite de fase (α + γ)/γ. La
ferrita de la perlita se denomina ferrita eutectoide y la ferrita formada antes de Te se
denomina ferrita proeutectoide
M
N
O
Las regiones blancas corresponden a la ferrita proeutectoide. En la perlita, la distancia
entre las capas α y Fe3C varía de un grano al otro; a veces la perlita aparece oscura
porque la distancia entre capas es indistinguible a los aumentos de la fotomicrografía.
Cabe anotar la existencia de dos microconstituyentes en esta fotomicrografía: ferrita
proeutectoide y perlita. Estos microconstituyentes aparecen en todos los aceros
hipoeutectoides enfriados lentamente desde la temperatura eutectoide.
Fotomicrografía de un acero 0.38 %C con una microestructura
constituida por perlita y ferrita proeutectoide (x635)
TRANSFORMACIÓN AUSTENITA – FERRITA (γ α) /// Austenita de 1% C (> 0.77 %))
CAMPO MONOFÁSICO
La temperatura Acm corresponde en cada acero al punto en que empieza a separarse la cementita (y ello sin
transformación alotrópica GAMMA ALFA a consecuencia del efecto gammágeno del C).
Al enfriar esta austenita desde altas temperaturas, la contracción de la red cristalina dará lugar a que el C
disuelto aumente la distorsión del cristal, y a una cierta temperatura la red cristalina se volverá inestable. Los
átomos de C expulsados de la red formarán, debido a la gran afinidad con el Fe, la cementita (Fe3C). Este paso de γ
a cementita NO ES UNA TRANSFORMACIÓN ALOTRÓPICA.
Para t = tI´, no se transforma (el papel gammageno del C lo justifica). Sin embargo, al disminuir la temperatura y
aumentar el tiempo (tI´ <t < tII´), se va inestabilizando, ya que va disminuyendo el valor del parámetro de red de .
Al alcanzar la temperatura Acm (Temperatura a la que se inicia la transformación)
los átomos de C emigran hacia las juntas de grano austenítico, donde por reacción
con átomos de Fe (afinidad Fe-C) forman cementita. Como la cementita tiene un
contenido en C del 6.67 %, captar es C de su alrededor, progresando su formación a
expensas del C de la austenita, en cuyo entorno, por tanto, hay una zona deprimida
en C. El centro del grano austenítico queda, por tanto, empobrecido en C [Tras
homogeneizarse el % en C de la fase γ que falta por transformar será menor del 1 %
(la fase γ va bajando en C)] y su austenita será estable. Por tanto, se hace necesaria
una disminución de la temperatura para que pueda producirse una nueva
emigración del carbono hacia los contornos de grano (que evita la distorsión -cada
vez mayor-ocasionada por el carbono cuando, con la temperatura, disminuye el
parámetro de red de la austenita).
Este proceso continúa durante el enfriamiento hasta que se alcanzan los 727 °C.
A dicha temperatura, hay 3.9 % en peso de cementita en los contornos de grano.
Simultáneamente, la austenita tiene un contenido en C de 0.77% en el interior
del grano.
Para contenidos superiores a 0.77 %C, la curva de la figura 1 señala para cada
temperatura Acm, la concentración de C que satura la austenita.
Acm
CAMPO BIFÁSICO
C(%) [0.77, 2.11]
Figura 1.- Schematic representations of the microstructures for
an iron–carbon alloy of hypereutectoid composition (containing
between 0.76 and 2.11 wt % C), as it is cooled from within the
austenite phase region to below the eutectoid temperature.
P
O
La composición de la cementita permanece constante (6.70% C) al variar la temperatura.
Sin embargo, la composición de la austenita se desplaza a lo largo de la línea PO antes del
eutectoide. Al descender por debajo de la temperatura eutectoide, toda la austenita
remanente de composición eutectoide se transforma en perlita. De este modo, la
microestructura resultante consiste en perlita y cementita proeutectoide como
microconstituyentes . Obsérvese que en la fotomicrografía de un acero de 1.4% C la
cementita aparece con una tonalidad clara. Ya que tiene una apariencia parecida a la
ferrita proeutectoide a veces es difícil distinguir la microestructura de los aceros hipo e
hipereutectoides.
Microestructura de un acero con 1.4 %C formado
por cementita proeutectoide blanca reticulada
alrededor de las colonias de perlita. (x1000).
TRANSFORMACIÓN AUSTENITA – FERRITA (γ α) /// Austenita de 1% C (> 0.77 %)
Resumiendo los dos procesos de enfriamiento
considerados —austenita de 0.3 % en C y austenita de 1 %
en C—, puede decirse que:
1º.- Las austenitas con carbono inferior a 0.77 % empiezan
a transformarse en ferrita a temperaturas A3 y si su
contenido original en C es mayor que 0.0218 %, no
terminan la transformación antes de los 727 °C
2°.- Las austenitas con más de 0.77% de C empiezan a
precipitar cementita a temperaturas Acm, y no se
transforman en ferrita antes de los 727 °C
3°.- En ambos casos, al alcanzar los 727 °C el contenido de
carbono de la austenita es 0.77 %
El acero ferrito-perlitico se produce si se enfría siguiendo el diagrama. La
cementita producida por debajo de 727 ºC se denomina cementita terciaria.
El acero ferritico es aquel cuyo contenido en C es menor del 0.0218 % y que
no presenta perlita. El acero perlitico es el eutectoide.
Acero hipoeutectoide: γ → α +perlita;
Carga de rotura de los aceros ferrito-perliticos :
R = (% f)Rf + (% p)Rp , (% p) = 100 – (% f)
% PRO
0.77 C
100
0.77 0.022
% Perlita
C 0.022
100
0.77 0.022
A mayor contenido de perlita el acero es más resistente.
↑ % p ↓ % f ↑ R ↑ dureza Acero dulce (blando): % C 1;
Acero extradulce:
% C < 0.0218
% Fe3CPRO
Acero hipereutectoide: γ → Fe3C +perlita
% Perlita
C 0.77
100
6.70 0.77
6.70 C
100
6.70 0.022
A medida que enfriamos aparece cementita+austenita y esta
última acaba formando perlita
Al aumentar el % de C, aumenta la resistencia a la tracción, pero el
alargamiento antes de la rotura disminuye (como en los aceros
hipereutectoides donde la cementita hace que rompa sin alargamiento)
Acero ferritico
Acero ferrito-perlitico