Propagación de plantas
Anuncio
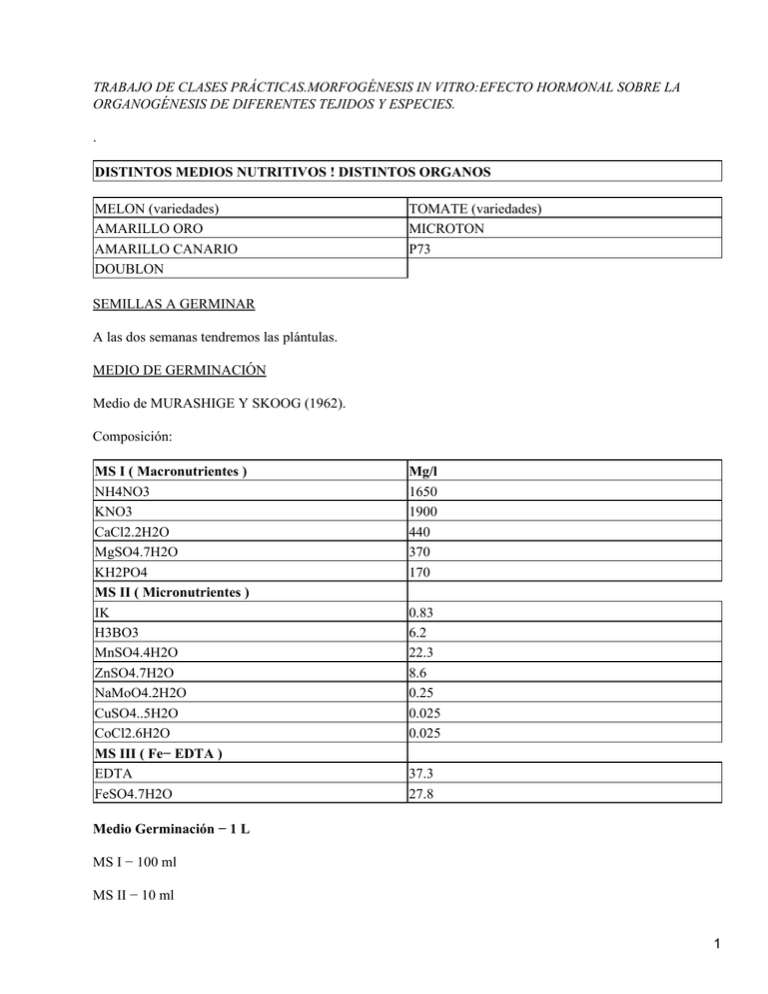
TRABAJO DE CLASES PRÁCTICAS.MORFOGÉNESIS IN VITRO:EFECTO HORMONAL SOBRE LA ORGANOGÉNESIS DE DIFERENTES TEJIDOS Y ESPECIES. . DISTINTOS MEDIOS NUTRITIVOS ! DISTINTOS ORGANOS MELON (variedades) AMARILLO ORO AMARILLO CANARIO DOUBLON TOMATE (variedades) MICROTON P73 SEMILLAS A GERMINAR A las dos semanas tendremos las plántulas. MEDIO DE GERMINACIÓN Medio de MURASHIGE Y SKOOG (1962). Composición: MS I ( Macronutrientes ) NH4NO3 KNO3 CaCl2.2H2O MgSO4.7H2O KH2PO4 MS II ( Micronutrientes ) IK H3BO3 MnSO4.4H2O ZnSO4.7H2O NaMoO4.2H2O CuSO4..5H2O CoCl2.6H2O MS III ( Fe− EDTA ) EDTA FeSO4.7H2O Mg/l 1650 1900 440 370 170 0.83 6.2 22.3 8.6 0.25 0.025 0.025 37.3 27.8 Medio Germinación − 1 L MS I − 100 ml MS II − 10 ml 1 MS III − 10 ml Inositol − 100 ml Sacarosa − 10 gr Se ajusta el pH = 5,7 (con KOH) Agar !0,8 % ! Añadiremos 8 g/l En probeta con 500 ml de agua destilada añadimos 4 gr de Agar. Para fundir el agar se usa el microondas (tarda poco) o el autoclave (tarda mucho). Se distribuye en tubos de ensayo antes de que solidifique, se ponen las tapas y se lleva al autoclave ! ESTERILIZA, a 121 oC durante 20 minutos. Esterilización de semillas. Melón ! hay que pelarlas antes. Acelera el proceso de germinación. Tomate ! esterilización directa. Tendremos cinco recipientes para esterilizar las semillas (uno vacío), el primero tendrá lejía al 20 % (comercial:40%), se dejaran las semillas reposar durante 20 minutos (50 ml: 25 H2O y 25 LEJIA). Tras los 20 minutos se pasan las semillas con unas pinzas al segundo recipiente con 50 ml de agua destilada, y se dejan alli 5 minutos. Pasados los 5 minutos se pasan las semillas al tercer recipiente con agua destilada, y se dejan allá 10 minutos. Pasados los 5 minutos se llevan las semillas al cuarto recipiente con agua destilada y se dejan allí durante 15 minutos. Este método de pasar las semillas de recipiente a recipiente es para diluir los restos de lejía de las semillas. En cabina de flujo laminar se haria bien la inoculación en el medio nutritivo de los tubos de ensayo, pero como no hay se flamean con alcohol las pinzas y los bordes de los tubos de ensayo. Melón ! 1 semilla por tubo de ensayo. Tomate ! 2 semillas por tubo de ensayo. Medio de organogénesis. Veremos como distintas concentraciones hormonales afectan a callos, brotes. En un litro de agua destilada añadimos: MS I MS II MS III Sacarosa 100 ml 10 ml 10 ml 40 gr 2 Inositol Vitamina SH (complejo) 100 mg 10 mgr Luego añadimos hormonas, en mg/l, en distintas combinaciones: AIA Kinetina 1 0 0 2 0,4 0,4 3 4 0,4 4 0,4 4 5 4 4 PH=5,7 0,8 % Agar Se introduce en el autoclave, esterilizando , y luego se aplican en placas de Petri. Cada grupo prepara 400 ml de medio. 16 placas. Cada grupo con 2 placas, una de tomate y otra de melón. MEDIO DE ANTERAS. De la planta Nicotiana glauca. Medio de Nitsch & Nitsch (1969). Del preparado comercial se pesan 2,1 gr/l. NOSOTROS Preparado comercial Inositol Sacarosa Vitamina SH 1 litro 2,1 100 mg 20 g 10 ml A (AIA) 2 mg/l (Kinetina) −−− B −−− 2 mg/l Enrasar a 200 ml PH=5,7 Agar 0,8% Se lleva al autoclave, esterilizando y se distribuye en 16 placas, 8 para A y 8 para B. MEDIO DE CULTIVO DE EMBRIONES (Citricos). En un litro de agua destilada añadimos: MS I MS II MS III 100 ml 10 ml 10 ml 3 Sacarosa Inositol Vitamina SH (complejo) 40 gr 100 mg 10 ml PH=5,7 Preparamos 200 ml y lo llevamos a 16 placas. CULTIVO DE ANTERAS. De plantas de Nicotiana glauca (o GANDUL). Antes de nada determinaremos el estadio adecuado del polen ! MICROSPORA TARDIO o BINUCLEADO TEMPRANO. Usaremos 6 estadios diferentes. Anteras. Gotas de carmin acético. Varilla de vidrio (maza). Estadios 1−TETRADA. Se esta produciendo la meiosis. 2−MICROSPORA. 3−BINUCLEADO. 4−MADURO. Cada tamaño de flor me dara un estadio diferente. TIPOS DISTINTOS DE FLOR SELECCIONADA: Lejia 20% rebajada al 25% ! 15 minutos. 3 aclareos. Se ponen sobre placas estériles, y se usan pinzas flameadas. Cortamos con bisturí y las anteras directamente se ponen en placa de cultivo. Medio A ! AUXINA Medio B ! CITOQUININA Plántulas de TOMATE ! cortamos en cuatro trozos los cotiledones. Hipocotilo ! trozos 0,3 − 0,4 cm. Los pasamos a los distintos medios preparados en la segunda práctica. 4 RESULTADOS DE MICROPROPAGACIÓN "IN VITRO". Grupo: G−7. Veamos los resultados en los distintos medios: TOMATE. 1 −Placa compartida con melón.Uno con hojas. Con raíces. 2 −Con raíces. 3 −Un poco contaminado. Con menos raíces. 4 −Con callo. Sin raíces. 5 −No ha regenerado. Trozos muy pequeños. MELÓN. 1 −Con callos. Sin raíces. 2 −Un propágulo con muchas hojas. Callos. 3 −Mucha formación de callo, sobre todo en tallos. 4 −Formación equilibrada, de callos con brotes y raíces. 5 −Está como quemado, muerto.Sin regeneración. Medios cultivados por la profesora, e inoculados con cuidado evitando la contaminación microbiana. Mejores medios ! MEDIOS 1 Y 5 PARA EL TOMATE, inoculándose trozos de hipocotilo.Se obtienen buenos desarrollos de plantas. Mejores medios para el melón no se observan. Como podemos observar existen diferencias visibles de Organogénesis en las dos especies utilizadas. Para el melón la obtención de callos es muy baja. PRACTICAS DE PROPAGACIÓN DE PLANTAS 1 1 MORFOGÉNESIS IN VITRO. FEBRERO 2001 5
