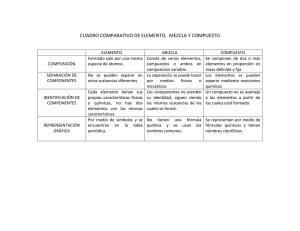
Química 2
Anuncio

Química 2 Índice: Competencia I…………………………………………………………………………………………………………………………..20 FORMULAS DE COMPUESTOS Saberes 1. Formulas de los Compuestos Químicos Ejemplos 1. Componentes de las formulas químicas Ejercicios 1. ¿Cuántos sabes? Práctica 1. Obteniendo las formulas químicas a partir de los ingredientes de un suplemento alimenticio Competencia II…………………………………………………………………………………………………………………………..30 ECUACIONES QUÍMICAS Saberes 1. Concepto de ecuación Química Ejemplos 1. Tipos de ecuaciones Químicas a sus aplicaciones Ejercicios 1. Sus componentes y la identificación de las ecuaciones químicas Práctica 1. Aplicando las ecuaciones químicas Competencia III……………………………………………………………………………………………………….………………..42 BALANCEO DE ECUACIONES Saberes 1. El balanceo de ecuaciones químicas Ejemplos 1. Método por tanteo 2. Método redox Ejercicios 1. Aplicando la ley de la conservación de la materia Práctica 1. Vayamos a la práctica Competencia IV………………………………………………………………………………………………………………………..53 RECONOCERÁ LOS TIPOAS DE SOLUCIONES QUE PARTICIPAN EN UNA REACCIÓN QUÍMICA Competencia V………………………………………………………………………………………………………………………..63 RELACIONES ESTEQUIOMÉTRICAS Saberes 1. Masa Atómica 2. Molalidad 3. Molaridad 4. Normalidad 5. Porcentual Ejemplos 1. Haciendo cálculos para determinar; la Masa Molecular, el Volumen, cantidad de soluto y el numero de moles en las soluciones Ejercicios 1. Como preparar una solución Práctica 1. Vayamos a la práctica Competencia VI………………………………………………………………………………………………………………………..76 APRENDE A CONOCER LAS CARACTERÍSTICAS ESENCIALES DE ACIDOS Y BASES Competencia VII………………………………………………………………………………………………………………………..88 ANALIZAR LA QUÍMICA DEL CARBONO Saberes 1. Hidrocarburos 2. Isómeros 3. Derivados halógenos Ejemplos 1. Qué fácil es Química Ejercicios 1. Aplicando Nomenclatura Práctica 1. Propiedades de los compuestos con carbono Este curso tiene como objetivo, que el alumno adquiera los contenidos fundamentales de la química, desarrolle habilidades de pensamiento, de comunicación y que a la vez le permitan utilizarlos en la resolución de problemas de la vida cotidiana. El alumno tendrá la habilidad para nombrar y representar a los cambios químicos que suceden en las sustancias, elementos y compuestos químicos, realizar los cálculos necesarios para la preparación de soluciones así como identificar a los hidrocarburos tanto en sus componentes, como en sus formas estructurales. Todo lo anterior con el único fin de enriquecer su nivel de aprendizaje. Estas notas también constituyen un manual técnico que presenta Prácticas del laboratorio que capacitan al alumno y los complementan con las clases (profesor-alumno-laboratoriomedio ambiente), ya que hemos visto, que de otra forma es difícil aprender el fascinante mundo de la química. Para apropiarse del aprendizaje de una ciencia experimental, como la Química, es necesario realizar actividades y experimentos sencillos. Para realizar cualquier experimento ten en cuenta las recomendaciones de seguridad y trata de evitar situaciones riesgosas. Página 16 Página de Página 17 Página de Bienvenido al modulo II de la asignatura de Química, tienes en tus manos un libro que fue elaborado pensado en ti. Te invitamos a que saques el mayor provecho a esta obra, ya que Juntos emprenderemos un viaje por el maravilloso mundo de la química. En este curso estudiarás cómo el ser humano es capaz de construir explicaciones en torno a los fenómenos naturales. Tendrás diversas actividades que te ayudaran a comprender la importancia de la Estequiometria y la Química del carbono temáticas fundamentales en este curso. Tendrás un mayor acercamiento en la comprensión de las formulas y ecuaciones químicas, así como de las soluciones y los tipos de reacciones mas utilizadas. Página 18 Página de Página 19 Página de FORMULAS DE COMPUESTOS 1 1.- Formulas de los Compuestos Químicos 1.-Componentes de las formulas químicas 1. ¿Cuántos sabes? 1. Obteniendo las formulas químicas a partir de los ingredientes de un suplemento alimenticio. Página 20 Página de La química es fundamental para la producción de nuevos materiales que facilitan la vida diaria, razón por la cual esta ciencia siempre influye en la vida de todo ser humano. En este curso estudiarás cómo el ser humano es capaz de construir explicaciones en torno a los fenómenos naturales. Aprenderás que el nombre de cualquier compuesto químico tiene su formula basado en las normas de los sistemas de nomenclatura química. Para los efectos de nombrar la gran variedad de compuestos químicos, es necesario agruparlos en categorías. Los ejemplos y practicas están hechas de tal manera que logres entender los fenómenos que te rodean, tal es el caso de la combustión, fenómeno en el cual a diario utilizas. Es por eso, nuestro interés de que al final logres ser competente al hacer uso y aplicaciones de tus conocimientos adquiridos de química. Te recomendamos que en el desarrollo de las prácticas trabajes en equipo con algunos de tus compañeros para que así compartan el material y la herramienta necesarios, sin embargo te recordamos también que las competencias se adquieren individualmente, por lo que deberás ser responsable y ordenado en tus actividades. Página 21 Página de ATRIBUTOS DE LA COMPETENCIA 9 9 9 Aprende de la importancia de las formulas químicas. Maneja los diferentes tipos de formulas químicas. Sera capaz de comprender la composición de la materia por medio de formulas químicas. Al finalizar estas actividades, el alumno podrá entender que las sustancias químicas se representan por medio de una formula, RESULTADO DE llamada formula química y estas a la vez utilizadas para APRENDIZAJE entender las reacciones químicas, debido a que están en el contexto de la vida cotidiana. Investiga en cualquier libro de química las siguientes preguntas y escribe las respuestas en el espacio correspondiente. 1.- ¿Que entiendes por química? __________________________________________________________________________ __________________________________________________________________________ 2.- ¿Para qué nos sirven las formulas de los compuestos? __________________________________________________________________________ __________________________________________________________________________ 3.- ¿Que significa IUPAC? __________________________________________________________________________ __________________________________________________________________________ 4.- ¿Qué indica una formula química? __________________________________________________________________________ __________________________________________________________________________ 5.- ¿Cuáles son los componentes en una formula química? __________________________________________________________________________ __________________________________________________________________________ Página 22 Página de Nombre Formulas de los Compuestos Químicos No. 1 Instrucciones Analiza la información que se presenta y aclara cualquier duda con su para el profesor Alumno *Estructura de los Manera compuestos químicos Saberes a Didáctica Mediante exposición y tareas adquirir *Tipos de Formulas de Lograrlos Debido a la enorme cantidad de compuestos que la química maneja, se hace imprescindible la existencia de un conjunto de reglas que permitan nombrar, de igual manera, en todo el mundo científico un mismo compuesto; de no ser así, el intercambio de información entre los países seria de nula utilidad. Los químicos, a consecuencia de una iniciativa surgida en el siglo pasado, decidieron representar de una forma sencilla y abreviada cada una de las sustancias que se manejan, la escritura en tipo de clave de cualquier sustancia constituye su formula. Todas las sustancias utilizadas en la actualidad, son representadas por medio de una combinación de símbolos químicos de los elementos que las constituyen, Esta forma de representación fue introducida por el químico sueco Jacobo Berzelius (1979-1848). Esta representación, nos indica los elementos que participan y en qué cantidad en átomos lo hacen cada uno de ellos y estos a la vez se representan como subíndice. La sacarosa es un compuesto que a diario consumimos, para obtener su formula química es necesario empezar por el análisis cualitativo basado en la nomenclatura ¿de qué elementos químicos está formada?, Posteriormente por el análisis cuantitativo ¿Cuánto hay de cada elemento? C12H22O11 Página 23 Página de SACAROSA Las formulas químicas son parte del lenguaje de la química, y es necesario que comprendas correctamente la notación empleada. Para objeto de estudio es necesario conocer las dos formas más utilizadas para representar a los compuestos. Formula condensada Formula desarrollada H 2O H −O− H Cl2 O Cl − O − Cl CO2 O−C −O 2 H 2 SO4 No. Moléculas Elemento Subíndice Glucosa Página 24 Página de Nombre Componentes de las formulas químicas No. 1 Instrucciones Revisa los contenidos sobre este tema y analiza los ejemplos que se dan en este apartado para el Alumno Manera Se recomienda hacer observaciones, un Orden y Actitudes a Didáctica análisis y desde luego con una formar Responsabilidad de participación activa de todo el alumnado. Lograrlas Competencia Desarrolla innovaciones y propone soluciones a problemas a partir de s Genéricas a métodos establecidos. Desarrollar Manera Didáctica de Lograrlas Realiza el análisis de las formulas químicas, y comenta en clase las dudas que resulten de manera que al final de la sesión, sean aclaradas por el profesor. Continuando con el estudio de las formulas químicas, es necesario conocer perfectamente los símbolos de los elementos químicos de la tabla periódica, dicho de otra manera, el memorizarlos trae grandes ventajas y facilita el estudio de las formulas, ya que en ellas se indican los elementos que la constituyen y la relación numérica en que intervienen sus átomos.En la siguiente tabla se muestran algunas formulas de los compuestos más conocidos y utilizados. Formula Química NaCl HCl C 19 H 19 N 7 O 6 Nombre Químico Cloruro de Sodio Acido Clorhídrico Acido Fólico H 2 O2 Peróxido de Hidrogeno H 2O Agua C 4 H 10 Gas Butano C6H 12 O6 Glucosa Página 25 Página de Nombre ¿Cuánto sabes? No . 1 Instrucciones Contesta los ejercicios de acuerdo a tus conocimiento generales de para el Alumno química, si tienes duda pide ayuda tu profesor o con tus compañeros. Actitudes a formar Competencias Genéricas a Desarrollar Manera Didáctica de Lograrlas Responsabilidad Manera Didáctica de Lograrlas Utilizando esta guía, y ejercicios de otras fuentes de información y tendrás mayores habilidades y destrezas para lograrlo. Aprende por iniciativa e interés propio a lo largo de la vida. El alumno investiga acerca de las diferentes tipos de formulas químicas; condensada y desarrollada y emplea los conocimientos adquiridos para distinguirlos. Marca la respuesta que consideres correcta y contestar cuando te lo indique. 1.- ¿Cuál de las siguientes formula química corresponde a un hidruro? b) NaOH c) H 2 S d) H 2 SO4 a) CaH 2 2.- Que nombre corresponde a la siguiente formula química H 2 SO4 a) Acido Nítrico b) Acido sulfúrico c) Hidróxido de Sodio d) Acido Clorhídrico 3.- ¿Cuál de estas formulas químicas corresponde con el acido fosfórico? a) H 3 PO4 b) H 2 CO3 c) HNO3 d) H 2 SO4 4.- ¿Cuál será el subíndice x en la formula química H 3 Px O4 ? si la masa molecular del compuesto es igual a 97.994 uma. b) x = 3 c) x = 1 d) x = 4 a) x = 2 5.- En la formula química del nitrato de potasio KNO 3 , el subíndice 3 del oxigeno representa. a) 3 moléculas b) 3 moles c) 3 átomos d) No se 6.- La miel de abeja se compone de fructosa, agua y glucosa, Su color y sabor dependen de la edad de la miel y de la fuente del néctar. Las mieles de color claro suelen ser de mejor calidad que las oscuras. La Glucosa tiene como formula química C 6 H 12 O6 . Si 500 abejas trabajan durante 15 días, para recolectar 1.5 litros de miel. a) ¿Esas mismas abejas para recolectar 3.8 litros. ¿Cuantos días tendrán que trabajar? a) 35 días b) 48 días c) 38 días d) No se 7.- La molécula del compuesto que produce la formación de la lluvia acida contiene un átomo de azufre y tres de oxigeno. ¿Cuál será su formula química? Página 26 Página de 8.-El óxido de calcio, que conocemos como cal o cal viva, se utiliza principalmente en la fabricación de vidrio y en la construcción. a) Cual será su formula química? b) ¿Cuántos moles de oxido de calcio hay en un bulto que pesa 50 Kg? a) CaO2 , ______ Mol b) Ca3 O2 , ______ Mol c) CaO , ______ Mol d) Ca3O3 , ______ Mol 9.- Cual será su formula química de cada uno de los siguientes compuestos. a) Fenol _______________ b) Benceno _______________ c) Metanol _______________ d) Oxido de Magnesio _______________ e) Nitrato de potasio _______________ 10.- En la siguiente formula química 3H 2 SO4 ¿Cuál será el análisis cualitativo y cuantitativo? Cualitativo: Cuantitativo: _______________ _______________ _______________ _______________ _______________ _______________ _______________ _______________ Página 27 Página de Nombre Competencia a Desarrollar Obteniendo las formulas químicas a partir de los No. 1 ingredientes de un suplemento alimenticio. Aplica los conocimientos necesarios para obtener las formulas químicas a partir de los nombres de los ingredientes de cualquier producto utilizado en la vida cotidiana. 9 Identifica los elementos que integran las formulas químicas 9 Logrará obtener el numero de átomos de cada elemento que forman la Habilidades formulas química. 9 Podrá comprobar que las formulas químicas son parte fundamental en el estudio de esta asignatura. Ten a la mano una tabla periódica de los elementos químicos y estar muy Instrucciones atento a las recomendaciones del maestro para llevar a cabo la práctica, para el haciendo uso del material en este caso la etiqueta de ingredientes de un Alumno suplemento alimenticio. Instrucciones Indicar la forma de hacerlo, proporcionar el material o indicar como para el adquirirlo y asistir a los alumnos. Docente Etiqueta de un producto Recursos Tabla periódica materiales de Reglas de la IUPAC apoyo Manera Orden Actitudes a Didáctica Realizar la práctica en el tiempo indicado formar Responsabilidad y realizarla con el orden mostrado. de Lograrlas Competencia s Genéricas a Desarrollar Manera Didáctica de Lograrlas Aprende por iniciativa e interés propio a lo largo de la vida. La actividad practica requiere que se haga individualmente, por lo que se deben tener conocimientos de cómo hacerlo, de no ser así se debe investigar mostrando iniciativa e interés. Página 28 Página de PROCEDIMIENTO: En base a la etiqueta y con la ayuda de la tabla periódica obtener la formula química de los compuestos que forman el producto, colocando en el lado izquierdo el nombre y en el lado derecho su formula química. ETIQUETA INGREDIENTES Ácido Cítrico, Gluconato de Magnesio, Niacina (Vitamina B3), Ácido Ascórbico (Vitamina C) Fosfato Tricálcico, Dióxido de Silicio, Mononitrato de Tiamina (Vitamina B1), Retinol (Vitamina A), Sulfato ferroso, Clorhidrato de Piridoxina (Vitamina B6), Cloruro de Sodio, Tocoferol (Vitamina E), Color amarillo ≠5, Mango Deshidratado, Piña Deshidratada y Fresa Deshidratada. Resultados: Nombre de la sustancia 1.- Ácido Cítrico 2.- Gluconato de Magnesio 3.- Niacina (Vitamina B3), 4.- Ácido Ascórbico (Vitamina C) 5.- Fosfato Tricálcico 6.- Dióxido de Silicio 7.- Mononitrato de Tiamina (Vitamina B1), 8.- Retinol (Vitamina A), 9.- Sulfato ferroso 10.- Cloruro de Sodio Formula química _______________ _______________ _______________ _______________ _______________ _______________ _______________ _______________ _______________ _______________ Página 29 Página de 1. Ecuaciones Químicas 2 1.- Concepto de ecuación Química. 1.- Tipos de ecuaciones Químicas y sus aplicaciones. 1.- Sus componentes y la identificación de las ecuaciones química 1.- aplicando las ecuaciones químicas Página 30 Página de Hola me da gusto que te des la oportunidad de aprender química, no hagas caso de que es muy difícil de entender, prepárate ha llegado el momento de introducirnos en el maravilloso mundo de la química, en este caso me toca a mí enseñarte todo lo relacionado con las ecuaciones químicas. Es importante que comprendas la definición, y desde luego toda la simbología utilizada, los diferentes tipos que existen, sus aplicaciones, sus usos, así como los cuidados que debes de tener al estar trabajando en el laboratorio, porque es ahí donde empiezan sus aplicaciones. Una ecuación química es la taquigrafía que los científicos usan para describir una reacción química. ¿Tú sabes que es una reacción química? Si no sabes o no recuerdas no te preocupes. Una reacción química es un proceso en el cual una sustancia (o sustancias) se transforma en una o mas sustancias nuevas y las ecuaciones químicas son el modo de representarlas. Estas reacciones químicas de las cual te hablo ocurren a nuestro alrededor, por ejemplo: cuando tu mamá enciende un fósforo para calentar la comida o cuando tu papá enciende el auto para llevarte a la escuela. Ahora te das cuenta de la importancia de aprender química, como te darás cuenta, la necesitamos para vivir y gracias a la química se deben grandes adelantos. Gracias por la oportunidad que me das, de continuar ensañándote química, ahora quiero que veas algún objeto de madera, ahora imagínatelo encendido, cuanto humo verdad. Que te parece si juntos armamos el rompecabezas aplicando química. Agua D Oxigeno B Cerillos A Humo (Dióxido de carbono) C Objeto de madera A La ciencia ha demostrado, que al quemar algún combustible, objeto de madera u otra cosa, se produce Dióxido de carbono y agua. Estos cambios en la materia se deben a que ocurrió una reacción química, en donde los reactivos se convirtieron en productos. Apliquemos las ecuaciones químicas. A + B ∆ C + D Madera + cerillos Dioxido de carbono + agua Oxigeno Esta es una de las ventajas que se tiene al representar una reacción química por una ecuación química. Esta representación escrita proporciona información acerca de lo que ha ocurrido en este fenómeno. Página 31 Página de ¿Cómo te sientes? ¿Podemos continuar? Observa esta imagen, es una empresa que produce pan, que distribuye a toda una ciudad, también aquí podemos aplicar las ecuaciones químicas. ¿Sabes cómo? bien te felicito. ATRIBUTOS DE LA COMPETENCIA RESULTADO DE APRENDIZAJE 9 Manejar conceptos fundamentales sobre reacciones químicas 9 Representar las reacciones químicas de acuerdo a la simbología requerida por las ecuaciones químicas. Comprende las reacciones que ocurren a nuestro alrededor aplicando ecuaciones químicas. El docente expone al grupo los motivos de esta competencia, mencionara algunas aplicaciones, apoyado de materiales multimedia o con demostraciones prácticas relacionadas con algunas reacciones químicas más importantes. Actividad para el alumno: Las empresas que aquí se muestran en las imágenes obtienen sus productos gracias a las reacciones químicas. Comenta con tus compañeros sobre algunas otras empresas o aparatos que creas que funcionen en basa a una reacción química y confírmalo con tu maestro. Página 32 Página de Nombre Concepto de ecuación Química. No. 1 Instrucciones Revisa los conceptos básicos que se muestran en este apartado para el Alumno Manera Tipos de Saberes a Didáctica Analizando la información y Ecuaciones adquirir de preguntando cualquier duda Químicas Lograrlos Una ecuación química es una representación escrita que proporciona información acerca de lo que ha ocurrido en las reacciones químicas. Para entender la información que nos proporciona es importante que conozcamos las características y las partes que la integran. En primer lugar, las sustancias participantes se representan con respectivas formulas químicas es decir: CO2 H 2O NaCl C6 H12O6 Así mismo, es importante indicar el estado físico de los reactivos y productos, antes de continuar, ¿sabes que es un reactivo?, déjame ayudarte, pues bien es la materia con la que vas a experimentar, con la finalidad de obtener o producir otra y que puedes utilizarla para llevar acabo tus actividades diaria, y mucha de las veces también puedes consumir o vender. Se me viene a la mente la definición de química, donde estable que es la ciencia que estudia la materia, la estructura, su composición como también la energía, pero sobre todo en la transformación en productos útiles a la sociedad. El estado físico o estado de agregación de los participantes se indica con letras entre paréntesis un lado de la formula química de las sustancias. Las letras usadas para indicar el estado físico son las siguientes. Estado Físico Símbolo Sólido (s) Liquido (l) Gas (g) Acuoso(disuelto en agua) (ac), (aq) Página 33 Página de Otra característica importante en las ecuaciones químicas, son las condiciones de la reacción, estas condiciones son detalles que aclaran aspecto que son necesarios para que ocurra la reacción como pueden ser: Condición Símbolo Temperatura T Presión P Presencia de Luz Luz Aplicación de Calor ∆ Catalizador Ct Por ultimo, también las ecuaciones químicas contienen símbolos que son parte fundamental, tales como: Símbolo Significado Da o produce Reacción reversible + Más o se agrega Gas que se desprende Precipitado que se forma Para entender bien la información que nos proporciona una ecuación química es importante saber leer su contenido. A continuación se muestra como leer una ecuación química. Al( s ) + Fe2O3( s ) Al2O3( s ) + Fe( s ) Se combina aluminio en estado sólido con oxido ferrico en estado sólido, para dar oxido de aluminio y Hierro en estado sólido. Página 34 Página de Nombre Tipos de ecuaciones Químicas y sus aplicaciones. No. 1 Instrucciones Revisa los saberes sobre este tema y analiza los ejemplos que se dan en para el este apartado. Alumno Analiza los ejemplos de los diferentes Manera Actitudes a Didáctica tipos de ecuaciones químicas que se dan Orden formar de en este apartado, es necesario que Lograrlas preguntes en caso de que tengas dudas. Competencia Contribuye al alcance de un equilibrio entre los intereses de corto y largo s Genéricas a plazo con relación al medio ambiente. Desarrollar Manera Didáctica de Lograrlas Que analice la información, para que al final pueda identificar cualquier tipo de reacción química a la que pertenece. Una gran cantidad de alimentos que consumimos, son conservados de una forma adecuada, para que no se echen a perder, dicho de otra manera, para que no se descompongan se utiliza la refrigeración o la congelación. Cuando los alimentos se descomponen, se dice que hay una reacción química, donde cambia de color. Las reacciones químicas se usan en la fabricación de medicamentos, telas, pigmentos, pinturas, plásticos etc. También las reacciones químicas producen energía para calentar el agua, encender el motor de un auto, caminar, trabajar, comer en fin. Al conjuntos de reacciones químicas destinadas a la transformación de nutrimentos y generar energía para el cuerpo se le denomina metabolismo; la transformación de los alimentos en sustancias útiles para el organismo se lleva a cabo por medio de reacciones químicas especificas a través de proteínas llamadas enzimas. Las reacciones químicas son parte fundamental para el estudio de la química, ya que nos brindan información muy importante sobre cuáles y cuantos elementos están participando en la reacción. Las reacciones para su estudio se clasifican en: a) Síntesis b) Sustitución simple c) Sustitución Doble d) Descomposición Página 35 Página de Síntesis Son aquellas reacciones que ocurren cuando se forma un compuesto a partir de materiales simples, es decir, son los que se unen químicamente dos o más elementos o compuestos para formar otros más complejos, se puede definir con la ecuación química: A + B → AB Para entender mejor la descripción se tomaran únicamente dos ejemplos para su demostración H 2 + O2 → H 2 O CaCO + CO2 → CaCO3 Sustitución Simple Las reacciones de sustitución sencilla son aquellas en las que un elemento reacciona con un compuesto y cambia o desplaza a un elemento de ese compuesto, dando como resultado otro compuesto diferente, lo que se puede representar con la siguiente ecuación química. A + B → AB + C Ejemplo de este tipo: Zn + HCl → ZnCl2 + H 2 Cl2 + KI → KCl + I 2 Sustitución Doble Es un tipo de reacción en donde se intercambian los iones o radicales entre compuestos para formar dos compuestos diferentes; donde se define con la ecuación química siguiente. AB + CD → AD + CB Ejemplo de este tipo: NaOH + HCl → NaCl + H 2O NaCl + AgNO3 → AgCl + NaNO3 Descomposición Es un tipo de reacción fácil de entender, debido a que sus participantes se fragmentan en elementos o compuestos más sencillos. BC → B + C H 2O → H 2 + O2 Al2O3 → Al + O2 Página 36 Página de Nombre Sus componentes y la identificación de las ecuaciones química No . 1 Instruccione Concéntrate y aplica todo los conocimientos adquiridos, logrando dar s para el resultados favorables a la actividad de enseñanza –aprendizaje. Alumno Utilizando esta guía y otras fuentes de Manera información y obtendrás las habilidades Actitudes a Didáctica Responsabilidad requeridas para el estudio de las formar de Lograrlas ecuaciones químicas. Competenci as Aprende por iniciativa e interés propio a lo largo de la vida. Genéricas a Desarrollar Manera El alumno investiga acerca de los diferentes tipos de ecuaciones químicas Didáctica de y emplea los conocimientos adquiridos para distinguirlas. Lograrlas I.- De acuerdo a la siguiente ecuación química, contestar lo que se te indique en cada uno de los puntos. (CaCO3 )(s ) → CaO(s ) + (CO2 )( g ) a) ¿Cuales son los nombres de los compuestos químicos que participan? CO2 =_______________ CaO =_______________ CaCO3 =_______________ b) ¿Cuales son reactivos y cuales son productos? CO2 =_______________ CaO =_______________ CaCO3 =_______________ c) ¿Cuales son los estados de agregación de los compuestos que participan? ( ): _______________ ( ): _______________ ( ): _______________ d) ¿Cual es la cantidad de átomos en reactivos y en productos de cada uno de los elementos que participan? Aplicando la ley de la conservación de la materia. Reactivos Productos Ca = _______________ Ca = _______________ C = _______________ C = _______________ O = _______________ O = _______________ e) ¿Cual es el peso atómico de cada elemento que participa en la reacción química? Ca = _______________ C = _______________ O = _______________ f) ¿Cuales son sus valencias de los elementos que participan? Ca = _______________ C = _______________ g) A que tipo de Reacción corresponde: _____________ O = _______________ Página 37 Página de h) ¿Sabes para que se utilizan los compuestos que participan? CaCO3 = __________________________________________________________________ CaO = __________________________________________________________________ CO2 = __________________________________________________________________ II.- Resolver los siguientes problemas 1.- Si pedro tiene 128.50 pesos, y decide comprar CaCO3 ¿Cuantos kilogramos le darán si el precio por kilo es de 16.95 pesos? 2.-Se requiere fabricar una pintura de color azul, si una primera persona mezcla H 2O + CaCO3 + Pigmento → P int ura y se lleva un tiempo de 8 horas con 5 minutos. Una segunda persona realiza la misma actividad con un tiempo de 7 horas y 56 minutos y por ultimo, una tercera persona realiza la misma actividad, en tan solo 7 horas con 59 minutos. ¿Cual será el tiempo promedio para realizar la fabricación de dicha pintura? III.-Clasificar las siguientes ecuaciones químicas de acuerdo al tipo que corresponda; Síntesis, Sustitución Simple o Doble y Descomposición. Ecuación: Tipo: _______________ 1.- SO3 + H 2O → H 2 SO4 2.- CuO + H 2 → H 2O + Cu 3.- HNO3 + NaOH → H 2O + NaNO3 _______________ _______________ _______________ 4.- H 2CO3 → H 2O + CO2 IV.-Analizar los siguientes casos y escribir si se lleva acabo una reacción química o no. 1.- Hornear un pastel _______________ 2.- Carne cruda en la alacena _______________ 3.- Correr _______________ 4.- Preparar una ensalada _______________ 5.- Una lata de frijoles _______________ 6.- Encender un cerillo _______________ Página 38 Página de IV.- Cuando ingerimos los alimentos (comer) se lleva a cabo una reacción química dentro nuestro cuerpo, sin que nos demos cuenta. Observa la siguiente figura, en ella se ilustra el aparato digestivo, donde ocurre la reacción química. Investigar: Que función desempeña cada uno de los siguientes órganos: 1.‐ Hígado 3.- Estómago: 2.- Vesícula Biliar: 4.-Intestino Grueso: 5.-Intestino Delgado: Página 39 Página de Nombre Competencia a Desarrollar Reacción entre el Sodio y el agua No. 1 El alumno identificará y comprobará de manera experimental un tipo de reaccion química inorgánica. 9 Logrará visualizar los cambios químicos de manera física y adecuarlos al contexto. 9 Podrá identificar de manera reflexiva que las reacciones químicas están en todos los procesos químicos, biológicos. Instrucciones Estará muy atento a las recomendaciones del maestro para llevar a cabo la para el práctica, haciendo uso del material, reactivos y equipos de manera Alumno adecuada. Instrucciones Indicar la forma de hacerlo, proporcionar el material o indicar como para el adquirirlo y asistir a los alumnos. Docente * 1vaso de precipitado de 100 ml Recursos * 1 vidrio de Reloj materiales de * 1 Espátula apoyo * Agua destilada * Un pedacito de sodio (tamaño de una lenteja) Manera Actitudes a Didáctica Realizar la práctica en el tiempo indicado Orden y realizarla con el orden mostrado. formar Responsabilidad de Lograrlas • Aprende por iniciativa e interés propio a lo largo de la vida. Competencia • Participa y colabora de manera efectiva en equipos diversos s Genéricas a • Desarrolla innovaciones y propone soluciones a partir de métodos Desarrollar establecidos. Manera La actividad practica requiere que se haga equipos de trabajo por lo que se Didáctica de deben tener conocimientos de cómo hacerlo, de no ser así se debe Lograrlas investigar mostrando iniciativa e interés de manera colaborativa. Habilidades Página 40 Página de DESARROLLO Objetivo: Realizar un tipo de reacción química de tipo exotérmica, es decir que desprende calor de manera práctica y sencilla, demostrando que el sodio es un elemento metálico explosivo. ¿Que necesitas? Material * 1 vaso de precipitado de 100 ml *1 vidrio de Reloj *1 Espátula Sustancia *50 ml de H 2 O destilada *Un pedacito de sodio (tamaño de una lenteja) Procedimiento: 1.- Se colocan los 50 ml de agua destilada en el vaso de precipitado 2.- Se deposita lentamente el pedacito de sodio (Na) en el agua destilada contenida en el vaso de precipitado. 11 Sodio 22.999 1 Sodio, de símbolo Na, es un elemento metálico blanco plateado, extremadamente blando y muy reactivo. El sodio se presenta en la naturaleza en estado combinado, por ejemplo en el agua de mar y en los lagos salinos como cloruro de sodio, NaCl. El sodio comercial se prepara descomponiendo electrolíticamente cloruro de sodio fundido. El sodio ocupa el séptimo lugar en abundancia entre los elementos de la corteza terrestre. Es un componente esencial del tejido vegetal y animal. ¿Qué veras? El pedacito de sodio permanece en la superficie del agua en forma de una esfera brillante. Esta esferita se desplaza con rapidez por la superficie del agua, con trayectoria errática, chispotenado y disminuyendo su tamaño hasta que se consume el sodio. De manera sencilla se realiza la reacción química entre estas dos sustancias quedando de la siguiente forma. Na + H 2 O → NaOH + H 2 Sabias que: Esta reacción corresponde al tipo: _____________ La respiración y la fermentación son dos reacciones químicas que realizamos los seres vivos para obtener la energía. La respiración la llevan a cabo los animales, y las plantas Página 41 Página de 3 BALANCEO DE ECUACIONES 3 1.- El balanceo de ecuaciones químicas 1.- Método por tanteo 3.- Método redox 1.- Aplicando la ley de la conservación de la materia. 1.- Vayamos a la práctica Página 42 Página de Con esta competencia se busca que analices y apliques la ley de la conservación de la materia en el balanceo de las ecuaciones químicas. Así que pon especial atención y no te quedes con ninguna duda, puedes acudir a tu maestro, a cualquier libro de química y porque no al uso de las tecnologías (Internet) En este apartado te apoyaremos principalmente con una serie de ejemplos y ejercicios diseñados para que aprendas de una manera fácil. Es para nosotros de suma importancia que logres el aprendizaje significativo, acerca del balanceo de ecuaciones químicas por los dos métodos más utilizados; método por tanteo y redox. ATRIBUTOS DE LA COMPETENCIA RESULTADO DE APRENDIZAJE 9 Manejar conceptos fundamentales sobre reacciones químicas 9 Representar las reacciones químicas de acuerdo a la simbología requerida por las ecuaciones químicas. Comprende las reacciones que ocurren a nuestro alrededor aplicando ecuaciones químicas. El docente llevará a cabo actividades grupales de auto diagnostico a fin de conocer el conocimiento que tienen los alumnos referente al tema. Además enriquecerá la información y se harán mesas de trabajo para llevar a cabo el análisis de la información. Los ejemplos expuestos de balanceo de las ecuaciones por los métodos de tanteo y redox son prácticos y fáciles de manejar. H 2 + O2 → H 2O Es la oportunidad para el docente de mencionar algunas aplicaciones, apoyándose de materiales de multimedia o con demostraciones prácticas relacionadas con el balanceo de ecuaciones de algunas reacciones químicas más importantes, tales como la reacción de combustión. Página 43 Página de Nombre El balanceo de ecuaciones químicas No. Instrucciones Revisa los conceptos básicos que se muestran en este apartado para el Alumno Manera Tipos de Saberes a Didáctica Analizando la información Ecuaciones preguntando cualquier duda adquirir de Químicas Lograrlos 1 y Una manera de aplicar la ley de la conservación de la materia, que establece que; la materia no se crea ni se destruye únicamente se trasforma, es por medio del balanceo de ecuaciones químicas en donde el numero de átomos de las sustancias que participan como reactivos, deben ser los mismos en las sustancias que resultan como producto. A continuación te presento una ecuación balanceada. CH 4 ( g ) + 2O2 ( g ) → CO2 ( g ) + 2 H 2O Átomos en Reactivo 1 C Átomos en Producto 1 4 O 4 4 H 4 Elemento El número de átomos de los elementos participantes es el mismo a ambos lados de la reacción, se dice que se trata de una ecuación química balanceada. Las ecuaciones químicas sin balancear no representan en forma precisa la reacción que se produce, cuando trabajemos con ecuaciones de reacción debemos de cuestionarnos si estas se encuentra balanceada. El principio fundamental del balanceo es que los átomos se conservan en la reacción química; es decir los átomos de los elementos participantes en la reacción no se crean ni se destruyen, solo se agrupan de una manera diferente. Al balancear ecuaciones químicas, es de suma importancia entender la diferencia entre Un coeficiente antepuesto a la fórmula y el subíndice de la fórmula, se puede observar que la modificación del subíndice en una fórmula cambia la identidad de la sustancia; Nunca se debe de modificar los subíndices al estar balanceando una ecuación; por el contrario si ponemos un coeficiente en la fórmula, lo único que estamos cambiando es la cantidad y no la identidad de la fórmula; 2H2O significa dos moléculas de agua; 3H2O significa tres moléculas de agua, etc. Página 44 Página de Método por tanteo y Método redox Nombre No. 1 Instrucciones Revisa los saberes sobre este tema y analiza los ejemplos que se dan en para el este apartado. Alumno Analiza los ejemplos de los diferentes Manera Actitudes a Didáctica tipos de ecuaciones químicas que se dan Orden formar en este apartado, es necesario que de Lograrlas preguntes en caso de que tengas dudas. Competencia Contribuye al alcance de un equilibrio entre los intereses de corto y largo s Genéricas a plazo con relación al medio ambiente. Desarrollar Manera Didáctica de Lograrlas Que analice la información, para que al final pueda identificar cualquier tipo de reacción química a la que pertenece. Método por tanteo El balanceo por el método de tanteo consiste en hacer diferentes ajustes por prueba y error, a los coeficientes de las formulas químicas de las sustancias que participan en la reacción. A continuación se indican los pasos a seguir para el balanceo. 1.- Escribe las formulas y símbolos correctamente de las sustancias que participan en la reacción. Lado izquierdo O reactivos Lado derecho O productos H 2 + O2 → H 2O 2.-Proceder a contar y comparar los diferentes tipos de átomos del lado izquierdo y del lado derecho de la ecuación. Reactivos Elementos Productos 2 átomos H 2 átomos 2 átomos O 1 átomo 3.-A continuación haz diferentes ajustes de coeficientes, a prueba y error, hasta que encuentres los números que permitan la igualdad, a ambos lados de la ecuación, para los diferentes topos de átomos que participan en la reacción. 2H 2 + O 2 → 2H 2 O Página 45 Página de Contando nuevamente los diferentes átomos. Reactivos Elementos Productos 4 átomos H 4 átomos 2 átomos O 2 átomo Se dice que la ecuación ya está balanceada Método Redox La oxidación y la reducción siempre ocurren simultáneamente. En una reacción, en la cual hay cambios en los números de oxidación de los elementos que forman las sustancias participantes, el número de electrones ganados por uno de los átomos o iones es igual al número de electrones perdidos por otro átomo. El método para balancear ecuaciones por el método del número de oxidación consiste en igualar el número de electrones ganados por un átomo con el número de electrones perdidos por otro átomo. Para balancear ecuaciones por este método es necesario el estudio del número de oxidación. El estado o número de oxidación de un elemento es la carga con la que actúa en determinado compuesto o formula. La valencia es el poder de combinación de un átomo y su denominación proviene del latín poder. Los elementos del grupo 1A tienen número de oxidación de +1,a los del grupo IIA les corresponde el número de oxidación de +2, y al grupo IIIA, es de +3. El número de oxidación de un elemento se conoce usando las siguientes reglas básicas. 1.- El numero de oxidación de un elemento en estado puro o sin combinar en una ecuación química es cero. H 2 SO4 → H2 + Al 0 + Al 2 (SO4 )3 2.-El numero de oxidación del hidrogeno es +1 y en los compuestos llamados hidruros será de -1. 3.-El numero de oxidación del oxigeno es -2, y en los peróxidos es -1. 4.-Como las moléculas son neutras, la suma algebraica de los números de oxidación de los elementos de un compuesto es igual a cero. H 2+1 S +6 O4−2 = 2+6-8=0 5.-Los números de oxidación de los metales son positivos en todos sus compuestos. Ca 2 + , Mg 2+ , Ba 2+ Ejemplo: Balancear la ecuación de la reacción de acido nítrico concentrado sobre el estaño. 1.-se escribe la ecuación asignando los números de oxidación de cada uno de los elementos. Sn 0 + H +1 N +5 O 3− 2 → Sn +4 O 2− 2 + N +4 O 2− 2 + H +1 2 O −2 2.-El estaño pierde 4 electrones y el nitrógeno gana un electrón. -4 e a) Sn 0 Sn +4 cada átomo de Sn pierde 4 electrones +5 +1e b) N N +4 cada átomo de N gana 1 electrón 3.-Para igualar el numero de electrones que se pierden y ganan se multiplica la ecuación b) por 4 -4 ea) Sn 0 Sn +4 4 N +4 b) 4 N +5 +4e- Página 46 Página de 4.- Los coeficientes encontrados se escriben en la ecuación principal: → SnO2 Sn + 4 HN 3 + 4 NO2 + 2 H 2O 5.- La ecuación queda balanceada para el estaño y para el nitrógeno. Se completa el balanceo de los demás elementos por tanteo. Sn → SnO2 + + 4 HNO3 4 NO2 + 2 H 2O Reactivos Elementos Productos 1 átomos Sn 1átomos 4 átomos H 4 átomo 4 átomo N 4 átomo 12 átomo O 12 átomo Se dice que la ecuación está balanceada Página 47 Página de Nombre Aplicando la ley de la conservación de la materia. No . 1 Instruccione Concéntrate y aplica todo los conocimientos adquiridos, logrando dar s para el resultados favorables a la actividad de enseñanza –aprendizaje. Alumno Utilizando esta guía y otras fuentes de Manera Actitudes a Didáctica información y obtendrás las habilidades Responsabilidad formar de requeridas para el estudio de las Lograrlas ecuaciones químicas. Competenci as Aprende por iniciativa e interés propio a lo largo de la vida. Genéricas a Desarrollar Manera El alumno investiga acerca de los diferentes tipos de ecuaciones químicas Didáctica de y emplea los conocimientos adquiridos para distinguirlas. Lograrlas I.-Balancear las siguientes ecuaciones químicas por el método de tanteo. HCl → MgCl2 H 2O a) Mg (OH )2 + + CO2 + H 2O HCl → CaCl 3 + H 2O → H2 c) Mg + + Mg (OH )2 d) CaCO 3 + HCl → CaCl2 + CO2 + H 2O → H2 + Fe + e) H 2 CO3 Fe2 (CO3 )3 BaCl2 → BaSO4 + + NaCl f) Na 2 SO4 H 2 SO4 → H 2O + K 2 SO4 + g) KOH O2 → CO2 + H 2O h) CH 3 OH + H 2 SO4 → H2 + i) Al + Al 2 (SO4 )3 j) Mg (OH )2 + HCl → MgCl2 + H 2O CO2 k) C 6 H 12 O6 → CH 3CH 2 OH + II.-Balancear las siguientes ecuaciones por el método Redox. H 2O → O2 + H2 1.2.→ O2 + KCl KClO3 O2 + 3.HgO → Hg H 2 O2 → O2 H 2O + 4.III.-Determina los subíndice “x”, “y” en la siguiente ecuación química. b) CaCO 3 + + 5.- C x H y + 6O2 → 4CO2 + 4H 2O Página 48 Página de IV.-Contestar las siguientes preguntas de acuerdo a lo expuesto en este apartado 6.- ¿Qué ley se cumple al balancear una reacción? __________________________________________________________________________ __________________________________________________________________________ 7.- ¿Que son los reactivos de una ecuación química? __________________________________________________________________________ __________________________________________________________________________ 8.-Define que es una reacción balanceada. __________________________________________________________________________ __________________________________________________________________________ 9.- Escribir la ecuación química del siguiente enunciado. El potasio sólido reacciona con agua liquida para formar hidrogeno gas e hidróxido de potasio. + + Página 49 Página de Nombre Competencia a Desarrollar Vayamos a la practica No. 1 El alumno identificará y comprobará de manera experimental un tipo de reacción química inorgánica. 9 Logrará visualizar los cambios químicos de manera física y adecuarlos al contexto. 9 Podrá identificar de manera reflexiva que las reacciones químicas están en todos los procesos químicos, biológicos. Instrucciones Estará muy atento a las recomendaciones del maestro para llevar a cabo la práctica, haciendo uso del material, reactivos y equipos de manera para el Alumno adecuada. Instrucciones Indicar la forma de hacerlo, proporcionar el material o indicar como para el adquirirlo y asistir a los alumnos. Docente *Tres cajas petri Recursos *Varillas materiales de *Reactivos: permanganato de potasio, sulfato de Hierro (II), dicromato de apoyo potasio, etanol, acido sulfúrico * Papel de cocina y paños. Manera Orden Actitudes a Didáctica Realizar la práctica en el tiempo indicado formar Responsabilidad de y realizarla con el orden mostrado. Lograrlas • Aprende por iniciativa e interés propio a lo largo de la vida. Competencia • Participa y colabora de manera efectiva en equipos diversos s Genéricas a • Desarrolla innovaciones y propone soluciones a partir de métodos Desarrollar establecidos. Manera La actividad practica requiere que se haga equipos de trabajo por lo que se Didáctica de deben tener conocimientos de cómo hacerlo, de no ser así se debe Lograrlas investigar mostrando iniciativa e interés de manera colaborativa. Habilidades Página 50 Página de Objetivo: Que el alumno siga instrucciones y procedimientos de manera reflexiva, comprendiendo cada uno de sus pasos y contribuya al alcance de los objetivos hipótesis, diseñe y aplique modelos para probar su validez. DESARROLLO REACCION 1 Se dispone una caja Petri, con unas gotas de permanganato de potasio 0,01 M en una determinada zona, se le agregan unas gotas de ácido sulfúrico 6 N y, con una pequeña varilla, se mezclan bien. Después se le agrega en la otra zona una disolución de sulfato de hierro II. Con la varilla se va produciendo la comunicación entre los reactivos, observándose los cambios de color que toman los productos de reacción, interpretando por el color que toman los resultados que se dan. La disolución de permanganato de potasio morada se decolora en medio ácido, al reducirse a sal de manganeso II. La reacción es la siguiente. KMnO 4 + H 2 SO4 + FeSO4 → MnSO 4 + H 2 O + H 2 O + K 2 SO4 + Fe 2 (SO4 )3 Color Morado Amarillo pálido REACCION 2 Con el dicromato de potasio (naranja), los cambios de color no son tan notables, por eso conviene dejar siempre una caja testigo para poder comparar los colores. Con el etanol (90%) hay que echar bastante cantidad de éste para que la reacción se produzca fácilmente, tardando algunos minutos K 2 Cr2 O7 + H 2 SO 4 + CH 3 CH 2 OH → Cr2 (SO 4 )3 + K 2 SO 4 + H 2 O + CH 3 CHO Color Naranja Azul verdoso Esta reacción es la base de la que se emplea cuando la policía exige que se sople por el tubo en el reconocimiento de alcohol en el aliento. Sugerencias Realizar las experiencias en medio básico; para ello, sustituir el ácido sulfúrico por hidróxido de sodio 6 N. También es posible estudiar cómo se comportan otros reactivos como el oxalato de sodio y el yoduro de potasio. RESULTADOS: Observaciones: ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ __________________________________________________________________________ Página 51 Página de Análisis (Balancear las ecuaciones químicas) Reacción 1 KMnO 4 + H 2 SO4 + FeSO4 → MnSO 4 + H 2 O + H 2 O + K 2 SO4 + Fe 2 (SO4 )3 ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Reacción 2 K 2 Cr2 O7 + H 2 SO 4 + CH 3 CH 2 OH → Cr2 (SO 4 )3 + K 2 SO 4 + H 2 O + CH 3 CHO ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ __________________________________________________________________________ Conclusiones ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ ___________________________________________________________________________ Página 52 Página de Reconocerá los tipos de soluciones que participan en una reacción química. 4 Hoy empezaremos a revisar algo interesante que en nuestra vida diaria hacemos sin percatarnos que en realidad tienen un significado químico. Te darás cuenta que todos los días tienes contacto con mezclas llamadas soluciones y juegan un papel importante. Las soluciones están en nuestra vida diaria como el caso de disolver agua y azúcar ya es una solución, y esto hace importante que se forman sistemas ópticamente homogéneos es decir que ni con el microscopio se puede observar quienes participan en esa mezcla; en esto se diferencian las soluciones de las mezclas ordinarias. Cuando utilizamos distintas soluciones en la vida cotidiana, la industria, la agricultura o la medicina, nuestro interés está centrado en las sustancias disueltas llamada soluto y disolvente. Las propiedades observadas en las disoluciones hacen pensar que estos sistemas son muy importantes en nuestra vida diaria y en todos los cambios y reacciones químicas. Definitivamente solo la disolución de unas sustancias en otras, ya sea en forma líquida, gaseosa, la mayoría de las veces y en forma solida unas cuantas, hacen posible reacciones químicas. No existe otro mecanismo más eficaz para poner en contacto una molécula y otra, o un átomo y otro, reactivos que son la base para producir sustancias de gran importancia para la humanidad. Para esta competencia el docente realizara una dinámica grupal de auto diagnostico a fin de conocer el conocimiento que tienen los alumnos referente al tema para que sea factible continuar con las actividades asignadas. El docente enriquecerá la información de manera auto dirigida y se harán mesas de trabajo para llevar a cabo análisis de la introducción. Página 53 Página de Nombre Soluciones y concentraciones No. Instrucciones El alumno a través de la información teoría presentada conocerá los diferentes tipos de soluciones que existen en la naturaleza química así para el como que elementos participan en ellas. Alumno Saberes a adquirir Definición de solución Definición de soluto. Definición de disolvente Definición de concentración. Solución diluida Solución concentrada Solución saturada Solución sobresaturada. Manera Didáctica de Lograrlos Participación activa cuando surjan las respuestas y dudas.. Análisis de los conceptos tratados. Cuando se agrega azúcar al agua y se le agita un momento, los cristales parecen desaparecer, no obstante su sabor permanece ahí, logrando formar una mezcla cuyos componentes no pueden distinguirse ni siquiera con un microscopio y esto se llama disolución. Una disolución puede contener uno o más solutos, cuyas moléculas o iones se dispersan uniformemente o se disuelven en el disolvente. En otras palabras la solución es la sustancia resultante de dicho cambio y la disolución se refiere al fenómeno de disolverse. La solución se compone de dos fases que se designan comúnmente como soluto y disolvente. Al componente que está en mayor proporción se le llama disolvente y al soluto al que está en menor proporción .no obstante se aplica ciertas reglas: 1. cuando uno de los componentes es líquido se le considera disolvente y el otro soluto. 2. si uno de los componentes es sólido y el otro es gaseoso, el sólido es el disolvente y el gaseoso el soluto. 3. en el caso de que ambos componentes sean sólidos, líquidos o gaseosos, el disolvente es el que interviene en mayor proporción. Las soluciones pueden ser: a) diluidas b) concentradas c) saturadas d) sobresaturadas. Página 54 Página de Tipo de Solución Definición DILUIDAS En este tipo de soluciones contiene pequeñas cantidades de soluto en relación con el solvente. CONCENTRADA Una solución concentrada es aquella que tiene mayor cantidad que la solución diluida pero muy inferior a la saturada. SATURADA Cuando una solución contiene la máxima cantidad de soluto disuelto se dice está saturada. SOBRESATURADA Se forma al calentar una solución saturada, agregándose más soluto se disolverá mientras esté caliente, pero al enfriarse volverá a solidificarse el soluto. CONCENTRACION: Siempre que escuchamos el termino concentración lo asociamos a algo abundante, cargado, masivo, es decir siempre hablamos del término como un máximo. Decimos el café está muy concentrado, el perfume viene muy concentrado pero que es en realidad químicamente: Es la relación existente entre el peso del soluto y el peso del disolvente es decir concentración es decir una cantidad determinada de soluto disuelta en una cantidad determinada de solvente. Las soluciones concentradas son todas aquellas donde hay una cantidad relativamente grande de soluto disuelto. Existen maneras cualitativas y cuantitativas para expresar la concentración De manera cualitativa no nos indica la cantidad de soluto en una solución por lo que son llamadas empíricas. Las soluciones valoradas son aquellas que si es posible cuantificar la concentración a partir de la cantidad de soluto y disolvente. En química usamos para expresar cuantitativamente la proporción entre el soluto y el Página 55 Página de disolvente en una disolución: distintas unidades como la molaridad, molalidad, normalidad, formalidad, porcentaje en peso, porcentaje en volumen, fracción molar, partes por millón. Pero esto lo veremos en capítulos más adelante. Página 56 Página de Nombre Solubilidad y factores que lo afectan Instrucciones para el Alumno Interpretara los conceptos mencionados a fin de conocer de qué manera la solubilidad depende de factores químicos que la afectan. Aplicara la temática en ejercicios propuestos en clase posteriormente. Saberes adquirir Concepto solubilidad a factores intervienen afectarla. y de los que para Manera Didáctica de Lograrlos No. Participación activa respuestas o dudas. cuando surjan 2 las La solubilidad de una sustancia se define como la máxima cantidad de la misma que se puede disolver en un volumen determinado de solvente a una temperatura dada. Algunos líquidos, como el agua y el alcohol, pueden disolverse entre ellos en cualquier proporción. En una solución de azúcar en agua, puede suceder que, si se le sigue añadiendo más azúcar, se llegue a un punto en el que ya no se disolverá más, pues la solución está saturada. La solubilidad de un compuesto en un solvente concreto y a una temperatura y presión dadas se define como la cantidad máxima de ese compuesto que puede ser disuelta en la solución. En la mayoría de las sustancias, la solubilidad aumenta al aumentar la temperatura del solvente. En el caso de sustancias como los gases o sales orgánicas de calcio, la solubilidad en un líquido aumenta a medida que disminuye la temperatura. En general, la mayor solubilidad se da en soluciones que moléculas tienen una estructura similar a las del solvente. La solubilidad de las sustancias varía, algunas de ellas son muy poco solubles o insolubles. La sal de cocina, el azúcar y el vinagre son muy solubles en agua, pero el bicarbonato de sodio casi no se disuelve. Las sustancias no se disuelven en igual medida en un mismo disolvente, con el fin de poder comparar la capacidad que tiene un disolvente para disolver un producto dado, se utiliza una magnitud que recibe el nombre de solubilidad. La capacidad de una determinada cantidad de liquido para disolver una sustancia solida no está ilimitada, añadiendo soluto a un volumen dado de disolvente se llega a un punto a partir del cual la disolución no admite mas soluto (un exceso de soluto se depositaria en el fondo del recipiente) Se dicen entonces que está saturada .Pues bien, la solubilidad de una sustancia respecto a un disolvente determinado es la concentración que corresponde al estado de saturación a una temperatura dada. Página 57 Página de Cuando dos sustancias liquidas pueden dar lugar a mezclas homogéneas disoluciones, se dice que son miscibles. Una parte homogénea de un sistema se llama fase, por ejemplo los perfumes que están constituidos por una disolución de agua y alcohol de ciertas es cencías aromáticas, sin embargo, no es posible determinar dónde está la parte de alcohol, donde del agua y donde de la escencia.la palabra miscible se usa para expresar que dos o más compuestos son solubles entre sí. Factores que afectan a la solubilidad: Temperatura: La solubilidad de los sólidos aumenta al elevarse la temperatura; la de los gases disminuye al aumentar la temperatura, los gases son más solubles en frio Presión: Los sólidos y líquidos son difíciles de comprimir.los gases, por el contrario, se comprimen fácilmente .la solubilidad de los gases aumenta cuando se eleva la presión. Naturaleza del soluto y disolvente: Interacciones soluto - disolvente • "Lo similar disuelve lo similar" • Las sustancias con fuerzas de atracción intermoleculares similares suelen ser mutuamente solubles. • Líquidos miscibles e inmiscibles. Agitación: Al agitar la solución se van separando las capas de disolución que se forman del soluto y nuevas moléculas del solvente continúan la disolución. Página 58 Página de Nombre Instrucciones para el Alumno Actitudes formar Identificar las diferentes soluciones que participan en reacciones químicas así como ubicar ejemplos en el contexto de su vida No. cotidiana. Realiza los ejercicios indicados, si tienes dudas repasa la sección de conocimientos y ejemplos o pide ayuda a un compañero o a tu profesor. a Orden responsabilidad Manera Didáctica de Lograrlas Ejercicio y tareas de investigación Competencias Aprende por iniciativa e interés propio a lo largo de la vida Genéricas a Participa y colabora de manera efectiva en equipos diversos. Desarrollar Manera Didáctica Lograrlas de Participación activa cuando surjan dudas sobre las respuestas Tareas sobre el tema. Ahora bien, veremos el ejemplo de la sal más agua. tenemos en este vaso agua en una cantidad de 50 ml y 5 gramos de sal de mesa. ¿Cual es es soluto?: la sal ¿y el solvente?: el agua. Análisis: hay pequeñas cantidades de soluto en relación al solvente. Tipo de solución: Diluida. Recuerda: Que las soluciones se aplican para la elaboración de medicamentos. Página 59 Página de El docente realizara una plenaria donde los alumnos desarrollen y ordenen la información aprendida. Los alumnos elaboraran una tabla comparativa, incluyendo diez ejemplos donde los asocie con la vida cotidiana. Nombre Reconoce y analiza las soluciones en aplicaciones de la vida No cotidiana Instrucciones para el Alumno Analiza los ejercicios detenidamente y contesta correctamente a las preguntas propuestas del tema. Actitudes formar Responsabilidad a 1 Manera Reconociendo el valor de cumplir en Didáctica de tiempo y forma el desarrollo del ejercicio Lograrlas Competencias Genéricas a Participa y colabora de manera efectiva en equipos diversos Desarrollar Manera Didáctica Lograrlas de El alumno muestra su interés y participa de manera entusiasta para desarrollar el trabajo asignado. I.-Complementa la siguiente tabla, indicando el tipo de; solución, disolvente, soluto y menciona ejemplos: Solución Gaseosa Liquida Liquida Disolvente gas Liquido Liquido Soluto Liquido gas Ejemplo O2 en H2O NaCl en H2O Página 60 Página de II.- De las siguientes figuras identifica las que se relacionan con solubilidad, concentración y soluciones: _ __________________ __________________ __________________ __________________ __________________ __________________ __________________ __________________ III.- Contesta de acuerdo a los conocimientos adquiridos en esta sesión: 1. Con tus palabras define el concepto de disolución: ___________________________________________________________________________ ___________________________________________________________________________ 2. En una disolución de dos líquidos ¿cual es el soluto?: ___________________________________________________________________________ ___________________________________________________________________________ 3. ¿Cuáles son los factores que afectan a la solubilidad de una sustancia? ___________________________________________________________________________ ___________________________________________________________________________ 5. Menciona 3 ejemplos de disoluciones diluidas: ___________________________________________________________________________ ___________________________________________________________________________ Sabias que El suero y bebidas energéticas que Página 61 Página de Ahora ya podemos decir que las soluciones que existen en la naturaleza son fundamentales para llevar a cabo reacciones químicas que podrán formar productos útiles para nuestra vida cotidiana. La solubilidad no es solo diluir una sustancia en otra, ya que para esto es necesario un proceso físico-químico que está sometido a diferentes factores que predominan como es el caso de la presión y temperatura. Concluyendo este tema es importante resaltar dos situaciones que me parecen importantes con respecto a la solubilidad: Si dos solutos son solubles en un mismo solvente, dependiendo de las cantidades (pequeñas) pueden disolverse ambos sin ninguna dificultad. Las disoluciones sobresaturadas son muy inestables es decir un cambio brusco de temperatura, un movimiento o adición del más mínimo grano del sólido, puede ocasionar que se rompa el equilibrio y el soluto en exceso cristalice, separándose de la mezcla. Página 62 Página de Relaciones estequiométricas 5 1.- Masa Atómica 2.- Molalidad 3.- Molaridad 4.- Normalidad 5.- Porcentual 1.- Haciendo cálculos para determinar; la Masa Molecular, el volumen, cantidad de soluto y el numero de moles en las soluciones. 1.- Como preparar una solución 1.- Vayamos a la práctica Página 63 Página de Seguramente has escuchado el reporte diario sobre la contaminación del aire en las grandes ciudades; partículas suspendidas e índice de ozono. ¿Realmente es posible cuantificar día a día los contaminantes en una mezcla tan grande como el aire de toda una ciudad?, por otro lado el uso del alcoholímetro se ha popularizado y con ello se han evitado un gran número de accidentes automovilístico, ¿cómo es posible determinar, mediante una muestra de aliento, la cantidad de alcohol que una persona ha ingerido? Por último un análisis de orina puede ser una prueba efectiva para saber si una persona ha consumido algún tipo de droga, todas estas interrogantes son resueltas aplicando los conocimientos del concentraciones. En ésta guía te apoyaremos principalmente con ejemplos diseñados para que aprendas de una manera práctica y sencilla a preparar soluciones a cualquier concentración, por lo que hemos incluido sólo la información que te ayude a lograrlo. Cuando acudas al laboratorio a realizar las practicas descritas en ésta guía, debes de trabajar en equipo, y además seguir las instrucciones que te indique el profesor de manera que evites causar algún daño a tus compañeros, material o equipo. ATRIBUTOS DE LA COMPETENCIA RESULTADO DE APRENDIZAJE 9 Manejar las formulas fundamentales sobre el cálculo de las concentraciones Comprende las aplicaciones de las soluciones que ocurren a nuestro alrededor aplicando expresiones matemáticas. El docente llevará a cabo actividades grupales de auto diagnostico a fin de conocer el conocimiento que adquirieron los alumnos en la sesión anterior. Además enriquecerá la información y se harán mesas de trabajo para llevar a cabo el análisis de la información. Los ejemplos expuestos de cálculo de concentraciones son prácticos y fáciles de entender, para que el alumno logre las competencias requeridas por este nivel académico. Página 64 Página de Nombre Masa Atómica. Molalidad , Molaridad , Normalidad y Porcentual No. 1 Instrucciones Revisar conceptos básicos y las formulas matemáticas que se muestran en para el este apartado Alumno Manera Tipos de la información y Saberes a Didáctica Analizando adquirir soluciones de preguntando cualquier duda Lograrlos Masa Atómica La masa atómica es la suma de las masas de la totalidad de las partículas elementales presentes en un átomo, protones, neutrones y electrones, dado el escaso valor de la masa de estos últimos en relación con el total, se puede considerar de forma aproximada que la masa atómica corresponde al número total de protones y neutrones presentes en el núcleo de dicho átomo. Un mismo elemento químico puede tener varios isótopos diferentes, cada uno de los cuales con una masa atómica distinta al variar el número de neutrones. Dentro de la notación química la masa atómica se representa con la letra A, y para definir un isótopo se indica con un superíndice situado a la izquierda del símbolo químico. A diferencia de lo que ocurre con el número atómico, aquí sí es necesario indicar el valor numérico de la masa atómica, ya que un mismo elemento químico puede tener varios isótopos de masas atómicas diferentes. Las masas atómicas de los elementos químicos tal como se presentan en la naturaleza son los valores medios dependientes de la proporción con la que se encuentran en ésta, que es una magnitud constante en nuestro planeta aunque puede variar en la materia procedente de otros lugares del Sistema Solar o del cosmos. Ejemplos característicos son: Hidrogeno y Carbono Página 65 Página de Cálculos estequiometricos La concentración de una disolución liquida, sólida o gaseosa, indica la cantidad de soluto que hay en cierta cantidad de disolvente. En la sección anterior se indicó que la sustancia que se encuentra en mayor cantidad en una disolución se llama disolvente, mientras que la sustancia en menor proporción se conoce como soluto. Al formar una disolución, decimos que el soluto está disuelto en el disolvente. Existen varias formas de expresar la concentración, aunque de una forma u otras todas representan lo mismo, por lo que puede hacerse cualquier conversión entre ellas. Molaridad Una de las principales formas de expresar la concentración de una disolución es la concentración molar, que indica el número de moles de soluto que hay en cada litro de disolución que se tenga, matemáticamente se expresa como: M = n V Para los químicos la molaridad es la expresión más importante, ya que al expresar la concentración de una disolución como molaridad se puede conocer la masa en gramos presentes de soluto y el número de partículas que hay en la disolución. Estas partículas pueden ser moléculas, átomos o iones. Pero para conocer la concentración molar se deben de conocerse el número de moles disueltos por litro de solución, ¿Cuál es la expresión utilizada? n= Gramos n= gr P.M Peso molecular 1mol= 6.02 x10 23 partículas Molalidad La molalidad (m) es el número de moles de soluto por kilogramo de disolvente. Para preparar disoluciones de una determinada molalidad, no se emplea un matraz aforado como en el caso de la molaridad, sino que se puede hacer en un vaso de precipitados y pesando con una balanza analítica, previo peso del vaso vacío para poderle restar el correspondiente valor. La expresión matemática utilizada es n M = Kg Moles de soluto M= Kg de disolvente Página 66 Página de Normalidad La concentración Normal o Normalidad, es el número de pesos equivalentes por litros de solución. Las expresiones matemáticas utilizadas para predecir su concentración de una solución en normalidad son: #Equivalentes de soluto Peso Molecular N= P.E.Q= Litros de Solución Valencia del primer elemento Concentración Porcentual La cantidad de soluto presente en una disolución puede expresarse como un valor porcentual de masa o de volumen y corresponde respectivamente, a los gramos de soluto presentes en los gramos de disolución o bien a los mililitros de soluto en los de disolución. Para cualquier cantidad de disolución que se vaya a preparar, se utiliza las siguientes expresiones matemáticas: Gramos de soluto % en masa= ml de soluto x100 Gramos de disolución % en volumen= x100 ml de disolución Página 67 Página de Nombre Haciendo cálculos para determinar; la Masa Molecular, el volumen, cantidad de soluto y el numero de moles en las soluciones. No. 1 Instrucciones Revisa los saberes sobre este tema y analiza los ejemplos que se dan en para el este apartado. Alumno Manera Analiza los ejemplos matemáticamente y Orden y Actitudes a Didáctica es necesario que preguntes en caso de formar responsabilidad de que tengas dudas. Lograrlas Competencia Se conoce y valora a sí mismo y aborda problemas y retos teniendo en s Genéricas a cuenta los objetivos que persigue. Desarrollar Manera Didáctica de Lograrlas Que analice la información, para que al final pueda ir al laboratorio a identificar y preparar disoluciones. Debido a que los átomos son demasiados pequeños y para contarlos uno por uno, nos llevaría enorme tiempo invertido. Los científicos utilizan una unidad mucho más práctica, llamadas unidad de masa atómica (uma). Para el cálculo de la masa atómica de una sustancia o molécula dada, esto se logra sumando las masas atómicas de todos los átomos que la forman y se expresa en unidades de masa atómica (uma). Página 68 Página de Ejemplos I.- Calculando la masa atómica 1.- Calcular la masa atómica del carbonato de calcio. CaCO3 Solución: a).- Al revisar la formula química del compuesto observamos de acuerdo con los subíndices (recuerda que el 1 no se escribe) se tiene: Elemento Numero de átomos Calcio 1 Carbono 1 Oxigeno 3 b).- Con ayuda de una tabla periódica obtenemos la masa atómica de cada elemento Elemento Masa atómica C 40.078 C 12.0107 O 15.9994 c).- Se multiplica el número de átomos por la masa atómica de cada elemento: Masa atómica por cada elemento Elemento Operación Resultado Calcio 1x40.078 40.078 Calcio 1x12.0107 12.0107 Oxigeno 3x15.9994 47.9982 100.087uma 100.087gr/mol Esto significa que un mol de CaCO3 pesa 100.087 g de CaCO3 Masa atómica II.- Calculando el volumen de una disolución 2.- Si la etiquetada una bebida indica una concentración de 15% en volumen de etanol en un volumen de 2000ml ¿Que volumen de alcohol se tiene? Solución: Datos % en volumen= 15% Ml de disolución=2000ml Ml de soluto= ? Página 69 Página de Formula %v = Despeje Sustitución ml.soluto ml.disolución ml.soluto = (%vol )(ml.disolución ) 100 ml.soluto= (15%)(2000ml) Resultado 300ml 100 III.- Calculando la cantidad de soluto en una disolución 3.- Si se tiene tres litros de una disolución al 2 molar de concentración de etanol ( C 2 H 6 O ) ¿cuál es la cantidad de soluto en gramos utilizados para esta disolución? Solución: Datos mol M =2 l v = 3L a.- Al revisar la formula química del compuesto observamos de acuerdo con los subíndices (recuerda que el 1 no se escribe) se tiene: Elemento Numero de átomos Carbono 2 Hidrogeno 6 Oxigeno 1 b.- Con ayuda de una tabla periódica obtenemos la masa atómica de cada elemento Elemento Masa atómica C 12 H 1 O 16 c.- Se multiplica el número de átomos por la masa atómica de cada elemento: Masa atómica por cada elemento Elemento Operación Resultado C 2x12 24 H 6x1 6 O 1x16 16 Masa Molar 46 gr mol Página 70 Página de d) Ahora se calcula calculan el numero de moles presentes en la disolución. Formula Despeje Sustitución Resultado M = n = (M )(V ) n V ⎛ mol ⎞ n = ⎜2 ⎟(3l ) ⎝ l ⎠ 6 moles e) A continuación se calculan los gramos contenidos en la disolución Formula Despeje Sustitución Resultado n = Nombre gr P .M gr = (n )(P.M ) gr ⎞ ⎛ gr = (6mol )⎜ 46 ⎟ ⎝ mol ⎠ 276 gr Como preparar una solución No . 1 Instruccione Concéntrate y aplica todo los conocimientos adquiridos, logrando dar s para el resultados favorables a la actividad de enseñanza –aprendizaje. Alumno Utilizando esta guía y otras fuentes de Manera Actitudes a Didáctica información y obtendrás las habilidades Responsabilidad formar de requeridas para el estudio y análisis de Lograrlas las cálculos estequiometricos. Competenci as Aprende por iniciativa e interés propio a lo largo de la vida. Genéricas a Desarrollar Manera El alumno revisa esta guía e investiga acerca de los cálculos necesarios Didáctica de para la resolución y preparación de cualquier disolución. Lograrlas I.- Contestar lo que se te indique en cada uno de los apartados 1) Obtener la masa atómica de los siguientes compuestos. C 2 H 5 OH Al2 (SO4 )3 Página 71 Página de II.-Aplicando los conocimientos adquiridos en este apartado, resolver los siguientes problemas 2.- Tienes medio litro de una disolución de glucosa 0.5 Molar. Calcular el número de moles, la masa del soluto y el número de moléculas presentes en la muestra. Considera que el peso molecular de la glucosa es de 180 gr/mol Datos Formula Despeje Sustitución Resultado Cuando la concentración se expresa en molaridad, se requiere un recipiente especial conocido como matraz aforado. Este recipiente está diseñado específicamente para preparar disoluciones con una molaridad determinada. El tamaño del matraz depende del volumen de disolución que se quiere preparar. Los hay con capacidad desde 1 ml hasta uno o dos litros. Para preparar las disoluciones, en un vidrio de reloj se pesa la cantidad en gramos del soluto, posteriormente se vacía en el matraz y se le agrega agua hasta la mitad del volumen. Se agita hasta que el sólido se disuelva por completo y finalmente se agrega agua hasta la línea de aforo, éste último paso se denomina aforar. 3.- Ahora que ya sabes cómo calcular la masa de soluto y cómo se hace una disolución. Preparar dos soluciones(A y B) con 250 ml cada una a una de concentración 0.1 y 3.1 Molar de cloruro de Sodio 0.1M y 250ml 0.1M y 250ml Cálculos Página 72 Página de Ahora, imagina que no identificaste con una etiqueta cada una de las disoluciones y, por error, las revuelves y ya no sabes cuál es cuál. Diseña algún procedimiento que te permita identificarlas. Nota: Nunca debes identificar ninguna sustancia probándola, así que piensa un poco más y lo lograrás. Análisis: _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ Página 73 Página de Nombre Competencia a Desarrollar Vayamos a la practica No. 1 El alumno realizará y conocerá de manera experimental la concentración Molar de una disolución Podrá identificar de manera reflexiva que las relaciones estequiometricas están en todos los procesos químicos y biológicos. Instrucciones Estará muy atento a las recomendaciones del maestro para llevar a cabo la para el práctica, haciendo uso del material, reactivos y equipos de manera Alumno adecuada. Instrucciones Indicar la forma de hacerlo, proporcionar el material o indicar como para el adquirirlo y asistir a los alumnos. Docente • 1 vaso 50 ml * 1 espátula * Agua destilada Recursos • 1 vaso 25 ml * 1 balanza * NaCl materiales de • 1 tubo de ensayo * 1 mechero apoyo • 1 pipeta * 1 Matraz volumétrico 25 ml Manera Orden Actitudes a Didáctica Realizar la práctica en el tiempo indicado formar Responsabilidad y realizarla con el suficiente orden de Lograrlas • Aprende por iniciativa e interés propio a lo largo de la vida. Competencia • Participa y colabora de manera efectiva en equipos diversos s Genéricas a • Desarrolla innovaciones y propone soluciones a partir de métodos Desarrollar establecidos. Manera La actividad practica requiere que se haga equipos de trabajo por lo que se Didáctica de deben tener conocimientos de cómo hacerlo, de no ser así se debe Lograrlas investigar mostrando iniciativa e interés de manera colaborativa. Habilidades Objetivo: Determinar y expresar la concentración de una disolución. En este experimento se determinara la concentración de una solución desconocida de NaCl expresada en la forma discutida anteriormente. Procedimiento: 1.- prepare la solución desconocida pesando la cantidad de soluto (NaCl) indicada por su profesor en un vaso de 25 ml limpio y seco. 2.- Disuelva el soluto con 15 ml de agua destilada y añada la solución cuantitativamente a un matraz volumétrico de 25 ml y complete con agua destilada hasta la marca de calibración. Esta será la solución desconocida a la cual se le determinará la concentración. Página 74 Página de 3.- Limpie y seque bien el tubo de ensayo y el vaso de 50 ml. 4.- Coloque el tubo de ensayo dentro del vaso de 50 ml y péselo. Anote la masa. 5.- Mida 2 ml de la solución desconocida y colóquelos en el tubo de ensayo. 6.-Coloque el tubo de ensayo con la solución dentro del vaso de 50 ml y péselo. Anote la masa. 7.- Caliente suavemente la solución en el tubo de ensayo hasta que todo el líquido se evapore 8.- Coloque el tubo de ensayo dentro del vaso de 50 ml, déjelo enfriar a temperatura ambiente y pese el sistema. Anote la masa. 9.- Llene la siguiente tabla con los valores de todas las mediciones Análisis Datos: Material a pesar Cantidad Soluto usado gr. de soluto pesado para preparar la solución desconocida Masa vaso + tubo de ensayo con la solución Masa vaso + tubo de ensayo con residuo Masa del vaso + tubo de ensayo vacio Volumen de la solución usada Masa de la solución usada(L) Masa de la solución Masa del residuo (solvente disuelto) Masa del disolvente (H2O) Masa molar del soluto Masa molar del H2O Moles del soluto Moles del disolvente Cálculos ¿Cuál será la concentración Molar de la disolución desconocida en base a los datos obtenidos? Conclusiones _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ Página 75 Página de Aprende a conocer las características escenciales de acidos y bases. 6 Hola como te sientes, esperando que para este tema que vamos a revisar estés muy bien, estos son mis deseos ya que quiero comentarte que en nuestra vida cotidiana, sobre todo, siempre hemos escuchado o dicho esto; está muy agrio, algunas golosinas, botanas, o el termino está muy amargo, déjame decirte que hablar de esto es muy importante para la química porque este conocimiento está centrado en dos conceptos fundamentales que son ACIDO Y BASE. Te comento, que estos parámetros de importancia química es esencial para lograr desarrollar productos de uso en la vida cotidiana. Por ejemplo por qué crees tú que es importante conocer que tan acida es tu orina, los médicos a través de un análisis valoran a sus pacientes. Todos los procesos químicos- biológicos se basan en estos 2 conceptos fundamentales. Las industrias, la agricultura, innovación de fármacos, alimentos necesitan trabajar siempre con estos términos acido-base. Veremos la trascendencia de ese conocimiento y te darás cuenta que todo lo que nos rodea involucra el saber que es un acido y una base, así como veremos cómo este conocimiento se fue dando poco a poco en la historia de la química. . Página 76 Página de Conocerá los antecedentes históricos del origen del concepto acido-base 9 Revisara los diferentes modelos acido –base de la historia química. 9 Entenderá que hablar de PH es hablar de un término fundamental para todo proceso químico. 9 Identificara las diferencias que existen entre un acido y una base así como sus aplicaciones en la vida cotidiana Conocer las aplicaciones de ácidos y bases en su contexto de la vida diaria así como el dominio de ejercicios y cálculos de PH propuestos. 9 ATRIBUTOS DE LA COMPETENCIA RESULTADO DE APRENDIZAJE El docente hará una breve introducción del tema así como una autoevaluación, posteriormente llevara a cabo una plenaria grupal a fin de interactuar y conocer que tanto conocimiento tienen del tema realizando un cuestionario. 1. ¿Sabes que es en realidad un acido? 2. ¿Conoces sustancias que tengan un sabor acido? 3. ¿Sabes que es y que sustancias se consideran bases? 4. ¿Qué importancia tiene saber que es un acido y una base en todo proceso químico? 5. ¿Tú crees que para elaborar alimentos, medicinas, vacunas es necesario saber que es acido y base y Porque? 6. ¿Crees que se podría elaborar cualquier producto sin conocer si es acido o base?. Página 77 Página de Nombre Instrucciones para el Alumno Saberes a adquirir ACIDOS Y BASES No. Revisa detenidamente la teoría y explicación de los temas a fin de realizar posteriormente ejercicios para poner en práctica lo aprendido, pide ayuda a tu profesor si tienes dudas más adelante. *Modelos acido-base *Modelo de Arrhenius *Modelo Bronstead-Lowry *Modelo de Lewis *Conceptos y ejercicios de pH y PoH. *Clasificación de ácidos y bases *Indicadores *Titulación *Neutralización Manera Didáctica de Lograrlos Analizar la temática de los conceptos a fin de lograr realizar actividades de aprendizaje elaborando ejercicios propuestos. Desde tiempos inmemorables, los hombres y las mujeres en diversas culturas reconocieron dos tipos de sustancias en propiedades opuestas: los ácidos y las bases. La mayoría de la frutas en especial las conocemos como cítricos (limones, naranjas), estos contieneen acido cítrico. El vinagre que se agrega a las ensaladas es una disolución acuosa de acido acético, la vitamina C es acido ascórbico, las aspirinas contiene acido acetilsalicilico. La palabra acido proviene del latín acidus que significa agrio y esta es una de sus características. Otra de sus características es: pican al contacto, producen efervescencia al contacto con metales, colorean de rojo el papel tornasol, sus disoluciones conducen la electricidad y además desprenden hidrogeno cuando reaccionan en disolución con Zinc u otros metales Página 78 Página de Por otro lado, la palabra base y álcali no son tan conocidas, aunque muchos de los productos de limpieza usuales en tu hogar son bases.los limpiadores con amonio o la sosa caustica empleada para destapar cañerías obstruidas y eliminar cochambre, de las estufas son ejemplos de bases o álcalis. La palabra álcali proviene del árabe al-qaliy cuyo significado es cenizas de planta y se aplico en un principio al carbonato de potasio, uno de los productos de la combustión de las plantas. Las principales características de las bases o álcalis son: sus disoluciones tienen sabor amargo, son resbalosos al contacto, cambian de color de varios extractos de origen vegetal y pierden todas estas características cuando reaccionan con los ácidos y además Colorean de azul el papel tornasol. Reaccionan con los ácidos para formar sal y agua. Existen varias teorías o modelos acerca de los ácidos y bases las cuales difieren ligeramente entre sí pero nos damos cuenta que tienen mucho que ver una con la otra. Svante Arrhenius químico sueco en 1884 a más de un siglo hoy en día sus estudios concluyen de manera simplificada que ciertas sustancias forman iones positivos y negativos que al ponerse al contacto con agua son capaces de conducir la corriente eléctrica, este proceso en el cual se forman iones durante la disolución de una sustancia en agua, se llama disociación. Su modelo acido base propone: 1. un acido es toda molécula que en agua es capaz de ionizarse cediendo un protón H + 2. una base es toda molécula que en agua es capaz de ionizarse cediendo un grupo hidroxilo OH − 3. El producto de la reacción entre un acido y una base es una sal y agua. 4. Este modelo es útil solo para aquellas moléculas que se disuelven en agua y en reacciones que se llevan a cabo en este medio. Página 79 Página de Johannes Niclaus Bronstead (1879-1947), químico danés, nacido en Varde. En 1908 recibió el título de doctor en Filosofía y un cargo de profesor de química en la Universidad de Copenhague. Sus trabajos más importantes fueron en el campo de la termodinámica. Thomas M. Lowry (1847-1936) fue un químico británico que, junto a Johannes Bronstead, anunció una teoría revolucionaria como resultado de los experimentos con ácidos y bases en solución, que desafiaba la definición clásica de ácidos y bases no relacionados al crear un nuevo concepto el de pares ácido-base conjugados. Las definiciones de Arrhenius de los ácidos y bases son muy útiles en el caso de las soluciones acuosas, pero ya para la década de 1920 los químicos estaban trabajando con disolventes distintos del agua. Se encontraron compuestos que actuaban como bases pero no había OH en sus fórmulas. Se necesitaba una nueva teoría y este caso Bronstead-lowry la presenta. Según la teoría de Bronsted-Lowry, un ácido es una sustancia donadora de protones y una base es una sustancia aceptora de protones (un protón es un átomo de H que ha perdido su electrón). Toma en cuenta el solvente, es decir, adiciona cada protón a una molécula de agua, obteniendo así un ión que denomina “hidronio”: H 3O + • La molécula de agua se comporta así como una base porque acepta un protón. Entonces el ión hidronio se comporta como un ácido porque dona un protón, y cualquier anión se comporta como una base cuando acepta ese protón. • Una de las principales limitaciones del modelo de ácidos y bases de Arrhenius es que solo explica las reacciones que suceden en el agua, desde hace muchos años sabemos que estas reacciones suceden en fase gaseosa, o en otros disolventes distintos que el agua. Por otro lado la teoría de Lewis define que un ácido , es una molécula o un ión que acepta un par solitario de electrones para formar un enlace covalente, y una base como una molécula o ión que puede donar un par solitario de electrones para formar un enlace covalente. Lewis propuso su teoría general sobre ácidos y bases: las sustancias que pueden ceder pares de electrones son bases de Lewis y las que pueden aceptar pares de electrones son ácidos. • Página 80 Página de Clasificación de ácidos y bases: Se clasifican los ácidos en función del número de átomos de hidrogeno presentes en su molécula por ejemplo se llaman: • Mono prótidos cuando tienen un solo átomo de hidrogeno: HCL. HI • Di prótidos: cuando tienen 2 H 2 ClO átomos de hidrogeno: , . SO4 4 • Más de tres: poliprotidos: H 3 PO4 De modo semejante las bases también se utilizan el prefijo mono, di, poli, pero haciendo mención del grupo funcional OH. No todos los ácidos y bases se disocian en igual proporción en agua .aquellos cuya disociación es mayor de 50%los llamamos ácidos o bases fuertes. INDICADORES Se puede medir de forma aproximada el pH de una disolución empleando indicadores, ácidos o bases débiles que presentan diferente color según el pH. Generalmente se emplea papel indicador, que se trata de papel impregnado de una mezcla de indicadores cualitativos para la determinación del pH. El papel de litmus o papel tornasol es el indicador mejor conocido. Otros indicadores usuales son la fenolftaleína y el naranja de metilo. TITULACION La palabra "titulación" viene del vocablo latino titalus, que significa inscripción o título. La palabra francesa titre, del mismo origen, significa rango o grado. Una titulación o valoración es, por definición, la determinación del grado o concentración de una disolución con respecto a agua con pH de 7. Página 81 Página de Concepto de PH (Potencial de Hidrogeno) Fue definido por primera vez por Soren Poer Lauritz Sorensen bioquímico danés en 1909. La palabra pH es la abreviatura de "pondus Hydrogenium". Esto significa literalmente el peso del hidrógeno. El pH es un indicador del número de iones de hidrógeno. Tomó forma cuando se descubrió que el agua estaba formada por protones ( H + ) e iones hidroxilo ( OH − ). Cálculos de PH. Ahora bien para poder medir la acidez o alcalinidad de sustancias será necesario ver una expresión matemática que expresa la medida de concentración molar de iones hidronio que hay en el agua a cierta temperatura. La escala de pH en agua a 25 grados centígrados adquiere valores entre o y 14. ⎛ 1 PH = Log ⎜⎜ + ⎝ H [ ] ⎞ ⎟⎟ = − Log H ⎠ ( + ) Cuando el valor de pH es menor a 7 es acido hay una concentración alta de iones H + . Cuando el valor de pH es igual a 7 la disolución es neutra, la concentración de iones H + e hidroxilo es igual. Cuando es mayor a 7 es básica es decir la concentraciones de H + es menor en relación a iones OH. Para calcular teóricamente el pH de una disolución acuosa es importante conocer si esta contiene sustancias acidas o básicas. Página 82 Página de Nombre Instrucciones para el Alumno Analiza la expresión matemática de PH (formula)e interpreta cada paso en los ejercicios que se presentan como ejemplos a fin de determinar correctamente ejercicios propuestos Orden Actitudes a Responsabilidad formar Competencias Genéricas a Desarrollar No. CALCULOS DE PH Y POH Manera Didáctica de Lograrlas Apóyate en la información del ejemplo presentado afín de que con apoyo de tu maestro puedas ejecutar correctamente ejercicios mas adelante. Aprende por interés e iniciativa propia. Expresa ideas y conceptos mediante representaciones lingüísticas, matemáticas o graficas. Vamos a calcular el pH de una disolución 0.01M de HN03 en agua. 1. Fijate que él HNO3 es un acido fuerte que al disolverse en agua se disocia totalmente produciéndose iones H + e iones NO3 , de tal forma que la concentración de los iones H + es igual a la concentración del acido. H + (ac ) + NO3−(ac ) HNO3(ac ) Así que utilizaremos la formula ⎛ 1 ⎞ ⎟ = − Log H + PH = Log ⎜⎜ + ⎟ ⎝ H ⎠ [ ] ( ) 2.- Como la concentración del acido nítrico es 0.01M la concentración de H + también es de 0.01M. Ahora sustituimos el valor de la concentración de iones H + en nuestra expresión de PH: ⎛ 1 ⎞ ⎟⎟ = 2 PH = Log ⎜⎜ ⎝ (0 . 01 ) ⎠ Página 83 Página de En las sustancias básicas el valor de pH se determina teóricamente de una manera algo distinta. Necesitamos calcular la concentración de iones OH − Ahora se obtiene el valor del logaritmo del inverso de la concentración de iones OH ⎛ 1 ⎞ ,a esta cantidad la llamaremos pOH Log ⎜ − ⎟ ⎝ OH ⎠ ⎛ 1 pOH = log ⎜⎜ ⎝ OH [ − ] − : ⎞ ⎟⎟ ⎠ Y el PH de la disolución será igual a pH = 14 − pOH Sabias que: • La coca cola tiene un valor de PH menor a 2. Página 84 Página de Calcula el PH Y POH Nombre Instrucciones para el Alumno Actitudes a formar No. 1 Calcula el PH de una disolución apoyándote en la expresión matemática. Responsabilidad Manera Didáctica de Lograrlas Utilizando esta guía y otras fuentes de información tendrás una mayor habilidad en el cálculo de ph en disoluciones. Aprende por iniciativa e interés propio a lo largo de la vida. Competencias Genéricas a Desarrollar Manera Didáctica de Lograrlas Expresa ideas ,conceptos, mediante expresiones lingüísticas ,matemáticas graficas .la practica requiere que se haga en forma individualmente, por lo que se deben tener conocimiento de cómo hacerlo, mostrando iniciativa e interés. Calcula por favor el pH de una disolución 0.02M de KOH en agua. El KOH es un compuesto solido que al disolverse en agua se disocia totalmente para producir iones k (+ac ) e iones OH − , con esto podemos calcular la concentración OH (−ac ) que deberá ser iguales a la concentración de KOH. KOH K (+ac ) + OH ( ac ) − ( ac ) Solución: Página 85 Página de Nombre Competencia a Desarrollar Atributos de la Competencia Reconocimiento de ácidos y bases. No. 1 Como reconocer los ácidos y las bases 9 Que los alumnos asuman una actitud constructiva, congruente con los conocimientos y habilidades con los que cuenta dentro del equipo de trabajo. 9 Conozca químicamente un acido y base 9 Implementación de métodos analíticos para su comprobación. Instrucciones para el Alumno Instrucciones para el Docente Recursos materiales de apoyo Actitudes a formar Competencias Genéricas a Desarrollar Manera Didáctica de Lograrlas Realizar el experimento a fin de explicar cómo es posible identificar a una sustancia básica y acida. El maestro guiara la práctica a fin de que se lleve a cabo de manera adecuada. Alcohol, plato hondo, flores de colores, como bugambilias, una cuchara, ocho vasos o botellas de vidrio trasparentes, vinagre incoloro,destapacaños. Orden Responsabilidad Manera Didáctica de Lograrlas Realizar la práctica en el tiempo indicado y realizarla con el orden mostrado. Aprende por iniciativa e interés propio a lo largo de la vida. La actividad practica requiere que se haga en forma colaborativa con los compañeros de grupo, por lo que se deben tener conocimientos de cómo hacerlo, de no ser así se debe investigar mostrando iniciativa e interés. Página 86 Página de Procedimiento: 1. separa dos tipos de flores. 2. corta las flores del mismo tipo en pedazos pequeños. 3. colócalas en el plato, agrega alcohol suficiente para cubrirlas y aplástalas con la cuchara hasta que el alcohol tenga el color de las flores. 4. agrega con cuidado el alcohol a uno de los vasos, asegúrate solo pasar la solución colorida y no los trozos de las flores. A esta solución le llamaremos indicador acido –base. 5. coloca en tres vasos cantidades iguales de vinagre, agua, y destapa caños. 6. en cada uno de los tres vasos agrega el indicador acido –base. Del indicador solo debes colocar aproximadamente una tercera parte de volumen de agua, vinagre o destapa caños que haya en el vaso. 7. observaras que el color del indicador en el vinagre (acido)es diferente al del indicador en el agua (neutra)y al del indicador en el destapacaño (básico). Repite los pasos 3, 4, 5, 6,7. Piensa y reflexiona: Qué color será la disolución resultante de mezclar el vinagre y destapacaños y el indicador acido base. Justifica tu análisis: Explica a detalle y realiza tus conclusiones. Página 87 Página de Analizar la química del carbono 7 1.-Hidrocarburos 2.- Isomeros. 3.- Derivados halogenados 1.- Qué fácil es química 1.- Aplicando Nomenclatura 1.- Propiedades de los compuestos con carbono Página 88 Página de Así como el hombre ha creado medicamentos, también ha creado compuestos muy tóxicos, como la llamada TCDD (2, 3, 7, 8 Tetraclorodibenceno-p-dioxinas), químico letal, contaminante, cancerigeno, y dañino para la piel, sistema inmune, neurológico, hepático, cardiovascular, óseo y reproductivo. ¿Que diferencia crees que haya entre un medicamento y un compuesto toxico. La Química del carbono también se conoce como química de la vida. Por otro lado, para lograr una mejor calidad de vida se ha desarrollado una nueva química: la química verde, creada para reducir o eliminar el uso y síntesis de compuestos peligrosos tanto para el ser humano como para el medio ambiente. ¿Por que crees que el carbono sea tan importante? ¿Te has preguntado que tienen en común las sustancias que integran a los alimentos, los plásticos, los árboles, las pinturas, los medicamentos, los detergentes, los combustibles y al cuerpo humano? Pues bien, el carbono es una pista para dar respuesta a estas y otras preguntas, debido a que puede formar más compuestos que cualquier otro elemento. En este apartado hablaremos mucho del carbono; por ello una vez mas te invito a que pongas especial atención, y ante cualquier comentario o inquietud puedes recurrir a tu maestro, a esta guía, a la biblioteca de tu escuela o a búsquedas por Internet de manera que no te quedes con tu inquietud para así lograr un buen proceso de enseñanza aprendizaje. ATRIBUTOS DE LA COMPETENCIA RESULTADO DE APRENDIZAJE 9 Manejar las estructuras, formulas y nomenclatura de la gran mayoría de compuestos que en su estructura contengan el elemento carbono. Comprender las reglas de nomenclatura y analizar el campo de aplicaciones de los compuestos orgánicos. El docente llevará a cabo actividades grupales, por ejemplo; lanzando preguntas al grupo tales como: ¿cual es el símbolo químico del carbono? ¿Con que otros elementos se pueden combinar? ¿Qué importancia tiene el carbono en nuestra vida? Con el único fin de conocer el conocimiento que adquirieron los alumnos en los cursos anteriores. Además enriquecerá la información y se harán mesas de trabajo para llevar a cabo el análisis de la información. Los ejemplos expuestos de hidrocarburos y sus derivados son apegados a la vida cotidiana para logar que el alumno visualice la enorme aplicación de los mismos. Página 89 Página de Nombre Hidrocarburos, Isomeros , Derivados halogenados y grupos funcionales No. 1 Instrucciones Revisar conceptos básicos y reglas establecidas por la IUPAC, que se para el muestran en este apartado. Alumno Manera Diferentes tipos de la información y Saberes a Didáctica Analizando adquirir hidrocarburos de preguntando cualquier duda Lograrlos Hidrocarburos Hidrocarburos, en química orgánica, familia de compuestos orgánicos que contienen carbono e hidrógeno. Son los compuestos orgánicos más simples y pueden ser considerados como las sustancias principales de las que se derivan todos los demás compuestos orgánicos. Los hidrocarburos se clasifican en dos grupos principales; de cadena abierta y cíclica. En los compuestos de cadena abierta que contienen más de un átomo de carbono, los átomos de carbono están unidos entre sí formando una cadena lineal que puede tener una o más ramificaciones. En los compuestos cíclicos, los átomos de carbono forman uno o más anillos cerrados. Los dos grupos principales se subdividen según su comportamiento químico en saturados e insaturados. Esquema de los diferentes tipos de Hidrocarburos HIDROCARBUROS Alifáticos Los carbonos se unen por ligaduras simples Aromáticos Alcanos simples Cicloalcanos dobles Alquenos triples Alquinos Página 90 Página de El petróleo es un recurso no renovable compuesto por hidrocarburos, Estos hidrocarburos son: parafinas (cadenas lineales de carbono), isoparafinas (cadenas ramificadas de carbonos), oleofinas (moléculas con enlaces dobles entre átomos de carbono), naftenos (moléculas de carbono en forma de ciclo), aromáticos (ciclos de carbono con enlaces dobles). Además existen hidrocarburos formados por diversos átomos, como nitrógeno, oxigeno y azufre. El calor y la presión en el interior del planeta convirtieron los restos de los seres vivos en petróleo a través de millones de años. Para su obtención, se buscan yacimientos y una vez localizados, se perforan, se extrae el petróleo y se lleva a las refinerías. En ellas, el petróleo se transforma en diferentes tipos de productos, como combustibles, aceites, ceras, solventes y diversas materias primas. En México se producen tres tipos de petróleo de diferente densidad, esto son: el Olmeca, l Istmo, el maya, y mezcla de los tres. El instituto Mexicano de Petróleo (IMP) es una institución dedicada específicamente a la investigación y aprovechamiento del petróleo. Para representar los compuestos orgánicos no basta una formula condensada o molecular, que sólo nos indica la composición de la molécula, sino que es necesario precisar el tipo de átomos que constituyen la molécula y los enlaces existentes entre ellos; esto se logra con las formulas estructurales. Formula condensada o molecular. CH 4 C2 H 6 Formulas estructurales Semidesarrollada Desarrollada CH 4 CH 3 − CH 3 H | H−C−H | H H H | | H−C−C−H | | H H Página 91 Página de Atendiendo a su estructura, los esqueletos que constituyen los compuestos orgánicos se pueden clasificar bajo los siguientes criterios. I.- Tipo de cadena formada por los átomos de carbono. II.- Tipo de enlaces existentes entre los átomos de carbono. III.- Estructura de la Cadena. Clasificación Ejemplos Lineales cadena continua CH3−CH2−CH3 Arborescentes con ramificaciones CH3−CH−CH3 | CH3 Clasificación Ejemplos Saturados, Enlaces sencillos entre C y C CH3 − CH3 No saturados, Doble o triples enlaces entre C y C. CH3 = CH − CH3 CH ≡ CH Alcanos Los alcanos son hidrocarburos saturados, es decir, presentan enlaces simples entre sus carbonos.Las cadenas de los hidrocarburos pueden ser lineales o ramificadas. Estos compuestos tiene la siguiente formula: Donde n el numero de carbonos Los alcanos tienen terminación ANO Cn H2n+2 Página 92 Página de En la siguiente tabla se muestran algunas propiedades mas importantes. Nombre Formula molecular (Cn H 2 n + 2 ) Formula estructural condensada Punto de Ebullición(ºC) Punto de Fusion(ºC) Densidad (gr/cm3) Metano CH 4 CH 4 -161 -183 Gas Butano C4 H10 CH 4 (CH 2 )3 CH 3 -0.5 -138 Gas Hexano C6 H14 CH 3 (CH 2 )5 CH 3 69 -95 0.659 El carbono es tetravalente, es decir, puede formar cuatro enlaces, es por eso que los carbonos de los extremos en una cadena pueden tener hasta tres hidrogenos enlazados y los carbonos centrales solo dos. Los alcanos se presentan en estao gaseoso, liquido o solido segun el tamaño de la cadena de carbonos. Hasta 4 o 5 carbonos sos gases (metano, etano, propano, butano y pentano), de seis a 12 son liquidos y de 12 y superiores se presentan como solidos aceitosos(parafinas). Los alcanos son incoloros y, en general, inodoros. Son practicamente insolubles en agua. . Las siguientes reglas de la IUPAC resumen los procedimientos que se siguen para nombrar a los alcanos. 1) Se identifica la cadena continua más larga de atomos de carbono como el compuesto principal, y se considera a los grupos alquilos unidos a esta como cadenas de sustituyentes, las cuales están reemplazando a un hidrogeno de la cadena princpal. 2) Se enumeran los carbonos en la cadena principal. Para esto, se empiez por el extremo de la cadena más proximo a un sustituyente. 3) Se nombra cada uno de los grupos sustituyentes y se designa su posición con un numero, de acuerdo con la cadena pricipal. 4) Si la cadena pricipal se repite el grupo alquilo, esta repetición se indica con un prefijo(di, tri, tetra) escrito antes de dicho grupo alquilo. 5) Cuando se tienen distintos grupos alquilo unidos a la cadena principal, se nombran en orden alfabético; los prefijos no se tomarán en cuenta para este fin. Página 93 Página de Prefijos y radicales para los alcanos mas utilizados Prefijo Met Et Prop But Pent Hex hept Oct Non Dec Numero de carbonos 1 2 3 4 5 6 7 8 9 10 Nombre Metil Radical CH 3 − Etil CH 3 − CH 2 − Propil CH 3 − CH 2 − CH 2 − Butil CH 3 − CH 2 − CH 2 − CH 2 − se utilizan para todos los hidrocarburos Ejemplo: 6 5 4 3 2 1 CH3− CH− CH2−CH−CH2−CH3 | | CH2 CH3 | CH3 3-etil-5-metilhexano : Alquenos y Alquinos A los alquenos y alquinos se les considera hidrocarburo insaturados, ya que no cuentan con el número máximo posible de hidrógeno, los cuales fueron sustituidos por los enlaces dobles o triples, según la molécula de que se trate. De acuerdo con la formula general, si se compara a los alcanos con los alquenos, éstos tienen dos hidrógenos menos que los primeros, y en relación con los alquinos, los alquenos tienen 4 hidrógenos menos; porque los alquinos tienen al menos un doble enlace entre carbono adyacentes, y los alquinos al menos un tripe enlace. Compuesto Alcano Tipo de Hidrocarburo Saturado Formula Cn H 2 n + 2 Tipo de enlace Sencillo ( --) Alqueno Insaturado Cn H 2 n Doble ( =) Alquino Insaturado Cn H 2 n − 2 Triple ( ≡ ) Página 94 Página de Los métodos para nombrar a los demás compuestos orgánicos son análogos al método para nombrar a los alcanos. En este caso seguiremos las siguientes reglas. 1) Se elige la cadena continua más larga de carbonos que contengan el doble o el triple enlace. 2) Al igual que los alcanos, esta cadena se nombra de acuerdo con el número de carbonos que contenga, y se cambia la terminación del alcano (-ano) por la terminación correspondiente al grupo que se tenga: alqueno (-eno) o alquinos (-ino). 3) Se numeran los carbonos en la cadena principal empezando por el extremo de la cadena más próximo al enlace doble o triple, según corresponda. El número correspondiente al enlace doble o triple se coloca al inicio del nombre del compuesto, lo que indica su posición. 4) Se continúa con los puntos 4 y 5 de la nomenclatura de los alcanos. Ejemplos: 6 5 4 3 2 1 CH3− CH− CH2−CH−CH2 = CH3 | | CH3 CH2 | CH3 3-etil-5-metil 1-hexeno 6 5 4 3 2 1 CH3− CH− CH2−CH ≡ CH2 −CH3 | CH2 5-metil 2-hexino Isomería La palabra isomería deriva de las raíces griegas isos, que significa “iguales”, y méros, que significa “partes”. Los isómeros, son compuestos que tienen la misma constitución o composición, pero difieren entre sí en la conectividad de sus átomos es decir de sus propiedades físicas. ¿Qué es lo que hace diferente tu mano derecha de tu mano izquierda? Diferencias hay muchísimas, pero una evidente es la posición de los dedos, y de ahí se derivan muchas otras, tal como sucede con los compuestos de carbono. La posición de los átomos unidos al carbono crea diferencias radicales en ciertas moléculas. Por ejemplo, un compuesto con la fórmula molecular C5 H12 puede corresponder a cualquiera de las siguientes formulas estructurales. CH3 | CH3 − CH2 − CH2 − CH2 − CH3 CH3 − CH − CH2 − CH3 CH3 − C − CH3 | | n-Pentano CH3 CH3 2-metilButano 2, 2 - DimetilPropano Página 95 Página de Derivados halogenados Los halogenuros de alquilo son una de las familias de compuestos empleados por excelencia como materia prima en los procesos químicos para generar nuevas sustancias. Estos compuestos resultan de la sustitución de uno o mas hidrógenos por elementos de la familia de los Halógenos (F, Cl, Br I). CH3 − CH − CH3 | Cl 2-cloro propano CH3 − CH − CH2−Br | CH3 1-Bromo-2-metilpropano Algunos de estos compuestos, como el triclorometano (cloroformo), ha sido aprovechados como anestésico. El tetraclorometano sirve para extinguir incendios o para el lavado en seco de ropa, el tetrafluoroetileno es la materia prima necesaria en la producción de un polímetro llamado politetrafluoroetileno, comúnmente conocido como teflón, este utilizado para hacer películas antiadherentes. El cloro etano se destina a la producción del cloruro de polivinilo, polímero mejor conocido por sus siglas en inglés como PVC, que sirve para fabricar mosaicos, tuberías, juguetes, vasos, recubrimientos y empaques, entre muchos otros productos. Su formula de estos compuestos es R-X, (X: F, Br, Cl, I) La nomenclatura de acuerdo con la IUPAC es la siguiente: por ejemplo, si se enlaza un etano a un bromo se le llama bromo etano, aun así muchos de estos compuestos conservan sus nombres comerciales, por los cuales son más conocidos. Uno de los tres merecedores mexicanos del premio Nóbel, obtuvo esta distinción por su trabajo sobre halogenuros de alquilo en la atmósfera. Página 96 Página de Grupos funcionales Un grupo funcional es un átomo o grupo de átomos con propiedades físicas y químicas muy similares. Que se unen a la cadena de las moléculas orgánicas. Estos grupos funcionales le confieren características específicas a las moléculas orgánicas, de tal forma que su reactividad química es, en cierta manera, predecible. Los hidrógenos de la molécula orgánica son reemplazados por el o los grupos funcionales; estos grupos pueden utilizarse como un parámetro para clasificar los diferentes tipos de compuestos orgánicos. A continuación la siguiente tabla muestra los grupos funcionales. Tipo Ejemplo Grupo Funcional Caracteristicas Alcohol CH 3 − CH 2 − OH − OH Grupo hidroxilo(-OH) Éter H 3C − O − CH 3 −O− Átomo de oxigeno unido a dos carbonos O Aldehido O || || − C − H H 3C H O Grupo carbonilo( carbono-oxigeno con doble enlace) unido a un hidrogeno O || || − C − Cetona Grupo carbonilo entre dos carbonos H 3C CH 3 O Acido carboxilico || R OH Amina Halogenuro de alquilo CH 3 − NH 3 CH 3Cl O || − C − O − H | −N − − F ,−Cl ,− Br ,− I Grupo carbonilo Atomo de nitrogeno unido a uno o mas atomos de carbono Halogeno unido a un carbono Página 97 Página de Nombre Qué fácil es química No. 1 Instrucciones Revisa los saberes sobre este tema y analiza los ejemplos que se dan en para el este apartado. Alumno Manera Practicando con la nomenclatura y es Actitudes a Orden y Didáctica necesario que preguntes en caso de que formar responsabilidad de tengas dudas. Lograrlas Competencia Se conoce y valora a sí mismo y aborda problemas y retos teniendo en s Genéricas a cuenta los objetivos que persigue. Desarrollar Manera Didáctica de Lograrlas Que analice la información, para que al final pueda asignarle el nomre a cada uno de los hidrocarburos I.-Nombrando a los alcanos de acuerdo a las reglas establecidas por la IUPAC a) 4-ETIL-2-METILHEPTANO La cadena continua más larga tiene 7 carbonos y se empieza con la numeración por el extremo derecho porque es el más cercano a un radical. Identificamos los radicales y el número del carbono al que están unidos, los acomodamos en orden alfabético y unido el último radical al nombre de la cadena. b) 5-ISOPROPIL-3- METILNONANO Página 98 Página de c) 3‐ETIL‐4‐METILHEXANO Al seleccionar la cadena de carbonos continua más larga observamos que a la misma distancia de cada extremo hay un radical, un metil y un etil, entonces iniciamos la numeración por el extremo más cercano al etil ya que es el radical de menor orden alfabético. II-Nombrando a los alquenos de acuerdo a las reglas establecidas por la IUPAC 1-Buteno 5-metil-2-hexano 2,3-Dimetil-2-penteno Página 99 Página de Nombre No . Aplicando la Nomenclatura 1 Instruccione Concéntrate y aplica todo los conocimientos adquiridos, logrando dar s para el resultados favorables a la actividad de enseñanza –aprendizaje. Alumno Utilizando esta guía y otras fuentes de Manera Actitudes a Didáctica información y obtendrás las habilidades Responsabilidad formar de requeridas para el estudio y análisis de Lograrlas las cálculos estequiometricos. Competenci as Aprende por iniciativa e interés propio a lo largo de la vida. Genéricas a Desarrollar Manera El alumno revisa esta guía e investiga acerca de los cálculos necesarios Didáctica de para la resolución y preparación de cualquier disolución. Lograrlas I.- Escribe en el paréntesis una V si la oración es verdadera o una F si es falsa. ( ( ( ( ( ) El carbono es el único elemento que puede formar largas cadenas con Átomos de él mismo. ) El petróleo es un compuesto que no contiene carbono ) Nuestro organismo se conforma con muchas moléculas que contienen carbono. ) Los mayores contaminantes del ambiente son los compuestos con Carbono. ) Lo que hace diferente al carbono de otros elementos es que éste puede unirse a otro carbono y formar largas cadenas con carbono II.-En parejas, calculen en su cuaderno, de acuerdo con la formula antes mencionada, los hidrógenos de los siguientes alcanos y escribir su formula desarrollada. a) C = 7 b) C = 5 c) C = 9 d) C = 4 Formula (a) Formula(c) Formula( b) Formula (d) Página 100 Página de III.- Cual es el nombre de los siguientes compuestos a) b) CH3 − CH2 − CH2 −C = CH − CH3 | CH3 CH3 − CH − CH2 −C ≡ C − CH − CH3 | | CH3 CH3 ________________________________________ ________________________________________ c) CH3 − CH − CH2 −CH − CH2 − CH3 | | Cl Cl ________________________________________ d) CH3 − CH − CH − CH2 − CH − CH2 −CH3 | | | CH3 CH3 CH3 ________________________________________ IV.- De acuerdo a la siguiente formula condensada, obtener todos los isomeros posibles y dar sus nombres. C9 H 20 Página 101 Página de Nombre Competencia a Desarrollar Propiedades de los compuestos con carbono No. 1 El alumno realizará y conocerá de manera experimental la concentración Molar de una disolución Podrá identificar de manera reflexiva que las relaciones estequiometricas están en todos los procesos químicos y biológicos. Instrucciones Estará muy atento a las recomendaciones del maestro para llevar a cabo la para el práctica, haciendo uso del material, reactivos y equipos de manera Alumno adecuada. Instrucciones Indicar la forma de hacerlo, proporcionar el material o indicar como para el adquirirlo y asistir a los alumnos. Docente *probeta *Vinagre blanco Recursos *6 vasos de precipitado * alcohol etílico materiales de *parrilla eléctrica * agua apoyo * termómetro con escala hasta 150ºC * aceite oleico Manera Orden Actitudes a Didáctica Realizar la práctica en el tiempo indicado formar Responsabilidad y realizarla con el suficiente orden de Lograrlas • Aprende por iniciativa e interés propio a lo largo de la vida. Competencia • Participa y colabora de manera efectiva en equipos diversos s Genéricas a • Desarrolla innovaciones y propone soluciones a partir de métodos Desarrollar establecidos. Manera La actividad practica requiere que se haga equipos de trabajo por lo que se Didáctica de deben tener conocimientos de cómo hacerlo, de no ser así se debe Lograrlas investigar mostrando iniciativa e interés de manera colaborativa. Habilidades Propósito: Que los alumnos sigan instrucciones y procedimientos de manera reflexiva, comprendiendo cada uno de sus pasos, y contribuyan al alcance de un objetivo; construyan hipótesis, diseñen y apliquen modelos para comprobar su validez, propongan la manera de solucionarlo un problema y desarrollen un proyecto en equipo, definiendo un curso de acción con pasos específicos y aporten puntos de vista con apertura y consideren los de otras personas de manera reflexiva. Página 102 Página de Conocimientos previos Menciona algunos grupos de los compuestos con carbono ___________________________________________________________________________ ___________________________________________________________________________ ¿Cuál es la formula para calcular el porcentaje en volumen? ¿Qué es el punto de ebullición? ___________________________________________________________________________ ___________________________________________________________________________ Escribe las formulas del acido acético (vinagre) y del etanol (alcohol etílico) y del acido oleico Acido acético Etanol Acido oleico Objetivo: Comparar algunas propiedades de los compuestos orgánicos con las de diferentes grupos funcionales y con las de compuestos con el mismo grupo funcional y diferente numero de carbonos. Procedimiento: 1 1.- Lean la etiqueta del envase del vinagre blanco y registren el porcentaje de acido acético que contiene 2.-Lean la etiqueta del envase de alcohol etílico y registren el porcentaje del etanol que contiene. 3.-Igualen los porcentajes de ambas disoluciones, calculando el porcentaje del volumen necesario para igualar el porcentaje del alcohol al vinagre. 4.-Coloquen 30 ml de vinagre blanco en un vaso de vidrio, caliéntelo en la parrilla eléctrica, midan el punto de ebullición con un termómetro y regístrelo en sus anotaciones. 5.-Coloquen 30 ml de alcohol etílico en un vaso de vidrio, caliéntelo en la parrilla eléctrica, midan el punto de ebullición con un termómetro y regístrelo en sus anotaciones. 6.- Comparen ambos resultados y comenten si existe alguna relación con los grupos funcionales que los conforman. Observaciones: _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ Página 103 Página de Datos y Resultados Procedimiento: 1 1.- Coloquen en un vaso de vidrio 100 ml de agua, agreguen 40 ml de vinagre blanco, agiten con la varilla de vidrio, esperen 4 minutos y observen 2.-Coloquen en otro vaso de vidrio 100 ml de agua, agreguen 40 ml de aceite oleico, agiten con la varilla de vidrio, esperen 4 minutos y observen. 3.- En otro vaso de vidrio coloquen 40 ml de vinagre y con ayuda del circuito eléctrico observen si es conductor o no. 4.- En el último vaso de vidrio coloquen 40 ml de aceite oleico y con ayuda del circuito eléctrico observen si es conductor o no. Observaciones: _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ Datos y Resultados Análisis Página 104 Página de Conclusiones: _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ _________________________________________________________________________ Tratamiento de residuos: Los desechos de alcohol, vinagre y agua viértalos en una botella con tapa y etiquétenla. En otra botella con tapa, vacíen el agua con el aceite oleico y etiquétenla. Entreguen las botellas a su profesor. Analizar, entreguen a su profesor los resultados de ambas actividades experimentales en un reporte detallado, con tus comentarios y conclusiones. La aplicación de los conceptos aprendidos son fundamentales para su entendimiento en todos los procesos químicos. En nuestro quehacer diario está envuelta la aplicación de formulas, simbología, reacciones químicas que forman parte de nuestra vida. Al estudiar los temas tratados descubrimos que el conocimiento científico, y en caso de la química, este conocimiento permite entender cada vez mucho mejor que los diversos procesos químicos, tiene una relación muy directa con nuestra vida actual. Entender la nomenclatura de compuestos en el curso pasado nos favoreció al entendimiento de las reacciones químicas y los diferentes métodos matemáticos para balancearlas. Las soluciones, sus propiedades y características nos permitieron conocer que no solo decir soluble indica una condición de mezclado, sino también de interacciones moleculares y los factores que las afectan. Los cálculos estequiometricos parte fundamental de este curso nos permitieron llevar a cabo una competencia donde aplicamos el uso de metodología matemática para el análisis de de problemas. Las reacciones acido-base sus métodos para lograr de manera experimental como son útiles en procesos biológicos-químicos hizo posible ubicar cada sustancia en el rango existente de PH. Lo más interesante es lograr haber aprendido como es un hidrocarburo, su nomenclatura, los grupos funcionales y que productos que nos rodean provienen del carbono formando una estructura tetraédrica fundamental. Esto despierta el interés de lograr estudiar, experimentar recursos alternativos energéticos de manera global con mucha demanda de ellos, viviendo tú y yo cada día en un mundo más globalizado. Página 105 Página de . 1.- Alcantar B. Ma. Del Consuelo Química de hoy Editorial Mc Graw Hill. 2.- Beristaín Bonilla Vladimir Química II. Editorial nueva imagen. 3.-Castañedo Ma .De los Ángeles Química General. Editorial Mc Graw Hill. 4.- Flores de Lombardi Teresita El Mundo tu y la Química 1 y 2. Editorial Esfinge. 5.- Maritza Quintanilla Bravo Química basado en competencias Progreso Editorial 6.- Gabriela Pérez Aguirre Química II Editorial Pearson 7.- Flores A. Héctor I. Fundamentos de química orgánica. Editorial Minerva Http://tutoriales.emagister.com Http://fisicanet.com.ar Http://www.uam.es Página 106 Página de