Transparencias
Anuncio

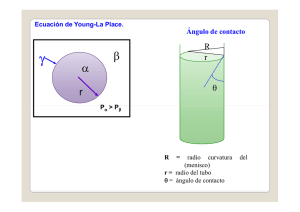
Fenómenos de superficie - Una diferencia fundamental entre gases y líquidos es la existencia de una superficie libre en éstos. - Gran variedad de fenómenos físicos están asociados a la existencia de esta superficie, y que se explican a partir de las propiedades contractiles de ésta. - Este estado de tensión de la superficie libre del líquido tiende a reducir el área de ésta a un valor mínimo compatible con los vínculos y con las fuerzas externas. - Las gotas de lluvia o las burbujas de aire en el interior de un líquido tiende a tomar la forma que ofrece una superficie mínima, esférica. Una aguja de coser (a pesar de que su densidad es mayor que la del agua) o un insecto pueden flotar en el agua - Cuando sumergimos parcialmente en agua un tubo de vidrio, limpio y de pequeño calibre, el agua asciende en su interior, pero si lo sumergimos en mercurio, el líquido desciende 1 Contacto entre varias fases • Cada porción homogénea de un sistema heterogéneo recibe el nombre de fase • La superficie de contacto o interfasial entre dos fases es la superficie de separación entre las fases del sistema. • Aquí nos interesan todas las superficies interfasiales excepto la sólido-sólido. • Cuando se encuentra a la vez tres fases, p. ej. , cuando se deposita una gota de mercurio sobre una lámina de cristal en el aire, existe una línea de contacto entre las tres fases, en nuestro ejemplo, la línea de contacto es el contorno común a las tres superficies interfasiales. Fuerzas intermoleculares. Cohesión • Las moléculas de los líquidos no oscilan respecto a posiciones fijas, como ocurre en los sólidos, sino que gozan de cierta libertad de movimiento. • Las distancias entre moléculas son lo suficientemente pequeñas como para que se ejerzan fuerzas atractivas de cohesión entre las moléculas. • Como resultado de tales fuerzas, el líquido ocupa un volumen determinado, aunque su forma sea la del recipiente que lo contiene. • En los gases, las fuerzas de cohesión son muy pequeñas porque las distancias intermoleculares son muy grandes, de modo que los gases tiende a ocupar todo el espacio del que dispongan. • La existencia de fuerzas de cohesión en los líquidos determina la existencia de una superficie libre y de los fenómenos asociados a ella. • Las fuerzas intermoleculares son de naturaleza electromagnética. Aunque las moléculas sean eléctricamente neutras, cuando dos moléculas se encuentran separadas una distancia suficientemente pequeña, sus distribuciones de carga se alternan, lo que da lugar a la aparición de una fuerza neta, atractiva o repulsiva, entre ambas. 2 •La intensidad de las fuerzas intermoleculares varía con la distancia. • La fuerza repulsiva intermolecular es la responsable de la impenetrabilidad de la materia (de que una molécula pueda atravesar a otra). • En cualquier caso las fuerzas intermoleculares son de corto alcance, como máximo algunos radios moleculares, • El efecto de las fuerzas de cohesión sólo es perceptible a una distancia r, que llamaremos radio de acción molecular, que es del orden de 10 A. Consideremos la molécula O1 en el interior del líquido, alejada de la superficie libre del mismo. Todas las moléculas contenidas dentro del radio de acción de O1, ejercerán fuerzas atractivas sobre ella, pero, como consecuencia de la homogeneidad del líquido, la distribución de fuerzas será isotrópica, y por tanto la resultante sobre O1 será nula. Las fuerzas de atracción intermoleculares ejercerán una presión a través de la esfera de acción molecular; cada capa esférica, al ser atraída por O1, comprimirá a las moléculas contenidas en capas más interiores, lo que da lugar a cierta presión interna dentro del líquido. La situación es diferente para una molécula como la O3, situada en la superficie del líquido. En estas condiciones, habrá más moléculas atrayendo a O3 hacia el interior del líquido que las que la atraen hacia fuera. O3 O1 3 - La distribución anisotrópica de las fuerzas de atracción intermoleculares sobre estas moléculas cercanas a la superficie libre del líquido origina la existencia de una fuerza neta sobre éstas, dirigidas hacia el interior del líquido, tanto más intensa cuanto más cercana se halle la molécula a la superficie. - Para llevar una molécula desde el interior del líquido hasta la superficie libre del mismo hay que realizar un trabajo contra la fuerza resultante que actúa cuando la molécula se acerca a la superficie. - Las moléculas de la superficie tienen mayor energía potencial que las situadas en el interior del mismo. La energía potencial de todas las moléculas que constituyen la superficie libre del líquido, debida a las fuerzas atractivas que sobre ellas ejercen las moléculas subyacentes es la energía superficial. - La energía potencial tiende a alcanzar un valor mínimo, que corresponde a la situación de equilibrio, i.e., cualquier cambio espontáneo tiende a disminuir esa energía. - Por tanto, la energía superficial tiende a tomar el valor más bajo, de modo que la superficie libre del líquido tiende a ser la menor posible, y esta disminución ocurrirá efectivamente, salvo que a ella se opongan otras fuerzas. La contracción tendrá lugar mediante el paso de las moléculas superficiales hacia el interior del líquido. El resultado es la aparición de una fuerza o tensión en la superficie libre del líquido que tiende a contraerla. Tensión superficial • • Sea un dispositivo formado por un alambre en forma de U, por el que desliza un segundo alambre de longitud l. El dispositivo se introduce en una disolución jabonosa, y al sacarlo, el deslizador (siempre que su peso F1 no sea demasiado grande) es rápidamente desplazado hacia la parte superior de la U. Para mantenerlo en equilibrio es necesario aplicar una segunda fuerza F2. La misma fuerza total F= F1+ F2 mantendrá el alambre en reposo, cualquiera que sea el área de la lámina líquida, siempre que ésta permanezca a temperatura cte. La película jabonosa está formada por un volumen de líquido limitado por dos capas superficiales, cuyo espesor es el de algunas moléculas. Cuando se tira hacia abajo de la varilla transversal, algunas moléculas del interior de la masa líquida, han pasado a las capas superficiales. Puesto que la película tiene dos caras, la longitud total donde actúa la fuerza superficial es 2l. La tensión superficial, γ, en la película se define como la razón de la fuerza superficial a la longitud (normal a la fuerza) a lo largo de la cual actúa. γ = F/2 l 4 • Un alambre circular de longitud l, es extraído de una masa líquida. • La fuerza adicional F necesaria para equilibrar las fuerzas superficiales, γl una a cada lado (anillo interno y externo), se mide por la tensión que aparece en un resorte o por la torsión de un hilo. • La tensión superficial es γ= Fuerza sup erficial F = longitud s obre la que actúa 2l Fuerza superficial que actúa a lo largo de cualquier línea en una superficie del fluido, por unidad de longitud sobre la que actúa La tensión superficial de un líquido en contacto con su propio vapor o con el aire sólo depende de la temperatura y de la naturaleza del líquido. Normalmente la tensión superficial disminuye al aumentar la temperatura (ya que disminuye la fuerza de cohesión). La unidad de tensión superficial en el SI es el N/m, aunque se usa la del sistema cgs, dina/cm. Ejercicio: Comprobar que 1 N/m =1000 dinas/cm. Contacto sólido-líquido-vapor. Ángulo de contacto • Menisco: En las proximidades de una pared sólida, la superficie de un líquido suele presentar cierta curvatura adyacente al sólido. γSv • γSV de la lámina sólido-líquido. • γSV de la lámina sólido-vapor • γLV de la lámina líquido-vapor. • En un punto de la línea de contacto, (definido por la intersección de las tres superficies interfasiales) concurren 4 fuerzas, las tres tensiones superficiales y la llamada fuerza de adherencia, Fa. En condiciones de equilibrio Fa= γLv senθ γSv-γSL = γLv cosθ El ángulo θ es el ángulo de contacto. Constituye una medida de la curvatura libre del líquido adyacente a la pared. Su valor depende de γSv-γSL. 5 • Cuando γSv>γSL, cosθ>0, lo que corresponde a un ángulo de contacto entre 0 y 90º. En estas condiciones se dice que el menisco es cóncavo, y que el líquido moja a la pared, pero sólo la moja perfectamente cuando θ= 0. • Cuando γSv≈γSL, cosθ≈0 y θ≈90º. • El valor del ángulo de contacto depende de la naturaleza del líquido y la pared. • Las adulteraciones o impurezas presentes o añadidas a los líquidos pueden alterar el valor del ángulo de contacto. • los detergentes y humectantes, que al ser añadidos a un líquido, puede modificar el valor del ángulo de contacto desde valores grandes (>90º) hasta valores pequeños (<90º). • Los agentes impermeabilizantes, que al ser añadidos a un tejido hacen que el ángulo de contacto del agua con el mismo sea superior a 90º, y por tanto hacen que el agua no moje al tejido. Impermeabilizante: no moja θ Detergente: moja θ Capilaridad. Ley de Jurin • Un fenómeno importante asociado a la tensión superficial es la elevación de un líquido en un tubo de sección pequeña. El término capilaridad se utiliza para describir este fenómeno (capilar≈ análogo a cabello). • En el caso de un líquido que moja la tubo, el ángulo de contacto es menor de 90º, y el líquido se eleva hasta alcanzar una altura de equilibrio h. • Si el líquido no moja, el ángulo de contacto es maor que 90º, y el líquido experimenta un descenso dentro del tubo. 6 Si el tubo es un cilindro de radio r, el líquido está en contacto con el tubo a lo largo de una línea de longitud 2πr. Considerando aislado el cilindro líquido, de altura y, junto con su capa líquido-vapor, la fuerza total hacia arriba es F=2πr γlv cosθ La fuerza hacia abajo es el peso del cilindro, que es igual a ρgV, con V aproximadamente igual a πr2h, despreciando el pequeño volumen del menisco, o sea, P= ρgπ r2h Puesto que el cilindro está en equilibrio ρ gπ r2h= 2πr γLV cosθ la altura del capilar es h= 2γ LV cos θ ρ gr • La ley de Jurin se aplica también al caso de un descenso capilar, que se presenta cuando el tubo capilar se sumerge parcialmente en un líquido que no lo moja. En estas condiciones, 90º<θ< 180º, y tendremos que cosθ <0 y h<0, lo que representa un descenso respecto al nivel del líquido fuera del tubo capilar. • La ley de Jurin permite determinar el valor de la tensión superficial γ si se conoce el ángulo de contacto, a partir de la medida del ascenso de un líquido en un tubo capilar. En realidad, el ángulo de contacto presenta valores inciertos, de modo que la ecuación anterior sólo es aplicable para líquidos que mojan perfectamente al capilar (θ=0). • Los fenómenos capilares se presentan en cualquier estructura tubular o porosa, cualquiera que sea su geometría. El ascenso o descenso capilar sigue siendo proporcional a 2 γlv cosθ /ρ g r, con r alguna dimensión típica; únicamente cambiará el coeficiente numérico (2 para el capilar cilíndrico). Así pues, el movimiento de los líquidos por pequeños espacios entre materiales fibrosos o porosos es también un fenómeno capilar. • Ejemplo de ello es también la absorción del alcohol o el petróleo por una mecha, la absorción de la tinta por papel secante, el humedecimiento gradual y/o completo de un tejido o una esponja. La elevación capilar del agua por los pequeños poros del suelo la hace aflorar a la superficie; la pérdida por evaporación se retrasa por la labranza, que suelta el suelo y reduce la acción capilar. 7