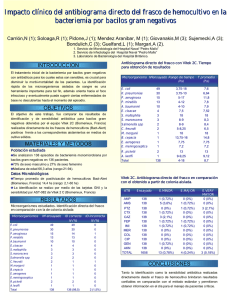
identificacion de los depositos microbiologicos en lentes de
Anuncio

IDENTIFICACION DE LOS DEPOSITOS MICROBIOLOGICOS EN LENTES DE CONTACTO BLANDOS DIANA CAROLINA CASTIBLANCO BARANZA UNIVERSIDAD DE LA SALLE FACULTAD DE OPTOMETRIA BOGOTA D.C. 2007 IDENTIFICACION DE LOS DEPOSITOS MICROBIOLOGICOS EN LENTES DE CONTACTO BLANDOS DIANA CAROLINA CASTIBLANCO BARANZA TRABAJO DE GRADO Directoras: MYRIAM TERESA MAYORGA OPTOMETRA MARTHA FABIOLA RODRIGUEZ BACTERIOLOGA UNIVERSIDAD DE LA SALLE FACULTAD DE OPTOMETRIA BOGOTA D.C. 2007 Nota de aceptación: _______________________________ _______________________________ _______________________________ _______________________________ _______________________________ _______________________________ _______________________________ ___________________________________________ Firma del jurado ___________________________________________ Firma del jurado Bogotá, Fecha _________________________________ DEDICATORIA A mis padres por su incondicional apoyo, por inculcar el espíritu de lucha en cada momento de la vida, por sus oraciones, por su amor y por la enseñanza de la importancia y el valor que tiene la educación en el desarrollo del ser. A la doctora Miriam teresa Mayorga y Martha Fabiola Rodríguez por su ayuda incondicional, por su apoyo y esfuerzo en la realización de este proyecto. Al doctor ballesteros que siempre tuvo una respuesta para todo y una solución en el momento, gracias. A representaciones visuales a cargo del señor Alberto escobar quien fue la persona que me brindo su ayuda en la recolección de la mayoría de los lentes para este estudio. Y a la Universidad de la Salle ya que sin la ayuda del laboratorio del centro y de chapinero no hubiese sido posible realizar el trabajo de campo de esta investigación. INDICE DE CONTENIDO RESUMEN…………………………………………………………………... 10 INTRODUCCION…………………………………………………………... 12 1. OBJETIVOS…………………………………………………………….. 13 1.1 OBJETIVO GENERAL……………………………………….............. 13 1.2 OBJETIVOS ESPECIFICOS…………………………………………. 13 2. JUSTIFICACION……………………………………………………… 14 2.1 JUSTIFICACION ACADEMICA……………………………............. 14 3. MARCO REFERENCIAL……………………………………………. 15 4. MARCO TEORICO……………………………………………………… 20 4.1 CLASIFICACION DE LCB SEGÚN LA FDA………………………….20 4.1.1 INTRODUCCION ………………………………………………………20 4.2 CLASIFICACION RUDKO (IACLE)…………………………………….21 4.2.1 GRADOS Y CLASIFICACION DE DEPOSITOS……………………21 4.2.2 RUDKO: CATEGORIAS DE CLASIFICACION…………………….22 4.3 CLASIFICACION DE LOS DEPOSITOS EN LC……………………..23 4.3.1 INTRODUCCION………………………………………………………..23 4.3.2 CLASIFICACION………………………………………………………..23 4.4 MICROBIOLOGIA EN LC……………………………………………….24 4.4.1 FLORA OCULAR NORMAL………………………………………....24 4.4.2 ADHERENCIA MICROBIANA………………………………………..25 4.4.4 BARRERAS ANATOMICAS………………………………………….26 4.4.5 PARPADOS…………………………………………………………….28 4.4.6 PELICULA LAGRIMAL……………………………………………....28 4.4.7 INFECCION OCULAR Y BIOMATERIALES………………………30 4.4.8 MICROORGANISMOS ASOCIADOS A INFECCIONES…………33 5. METODOS Y MATERIALES………………………………………………38 5.1 TIPO DE ESTUDIO………………………………………………………..38 5.2 MUESTRA………………………………………………………………….38 5.3 METODO…………………………………………………………………...38 5.4 ANALISIS ESTADISTICO………………………………………………..43 6. RESULTADOS……………………………………………………………..44 6.1 RESULTADOS ESTADISTICOS……….………………………………44 6.1.1 RESULTADOS FDA…….……………………………………………..44 6.1.2 RESULTADOS CRITERIOS DE RUDKO…………………………..45 6.1.3 RESULTADOS DE HISTORIAL LCB………………………………46 6.2 MICROORGANISMOS…………………………………………………..47 6.2.1 CULTIVOS………………………………………………………………48 6.2.3 GRAM DE CULTIVOS…………………………………………………49 6.2.4 BACTERIAS SEGÚN FORMA……………………………………….50 6.3 RESULTADOS HONGOS……………………………………………….51 6.4 DEPOSITOS Vs CONTAMINACION…………………………………..52 6.5 GRUPO FDA Vs CRITERIO RUDKO………………………………….53 6.6 GRUPO FDA Vs CONTAMINACION ………………………………….54 RESULTADOS………………………………………………………………..55 DISCUSION……………………………………………………………………56 BIBLIOGRAFIA………………………………………………………………59 ANEXOS……………………………………………………………………….62 INDICE DE FIGURAS Fig. 1. FRECUENCIA EN LA CLASIFICACION DE FDA……………………44 Fig. 2. FRECUENCIA EN CRITERIOS DE RUDKO…………………………..45 Fig. 3. FRECUENCIA EN MICROORGANISMOS…………………………….47 Fig. 4. FRECUENCIA EN CULTIVOS………………………………………….48 Fig. 5. FRECUENCIA DE GRAM ……………………………………………….49 Fig. 6. FRECUENCIA DE BACTERIAS SEGÚN FORMA…………………...50 Fig. 7. FRECUENCIA DE HONGOS……………………………………………51 Fig. 8. FRECUENCIA DEPOSITOS Vs CONTAMINACION………………..52 Fig. 9. FRECUENCIA GRUPO FDA Vs CRITERIO RUDKO……………….53 Fig. 10. FRECUENCIA GRUPO FDA Vs CONTAMINACION……………….54 INDICE DE TABLAS Tab.1. FRECUENCIA EN LA CLASIFICACION DE FDA……………………44 Tab. 2. FRECUENCIA EN CRITERIOS DE RUDKO…………………………45 Tab. 3. FRECUENCIA EN MICROORGANISMOS…………………………..47 Tab. 4. FRECUENCIA EN CULTIVOS…………………………………………48 Tab. 5. FRECUENCIA DE GRAM ……………………………………………..49 Tab. 6. FRECUENCIA DE BACTERIAS SEGÚN FORMA…………………50 Tab. 7. FRECUENCIA DE HONGOS………………………………………….51 Tab. 8. FRECUENCIA DEPOSITOS Vs CONTAMINACION………………52 Tab. 9. FRECUENCIA GRUPO FDA Vs CRITERIO RUDKO……………..53 Tab. 10. FRECUENCIA GRUPO FDA Vs CONTAMINACION……………54 INDICE DE ANEXOS ANEXO 1. FICHA TECNICA RECOLECCION DE RESULTADOS…………62 ANEXO 2. RESULTADOS DE DATOS LCB Y CRITERIOS DE RUDKO…63 ANEXO 3. RESULTADOS DE CULTIVOS Y GRAM…………………………72 ANEXO 4. RESULTADOS PARA HONGOS………………………………….81 RESUMEN Objetivo: Determinar y clasificar los depósitos microbiológicos encontrados en los lentes de contacto blandos de prueba, clasificados de acuerdo a la FDA. Materiales y Métodos: A 100 lentes de contacto blandos de prueba de cada uno de los grupos según la clasificación de FDA (Grupo I, II, III y IV), obtenidos en Bogotá, Medellín, Cali, Ibagué y Fusagasuga de pacientes y lentes de prueba los cuales se les realizo observación directa en la lámpara de hendidura y clasificación del tipo de depósitos mediante un parámetro cualitativo de Rudko que se encuentra en Contact Lenses course IACLE. Posteriormente, a cada lente se le hizo examen directo en solución salina, azul de Lactofenol y frotis de Gram, y cultivo en agar sangre, durante 24 horas a 37°C. Las colonias obtenidas se clasificaron macroscópicamente y microscópicamente mediante la coloración de Gram. Se determino en cada grupo la frecuencia de los microorganismos hallados y se correlacionaron los resultados obtenidos entre la prueba cualitativa y el estudio microbiológico. Resultados El análisis cualitativo de los depósitos con lámpara de hendidura determino que el 64.4% de los lentes presentaban depósitos visibles en hidratación con magnificación 15x (38/59), el 100% (55/55) presento depósitos no visibles en lente hidratado o no hidratado con magnificación de 15x y el 100% (7/7) presentaba depósitos visibles en lente hidratado sin magnificación. En el grupo I se encontró que el 36% (9/25) de los lentes estaba contaminado con bacilos Gram negativos, el 12% (3/25) con cocobacilos Gram negativos y el 8% (2/25) con hongos. En el grupo II el 64% (16/25) tuvo bacilos Gram negativos, el 36% (9/25) cocobacilos Gram negativos y el 4% (1/25) hongos. En el grupo III el 56% (14/25) de los lentes estaba contaminado con bacilos Gram negativos, el 24% (6/25) con cocobacilos Gram negativos y el 20% (5/25) con hongos. En el grupo IV el 64% (16/25) tuvo bacilos Gram negativos, el 16% (4/25) cocobacilos Gram negativos y el 16% (4/25) hongos. Conclusiones: Los mayores contaminantes de los lentes de contacto blando de prueba son los bacilos Gram negativos, indicando fallas en el sistema de limpieza y mantenimiento de este tipo de lentes. Es urgente que se tenga en cuenta la no reutilización de los lentes de prueba. INTRODUCCION Se calcula que el numero de portadores de lentes de contacto a aumentado y que aproximadamente llegan hacer unos 75 millones de usuarios en el mundo, según IACLE (Internacional Association for Contact Lens Educators), por lo que incluso complicaciones de baja incidencia afectaran en un numero significativo de individuos. El conocimiento de la incidencia de las complicaciones relacionadas con las LC y de sus factores de riesgos permite a los contactólogos informar a sus pacientes con precisión sobre los riesgos de padecer estos trastornos. Esta información también puede ayudar a tratar enfermedades relacionadas con el uso de LC y a conocer su patogenia.1 Por lo tanto este trabajo de investigación se oriento en la necesidad de hacer un estudio para constatar los resultados obtenidos en otras investigaciones fuera del país, en los cuales los lentes de contacto del grupo II y IV, según clasificación de FDA, forman depósitos más fácilmente, que los otros grupos. Así como también determinar la frecuencia del tipo de microorganismo (bacterias y hongos) encontrados como depósitos. 1. DURAN DE LA COLINA, Juan A. COMPLICACIONES DE LAS LENTES DE CONTACTO. LXXIV PONENCIA OFICIAL DE LA SOCIEDAD ESPAÑOLA DE OFTALMOLOGIA 1998. Editorial Tecnimedia. MadridEspaña. 1. OBJETIVOS OBJETIVO GENERAL Identificar los depósitos microbiológicos, bacterias y/o hongos, en los lentes de contacto blandos clasificados según los grupos establecidos por la FDA OBJETIVOS ESPECIFICOS Clasificar cualitativamente los depósitos encontrados en los lentes de contacto según los criterios de Rudko. Establecer los depósitos microbiológicos, bacterias y/o hongos, en los lentes de contacto blandos, por medio de cultivo y tinciones. Determinar la frecuencia del tipo de microorganismo según el grupo de los lentes blandos 13 2. JUSTIFICACION JUSTIFICACION ACADEMICA El optómetra integral debe partir de una diversidad de actividades que mejoren y garanticen la calidad de la salud visual de la población. Con el incremento de usuarios de LC blandos en el país, la diversidad de materiales, métodos desinfectantes, y manejo del usuario; nos hace poner en alerta en cuanto a las complicaciones relacionadas con su uso. Se pretende comprobar que existe mayor adherencia de depósitos en los grupos II y IV según la clasificación de la FDA, por tener altos contenidos acuosos y mayor ionicidad en sus polímeros. Se insiste en que depósitos proteínicos atraen mayor grado de colonizaciones bacterianas en la superficie del lente, pero han sido muy bajos los resultados encontrados en los estudios que nos indique que esta pueda ser una afirmación. Sin embargo existen variados factores que contribuyen a que haya colonizaciones bacterianas en la superficie del lente y que posteriormente existan infecciones oculares. La mayoría de veces realizamos la inspección del lente dando una valoración cualitativa que realmente no asegura que estos lentes no tengan alguna contaminación, y así mismo prevenir alteraciones oculares en los pacientes. De acuerdo a esto, se ve la necesidad de demostrar la prevalencia de los microorganismos en los lentes de contacto utilizados, la importancia del aseo en el uso de lentes de contacto, su buen manejo y la utilización para el cual fueron hechos los lentes. De esto dependerá que las complicaciones dadas por los LC disminuyan gradualmente y se cree una cultura entre los usuarios y profesionales. 14 3. MARCO REFERENCIAL Cuando los lentes de contactos blandos fueron introducidos al mercado en 1960 para la corrección de errores refractivos la posibilidad de infecciones oculares asociada a su uso fue de gran importancia.2 El incremento en el numero de portadores de LC blandas, tanto en el porte diario o prolongado ha provocado a su vez, la aparición de problemas asociados al incremento de depósitos sobre la superficie de las lentes. Los depósitos pueden hacer reducir la calidad de visión y provocar molestias y desplazamientos excesivos de las lentes. 2 Se han realizado con anterioridad intentos por determinar las complicaciones asociadas con las LC sobre la base de su patogenia. Debido a la diversidad de las clasificaciones utilizadas por distintos autores es difícil hacer una estimación exacta de la frecuencia global de dichas complicaciones.2 Factores predisponentes para desarrollar complicaciones incluyen la composición del lente, horarios de uso, adherencia microbiana en la superficie del lente, y la contaminación de los sistemas de desinfección. La contaminación de los sistemas de desinfección o de limpieza puede ser una importante fuente para desarrollo de microorganismos infecciosos. 3 La infección corneal es sin duda la complicación mas grave del uso de LC. Aunque su frecuencia no es elevada y es bien cierto que la inmensa mayoría de los usuarios no va a sufrir esta complicación. La gravedad de la complicación se basa en la disminución visual que provoca, que puede llegar a ser definitiva. Por su parte las diferentes modalidades de porte han ido incidiendo en la atención del problema, pues tanto el porte permanente como la irrupción de los lentes desechables no han sido ajenos a esta complicación. 15 El epitelio corneal es una eficaz barrera a la penetración bacteriana, por lo que es necesaria su rotura para que se inicie una infección. El porte de LC puede ser un motivo suficiente para provocar dicha rotura; además el LC puede ser el vehículo de la bacteria. La alta frecuencia de infecciones cornéales por Pseudomona Aeruginosa, Staphylococcus Aureus y Streptococcus Pneumoniae, es precisamente debido a la mayor capacidad de estas bacterias para adherirse al epitelio corneal. La fuente de microorganismos es variado. Los parpados y la conjuntiva albergan un numero importante de bacterias, la mayoría de ellas cocos Gram + (Staphylococcus Aureus y Staphylococcus Epidermidis) con fácil acceso al LC y a la cornea. El estuche de LC en su medio húmedo, contiene tanto bacterias como hongos y amebas constituyendo un indicador de este hecho la presencia de contaminación ambiental y falla en la correcta desinfección y limpieza. Estudios realizados con anterioridad demuestran diferencias en la adherencia de los microorganismos de acuerdo a los tipos de material de los lentes de contacto. En un estudio con 75 LCB de cambio frecuente, 35 Baush & Lomb de polymacon de del grupo I y 40 de Carl Zeiss del grupo IV; en donde los usuarios asintomáticos usaban estos lentes durante 7 horas en el día. Los lentes se cultivaron en agar de sangre – chocolate y McConkey durante 48h a 37ºC. Para hongos se utilizo agar dextrosa de Saboraud`s durante 20 días a 25ºC. Encontrando que los microorganismos mas aislados fueron Staphylococcus Aureus, Corynebacterium, Streptococcus no hemolíticos, bacilos Gram negativos, Neisseria y Penicillium en LCB del grupo IV los cuales no fueron igualmente aislados en el grupo I. El microorganismo mas frecuente que creció en ambos cultivos de ambos grupos fue Staphylococcus coagulasa 16 negativa en un rango de 55% para grupo IV y 42.8% para grupo I. (BAHAR Y UNAL, 2002). STAPLETON Y SWEENEY, (2001) realizaron un estudio comparativo entre el grado de contaminación de los lentes de contacto y la sintomatología del paciente. Ellos utilizaron LCB de Vistakon J&J y Baush & Lomb; grupo IV y I respectivamente. Ningún paciente presento alteración ocular, diagnosticada por lámpara de hendidura. El cultivo de los lentes utilizados demostró contaminación en cerca de un 100% con bacterias Gram positivas y en un 80% con bacterias Gram negativas. Las bacterias Gram positivas mas frecuentes fueron Staphylococcus ssp., Propionibacterium ssp. y Corynebacterium ssp. Las bacterias Gram negativas mas prevalentes fueron Serratia ssp y Micrococcus y Pseudomona, siendo este ultimo el agente mas frecuentemente encontrado en estos cultivos. Se encontraron similitudes en el tipo de microorganismo entre los dos grupos de LCB tanto en grupo I como en IV. WILLCOX Y POWER (1997): Estudiaron 70 LCB de LCB de Vistakon J&J y Baush & Lomb de grupo IV y I respectivamente. Los lentes se cultivaron en Agar chocolate y Saboraud’s. En total se encontraron 30 especies diferentes de microorganismos. El microorganismo mas frecuente fue el Staphylococcus coagulasa negativa en cerca de 39.9% en lentes del grupo I. En este estudio se analizo también la flora ocular normal, la contaminación de los estuches, de los dedos y el agua de los lugares donde estaban presentes los usuarios. JONES Y EVANS (1997): Realizaron un estudio con 40 LCB de Ciba visión (focus Visitint) y de Pilkington Barnes-Hind (precisión UV) de los grupos IV y II respectivamente; para determinar los depósitos en los mismos. Se encontró que existe una diferencia significativa entre el grado de depósitos proteínicos entre los dos materiales. El grupo IV presento mayor grado de depósitos proteínicos que el grupo II, y a nivel lipidico se encuentro que el grupo II tenía 17 mayor grado de estos depósitos que el grupo IV. No se encuentro diferencias significativas entre los tiempos de uso o de reemplazo para presentar depósitos en la superficie del LCB. En otro estudio con tiempo de uso controlado, se encontró que los cultivos fueron positivos para microorganismos en un 86.6% de los LCB. La Pseudomona fue el microorganismo mas aislado seguido de Staphylococcus Aureus. El rango de uso de los LCB fue cerca de 9.2 meses y la solución de limpieza alrededor de 10.9 meses y los LCB fueron 60% del grupo I, el 40% del grupo IV (LIPENER Y NAGOYA, 1995) HURTADO Y HARTUNG (1995): Identificaron la presencia de hongos en 17 LCB de diferentes grupos. Los lentes se cultivaron en agar dextrosa y Saboraud’s con cloranfenicol a una temperatura entre 14 y 37ºC. Se encontró que el crecimiento de hongos se realiza en la matriz del LCB y la frecuencia de hongos encontrada fue de Penicillium (5 cultivos), Aspergillius (3 cultivos), Cephalosporium – Scopulariopsis – Exophiala (2 cultivos cada uno), Scytalidium – Rhinocladiella – Sclerotlum (1 cultivo cada uno). Todos los hongos encontrados fueron de tipo filamentosos. Muchas infecciones cornéales responden adecuadamente a antibióticos de amplio espectro en preparación comercial, por lo cual comúnmente no se realiza el diagnostico confirmatorio en el laboratorio, el cual incrementaría el costo y tiempo para el paciente. Por otra parte, la veracidad del laboratorio ha sido puesta en duda por el alto índice de resultados inciertos e incluso erróneos. Sin embargo, el laboratorio ofrece unas ventajas innegables: aísla la mayor parte de las veces el germen responsable de la infección, determina la susceptibilidad y resistencia de la bacteria frente a una amplia gama de antibióticos y permite realizar estudios clínicos, microbiológicos y epidemiológicos. De ahí que la tendencia sea hacia la selección de los casos, 18 bien sea para ser tratados por optómetra u oftalmólogo o bien sea para ser enviados a centros especializados que incluyan el diagnostico del laboratorio. 19 4. MARCO TEORICO 4.1 CLASIFICACION DE LCB SEGÚN LA FDA (FOOD AND DRUGS ASMINISTRATION) 4.1.1 INTRODUCCION En los últimos años se ha popularizado notablemente el empleo de lentes de contacto, fundamentalmente los lentes de contacto blandos empleados en un 90% de los casos. Los lentes de contacto blandos están fabricados por una combinación de diversos polímeros (hidrogeles) con contenidos variables de agua que oscilan entre el 35% y el 80%. Esos contenidos variables son la capacidad del material en absorber agua (hidrofilicos) y se tornen blandos, entre mayor contenido acuoso mayor es la permeabilidad (DK) que se interpreta como la capacidad del material para dejar pasar oxigeno entre el lente y la cornea. Estos polímeros poseen propiedades físicas, químicas y estructurales diferentes, de forma que dotan a la lente de características de hidratación, porosidad, transmisibilidad al oxígeno, humidificación de la superficie, durabilidad, etc. específicas. La FDA da un nombre genérico a cada material de lente de contacto, en general todos los lentes de hidrogel terminan en su nombre genérico que es el "filcon" y todos los no hidrogeles terminan en "focon." Se clasifican los lentes de contacto blandos o de hidrogel en cuatro agrupaciones para propósitos de evaluación de productos adicionales valorando el material del lente. Las lentes con menos de 50% de volumen de agua se considera que son “bajo contenido acuoso” y los otros son “alto 20 contenido acuoso”. Las superficies menos reactivas son los términos denominados "no iónico" y los materiales más reactivos “iónicos.” El Dk (permeabilidad) de los lentes de contacto blandos o de hidrogel se utiliza como contenido acuoso o de agua (H2O). Materiales de bajos contenidos de agua tienen bajos valores de DK y loas materiales de altos contenidos acuosos tienen mayores valores de DK.los valores de DK son teóricamente un absoluto para cualquier material dado, pero prácticamente los valores encontrados en diferentes investigaciones varían un poco. 4.2 CLASIFICACION DE RUDKO 4.2.1 GRADOS Y CLASIFICACION DE LOS DEPOSITOS VALORACION DE LA SUPERFICIE Clasificación por apariencia: RUDKO Categorías y tipos de depósitos: TRIPATHI Sistema de grados: JOSEPHSON, CAFFERY, HART Los resultados pueden ser influenciados por: Acuosidad del lente Tiempo de deshidratación de la superficie 4.2.2 RUDKO: CATEGORIAS DE CLASIFICACION I: Depósitos no visibles en lente hidratado o deshidratado con 15x de magnificación II: Depósitos visibles en lente hidratado con 15x de magnificación III: Depósitos visibles en lente deshidratado sin magnificación IV: Depósitos visibles en lente hidratado sin magnificación 21 Un temprano experimento para clasificar los depósitos fue presentado por RUDKO en 1974 (RUDKO Y PROBY en 1974, RUDKO Y GREGG en 1975) Este sistema luego fue modificado incluyendo códigos para: El tipo de depósitos (cristalinos, granulares, membranoso, partículas metálicas, etc.) La extensión del deposito (cuanta área de la superficie del lente esta cubierta) Las variaciones de esta clasificación en general son utilizadas todavía. 4.3 CLASIFICACION DEPOSITOS EN LCB El incremento en el numero de portadores de LC blandas, tanto en el porte diario o prolongado ha provocado a su vez, la aparición de problemas asociados al incremento de depósitos sobre la superficie de las lentes. La presencia de depósitos supone una situación de alto riesgo para la aparición de problemas debido a las modificaciones que induce en la lente, como la disminución de su calidad óptica, o la aparición de signos de inflamación o sensibilización pudiendo llegar a provocar cambios importantes en la superficie ocular. La presencia de depósitos favorece la colonización de las LC por diferentes microorganismos siendo un paso previo para una infección ocular. También que uno o mas factores relacionados con las lentes pueden estar en situación inadecuada como: • medio ambiente del portador de lentes • calidad de la higiene ocular y métodos de limpieza • bioquímica de las lagrimas y su interrelación con las lentes 22 • características del material de la lente y calidad de manufacturación. Se han hecho estudios comparativos de los depósitos (lípidos y proteínas) que aparecen en dos tipos distintos de LC: grupo II (no-iónico de alta hidratación) frente al grupo IV (iónicos de alta hidratación) según clasificación de la FDA; concluyendo que los depósitos mas frecuentes en el grupo IV fueron mas proteicos, mientras en el grupo II fueron mas lipidicos.(Contact lens spectrum, 1995) 4.3.2 CLASIFICACION DE LOS DEPOSITOS 1. DEPOSITOS ORGANICOS PROTEINAS (Lisozima, Aminoácidos libres, glicoproteínas) LIPIDOS MUCINA LIPOPOLISACARIDOS DROGAS COSMETICOS Y PIGMENTOS ORGANICOS CONTAMINANTES AMBIENTALES 2. DEPOSITOS INORGANICOS SALES DE CALCIO (Fosfato y Carbonato9 MERCURIO, HIERRO Y OTROS METALES SILICE MAGNESIO SAL SODICA 3. DEPOSITOS MIXTOS COMPLEJOS DE MUCOPRTEINAS Y LIPIDOS (MPL) CON/SIN CALCIO CON/SIN OTROS ELEMENTOS ORGANICOS E INORGANICOS 23 4. DEPOSITOS MICROBIANOS FLORA OPORTUNISTA DE PARPADOS Y CONJUNTIVA BACTERIAS, HONGOS, ETC, DE ORIGEN EXTRAOCULAR 5. DEPOSITOS INTRINSECOS DE LA LENTE DEFECTOS DE FABRICACION IMPUREZAS DEL POLIMERO ENVEJECIMIENTO 4.4 MICROBIOLOGIA EN LC 4.4.1 FLORA OCULAR NORMAL La flora normal de los parpados y la conjuntiva principalmente consisten en bacterias aeróbicas como Sthaphylococcus Epidermis, Staphylococcus Aureus y dipteroides (solos o en combinación) suelen ser aislados desde la conjuntiva humana en pacientes normales. Otros anaerobios y hongos filamentosos pueden ser recuperados desde las superficies oculares externas, pero su número y existencia varia de un estudio a otro.(OCULAR INFECTION & IMMUNITY,1996) Los organismos residentes en la superficie externa ocular no se encuentran distribuidos a través de la superficie ocular, sino en hábitats estrictamente dominados. La superficie conjuntival proporciona una amplia extensión para la colonización los mecanismo de limpieza acción de las lagrimas, con componentes para acción antimicrobial natural, restringe la implantación de los microbios que poseen mecanismos adhesivos y son resistente a los efectos de los componentes de la P.L. y los componentes anaeróbicos de la flora ocular 24 son localizados en las criptas inferiores del fornix, las glándulas sebáceas, las glándulas meibomianas y los folículos vellosos donde el bajo potencial de oxidación y reducción favorece el crecimiento de microareofilicas, facultativas y anaerobios obligados.(OCULAR INFECTION & IMMUNITY, 1996) Bacterias y levaduras son parte de la flora normal de las superficies oculares externas, los virus y amebas no lo son. La Acantamoeba no se encuentra en la superficie ocular externa normal, excepto en usuarios de lentes de contacto donde la flora normal esta en contacto con contaminaciones del lente lo cual induce esta infección que en la flora normal no ocurre. 4.4.2 ADHERENCIA MICROBIANA El ataque microbiano se inicia por interacciones moleculares entre la superficie de la bacteria glicoproteínas adhesivas (invasores) y los receptores proteínicos (integrante) en las células epiteliales de la superficie ocular, lo que resulta en un cubrimiento al microorganismo que evita ser desechado por los mecanismos de limpieza existentes en el ojo. Además los organismos que colonizan las superficies oculares son limitados a bacterias selectivas, esta predilección por superficies conjuntivales puede explicarse también por su extensión y por la diferencia en habilidades de los organismos en la adherencia a diferentes tipos de células epiteliales existentes. 4.4.4 BARRERAS ANATOMICAS Cuando un microorganismo intenta entrar al cuerpo, la primera barrera es la piel y las mucosas, las células epiteliales que constituyen las capas mas externas forman una pared que actúa físicamente previniendo la entrada de la mayoría de estos. A demás del impedimento físico, el epitelio produce sustancias, que ayudan a evitar la invasión del agente extraño, por ejemplo, la piel produce una secreción sebácea que mantiene el PH acido, el cual inhibe el 25 crecimiento de la mayoría de los microorganismos, solo algunas bacterias pueden vivir bajo estas condiciones. Las mucosas a diferencia de la piel son húmedas, están recubiertas por secreciones, saliva o lágrimas que continuamente bañan el epitelio impidiendo la adherencia de los microorganismos. Estas secreciones contiene sustancias bactericidas o bacteriostáticas. El epitelio de la conjuntiva es estratificado no queratinizado y varia de espesor desde el margen palpebral hasta el limbo, a diferencia de los otros epitelios escamosos estratificados, este contiene células caliciformes, secretoras de mucina, que se encuentran unidas y entre las células epiteliales. El epitelio de la conjuntiva bulbar es mas grueso que el de la conjuntiva palpebral, consiste de 6 a 9 capas, las membranas de estas células epiteliales muestran marcados dobleces o pliegues, que impide que las células adyacentes se conectan totalmente, lo cual produce amplios espacios intracelulares en los cuales los Ac y otros constituyentes proteicos, provenientes de los vasos sanguíneos, en la sustancia propia, pueden acumularse, pero también los agentes infecciosos o sustancias aplicadas tópicamente pueden ganar acceso a los espacios intracelulares y posteriormente a los capilares conjuntivales y a la circulación sistémica. En la superficie del epitelio la mucina secretada por las células caliciformes mantiene la estabilidad de la película lagrimal sobre la superficie conjuntival. Aunque el epitelio de la cornea difiere de la conjuntiva en su organización y componentes celulares, ambos constituyen barreras de defensa de la superficie ocular. El epitelio de la cornea está compuesto de células epiteliales escamosas, estratificadas, no queratizadas. Consiste de tres tipos de células, dos a tres capas de células superficiales, dos a tres capas de células aladas o intermedias y una monocapa de células básales adyacentes a la capa de Bowman. Solo la capa de células básales prolifera, las células hijas se 26 diferencias en aladas y subsecuentemente en células superficiales. El proceso de diferenciación demora entre 7 y 14 días, después de este tiempo las células superficiales se descaman en la película lagrimal. La rápida renovación de las células epiteliales también ayuda a proteger la cornea de la unión microbiana. Las interacciones célula-célula y célula-matriz son importantes para mantener la estratificación del tejido. La presencia de fuertes uniones entre las células epiteliales adyacentes previene el paso de sustancias a las capas internas. Cualquier defecto en el epitelio permitirá la entrada del fluido lagrimal en el estroma ocasionado el edema y por lo tanto, alteración en la transmisión de la luz. Las uniones más fuertes están presentes en las capas superficiales para impedir el paso de la lágrima, mientras que las uniones más laxas se encuentran en las capas internas facilitando el flujo de sustancias entre estas células. En el epitelio corneal se encuentran células de langerhans y macrófagos, implicadas en la presentación antigénica, su localización esta restringida a la periferia y están ausentes en el centro de la cornea. El epitelio corneal no posee ningún otro tipo de células inmunológicas ni células caliciformes. 4.4.5 PARPADOS Los lípidos de las glándulas meibomianas humanas están compuestas por esteres de esterol (30% del total de lípidos), esteres de cera (35%), diesteres (8%), triglicéridos (5%), esteroles libres (2%), ácidos grasos libres (2%) y fosfolipidos (15%). Estos lípidos mantienen las propiedades ópticas de la P.L, retarda el tiempo de evaporación de la P.L., cuando el ojo esta expuesto al medio ambiente. Previene y da lubricación a la interface ojo – parpados. Las pestañas barren las partículas que entran del aire y cuando el parpado se cierra; el mecanismo de barrido de los fluidos de la lagrimas y el moco suspenden a la bacteria hacia los puntos lagrimales, luego este se dirige al saco lagrimal para ser subsecuentemente drenado por la nariz. 27 4.4.6 COMPONENTES DE LA P.L. La película lagrimal contiene numerosas proteínas, electrolitos, aminoácidos, vitaminas y metabolismos intermedios. Las diversas proteínas en donde existe más de 60 identificadas, incluye unas que poseen actividad antimicrobial, mientras algunos componentes de la P.L. Tiene este efecto directo, otros componentes expresan la acción antibacterial indirectamente por acceso a resolución microbial de nutrientes esenciales. LISOZIMA: esta comprende entre el 20 y el 40% del total de contenido proteínico de la lágrima. Esta se activa en contra de muchas bacterias gram positivas disolviendo su pared celular, su concentración es elevada por esto es bactericida. La producción de la Lisozima disminuye con la edad; estos niveles de disminución pueden predisponer a la superficie conjuntival a un mayor grado de colonización con especies bacterianas comunes. Su acción también depende del pH. El pH optimo para la lisis varia de acuerdo con la solubilidad de las proteínas bacterianas, pero en general oscila entre 6.0 y 7.4. LACTOFERRINA Y OTRAS PROTEINAS: la lactoferrina fue aislada primordialmente en la leche bovina e identificada posteriormente en la película lagrimal humana. Es un enlace entre dos átomos de hierro y cobre teniendo afinidad por las inmunoglobulinas IgA, IgG y albumina. Esta tiene dos propiedades bacteriostáticas y bactericidas las cuales pueden interactuar específicamente con anticuerpos y complementos. B- LISINA: B_Lisina es una proteína bactericida encontrada en la lágrima humana, actúa directamente en la membrana citoplasmática de la bacteria y su función es óptima cuando se combina con Lisozima para una acción sinergista. COMPLEMENTO: El complemento es una serie de proteínas las cuales cuando se activan inician la cascada de reacciones que posteriormente 28 resultan en la lisis de la bacteria. Existen dos distintos pero interrelacionados caminos del complemento y los componentes de cada uno son encontrados en la PL. INMUNOGLOBULINAS: Estas están presentes en condiciones bajas de la PL. La secreción de la inmunoglobulina A es la más predominante. Los monómeros de la IgA son producidos por células plasmáticas localizadas en los tejidos intersticiales en su mayor parte y en las glándulas lagrimales accesorias y en la conjuntiva. El papel de la IgA es la prevención de la adherencia bacterial a las células epiteliales mediante atrapar el microorganismo con la mucosa. También tiene acción directa antimicrobiana contra las bacterias, aunque esta no ha sido bien aclarada. Esta también activa la forma alterna de la cascada del complemento y puede en combinación con otros componentes de la lágrima como la Lisozima inducir bacteriólisis; también neutraliza toxinas extracelulares y virus. IgG esta presente en bajas concentraciones, la cual activa la clásica cascada del complemento, y los resultados son la fagocitosis y lisis de los microorganismos patógenos. IgE no esta claro su acción de defensa ante las infecciones. Facilita la erradicación del organismo patógeno por medios indirectos. Se encuentra en la superficie de las células mastoides y pueden activar antígenos y desencadenar una cadena de eventos que conducen a la liberación de aminas vasocativas. Estas sustancias causan vasodilatación de los vasos conjuntivales y secreción de varios componentes del suero en los sacos conjuntivales. El resultado de este fenómeno es la eliminación del organismo por medio del flujo de la PL. IgM e IgD están detectadas inusualmente en la P.L. Bajo ciertas condiciones patológicas y elevados niveles de estas y otras clases de inmunoglobulinas han sido encontradas. 29 Finalmente, la flora normal, como se menciono arriba, tiene una “función protectora” ya que compite con los patógenos, por los sitios de unión a la superficie del epitelio y por los nutrientes, producen sustancias que inhiben el crecimiento de otros microorganismos etc. 4.4.7 INFECCION OCULAR Y BIOMATERIALES En una superficie mucosa como la conjuntiva, la colonización de los organismos se inicia como un débil ataque reversible llamado asociación. Esto se facilita por factores que incluyen cargas electrostáticas comparativas en la superficie, la hidrofobia o hidrofilia del patógeno y la superficie de la célula huésped y la presencia o ausencia de la superficie celular mucosa rica en carbohidratos extrínsecos o glycocalix. Si el microorganismo no repele este desarrollo y la asociación es relativamente estable, el ataque microbiano es irreversible en las células huéspedes y ocurre el evento llamado adhesión o adherencia. Esto se facilita algunas veces por estructuras moleculares complementarias presentes en la superficie de ambos tanto en los microbios como en las células huéspedes. El ligando es una molécula microbiana superficial que realiza la adhesión, exhibiendo propiedades especificas que atan las moléculas complementarias en la superficie de las células huéspedes llamadas receptor. Después de la adhesión a la superficie mucosa los patógenos inician la infección clínica o invasiva, crece en la superficie elaborando toxinas que pueden penetrar la barrera mucosa (invasión) y establecer el crecimiento dentro de las células epiteliales o subyacentes al estroma. En cualquiera de las dos instancias del ataque microbiano, es crítico, tanto el evento inicial en la infección como en la invasión. Ciertas bacterias como el S. Epidermidis y P. Aeruginosa secretan una sustancia extracelular, un polímero que es llamado glycocalix, la cual funciona como una adhesina no especifica que media el ataque de esas bacterias en superficies vivas y no vivas. 30 MECANISMOS DE INFECCION ASOCIADA CON BIOMATERIALES Bacterias Gram positivas y Gram negativas son los patógenos predominantes. El S. Epidermidis es el agente mas frecuente en casos de infección relacionados con el uso de catéter intravenoso, dispositivos ortopédicos, injertos vasculares sintéticos y catéter de diálisis peritoneal. Los estreptococos alpha-hemolitocos se adhieren selectivamente a las superficies de los dientes, es el primer colonizador de placa dental, y es el mayor causante de endocarditis bacteriana. Bacterias gram negativas, particularmente la Escherichia Coli es el colonizador mas común en catéteres urinarios que resulta en una infección de las células urinoepiteliales. La Candida puede colonizar catéteres y causar fungemia intermitente con distantes metástasis. EFECTOS DEL USO DE LENTES DE CONTACTO El uso prolongado de lentes de contacto ha sido asociado con cambios en la flora normal. Mientras que el uso de LCB en corto tiempo menor a 7 días, no varía en la flora normal conjuntival residente, Los cambios significativos ocurren después de 2 meses de uso extendido. Estos cambios incluyen incremento en la potencialidad patógena, en el número de cultivos negativos y el decrecimiento en la incidencia de cuidado o reservorio del ojo solo en flora normal conjuntival. Estos datos reflejan las presiones tanto físicas como bioquímicas que acompañan el uso de LC en la superficie ocular. Los cambios fisiológicos incluyen reducción en la velocidad del parpadeo, estancamiento de la lagrima bajo el lente, reducción de oxigenación de los tejidos, un cambio de aerobia a mas actividad metabólica anaeróbica de los tejidos con incremento de producción de acido láctico y adhesión selectiva de bacterias al LC. 31 Además, los desinfectantes de LC se contaminan con microorganismos no resistente a sus efectos de limpieza por esto se aumenta la probabilidad de tener mayor patogenicidad para la superficie ocular. Los LC y sus estuches son polímeros frecuentemente usados en la práctica clínica. El uso de los lentes de contacto a aumentado dramáticamente en los últimos años, por ejemplo, durante un periodo de 5 años (1987-1992) el número de usuarios americanos de LC se incremento de 18 millones a 24 millones. La mayor demanda de los usuarios fue el uso de LCB de uso programado o uso extendido. Los Lentes rígidos RGP son compuestos principalmente por un porcentaje variable del polímero silicona y de PMMA con o sin fluoruro o polímeros de estireno. Estos reemplazan a los LC duros antes usados, los cuales se fabricaban solo con PMMA. Las infecciones oculares asociadas al uso de LC no es un fenómeno reciente. En 1966 el NATION WIDE SURVEY reporto un paciente con queratitis severa con disminución de la visión, usuario de desinfectantes para LC con HCL. Otros dos usuarios adicionales de HCL, tuvieron queratitis por Pseudomona, se descubrieron en 1970 y en los dos casos el organismo aislado fue el mismo en los LCB. Con el incremento en 1970 de usuarios de LCB, las queratitis microbianas fueron causadas principalmente por bacterias Gram negativas contaminantes del LC o de las soluciones desinfectantes. Se sugirió entonces que estas contaminaciones en usuarios se debían a la inadecuada desinfección del lente, siendo esta el mayor grado de contribución a las infecciones. Todos los usuarios de LC tienden a tener un riesgo de infección corneal, sobre todo en usos excesivos; siendo este el mayor factor de riesgo en los usuarios 32 4.4.7.1 MICRORGANISMOS ASOCIADOS A LAS INFECCIONES OCULARES EN USUARIOS DE LC BACTERIAS: bacterias Gram positivas o Gram negativas generalmente P. Aeruginosa predomina en los casos de infección corneal asociado al uso de LC. La Serratia Marcensces y el Staphylococcus también predominan y son encontrados en infecciones con uso de LC. PROTOZOARIOS: La Acantamoeba, es una ameba pequeña que vive libremente con un ciclo de vida caracterizado por estadios de ameba y de quiste. Esta es comúnmente aislado en bordes como los de piscinas, bañeras, vasos, arena y cajas de arena y en el polvo de varias locaciones habitables. Aunque las infecciones corneales por ACANTAMOEBA, no se limita al uso de LC, la mayoría de casos encontrados casi en un 85% tienen un antecedente de uso de LC. Adicionalmente el uso de LCB programados o prolongados y RGP también se asocian con queratitis por ACANTAMOEBA. HONGOS: infecciones fúngicas en la cornea por uso de LC no es común, aunque todos los tipos de LC han sido asociados con queratitis Micoticas, pero los LCB para afaquia y terapéuticos, de uso extendido, son los más frecuentemente implicados. Los LCB de EW para la afaquia frecuentemente se asocian con hongos filamentosos patógenos (HYPHOMYCETES) mientras que los hongos levaduriformes son mas frecuentemente implicados en el uso de lentes terapéuticos blandos. ADHESION MICROBIANA Y FORMACION DE BIOFILM: Cualquier microorganismo puede causar una queratitis Microbiana. Sin embargo en muchos pacientes que no son usuarios de LC tiene que de alguna forma tener un antecedente de trauma que rompe la protección de la capa epitelial. 33 En usuarios de LC con queratitis ulcerativa, el antecedente de trauma en la historia, usualmente esta ausente. Una irritación espontanea o sensación de cuerpo extraño generalmente se intensifica persistiendo dolor, fotofobia, ojo rojo y disminución en la visión. La rapidez en el inicio de los síntomas y los hallazgos clínicos depende en gran medida de los mecanismos de patogenicidad que caracterizan al agente (puede ser la virulencia, invasivos, toxigenicidad y patogenicidad). La producción microbiana de un exopolimero pegajoso y mucoide facilita la formación del biofilm o bio capa, este es uno de los componentes más importantes de la patogénesis de la infección microbiana asociada a biopolimeros. El biofilm permite a la colonia microbiana establecer y persistir en superficies plásticas como los LC o en lugares de humedad. P. AERUGINOSA: Es un bacilo Gram negativo no fermentador, que se adapta para a crecer en ambientes acuáticos, porque puede fijar el nitrógeno y metabolizar el dióxido de carbono disuelto. La Pseudomona ssp. puede crecer en agua destilada y es un habitante universal de ambientes inanimados como fregaderos y bañeras; y en algunas tapas y botellas de agua. También esta presentes en piscinas en menor cantidad a pesar de la acción del cloro usado en ellas. Los LC pueden compararse con un ambiente de piscina. Muchas de las Pseudomonas que se inoculan, mueren por los componentes de los desinfectantes, pero otras se adhieren a las paredes plásticas formando un biofilm que las protege de los desinfectantes. Como en las piscinas, la adición de desinfectantes activos, puede limpiar el agua, de células bacterianas, pero con el tiempo, se forma el biofilm, con las bacterias que logran sobrevivir, liberando continuamente células de la biocapa en la solución, las cuales se replican en presencia de desinfectantes débiles. La Pseudomonas ssp. pueden adherirse a nuevos acumulo proteicos en el LCB mucho mas que en un RGP. 34 Así cuando los lentes entran en contacto con un ambiente contaminado pueden adherir bacterias a su superficie y transferir las células bacterianas a la superficie corneal cuando el lente es colocado en el ojo. SERRATIA MARCESCENS es un bacilo Gram negativo fermentador, que forma parte de la familia de las enterobacterias. Esta bacteria ha sido identificada en ulceras corneales alrededor de un 5% al 10%, como contaminante, de los sistemas de cuidado de los pacientes usuarios de LC. En un estudio de nueve pacientes con queratitis ulcerativas (todos usuarios de RGP y usando solución de limpieza con preservantes de clorhidrato) ocho de ellos tenían Serratia ssp. aislado de los LC y siete aislados de sus botellas de soluciones desinfectantes. La contaminación por S. Marcescens fue identificada en las botellas de desinfectantes con preservantes de clorhidrato en el 63% de los pacientes y en un 36% fue contaminada con 7 días de uso. Esto puede crear una infección en la superficie de los LC por adherencia y formación del biofilm, incrementando los casos de infección por este microorganismo. STAPHYLOCOCCUS : Ambos S. Aureus y S. Epidermidis, han sido aislados de los LC y han sido reportados en casos de queratitis por usuarios de LC. S. Epidermidis, es residente aeróbico de la flora ocular normal, por lo cual fácilmente puede adherirse o colonizar los LC. La producción de biofilm constituye un factor de virulencia en la infección asociada a biomateriales no oftálmicos. La adherencia de microorganismos a la superficie del lente mediante el polietileno se hace resistente a la acción de desinfección de las soluciones de la misma manera que la P. Aureginosa. ACANTAMOEBA: Dada la prevalencia de la ACANTAMOEBA en el ambiente humano, no nos sorprenden los casos de queratitis por Acantamoeba en pacientes usuarios de LC. Inicialmente la enfermedad fue mas común en 35 usuarios de LC de uso programado que limpiaban sus lentes con soluciones de no persevantes, preparaciones de solución salina hechas en casa con sin desinfección de calor adecuadas. La queratitis por Acantamoeba en usuarios de LC frecuentemente esta asociada con la presencia de estos parásitos contaminantes en los sistemas de limpieza con asociación a la contaminación bacteriana principalmente organismos Gram negativos. HONGOS: Mientras que la flora ocular normal esta compuesta en su mayoría por bacterias aeróbicas, la flora fúngica normal en el ojo es muy rara y solo se han reportado levaduras, nunca hongos filamentosos o miceliales. La mayoría de hongos aislados en el ojo son producto de la contaminación del ambiente. Estos hongos pueden propagarse a la superficie del lente de hidrogel mientras esta siendo usado, el cual puede evitar las soluciones desinfectantes y penetrar la matriz del LC. El uso de este lente infectado puede producir una irritación ocular o en el peor de los casos una ulcera corneal fúngica. La Cándida Albicans, una levadura que hace parte de la flora normal de piel y mucosas, se adhiere sin formar biofilm al polietileno de los LC y es más resistente a la acción de los desinfectantes que las bacterias. 36 5. METODOS Y MATERIALES 5.1 TIPO DE ESTUDIO Estudio de tipo descriptivo que es el encargado de realizar una descripción de algún problema registrando características de la afección. Se efectúan mediciones de tipo pruebas microbiológicas en grupos de lentes de contacto blandos ya usados, se establecen frecuencias y cuando es posible se usan algunas herramientas estadísticas para retratar mejor la situación. 5.2 MUESTRA Se evaluaron 100 lentes de contacto blandos ya usados; 25 de cada clasificación según la FDA para comparaciones. 5.3 METODO Se utilizo una ficha técnica (anexo 1) para recolectar la información particular de cada lente y los resultados obtenidos tanto en el examen cualitativo como microbiológico. EXAMEN CUALITATIVO PARA DETERMIANR EL TIPO DE DEPÓSITO Se utilizo una Lámpara de Hendidura marca Burton en las instalaciones de clínica del instituto de investigaciones optométricas de la Universidad de la Salle -Facultad Optometría-. Los lentes fueron observados en la lámpara TAL Y COMO provenían del lugar de origen, con líquido de los pacientes o de la óptica, se revisaron los lentes con aumento de 10X, según los criterios de RUDKO, para su análisis. 37 El examen se realizo en condiciones de esterilidad y fueron colocados nuevamente en su estuche, Para su manipulación se utilizaron escobillones previamente esterilizados y guantes desechables. EXAMEN MICROBIOLOGICO Se realizaron en el laboratorio de La Universidad de la Salle en la sede centro, donde se hicieron los cultivos y frotis de gran. El examen directo con solución salina y azul de Lactofenol y la lectura del Gram se hizo en el laboratorio de investigaciones de la Universidad de La Salle de la facultad de optometría. MEDIOS DE CULTIVOS Se utilizo un medio solido base de agar sangre. Para la preparación de los medios, inicialmente se esterilizo todo el material de vidrio ha utilizar. El material se envolvió en papel Kraft así: Placas de Petri 1. colocar las placas de Petri en grupos de 3, con la tapa hacia abajo 2. envolverlas con papel craft siguiendo las instrucciones indicadas 3. anotar si es necesario datos para identificación del material 4. colocar la cinta de verificación del tiempo de esterilización La mayoría de los medios de cultivo están disponibles comercialmente en polvo 38 Se peso y se hidrata en agua destilada, de acuerdo a la cantidad requerida en un elermeyer de vidrio, se coloco un tapón de gasa cubierto con papel de aluminio y se procedió ha esterilizar, en autoclave junto con las cajas de petri. La esterilización en autoclave genera calor en forma de vapor en saturación y a presión Es el agente más práctico para esterilizar ya que el vapor a presión proporciona temperaturas superiores a las que se obtienen a presión normal. Las autoclaves son ollas a presión donde se regula la presión y el tiempo. En general su emplean a una presión de vapor de una atmósfera por encima de la atmosférica, lo que corresponde a una temperatura de 121°C. Para este estudio se esterilizo a 121°C por 30 minutos y se espero una hora y cuarenta y cinco minutos para abrir la autoclave Una vez se saco el medio de la autoclave se dejo enfriar la una temperatura de 37-39°C y se adiciono sangre bovina extraída en condiciones estériles y se homogenizo gentilmente. Las cajas estériles se sacaron de su empaque, se colocaron sobre el mesón previamente desinfectado y con el mechero se procedió a servir el medio en las cajas petri. Una vez se gelifico el agar las cajas se llevaron a incubar a 37°C por 18 horas para realizar la prueba de esterilidad. Después las cajas se conservaron en nevera a 18°C hasta su uso por un tiempo menor de 24 horas. 39 SIEMBRA Y CULTIVO Con el mechero prendido, cada lente de contacto se retiro del estuche con un escobillón estéril y se realizo la siembra masiva frotando suavemente el lente en contacto en el medio, con ayuda del escobillón o el asa redonda previamente esterilizada. Los medios así sembrados se llevaron a incubar a 37°C en condiciones aeróbicas por 24 horas. Al cabo de este tiempo se observo el crecimiento bacteriano y se identificaron las colonias macro y microscópicamente con la coloración de Gram (ver técnica abajo). Cada tipo de colonia diferenciada macroscópicamente, se tomo con asa recta, se realizo el frotis y coloración de Gram. Lo anterior para cada uno de los cultivos de los lentes. Las láminas se observaron al microscopio en 10X y 100X con aceite de inmersión. Se reporto la presencia de bacterias (forma y coloración, Gram positiva o Gram negativa). Cultivos de LCB FROTIS DE GRAM Una vez se cultivo el lente, se realizo el frotis directo del Lente para colorea con Gram Preparación de frotis Se toma el LCB con un escobillón esterilizado y se realizo el frotis en la lámina tratando de que esta quede realmente impregnada. Se fijo tres veces a la llama del mechero y realizar tinción de Gram. 40 Coloración de Gram Colocar el porta sobre un soporte para tinciones Cubrir con solución de cristal violeta y dejar actuar 1 minuto Lavar suavemente con agua de la canilla Cubrir con lugol y dejar actuar 1 min. Lavar de la misma manera Cubrir con alcohol de acetona 30 segundos moviendo suavemente la lámina. Lavado con agua Cubrir con fucina dejar actuar 1 min. Lavar y secar Las láminas se observaron al microscopio en 10X y 100X con aceite de inmersión. Se reporto la presencia de bacterias (forma y coloración, Garma positiva o Gram negativa), levaduras o hifas. EXAMEN EN FRESCO PARA HONGOS Después del cultivo y frotis directo para Gram, se realizaron preparaciones entre porta y cubreobjetos así: el LCB se coloco directamente en el portaobjeto solución salina y se coloco el y se adiciono una gota de cubreobjetos. La lectura se realizo en 10X y 40X para establecer la presencia de hifas o levaduras. Para confirmar se adiciono Azul de Lactofenol al 10 % y se repitió nuevamente la lectura. 41 6.4 ANALISIS ESTADISTICO VARIABLES VARIABLE TIPO DE CATEGORIA CRITERIO CATEGORIA 1 RUDKO VARIABLES INDEPENDIENTES CLASE DE CATEGORICA DEPOSITO CATEGORIA 2 CATEGORIA 3 CATEGORIA 4 GRUPO DE LCB CATEGORICA GRUPO 1 FDA GRUPO 2 GRUPO 3 GRUPO 4 DEPENDIENTES DEPOSITOS MICROBIOLOGICOS CATEGORICA BACTERIAS COLORACION *GRAM + DE GRAM *GRAM HONGOS OBSERVACION *HIFAS BAJO *LEVADURAS MICROSCOPIO 42 6. RESULTADOS 6.1 RESULTADOS ESTADISTICOS CLASIFICACION DE LOS LCB EN GRUPOS SEGÚN LA FDA Se evaluaron en total 100 lentes de contacto blandos los cuales se dividieron según la clasificación dado en grupos por la FDA (food and drugs administration) para comparar la adherencia de microorganismos. Como se aprecia en la figura 1 tabla 1, el mayor grupo de LCB adquiridos esta presente en los pacientes y no en lentes de las ópticas. Figura 1. Estadísticas de clasificación en grupos para LCB por la FDA PACIENTES OPTICA GRUPO I 22 3 GRUPO II 14 18 GRUPO III 16 9 GRUPO IV 20 5 Tabla 1. Estadísticas de clasificación en grupos para LCB dada por la FDA 43 CATEGORIZACIÓN DE RUDKO (CONTACT LENSES COURSE - IACLE) EN FORMA CUALITATIVA DE LOS DEPÓSITOS Se encontró que el mayor criterio utilizado fue la categoría 2 como se aprecia en la figura 2 tabla 2 la categoría 1 anteriormente descrita y una menor demanda en la categoría 3. Figura 2. Estadísticas para Criterios de Rudko. PACIENTES OPTICA Categoría 1 31 7 Categoría 2 39 16 Categoría 3 0 0 Categoría 4 2 5 Tabla 2. Estadísticas para Criterios de Rudko. 44 RESULTADOS DE HISTORIAL DE LOS LENTES DE CONTACTO 1. Horarios de uso: Se encontró que los horarios de uso entre los LCB de pacientes existía un máximo de 10h y un mínimo de 2 horas, y el promedio de uso fue de 6 -8 horas diarias. 2. Tiempo de reemplazo: Entre los LCB adquiridos de pacientes 28 eran de uso programado y su mayor tiempo de reemplazo varia entre 3-4 meses y 45 de uso extendido y su mayor tiempo de reemplazo varia entre 8y16 meses. Para los lentes de prueba de las ópticas se recolectaron 12 LCB de uso programado y 15 LCB de uso extendido y los tiempos de reemplazo respectivos varían igual que en el tiempo de reemplazo de los pacientes. 3. Ciudades origen LCB: Se encontró que la mayoría de LCB provenían de Bogotá y la minoría de Fusagasuga. Existen variaciones entre Cali, Medellín e Ibagué pero sin ninguna importancia significativa. 45 EXAMEN MICROBIOLOGICO De los LCB usados el 79% (57/72) estaban contaminados con bacterias, el 13.8% con hongos (10/72) y el 22.2% fueron negativos (16/72). De los LCB de las ópticas o de prueba 75%(21/28) estaban contaminados con bacterias, el 7.1% con hongos (2/28) y el 17.8% fueron negativos (5/28). Figura 7. Estadística de microorganismos en los LCB PACIENTES OPTICA BACTERIAS 79% 75% HONGOS 13.8% 7.1% NEGATIVOS 22.2% 17.8% Tabla 7. Estadísticas de microorganismos en los LCB 46 CULTIVOS MICROBIOLOGICOS El 79% (57/72) de los cultivos de los LCB de pacientes fue positivo y el 22.2% (16/72) fue negativo, en el caso de los cultivos obtenidos de los LCB provenientes de las ópticas el 75% (21/28) fueron positivos y el 17.8% (5/28) negativos Figura 8. Estadísticas de cultivos en agar sangre de los LCB PACIENTES OPTICA POSITIVOS 79% 75% NEGATIVOS 22% 18% Tabla 8. Estadísticas de cultivos en agar sangre de los LCB ESTA DA IGUAL QUE LA ANTERIOR LA ELIMINO?OJOJOJOJOJO 47 PORCENTAJE DE BACTERIAS GRAM POSITIVAS, GRAM NEGATIVAS Y LEVADURAS OBTENIDOS EN LOS CULTIVOS POSITVOS DE LCB DE PACIENTES Y OPTICAS Al 79% (57/72) de los cultivos positivos realizamos coloración de Gram para pacientes y obtuvimos que el 85.9%(49/57) para Gran negativo, el 8.7%(5/57) para Gram positivos y el 10.5% (6/57) para levaduras. Para lentes de prueba de ópticas se encontró que el 61.9%(13/21) para Gram negativas, el 4.7% (1/21) para Gram positivas y el 4.7% (1/21) para levaduras. Figura 9. Estadística de coloración de Gram para muestras de cultivos realizados a los LCB. PACIENTES OPTICA GRAM + 7% 4% GRAM ‐ 74% 75% LEVADURAS 8% 4% Tabla 9. Estadística de coloración de Gram para muestras de cultivos realizados a los LCB. 48 BACTERIAS SEGÚN LA FORMA En general, según forma y coloración de Gram, la mayoría de las bacterias contaminantes de los LCB de paciente y ópticas fueron los bacilos Gram negativos como se observa en la figura 10 y tabla 10. Figura 10. Estadística de Gram según su forma para describir Bacterias en la coloración de Gram y su análisis bajo microscopio. COCOS COCO BACILOS BACILOS DIPLOBACILOS Pacientes Ópticas 0 15 46 2 0 7 17 0 Tabla 10. Estadística de gram según su forma para describir bacterias en la coloración de gram y su análisis bajo microscopio. si se observaron solo bacilos gram negativos no tiene que especificarse, no entiendo como se explica esto solo sin saber que tipo gram negativas 49 DESCRIPCION DE HONGOS Para identificación de hongos se dispuso los LCB en las láminas bajo laminillas para observación en microscopio y determinar la presencia de hifas o levaduras en los mismos. Se encontró que el 13.8% (10/72) para LCB de pacientes presentaron hifas y el 8.3% (6/28) presentaron levaduras. Para los lentes de óptica el 7.1% (2/28) presentaron hifas y el 3.2% (1/28) presentaron levaduras descrito en la figura 13 y tabla 13. Figura 13. Estadística de observación bajo microscopio para hongos. PACIENTES OPTICAS HIFAS 13.8% 7.1% LEVADURAS 8.3% 3.5% Tabla 13. Estadística de observación bajo microscopio para hongos. 50 DEPOSITOS CATEGIRAS DE RUDKO Y CONTAMINACION Se realizo una comparación entre el deposito encontrado según criterios de Rudko y de estos cuales dieron contaminación. Encontramos que el 44.7% (17/38) para la categoría 1 de Rudko, el 100% (55/55) para la categoría 2, el 0% (0/0) para la categoría 3 y el 100% (7/7) para la categoría 4 como se muestra en la figura y tabla. Fig. % CATEGORIA CATEGORIA CATEGORIA 3 CATEGORIA 4 1 2 45% 100% 0% 100% Tabla 51 CLASIFICACION DE FDA COMPARADA CON LAS CATEGORIAS DE RUDKO Se realizo comparación entre los grupos dado por la FDA y los criterios de Rudko para valorar si existen similitudes entre el contenido acuoso e ionicidad en los depósitos de la superficie del lente. Se encontró que el 65.7% (25/38) del grupo 1 presento depósitos, el 45%(25/55) para el grupo 2, el 0% (0/25) para el grupo 3 y el 28% (7/25) para el grupo 4, explicados en la figura y tabla . GRUPO FDA Vs DEPOSITOS RUDKO 70% 60% 60% 60% 56% 60% 50% 40% 40% 32% CATEGORIA 1 36% 32% CATEGORIA 2 30% CATEGORIA 3 16% 20% CATEGORIA 4 8% 10% 0% 0% 0% 0% 0% 0% 0% GRUPO 1 GRUPO 2 GRUPO 3 GRUPO 4 Figura 14. Comparación entre criterios de Rudko y la clasificación de la FDA. CATEGORIA 1 CATEGORI CATEGORIA 3 CATEGORIA 4 A 2 GRUPO 1 32% 60% 0% 0% GRUPO 2 32% 56% 0% 16% GRUPO 3 40% 60% 0% 8% GRUPO 4 36% 60% 0% 0% Tabla 14. Comparación entre criterios de Rudko y la clasificación de la FDA. CLASIFICACION DE FDA COMPARADA CON LA CONTAMINACION 52 El resultado mas importante que es nuestro objetivo de la investigación es la comparación entre el grupo dado por la FDA y la contaminación existente en ellos. Se encontró que el 80% (20/25) del grupo 1 presento bacterias, el 8% (2/25) presento hongos y el 8% (2/25) presentaron contaminación mixta. Para el grupo 2 el 76% (19/25) presento bacterias, el 4% (1/25) presentaron hongos y el 12% (3/25) presentaron contaminación mixta. Para el grupo 3 el 68% (17/25) presento bacterias, el 20% (5/25) presento hongos y el 12% (3/25) presentaron contaminación mixta y finalmente para el grupo 4 el 92% (23/25) presento bacterias, el 16% (4/25) presento hongos y el 16% (4/25) presentaron contaminación mixta. Figura 15. Comparación entre el grupo FDA y la contaminación encontrada. BACTERIAS HONGOS MIXTOS GRUPO 1 80% 8% 8% GRUPO 2 76% 4% 12% GRUPO 3 68% 20% 12% GRUPO 4 92% 16% 16% Tabla 15. Comparación entre el grupo FDA y la contaminación encontrada RESULTADOS 53 1. Se encontró mayor depósitos bacterianos que fúngicos en los LCB utilizados sin ninguna diferencia significativa entre los grupos de la FDA. 2. Según los criterios de Rudko el criterio 2 fue el más utilizado el cual describe que existen depósitos visibles en lente hidratado con magnificación de 15x. 3. La frecuencia de adherencia para los diferentes grupos no tuvo una diferencia significativa, ya que para la adherencia de bacterias no se encontró que alguno de los grupos tuviera mayor demanda, para hongos existe mayor adherencia en el grupo 4 que en el grupo 1, pero sin ninguna diferencia mayor entre los grupos 2 y 3. en cuanto a adherencia mixta se encontró que el grupo 3 presenta mayoría pero no tanta para que sea significativa entre los demás grupos. 54 DISCUSION En los últimos años se ha popularizado notablemente el empleo de lentes de contacto, fundamentalmente los lentes de contacto blandos empleados en un 89% de los casos (1). Los lentes de contacto blandos están fabricados con una combinación de diversos polímeros (hidrogeles) con contenidos variables de agua que oscilan entre el 35% y el 80%. Estos polímeros poseen propiedades físicas, químicas y estructurales diferentes, de forma que dotan al lente con características específicas de hidratación, porosidad, transmisibilidad al oxígeno, humectabilidad en la superficie, durabilidad, etc. Atendiendo a la FDA los lentes de contacto blandos se clasifican en cuatro grupos según el contenido en agua e ionicidad del polímero. Se han estudiad los riesgos relativos de infecciones oculares con el uso de distintos lentes de contacto y como conclusiones se dice que el riesgo es mayor en lentes de contacto blandas que en rígidas y particularmente en las lentes de empleo nocturno (9,10). Entre las infecciones oculares que mas encontramos están las queratitis ulcerativas, ulceras corneales y abrasiones en la cornea con un porcentaje bastante comprometedor de estas en usuarios de LCB. Los lentes de contacto sirven como sustrato pasivo pero constante para la adherencia, colonización y crecimiento bacteriano en el epitelio corneal dañado. Desde un punto de vista microbiológico los lentes de contacto están colonizados en general por un número inferior a 10 UFC (Unidades formadoras de colonias)/lente (4). Pseudomonas Aeruginosa es el patógeno más habitual en úlceras provocadas por lentes de contacto, pero desde hace algún tiempo se ha observado un incremento en la incidencia de queratitis debidas a otros microorganismos como los estafilococos coagulasa negativos (5,6), donde se incluye Staphylococcus Epidermidis. 55 S. Epidermidis es una bacteria con capacidad de adherirse y acumularse en la superficie inerte de lentes de contacto (7,8), hecho que facilita la colonización y la infección (7,8). La contaminación de los lentes de contacto se atribuye en la mayoría de los casos a la manipulación hecha por el usuario, los mecanismos de limpieza para bacterias oculares y de limpieza para los lentes son eficaces en cierta manera para evitar la infección; a veces nos encontramos que estos mismos crean una infección aun mayor. Estudios demuestran que las soluciones de limpieza utilizadas para los LCB son reservorios aun mayores de microorganismos (12). la mayoría de estudios estadísticos concluyen que el riesgo de contaminación aumenta en lentes blandas de uso permanente y en lentes con depósitos. (13) Fleiszig (8) comparó la adherencia de S. Epidermidis a diversos tipos de LC y explica que existe una adhesina específica de S. Epidermidis sobre lentes de contacto, de modo que si existieran moléculas capaces de bloquear esta adhesina se podría reducir la adherencia bacteriana. Galliani (11) llama la atención sobre el hecho de que la producción de adhesinas es variable en las diferentes cepas bacterianas y por tanto aparecen diferencias en cuanto a intensidad de la adhesión. Cuando se han comparado entre sí los 4 grupos de la FDA para ver la influencia de la ionicidad y la hidratación hemos hallado pocas diferencias estadísticamente significativas. En general se observa adherencias bacterianas mayor en las lentes de contacto de bajo contenido en agua (grupos 1 y 3) y en las no iónicas. Los resultados obtenidos por otros autores son variables. Fleiszig (8) señala que la adhesión de S. Epidermidis a lentes de contacto no depende únicamente de las propiedades de cada material, sino que intervienen otros factores. En su estudio se observa una diferente colonización de S. Epidermidis a lentes de contacto recién extraídas de su envase estéril y tras lavado de las mismas. En LC nada más extraídas de su envase la adherencia era significativamente mayor a Polymacon (en solución salina balanceada con 0,1% de alcohol polivinílico) que a Etafilcón A (en solución salina con borato). 56 Sin embargo, tras lavado completo de los lentes la adhesión de S. Epidermidis a Polymacon resultó ser significativamente menor. Presumiblemente el alcohol polivinílico podría favorecer la adhesividad bacteriana. Estos resultados indican que el número de bacterias potencialmente patógenas vehiculadas por el LC, podrían reducirse con una selección adecuada de la solución de envasado de la lente. Gopinathan (13) estudió "in vivo" la contaminación de lentes de contacto de hidrogel de alta y baja hidratación y no halló diferencias significativas. Los mayores contaminantes de los lentes eran estafilococos coagulasa negativos y en su investigación comprobó que el tipo de material, el contenido en agua y la carga iónica no parecían tener influencia en relación con la colonización bacteriana. La falta de coincidencia entre los resultados "in vivo" e "in vitro" no permite sacar conclusiones concretas sobre la influencia del material en la contaminación bacteriana y lleva a considerar otros factores del material como la elasticidad, la porosidad, las impurezas y las marcas. El método de fabricación de los LC más que el propio material parece el parámetro más determinante en la adherencia, ya que las lentes de contacto más adherentes son las torneadas y las menos adherentes las moldeadas blandas que aseguran una superficie menos rugosa y más homogénea.(14) La comparación entre sí de la adherencia estafilocócica en los cuatro grupos de la FDA mostró que al comparar los grupos 1 y 2 no se encontraron diferencias significativas. La comparación de los grupos 1 y 3 dio adherencia significativamente mayor de la cepa bacteriana con el grupo 1. No hubo diferencias significativas en cuanto a adherencia bacteriana al comparar los grupos 1 y 4, ni tampoco al comparar los grupos 2 y 3 ni 2 y 4. Al comparar los grupos 3 y 4 aparece muy significativa la adherencia de S. Epidermidis al grupo 3. (14) 57 En nuestro estudio encontramos que entre 72 LCB de usuarios y 28 LCB de ópticas como lentes de prueba para un total de 100 lentes analizados; el mayor numero de microorganismos depositados en lo LCB fueron bacterias ya que de los LCB de usuarios el 79% (57/72) estaban contaminados con bacterias, el 13.8% con hongos (10/72) y el 22.2% fueron negativos (16/72). De los LCB de las ópticas o de prueba 75%(21/28) estaban contaminados con bacterias, el 7.1% con hongos (2/28) y el 17.8% fueron negativos (5/28). También encontramos en cuanto a bacterias el 79% (57/72) de los cultivos positivos realizamos coloración de Gram para pacientes y obtuvimos que el 85.9%(49/57) para Gran negativo, el 8.7%(5/57) para Gram positivos y el 10.5% (6/57) para levaduras. Para lentes de prueba de ópticas se encontró que el 61.9%(13/21) para Gram negativas, el 4.7% (1/21) para Gram positivas y el 4.7% (1/21) para levaduras. Para examinar hongos determinamos la presencia de hifas o levaduras en los mismos. Se encontró que el 13.8% (10/72) para LCB de pacientes presentaron hifas y el 8.3% (6/28) presentaron levaduras. Para los lentes de óptica el 7.1% (2/28) presentaron hifas y el 3.2% (1/28) presentaron levaduras. Y en cuanto a grupos de la FDA contra la contaminación encontrada siendo este nuestro objetivo principal del estudio observamos que se encontró que el 80% (20/25) del grupo 1 presento bacterias, el 8% (2/25) presento hongos y el 8% (2/25) presentaron contaminación mixta. Para el grupo 2 el 76% (19/25) presento bacterias, el 4% (1/25) presentaron hongos y el 12% (3/25) presentaron contaminación mixta. Para el grupo 3 el 68% (17/25) presento bacterias, el 20% (5/25) presento hongos y el 12% (3/25) presentaron contaminación mixta y finalmente para el grupo 4 el 92% (23/25) presento bacterias, el 16% (4/25) presento hongos y el 16% (4/25) presentaron contaminación mixta. 58 Otra comparación que realizamos fue determinar por medio de criterios cualitativos en especial RUDKO que fue el que utilizamos, la frecuencia entre los depósitos con simple examen valorativo por medio de una lámpara de hendidura de los LCB y su contaminación posterior. Encontramos que existe una cierta afinidad en los lentes que obtuvieron depósitos en la superficie con la contaminación valorada por medio de cultivos microbiológicos. Se encontró que el 44.7% (17/38) para la categoría 1 de Rudko, el 100% (55/55) para la categoría 2, el 0% (0/0) para la categoría 3 y el 100% (7/7) para la categoría 4. Finalmente podemos analizar que entre la contaminación de los grupos clasificados según la FDA que entre los grupos 1 y 4 existe los mayores depósitos microbiológicos que entre el grupo 2 y 3, pero sin ninguna diferencia significativa. Entonces la adherencia bacteriana no esta dada por el contenido acuoso alto o bajo ni la presencia de ionicidad o ausencia de ella. En cuanto a depósitos microbiológicos encontramos una mayoría en bacterias que en hongos, y que la presencia de bacterias son gram negativas y de forma en bacilos y cocobacilos en su mayoría por lo que pensaríamos que los microorganismos infecciosos pueden estar entre Pseudomona Aeruginosa, Serratia Marcensces, Moraxella Lacunata, lo cual nos hace descartar organismos gram positivos ya que se encuentran en baja cantidad. Y podemos enfocarnos mas en la parte de depósitos en los LCB que atraen a los microorganismos ya que de esto se han realizados estudios que difieren de respuestas creando incertidumbre si esto realmente esta relacionado. BIBLIOGRAFIA 59 2. PRESCOTT, Lansing; HARLEY, John y KLEIN, Donald. (2004) Microbiología. Editorial McGraw Hill. Quinta edición. Traducción de MICROBIOLOGY en ingles. ESPAÑA 3. SILBERT, Joel. ANTERIOR SEGMENT COMPLICATION OF CONTACT LENS WEAR. (2000). Editorial Butterworth Heinemann. Segunda edición. CANADA. 4. DURAN DE LA COLINA, Juan A. COMPLICACIONES DE LAS LENTES DE CONTACTO. LXXIV PONENCIA OFICIAL DE LA SOCIEDAD ESPAÑOLA DE OFTALMOLOGIA 1998. Editorial Tecnimedia. MadridEspaña 5. TOMLINSON, Alan. COMPLICATIONS OF CONTACT LENS WEAR. Editorial Mosby. Año 1992 6. Wilhelmus KR. MICROBIAL KERATITIS ASSOCIATED WITH CONTACT LENS WEAR. De CONTACT LENSES. The CLAO guide. 1995. VOLUMEN III, pp 19-48 7. Pepose, A. OCULAR INFECTION AND IMMUNITY. Editorial de . Capitulos 14 y 16. 8. Sweeney, Deborah y colaboradores. MICROBIAL COLONIZATION OF SOFT CONTACT LENSES OVER TIME. Optometry and Vision Science. Febrero 2001. 9. Taylor, Rebecca y colaboradores. MODULATION OF BACTERIAL ADHESION TO HYDROGEL CONTACT LENSES BY ALBUMIN. Optometry and vision Science. Enero 1998. 60 10. Willcox, Mark y colaboradores. POTENCIAL SOURCES OF BACTERIA THAT ARE ISOLATED FROM CONTACT LENSES DURING WEAR. Optometry and Vision Science. Diciembre de 1997. 11. Iskeleli, Gûzin y colaboradores. MICROBIOLOGIC EVALUATION OF FREQUENT-REPLACEMENT SOFT CONTACT LENSES. The CLAO journal. Julio de 2002 12. Hart, Dean y colaboradores. MICROBIAL CONTAMINATIN OF HYDROPHILIC CONTACT LENSES: QUANTITATION AND IDENTIFICATION OF MICROORGANISMS ASSOCIATED WITH CONTACT LENSES WHILE ON THE EYE. Optometry and Vision Science. Julio 1993. 13. Jones, Lyndon y colaboradores. LIPID AND PROTEIN DEPOSITION OF N-VINYL PYRROLIDONE-CONTAINING GROUP II AND GROUP IV FREQUENT REPLACEMENT CONTACT LENSES. The CLAO journal. Abril 1997. 14. Midelfart, Jana y colaboradores. MICROBIAL CONTAMINATION OF CONTACT LENSES CASES AMONG MEDICAL STUDENTS. The CLAO journal. Enero 1996. 15. Hurtado, I. y colaboradores. IDENTIFICATION OF FUNGI GROWING WITHIN SOFT CONTACT LENSES: A REPORT FROM THE NEOTROPICS. The CLAO journal. Enero 1995. 16. Lipener, Cesar y colaboradores. BACTERIAL CONTAMINATION IN SOFT CONTACT LENSES WEARERS. The CLAO journal. Abril 1995. 61 17. Alongui, Salvatore y colaboradores. BACTERIAL LOAD AND PROTEIN DEPOSITS ON 15-DAY Vs 1-DAY DISPOSABLE HYDROPHILIC CONTACT LENSES. Cornea. Enero 1998 18. Franklin, Valerie y colaboradores. EARLY DEPOSITION TRENDS ON GROUP I (POLYMACON AND TETRAFILCON A) AND GROUP III (BUFILCON A) MATERIALS. The CLAO journal. Octubre 1991. 19. Kelly, Lisa. Xu, Lijun. THE EFFECT OF ACANTHAMOEBA CONCENTRATION ON ADHERENCE TO FOUR TYPES OF UNWORN SOFT CONTACT LENSES. The CLAO journal. Enero 1995 20. Lucas, A y colaboradores. EFFICACY OF A CONTACT LENS CLEANING DEVICE AND ITS ANHANCEMENT OF THE PERFORMANCE OF CONTACT LENS CARE PRODUCTS. Ophthalmology. Enero 2000 21. Willcox, P y colaboradores. HAEMOPHILUS INFLUENZAE ADHERENT TO CONTACT LENS ASSOCIATED. Journal of Clinical Microbiology. Octubre 1996. 22. Gutierrez, D. THE BACTERIAL FLORA OF THE HELTHY EYE. The CLAO journal. Octubre 1991 ANEXO 1. FICHA TECNICA DE RECOLECCION DE DATOS FECHA LLEGADA DEL LENTE ____________________________ 62 CIUDAD ________________ EDAD DEL PTE / OPTICA ___________ OCUPACION DEL PACIENTE _________________________ HORAS HABITUALES DE USO / TIEMPO DE USO - _______________________ TIEMPO DE REEMPLAZO DE LOS LENTES _______________________ CLASIFICAION FDA GRUPO DEL LCB GRUPO I _______ GRUPO II _______ GRUPO III _______ GRUPO IV _______ CLASIFICACION RUDKO: NUMERAL 1: ________________________ NUMERAL2:_________________________ NUMERAL 3: ________________________ NUMERAL 4: ________________________ NUMERAL 5: _________________________ MICROBIOLOGIA QUE MICROORGANISMO SE ENCONTRO: BACTERIA ________ HONGO ________ DESCRIPCIÓN DE LA BACTERIA: FORMA___________________________________ GRAM___________________________________ CANTIDAD________________________________ DESCRIPCIÓN DEL HONGO: HIFAS______ LEVADURA ______ 63 ANEXO 2. RESULTADOS DE DATOS LCB Y CRITERIOS DE RUDKO OPTICAS LCB CIUDAD OCUPACION DEL PTE TIEMPO DE REEMPLAZO DEL LENTE (APROX) GRUPO FDA MICROORGANISMO 7 BOGOTA OPTICA * 1 AÑO EN USO 2 BACTERIA CLASIFICACION RUDKO 2 8 BOGOTA OPTICA * 1 AÑO EN USO 4 BACTERIA 2 9 BOGOTA OPTICA * 1 ½ AÑO EN USO 4 BACTERIA 2 10 BOGOTA OPTICA * 1 ½ AÑO EN USO 3 NEGATIVO 1 11 IBAGUE OPTICA * 1 AÑO EN USO 2 BACTERIA 4 12 IBAGUE OPTICA * 1 AÑO EN USO 3 BACTERIA 2 13 IBAGUE OPTICA * 4 MESES EN USO 1 BACTERIA 2 14 IBAGUE OPTICA * 4 MESES EN USO 3 BACTERIA 2 15 BOGOTA OPTICA * 8 MESES EN USO 3 BACTERIA 4 16 BOGOTA OPTICA * 8 MESES EN USO 3 NEGATIVO 1 17 CALI OPTICA * 1 AÑO EN USO 2 NEGATIVO 1 18 CALI OPTICA * 1 AÑO EN USO 2 BACTERIA 2 64 LCB CIUDAD OCUPACION DEL PTE GRUPO FDA MICROORGANISMO OPTICA * TIEMPO DE REEMPLAZO DEL LENTE (APROX) 2 AÑO EN USO 3 NEGATIVO CLASIFICACION RUDKO 1 19 CALI 20 CALI OPTICA * 2 AÑO EN USO 4 BACTERIA 2 29 BOGOTA OPTICA * 2 AÑO EN USO 4 NEGATIVO 1 30 BOGOTA OPTICA * 2 AÑO EN USO 4 NEGATIVO 1 31 MEDELLIN OPTICA * 2 AÑO EN USO 2 BACTERIA 2 32 MEDELLIN OPTICA * 2 AÑO EN USO 2 BACTERIA 2 33 BOGOTA OPTICA * 1 AÑO EN USO 2 BACTERIA 2 34 BOGOTA OPTICA * 1 AÑO EN USO 2 BACTERIA 4 39 IBAGUE OPTICA * 1 ½ AÑO EN USO 3 BACTERIA 2 50 MEDELLIN OPTICA * 1 AÑO EN USO 1 BACTERIA 2 51 MEDELLIN OPTICA * 1 AÑO EN USO 1 BACTERIA 2 92 BOGOTA OPTICA * 1 AÑO EN USO 3 BACTERIA 1 65 LCB CIUDAD OCUPACION DEL PTE GRUPO FDA MICROORGANISMO OPTICA * TIEMPO DE REEMPLAZO DEL LENTE (APROX) 1 AÑO EN USO 3 BACTERIA CLASIFICACION RUDKO 2 97 BOGOTA IIO 98 BOGOTA IIO OPTICA * 1 AÑO EN USO 2 BACTERIA 4 99 BOGOTA IIO OPTICA * 1 AÑO EN USO 2 BACTERIA 4 100 BOGOTA IIO OPTICA * 1 AÑO EN USO 2 BACTERIA 2 * NO SE ESPECIFICA EL NOMBRE DE LA OPTICA POR CONSENTIMIENTO DE ELLOS 66 PACIENTES LCB CIUDAD OCUPACION DEL PTE BOGOTA EDAD DEL PTE 25 A TIEMPO DE REEMPLAZO DEL LENTE (APROX) 2 MESES EN USO GRUPO FDA ABOGADA HORAS HABITUALES DE USO +/- 8 H OCASIONAL 1 2 BOGOTA 3 MICROORGANISMO CLASIFICACION RUDKO 3 BACTERIA 2 25 A ABOGADA +/- 8 H OCASIONAL 2 MESES EN USO 3 BACTERIA 2 MEDELLIN 25 A ESTUDIANTE +/- 4 H 3 MESES EN USO 3 BACTERIA 2 4 MEDELLIN 25 A ESTUDIANTE +/-4H 3 MESES EN USO 3 BACTERIA 4 5 BOGOTA 23 A ARQUITECTO +/- 8H 3 MESES EN USO 4 BACTERIA 2 6 BOGOTA 23 A ARQUITECTO +/- 8H 3 MESES EN USO 4 BACTERIA 2 21 BOGOTA 50 A PENSIONADO +/- 6 H 3 MESES EN USO 4 BACTERIA 2 22 BOGOTA 50 A PENSIONADO +/- 6 H 3 MESES EN USO 4 BACTERIA 4 23 CALI 35 A PUBLICISTA +/- 8H 4 MESES EN USO 3 NEGATIVO 1 24 CALI 35 A PUBLICISTA +/- 8H 4 MESES EN USO 3 NEGATIVO 1 25 CALI 37 A PUBLICISTA +/- 8H 4 MESES EN USO 3 BACTERIA 2 26 CALI 37 A PUBLICISTA +/- 8H 4 MESES EN USO 3 BACTERIA 1 67 LCB CIUDAD IBAGUE EDAD DEL PTE 20 A 27 28 IBAGUE 35 OCUPACION DEL PTE TIEMPO DE REEMPLAZO DEL LENTE (APROX) 5 MESES EN USO GRUPO FDA ESTUDIANTE HORAS HABITUALES DE USO +/- 6H MICROORGANISMO CLASIFICACION RUDKO 2 BACTERIA 1 20 A ESTUDIANTE +/- 6H 5 MESES EN USO 2 BACTERIA 2 IBAGUE 10 A ESTUDIANTE +/- 8 H 5 MESES EN USO 1 BACTERIA 2 36 IABGUE 10 A ESTUDIANTE +/- 8 H 5 MESES EN USO 1 BACTERIA 1 37 BOGOTA 28 A PSICOLOGA +/- 8H 4 MESES EN USO 2 BACTERIA 1 38 BOGOTA 28 A PSICOLOGA +/- 8H 4 MESES EN USO 2 BACTERIA 1 40 IBAGUE 20 A ESTUDIANTE +/- 6 H 2 MESES EN USO 2 NEGATIVO 1 41 IBAGUE 20 A ESTUDIANTE +/- 6 H 2 MESES EN USO 2 NEGATIVO 1 42 BOGOTA 18 A ESTUDIANTE +/- 6H 3 MESES EN USO 3 NEGATIVO 1 43 BOGOTA 18 A ESTUDIANTE +/- 6H 3 MESES EN USO 3 NEGATIVO 1 44 IBAGUE 32 A ARQUITECTO +/- 8H 14 MESES EN USO 1 BACTERIA 1 45 IBAGUE 32 A ARQUITECTO +/- 8H 14 MESES EN USO 1 BACTERIA 2 68 LCB CIUDAD OCUPACION DEL PTE BOGOTA EDAD DEL PTE 25 A TIEMPO DE REEMPLAZO DEL LENTE (APROX) 10 MESES EN USO GRUPO FDA MEDICO HORAS HABITUALES DE USO +/- 10 H 46 47 BOGOTA 48 MICROORGANISMO CLASIFICACION RUDKO 1 NEGATIVO 1 25 A MEDICO +/- 10H 10 MESES EN USO 1 NEGATIVO 1 MEDELLIN 27 A MEDICO +/- 8H 11 MESES EN USO 1 BACTERIA 2 49 MEDELLIN 27 A MEDICO +/- 8H 11 MESES EN USO 1 BACTERIA 2 52 MEDELLIN 25 A MEDICO +/- 8H 12 MESES EN USO 1 BACTERIA 2 53 MEDELLIN 25 A MEDICO +/- 8H 12 MESES EN USO 1 BACTERIA 2 54 IBAGUE 25 A MEDICO +/- 6H 15 MESES EN USO 3 BACTERIA 2 55 IBAGUE 25 A MEDICO +/- 6H 15 MESES EN USO 3 BACTERIA 1 56 BOGOTA 26 A +/- 8H 14 MESES EN USO 1 BACTERIA 2 57 BOGOTA 26 A +/- 8H 14 MESES EN USO 1 BACTERIA 2 58 BOGOTA 28 A +/- 8H 13 MESES EN USO 1 NEGATIVO 1 59 BOGOTA 28 A DISEÑADORA TEXTIL DISEÑADORA TEXTIL DISEÑADORA TEXTIL DISEÑADORA TEXTIL +/- 8H 13 MESES DE USO 1 BACTERIA 2 69 LCB CIUDAD BOGOTA EDAD DEL PTE 31 A 60 61 BOGOTA 62 OCUPACION DEL PTE TIEMPO DE REEMPLAZO DEL LENTE (APROX) 15 MESES DE USO GRUPO FDA SECRETARIA HORAS HABITUALES DE USO +/- 8H MICROORGANISMO CLASIFICACION RUDKO 1 BACTERIA 1 31 A SECRETARIA +/- 8H 15 MESES DE USO 1 BACTERIA 2 CALI 19 A ESTUDIANTE +/- 6H 11 MESES EN USO 3 BACTERIA 2 63 CALI 19 A ESTUDIANTE +/- 6H 11 MESES EN USO 3 BACTERIA 2 64 CALI 20 A ESTUDIANTE +/- 8H 12 MESES EN USO 1 BACTERIA 2 65 CALI 20 A ESTUDIANTE +/- 8H 12 MESES EN USO 1 BACTERIA 1 66 BOGOTA 37 A CONTADORA +/- 8H 13 MESES EN USO 1 BACTERIA 2 67 BOGOTA 37 A CONTADORA +/- 8H 13 MESES EN USO 1 BACTERIA 2 68 BOGOTA 35 A VETERINARIO +/- 8H 14 MESES EN USO 1 NEGATIVO 1 69 BOGOTA 35 A VETERINARIO +/- 8H 14 MESES EN USO 1 NEGATIVO 1 70 BOGOTA 31 A +/- 9H 3 MESES EN USO 4 BACTERIA 2 71 BOGOTA 31 A DISEÑADORA TEXTIL DISEÑADORA TEXTIL +/- 9H 3 MESES EN USO 4 BACTERIA 2 70 LCB CIUDAD 72 BOGOTA EDAD DEL PTE 28 A OCUPACION DEL PTE HORAS HABITUALES DE USO +/- 8H TIEMPO DE REEMPLAZO DEL LENTE (APROX) 4 MESES EN USO GRUPO FDA 73 BOGOTA 28 A 74 BOGOTA 26 A 75 BOGOTA 26 A 76 BOGOTA 27 A AUXILIAR CONTABLE AUXILIAR CONTABLE MEDICO INTERNISTA MEDICO INTERNISTA ODONTOLOGA 77 BOGOTA 27 A 78 BOGOTA 79 MICROORGANISMO CLASIFICACION RUDKO 4 BACTERIA 2 +/- 8H 4 MESES EN USO 4 BACTERIA 2 +/- 9H 3 MESES EN USO 4 BACTERIA 2 +/- 9H 3 MESES EN USO 4 NEGATIVO 1 +/- 8H 3 O 4 MESES EN USO 2 NEGATIVO 1 ODONTOLOGA +/- 8H 3 O 4 MESES EN USO 2 BACTERIA 2 26 A PELUQUERIA +/- 8H 4 MESES EN USO 2 BACTERIA 2 BOGOTA 26 A PELUQUERIA +/- 8H 4 MESES EN USO 2 BACTERIA 2 80 IBAGUE 32 A OPTOMETRA +/- 8H 12 MESES DE USO 4 BACTERIA 2 81 IBAGUE 32 A OPTOMETRA +/- 8H 12 MESES DE USO 4 BACTERIA 2 82 IBAGUE 42 A CONTADORA HSF +/- 6H 13 MESES DE USO 2 BACTERIA 2 83 IBAGUE 42 A CONTADORA HSF +/- 6H 13 MESES DE USO 2 BACTERIA 2 71 LCB CIUDAD FUSAGASUGA EDAD DEL PTE 21 A 84 85 FUSAGASUGA 86 OCUPACION DEL PTE TIEMPO DE REEMPLAZO DEL LENTE (APROX) 13 MESES DE USO GRUPO FDA ESTUDIANTE HORAS HABITUALES DE USO +/- 6H MICROORGANISMO CLASIFICACION RUDKO 4 NEGATIVO 1 21 A ESTUDIANTE +/- 6H 13 MESES DE USO 4 NEGATIVO 1 BOGOTA 35 A ENFERMERA +/- 8H 13 MESES DE USO 4 BACTERIA 1 87 BOGOTA 35 A ENFERMERA +/- 8H 13 MESES DE USO 4 BACTERIA 1 88 BOGOTA 22 A ESTUDIANTE +/- 6H 12 MESES DE USO 4 BACTERIA 1 89 BOGOTA 22 A ESTUDIANTE +/ 6H 12 MESES DE USO 4 BACTERIA 2 90 BOGOTA 30 A ENFERMERA +/- 8H 8 MESES DE USO 4 BACTERIA 1 91 BOGOTA 30 A ENFERMERA +/- 8H 8 MESES DE USO 4 BACTERIA 1 93 BOGOTA 33 A +/- 9 O 10H 3 MESES DE USO 3 BACTERIA 2 94 BOGOTA 33 A +/-9 O 10H 3 MESES DE USO 2 BACTERIA 2 95 BOGOTA 28 A +/- 10H 3 MESES DE USO 3 BACTERIA 1 96 BOGOTA 28 A INSTRUMENTADORA QX INSTRUMENTADORA QX RADIOLOGO INTERNISTA RADIOLOGO INTERNISTA +/- 10H 3 MESES DE USO 2 BACTERIA 1 72 ANEXO 3. RESULTADOS DE CULTIVOS Y GRAM BACTERIAS CULTIVOS LCB NUMERO COLONIAS CANTIDAD DE CULTIVO GRAM 1 GRIS CREMOSA REDONDA INCONTABLES BACILOS GRAM NEGATIVOS 2 GRIS CREMOSA REDONDA INCONTABLES BACILOS GRAM NEGATIVOS 3 GRIS Y/ PUNTIFORME MUCHAS EN AMBAS 4 GRIS Y / PUNTIFORME INCONTABLES AMBAS 5 GRIS OPACA CREMOSA REDONDA INCONTABLES BACILOS GRAM NEGATIVOS AMBAS BACILOS GRAM NEGATIVOS AMBAS BACILOS GRAM NEGATIVOS 6 GRIS OPACA CREMOSA REDONDA INCONTABLES BACILOS GRAM NEGATIVOS 7 GRIS ¿????? 2????? INCONTABLES BACILOS GRAM NEGATIVOS 8 GRIS REDONDA CREMOSA INCONTABLES 9 GRIS REDONDA CREMOSA INCONTABLES 10 NEGATIVO NEGATIVO BACILOS Y COCO BACILOS GRAM NEGATIVO BACILOS Y COCO BACILOS GRAM NEGATIVO NEGATIVO 11 GRIS CREMOSA Y GRIS OPACA INCONTABLES AMBAS 12 GRIS CREMOSA INCONTABLES COCO BACILOS GRAM NEGATIVAS AMBAS BACILOS GRAM NEGATIVOS 73 LCB NUMERO COLONIAS CANTIDAD DE CULTIVO GRAM 13 GRIS CREMOSA 18 BACILOS GRAM NEGATIVOS 14 PUNTIFORME / GRIS OPACA / GRIS CREMOSA PUNTIFORME / GRIS OPACA / GRIS CREMOSA INCONTABLES TODAS 16 NEGATIVO NEGATIVO BACILOS GRAM NEGATIVOS TODAS BACILOS GRAM NEGATIVOS7BACILOS GRAM NEGATIVOS FILAMENTOSOS Y LEVADURAS NEGATIVO 17 NEGATIVO NEGATIVO NEGATIVO 18 INCONTABLES 19 PUNTIFORME/ GRIS OPACA/ GRIS CREMOSA NEGATIVO NEGATIVO BACILOS GRAM NEGATIVOS TODAS NEGATIVO 20 PUNTIFORME INCONTABLES BACILOS GRAM NEGATIVO 21 GRIS CREMOSA 5 22 GRIS OPACA MUCHAS BACILOS GRAM POSITIVOS ALARGADOS BACILOS GRAM POSITIVOS 23 NEGATIVO NEGATIVO NEGATIVO 24 NEGATIVO NEGATIVO NEGATIVO 15 INCONTABLES TODAS 74 LCB NUMERO COLONIAS CANTIDAD DE CULTIVO GRAM 25 PUNTIFORME INCONTABLES COCO BACILO GRAM NEGATIVO 26 PUNTIFORME INCONTABLES 27 PUNTIFORME INCONTABLES BACILOS GRAM NEGATIVOSY BACILOS GRAM NEGATIVOS FILAMENTOSOS BACILOS GRAM NEGATIVO 28 PUNTIFORME INCONTABLES BACILOS GRAM NEGATIVO 29 NEGATIVO NEGATIVO NEGATIVO 30 NEGATIVO NEGATIVO NEGATIVO 31 GRIS CREMOSA INCONTABLES 32 PUNTIFORME INCONTABLES 33 PUNTIFORME / GRIS CREMOSA INCONTABLES 34 PUNTIFORME/ GRIS CREMOSA / GRIS OPACA ICONTABLES / MUCHAS / INCONTABLES 35 PUNTIFORME INCONTABLES COCO BACILOS GRAM NEGATIVOS BACILOS Y COCO BACILOS GRAM NEGATIVO BACILOS Y COCO BACILOS GRAM NEGATIVO BACILOS Y COCO BACILOS GRAM NEGATIVOS Y BACILOS GRAM POSITIVOS BACILOS GRAM NEGATIVOS 36 PUNTIFORME INCONTABLES BACILOS GRAM NEGATIVOS ALGUNOS FILAMENTOSOS 75 LCB NUMERO COLONIAS CANTIDAD DE CULTIVO GRAM 37 PUNTIFORME MUCHAS 38 PUNTIFORME INCONTABLES 39 PUNTIFORME INCONTABLES 40 NEGATIVO NEGATIVO BACILOS GRAM NEGATIVOS Y BACILOS GRAM NEGATIVOS FILAMENTOSOS BACILOS GRAM NEGATIVOSY BACILOS GRAM NEGATIVOS FILAMENTOSOS BACILOS GRAM NEGATIVO Y BACILOS GRAM NEGATIVOS FILAMENTOSOS NEGATIVO 41 NEGATIVO NEGATIVO NEGATIVO 42 NEGATIVO NEGATIVO NEGATIVO 43 NEGATIVO NEGATIVO NEGATIVO 44 GRIS CREMOSA / GRIS OPACA INCONTABLES 45 GRIS CREMOSA / PUNTIFORME INCONTABLES 46 NEGATIVOS NEGATIVO BACILOS GRAM POSITIVOS ALARGADOS Y BACILOS GRAM POSITIVOS COCO BACILOS GRAM NEGATIVOS NEGATIVO 47 NEGATIVO NEGATIVO NEGATIVO 48 GRIS PUNTIFORME / GRIS CREMOSA INCONTABLES BACILOS GRAM NEGATIVOS 76 LCB NUMERO COLONIAS CANTIDAD DE CULTIVO GRAM 49 PUNTIFORME INCONTABLES BACILO GRAM NEGATIVO 50 GRIS CREMOSA INCONTABLES BACILOS GRAM NEGTIVOS 51 PUNTIFORME INCONTABLES 52 PUNTIFORME / GRIS CREMOSA INCONTABLES / MUCHAS 53 INCONTABLES 55 GRIS CREMOSA REDONDA Y ROSADA GRIS CREMOSA REDONDA Y ROSADA REDONDA GRIS CREMOSA INCONTABLES BACILOS GRAM NEGATIVO FILAMENTOSOS BACILOS GRAM NEGATIVO TODAS COCO BACILOS GRAM NEGATIVOS Y LEVADURAS COCO BACILOS GRAM NEGATIVOS BACILOS GRAM NEGATIVO 56 GRIS CREMOSA ESCASAS BACILOS GRAM NEGATIVO 57 PUNTIFORME INCONTABLES BACILOS GRAM NEGATIVO 58 NEGATIVO NEGATIVO NEGATIVO 59 GRIS CREMOSA / PUNTIFORME INCONTABLES 60 PUNTIFORME MUCHAS BACILOS GRAM NEGATIVOS Y BACILOS GRAM NEGATIVOS FILAMENTOSOS BACILOS GRAM NEGATIVOS FILAMENTOSOS Y LEVADURAS 54 INCONTABLES 77 LCB NUMERO COLONIAS CANTIDAD DE CULTIVO GRAM 61 PUNTIFORME / GRIS CREMOSA MUCHAS 62 PUNTIFORME / GRIS OPACA / GRIS CREMOSA INCONTABLES 63 PUNTIFORME INCONTABLES COCO BACILO GRAM NEGATIVO Y BACILOS GRAM NEGATIVOS FILAMENTOSOS BACILOS GRAM NEGATIVOSY COCO BACILOS GRAM NEGATIVOS BACILOS GRAM NEGATIVO 64 PUNTIFORME INCONTABLES BACILOS GRAM NEGATIVO 65 GRIS CREMOSA INCONTABLES BACILOS GRAM NEGATIVOS 66 PUNTIFORME POCAS BACILOS GRAM NEGATIVOS 67 PUNTIFORME OPACA INCONTABLES 68 NEGATIVO NEGATIVO BACILOS GRAM NEGATIVOS ESPORULADOS NEGATIVO 69 NEGATIVO NEGATIVO NEGATIVO 70 GRIS CREMOSA INCONTABLES BACILOS GRAM NEGATIVOS 71 PUNTIFORME / GRIS CREMOSA INCONTABLES 72 PUNTIFORME /GRIS CREMOSA INCONTABLES COCO BACILOS GRAN NEGATIVOS AMBAS BACILOS GRAM NEGATIVOS Y BACILOS GRAM POSITIVOS 78 LCB NUMERO COLONIAS CANTIDAD DE CULTIVO GRAM 73 PUNTIFORME / GRIS CREMOSA INCONTABLES 74 PUNTIFORME / GRIS CREMOSA INCONTABLES 75 NEGATIVO NEGATIVO COCO BACILO GRAM NEGATIVO FILAMENTOSOS Y LEVADURAS BACILOS GRAM NEGATIVOS Y LEVADURAS ¿??? NEGATIVO 76 NEGATIVO NEGATIVO NEGATIVO 77 INCONTABLE 78 PUNTIFORME OPACA / GRIS CREMOSA PUNTIFORME / GRIS CREMOSA INCOMTABLES 79 PUNTIFORME / GRIS CREMOSA INCONTABLES 80 PUNTIFORME INCONTABLES COCO BACILOS GRAM NEGATIVOS Y LEVADURAS COCO BACILOS GRAM NEGATIVOS COCO BACILOS GRAM NEGATIVOS BACILOS GRAM NEGATIVO 81 PUNTIFORME INCONTABLES 82 PUNTIFORME MUCHAS 83 PUNTIFORME POCAS 84 NEGATIVO NEGATIVO BACILOS GRAM NEGATIVO FILAMENTOSOS BACILOS GRAM NEGATIVOS Y BACILOS GRAM NEGATIVOS FILAMENTOSOS DIPLOBACILOS GRAM NEGATIVOS Y BACILOS GRAM NEGATIVOS FILAMENTOSOS NEGATIVO 79 LCB NUMERO COLONIAS CANTIDAD DE CULTIVO GRAM 85 NEGTIVO NEGATIVO NEGATIVO 86 PUNTIFORME INCONTABLES 87 PUNTIFORME INCONTABLE 88 PUNTIFORME OPACA INCONTABLE BACILOS GRAM NEGATIVOS Y BACILOS GRAM NEGATIVOS FILAMENTOSOS DIPLOBACILOS GRAM NEGATIVOS Y GRAM + ¿??? BACILOS GRAM NEGATIVOS 89 PUNTIFORME INCONTABLE 90 PUNTIFORME INCOMTABLES 91 PUNTIFORME / GRIS CREMOSA INCONTABLES 92 PUNTIFORME / GRIS CREMOSA INCONTABLES / POCAS 93 PUNTIFORME INCONTABLES 94 PUNTIFORME INCONTABLES 95 PUNTIFORME INCONTABLES 96 PUNTIFORME / GRIS CREMOSA INCONTABLES / POCAS BACILOS GRAM NEGATIVOS Y LEVADURAS BACILOS GRAM NEGATIVOS Y BACILOS GRAM NEGATIVOS FILAMENTOSOS BACILOS GRAM NEGATIVOS BACILOS GRAM NEGATIVO FILAMENTOSOS Y COCO BACILOS GRAM NEGATIVOS COCO BACILOS GRAM NEGATIVO BACILOS GRAM NEGATIVOS BACILOS GRAM NEGATIVOS Y BACILOS GRAM NEGATIVOS FILAMENTOSOS BACILOS GRAM NEGATIVOS Y BACILOS GRAM NEGATIVOS FILAMENTOSOS 80 LCB NUMERO COLONIAS CANTIDAD DE CULTIVO GRAM 97 GRIS CREMOSA INCONTABLES 98 GRIS CREMOSA INCONTABLES COCO BACILOS GRAM NEGATIVOS/ BACILOS GRAM NEGATIVOS Y LEVADURAS BACILOS GRAM NEGATIVOS 99 PUNTIFORME / GRIS CREMOSA INCONTABLE 100 GRIS CREMOSA INCONTABLE BACILOS GRAM NEGATIVOS / COCOBACILOS GRAM NEGATIVOS Y BACILOS GRAM NEGATIVOS FILAMENTOSOS BACILOS GRAM NEGATIVOS 81 ANEXO 4. RESULTADOS PARA HONGOS LCB AZUL DE LACTOFENOL LCB AZUL DE LACTOFENOL 1 NEGATIVO 13 NEGATIVO 2 NEGATIVO 14 POSITIVO: HIFAS 3 NEGATIVO 15 NEGATIVO 4 NEGATIVO 16 NEGATIVO (CRISTALES) 5 NEGATIVO 17 NEGATIVO (CRISTALES) 6 NEGATIVO 18 NEGATIVO 7 NEGATIVO 19 NEGATIVO 8 NEGATIVO 20 NEGATIVO 9 NEGATIVO 21 POSITIVO : HIFAS 10 NEGATIVO 22 NEGATIVO 11 NEGATIVO 23 NEGATIVO 12 NEGATIVO 24 NEGATIVO 82 LCB AZUL DE LACTOFENOL LCB AZUL DE LACTOFENOL 25 NEGATIVO 37 NEGATIVO 26 POSITIVO: HIFAS 38 NEGATIVO 27 NEGATIVO 39 NEGATIVO 28 NEGATIVO 40 NEGATIVO 29 NEGATIVO 41 NEGATIVO 30 NEGATIVO 42 NEGATIVO 31 NEGATIVO 43 NEGATIVO 32 NEGATIVO 44 NEGATIVO 33 NEGATIVO 45 NEGATIVO 34 NEGATIVO 46 NEGATIVO 35 NEGATIVO 47 NEGATIVO 36 NEGATIVO 48 NEGATIVO 83 LCB AZUL DE LACTOFENOL LCB AZUL DE LACTOFENOL 49 NEGATIVO 61 NEGATIVO 50 NEGATIVO 62 NEGATIVO 51 NEGATIVO 63 NEGATIVO 52 NEGATIVO 64 POSITIVO: HIFAS 53 POSITIVO: HIFAS 65 NEGATIVO 54 NEGATIVO 66 NEGATIVO 55 POSITIVO: HIFAS 67 NEGATIVO 56 NEGATIVO 68 NEGATIVO 57 NEGATIVO 69 NEGATIVO 58 NEGATIVO 70 NEGATIVO 59 NEGATIVO 71 NEGATIVO 60 NEGATIVO 72 NEGATIVO LCB AZUL DE LACTOFENOL 84 85 NEGATIVO LCB AZUL DE LACTOFENOL 86 POSITIVO: HIFAS 73 NEGATIVO 87 NEGATIVO 74 NEGATIVO 88 NEGATIVO 75 NEGATIVO 89 POSITIVO: HIFAS 76 POSITIVO: HIFAS 90 NEGATIVO 77 NEGATIVO 91 NEGATIVO 78 NEGATIVO 92 POSITIVO: HIFAS 79 NEGATIVO 93 POSITIVO: HIFAS 80 POSITIVO: HIFAS 94 NEGATIVO 81 NEGATIVO 95 NEGATIVO 82 NEGATIVO 96 NEGATIVO 83 NEGATIVO 97 NEGATIVO 84 NEGATIVO 98 NEGATIVO 99 NEGATIVO 100 NEGATIVO 85