001-LA TABLA PERIÓDICA
Anuncio
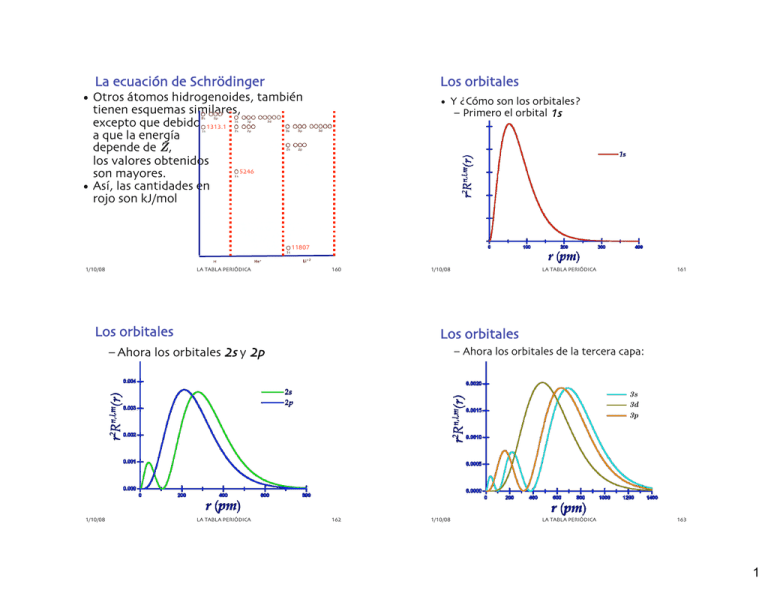
La ecuación de Schrödinger Los orbitales • Otros átomos hidrogenoides, también tienen esquemas similares, excepto que debido 1313.1 a que la energía depende de Z, los valores obtenidos 5246 son mayores. • Así, las cantidades en rojo son kJ/mol • Y ¿Cómo son los orbitales? – Primero el orbital 1s 11807 1/10/08 LA TABLA PERIÓDICA 160 Los orbitales 1/10/08 LA TABLA PERIÓDICA 161 Los orbitales – Ahora los orbitales 2s y 2p – Ahora los orbitales de la tercera capa: 3s 3d 3p 1/10/08 LA TABLA PERIÓDICA 162 1/10/08 LA TABLA PERIÓDICA 163 1 Los orbitales Los orbitales – Ahora comparamos los orbitales s de estas tres capas – Y finalmente los comparamos todos: 1s 2s 2p 3s 3d 3p 1/10/08 LA TABLA PERIÓDICA 164 Otra vez la ecuación de Schrödinger 1/10/08 • l = 0, ml = 0: 1/10/08 LA TABLA PERIÓDICA 1 165 Los orbitales • La parte angular de la función de onda describe la forma de la nube electrónica. • Y varía dependiendo de la clase de orbital y de su orientación en el espacio (s, p, d o f). • Sin embargo para cada tipo de orbital por ejemplo todos los s o todos los pz la función angular es idéntica, es decir no dependen de n. • De esta manera tenemos que para cualquier orbital s, la función angular es así: 1 Θ (θ ) Φ (φ ) = 4π LA TABLA PERIÓDICA – Y tienen esta forma: 2 1s 166 1/10/08 2s 3s LA TABLA PERIÓDICA 167 2 Los orbitales La ecuación de Schrödinger • En tanto que para los orbitales pz, tiene esta forma: – Y su forma es así: 1 • l = 1, ml = 0: 3 2 Θ (θ ) Φ (φ ) = cos (θ ) 4π • Los orbitales px y py tienen una dependencia de Θ(θ) y Φ(φ) diferente pero la misma forma, es decir únicamente se orientan en el espacio de manera diferente. 1/10/08 LA TABLA PERIÓDICA 2p x 168 La ecuación de Schrödinger 2p y 1/10/08 2pz LA TABLA PERIÓDICA 169 Los orbitales • Finalmente en el caso del orbital dz2 se tiene esta dependencia angular de la función de onda: • l = 0, ml = 0: 1 • Y tienen esta forma: 5 2 3 cos2 θ −1 Θ (θ ) Φ (φ ) = ( ) 16π • Los demás orbitales d también tienen una dependencia de Θ(θ) y Φ(φ) diferente. • Y también tienen diferentes orientaciones en el espacio. 1/10/08 LA TABLA PERIÓDICA 3dx2-y2 3dz2 170 1/10/08 LA TABLA PERIÓDICA 3dxy 171 3 Símbolos atómicos Símbolos atómicos • A cada elemento se le asigna un símbolo único: • En general representamos a los átomos con esta simbología: A Z Arsénico Bario Carbono Cloro Hidrógeno Helio Oro X #C • Donde: A - Masa atómica Z - Número atómico C - Carga #- Número de átomos 1/10/08 # de protones + neutrones # de protones Valores positivos o negativos # de átomos en la fórmula LA TABLA PERIÓDICA 172 K Ni N O Rn Ti U 1/10/08 LA TABLA PERIÓDICA 173 Desarrollo de la tabla periódica • La herramienta más importante para organizar y recordar hechos químicos es la tabla periódica • Está basada en la naturaleza periódica de las propiedades químicas de los elementos • Y también en la naturaleza periódica de las configuraciones electrónicas de estos • Los elementos en la misma columna tienen el mismo número de electrones de valencia • Las similitudes en las propiedades químicas de los elementos, se pueden atribuir a las similitudes en la configuración de los electrones de valencia LA TABLA PERIÓDICA Potasio Níquel Nitrógeno Oxígeno Radón Titanio Uranio • Cada símbolo tiene una o dos letras y la primera siempre es mayúscula. • Si el símbolo parece no ajustarse al nombre, es que el elemento tenía originalmente un nombre diferente Propiedades periódicas de los elementos 1/10/08 As Ba C Cl H He Au 174 • Algunos elementos, como la plata y el oro, se encuentran naturalmente en su forma elemental y fueron descubiertos hace miles de años • Algunos elementos radiactivos son extraordinariamente inestables y su aislamiento depende de la tecnología moderna • Aunque la mayoría de los elementos son estables, únicamente se pueden encontrar formando compuestos con otros elementos 1/10/08 LA TABLA PERIÓDICA 175 4 Desarrollo de la tabla periódica • Algunos elementos presentan características muy similares: • Litio (Li), Sodio (Na) y Potasio (K) son metales blandos y muy reactivos • Helio (He), Neón (Ne) y Argón (Ar) son gases que no reaccionan con otros elementos • Al arreglar a todos los elementos en el orden de su número atómico, se observa que sus propiedades físicas y químicas muestran un patrón de repetición periódico • Un ejemplo de la naturaleza periódica de los átomos es que cuando están ordenados según su número atómico, cada uno de los metales blandos y reactivos de arriba, viene inmediatamente después de uno de los gases que no reaccionan 1/10/08 LA TABLA PERIÓDICA 176 Desarrollo de la tabla periódica • En el siglo XIX, se diseñaron métodos para aislar muchos de los elementos de sus compuestos. • A partir de ese momento se aíslan cada vez más y más elementos • Para 1800 había 31 elementos identificados • Para 1865 había ya 63 elementos identificados • A medida que se fueron descubriendo y caracterizando más y más elementos, se intentaba al mismo tiempo encontrar si se podían agrupar y clasificar, de acuerdo a su comportamiento químico 1/10/08 LA TABLA PERIÓDICA Desarrollo de la tabla periódica Desarrollo de la tabla periódica • Este esfuerzo, dio como resultado la tabla periódica de los elementos • En el año de 1869, • Dimitri Mendeleiev y Lothar Meyer • El primero, basado en sus propiedades químicas • El segundo, en sus propiedades físicas • Ambos concluyen que: – Los elementos pueden ordenarse de acuerdo a su peso atómico • Es decir, g / mol de su mezcla natural de isótopos – Mostrando como resultado un arreglo con características periódicas – publican independientemente esquemas de clasificación de los elementos 1/10/08 LA TABLA PERIÓDICA 178 1/10/08 LA TABLA PERIÓDICA 177 179 5 La ley y la tabla periódicas La ley y la tabla periódicas • Este es uno de los documentos originales de Mendeleiev: • Esta es la publicación de 1871 de Mendeleiev: Reihen 1/10/08 LA TABLA PERIÓDICA 180 La ley y la tabla periódicas LA TABLA PERIÓDICA Gruppe II. - Gruppe III. Gruppe VI. B = 11 Al = 27,3 - = 44 C = 12 Si = 28 Ti = 48 (Cu = 63) Rb = 85 Zn = 65 Sr = 87 - = 68 ?Yt = 88 - = 72 Zr = 90 As = 75 Nb = 94 Sn = 118 ?Ce = 140 ?La = 180 Sb = 122 Ta = 182 Te = 125 W = 184 Pb = 207 Th = 231 Bi = 208 - U = 240 7 8 9 10 Ag = 108 Cs = 133 (-) - Cd = 112 Ba = 137 - In = 113 ?Di = 138 ?Er = 178 11 12 (Au = 199) - Hg = 200 - Tl = 204 - 1/10/08 RH4 RO2 Gruppe V. Be = 9,4 Mg = 24 Ca = 40 RO R 2O 3 Gruppe IV. R2O H=1 Li = 7 Na = 23 K = 39 RH3 R2O 5 N = 14 P = 31 V = 51 RH2 RO3 Gruppe VII. RH R2O7 O = 16 S = 32 Cr = 52 F = 19 Cl = 35,5 Mn = 55 Se = 78 Mo = 96 Br = 80 - = 100 Gruppe VIII. RO4 Fe = 56, Co=59 Ni=59, Cu=63 Ru=104, Rh=104 Pd=106, Ag=108 J = 127 - - - - Os=195, Ir=197, Pt=198, Au=199 - - - - LA TABLA PERIÓDICA 181 Desarrollo de la tabla periódica • Mendeleiev, en 1871, demuestra: Que las propiedades de los elementos varían de manera periódica • Así, la tabla periódica nos ayuda a comprender – el comportamiento – las propiedades y – la reactividad de los elementos • Basados en que las propiedades de los elementos tienden a reproducirse de manera regular (periódica) al ordenar a los elementos según su número atómico 1/10/08 Gruppe I. 1 2 3 4 5 6 La tabla de Mendeleiev • A continuación se indican los ocho principios periódicos de Mendeleiev (1860): 1. Los elementos exhiben una evidente periodicidad de propiedades si se ordenan de acuerdo a su masa atómica. 2. Los elementos con propiedades similares tienen masas atómicas que son casi las mismas (Pt, Ir, Os) o se incrementan regularmente (K, Rb, Cs o Cl, Br I) 3. El arreglo de los elementos en grupos, corresponde tanto a la valencia, como en cierta medida a sus propiedades químicas distintivas. 182 1/10/08 LA TABLA PERIÓDICA 183 6 Desarrollo de la tabla periódica Desarrollo de la tabla periódica 4.Los elementos que están más ampliamente difundidos tienen masas atómicas pequeñas. 5.La magnitud de la masa atómica de un determina el carácter del elemento. 6.Se debe esperar en los años próximos el descubrimiento de muchos elementos aun desconocidos análogos al aluminio y silicio cuya masa será de 65 a 75. 7.La masa atómica de un elemento puede corregirse algunas veces, si conocemos los elementos contiguos a este, así la masa atómica del Te debe estar entre 123 y 126 y no 128. 8.Ciertas características de los elementos pueden predecirse de su masa. • La insistencia de Mendeleiev en ordenar a los elementos de acuerdo a su peso atómico y agruparlos según sus características químicas, dio como resultado la aparición de una serie de agujeros en la tabla • Ni el Galio (Ga), ni el Germanio (Ge) se conocían en la época, es decir había dos agujeros en la tabla de Mendeleiev debajo del Aluminio (Al) y el Silicio (Si) • Concluye que debían de existir dos elementos que debían llenar los agujeros • A estos dos elementos los llamó eka-aluminio y eka-silicio 1/10/08 LA TABLA PERIÓDICA 184 Desarrollo de la tabla periódica • Ahora bien, Mendeleiev no solamente predijo la existencia del Ga y el Ge y otros elementos sino que también describió como eran, • Es decir, describió algunas de sus propiedades físicas y químicas, entre ellas: – El peso atómico aproximado, – La manera en que se combinarían con O y Cl – Las propiedes de sus óxidos y cloruros • Cuando el Ga y el Ge fueron descubiertos varios años más tarde, se observó que sus propiedades físicas y químicas eran las que Mendeleiev había predicho. • Estos serán la mejor confirmación de la teoría 1/10/08 LA TABLA PERIÓDICA 186 1/10/08 LA TABLA PERIÓDICA 185 Desarrollo de la tabla periódica • Para entender la importancia tanto del trabajo como de la confianza de Mendeleiev en su teoría, presentamos a continuación las predicciones hechas en 1869. • Para darles nombres provisionales a los elementos que predijo, usó los prefijos eka-, dvi- y tri- del sánscrito, correspondientes a los números uno, dos y tres dependiendo de la posición que el elemento descubierto ocupaba debajo de un elemento conocido en su tabla. – Eka-boro ⇒ escandio: Aislado por Lars F. Nilson en 1879, Per T. Cleve reconoce la correspondencia. Masa predicha 44, masa observada: 44.955910 1/10/08 LA TABLA PERIÓDICA 187 7 Desarrollo de la tabla periódica Desarrollo de la tabla periódica • En 1869 Mendeleiev predice las propiedades de un compuesto al cual llama eka-silicio, que no será aislado sino hasta 1882, el Germanio. Eka-silicio Germanio Propiedad Masa Atómica 72 72.59 3 Densidad (g/cm ) 5.5 5.35 Punto de Fusión Alto 947°C Color gris gris Tipo de óxido refractario refractario Densidad del óxido (g/cm3) 4.7 4.7 Actividad del óxido Poco ácido Poco ácido Punto de ebullición del Cloruro < 100°C 86°C 3 Densidad del Cloruro (XCl4) (g/cm ) 1.9 1.9 1/10/08 LA TABLA PERIÓDICA 188 Desarrollo de la tabla periódica LA TABLA PERIÓDICA Eka-aluminio Propiedad Masa atómica 68 3 Densidad (g/cm ) 5.9 Punto de fusión Bajo Fórmula del óxido Ea2O3 Fórmula del cloruro Ea2Cl6 1/10/08 Galio 69.3 5.93 30.15 °C Ga2O3 Ga2Cl6 LA TABLA PERIÓDICA 189 Desarrollo de la tabla periódica • En 1871 predice la existencia de un elemento que no será aislado sino hasta 1937 por Emilio Segré de muestras de Mo bombardeado con deuterio en un ciclotrón a este elemento se le llamó tecnecio. Mendeleiev había predicho una masa de 100 para el eka-manganeso y el isótopo más estable es el 98Tc, cuya masa es de 97.907214 • También en 1871 predice la existencia de un elemento entre el Th y el U. • En 1900 William Crook aisla un material radiactivo del U sin poder identificarlo. • Será hasta 1949 que se reconoce que este elemento era el Protoactinio. 1/10/08 • En 1871 predice la existencia de otro elemento al que llamó eka-aluminio, la tabla muestra las características propuestas por Mendeleiev comparadas alas propiedades observadas para el Ga, descubierto en 1875. 190 •La exactitud de las predicciones de Mendeliev para los elementos desconocidos basadas en la tabla periódica, convencieron sin lugar a dudas de su validez a los científicos de la época. •Sin embargo, todavía se necesitaba una importante modificación •Dado que Mendeleiev había ordenado a los elementos en términos de su masa relativa, esto le generó algunos problemas, por ejemplo el I tiene una masa relativa menor a la del Te, por tanto debía estar antes, pero para poner al I con el Cl y el Br, tuvo que ponerlo después. •Será en 1913 que Moseley resuelve el problema al organizar los elementos en términos de su número atómico. 1/10/08 LA TABLA PERIÓDICA 191 8 La ley y la tabla periódicas La tabla periódica moderna • La ley periódica se basa en el arreglo de los elementos llamado (Tabla periódica). • En la cual, cada elemento pertenece a un agrupamiento vertical llamado familia y a un agrupamiento horizontal llamado periodo. • Los elementos de una familia tienden a presentar propiedades químicas similares. • Presentaremos muchas tablas periódicas, pero todas están basadas en la de Mendeleiev. • Aunque en algunos casos no lo parezcan. • Empezaremos por las más conocidas. • La tabla periódica corta (IUPAC) 1/10/08 LA TABLA PERIÓDICA Antes de 1800 1800-1849 1850-1899 1900-1949 1950-1999 192 La tabla periódica moderna LA TABLA PERIÓDICA 1/10/08 LA TABLA PERIÓDICA 193 La tabla periódica moderna • La tabla periódica larga (tres versiones) • La tabla periódica corta (en colores) 1/10/08 Descubrimiento 194 1/10/08 LA TABLA PERIÓDICA 195 9 La tabla periódica moderna La tabla periódica moderna • La tabla periódica de Adomah(Perfecta) • La tabla periódica de Tarantola 1/10/08 LA TABLA PERIÓDICA 196 La tabla periódica moderna 1/10/08 LA TABLA PERIÓDICA 197 La tabla periódica moderna • La tabla periódica de Hull • La tabla periódica de Bohr-Bayley Conexiones principales Conexiones secundarias Represetativos Transición Transición interna Metaloides No metales 1/10/08 LA TABLA PERIÓDICA 198 1/10/08 LA TABLA PERIÓDICA 199 10






