2 NO
Anuncio

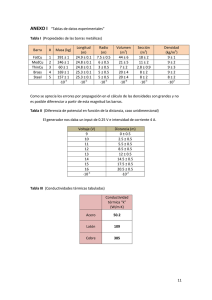
Cinética química Oscar Cifuentes Sanhueza Química y CCNN Didáctica de las Ciencias Cinética química 1.- Velocidad de reacción 2.- Teoría de las colisiones. 3.- Factores que influyen en la velocidad de reacción 4. Orden de reacción ¿CUÁN RÁPIDO OCURREN LAS REACCIONES? ¿CUÁN RÁPIDO CAMBIAN LAS CONCENTRACIONES? ¿CUÁN RÁPIDO CAMBIAN LAS CONCENTRACIONES? VELOCIDAD DE REACCIÓN Cambio en la concentración de reaccionantes o productos por unidad de tiempo. Para una reacción: A B ; Velocidad - Conc. A t El signo negativo se d debe a que A está desapareciendo, o sea: Concentración Ainicial > Concentración Afinal Usamos el símbolo [A] para representar concentración molar de A. A , también: Velocidad B Velocidad t t 1.Velocidad de reacción La velocidad de una reacción química indica cómo varía la concentración de reactivos o productos con el tiempo Ejemplo: Para la reacción aA + bB cC + dD La velocidad de la reacción se puede expresar: 1 d A 1 d B 1 d C 1 d D v a dt b dt c dt d dt a b d COLISIONES MOLECULARES O3 + NO c O2 + NO2 2. Teoría de las colisiones Las reacciones químicas se producen por los choques eficaces entre las moléculas de reactivos Veamos la reacción de formación del HI a partir de I2 e H2 H H I I Choque I I H H HI + HI H I I H H I I2 + H 2 H I I I I2 H H H2 Además del choque adecuado las moléculas tienen que tener una energía suficiente, esta energía mínima se denomina energía de activación. Complejo activado Complejo activado Energía de activación Energía de activación Productos Reactivos H>0 H<0 Reactivos Productos Transcurso de la reacción Reacción exotérmica Transcurso de la reacción Reacción endotérmica El complejo activado es una asociación transitoria muy inestable, ya que su energía es superior a las moléculas de reactivo y producto Complejo activado Energía de activación Complejo activado Energía de activación Productos Reactivos H>0 H<0 Reactivos Productos Transcurso de la reacción Reacción exotérmica Transcurso de la reacción Reacción endotérmica 3. Factores que influyen en la velocidad de reacción 1.- Estado físico de los reactivos Las reacciones son más rápidas si los reactivos son gaseosos o están en disolución. En las reacciones heterogéneas la velocidad dependerá de la superficie de contacto entre ambas fases, siendo mayor cuanto mayor es el estado de división. 2.- Concentración de los reactivos 3.- Temperatura Un incremento de la temperatura provoca un incremento en la energía cinética de las moléculas, lo que hace que sea mayor el número de moléculas que alcanza la energía de activación. 4.- Catalizadores Concentración de los reactivos La velocidad de la reacción se incrementa al aumentar la concentración de los reactivos, ya que aumenta el número de choques entre ellos. Reacción no catalizada Reacción catalizada Complejo activado Complejo activado Energía de activación E.A Energía de activación Productos Reactivos H>0 H<0 Reactivos Productos Transcurso de la reacción Transcurso de la reacción Reacción exotérmica Reacción endotérmica Los catalizadores cambian la energía de activación de una determinada reacción, y por lo tanto incrementan la velocidad de reacción Complejo activado E.A sin catalizador E.A con catalizador negativo E.A con catalizador positivo Los catalizadores negativos aumentan la energía de activación Energía de activación E.A Complejo activado Energía de activación Los catalizadores positivos disminuyen la energía de activación E.A Productos Reactivos H>0 H<0 Reactivos Productos Transcurso de la reacción Transcurso de la reacción Reacción exotérmica Reacción endotérmica LA ECUACIÓN (O LEY) DE VELOCIDAD Una ecuación: a A + b B + …… c C + d D + …... tiene una ecuación de velocidad: Velocidad k A m B n ...... K: constante de velocidad m y n: órdenes con respecto a A y B. No confundir con los coeficientes a y b m + n + …… : orden DETERMINACIÓN DE LOS ÓRDENES DE REACCIÓN a) A partir de la ecuación de velocidad: Para cada una de las siguientes reacciones, determina el orden con respecto a cada reactante, y el orden global. 2 NO(g) + O2(g) = 2 NO2(g) Veloc. k NO 2 O 2 CH3CHO(g) = CH4(g) + CO(g) Veloc. k CH3 CHO3 / 2 - + - H2O2(ac) + 3 I (ac) + 2 H (ac) = I3 (ac) + 2 H2O(l) Veloc. k H2 O 2 I DETERMINACIÓN DE LOS ÓRDENES DE REACCIÓN b) A partir de las velocidades iniciales: Para la reacción: 2 NO(g) + O2(g) = 2 NO2(g) , determina los órdenes parciales, el orden global y la constante de velocidad de la reacción a partir de los siguientes datos: Velocidades Iniciales para una Serie de Experimentos en la Reacción entre O2 y NO. Concentraciones iniciales de reactantes (mol/L) Experimento O2 NO Velocidad inicial (mol/L·s) 1 1,10 x 10-2 1,30 x 10-2 3,21 x 10-3 2 2,20 x 10-2 1,30 x 10-2 6,40 x 10-3 3 1,10 x 10-2 2,60 x 10-2 12,8 x 10-3 4 3,30 x 10-2 1,30 x 10-2 9,60 x 10-3 5 1,10 x 10-2 3,90 x 10-2 28,8 x 10-3