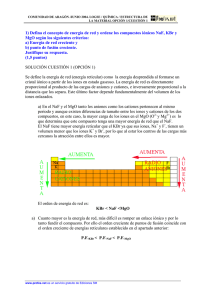
3.- Teniendo en cuenta la energía de red de los compuestos ionicos
Anuncio

ARAGÓN / JUNIO98. LOGSE / QUÍMICA / ESTRUCTURA MATERIA / OPCIÓN 1 / Nº 3 3.- Teniendo en cuenta la energía de red de los compuestos ionicos, conteste razonadamente a las siguientes cuestiones: a) ¿Cual de los siguientes compuestos tendrá mayor punto de fusión: NaF o KBr? (1 punto.) b) ¿Cual de los siguientes compuestos será más soluble en agua: MgO o CaS? (0,5 puntos.) Solución: a) El NaF y el KBr, presentan enlace ionico. Consistente en una atracción electrostática entre iones de signo opuesto, que es bastante fuerte, por lo que se necesita bastante energía para romper la red. Tendrá mayor punto de fusión aquel compuesto que presente mayores atracciones electrostáticas entre los iones de signo opuesto. La atracción electrostática viene dada por la ley de Coulomb: F=K Q1 ⋅ Q 2 (r1 + r2 ) 2 En ambos casos, el valor absoluto de las cargas es la misma, por lo que el factor que determina la intensidad de las fuerzas de unión será la distancia entre los iones. Los átomos de Na y F son más pequeños que los de K y Br, por lo que el NaF tiene unas fuerzas de atracción más intensas, por lo que el punto de fusión será mayor. b) La disolución implica la rotura de la estructura cristalina. Aquel compuesto que presente fuerzas interionicas más débiles, será el mas soluble. En ambos casos las cargas valen lo mismo. Como el Ca esta en el cuarto periodo, y el Mg en el tercero, será el radio del Ca mayor que el del Mg y, de la misma forma, al estar el S en el tercer periodo y el O en el segundo, será el radio del S mayor que el radio del O. Por lo que las distancias interiónicas son mayores en el CaS, y, por tanto, éste será mas soluble. www.profes.net es un servicio gratuito de Ediciones SM