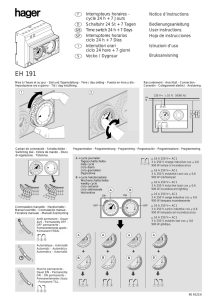
APPLICATION RESUME ET EXPLICATION PRINCIPE
Anuncio

FR DE ES IT PT Différents agents viraux peuvent provoquer des infections des voies respiratoires basses chez les enfants et les adultes. Cependant, les agents étiologiques les plus courants sont la grippe A et B, le virus respiratoire syncytial (VRS), les virus grippaux 1, 2 et 3 et les adénovirus. Parmi ces virus, les grippes A et B et le VRS sont les causes les plus importantes de maladies respiratoires aiguës faisant l’objet d’une assistance médicale. Outre le fait qu’ils présentent une prévalence saisonnière similaire, il est important de se rappeler que ces virus ont en commun des caractéristiques cliniques et un potentiel d’infection pour certains groupes de patients à haut risque (ex : patients très âgés ou très jeunes, patients souffrant de maladies cardio-pulmonaires sousjacentes, immunodéprimés). SV RESUME ET EXPLICATION La grippe est une infection aiguë très contagieuse provoquée par des virus appelés «virus grippaux». Cette infection affecte les voies respiratoires. Il existe trois types de virus grippaux : A, B et C. Toutefois, seuls les types A et B sont régulièrement à l’origine d’infections chez l’homme. Les virus de type A sont les plus fréquents et sont souvent associés aux épidémies les plus graves. Les virus de type B provoquent des symptômes généralement moins sévères que ceux causés par le virus de type A. Les virus de type A et B peuvent co-exister, cependant l’un d’eux est généralement dominant lors d’une épidémie saisonnière (1). EN APPLICATION bioNexia® Influenza A+B est un test immunochromatographique rapide qui permet la détection qualitative des antigènes associés à la grippe A et à la grippe B dans des échantillons nasopharyngés humains. Ce test est indiqué dans le cadre du diagnostic de la grippe. Il est destiné exclusivement au diagnostic in vitro et est réservé à un usage professionnel. TR RU PL CS PRINCIPE Le test bioNexia® Influenza A+B est un test immunochromatographique qualitatif qui permet la détection des antigènes associés à la grippe A et à la grippe B dans des échantillons nasopharyngés humains. Le test bioNexia® Influenza A+B détecte la nucléoprotéine, qui est la protéine structurale majeure du virus dont une région est conservée. Ce test n’est pas destiné à la détection de l’antigène de la grippe C. Lors de la réalisation du test, les antigènes du virus grippal présents dans l’échantillon réagissent avec des anticorps anti-grippe. Les complexes antigène-anticorps migrent par capillarité le long de la membrane jusqu’aux zones FLU A et/ou FLU B où ils sont capturés par des anticorps immobilisés sur la membrane entraînant la formation d’une ligne rouge (FLU A) et/ou bleue (FLU B). La présence d’une ligne rouge et/ou bleue correspond donc à un test positif. Si l’échantillon ne contient pas d’antigène de la grippe, aucune ligne n’apparaît dans les zones FLU A et FLU B. Une ligne verte apparaît dans la zone contrôle (C). Cette ligne de contrôle doit apparaître pour valider la migration. bioNexia® Influenza A + B 1 COMPOSITION DES REACTIFS DU COFFRET (10 TESTS) 10 cassettes test 1 flacon de solution tampon R1 10 tubes EXT d’extraction avec bouchons comptegouttes 1 écouvillon de contrôle positif 10 écouvillons stériles Ensachées individuellement avec une psipette de prélèvement jetable et un dessicant. La membrane de la cassette test contient des anticorps monoclonaux de souris dirigés contre les antigènes de la grippe A et B. Flacon en plastique contenant 6 mL de solution tampon. Prêt à l’emploi. Tampon PBS contenant du détergent et moins de 0,1 % d’azide de sodium. Tube en plastique et bouchon compte-gouttes avec filtre à usage unique. Ensaché individuellement avec un dessicant. L’écouvillon est enduit d’extraits inactivés de souches de la grippe A et B. Dispositif à usage unique pour prélèvements nasopharyngés (Conformément à la Directive 93/42/CEE, CE 0123). Stérilisés à l’oxyde d’éthylène. Stériles uniquement si l’emballage est intact. 1 support pour réactif 1 guide d’utilisation simplifié imprimé sur le coffret réactif 1 notice MATERIEL NECESSAIRE MAIS NON FOURNI Récipient pour recueil des échantillons Gants jetables Appareil d’aspiration, cathéter d’aspiration stérile Chronomètre PRECAUTIONS D’UTILISATION • • • • • • • • 2 Pour diagnostic in vitro uniquement. Pour usage professionnel uniquement. Ce coffret contient des composants d’origine animale. La maîtrise de l’origine et/ou de l’état sanitaire des animaux ne pouvant garantir de façon absolue que ces produits ne contiennent aucun agent pathogène transmissible, il est recommandé de les manipuler avec les précautions d’usage relatives aux produits potentiellement infectieux. Ne pas utiliser les réactifs après la date de péremption indiquée sur les emballages. La cassette test, l’écouvillon stérile et le contrôle positif doivent être conservés jusqu’à utilisation dans le sachet scellé contenant le dessicant. Ne pas les utiliser si l’emballage est endommagé. Tous les composants, à l’exception du tampon (R1), sont jetables ; ils ne doivent pas être réutilisés. Tous les prélèvements doivent être considérés comme potentiellement infectieux et manipulés en suivant les précautions recommandées selon les règlements en vigueur dans le pays d’utilisation. Pour des informations complémentaires sur les précautions de manipulation: se référer à « Biosafety in Microbiological and Biomedical Laboratories – CDC/NIH – dernière édition » ou à la réglementation en vigueur dans le pays d’utilisation. Le tampon d’échantillon (R1) contient de l’azide de sodium (conservateur) à une concentration inférieure à la valeur seuil limite égale à 0,1 %. 410918 • EN • Conserver le coffret entre 2 et 30 °C. NE PAS CONGELER. Tous les composants sont stables jusqu’à la date de péremption indiquée sur les emballages, s’ils sont conservés dans les conditions préconisées. Ne pas utiliser au-delà de la date de péremption. La cassette doit être maintenue dans son sachet scellé jusqu’à utilisation. Utiliser la cassette de test et le contrôle positif dans l’heure qui suit l’ouverture. FR CONDITIONS DE STOCKAGE ET STABILITE • • • PRELEVEMENT ET PREPARATION DES ECHANTILLONS Utilisation de l’écouvillon nasopharyngé ES Introduire l’écouvillon dans la narine jusqu’à atteindre le nasopharynx postérieur. – Faire pivoter l’écouvillon à plusieurs reprises afin de prélever des cellules infectées (veiller à ne pas casser le batonnet au point de rupture). – Pour garantir un échantillonnage optimal, répéter la procédure dans l’autre narine. Préparer l’échantillon immédiatement tel que décrit au paragraphe Mode opératoire. DE – Aspiration nasopharyngée ou lavage nasal – Déposer plusieurs gouttes de solution saline dans chaque narine. Placer le cathéter dans la narine jusqu’à parvenir au nasopharynx postérieur. – Exercer une légère aspiration. Par un mouvement de rotation, retirer délicatement le cathéter. – Pour garantir un échantillonnage optimal, répéter la procédure dans l’autre narine. Préparer l’échantillon immédiatement tel que décrit au paragraphe Mode opératoire. IT – – – – A partir d’échantillons prélevés par aspiration nasopharyngée ou lavage nasal (voir les sections 1a à 1c du guide d’utilisation simplifié) – – – Ouvrir le sachet et retirer la psipette jetable. A l’aide de cette psipette, déposer 6 gouttes de l’échantillon obtenu par aspiration nasopharyngée ou lavage nasal dans le tube d’extraction (un tube pour chaque échantillon). Ajouter 3 gouttes de R1, placer le bouchon comptegouttes sur le tube d’extraction et bien mélanger. bioNexia® Influenza A + B 3 SV CS Utiliser un tube d’extraction distinct pour chaque échantillon. Déposer 15 gouttes de R1 dans le tube d’extraction. Placer l’écouvillon nasopharyngé (ou l’écouvillon de contrôle positif ) dans le tube d’extraction et bien mélanger. Eliminer autant de liquide possible de l’écouvillon en appuyant sur les parois du tube. Retirer l’écouvillon et placer le bouchon compte-gouttes sur le tube. Retirer le test bioNexia® Influenza A+B de son sachet. Maintenir le tube d’extraction en position verticale et déposer exactement 3 gouttes dans le puits échantillon (S). Lire le résultat à 10 minutes. Ce délai doit être strictement respecté afin de s’assurer de l’obtention de résultats corrects. PL – – RU – TR A partir d’échantillons prélevés avec un écouvillon nasopharyngé ou le contrôle positif (voir les sections 1a’ à 1b’ du guide d’utilisation simplifié) PT MODE OPERATOIRE Amener les tests, les échantillons et les réactifs à température ambiante (15 à 30 °C) avant leur utilisation. Ne pas ouvrir le sachet à l’état réfrigéré, afin d’éviter la formation de condensation sur la membrane du test. – – – Retirer le test bioNexia® Influenza A+B de son sachet. Maintenir le tube d’extraction en position verticale et déposer exactement 3 gouttes dans le puits d’échantillon (S). Lire le résultat à 10 minutes. Ce délai doit être strictement respecté afin de s’assurer de l’obtention de résultats corrects STABILITE DES PRE-TRAITEMENT ECHANTILLONS APRES L’échantillon dilué peut être utilisé immédiatement ou conservé entre 18 et 25 °C ou 2 et 8 °C pendant un maximum de 8 heures. RESULTATS ET INTERPRETATION Résultat POSITIF • • • Positif à la grippe A : Deux lignes distinctes apparaissent dans la fenêtre de résultat : une ligne rouge apparaît dans la zone FLU A et une ligne verte dans la zone contrôle (C). Positif à la grippe B : Deux lignes distinctes apparaissent dans la fenêtre de résultat : une ligne bleue apparaît dans la zone FLU B et une ligne verte dans la zone de la ligne de contrôle (C). Positif à la grippe A et à la grippe B : Trois lignes distinctes apparaissent dans la fenêtre de résultat : une ligne rouge apparaît dans la zone FLU A, une ligne bleue dans la zone FLU B et une ligne verte dans la zone contrôle (C). L’intensité de la couleur dans les zones des lignes de test dépend de la concentration des antigènes de la grippe présents dans l’échantillon. Cependant, ce test qualitatif ne permet pas de déterminer cette concentration. Une ligne rouge ou bleue pâle doit être considérée comme un résultat positif. Résultat NEGATIF Une ligne verte apparaît dans la zone contrôle (C). Aucune ligne n’apparaît dans les zones FLU A et FLU B. Résultat NON VALIDE La ligne de contrôle (C) verte n’apparaît pas. Dans ce cas, le résultat n’est pas valide, même si une ligne test est visible (ligne rouge dans la zone FLU A et/ou ligne bleue dans la zone FLU B). L’absence de ligne verte dans la zone de contrôle (C) signifie que la migration ne s’est pas effectuée correctement. Revoir la procédure et répéter le test avec une nouvelle cassette. Si le problème persiste, ne plus utiliser le coffret de test et contacter le fournisseur. Lire le résultat à 10 minutes C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU A FLU A FLU B Influenza A+B FLU A+B FLU B POSITIF + C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B NEGATIF NON VALIDE x CONTROLE DE QUALITE Un écouvillon de contrôle positif est inclus dans le coffret. Il doit donner un résultat positif pour la grippe A et B. Ce contrôle doit être effectué immédiatement à l’ouverture d’un nouveau coffret afin de s’assurer que les performances des réactifs sont intactes. Aucun résultat ne pourra être validé si les résultats du contrôle ne sont pas conformes aux attentes. 4 410918 FR Le test inclut un contrôle de migration indiqué par une ligne verte dans la zone contrôle (C). Si la ligne de contrôle n’apparaît pas, le test est invalide. Il est de la responsabilité de l’utilisateur de s’assurer que le contrôle de qualité est mis en œuvre conformément à la législation locale en vigueur. ES DE EN LIMITES DU TEST 1. bioNexia® Influenza A+B indique uniquement la présence de la grippe dans l’échantillon (détection qualitative) et doit être utilisé exclusivement pour détecter les antigènes associés à la grippe A et à la grippe B dans des échantillons nasopharyngés (prélevés par écouvillons, aspiration ou lavage). Ce test ne permet pas de déterminer la valeur quantitative, ni le taux d’augmentation de la concentration des antigènes associés à la grippe. 2. Si le résultat du test est négatif et les symptômes cliniques persistent, la réalisation de tests supplémentaires à l’aide d’autres méthodes est recommandée. Un résultat négatif n’exclut pas la possibilité d’une infection grippale. 3. Ce test est un outil diagnostique. Tous les résultats doivent être interprétés à la lumière d’autres informations cliniques et résultats d’analyses de laboratoire à la disposition du médecin. La sensibilité analytique a été déterminée à l’aide de 22 souches de virus de grippe humaine : 14 souches de grippe A et 8 de grippe B. A H1N1 VR-333 Victoria/3/75 A H3N2 VR-822 Swine/1976/31 A H1N1 VR-99 Weiss/43 A H1N1 VR-96 New Jersey/8/76 (Hsw N1) NWS/33 A H1N1 VR-897 A H1N1 VR-219 Port Chalmers/1/73 California/07/09 A H3N2 VR-810 A H1N1 - Paris/5509/09 A H1N1 - Niger/2090/06 A H5N1 - Vietnam/1203/04 A H5N1 - Solomon Islands/3/2006 South Dakota/6/2007 R22 Barbara A H1N1 - A H1N1 - B - VR-788 Maryland/1/59 B - VR-296 GL/1739/54 B - VR-103 PT Swine/Iowa/15/30 bioNexia® Influenza A + B VR-95 SV H1N1 CS A PL PR/8/34 Niveau détectable minimum 8,89 x 105 CEID[50]/mL 8,89 x 106 CEID[50]/mL 1,58 x 105 CEID[50]/mL 8,89 x 105 CEID[50]/mL 8,89 x 108 CEID[50]/mL 1,58 x 105 CEID[50]/mL 1,58 x 105 CEID[50]/mL 1,58 x 106 CEID[50]/mL 5 x 104 TCID[50]/mL 5 x 104 TCID[50]/mL 5 x 105 TCID[50]/mL 106 TCID[50]/mL 105 TCID[50]/mL 105 TCID[50]/mL 8,89 x 103 CEID[50]/mL 8,89 x 102 CEID[50]/mL 1,58 x 105 CEID[50]/mL RU Type Sous- N° ATCC viral type TR Souche virale IT PERFORMANCES Sensibilité analytique 5 Souche virale Type Sous- N° ATCC viral type Lee/40 B - VR-101 Hong Kong/5/72 B - VR-823 Russia/69 B - VR-790 Jiangsu/10/2003 B - - Brisbane/60/2008 B - - Niveau détectable minimum 8,89 x 103 CEID[50]/mL 8,89 x 103 CEID[50]/mL 8,89 x 104 CEID[50]/mL 105 TCID[50]/mL 105 TCID[50]/mL TCID[50]/mL : concentration produisant l’infection de >50% des cellules en culture. CEID[50]/mL : concentration produisant l’infection de >50% d’embryons de poulet. SENSIBILITE CLINIQUE ET SPECIFICITE Les échantillons obtenus par écouvillon nasopharyngé, aspiration nasopharyngée ou lavage nasal auprès de 72 patients présentant les symptômes de la grippe ont été testés avec bioNexia® Influenza A+B et une technique RT-PCR. Test bioNexia® Influenza A+B (types A et B) Total Technique RT-PCR + + 55 0 1 16 56 16 Total 55 17 72 Sensibilité : 98,2 % ; Spécificité : >99 % ; En outre, sur des échantillons négatifs à la grippe confirmés cliniquement : – 77 patients ont été testés avec bioNexia® Influenza A+B : 75 échantillons sur 77 étaient négatifs pour les types A et B. La spécificité était égale à 97,4 %. – 86 patients ont été testés avec bioNexia® Influenza A+B : 85 échantillons sur 86 étaient négatifs pour le type A. La spécificité était égale à 98,8 %. – 84 patients ont été testés avec bioNexia® Influenza A+B : 83 échantillons sur 84 étaient négatifs pour le type B. La spécificité était égale à 98,8 %. Concordance avec un autre test rapide Les performances du test bioNexia® Influenza A+B ont été évaluées en comparaison avec un autre test immunochromatographique rapide. Les échantillons nasopharyngés (obtenus par écouvillon, aspiration ou lavage) de 93 patients présentant les symptômes de la grippe ont été testés avec les deux techniques. Test immuno-chromatographique de la grippe A + Total bioNexia® Influenza A+B + 4 4 8 Test (Type A) 0 85 85 Total 4 89 93 Concordance globale 95,7 % IC95 % [89,3 – 98,3] Test immuno-chromatographique de la grippe B + Total bioNexia® Influenza A+B + 7 1 8 Test (Type B) 2 83 85 Total 9 84 93 Concordance globale 96,8 % IC95 % [90,8 – 98,9] 6 410918 FR EN Les tests ont été effectués de façon indépendante par trois utilisateurs différents, deux d’entre eux étant des techniciens de laboratoire expérimentés et l’autre étant une personne effectuant des tests rapides de façon occasionnelle (comparable à un auxiliaire médical). Les échantillons positifs ont été préparés par dilution de l’extrait du contrôle positif dans le tampon d’extraction afin d’obtenir un échantillon de contrôle positif moyen et élevé. Un échantillon négatif (tampon uniquement) et les échantillons positifs ont chacun été testé en dix réplicats sur trois lots. Pour tous les tests, l’échantillon négatif a donné un résultat négatif et les échantillons positifs des résultats positifs. La répétabilité (dans un même lot, le même jour) et la reproductibilité (différents lots, différents opérateurs) sont acceptables pour tous les échantillons testés. DE Précision ES Test immuno-chromatographique de la grippe A/B + Total Test bioNexia® Influenza + 11 5 16 A+B (Types A/B) 2 75 77 Total 13 80 93 Concordance globale 92,5 % IC95 % [85,1 – 96,4] Une évaluation a été effectuée pour déterminer la réactivité croisée du test bioNexia® Influenza A+B. Aucune réactivité croisée n’a été observée avec les agents pathogènes respiratoires suivants, présents occasionnellement dans les échantillons : • Virus respiratoire syncytial • Adénovirus IT Réactivité croisée SV PT ELIMINATION DES DECHETS Eliminer les réactifs utilisés ou non utilisés ainsi que les matériels à usage unique contaminés en suivant les procédures relatives aux produits infectieux ou potentiellement infectieux. Il incombe à chaque laboratoire de gérer les déchets et les effluents qu’il produit selon leur nature et leur dangerosité, et de s’assurer du traitement et de l’élimination selon les réglementations applicables. TR RU PL CS REFERENCES BIBLIOGRAPHIQUES 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. bioNexia® Influenza A + B 7 TABLE DES SYMBOLES Symbole Signification Référence du catalogue Dispositif médical de diagnostic in vitro Fabricant Limites de température Utiliser jusque Code du lot Contrôle positif Ne pas utiliser si l’emballage est endommagé Directive sur les dispositifs médicaux Consulter les instructions d’utilisation Ne pas réutiliser Méthode de stérilisation utilisant l’oxyde d’éthylène Conserver à l’abri de la lumière solaire Contenu suffisant pour <n> tests BIOMERIEUX, le logo bleu et bioNexia sont des marques utilisées, déposées et/ou enregistrées appartenant à bioMérieux SA ou à l’une de ses filiales. CLSI est une marque appartenant à Clinical and Laboratory Standards Institute, Inc. Les autres marques et noms de produits mentionnés dans ce document sont des marques commerciales de leurs détenteurs respectifs. bioMérieux SA 69280 Marcy-l’Etoile-France Tél. : 33 (0)4 78 87 20 00 Fax : 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 8 410918 FR DE ES IT PL TR RU PRINCIPLE The bioNexia® Influenza A+B test is a qualitative immunochromatographic assay for the detection of Influenza type A and type B antigens in human nasopharyngeal samples. The bioNexia® Influenza A+B test detects the nucleoprotein, which is the part of the virus that never changes and subsequently detects the A&B subtypes. The test is not intended for the detection of Influenza C antigen. During testing, the sample reacts with the particle coated with anti-Influenza antibodies. The antigen-antibody complexes migrate by capillary action along the membrane that is pre-coated with monoclonal antibodies directed against Influenza type A and type B antigens in the test line region. In case of a positive result the specific antibodies present on the membrane will react with the mixture conjugate and generate one or two colored lines in the FLU A (red) and/or the FLU B (blue) region. If the sample does not contain Influenza antigen, no line will appear in the FLU A and the FLU B region. A green-colored line appearing in the control line region (C) serves as a procedural control and indicates that test migration has been correctly performed. CS SV Although a wide variety of viral agents are capable of causing lower respiratory tract infections in children and adults, the most common agents are Influenza A & B, respiratory syncytial virus (RSV), para Influenza viruses 1, 2, and 3, and adenovirus. Among these, Influenza A & B and RSV are the most important causes of medically-attended acute respiratory illness. In addition to sharing a similar seasonal prevalence, it is important to remain cognizant of the fact that Influenza A & B and RSV share overlapping clinical features and infection potential for certain high-risk patient groups (e.g., patients at the extremes of age, patients suffering from underlying cardiopulmonary disease and immunosuppression). PT SUMMARY AND EXPLANATION Influenza is a highly contagious, acute infection of the respiratory tract caused by viruses known as Influenza viruses. There are three types of Influenza viruses: A, B, and C, but only A & B types are known to cause infections in humans regularly. Type A viruses are the most frequent and are often associated with most severe epidemics. Type B viruses produce symptoms that are generally milder than those caused by type A. Type A and type B viruses can circulate simultaneously, but usually one type is dominant during a seasonal epidemic (1). EN INTENDED USE The bioNexia® Influenza A+B test is a rapid immunochromatographic test for the qualitative detection of Influenza type A and type B antigens in human nasopharyngeal samples. The test is indicated for use as an aid in the diagnosis of Influenza infection. The test is intended for professional in vitro diagnostic use only. bioNexia® Influenza A + B 9 CONTENT OF THE KIT (10 TESTS) 10 Test cassettes 1 Buffer bottle R1 10 Extraction EXT tubes with dropper caps 1 Positive control swab 10 Sterile swabs In individual sealed pouches with a disposable specimen pipette and a desiccant. The test cassette membrane is coated with mouse monoclonal antibodies directed against Influenza type A and type B antigens. Plastic vial containing 6 mL of buffer solution. Ready-to-use. PBS buffer containing detergent and <0.1% sodium azide. Plastic tube and dropper cap with filter for single use only. In an individual sealed pouch with desiccant. The swab is coated with inactivated extracts of Influenza A and Influenza B strains. Single-use device to collect nasopharyngeal samples (under the Directive 93/42/EEC, CE 0123). Sterilization using ethylene oxide. Sterile only if peel-pouch is intact. 1 Reagent holder 1 User quick guide printed on the box 1 Package insert MATERIALS REQUIRED BUT NOT PROVIDED Container for sample collection Disposable gloves Suction apparatus, sterile suction catheter Timer WARNINGS AND PRECAUTIONS • • • • • • • • For in vitro diagnostic use only. For professional use only. This kit contains products of animal origin. Certified knowledge of the origin and/or sanitary state of the animals does not totally guarantee the absence of transmissible pathogenic agents. It is therefore recommended that these products be treated as potentially infectious, and handled observing the usual safety precautions. Do not use reagents after the expiry date indicated on the packaging. The test cassette, the sterile swab and the positive control should be stored in the sealed pouch containing the desiccant until use. Do not use them if the pouch foil packaging is damaged. All the components except the buffer (R1) are disposable; they should not be reused. All specimens should be considered infectious and handled following the recommended precautions (CLSI® M29-A, Protection of Laboratory Workers from Instrument Biohazards and Infectious Disease Transmitted by Blood, Body Fluids, and Tissue; Approved Guideline – Current revision). For additional information on handling precautions, refer to “Biosafety in Microbiological and Biomedical Laboratories – CDC/NIH – Latest edition“, or the current regulations in the country of use. The sample buffer (R1) contains sodium azide (preservative) at a concentration below the threshold limit value of 0.1%. STORAGE AND STABILITY • • 10 Store the kit at 2–30°C. DO NOT FREEZE. 410918 • • If stored according to the recommended conditions, all components are stable until the expiry date indicated on the packaging. Do not use beyond the expiry date. The test device should remain in the pouch until use. Use the test cassette and the positive control within one hour after opening. FR • SPECIMEN COLLECTION AND PREPARATION Nasopharyngeal swab method DE Insert the swab through the nostril to the posterior nasopharynx. – Rotate the swab a few times to obtain infected cells (take care not to break the shaft at the molded breakpoint). – For optimal sampling, repeat the procedure using the other nostril. Prepare the sample immediately as described in the paragraph Instructions for use. EN – Nasopharyngeal aspiration or nasal wash methods Instill several drops of saline solution into each nostril. Place the catheter through the nostril to the posterior nasopharynx. – Apply gentle suction. Using a rotating movement, slowly withdraw the catheter. – For optimal sampling, repeat the procedure using the other nostril. Prepare the sample immediately as described in the paragraph Instructions for use. ES – – IT INSTRUCTIONS FOR USE Allow the tests, samples and reagents to reach room temperature (15–30°C) prior to testing. Do not open the refrigerated pouch, to avoid condensation of atmospheric humidity on the test membrane. – Procedure for nasopharyngeal aspirate or wash samples (refer to quick guide 1a to 1c) – – – – – – Open the pouch and remove the disposable specimen pipette. With this pipette, dispense 6 drops of the nasopharyngeal wash or aspirate sample into an extraction tube (one for each sample). Add 3 drops of R1, put the dropper cap on the extraction tube and mix well. Remove the bioNexia® Influenza A+B test from its pouch. Hold the extraction tube vertically and dispense exactly 3 drops into the sample well (S). Read the result 10 minutes after dispensing the sample. This timeline must be strictly adhered to, to ensure correct results are obtained. SV CS – PL – Use a separate extraction tube for each sample. Add 15 drops of R1 into the extraction tube. Put the nasopharyngeal swab (or the positive control swab) into the extraction tube and mix well. Expel as much liquid as possible from the swab. Remove the swab and put the dropper cap on the tube. Remove the bioNexia® Influenza A+B test from its sealed pouch. Hold the extraction tube vertically and dispense exactly 3 drops into the sample well (S). Read the result 10 minutes after dispensing the sample. This timeline must be strictly adhered to, to ensure correct results are obtained. RU – – – PT Procedure for nasopharyngeal swab samples and the positive control (refer to quick guide 1a’ to 1b’) SAMPLE STABILITY AFTER PRE-TREATMENT TR The diluted sample can be used immediately or stored at 18–25°C or 2–8°C for up to 8 hours. bioNexia® Influenza A + B 11 INTERPRETATION OF RESULTS POSITIVE • • • Influenza A positive: Two distinct lines appear across the result window: one red line appears in the FLU A region and one green line appears in the control line region (C) . Influenza B positive: Two distinct lines appear across the result window: one blue line appears in the FLU B region and one green line appears in the control line region (C). Influenza A+B positive: Three distinct lines appear across the result window: one red line appears in the FLU A region one blue line appears in the FLU B region and one green line appears in the control line region (C). The intensity of the color in the test line regions may vary depending on the concentration of Influenza antigens present in the sample. However, the concentration of Influenza antigens in the sample cannot be determined by this qualitative test. A faint red/blue line should be considered positive. NEGATIVE One green line appears across the control line region (C). No visible line appears in the FLU A and FLU B regions. INVALID The green colored control line (C) does not appear. In this case, the result is invalid even if the test line is visible (red line in the FLU A region and/or blue line in the FLU B region). No green line in the control line region (C) means that test migration has not been correctly performed and the test result is invalid. Review the procedure and repeat the test with a new test cassette. If the problem persists, discontinue using the test kit immediately and contact your local distributor. C FLU A C FLU A C FLU A FLU B FLU B FLU B Read the result at 10 minutes FLU A FLU A FLU B Influenza A+B FLU A+B FLU B Positive + C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B Negative Invalid x QUALITY CONTROL One positive control swab is included in the kit. The positive control should generate an Influenza A+B positive result. This control must be performed immediately after opening a new kit to ensure that reagent performance has not been altered. Results cannot be validated if the control results deviate from the expected results. The test includes an internal procedural control and a colored line (C) indicates that test migration has been correctly performed. If the control line does not appear, the test is invalid. It is the responsibility of the user to perform Quality Control in accordance with any local applicable regulations. LIMITATIONS OF THE METHOD 1. bioNexia® Influenza A+B will only indicate the presence of Influenza in the sample (qualitative detection) and should be used for the detection of Influenza type A and type B antigens in nasopharyngeal samples only (from swab, aspirate or wash). Neither the quantitative value nor the rate of increase in Influenza antigen concentration can be determined by this test. 2. If the test result is negative and clinical symptoms persist, additional testing using other methods is recommended. 12 410918 FR A negative result does not at any time preclude the possibility of Influenza infection. 3. This test provides a presumptive diagnosis of Influenza infections. All results must be interpreted together with other clinical information and laboratory findings available to the physician. A H1N1 VR-333 Victoria/3/75 A H3N2 VR-822 Swine/1976/31 A H1N1 VR-99 Weiss/43 A H1N1 VR-96 New Jersey/8/76 (Hsw N1) NWS/33 A H1N1 VR-897 A H1N1 VR-219 Port Chalmers/1/73 California/07/09 A H3N2 VR-810 A H1N1 - Paris/5509/09 A H1N1 - Niger/2090/06 A H5N1 - Vietnam/1203/04 A H5N1 - Solomon Islands/3/2006 South Dakota/6/2007 R22 Barbara A H1N1 - A H1N1 - B - VR-788 Maryland/1/59 B - VR-296 GL/1739/54 B - VR-103 Lee/40 B - VR-101 Hong Kong/5/72 B - VR-823 Russia/69 B - VR-790 Jiangsu/10/2003 B - - Brisbane/60/2008 B - - DE Swine/Iowa/15/30 ES VR-95 IT H1N1 PT A SV PR/8/34 Minimum Detectable Level 8.89 x 105 CEID[50]/mL 8.89 x 106 CEID[50]/mL 1.58 x 105 CEID[50]/mL 8.89 x 105 CEID[50]/mL 8.89 x 108 CEID[50]/mL 1.58 x 105 CEID[50]/mL 1.58 x 105 CEID[50]/mL 1.58 x 106 CEID[50]/mL 5 x 104 TCID[50]/mL 5 x 104 TCID[50]/mL 5 x 105 TCID[50]/mL 106 TCID[50]/mL 105 TCID[50]/mL 105 TCID[50]/mL 8.89 x 103 CEID[50]/mL 8.89 x 102 CEID[50]/mL 1.58 x 105 CEID[50]/mL 8.89 x 103 CEID[50]/mL 8.89 x 103 CEID[50]/mL 8.89 x 104 CEID[50]/mL 105 TCID[50]/mL 105 TCID[50]/mL CS Viral Sub- ATCC # Type type PL Viral strain RU Analytical sensitivity was determined using a total of 22 strains of human Influenza viruses: 14 Influenza A and 8 Influenza B. EN PERFORMANCE Analytical Sensitivity TCID[50]/mL: 50% tissue culture infectious dose CEID[50]/mL: 50% chicken embryo infectious dose bioNexia® Influenza A + B 13 TR CLINICAL SENSITIVITY AND SPECIFICITY Nasopharyngeal swab, aspirate or wash samples from 72 patients with flu symptoms were tested with the bioNexia® Influenza A+B test and a RT-PCR technique. bioNexia® Influenza A+B Test (Type A +B line) Total RT-PCR technique + + 55 0 1 16 56 16 Total 55 17 72 Sensitivity: 98.2%; Specificity: >99%; In addition, on clinically-confirmed influenza negative specimens: – 77 patients were tested with the bioNexia® Influenza A+B Test:75 out of the 77 specimens were negative for the A and B lines. The specificity was 97.4%. – 86 patients were tested with the bioNexia® Influenza A+B Test: 85 out of the 86 specimens were negative for the A line. The specificity was 98.8%. – 84 patients were tested with the bioNexia® Influenza A+B Test: 83 out of the 84 specimens were negative for the B line. The specificity was 98.8%. Agreement with another rapid test The performance of the bioNexia® Influenza A+B test has been evaluated in comparison with another rapid immunochromatographic test. Nasopharyngeal specimens (swab, aspirate or wash) of 93 patients with influenza symptoms were tested with both techniques. Influenza type A Immunochromatographic assay + Total bioNexia® Influenza A+B + 4 4 8 Test (Type A line) 0 85 85 Total 4 89 93 Global agreement 95.7% CI95% [89.3–98.3] Influenza type B Immunochromatographic assay + Total bioNexia® Influenza A+B + 7 1 8 Test (Type B line) 2 83 85 Total 9 84 93 Global agreement 96.8% CI95% [90.8–98.9] Influenza type A/B Immunochromatographic assay + Total bioNexia® Influenza A+B + 11 5 16 Test (Type A/B line) 2 75 77 Total 13 80 93 Global agreement 92.5% CI95% [85.1–96.4] Precision The tests were performed independently by three different users, two of whom are experienced laboratory personnel and one of whom is a person who occasionally evaluates rapid tests (comparable to a physician’s assistance). Positive samples were prepared by dilution of the positive control extract in the extraction buffer in order to obtain a medium positive and a high positive control sample. A negative sample (buffer only) and the positive samples were each tested in ten replicates on three lots. For all the tests, the negative sample gave negative results and the positive samples gave positive results. Repeatability (within-lot, same day) and reproducibility (between-lot, different operators) are acceptable for all tested samples. 14 410918 An evaluation was performed to determine the crossreactivity of the bioNexia® Influenza A+B test. No crossreactivity was observed with the following respiratory pathogens occasionally present in nasopharyngeal samples: • Respiratory syncytial virus • Adenovirus FR Cross-Reactivity DE EN WASTE DISPOSAL Dispose of used or unused reagents as well as any other contaminated disposable materials following procedures for infectious or potentially infectious products. It is the responsibility of each laboratory to handle waste and effluents produced according to their nature and degree of hazardousness and to treat and dispose of them (or have them treated and disposed of ) in accordance with any applicable regulations. ES LITERATURE REFERENCES 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. INDEX OF SYMBOLS Symbol Meaning IT Catalogue number In Vitro Diagnostic Medical Device Manufacturer PT Temperature limitation Use by SV Batch code Positive control Do not use if package damaged CS Medical Device Directive Consult Instructions for Use Do not reuse PL Method of sterilization using ethylene oxide Keep away from sunlight TR RU Contains sufficient for <n> tests bioNexia® Influenza A + B 15 WARRANTY bioMérieux disclaims all warranties, express or implied, including any implied warranties of MERCHANTABILITY AND FITNESS FOR A PARTICULAR USE. bioMérieux shall not be liable for any incidental or consequential damages. IN NO EVENT SHALL BIOMERIEUX’S LIABILITY TO CUSTOMER UNDER ANY CLAIM EXCEED A REFUND OF THE AMOUNT PAID TO BIOMERIEUX FOR THE PRODUCT OR SERVICE WHICH IS THE SUBJECT OF THE CLAIM. BIOMERIEUX, the blue logo and bioNexia are used, pending and/or registered trademarks belonging to bioMérieux SA or one of its subsidiaries. CLSI is a trademark belonging to Clinical and Laboratory Standards Institute, Inc. Any other name or trademark is the property of its respective owner. bioMérieux SA 69280 Marcy-l‘Etoile-France Tel: 33 (0)4 78 87 20 00 Fax: 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 16 410918 FR DE ES IT PT Obgleich eine große Bandbreite viraler Krankheitserreger Infektionen der unteren Atemwege bei Kindern und Erwachsenen hervorrufen kann, treten Influenza A/B, das Respiratory-Syncytial-Virus (RSV), die Parainfluenza-Viren 1, 2 und 3 sowie das Adenovirus am häufigsten auf. Hierbei sind Influenza A und B sowie RSV die Hauptverursacher ärztlich behandelter, akuter Atemwegserkrankungen. Abgesehen davon, dass diesen eine ähnliche saisonale Prävalenz gemeinsam ist, darf nicht außer Acht gelassen werden, dass Influenza A und B sowie RSV einander überschneidende klinische Merkmale haben und ihnen ein besonderes Infektionspotential für bestimmte Hochrisiko-Patientengruppen gemeinsam ist (Altersextreme, kardiopulmonale Grunderkrankungen und Immunsuppression). SV EINFÜHRUNG UND TESTERKLÄRUNG Influenza ist eine hochansteckende, akute Infektion der Atemwege, die von als Influenzaviren bezeichneten Viren ausgelöst wird. Es gibt drei Arten von Influenzaviren: A, B und C, jedoch ist nur von Typ A und B bekannt, dass sie regelmäßig Infektionen beim Menschen auslösen. Viren vom Typ A kommen am häufigsten vor und werden oft mit den schwerwiegenderen Epidemien in Zusammenhang gebracht. Viren vom Typ B verursachen in der Regel mildere Symptome als Typ A. Viren von Typ A und Typ B können gleichzeitig im Umlauf sein, jedoch ist in der Regel ein Typ während einer saisonalen Epidemie dominant (1). EN VERWENDUNGSZWECK Der bioNexia® Influenza A+B-Test ist ein immunochromatographischer Schnelltest für den qualitativen Nachweis von Influenza-Antigenen Typ A und Typ B in humanen nasopharyngealen Proben. Der Test ist als Hilfe bei der Diagnose von Influenzainfektionen angezeigt. Der Test ist nur für die in-vitro-Diagnostik durch Fachpersonal angezeigt. bioNexia® Influenza A + B 17 TR RU PL CS PRINZIP Der bioNexia® Influenza A+B-Test ist ein immunochromatographischer Test für den qualitativen Nachweis von InfluenzaAntigenen Typ A und Typ B in humanen nasopharyngealen Proben. Der bioNexia® Influenza A+B-Test erkennt das Nukleoprotein, das den unveränderlichen Anteil des Virus ausmacht, und kann so die A- und B-Subtypen erkennen. Der Test ist nicht für den Nachweis des Influenza C-Antigens angezeigt. Während des Testvorgangs reagiert die Probe mit den Partikeln, die mit Anti-Influenza-Antikörpern beschichtet sind. Die Antigen-Antikörper-Komplexe migrieren aufgrund der Kapillarwirkung entlang der Membran, die im Testlinienbereich mit monoklonalen Antikörpern gegen Influenza Typ A- und Typ B-Antigene beschichtet ist. Bei einem positiven Ergebnis reagieren die auf der Membran vorhandenen spezifischen Antikörper mit dem Konjugat und es erscheinen ein oder zwei farbige Linien im FLU A- (rot) und/oder FLU B-Bereich (blau). Wenn die Probe kein Influenza-Antigen enthält, erscheint keine Linie im FLU A- oder FLU B-Bereich. Eine grüne Linie im Kontrolllinienbereich (C) dient der Verfahrenskontrolle und zeigt an, dass die Testmigration richtig durchgeführt wurde. PACKUNGSINHALT (10 TESTS) 10 Testkassetten 1 Flasche mit Pufferlösung R1 10 Extraktions- EXT röhrchen mit Tropfkappe 1 Positivkontrolle (Tupfer) 10 sterile Tupfer In einzeln versiegelten Beuteln mit einer Einwegpipette zur Proben-entnahme und einem Trockenmittel. Die Membran der Testkassette ist mit monoklonalen MausAntikörpern gegen Influenza Typ A- und Typ B-Antigene beschichtet. Plastikfläschchen mit 6 ml Pufferlösung. Gebrauchsfertig. PBS-Puffer mit Detergens und <0,1 % Natriumazid. Plastikröhrchen und Tropfkappe mit Filter für den einmaligen Gebrauch. In einem einzeln versiegelten Beutel mit einem Trockenmittel. Der Tupfer ist mit inaktivierten Extrakten von Influenza A- und Influenza B-Stämmen beschichtet. Einmaltupfer zur Entnahme der nasopharyngealen Proben (gemäß Medizinprodukterichtlinie 93/42/EWG, CE 0123). Sterilisation mit Ethylenoxid. Nur steril wenn Beutel unbeschädigt. 1 Reagenzienhalter 1 Kurzanleitung auf der Verpackung 1 Arbeitsanleitung ZUSÄTZLICH ERFORDERLICHE MATERIALIEN Gefäß zum Sammeln der Probe Einmal-Schutzhandschuhe Absaugvorrichtung, steriler Absaugkatheter Stoppuhr VORSICHTSMASSNAHMEN • • • Ausschließlich für die in vitro-Diagnostik bestimmt. Nur für die Verwendung durch Fachkundige bestimmt. Dieser Kit enthält Produkte tierischen Ursprungs. Da durch die Kontrolle der Herkunft und/oder des Gesundheitszustandes der Tiere nicht völlig gewährleistet werden kann, dass diese Produkte keine übertragbaren pathogenen Erreger enthalten, ist es empfehlenswert, die Produkte als potenziell infektiös zu betrachten und unter Beachtung entsprechender Vorsichtsmaßnahmen zu behandeln. • Die Reagenzien nach Ablauf des auf der Verpackung angegebenen Verfallsdatums nicht mehr verwenden. • Die Testkassette, der sterile Tupfer und die Positivkontrolle müssen bis zum Gebrauch mit dem Trockenmittel im versiegelten Beutel gelagert werden. Verwenden Sie die Komponenten nicht, wenn die Schutzfolie beschädigt ist. • Alle Komponenten außer dem Puffer (R1) sind für den einmaligen Gebrauch bestimmt und dürfen nicht wiederverwendet werden. • Alle Proben müssen als potenziell infektiös betrachtet und unter Beachtung geeigneter Vorsichtsmaßnahmen sachgemäß behandelt werden. Siehe „CLSI® M29-A, Protection of Laboratory Workers from Instrument Biohazards and Infectious Disease Transmitted by Blood, Body Fluids, and Tissue, Approved Guideline“ – Aktuelle Ausgabe. Weitere diesbezügliche Informationen finden Sie in „Biosafety in Microbiological and Biomedical Laboratories, CDC/NIH“ – Neueste Ausgabe oder in den jeweils gültigen Richtlinien. • Der Probenpuffer (R1) enthält Natriumazid (ein Konservierungsmittel) in einer Konzentration unterhalb dem Grenzwert von 0,1 %. 410918 18 • EN • Lagern Sie den Kit bei 2 bis 30 °C. NICHT EINFRIEREN. Unter den empfohlenen Lagerungsbedingungen sind alle Kitbestandteile bis zu dem auf der Verpackung angegebenen Verfallsdatum haltbar. Nach Ablauf des Verfallsdatums nicht mehr verwenden. Die Testkassette muss bis zum Gebrauch im Originalbeutel aufbewahrt werden. Die Testkassette und die Positivkontrolle innerhalb einer Stunde nach dem Öffnen verwenden. FR LAGERUNGSBEDINGUNGEN UND HALTBARKEIT • • • PROBENGEWINNUNG UND -VORBEREITUNG Nasopharyngealabstrich-Methode Nasopharyngealaspirations-oder NasenspülungsMethode In jedes Nasenloch mehrere Tropfen Salzlösung einträufeln. Katheter durch das Nasenloch zum hinteren Nasenrachenraum führen. – Vorsichtig absaugen. Den Katheter mit drehender Bewegung langsam herausziehen. – Für eine optimale Probe das Verfahren im anderen Nasenloch wiederholen. Probe sofort wie im Abschnitt „Testdurchführung“ beschrieben aufbereiten. ES Tupfer durch das Nasenloch zum hinteren Nasenrachenraum führen. – Tupfer mehrmals drehen, um infizierte Zellen aufzunehmen (darauf achten, dass der Schaft nicht an der vorgeformten Bruchstelle abbricht). – Für eine optimale Probe das Verfahren im anderen Nasenloch wiederholen. Probe sofort wie im Abschnitt „Testdurchführung“ beschrieben aufbereiten. DE – – – – – Verarbeitung der nasopharyngealen Aspiratoder Spülungsproben (siehe Kurzanleitung 1a bis 1c) – – – – – Beutel öffnen und Einwegprobenpipette herausnehmen. Mit der Pipette 6 Tropfen der nasopharyngealen Spülungs- oder Aspiratprobe in ein Extraktionsröhrchen geben (ein separates Röhrchen je Probe). 3 Tropfen R1 zugeben, die Tropfkappe auf das Extraktionsröhrchen setzen und gut mischen. bioNexia® Influenza A+B-Test aus dem Beutel nehmen. Extraktionsröhrchen senkrecht halten und genau 3 Tropfen in die Probenkammer geben (S). bioNexia® Influenza A + B 19 PT SV CS – – Für jede Probe ein separates Extraktionsröhrchen verwenden. 15 Tropfen R1 in das Extraktionsröhrchen geben. Den Nasopharyngealtupfer (oder den Positiv-kontrolltupfer) in das Extraktionsröhrchen geben und gut mischen. Soviel Flüssigkeit wie möglich aus dem Tupfer drücken. Tupfer herausnehmen und Tropfkappe auf das Röhrchen setzen. bioNexia® Influenza A+B-Test aus dem versiegelten Beutel nehmen. Extraktionsröhrchen senkrecht halten und genau 3 Tropfen in die Probenkammer geben (S). Das Ergebnis 10 Minuten nach Eintropfen der Probe ablesen. Dieser Zeitraum ist genau zu beachten, um korrekte Ergebnisse zu erzielen. PL – RU Verarbeitung des entnommenen Nasopharyngealabstrichs und der Positivkontrolle (siehe Kurzanleitung 1a‘ bis 1b‘) TR TESTDURCHFÜHRUNG Tests, Proben und Reagenzien vor der Testdurchführung auf Raumtemperatur (15 – 30 °C) bringen. Öffnen Sie keine gekühlten Beutel, um eine Kondensation von Luftfeuchtigkeit auf der Testmembran zu vermeiden. IT – – Das Ergebnis 10 Minuten nach Eintropfen der Probe ablesen. Dieser Zeitraum ist genau zu beachten, um korrekte Ergebnisse zu erzielen. PROBENSTABILITÄT NACH DER AUFBEREITUNG Die verdünnte Probe kann entweder sofort verwendet oder bei 18 – 25 °C oder 2 – 8 °C bis zu 8 Stunden gelagert werden. INTERPRETATION DER ERGEBNISSE POSITIV • • • Influenza A positiv: Zwei deutliche Linien erscheinen im Ergebnisfenster: eine rote Linie im FLU A-Bereich und eine grüne Linie im Kontrolllinienbereich (C). Influenza B positiv: Zwei deutliche Linien erscheinen im Ergebnisfenster: eine blaue Linie im FLU B-Bereich und eine grüne Linie im Kontrolllinienbereich (C). Influenza A+B positiv: Drei deutliche Linien erscheinen im Ergebnisfenster: eine rote Linie im FLU A-Bereich, eine blaue Linie im FLU B-Bereich und eine grüne Linie im Kontrolllinienbereich (C). Die Intensität der Farbe der Testlinien kann in Abhängigkeit von der Konzentration der in der Probe vorhandenen Influenza-Antigene variieren. Die Konzentration der Influenza-Antigene in der Probekann mit diesem qualitativen Test jedoch nicht bestimmt werden. Eine schwach rot/blau gefärbte Linie sollte als positives Ergebnis gewertet werden. NEGATIV Eine grüne Linie wird im Kontrolllinienbereich (C) erkennbar. Keine erkennbare Linie in den Bereichen FLU A und FLU B. UNGÜLTIG Die grüne Kontrolllinie (C) wird nicht angezeigt. In diesem Fall ist das Ergebnis auch dann ungültig, wenn eine Testlinie erkennbar ist (rote Linie im FLU A-Bereich und/oder blaue Linie im FLU B-Bereich). Wird keine grüne Linie im Kontrolllinienbereich (C) erkennbar, so ist dies auf eine inkorrekte Durchführung der Testmigration zurückzuführen. Das Testergebnis ist somit ungültig. Überprüfen Sie das Verfahren und wiederholen Sie den Test mit einer neuen Testkassette. Falls das Problem bestehen bleibt, brechen Sie die Verwendung des Testkits sofort ab und wenden Sie sich bitte an Ihre Vertretung vor Ort. C FLU A C FLU A C FLU A FLU B FLU B FLU B Lesen Sie das Ergebnis nach genau 10 Minuten ab FLU A FLU A FLU B Influenza A+B FLU A+B FLU B Positiv + C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B Negativ Ungültig x QUALITÄTSKONTROLLE Im Kit ist ein Positivkontrolltupfer enthalten. Die Positivkontrolle muss ein positives Ergebnis für Influenza A+B ergeben. Diese Kontrolle muss sofort nach dem Öffnen eines neuen Kits durchgeführt werden, um sicherzustellen, dass die Reagenzienleistung nicht verändert wurde. Ergebnisse können nicht validiert werden, wenn die Kontrollergebnisse von den erwarteten Ergebnissen abweichen. Der Test beinhaltet eine interne Verfahrenskontrolle und eine farbige Linie (C) zeigt an, dass die Testmigration richtig durchgeführt wurde. Wird die Kontrolllinie nicht angezeigt, ist der Test ungültig. Es liegt in der Verantwortung des Anwenders, die Qualitätskontrolle in Übereinstimmung mit den einschlägigen lokalen Vorschriften durchzuführen. 410918 20 DE EN FR LIMITIERUNGEN 1. bioNexia® Influenza A+B zeigt nur das Vorhandensein von Influenza in der Probe an (qualitativer Nachweis) und darf nur für den Nachweis von Influenza Typ Aund Typ B-Antigenen in nasopharyngealen Proben (Abstrich oder Spülung) verwendet werden. Weder der quantitative Wert noch die Erhöhungsrate der InfluenzaAntigenkonzentration kann mit diesem Test ermittelt werden. 2. Wenn das Testergebnis negativ ist und die klinischen Symptome weiterhin bestehen, werden zusätzliche Tests mit anderen Methoden empfohlen. Ein negatives Ergebnis schließt keinesfalls die Möglichkeit einer Influenza-Infektion aus. 3. Dieser Test bietet eine mutmaßliche Diagnose von Influenza-Infektionen. Alle Ergebnisse müssen im Zusammenhang mit anderen, dem Arzt zur Verfügung stehenden klinischen Informationen und Laborbefunden interpretiert werden. Swine/Iowa/15/30 A H1N1 VR-333 Victoria/3/75 A H3N2 VR-822 Swine/1976/31 A H1N1 VR-99 Weiss/43 A H1N1 VR-96 New Jersey/8/76 (Hsw N1) NWS/33 A H1N1 VR-897 A H1N1 VR-219 Port Chalmers/1/73 California/07/09 A H3N2 VR-810 A H1N1 - Paris/5509/09 A H1N1 - Niger/2090/06 A H5N1 - Vietnam/1203/04 Solomon Islands/3/2006 South Dakota/6/2007 R22 Barbara A A H5N1 H1N1 - A H1N1 - 105 TCID[50]/ml B - VR-788 Maryland/1/59 B - VR-296 GL/1739/54 B - VR-103 Lee/40 B - VR-101 Hong Kong/5/72 B - VR-823 8,89 x 103 CEID[50]/ml 8,89 x 102 CEID[50]/ml 1,58 x 105 CEID[50]/ml 8,89 x 103 CEID[50]/ml 8,89 x 103 CEID[50]/ml VR-95 IT H1N1 PT A SV PR/8/34 Minimal erkennbare Konzentration 8,89 x 105 CEID[50]/ml 8,89 x 106 CEID[50]/ml 1,58 x 105 CEID[50]/ml 8,89 x 105 CEID[50]/ml 8,89 x 108 CEID[50]/ml 1,58 x 105 CEID[50]/ml 1,58 x 105 CEID[50]/ml 1,58 x 106 CEID[50]/ml 5 x 104 TCID[50]/ml 5 x 104 TCID[50]/ml 5 x 105 TCID[50]/ml 106 TCID[50]/ml 105 TCID[50]/ml CS ATCC Nr. PL Virus- Subtyp typ TR Virusstamm RU Die analytische Empfindlichkeit wurde mit insgesamt 22 Stämmen von humanen Influenza-Viren ermittelt: 14 Influenza A und 8 Influenza B. ES PERFORMANCE Analytische Empfindlichkeit bioNexia® Influenza A + B 21 Virusstamm Virus- Subtyp typ Russia/69 B - Jiangsu/10/2003 Brisbane/60/2008 B B - ATCC Nr. Minimal erkennbare Konzentration VR-790 8,89 x 104 CEID[50]/ml 105 TCID[50]/ml 105 TCID[50]/ml TCID[50]/ml: 50 % infektiöse Dosis in der Gewebekultur CEID[50]/ml: 50 % infektiöse Dosis in Hühnerembryos KLINISCHE SENSITIVITÄT UND SPEZIFITÄT Nasopharyngeale Abstrich-, Aspirat- oder Spülungsproben von 72 Patienten mit Grippesymptomen wurden mit dem bioNexia® Influenza A+B-Test und einer RT-PCR-Technik getestet. RT-PCR-Technik + - Gesamtanzahl bioNexia® Influenza A+BTest (Typ A- und B-Linie) Gesamtanzahl + - 55 1 56 0 16 16 55 17 72 Empfindlichkeit: 98,2 %; Spezifität: >99 %; Außerdem ergaben klinisch bestätigte Influenza-negative Proben folgende Ergebnisse: – 77 Patienten wurden mit dem bioNexia® Influenza A+B Test getestet: 75 der 77 Proben waren negativ für A- und B-Linie. Die Spezifität betrug 97,4 %. – 86 Patienten wurden mit dem bioNexia® Influenza A+B Test getestet: 85 der 86 Proben waren negativ für die A-Linie. Die Spezifität betrug 98,8 %. – 84 Patienten wurden mit dem bioNexia® Influenza A+B Test getestet: 83 der 84 Proben waren negativ für die B-Linie. Die Spezifität betrug 98,8 %. Übereinstimmung mit einem anderen Schnelltest Die Leistung des bioNexia® Influenza A+B-Tests wurde im Vergleich zu einem anderen immunochromatographischen Schnelltest ermittelt. Nasopharyngeale Proben (Abstrich, Aspiration oder Spülung) von 93 Patienten mit InfluenzaSymptomen wurden mit beiden Techniken getestet. Influenza Typ A – Immunochromatographischer Test + - Gesamtanzahl bioNexia® Influenza A+B- + 4 4 8 Test (Typ A-Linie) 0 85 85 Gesamtanzahl 4 89 93 Globale Übereinstimmung 95,7 % CI95 % [89,3 – 98,3] Influenza Typ B – Immunochromatographischer Test + - Gesamtanzahl bioNexia® Influenza A+B- + 7 1 8 Test (Typ B-Linie) 2 83 85 Gesamtanzahl 9 84 93 Globale Übereinstimmung 96,8 % CI95 % [90,8 – 98,9] Influenza Typ A/B – Immunochromatographischer Test + - Gesamtanzahl bioNexia® Influenza A+B- + 11 5 16 Test (Typ A- und B-Linie) 2 75 77 Gesamtanzahl 13 80 93 Globale Übereinstimmung 92,5 % CI95 % [85,1 – 96,4] 22 410918 EN DE Die Tests wurden unabhängig von drei verschiedenen Anwendern durchgeführt. Zwei waren erfahrene Laborkräfte und eine Person führt gelegentlich Schnelltests durch (einem Arzthelfer vergleichbar). Positive Proben wurden durch Verdünnen des Positivkontrollenextrakts im Extraktionspuffer zur Herstellung einer mittleren positiven und einer deutlich positiven Kontrollprobe gewonnen. Eine negative Probe (nur Puffer) und die positiven Proben wurden dann mit jeweils 10 Wiederholungen aus 3 Chargen getestet. Bei allen Tests ergaben die negativen Proben negative Ergebnisse und die positiven Proben positive Ergebnisse. Die Wiederholbarkeit (innerhalb der Charge, am selben Tag) und die Reproduzierbarkeit (unterschiedliche Chargen, unterschiedliche Benutzer) war für alle getesteten Proben gegeben. FR Präzision Es wurde eine Auswertung zu Bestimmung der Kreuzreaktivität des bioNexia® Influenza A+B-Tests vorgenommen. Es besteht keine Kreuzreaktivität mit folgenden respiratorischen Pathogenen, die gelegentlich in nasopharyngealen Proben vorhanden sind: • Respiratory-Syncytial-Virus • Adenovirus ES Kreuzreaktivität LITERATUR TR RU PL CS 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. SV PT IT BESEITIGUNG DER ABFÄLLE Entsorgen Sie alle gebrauchten und nicht gebrauchten Reagenzien sowie kontaminierte Einwegmaterialien gemäß den für infektiöse oder potenziell infektiöse Materialien geltenden Bestimmungen. Es liegt in der Verantwortung jedes Labors, die entstandenen Fest- und Flüssigabfälle gemäß der jeweiligen Risikogruppe zu behandeln und deren Entsorgung in Übereinstimmung mit den gültigen gesetzlichen Bestimmungen sicherzustellen. bioNexia® Influenza A + B 23 SYMBOLE Symbol Bedeutung Bestellnummer In-vitro-Diagnostikum Hersteller Temperaturbegrenzung Verwendbar bis Chargenbezeichnung Positive Kontrolle Nicht verwenden, wenn die Verpackung beschädigt ist. Medizinprodukterichtlinie Gebrauchsanweisung beachten Nicht zur Wiederverwendung Sterilisation mit Ethylenoxid Vor Sonnenlicht schützen Inhalt ausreichend für <n> Tests BIOMERIEUX, das blaue Logo und bioNexia sind verwendete, angemeldete und/oder eingetragene Marken von bioMérieux SA oder einer ihrer Niederlassungen. CLSI ist eine Marke von Clinical and Laboratory Standards Institute, Inc. Alle anderen Namen oder Marken sind Eigentum ihrer jeweiligen Inhaber. bioMérieux SA 69280 Marcy-l’Etoile-France Tel.: 33 (0)4 78 87 20 00 Fax: 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 24 410918 FR DE ES IT PT Aunque hay muchos agentes víricos capaces de causar infecciones de las vías respiratorias bajas en niños y adultos, los más corrientes son los virus de la gripe A y B, el virus respiratorio sincitial (RSV), los virus paragripales 1, 2 y 3 y los adenovirus. Entre ellos, los causantes más importantes de enfermedades respiratorias agudas que precisan de atención médica son los virus de la gripe A y B y el RSV. Es importante saber que los virus de la gripe A y B y el RSV, además de compartir una prevalencia estacional parecida, también tienen características clínicas comunes y un potencial para infectar a determinados grupos de pacientes de alto riesgo (por ejemplo, a los pacientes de corta edad y de edad avanzada, los pacientes con trastornos cardiopulmonares subyacentes y con inmunosupresión). SV RESUMEN Y EXPLICACIÓN La gripe es una infección aguda de las vías respiratorias muy contagiosa, causada por virus conocidos como virus de la gripe. Existen tres tipos de virus de la gripe: A, B y C, pero solamente los de tipo A y B han sido identificados regularmente como causa de infecciones en los seres humanos. Los virus de tipo A son los más frecuentes y suelen estar asociados a las epidemias más graves. Los virus de tipo B generalmente producen síntomas más leves que los causados por los virus de tipo A. Los virus de los tipos A y B pueden circular simultáneamente, aunque durante una epidemia estacional normalmente uno de los tipos predomina sobre el otro (1). EN USO PREVISTO bioNexia® Influenza A+B es una prueba inmunocromatográfica rápida para la detección cualitativa de los antígenos de los virus de la gripe tipos A y B en muestras nasofaríngeas humanas. La prueba está indicada como ayuda para el diagnóstico de la infección por gripe. La prueba está concebida exclusivamente para uso diagnóstico profesional in vitro. bioNexia® Influenza A + B 25 TR RU PL CS PRINCIPIO La prueba bioNexia® Influenza A+B es un ensayo inmunocromatográfico cualitativo para la detección de los antígenos de los virus de la gripe de tipos A y B en muestras nasofaríngeas humanas. La prueba bioNexia® Influenza A+B detecta la nucleoproteína, la parte del virus que nunca cambia, y posteriormente detecta los subtipos A y B. La prueba no está diseñada para detectar el antígeno de la gripe C. Durante la prueba, la muestra reacciona con la partícula revestida con anticuerpos antigripales. Los complejos antígeno-anticuerpo migran por capilaridad a lo largo de la membrana, que tiene un recubrimiento previo de anticuerpos monoclonales dirigidos contra los antígenos de la gripe tipos A y B en la región de la línea de prueba. En caso de resultado positivo, los anticuerpos específicos presentes en la membrana reaccionan con el conjugado de la mezcla y generan una o dos líneas de color en las regiones FLU A (rojo) y/o FLU B (azul). Si la muestra no contiene el antígeno de la gripe, no aparecerá una línea en las regiones FLU A y FLU B. La línea de color verde que aparece en la región de la línea de control (C) sirve como control del procedimiento e indica que la migración de la prueba se ha realizado correctamente. CONTENIDO DEL KIT (10 PRUEBAS) 10 casetes de prueba 1 frasco de tampón R1 10 tubos de extracción con tapón cuentagotas 1 torunda de control positivo EXT 10 torundas estériles En bolsas selladas individuales, con una pipeta desechable para muestras y un desecante. La membrana del casete de la prueba está recubierta con anticuerpos monoclonales de ratón dirigidos contra los antígenos de la gripe tipos A y B. Vial plástico que contiene 6 ml de solución tamponada. Listo para usar. Tampón PBS que contiene detergente y <0,1% de azida sódica. Tubo de plástico y tapón cuentagotas con filtro para un solo uso. En una bolsa sellada individual con desecante. La torunda está recubierta con extractos inactivados de cepas de gripe A y gripe B. Dispositivo de un solo uso para obtener muestras nasofaríngeas (conforme a la directiva 93/42/CEE, CE 0123). Método de esterilización con óxido de etileno. Esterilizar únicamente si la bolsa abre fácil está intacta. 1 portarreactivos 1 guía rápida para el usuario, impresa en la caja 1 ficha técnica MATERIALES NECESARIOS SUMINISTRADOS PERO NO Recipiente para obtención de muestras Guantes desechables Aparato de aspiración, catéter de aspiración estéril Cronómetro ADVERTENCIAS Y PRECAUCIONES • • • • • • • 26 Sólo para uso diagnóstico in vitro. Sólo para uso profesional. Este kit contiene productos de origen animal. La certificación del origen o estado sanitario de los animales no garantiza totalmente la ausencia de agentes patógenos transmisibles. Por lo tanto, se recomienda tratar estos productos como potencialmente infecciosos, y manipularlos observando las precauciones de seguridad habituales. No utilice los reactivos después de la fecha de caducidad indicada en el envase. El casete de la prueba, la torunda estéril y el control positivo deben almacenarse en la bolsa sellada que contiene el desecante, hasta el momento de usarlos. No los utilice si la envoltura de papel metalizado está dañada. Todos los componentes son desechables excepto el tampón (R1); no deben volver a utilizarse. Todas las muestras deben considerarse como infecciosas y manipularse siguiendo las precauciones recomendadas (CLSI® M29-A, Protection of Laboratory Workers from Instrument Biohazards and Infectious Disease Transmitted by Blood, Body Fluids, and Tissue; Approved Guideline – Revisión actual). Para más información sobre las precauciones de manipulación, consulte “Biosafety in Microbiological and Biomedical Laboratories – CDC/NIH – Última edición”, o las normativas actuales en el país de utilización. 410918 • • Almacene el kit a 2 – 30 °C. NO LO CONGELE. Si se almacenan de acuerdo con las condiciones recomendadas, todos los componentes son estables hasta la fecha de caducidad indicada en el envase. No lo utilice después de la fecha de caducidad. El dispositivo de la prueba debe permanecer en la bolsa hasta el momento de utilización. Entre la apertura del casete de la prueba y el control positivo y su utilización no debe pasar más de una hora. RECOGIDA Y PREPARACIÓN DE MUESTRAS Método con exudado nasofaríngeo – Inserte la torunda a través de la fosa nasal hasta la nasofaringe posterior. – Gire la torunda varias veces para obtener células infectadas (tenga cuidado de que no se rompa el eje en el punto de corte moldeado). – Para obtener una muestra óptima, repita el procedimiento en la otra fosa nasal. Prepare la muestra inmediatamente conforme a las explicaciones del párrafo Instrucciones de uso. DE CONSERVACIÓN Y ESTABILIDAD • • • EN FR El tampón de muestras (R1) contiene azida sódica (conservante) a una concentración por debajo del valor límite umbral de 0,1%. ES • Infiltre varias gotas de solución salina en cada fosa nasal. Inserte el catéter a través de la fosa nasal hasta la nasofaringe posterior. – Succione con suavidad. Extraiga lentamente el catéter, con un movimiento giratorio. – Para obtener una muestra óptima, repita el procedimiento en la otra fosa nasal. Prepare la muestra inmediatamente conforme a las explicaciones del párrafo Instrucciones de uso. PT – – IT Métodos con muestras de aspiración nasofaríngea o lavado nasal SV INSTRUCCIONES DE USO Las pruebas, las muestras y los reactivos deben alcanzar la temperatura ambiente (15 – 30 °C) antes de utilizarlos. No abra la bolsa refrigerada, para evitar que se condense la humedad atmosférica en la membrana de la prueba. – Procedimiento para las muestras de lavado o aspiración nasofaríngea (consulte de 1a a 1c en la guía rápida) – – – Abra la bolsa y extraiga la pipeta desechable para muestras. Transfiera con esta pipeta 6 gotas de muestra obtenida por aspiración o por lavado nasofaríngeo al tubo de extracción (una por cada muestra). Añada 3 gotas de R1, coloque el tapón cuentagotas en el tubo de extracción y mezcle bien. bioNexia® Influenza A + B 27 PL – RU – Use un tubo de extracción distinto para cada muestra. Añada 15 gotas de R1 al tubo de extracción. Coloque la torunda nasofaríngea (o la torunda del control positivo) en el tubo de extracción y mezcle bien. Elimine la mayor cantidad posible de líquido de la torunda. Quite la torunda y coloque el tapón cuentagotas en el tubo. Extraiga la prueba bioNexia® Influenza A+B de la bolsa sellada. Sujete el tubo de extracción en posición vertical y transfiera exactamente 3 gotas al pocillo de muestra (S). Lea el resultado 10 minutos después de transferir la muestra. Deben cumplirse estrictamente estas pautas de tiempo para asegurar la obtención de resultados correctos. TR – – – CS Procedimiento para las muestras de torundas nasofaríngeas y controles positivos (consulte de 1a’ a 1b’ en la guía rápida) – – – Extraiga la prueba bioNexia® Influenza A+B de la bolsa. Sujete el tubo de extracción en posición vertical y transfiera exactamente 3 gotas al pocillo de muestra (S). Lea el resultado 10 minutos después de transferir la muestra. Deben cumplirse estrictamente estas pautas de tiempo para asegurar la obtención de resultados correctos. ESTABILIDAD DE LAS MUESTRAS DESPUÉS DEL TRATAMIENTO PREVIO La muestra diluida puede utilizarse de inmediato o conservarse a una temperatura de 18 – 25 °C o 2 – 8 °C durante 8 horas como máximo. INTERPRETACIÓN DE LOS RESULTADOS POSITIVO • • • Positivo de gripe A: Aparecen dos líneas definidas en la ventana de resultados: una línea roja en la región FLU A y una línea verde en la región de la línea de control (C). Positivo de gripe B: Aparecen dos líneas definidas en la ventana de resultados: una línea azul en la región FLU B y una línea verde en la región de la línea de control (C). Positivo de la gripe A+B: Aparecen tres líneas definidas en la ventana de resultados: una línea roja en la región FLU A, una línea azul en la región FLU B y una línea verde en la región de la línea de control (C). La intensidad del color en las regiones de las líneas de la prueba puede variar en función de la concentración de los antígenos de gripe presentes en la muestra. Sin embargo, la concentración de los antígenos de la gripe en la muestra no puede determinarse por medio de esta prueba cualitativa. Una línea roja/azul tenue debe considerarse como un resultado positivo. NEGATIVO Aparece una línea verde en la región de la línea de control (C). No aparecen líneas visibles en las regiones FLU A y FLU B. NO VÁLIDO La línea de control de color verde (C) no aparece. En este caso, el resultado no es válido aunque esté visible la línea de prueba (línea roja en la región FLU A y/o línea azul en la región FLU B). Si no aparece una línea verde en la región de control (C), esto significa que la migración de la prueba no se ha realizado correctamente y que el resultado no es válido. Revise el procedimiento y repita la prueba con un nuevo casete de prueba. Si el problema continúa, interrumpa el uso del equipo de inmediato y comuníquese con su distribuidor local. FLU A FLU B Influenza A+B Lea el resultado a los 10 minutos C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU A FLU A+B FLU B Positivo + C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B Negativo No válido x CONTROL DE CALIDAD El kit incluye una torunda de control positivo, que debe generar un resultado positivo de gripe A+B. El control debe realizarse inmediatamente después de abrir un kit nuevo, para asegurarse de que no se haya alterado el rendimiento del reactivo. Si los resultados del control se apartan de los valores esperados, los resultados de la prueba no pueden validarse. 28 410918 FR La prueba incluye un control de migración indicado por una línea de color (C). Si no aparece la línea de control, la prueba no es válida. Es responsabilidad del usuario realizar el control de calidad de acuerdo con cualquier normativa aplicable local. ES DE EN LIMITACIONES DEL MÉTODO 1. bioNexia® Influenza A+B solamente indica la presencia de gripe en la muestra (detección cualitativa) y debe utilizarse exclusivamente para detectar la presencia de antígenos de la gripe de tipos A y B en las muestras en nasofaríngeas (a partir de exudado, aspirdo o lavado). Esta prueba no puede determinar el valor cuantitativo ni la tasa de aumento de la concentración de antígeno de la gripe. 2. Si el resultado de la prueba es negativo y los síntomas clínicos continúan, se recomienda hacer otras pruebas utilizando otros métodos. Un resultado negativo no excluye en ningún momento la posibilidad de una infección gripal. 3. Esta prueba proporciona un diagnóstico presuntivo de infección gripal. Todos los resultados deben interpretarse conjuntamente con otros resultados de laboratorio e información clínica disponibles para el médico. RENDIMIENTO Sensibilidad analítica A H3N2 VR-822 Swine/1976/31 A H1N1 VR-99 Weiss/43 A H1N1 VR-96 New Jersey/8/76 (Hsw N1) NWS/33 A H1N1 VR-897 A H1N1 VR-219 Port Chalmers/1/73 California/07/09 A H3N2 VR-810 A H1N1 - Paris/5509/09 A H1N1 - Niger/2090/06 A H5N1 - Vietnam/1203/04 A H5N1 - Solomon Islands/3/2006 South Dakota/6/2007 R22 Barbara A H1N1 - A H1N1 - B - VR-788 Maryland/1/59 B - VR-296 GL/1739/54 B - VR-103 Lee/40 B - VR-101 bioNexia® Influenza A + B 29 PT Victoria/3/75 SV H1N1 VR-333 CS A PL Swine/Iowa/15/30 Nivel detectable mínimo 8,89 x 105 CEID[50]/mL 8,89 x 106 CEID[50]/mL 1,58 x 105 CEID[50]/mL 8,89 x 105 CEID[50]/mL 8,89 x 108 CEID[50]/mL 1,58 x 105 CEID[50]/mL 1,58 x 105 CEID[50]/mL 1,58 x 106 CEID[50]/mL 5 x 104 TCID[50]/mL 5 x 104 TCID[50]/mL 5 x 105 TCID[50]/mL 106 TCID[50]/mL 105 TCID[50]/mL 105 TCID[50]/mL 8,89 x 103 CEID[50]/mL 8,89 x 102 CEID[50]/mL 1,58 x 105 CEID[50]/mL 8,89 x 103 CEID[50]/mL RU PR/8/34 Tipo Sub- N.° de de tipo ATCC virus A H1N1 VR-95 TR Cepa vírica IT La sensibilidad analítica se determinó utilizando un total de 22 cepas de virus de la gripe humana: 14 de gripe A y 8 de gripe B. Cepa vírica Hong Kong/5/72 Tipo Sub- N.° de de tipo ATCC virus B VR-823 Russia/69 B - VR-790 Jiangsu/10/2003 B - - Brisbane/60/2008 B - - Nivel detectable mínimo 8,89 x 103 CEID[50]/mL 8,89 x 104 CEID[50]/mL 105 TCID[50]/mL 105 TCID[50]/mL TCID[50]/mL: 50% de dosis infecciosa en cultivo tisular CEID[50]/mL: 50% de dosis infecciosa en embrión de pollo SENSIBILIDAD Y ESPECIFICIDAD CLÍNICAS Se analizaron exudados nasofaríngeos, aspirados o lavados de 72 pacientes con síntomas de gripe con la prueba bioNexia® Influenza A+B y una técnica RT-PCR. Técnica RT-PCR + Total Prueba bioNexia® + 55 0 55 Influenza A+B (línea de 1 16 17 tipo A +B) Total 56 16 72 Sensibilidad: 98,2%; Especificidad: >99%; Además, en muestras con resultado negativo de gripe confirmadas clínicamente: – Se analizaron las muestras de 77 pacientes con la prueba bioNexia® Influenza A+B: en 75 de las 77 muestras, el resultado de las líneas A y B fue negativo. La especificidad fue del 97,4%. – Se analizaron las muestras de 86 pacientes con la prueba bioNexia® Influenza A+B: en 85 de las 86 muestras, el resultado de la línea A fue negativo. La especificidad fue del 98,8%. – Se analizaron las muestras de 84 pacientes con la prueba bioNexia® Influenza A+B: en 83 de las 84 el resultado de la línea B fue negativo. La especificidad fue del 98,8%. Concordancia con otra prueba rápida El rendimiento de la prueba bioNexia® Influenza A+B se ha evaluado en comparación con otras pruebas inmunocromatográficas rápidas. Se analizaron con las dos técnicas las muestras nasofaríngeas (torunda, aspiración o lavado) de 93 pacientes con síntomas de gripe. Ensayo inmunocromatográfico de gripe de tipo A + Total Prueba bioNexia® + 4 4 8 Influenza A+B (línea de 0 85 85 tipo A) Total 4 89 93 Concordancia global 95,7% IC95% [89,3 – 98,3] Ensayo inmunocromatográfico de gripe de tipo B + Total Prueba bioNexia® + 7 1 8 Influenza A+B (línea de 2 83 85 tipo B) Total 9 84 93 Concordancia global 96,8% IC95% [90,8 – 98,9] 30 410918 Las pruebas se realizaron de manera independiente por tres usuarios diferentes, siendo dos de ellos personal de laboratorio con experiencia y uno de ellos una persona que ocasionalmente evalúa pruebas rápidas (comparable con un asistente médico). Las muestras positivas se prepararon por dilución del extracto del control positivo en el tampón de extracción, con objeto de obtener una muestra de control positivo medio y un positivo alto. Se analizaron una muestra negativa (solo tampón) y las muestras positivas en diez determinaciones en tres lotes. Para todas las pruebas, la muestra negativa proporcionó resultados negativos y las muestras positivas proporcionaron resultados positivos. La repetibilidad (dentro del lote, el mismo día) y la reproducibilidad (entre lotes, con operadores diferentes) son aceptables para todas las muestras analizadas. FR ES Precisión DE EN Ensayo inmunocromatográfico de gripe de tipos A/B + Total Prueba bioNexia® + 11 5 16 Influenza A+B (línea de 2 75 77 tipos A/B) Total 13 80 93 Concordancia global 92,5% IC95% [85,1 – 96,4] Se llevó a cabo una evaluación para determinar la reactividad cruzada de la prueba bioNexia® Influenza A+B. No se observó reactividad cruzada con los patógenos respiratorios presentes ocasionalmente en las muestras nasofaríngeas: • Virus respiratorio sincitial • Adenovirus IT Reactividad cruzada SV PT ELIMINACIÓN DE RESIDUOS Elimine los reactivos usados o no usados, así como cualquier otro material desechable contaminado, siguiendo los procedimientos para productos infecciosos o potencialmente infecciosos. Es responsabilidad de cada laboratorio gestionar los residuos y efluentes producidos de acuerdo con su naturaleza y grado de peligro, y tratarlos y desecharlos (o hacer que se los trate y deseche) de acuerdo con las normativas aplicables. TR RU PL CS REFERENCIAS BIBLIOGRÁFICAS 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. bioNexia® Influenza A + B 31 ÍNDICE DE SÍMBOLOS Símbolo Significado Número de catálogo Diagnóstico in vitro Dispositivo médico Fabricante Limitación de temperatura Fecha de caducidad Código de lote Control positivo No utilizar si el envase está deteriorado Directiva de productos sanitarios Consultar las instrucciones de uso No reutilizar Método de esterilización mediante óxido de etileno No exponer a la luz solar Contenido suficiente para <n> ensayos BIOMÉRIEUX, el logotipo azul y bioNexia son marcas utilizadas, depositadas y/o registradas pertenecientes a bioMérieux SA o a cada una de sus filiales. CLSI es una marca perteneciente a Clinical and Laboratory Standards Institute, Inc. Cualquier otro nombre o marca comercial es propiedad de su respectivo propietario. bioMérieux SA 69280 Marcy-l‘Etoile-France Tel.: 33 (0)4 78 87 20 00 Fax: 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 32 410918 FR IT Nonostante un’ampia gamma di agenti virali sia in grado di causare infezioni delle basse vie respiratorie in bambini e adulti, gli agenti più comuni sono i virus dell’influenza A e B, i virus respiratori sinciziali (RSV), i virus parainfluenzali 1, 2 e 3 e adenovirus. Tra questi, i virus dell’influenza A e B e RSV sono le cause più importanti di malattie respiratorie acute. Oltre a condividere una prevalenza stagionale, è importante ricordare che influenza A e B e RSV condividono caratteristiche cliniche comuni e un potenziale d’infezione per i medesimi gruppi di pazienti a rischio (ad esempio pazienti di età avanzata, pazienti con patologie cardiopolmonari e in terapia con farmaci immunosoppressori). PT L’influenza è una sindrome acuta che colpisce il tratto respiratorio ad elevata contagiosità e acuta, causata da virus conosciuti come virus dell’influenza. Esistono tre tipi di virus dell’influenza: A, B e C, ma solamente i tipi A e B causano comunemente infezioni negli esseri umani. I virus del tipo A sono i più frequenti e sono spesso associati alle epidemie più diffuse. I virus del tipo B causano sintomi generalmente più lievi rispetto a quelli causati dal tipo A. I virus del tipo A e del tipo B possono circolare simultaneamente, ma solitamente un tipo è dominante durante un’epidemia stagionale (1). ES DE INTRODUZIONE E OBIETTIVO DEL TEST EN MODALITÀ DI IMPIEGO Il test bioNexia® Influenza A+B è un test immunocromatografico rapido per la rilevazione qualitativa di antigeni dei virus influenzali di tipo A e tipo B in campioni nasofaringei umani. Il test è di ausilio nella diagnosi di influenza. Il test è esclusivamente per un uso diagnostico in vitro professionale. TR RU PL CS SV PRINCIPIO bioNexia Influenza A+B è un test qualitativo immunocromatografico per la rilevazione degli antigeni dei virus influenzali di tipo A e tipo B in campioni nasofaringei umani. Il test bioNexia® Influenza A+B rileva la nucleoproteina, parte del virus che non subisce mutazioni, quindi rileva i sottotipi A e B. Il test non rileva l’antigene dell’influenza C. Durante il test, il campione reagisce con la fase solida rivestita di anticorpi anti-influenzali. I complessi antigene-anticorpo migrano per azione capillare sulla membrana pre-rivestita con anticorpi monoclonali diretti verso antigeni dell’influenza di tipo A e tipo B nella regione della linea di test. In caso di risultati positivi, gli anticorpi specifici presenti sulla membrana reagiranno con il complesso antigene-anticorpo e genereranno uno o due bande colorate nella regione FLU A (rosso) e/o FLU B (blu). Se il campione non contiene antigeni dell’influenza, non compariranno bande in corrispondenza delle regioni FLU A e FLU B. Nella regione della linea di controllo una banda verde (C) serve come controllo interno del test e indica che la migrazione è avvenuta correttamente. bioNexia® Influenza A + B 33 CONTENUTO DEL KIT (10 TEST) 10 card per test 1 Flacone R1 10 Provette EXT per estrazioni con contagocce 1 Tampone controllo positivo 10 Tamponi sterili Ciascuna in un sacchetto chiuso con una pipetta monouso per il campione ed un sacchetto disidratante. La membrana della card è rivestita con anticorpi monoclonali di topo diretti contro gli antigeni dell’influenza tipo A e tipo B. Flacone di plastica contenente 6 ml di soluzione tampone. Pronto per l’uso. Tampone PBS contenente <0,1% di sodio azide. Provetta monouso in plastica con contagocce e filtro. Ciascuno in un sacchetto chiuso con disidratante. Il tampone è rivestito con estratti inattivati di ceppi di virus influenzali di tipo A e B. Dispositivo monouso per la raccolta di campioni nasofaringei (ai sensi della Direttiva 93/42/CEE, CE 0123). Metodo di sterilizzazione con ossido di etilene. Sterile solo se il sacchetto è intatto. 1 Supporto reagente 1 Guida rapida per l’utilizzatore stampata sulla scatola 1 Foglietto illustrativo MATERIALI NECESSARI MA NON FORNITI Contenitore per la raccolta dei campioni Guanti monouso Apparato per aspirazione, catetere sterile di aspirazione Cronometro AVVERTENZE E PRECAUZIONI • • • • • • • • 34 Solo per uso diagnostico in vitro. Solo per uso professionale. Questo kit contiene prodotti di origine animale. La conoscenza certa della provenienza e/o delle condizioni sanitarie degli animali non garantisce totalmente l’assenza di agenti patogeni trasmissibili. Si raccomanda quindi che questi prodotti vengano trattati e gestiti come prodotti potenzialmente infetti, osservando le abituali precauzioni di sicurezza. Non utilizzare reagenti dopo la data di scadenza indicata sulla confezione. Fino al momento dell’uso, la card, il tampone sterile e il controllo positivo devono essere conservati nel sacchetto chiuso contenente disidratante. Non utilizzarli se il sacchetto protettivo è danneggiato. Tutti i componenti eccetto il tampone (R1) possono essere smaltiti; non devono essere riutilizzati. Tutti i campioni devono essere considerati potenzialmente infetti e maneggiati in conformità alle precauzioni consigliate (CLSI® M29-A, Protection of Laboratory Workers from Instrument Biohazards and Infectious Disease Transmitted by Blood, Body Fluids, and Tissue; Approved Guideline – Revisione corrente). Per ulteriori informazioni sulle precauzioni da adottare, fare riferimento a “Biosafety in Microbiological and Biomedical Laboratories (Sicurezza biologica in laboratori microbiologici e biomedici) – CDC/NIH – Ultima edizione“, o alla regolamentazione vigente nel paese d’uso del prodotto. Il tampone (R1) contiene sodio azide come conservante a una concentrazione sotto il limite di soglia dello 0,1%. 410918 • EN • Conservare il kit a 2 – 30°C. NON CONGELARE. Se conservati secondo le condizioni raccomandate, tutti i componenti sono stabili fino alla data di scadenza indicata sulla confezione. Non utilizzare dopo la data di scadenza. Il dispositivo per i test deve restare nel sacchetto fino all’utilizzo. Utilizzare la card e il controllo positivo entro un’ora dall’apertura. FR CONSERVAZIONE E STABILITÀ • • • Aspirazione nasofaringea o metodi di lavaggio nasale Instillare diverse gocce di soluzione salina in ciascuna narice. Inserire il caterere nella narice toccando la nasofaringe posteriore. – Eseguire delicatamente un’aspirazione. Con un movimento rotatorio, rimuovere lentamente il catetere. – Per un campionamento ottimale, ripetere la procedura con l’altra narice. Preparare il campione immediatamente come descritto nel paragrafo Istruzioni per l’uso. ES – Inserire il tampone nella narice toccando la nasofaringe posteriore. – Ruotare il tampone alcune volte per ottenere cellule infette (fare attenzione a non rompere l’asticella del tampone nel punto della tacca). – Per un campionamento ottimale, ripetere la procedura con l’altra narice. Preparare il campione immediatamente come descritto nel paragrafo Istruzioni per l’uso. DE PRELIEVO E PREPARAZIONE DEI CAMPIONI Metodo con tampone nasofaringeo – Procedura per l’ottenimento di campioni con tampone nasofaringeo e controllo positivo (fare riferimento alla guida rapida da 1a’ a 1b’) – – – – Aprire il sacchetto e rimuovere la pipetta monouso del campione. Con questa pipetta, dispensare 6 gocce di campione nasofaringeo, ottenuto con lavaggio o aspirazione, in una provetta di estrazione (una per ciascun campione). Aggiungere 3 gocce di R1, mettere il contagocce sulla provetta di estrazione e mescolare bene. Rimuovere la card bioNexia® Influenza A+B dal sacchetto chiuso. bioNexia® Influenza A + B 35 PT PL RU Procedura per l’ottenimento di campioni nasofaringei con aspirazioni o lavaggi (fare riferimento alla guida rapida da 1a a 1c) CS – TR Utilizzare una provetta di estrazione separata per ciascun campione. – Aggiungere 15 gocce di R1 nella provetta di estrazione. – Inserire il tampone nasofaringeo (o il tampone controllo positivo) nella provetta di estrazione e mescolare bene. Premere il tampone contro le pareti per ottenere il massimo rilascio di liquido. – Rimuovere il tampone e chiudere con il contagocce la provetta. Rimuovere la card bioNexia® Influenza A+B dal sacchetto chiuso. – Tenere la provetta in posizione verticale e dispensare esattamente 3 gocce nel pozzetto campione (S). – Leggere il risultato esattamente 10 minuti dopo l’erogazione del campione. Osservare strettamente questa tempistica, per ottenere dei risultati. SV ISTRUZIONI PER L’USO Attendere che i test, i campioni e i reagenti raggiungano la temperatura ambiente (15 – 30°C) prima di eseguire il test. Non aprire il sacchetto refrigerato, per evitare che la condensa si depositi sulla card. IT – – – Tenere la provetta in posizione verticale e dispensare esattamente 3 gocce nel pozzetto campione (S). Leggere il risultato esattamente dopo l’erogazione del campione. Osservare strettamente questa tempistica, per ottenere risultati corretti. STABILITÀ DEL PRE-TRATTAMENTO CAMPIONE DOPO IL Il campione diluito può essere utilizzato immediatamente o conservato a 18 – 25°C o 2 – 8°C per un massimo di 8 ore. INTERPRETAZIONE DEI RISULTATI POSITIVO • • • Influenza A positivo: Due bande distinte compaiono sulla finestra dei risultati: una banda rossa compare nella regione FLU A e una banda verde compare nella regione della linea di controllo (C) . Influenza B positivo: Due bande distinte compaiono sulla finestra dei risultati: una banda blu compare nella regione FLU B e una banda verde compare nella regione della linea di controllo (C) . Influenza A+B positivo: Tre bande distinte compaiono sulla finestra dei risultati: una banda rossa compare nella regione FLU A, una banda blu compare nella regione FLU B e una banda verde compare nella regione della linea di controllo (C). L’intensità di colore della banda può variare in funzione della concentrazione degli antigeni nel campione. Tuttavia, non è possibile determinare la concentrazione degli antigeni nel campione per mezzo del presente test qualitativo. Una banda rossa/blu di test (T), anche solo lievemente visibile, è da considerare un risultato positivo. NEGATIVO Compare una banda verde nella regione della linea di controllo (C). Non compare nessuna banda visibile nelle regioni FLU A e FLU B. NON VALIDO La banda di controllo verde (C) non compare. In questo caso il risultato non è valido neanche se la linea di test è visibile (banda rossa nella regione FLU A e/o banda blu nella regione FLU B). La mancata comparsa della banda verde nella regione della linea di controllo (C) indica che la migrazione del campione non è avvenuta correttamente correttamente e il risultato del test non è valido. Rivedere la procedura e ripetere il test con una nuova card. Se il problema persiste, non utilizzare più il kit e contattare il distributore locale. C FLU A C FLU A C FLU A FLU B FLU B FLU B Leggere i risultati dopo 10 minuti esatti FLU A FLU B FLU A FLU A+B FLU B Positivo + Influenza A+B C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B Negativo Non valido x CONTROLLO DI QUALITÀ Il kit include un tampone controllo positivo. Il controllo positivo genera un risultato positivo dell’influenza A+B. Questo controllo deve essere eseguito immediatamente dopo l’apertura di un nuovo kit per assicurarsi che le prestazioni dei reagenti non si siano alterate. I risultati non possono essere convalidati se i risultati del controllo non corrispondono ai risultati attesi. 36 410918 FR Il test include un sistema di controllo interno, una banda colorata (C) indica che la migrazione del campione è avvenuta correttamente. Se la banda del controllo non compare, il test non è valido. È responsabilità dell’utilizzatore eseguire i controlli di qualità secondo le normative locali vigenti. ES DE EN LIMITI DEL METODO 1. Il test bioNexia® Influenza A+B indicherà esclusivamente la presenza del virus dell’influenza nel campione (rilevamento qualitativo) e deve essere utilizzato per il rilevamento di antigeni dell’influenza tipo A e tipo B esclusivamente in campioni nasofaringei (da tamponi, aspirati o lavaggi). Questo test non consente di determinare il valore quantitativo né le variazioni della concentrazione degli antigeni. 2. In caso il risultato del test sia negativo ma i sintomi clinici persistono, si raccomanda di eseguire ulteriori approfondimenti diagnostici. Un risultato negativo non esclude la possibilità della presenza di una sindrome influenzale. 3. Il test fornisce una diagnosi presuntiva di influenza. Tutti i risultati devono essere interpretati contestualmente alle altre informazioni cliniche e agli altri dati di laboratorio disponibili. La sensibilità analitica è stata determinata utilizzando un totale di 22 ceppi di virus dell’influenza umana: 14 di influenza A e 8 di influenza B. bioNexia® Influenza A + B 37 RU PL CS SV PT Ceppo virale TR Tipo Sotto- n. ATCC Livello minimo virale tipo rilevabile PR/8/34 A H1N1 VR-95 8,89 x 105 CEID[50]/ml Swine/Iowa/15/30 A H1N1 VR-333 8,89 x 106 CEID[50]/ml Victoria/3/75 A H3N2 VR-822 1,58 x 105 CEID[50]/ml Swine/1976/31 A H1N1 VR-99 8,89 x 105 CEID[50]/ml Weiss/43 A H1N1 VR-96 8,89 x 108 CEID[50]/ml New Jersey/8/76 A H1N1 VR-897 1,58 x 105 CEID[50]/ml (Hsw N1) NWS/33 A H1N1 VR-219 1,58 x 105 CEID[50]/ml Port A H3N2 VR-810 1,58 x 106 Chalmers/1/73 CEID[50]/ml California/07/09 A H1N1 5 x 104 TCID[50]/ml Paris/5509/09 A H1N1 5 x 104 TCID[50]/ml Niger/2090/06 A H5N1 5 x 105 TCID[50]/ml Vietnam/1203/04 A H5N1 106 TCID[50]/ml Solomon A H1N1 105 TCID[50]/ml Islands/3/2006 South A H1N1 105 TCID[50]/ml Dakota/6/2007 R22 Barbara B VR-788 8,89 x 103 CEID[50]/ml Maryland/1/59 B VR-296 8,89 x 102 CEID[50]/ml GL/1739/54 B VR-103 1,58 x 105 CEID[50]/ml Lee/40 B VR-101 8,89 x 103 CEID[50]/ml IT PERFORMANCE Sensibilità analitica Ceppo virale Tipo Sotto- n. ATCC Livello minimo virale tipo rilevabile Hong Kong/5/72 B VR-823 8,89 x 103 CEID[50]/ml Russia/69 B VR-790 8,89 x 104 CEID[50]/ml Jiangsu/10/2003 B 105 TCID[50]/ml Brisbane/60/2008 B 105 TCID[50]/ml TCID[50]/ml: 50% dose infettante in coltura tissutale CEID[50]/ml: 50% dose infettante in embrione di pollo SENSIBILITÀ E SPECIFICITÀ CLINICA Campioni nasofaringei ottenuti con tampone, aspirazione o lavaggio da 72 pazienti con sintomi influenzali sono stati testati con il kit bioNexia® Influenza A+B e una tecnica RT-PCR. Test bioNexia® Influenza A+B (linea Tipo A +B) Totale + - Tecnica RT-PCR + Totale 55 0 55 1 16 17 56 16 72 Sensibilità: 98,2%; Specificità: >99%; Inoltre, su campioni negativi confermati clinicamente: – – – 77 pazienti sono stati testati con il test bioNexia® Influenza A+B: 75 campioni su 77 sono risultati negativi per le linee A e B.La specificità è risultata pari al 97,4%. 86 pazienti sono stati testati con il test bioNexia® Influenza A+B: 85 campioni su 86 sono risultati negativi per la linea A. La specificità è risultata pari al 98,8%. 84 pazienti sono stati testati con il test bioNexia® Influenza A+B: 83 campioni su 84 sono risultati negativi per la linea B. La specificità è risultata pari al 98,8%. Concordanza con un altro test rapido Le prestazioni del test bioNexia® Influenza A+B sono state confrontate con altri test rapidi immunocromatografici. Campioni nasofaringei (ottenuti con tampone, aspirazione o lavaggio) di 93 pazienti con sintomi influenzali sono stati testati con entrambe le tecniche. Esame immunocromatografico influenza tipo A + Totale + 4 4 8 Test bioNexia® Influenza A+B (linea Tipo A) 0 85 85 Totale 4 89 93 Accordo complessivo 95,7% CI95% [89,3 – 98,3] Esame immunocromatografico influenza tipo B + Totale + 7 1 8 Test bioNexia® Influenza A+B (linea Tipo B) 2 83 85 Totale 9 84 93 Accordo complessivo 96,8% CI95% [90,8 – 98,9] Esame immunocromatografico influenza tipo A/B + Totale Test bioNexia® Influenza + 11 5 16 A+B (linea Tipo A/B) 2 75 77 Totale 13 80 93 Accordo complessivo 92,5% CI95% [85,1 – 96,4] 38 410918 È stata eseguita una valutazione per determinare la reattività crociata del test bioNexia® Influenza A+B. Non sono stati osservati casi di reattività crociata con i seguenti patogeni respiratori presenti occasionalmente in campioni nasofaringei: • Virus respiratorio sinciziale • Adenovirus EN DE Reattività crociata ES I test sono stati eseguiti indipendentemente da tre diversi utilizzatori, due dei quali esperti di laboratorio e ed un terzo utilizzatore occasionale (paragonabile ad un assistente di studio medico). I campioni positivi sono stati preparati diluendo un estratto di controllo positivo nel tampone d’estrazione allo scopo di ottenere un campione di controllo mediamente positivo e altamente positivo. Un campione negativo (solo tampone) e ciascuno dei campioni positivi sono stati testati in dieci replicati su tre lotti. Su tutti i test, il campione negativo ha fornito risultato negativo e il campione positivo ha fornito risultato positivo. La ripetibilità (intra-lotto, stesso giorno) e riproducibilità (inter-lotto, diversi operatori) sono risultate accettabili per tutti i campioni testati. FR Precisione IT SMALTIMENTO DEI RIFIUTI Smaltire reagenti usati o non usati e ogni altro materiale monouso contaminato seguendo le procedure previste per prodotti infetti o potenzialmente infetti. È responsabilità di ogni laboratorio gestire i rifiuti e gli effluenti prodotti a seconda della loro natura e della loro pericolosità ed assicurarne (o farne assicurare) il trattamento e lo smaltimento conformemente alla legislazione vigente. TR RU PL CS SV PT RIFERIMENTI BIBLIOGRAFICI 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. bioNexia® Influenza A + B 39 INDICE DEI SIMBOLI Simbolo Significato Numero di catalogo Dispositivo medico-diagnostico in vitro Fabbricante Limite di temperatura Utilizzare entro Codice del lotto Controllo positivo Non usare se la confezione è danneggiata Direttiva sui dispositivi medici Consultare le istruzioni per l’uso Non riutilizzare Metodo di sterilizzazione con ossido di etilene Tenere lontano dalla luce solare diretta Contenuto sufficiente per <n> saggi BIOMERIEUX, il logo blu e bioNexia sono marchi utilizzati, depositati e/o registrati di proprietà di bioMérieux SA o di una delle sue filiali. CLSI è un marchio di proprietà di Clinical and Laboratory Standards Institute, Inc. Altri nomi e marchi sono di proprietà dei rispettivi proprietari. bioMérieux SA 69280 Marcy-l‘Etoile-France Tel: 33 (0)4 78 87 20 00 Fax: 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 40 410918 FR DE EN APLICAÇÃO DO TESTE bioNexia® Influenza A+B é um teste rápido imunocromatográfico para a detecção qualitativa de antigénios de Influenza tipo A e tipo B em amostras nasofaríngeas humanas. Este teste é indicado para ser utilizado como ajuda no diagnóstico da infecção por Influenza. O teste destina-se a ser utilizado apenas para diagnóstico in vitro profissional. IT PT SV Apesar de uma vasta variedade de agentes virais poderem provocar infecções do tracto respiratório inferior em crianças e adultos, os agentes mais comuns são a Influenza A e B, o vírus sincicial respiratório (VSR), vírus parainfluenza 1, 2 e 3 e o adenovírus. Entre estes, a Influenza A e B e o VSR são as causas mais importantes de doenças respiratórias agudas que requerem assistência médica. Para além de partilharem uma prevalência sazonal semelhante, é importante ter presente o facto de a Influenza A e B e do VSR partilharem também características clínicas sobrepostas e o potencial para determinados grupos de doentes de alto risco (por exemplo, doentes de classes etárias extremas, doentes que sofrem de doença cardiopulmonar subjacente e de imunossupressão). ES RESUMO E EXPLICAÇÃO A gripe é uma infecção aguda, do aparelho respiratório, altamente contagiosa, causada por vírus conhecidos como vírus Influenza. Existem três tipos de vírus Influenza: A, B e C, mas, segundo se sabe, apenas os tipos A e B causam regularmente infecções nos humanos. Os vírus do tipo A são os mais frequentes e estão frequentemente associados às epidemias mais graves. Os vírus do tipo B produzem sintomas que são geralmente mais ligeiros do que os causados pelo tipo A. Os vírus do tipo A e do tipo B podem circular em simultâneo, mas habitualmente um tipo é dominante durante uma epidemia sazonal (1). bioNexia® Influenza A + B 41 TR RU PL CS PRINCÍPIO bioNexia® Influenza A+B é um ensaio imunocromatográfico qualitativo para a detecção de antigénios de Influenza tipo A e tipo B em amostras nasofaríngeas humanas. O teste bioNexia® Influenza A+B detecta a nucleoproteína, que é a parte do vírus que nunca se altera e subsequentemente detecta os subtipos A e B. O teste não se destina à detecção do antigénio de Influenza C. Durante a realização do teste, a amostra reage com a partícula revestida com anticorpos anti-Influenza. Os complexos antigénio-anticorpo migram por acção capilar ao longo da membrana que está pré-revestida com anticorpos monoclonais direccionados contra os antigénios de Influenza tipo A e tipo B na região da linha de teste. No caso de um resultado positivo, os anticorpos específicos presentes na membrana irão reagir com o conjugado da mistura e geram uma ou duas linhas coloridas na região FLU A (vermelho) e/ou na região FLU B (azul). Se a amostra não contiver antigénio de Influenza, não surgirá nenhuma linha na região FLU A e na região FLU B. Uma linha de cor verde que surge na região da linha de controlo (C) serve de controlo do procedimento e indica que a migração do teste foi correctamente efectuada. COMPOSIÇÃO DOS REAGENTES DA EMBALAGEM (10 TESTES) 10 Cassetes de teste 1 Frasco de tampão R1 10 Tubos de extracção com tampa conta-gotas 1 Zaragatoa de controlo positivo EXT Em bolsas individuais seladas com uma pipeta descartável para as amostras e um desidratante. A membrana da cassete de teste é revestida com anticorpos monoclonais de ratinho direccionados contra antigénios de Influenza tipo A e tipo B. Frasco de plástico com 6 ml de solução tampão. Pronto a usar. Tampão PBS com detergente e <0,1% de azida sódica. Tubo plástico e tampa conta-gotas com filtro para utilização única. Numa bolsa individual selada com desidratante. A zaragatoa é revestida com estirpes de extractos inactivados de Influenza A e de Influenza B. 10 Dispositivos de utilização Zaragatoas única para colher amostras estéreis nasofaríngeas (de acordo com a Directiva Comunitária 93/42/CEE, CE 0123). Esterilização por óxido de etileno. Estéril apenas se a bolsa destacável estiver intacta. 1 Suporte para reagente 1 Guia rápido do utilizador impresso na caixa 1 Folheto informativo MATERIAL NECESSÁRIO MAS NÃO FORNECIDO Recipiente para colheita de amostras Luvas descartáveis Aparelho de aspiração, cateter de aspiração estéril Cronómetro PRECAUÇÕES DE UTILIZAÇÃO • • • • • • • 42 Apenas para utilização em diagnóstico in vitro. Apenas para utilização profissional. Este dispositivo contém produtos de origem animal. O controlo da origem e/ou do estado sanitário dos animais não pode garantir de maneira absoluta que estes produtos não contenham nenhum agente patogénico transmissível, pelo que é aconselhável manipulá-los com as precauções de utilização relativas aos produtos potencialmente infecciosos. Não utilizar os reagentes após a data de validade indicada na embalagem. A cassete de teste, a zaragatoa estéril e o controlo positivo devem ser conservados na bolsa selada, que contém o desidratante, até serem utilizados. Não utilizar se a embalagem de folha de alumínio estiver danificada. Todos os componentes, excepto o tampão (R1), são descartáveis; não voltar a utilizá-los. Todas as amostras devem ser consideradas potencialmente infecciosas e manipuladas em conformidade com as precauções recomendadas (CLSI® M29-A, Protection of Laboratory Workers from Instrument Biohazards and Infectious Disease Transmitted by Blood, Body Fluids, and Tissue; Approved Guideline - Revisão em vigor). Para informações complementares sobre as precauções de manipulação, consultar o “Biosafety in Microbiological and Biomedical Laboratories – CDC/NIH – Última edição”, ou a regulamentação em vigor no país de utilização. 410918 FR O tampão de amostra (R1) contém azida sódica (conservante) numa concentração inferior ao valor limiar de 0,1%. ARMAZENAMENTO E ESTABILIDADE • • • • • Conservar a embalagem entre 2 – 30 °C. NÃO CONGELAR. Todos os componentes permanecem estáveis até à data de validade indicada nas embalagens, se forem conservados nas condições exigidas. Não utilizar após a data de validade. O dispositivo deve ser mantido na bolsa selada até utilização. Utilizar a cassete de teste e o controlo positivo no espaço de uma hora após a respectiva abertura. DE COLHEITA E PREPARAÇÃO DAS AMOSTRAS Método de zaragatoa nasofaríngea EN • – Introduzir a zaragatoa na narina até à região posterior da nasofaringe. Rodar a zaragatoa algumas vezes para obter células infectadas (tendo o cuidado para não partir a haste no ponto de ruptura). – Para obter uma amostra óptima, repetir o procedimento utilizando a outra narina. Preparar a amostra imediatamente, conforme descrito no parágrafo Instruções de utilização. ES – Instilar várias gotas de solução salina em cada narina. Introduzir o cateter na narina até à região posterior da nasofaringe. – Aplicar uma aspiração suave. Com um movimento rotativo, retirar o cateter devagar. – Para obter uma amostra óptima, repetir o procedimento utilizando a outra narina. Preparar a amostra imediatamente, conforme descrito no parágrafo Instruções de utilização. PT – – IT Métodos de aspiração nasofaríngea ou de lavagem nasal – – Procedimento para amostras de lavagem ou aspiração nasofaríngea (consultar o guia rápido 1a a 1c) – – – – Abrir a bolsa e retirar a pipeta descartável para amostras. Com esta pipeta, aplicar 6 gotas da amostra de aspiração ou de lavagem nasofaríngea num tubo de extracção (um para cada amostras). Adicionar 3 gotas de R1, colocar a tampa conta-gotas no tubo de extracção e misturar bem. Retirar o teste bioNexia® Influenza A+B da respectiva bolsa. bioNexia® Influenza A + B 43 CS PL – Utilizar um tubo de extracção para cada amostra. Adicionar 15 gotas de R1 ao tubo de extracção. Colocar a zaragatoa nasofaríngea (ou a zaragatoa de controlo positivo) no tubo de extracção e misturar bem. Expelir o máximo de líquido possível da zaragatoa. Retirar a zaragatoa e colocar a tampa conta-gotas no tubo. Retirar o teste bioNexia® Influenza A+B da respectiva bolsa selada. Manter o tubo de extracção na vertical e aplicar exactamente 3 gotas no poço de amostras (S). Ler o resultado 10 minutos após aplicar a amostra. Este período de tempo deve ser estritamente seguido para assegurar a obtenção de resultados correctos. RU – – – TR Procedimento para amostras com zaragatoa nasofaríngea e o controlo positivo (consultar o guia rápido 1a' a 1b') SV INSTRUÇÕES DE UTILIZAÇÃO Esperar que os testes, amostras e reagentes atinjam a temperatura ambiente (15 – 30 °C) antes de efectuar o teste. Não abrir a bolsa refrigerada para evitar a condensação de humidade atmosférica na membrana de teste. – – Manter o tubo de extracção na vertical e aplicar exactamente 3 gotas no poço de amostras (S). Ler o resultado 10 minutos após aplicar a amostra. Este período de tempo deve ser estritamente seguido para assegurar a obtenção de resultados correctos. ESTABILIDADE DA PRÉ-TRATAMENTO AMOSTRA APÓS O A amostra diluída pode ser imediatamente utilizada ou armazenada entre 18 e 25 °C ou entre 2 e 8 °C até 8 horas. INTERPRETAÇÃO DOS RESULTADOS POSITIVO • • • Influenza A positivo: Aparecem duas linhas distintas na janela de resultados: aparece uma linha vermelha na região FLU A e uma linha verde na região da linha de controlo (C). Influenza B positivo: Aparecem duas linhas distintas na janela de resultados: aparece uma linha azul na na região FLU B e uma linha verde na região da linha de controlo (C). Influenza A+B positivo: Aparecem três linhas distintas na janela de resultados: aparece uma linha vermelha na região FLU A, uma linha azul na região FLU B e uma linha verde na região da linha de controlo (C). A intensidade da cor nas regiões das linhas de teste pode variar dependendo da concentração de antigénios de Influenza presentes na amostra. Contudo, não é possível determinar a concentração de antigénios de Influenza na amostra com este teste qualitativo. Uma linha vermelha/azul esbatida deve ser considerada positiva. NEGATIVO Aparece uma linha verde ao longo da região da linha de controlo (C). Não aparece qualquer linha visível nas regiões FLU A e FLU B. INVÁLIDO A linha de controlo de cor verde (C) não aparece. Neste caso, o resultado é inválido, mesmo se a linha de teste estiver visível (uma linha vermelha na região FLU A e/ou uma linha azul na região FLU B). Nenhuma linha verde na região da linha de controlo (C) significa que a migração do teste não foi correctamente efectuada e o resultado do teste é inválido. Rever o procedimento e repetir o teste com uma nova cassete de teste. Se o problema persistir, deixar de utilizar a embalagem de teste imediatamente e contactar o distribuidor local. C FLU A C FLU A C FLU A FLU B FLU B FLU B Ler o resultado aos 10 minutos FLU A FLU B Influenza A+B FLU A FLU A+B FLU B Positivo + C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B Negativo Inválido x CONTROLO DE QUALIDADE A embalagem inclui uma zaragatoa de controlo positivo. O controlo positivo deve gerar um resultado positivo de Influenza A+B. Este controlo deve ser efectuado imediatamente logo após a abertura de uma nova embalagem para garantir que o comportamento funcional do reagente não foi alterado. Os resultados não podem ser validados se os resultados do controlo se desviarem dos resultados esperados. 44 410918 FR O teste inclui um controlo de procedimento interno e uma linha colorida (C) indica que a migração do teste foi correctamente efectuada. Se a linha de controlo não aparecer, o teste é inválido. É da responsabilidade do utilizador garantir que o controlo de qualidade é efectuado em conformidade com a legislação local em vigor. ES DE EN LIMITES DO TESTE 1. O bioNexia® Influenza A+B apenas indicará a presença de Influenza na amostra (detecção qualitativa) e deve ser utilizado para a detecção de antigénios de Influenza tipo A e tipo B apenas em amostras nasofaríngeas (obtidas com uma zaragatoa, aspiração ou lavagem). Nem o valor quantitativo nem a taxa de aumento na concentração de antigénio de Influenza podem ser determinados por este teste. 2. Se o resultado do teste for negativo e os sintomas clínicos persistirem, recomenda-se a realização de testes adicionais com outros métodos. Um resultado negativo não exclui em momento algum a possibilidade de infecção por Influenza. 3. O teste fornece um diagnóstico presuntivo de infecções por Influenza. Todos os resultados devem ser todos interpretados em conjunto com outras informações clínicas e descobertas laboratoriais que o médico tenha disponíveis. COMPORTAMENTO FUNCIONAL A H3N2 VR-822 Swine/1976/31 A H1N1 VR-99 Weiss/43 A H1N1 VR-96 New Jersey/8/76 (Hsw N1) NWS/33 A H1N1 VR-897 A H1N1 VR-219 Port Chalmers/1/73 California/07/09 A H3N2 VR-810 A H1N1 - Paris/5509/09 A H1N1 - Niger/2090/06 A H5N1 - Vietnam/1203/04 Solomon Islands/3/2006 South Dakota/6/2007 R22 Barbara A A H5N1 H1N1 - A H1N1 - 105 TCID[50]/ml B - VR-788 Maryland/1/59 B - VR-296 GL/1739/54 B - VR-103 8,89 x 103 CEID[50]/ml 8,89 x 102 CEID[50]/ml 1,58 x 105 CEID[50]/ml PT Victoria/3/75 SV H1N1 VR-333 CS A bioNexia® Influenza A + B N.° ATCC VR-95 PL Swine/Iowa/15/30 Nível mínimo detectável 8,89 x 105 CEID[50]/ml 8,89 x 106 CEID[50]/ml 1,58 x 105 CEID[50]/ml 8,89 x 105 CEID[50]/ml 8,89 x 108 CEID[50]/ml 1,58 x 105 CEID[50]/ml 1,58 x 105 CEID[50]/ml 1,58 x 106 CEID[50]/ml 5 x 104 TCID[50]/ml 5 x 104 TCID[50]/ml 5 x 105 TCID[50]/ml 106 TCID[50]/ml 105 TCID[50]/ml PR/8/34 Tipo Subviral tipo A H1N1 TR Estirpe viral RU A sensibilidade analítica foi determinada utilizando 22 estirpes do vírus Influenza humano: 14 de influenza A e 8 de Influenza B. IT Sensibilidade analítica 45 Estirpe viral Tipo SubN.° Nível mínimo viral tipo ATCC detectável Lee/40 B VR-101 8,89 x 103 CEID[50]/ml Hong Kong/5/72 B VR-823 8,89 x 103 CEID[50]/ml Russia/69 B VR-790 8,89 x 104 CEID[50]/ml Jiangsu/10/2003 B 105 TCID[50]/ml Brisbane/60/2008 B 105 TCID[50]/ml TCID[50]/ml: 50% de dose infecciosa de cultura de tecidos CEID[50]/ml: 50% de dose infecciosa de embrião de galinha SENSIBILIDADE E ESPECIFICIDADE CLÍNICAS Amostras de zaragatoa, aspiração ou lavagem nasofaríngea de 72 doentes com sintomas de gripe testadas com bioNexia® Influenza A+B e uma técnica de RT-PCR. Teste bioNexia® Influenza A+B (linha Tipo A + B) Total Técnica de RT-PCR + Total + 55 0 55 1 16 17 56 16 72 Sensibilidade: 98,2%; Especificidade: >99%; Adicionalmente, em amostras negativas de Influenza clinicamente confirmadas: – 77 doentes foram submetidos ao teste bioNexia® Influenza A+B: 75 das 77 amostras foram negativas para as linhas A e B. A especificidade foi de 97,4%. – 86 doentes foram submetidos ao teste bioNexia® Influenza A+B: 85 das 86 amostras foram negativas para a linha A. A especificidade foi de 98,8%. – 84 doentes foram submetidos ao teste bioNexia® Influenza A+B: 83 das 84 amostras foram negativas para a linha B. A especificidade foi de 98,8%. Concordância com outro teste rápido O comportamento funcional do teste bioNexia® Influenza A+B foi avaliado em comparação com outro teste imunocromatográfico rápido. Foram testadas amostras nasofaríngeas (zaragatoa, aspiração ou lavagem) de 93 doentes com sintomas de gripe utilizando ambas as técnicas. Ensaio imunocromatográfico de Influenza tipo A + Total + 4 4 8 Teste bioNexia® Influenza A+B (linha Tipo A) 0 85 85 Total 4 89 93 Concordância global 95,7% ICde 95% [89,3 – 98,3] Ensaio imunocromatográfico de Influenza tipo B + Total Teste bioNexia® Influenza + 7 1 8 A+B (linha Tipo B) 2 83 85 Total 9 84 93 Concordância global 96,8% ICde 95% [90,8 – 98,9] 46 410918 Os testes foram efectuados de forma independente por três utilizadores diferentes, sendo dois deles funcionários laboratoriais com experiência e o outro uma pessoa que ocasionalmente avalia testes rápidos (comparável a um assistente de médico). Foram preparadas amostras positivas através da diluição do extracto de controlo positivo no tampão de extracção com a finalidade de obter um meio positivo e uma amostra de controlo positivo elevada. Uma amostra negativa (apenas tampão) e as amostras positivas foram individualmente testadas em dez replicados em três lotes. Para todos os testes, a amostra negativa produziu resultados negativos e as amostras positivas produziram resultados positivos. Tanto a repetibilidade (no mesmo lote e no mesmo dia) e a reprodutibilidade (entre lotes, operadores diferentes) são aceitáveis para todas as amostras testadas. FR ES Precisão DE EN Ensaio imunocromatográfico de Influenza tipo A/B + Total Teste bioNexia® + 11 5 16 Influenza A+B 2 75 77 (linha Tipo A/B) Total 13 80 93 Concordância global 92,5% ICde 95% [85,1 – 96,4] Foi efectuada uma avaliação para determinar a reactividade cruzada do teste bioNexia® Influenza A+B. Não foi observada reactividade cruzada com os seguintes agentes patogénicos respiratórios ocasionalmente presentes em amostras nasofaríngeas. • Vírus sincicial respiratório • Adenovírus Proceder à eliminação dos reagentes utilizados ou não utilizados, bem como de quaisquer outros materiais descartáveis contaminados seguindo os procedimentos para produtos infecciosos ou potencialmente infecciosos. É da responsabilidade de cada laboratório gerir os resíduos e os efluentes produzidos de acordo com a sua natureza e com o grau de perigosidade, e proceder ao tratamento e eliminação dos mesmos (ou contratar uma entidade para proceder ao seu tratamento e eliminação) em conformidade com quaisquer normas aplicáveis. SV PT ELIMINAÇÃO DE RESÍDUOS IT Reactividade cruzada TR RU PL CS REFERÊNCIAS BIBLIOGRÁFICAS 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. bioNexia® Influenza A + B 47 QUADRO DE SÍMBOLOS Símbolo Significado Referência de catálogo Dispositivo médico para diagnóstico in vitro Fabricante Limites de temperatura Prazo de validade Código do lote Controlo positivo Não utilizar se a embalagem estiver danificada Directiva relativa a dispositivos médicos Consultar as instruções de utilização Não voltar a utilizar Método de esterilização por óxido de etileno Manter afastado da luz solar Conteúdo suficiente para <n> ensaios A BIOMERIEUX, o logótipo azul e bioNexia são marcas utilizadas, depositadas e/ou registadas, propriedade exclusiva da bioMérieux SA ou de uma das suas filiais. CLSI é uma marca propriedade exclusiva da Clinical and Laboratory Standards Institute, Inc. Qualquer outro nome ou marca comercial é propriedade do respectivo proprietário. bioMérieux SA 69280 Marcy-l‘Etoile-France Tel: 33 (0)4 78 87 20 00 Fax: 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 48 410918 FR DE ES IT Trots att en rad olika virus kan orsaka nedre luftvägsinfektioner hos barn och vuxna, så är de vanligaste influensa A & B, respiratoriskt syncytialvirus (RSV), parainfluensavirus 1, 2 och 3 och adenovirus. Bland dessa är influensa A & B och RSV de vanligaste orsakerna till akut respiratorisk sjukdom som kräver medicinsk vård. Förutom att dessa virus har en likartad säsongsprevalens, är det viktigt att vara medveten om det faktum att influensa A & B och RSV också har överlappande kliniska egenskaper och infektionspotential för vissa högriskgrupper bland patienter (t.ex. patienter som är mycket unga eller gamla, patienter med underliggande kardiopulmonala sjukdomar och immunsuppression). PT SAMMANFATTNING OCH FÖRKLARING Influensa är en mycket smittsam, akut infektion i luftvägarna som orsakas av virus som kallas influensavirus. Det finns tre typer av influensavirus: A, B och C, men det är endast typ A & B som enligt vad som är känt orsakar infektioner hos människor regelbundet. Typ A-virus är vanligast och associeras ofta med de flesta allvarliga epidemier. Typ B-virus ger symptom som vanligtvis är lindrigare än de som orsakas av typ A. Typ A och typ B-virus kan vara i omlopp samtidigt, men vanligtvis är en typ mer dominant under en säsongsepidemi (1). EN AVSEDD ANVÄNDNING bioNexia® Influenza A+B-testet är en snabb immunokromatografisk analys för kvalitativ detektion av influensa typ A- och typ B-antigener i humana nasofaryngealprover. Analyen är avsedd som ett hjälpmedel vid diagnostisering av influensainfektion. Detta test är endast avsett för professionell in vitrodiagnostisk användning. TR RU PL CS SV PRINCIP bioNexia® Influenza A+B-testet är en kvalitativ immunokromatografisk analys för detektion av influensa typ A- och typ B-antigener i humana nasofaryngealprover. bioNexia® Influenza A+B-testet detekterar det nukleoprotein, som är den del av viruset som aldrig förändras och detekterar följaktligen A&B-subtyper. Analysen är inte avsedd för detektion av influensa C-antigen. Vid analysen reagerar provet med partikeln överdragen med anti-influensa-antikroppar. Antigen-antikropp-komplexet migrerar genom kapillärverkan längs membranet som är överdraget med monoklonala antikroppar riktade mot influensa typ A- och typ B-antigener i testregionen. Vid ett positivt resultat reagerar de specifika antikropparna som finns på membranet med blandningskonjugatet och genererar en eller två färgade linjer i FLU A- (röd) och/eller FLU B-regionen (blå). Om provet inte innehåller influensaantigen framträder ingen linje i FLU A- och FLU B-regionen. En grönfärgad linje, som visas i kontrollregionen (C), fungerar som en procedurmässig kontroll och anger att testmigration har utförts korrekt. bioNexia® Influenza A + B 49 KITETS INNEHÅLL (10 TESTER) 10 testkassetter 1 buffert-flaska R1 10 extraktionsrör EXT med pipettlock 1 positiv kontrollsvabb 10 sterila svabbar I separat förseglade påsar med en engångspipett för prover och ett torkmedel. Testkassettens membran är överdraget med monoklonala musantikroppar riktade mot influensa typ A- och typ B-antigener. Plastflaska med 6 ml buffertlösning. Klar att användas. PBS-buffert med detergent och < 0,1 % natriumazid. Plaströr och pipettlock med filter för engångsanvändning. I en separat förseglad påse med torkmedel. Svabben är överdragen med inaktiverade extrakt av influensa A- och influensa B-stammar. Engångsprodukt för att ta nasofaryngeala prover (i enlighet med direktiv 93/42/EG, CE 0123). Sterilisering med etylenoxid. Sterila endast om påsen är intakt. 1 reagenshållare 1 snabbguide tryckt på förpackningen 1 bipacksedel NÖDVÄNDIGT MATERIAL (SOM INTE MEDFÖLJER) Behållare för provtagning Engångshandskar Sugapparat, steril sugkateter Timer FÖRSIKTIGHETSÅTGÄRDER • • • • • • • • 50 Endast för in vitro-diagnostik. Endast för professionell användning. Detta kit innehåller produkter av animaliskt ursprung. Certifierade data angående ursprunget och/eller hälsotillståndet hos djuren garanterar inte total frånvaro av överförbara patogena agens. Det rekommenderas därför att dessa produkter behandlas som potentiellt infektiösa och att de handhas med sedvanliga försiktighetsåtgärder. Använd inga reagens efter det utgångsdatum som anges på förpackningen. Testkassetten, den sterila svabben och den positiva kontrollen ska förvaras i den förseglade påsen med torkmedel tills den används. Använd dem inte om folieförpackningen är skadad. Alla komponenterna förutom bufferten (R1) är engångsprodukter; de får inte återanvändas. Alla prover ska anses infektiösa och behandlas enligt rekommenderade försiktighetsåtgärder (CLSI® M29-A, Protection of Laboratory Workers from Instrument Biohazards and Infectious Disease Transmitted by Blood, Body Fluids, and Tissue; Approved Guideline – aktuell revidering). För ytterligare information angående försiktighetsåtgärder vid hantering, se ”Biosafety in Microbiological and Biomedical Laboratories – CDC/NIH – senaste upplagan”, eller de f.n. gällande bestämmelserna i det aktuella landet. Provbufferten (R1) innehåller natriumazid (konserveringsmedel) vid en koncentration som understiger tröskelgränsvärdet 0,1 %. 410918 • • Förvara kitet vid 2 – 30 °C. FRYS INTE. Vid förvaring enligt rekommendationerna är alla komponenter stabila fram till det utgångsdatum som anges på förpackningen. Använd inte efter detta datum. Testkassetten ska förvaras i påsen tills den används. Använd testkassetten och den positiva kontrollen inom en timme efter att förpackningen har öppnats. EN PROVTAGNING OCH BEREDNING Tillvägagångssätt, nässvabb FR FÖRVARING OCH STABILITET • • • För in svabben i näsborren till bakre nasofarynx. Rotera svabben ett par gånger för att samla upp infekterade celler (var försiktig så att inte skaftet bryts av vid brytpunkten). – För optimal provtagning, upprepa proceduren i den andra näsborren. Bered provet omedelbart enligt beskrivningen i avsnittet Bruksanvisning. DE – – Droppa flera droppar koksaltlösning i vardera näsborre. För in katetern genom näsborren till bakre nasofarynx. Sug försiktigt. Dra långsamt ut katetern med en roterande rörelse. – För optimal provtagning, upprepa proceduren i den andra näsborren. Bered provet omedelbart enligt beskrivningen i avsnittet Bruksanvisning. IT – – – ES Nasofaryngeal aspiration eller nässköljningsmetoder BRUKSANVISNING – – – Använd ett separat extraktionsrör för varje prov. Tillsätt 15 droppar R1 i extraktionsröret. Placera nässvabben (eller den positiva kontrollsvabben) i extraktionsröret och blanda väl. Pressa ut som mycket vätska som möjligt från svabben. Avlägsna svabben och sätt pipettlocket på röret. Ta ut bioNexia® Influenza A+B-testet från den förseglade påsen. Håll extraktionsröret vertikalt och dispensera exakt 3 droppar i provbrunnen (S). Läs av resultatet 10 minuter efter provdispensering. Den här tidsramen måste strikt följas för att säkerställa att korrekta resultat erhålls. SV – – – CS Procedur för nässvabbsprover och den positiva kontrollen (se snabbguiden 1a’ till 1b’) PT Låt analyserna, proverna och reagenserna anta rumstemperatur (15 – 30 °C) före analys. Öppna inte den kylda påsen för att undvika kondens från luftfuktigheten på testmembranet. – – – – Öppna påsen och avlägsna engångspipetten för prover. Använd pipetten och dispensera 6 droppar av nässköljet eller aspirera prov i ett extraktionsrör (ett för varje prov). Tillsätt 3 droppar R1, sätt på pipettlocket på extraktionsröret och blanda väl. Avlägsna bioNexia® Influenza A+B-analysen från påsen. Håll extraktionsröret vertikalt och dispensera exakt 3 droppar i provbrunnen (S). Läs av resultatet 10 minuter efter provdispensering. Den här tidsramen måste strikt följas för att säkerställa att korrekta resultat erhålls. RU – – PL Procedur för nasofaryngeal aspirations- eller sköljprover (se snabbguiden 1a till 1c) PROVSTABILITET EFTER FÖRBEHANDLING TR Det utspädda provet kan användas omedelbart eller förvaras vid 18 – 25 °C eller 2 – 8 °C i upp till 8 timmar. bioNexia® Influenza A + B 51 RESULTAT OCH TOLKNING POSITIVT • • • Influensa A-positiv: Två tydliga linjer framträder i resultatfönstret: ett röd linje framträder i FLU A-regionen och en grön linje i kontrollregionen (C). Influensa B-positiv: Två tydliga linjer framträder i resultatfönstret: en blå linje framträder i FLU B-regionen och en grön linje i kontrollregionen (C). Influensa A+B-positiv: Tre fristående linjer framträder i resultatfönstret: ett röd linje framträder i FLU A-region och en blå linje i FLU B-regionen och en grön linje i kontrollregionen (C). Intensiteten på färgen i testregionerna kan variera beroende på koncentrationen av influensaantigener i provet. Koncentrationen av influensaantigener i provet kan dock inte fastställas med denna kvalitativa analys. En svag röd/blå linje ska betraktas som positiv. NEGATIVT En grön linje framträder i kontrollregionen (C). Ingen synlig linje framträder i FLU A- och FLU B-regionerna. OGILTIGT Den grönfärgade kontrollinjen (C) framträder inte. I det här fallet är resultatet ogiltigt även om testlinjen framträder (röd linje i FLU A-regionen och/eller blå linje i FLU B-regionen). Avsaknad av grön linje i kontrollregionen (C) betyder att testmigrationen inte har utförts korrekt och testresultatet är ogiltigt. Granska proceduren och upprepa testet med en ny testkassett. Om problem kvarstår, upphör genast att använda testkitet och kontakta din lokala distributör. FLU A FLU B Influenza A+B C FLU A C FLU A C FLU A FLU B FLU B FLU B Läs av resultatet 10 minuter efter provdispensering FLU A FLU A+B FLU B Positivt + C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B Negativt Ogiltigt x KVALITETSKONTROLL En positiv kontrollsvabb medföljer i kitet. Den positiva kontrollen ska generera ett influensa A+B-positivt resultat. Den här kontrollen måste utföras omedelbart efter att ett nytt kit har öppnats för att säkerställa att reagensprestandan inte har förändrats. Resultat kan inte valideras om kontrollresultaten avviker från de förväntade resultaten. Testet inkluderar en intern procedurmässig kontroll och en färgad linje (C) anger att testmigration har utförts korrekt. Om kontrollinjen inte visas är testet ogiltigt. Det är användarens ansvar att utföra kvalitetskontroll i enlighet med lokala tillämpliga förhållningsregler. METODENS BEGRÄNSNINGAR 1. bioNexia® Influenza A+B indikerar endast förekomsten av influensa i provet (kvalitativ detektion) och ska endast användas för detektion av influensa typ A- och typ B-antigener i nasofaryngeala prover (från svabb, aspirering eller sköljning). Varken kvantitativt värde eller graden av ökning av influensaantigenskoncentrationen kan fastställas med denna analys. 2. Om testresultatet är negativt och kliniska symptom kvarstår rekommenderas ytterligare testning med andra metoder. Ett negativt resultat utesluter aldrig att det rör sig om influensainfektion. 52 410918 FR 3. Denna analys tillhandahåller en presumptiv diagnos av influensainfektioner. Alla resultat måste tolkas tillsammans med annan klinisk information och laboratoriefynd som läkaren har tillgång till. PRESTANDA Analytisk sensitivitet DE ES IT PT SV CS Virus- Sub- ATCC nr Minsta typ typ detekterbara nivå PR/8/34 A H1N1 VR-95 8,89 x 105 CEID[50]/ml Swine/Iowa/15/30 A H1N1 VR-333 8,89 x 106 CEID[50]/ml Victoria/3/75 A H3N2 VR-822 1,58 x 105 CEID[50]/ml Swine/1976/31 A H1N1 VR-99 8,89 x 105 CEID[50]/ml Weiss/43 A H1N1 VR-96 8,89 x 108 CEID[50]/ml New Jersey/8/76 A H1N1 VR-897 1,58 x 105 (Hsw N1) CEID[50]/ml NWS/33 A H1N1 VR-219 1,58 x 105 CEID[50]/ml Port A H3N2 VR-810 1,58 x 106 CEID[50]/ml Chalmers/1/73 California/07/09 A H1N1 5 x 104 TCID[50]/ml Paris/5509/09 A H1N1 5 x 104 TCID[50]/ml Niger/2090/06 A H5N1 5 x 105 TCID[50]/ml Vietnam/1203/04 A H5N1 106 TCID[50]/ml Solomon A H1N1 105 TCID[50]/ml Islands/3/2006 South A H1N1 105 TCID[50]/ml Dakota/6/2007 R22 Barbara B VR-788 8,89 x 103 CEID[50]/ml Maryland/1/59 B VR-296 8,89 x 102 CEID[50]/ml GL/1739/54 B VR-103 1,58 x 105 CEID[50]/ml Lee/40 B VR-101 8,89 x 103 CEID[50]/ml Hong Kong/5/72 B VR-823 8,89 x 103 CEID[50]/ml Russia/69 B VR-790 8,89 x 104 CEID[50]/ml Jiangsu/10/2003 B 105 TCID[50]/ml Brisbane/60/2008 B 105 TCID[50]/ml PL Virusstam EN Analytisk sensitivitet fastställdes med totalt 22 stammar av humant influensavirus: 14 influensa A och 8 influensa B. TCID[50]/ml: 50 % vävnadsodling infektiös dos CEID[50]/ml: 50 % kycklingembryo infektiös dos TR RU KLINISK SENSITIVITET OCH SPECIFICITET Nässvabbs-, aspirations- eller sköljprover från 72 patienter med influensasymptom analyserades med bioNexia® Influenza A+B-testet och en RT-PCR-teknik. bioNexia® Influenza A + B 53 bioNexia® Influenza A+Banalys (typ A+B-linje) Totalt + - RT-PCR-teknik + 55 0 1 16 56 16 Totalt 55 17 72 Sensitivitet: 98,2 %; Specificitet: > 99 %; Dessutom för kliniskt bekräftade influensanegativa prover: – 77 patienter analyserades med bioNexia® Influenza A+B-testet: 75 av de 77 proverna var negativa för A- och B-stammarna. Specificiteten var 97,4%. – 86 patienter analyserades med bioNexia® Influenza A+Btestet: 85 av de 86 proverna var negativa för A-stammen. Specificiteten var 98,8%. – 84 patienter analyserades med bioNexia® Influenza A+Btestet: 83 av de 84 proverna var negativa för B-stammen. Specificiteten var 98,8%. Överensstämmelse med ett annat snabbtest Prestandan för bioNexia® Influenza A+B-testet har utvärderats genom jämförelse med ett annat immunokromatografiskt snabb test. Nasofaryngeala prover (från svabb, aspiration eller sköljning) från 93 patienter med influensasymptom analyserades med både teknikerna. Influensa typ A immunokromatografisk analys + Totalt bioNexia® Influenza A+B+ 4 4 8 test (typ A-linje) 0 85 85 Totalt 4 89 93 Global överensstämmelse 95,7 % KI95 % [89,3 – 98,3] Influensa typ B immunokromatografisk analys + Totalt bioNexia® Influenza A+B+ 7 1 8 test (typ B-linje) 2 83 85 Totalt 9 84 93 Global överensstämmelse 96,8 % KI95 % [90,8 – 98,9] Influensa typ A/B immunokromatografisk analys + Totalt bioNexia® Influenza A+B+ 11 5 16 test (typ A/B-linje) 2 75 77 Totalt 13 80 93 Global överensstämmelse 92,5 % KI95 % [85,1 – 96,4] Precision Analyserna utfördes var för sig av tre olika användare, varav två är erfaren laboratoriepersonal och en är en person som ibland utvärderar snabbtest (motsvarande vårdpersonal). Positiva prover bereddes genom spädning av det positiva kontrollextraktet i extraktionsbufferten för att erhålla ett medium positivt och ett kraftigt positivt kontrollprov. Ett negativt prov (endast buffert) och de positiva proverna testades vart och ett i tio replikat med tre lot. I alla analyserna gav det negativa provet negativa resultat och de positiva proverna positiva resultat. Repeterbarhet (inom samma lot, samma dag) och reproducerbarhet (mellan lot, olika användare) är acceptabel för alla analyserade prover. 54 410918 En bedömning gjordes för att fastställa bioNexia® Influenza A+B-testets korsreaktivitet. Ingen korsreaktivitet observerades med följande respirationspatogener som ibland finns i nasofaryngeala prover: • Respiratoriskt syncytialvirus • Adenovirus FR Korsreaktivitet DE EN AVFALLSHANTERING Avfallshantering för använda eller oanvända reagenser, liksom för andra kontaminerade engångsmaterial, ska ske i enlighet med procedurer för infektiösa eller potentiellt infektiösa produkter. Det är varje laboratoriums ansvar att handha avfallsoch avloppsprodukter enligt typ och farlighetsgrad och behandla och avlägsna dem (eller få dem behandlade och avlägsnade) i enlighet med alla tillämpliga föreskrifter. ES REFERENSER 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. SYMBOLER Symbol Betydelse IT Katalognummer Medicintekniska produkter för in vitro-diagnostik Tillverkare PT Temperaturbegränsning Använd före SV Lotnummer Positiv kontroll Använd inte om förpackningen är skadad CS Direktiv om medicintekniska produkter Se handhavandebeskrivningen Återanvänd ej PL Sterilisering med etylenoxid Förvara inte i direkt solljus RU Räcker till <n> antal tester CLSI är ett varumärke som tillhör Clinical and Laboratory Standards Institute, Inc. Alla andra namn eller varumärken tillhör respektive ägare. bioNexia® Influenza A + B 55 TR BIOMERIEUX, den blå logotypen och bioNexia är patentsökta och/eller registrerade varumärken som tillhör och används av bioMérieux SA eller något av dess dotterbolag. bioMérieux SA 69280 Marcy-l‘Etoile-France Tel: 33 (0)4 78 87 20 00 Fax: 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 56 410918 FR IT Přestože infekce dolního dýchacího traktu u dětí a dospělých může způsobovat celá řada virových původců, k nejčastějším patří chřipka typu A a B, respirační syncyciální virus (RSV), viry parainfluenzy 1, 2 a 3 a adenovirus. Z nich jsou nejdůležitějšími příčinami akutního onemocnění dýchacích cest viry chřipky typu A a B a RSV. Kromě toho, že viry chřipky typu A a B a RSV mají podobnou sezónní prevalenci, je důležité si uvědomit, že mají některé společné klinické rysy a infekční potenciál pro určité vysoce ohrožené skupiny pacientů (např. pro velmi mladé a velmi staré pacienty, pacienty trpící existujícím kardiopulmonálním onemocněním a imunosupresí). PT Chřipka je vysoce nakažlivá, akutní infekce dýchacího traktu vyvolaná viry známými jako viry chřipky. Existují tři typy virů chřipky: A, B a C, ale je známo, že infekce u lidí pravidelně způsobují jen typy A a B. Viry typu A jsou nejběžnější a často s nimi souvisejí nejzávažnější epidemie. Viry typu B vyvolávají symptomy, které jsou celkově mírnější než symptomy způsobené typem A. Viry typu A a B se mohou vyskytovat souběžně, ale během sezónní epidemie obvykle jeden typ převažuje (1). ES DE SOUHRN A VYSVĚTLENÍ EN ÚČEL POUŽITÍ Test bioNexia® Influenza A+B je rychlý imunochromatografický test ke kvalitativnímu stanovení antigenů chřipky typu A a typu B ve vzorcích z lidského nosohltanu. Test je určen k použití jako pomůcka při diagnostice chřipkové infekce. Test je určen pouze pro profesionální diagnostiku in vitro. TR RU PL CS SV PRINCIP Test bioNexia® Influenza A+B je kvalitativní imunochromatografický test ke stanovení antigenů chřipky typu A a B ve vzorcích z lidského nosohltanu. Test bioNexia® Influenza A+B detekuje nukleoprotein, který je neměnnou součástí viru, s následnou detekcí podtypů A a B. Test není určen k detekci antigenu chřipky typu C. Během testu vzorek reaguje s částicí pokrytou protilátkami proti chřipce. Komplexy antigenu a protilátky vzlínají po membráně do zóny výsledku testu, na kterou byla předem nanesena vrstva monoklonálních protilátek proti antigenům chřipky typu A a B. V případě pozitivního výsledku budou specifické protilátky přítomné na membráně reagovat se směsí konjugátu a v zóně FLU A (červená) a/nebo FLU B (modrá) vzniknou dvě barevné linie. Pokud vzorek neobsahuje antigen chřipky, v zóně FLU A a FLU B se žádná linie neobjeví. Zelená linie, která se objeví v kontrolní zóně (C), slouží pro kontrolu postupu a potvrzuje, že migrace při testu byla správně provedena. bioNexia® Influenza A + B 57 OBSAH SOUPRAVY (10 TESTŮ) 10 kazet s testem 1 lahvička s pufrem R1 10 extrakčních EXT zkumavek s víčky s kapátky 1 štětička s pozitivní kontrolou 10 sterilních štětiček V jednotlivých uzavřených pouzdrech s jednorázovou pipetou na vzorky a vysoušecím prostředkem. Membrána kazety s testem je pokryta vrstvou monoklonálních myších protilátek proti antigenům chřipky typu A a B. Plastová lahvička obsahující 6 ml roztoku pufru. Připravená k použití. Pufr PBS obsahující detergent a < 0,1 % azidu sodného. Plastová zkumavka a víčko s kapátkem a filtrem jen na jedno použití. V jednotlivém hermeticky uzavřeném sáčku s vysoušecím prostředkem. Na štětičku jsou naneseny deaktivované extrakty kmenů chřipky typu A a B. Zařízení na jedno použití k odběru vzorků z nosohltanu (podle směrnice č. 93/42/EHS, CE 0123). Sterilizace etylenoxidem. Sterilní jen v případě, že sáček s odlupovací vrstvou není poškozený. 1 držák reagencie 1 stručný návod pro uživatele vytištěný na krabičce 1 příbalový leták MATERIÁL, KTERÝ SE VYŽADUJE, AVŠAK NEPOSKYTUJE Nádobka na odběr vzorků Jednorázové rukavice Odsávačka, sterilní odsávací katétr Časovač VAROVÁNÍ A BEZPEČNOSTNÍ OPATŘENÍ • • • • • • • 58 Pouze pro diagnostiku in vitro. Pouze pro profesionální použití. Souprava obsahuje produkty živočišného původu. Ověřená znalost původu a/nebo zdravotního stavu živočichů není úplnou zárukou nepřítomnosti přenosných patogenních agens. Doporučuje se proto, aby se s těmito produkty zacházelo jako s potenciálně infekčními a při manipulaci se dbalo na běžná bezpečnostní opatření. Nepoužívejte reagencie po uplynutí data použitelnosti vyznačeného na obalu. Kazetu s testem, sterilní štětičku a pozitivní kontrolu je nutné před použitím uchovávat v uzavřeném pouzdře obsahujícím vysoušecí prostředek. Je-li fólie obalu poškozená, nepoužívejte je. Všechny složky s výjimkou pufru (R1) jsou na jedno použití; nesmí se používat opakovaně. Všechny vzorky je nutno považovat za infekční a je třeba s nimi zacházet podle doporučených bezpečnostních opatření (CLSI® M29-A, Protection of Laboratory Workers from Instrument Biohazards and Infectious Disease Transmitted by Blood, Body Fluids, and Tissue; Approved Guideline – aktuální revize). Další informace o bezpečnostních opatřeních při manipulaci naleznete v publikaci „Biosafety in Microbiological and Biomedical Laboratories – CDC/NIH – poslední vydání“, nebo v současných předpisech v zemi použití. 410918 FR Vzorek pufru (R1) obsahuje azid sodný (konzervační prostředek) v koncentraci pod prahovou mezní hodnotou 0,1 %. SKLADOVÁNÍ A STABILITA • • • • • Soupravu skladujte při teplotě 2 – 30 °C. NEZMRAZUJTE. Jsou-li všechny složky skladovány za doporučených podmínek, jsou stabilní, a to až do data uplynutí použitelnosti vyznačeného na obalu. Materiál nepoužívejte po uplynutí data jeho použitelnosti. Testovací zařízení by mělo před použitím zůstat v pouzdře. Kazetu s testem a pozitivní kontrolu použijte do jedné hodiny po otevření. DE ODBĚR A PŘÍPRAVA VZORKŮ Metoda stěru z nosohltanu EN • Štětičku zasuňte nosní dírkou do zadní části nosohltanu. Štětičkou několikrát otočte, abyste zachytili infikované buňky (dbejte na to, abyste nezlomili tyčinku v zalisovaném místě přerušení). – Abyste získali optimální vzorek, zopakujte postup v druhé nosní dírce. Ihned připravte vzorek podle pokynů uvedených v části Návod k použití. ES – – Metoda odsátí vzorku z nosohltanu nebo výplachunosu PT Do každé nosní dírky nakapejte několik kapek fyziologického roztoku. – Katétr zasuňte nosní dírkou do zadní části nosohltanu. – Jemně proveďte odsátí. Kroutivým pohybem pomalu vyjměte katétr. – Abyste získali optimální vzorek, zopakujte postup v druhé nosní dírce. Ihned připravte vzorek podle pokynů uvedených v části Návod k použití. IT – NÁVOD K POUŽITÍ – – – Postup pro vzorky získané odsátím z nosohltanu nebo jeho výplachem (viz stručný návod, body 1a až 1c) – – – – Otevřete sáček a vyjměte jednorázovou pipetu na vzorek. Touto pipetou umístěte 6 kapek vzorku získaného výplachem nosohltanu nebo odsátím do extrakční zkumavky (pro každý vzorek použijte jednu). Přidejte 3 kapky roztoku R1, do extrakční zkumavky vložte víčko s kapátkem a dobře promíchejte. Ze sáčku vyjměte test bioNexia® Influenza A+B. bioNexia® Influenza A + B 59 CS Pro každý vzorek použijte samostatnou extrakční zkumavku. Do extrakční zkumavky umístěte 15 kapek roztoku R1. Do extrakční zkumavky vložte štětičku se stěrem z nosohltanu (nebo štětičku s pozitivní kontrolou) a dobře promíchejte.Ze štětičky vytlačte co nejvíce tekutiny. Vyjměte štětičku a do zkumavky vložte víčko s kapátkem. Z uzavřeného sáčku vyjměte test bioNexia® Influenza A+B. Extrakční zkumavku držte ve svislé poloze a do jamky na vzorek (S) umístěte přesně 3 kapky. Výsledky odečtěte za 10 minut po umístění vzorku. Tuto dobu je nutné přesně dodržet, aby byly získané výsledky správné. PL – – RU – TR Postup pro vzorky stěru z nosohltanu a pozitivní kontrolu (viz stručný návod, body 1a’ až 1b’) SV Testy, vzorky a reagencie musí mít před provedením testu pokojovou teplotu (15 – 30 °C). Sáček po vyjmutí z chladničky neotvírejte, aby se na jeho membráně nesrážela vlhkost ze vzduchu. – Extrakční zkumavku držte ve svislé poloze a do jamky na vzorek (S) umístěte přesně 3 kapky. – Výsledky odečtěte za 10 minut po umístění vzorku. Tuto dobu je nutné přesně dodržet, aby byly získané výsledky správné. STABILITA VZORKU ZPRACOVÁNÍ PO PŘEDBĚŽNÉM Zředěný vzorek lze použít okamžitě nebo jej lze uchovat po maximální dobu 8 hodin při teplotě 18 – 25 °C nebo 2 – 8 °C. INTERPRETACE VÝSLEDKŮ POZITIVNÍ • • • Pozitivní chřipka typu A: V okénku s výsledkem se objeví dvě zřetelné linie: jedna červená linie se objeví v zóně FLU A a jedna zelená linie se objeví v kontrolní zóně (C). Pozitivní chřipka typu B: V okénku s výsledkem se objeví dvě zřetelné linie: jedna modrá linie se objeví v zóně FLU B a jedna zelená linie se objeví v kontrolní zóně (C). Pozitivní chřipka typu A+B: V okénku s výsledkem se objeví tři zřetelné linie: jedna červená linie se objeví v zóně FLU A, jedna modrá linie se objeví v zóně FLU B a jedna zelená linie se objeví v kontrolní zóně (C). Intenzita zbarvení v zónách výsledku testu se může měnit v závislosti na koncentraci antigenů chřipky ve vzorku. Koncentraci antigenů chřipky ve vzorku však nelze tímto kvalitativním testem přesně stanovit. Slabá červená nebo modrá linie znamená pozitivní výsledek. NEGATIVNÍ V kontrolní zóně (C) se objeví jedna zelená linie. V zónách FLU A a FLU B se neobjeví žádná viditelná linie. NEPLATNÝ Zelená kontrolní linie (C) se neobjeví. V takovém případě je výsledek neplatný, a to i tehdy, když je vidět linie výsledku testu (červená linie v zóně FLU A a/nebo modrá linie v zóně FLU B). Pokud se v kontrolní zóně (C) neobjeví zelená linie, znamená to, že migrace neproběhla správně a výsledek testu je neplatný. Zkontrolujte postup a test zopakujte s novou kazetou. Pokud problém přetrvává, testovací soupravu ihned přestaňte používat a kontaktujte místního distributora. FLU A FLU B C FLU A C FLU A C FLU A FLU B FLU B FLU B Výsledek testu vyhodnoťte za 10 minut FLU A FLU A+B FLU B Pozitivní + Influenza A+B C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B Negativní Neplatný x KONTROLA KVALITY Souprava obsahuje jednu štětičku s pozitivní kontrolou. Pozitivní kontrola by měla mít pozitivní výsledek na chřipku A+B. Tuto kontrolu je nutné provést ihned po otevření nové soupravy, aby bylo zajištěno správné chování reagencií. Výsledky nelze validovat, jestliže se kontrolní výsledky budou lišit od očekávaných výsledků. Test zahrnuje vnitřní kontrolu postupu a barevná linie (C) značí, že migrační zkouška byla provedena správně. Pokud se kontrolní linie neobjeví, test je neplatný. Uživatel nese odpovědnost za provádění kontroly kvality v souladu se všemi platnými místními předpisy. 60 410918 EN DE CHARAKTERISTIKY Analytická citlivost FR OMEZENÍ METODY 1. Test bioNexia® Influenza A+B pouze indikuje přítomnost viru chřipky ve vzorku (kvalitativní stanovení) a neměl by se používat ke stanovení antigenů chřipky typu A a B jen ve vzorcích z nosohltanu (získaných stěrem, odsátím nebo výplachem). Tímto testem nelze stanovit kvantitativní hodnotu ani tempo růstu koncentrace antigenu chřipky. 2. Je-li výsledek testu negativní a klinické symptomy přetrvávají, doporučuje se další vyšetření jinými metodami. Negativní výsledek nikdy nevylučuje možnost chřipkové infekce. 3. Tento test umožňuje stanovení pravděpodobné diagnózy chřipkových infekcí. Všechny výsledky je nutné interpretovat společně s dalšími klinickými údaji a laboratorními nálezy, které má lékař k dispozici. Analytická citlivost byla stanovena celkem na 22 kmenech virů lidské chřipky: 14 kmenech chřipky typu A a 8 kmenech chřipky typu B. TCID[50]/ml: 50 % infekční dávka pro tkáňovou kulturu CEID[50]/ml: 50 % infekční dávka pro kuřecí embrya bioNexia® Influenza A + B 61 IT PT SV CS PL RU TR Typ Podtyp Č. ATCC Minimální viru detekovatelná úroveň PR/8/34 A H1N1 VR-95 8,89 x 105 CEID[50]/ml Swine/Iowa/15/30 A H1N1 VR-333 8,89 x 106 CEID[50]/ml Victoria/3/75 A H3N2 VR-822 1,58 x 105 CEID[50]/ml Swine/1976/31 A H1N1 VR-99 8,89 x 105 CEID[50]/ml Weiss/43 A H1N1 VR-96 8,89 x 108 CEID[50]/ml New Jersey/8/76 A H1N1 VR-897 1,58 x 105 (Hsw N1) CEID[50]/ml NWS/33 A H1N1 VR-219 1,58 x 105 CEID[50]/ml Port A H3N2 VR-810 1,58 x 106 Chalmers/1/73 CEID[50]/ml California/07/09 A H1N1 5 x 104 TCID[50]/mL Paris/5509/09 A H1N1 5 x 104 TCID[50]/mL Niger/2090/06 A H5N1 5 x 105 TCID[50]/mL Vietnam/1203/04 A H5N1 106 TCID[50]/ mL Solomon A H1N1 105 TCID[50]/ Islands/3/2006 mL South A H1N1 105 TCID[50]/ mL Dakota/6/2007 R22 Barbara B VR-788 8,89 x 103 CEID[50]/ml Maryland/1/59 B VR-296 8,89 x 102 CEID[50]/ml GL/1739/54 B VR-103 1,58 x 105 CEID[50]/ml Lee/40 B VR-101 8,89 x 103 CEID[50]/ml Hong Kong/5/72 B VR-823 8,89 x 103 CEID[50]/ml Russia/69 B VR-790 8,89 x 104 CEID[50]/ml Jiangsu/10/2003 B 105 TCID[50]/ml Brisbane/60/2008 B 105 TCID[50]/ml ES Kmen viru KLINICKÁ CITLIVOST A SPECIFICITA Testem bioNexia® Influenza A+B a metodou RT-PCR byly vyšetřeny vzorky získané stěrem, odsátím nebo výplachem od 72 pacientů se symptomy chřipky. Test bioNexia® Influenza A+B (linie pro typ A+B) Celkem + - Metoda RT-PCR + Celkem 55 0 55 1 16 17 56 16 72 Citlivost: 98,2 %; Specificita: > 99 %; Dále na vzorcích klinicky potvrzených jako negativní: – testem bioNexia® Influenza A+B bylo vyšetřeno 77 pacientů: 75 ze 77 vzorků bylo negativních na linii A a B. Specificita byla 97,4 %. – testem bioNexia® Influenza A+B bylo vyšetřeno 86 pacientů: 85 z 86 vzorků bylo negativních na linii A. Specificita byla 98,8 %. – testem bioNexia® Influenza A+B bylo vyšetřeno 84 pacientů: 83 z 84 vzorků bylo negativních na linii B. Specificita byla 98,8 %. Shoda s jiným rychlým testem Byly hodnoceny charakteristiky testu bioNexia® Influenza A+B ve srovnání s jiným rychlým imunochromatografickým testem. Oběma metodami byly vyšetřeny vzorky z nosohltanu (získané stěrem, odsátím nebo výplachem) od 93 pacientů. Imunochromatografické stanovení chřipky typu A + Celkem Test bioNexia® Influenza + 4 4 8 A+B (linie pro typ A) 0 85 85 Celkem 4 89 93 Celková shoda 95,7 % CI95 % [89,3 – 98,3] Imunochromatografické stanovení chřipky typu B + Celkem Test bioNexia® Influenza + 7 1 8 A+B (linie pro typ B) 2 83 85 Celkem 9 84 93 Celková shoda 96,8 % CI95 % [90,8 – 98,9] Imunochromatografické stanovení chřipky typu A/B + Celkem Test bioNexia® Influenza + 11 5 16 A+B (linie pro typ A/B) 2 75 77 Celkem 13 80 93 Celková shoda 92,5 % CI95 % [85,1 – 96,4] Přesnost Testy byly provedeny nezávisle třemi různými uživateli. Dva z nich jsou zkušenými laboratorními pracovníky. Třetí z nich občas vyhodnocuje rychlé testy (podobně jako asistent lékaře). Pozitivní vzorky byly připraveny zředěním extraktu z pozitivní kontroly v extrakčním pufru, čímž byl získán středně pozitivní a vysoce pozitivní kontrolní vzorek. Negativní vzorek (jen pufr) a pozitivní vzorky byly jednotlivě testovány v deseti replikátech na třech šaržích. U všech testů negativní vzorky poskytly negativní výsledky a pozitivní vzorky poskytly pozitivní výsledky. Opakovatelnost (v rámci šarže, ve stejný den) a reprodukovatelnost (mezi šaržemi, různí pracovníci) jsou přijatelné pro všechny testované vzorky. 62 410918 Bylo provedeno hodnocení ke stanovení zkřížené reaktivity testu bioNexia® Influenza A+B. Zkříženou reaktivitu nevykazovaly tyto respirační patogeny, které se občas vyskytují ve vzorcích z nosohltanu: • respirační syncyciální virus, • adenovirus. FR Zkřížená reaktivita DE ES LITERATURA 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. EN LIKVIDACE ODPADU Použité a nepoužité reagencie a rovněž další kontaminované jednorázové materiály zlikvidujte podle postupů pro infekční nebo potenciálně infekční produkty. Každá laboratoř je zodpovědná za to, aby s odpadem a vypouštěnými látkami nakládala podle jejich povahy a stupně nebezpečnosti a zacházela s nimi a likvidovala je (nebo je nechala likvidovat jinými subjekty) v souladu se všemi platnými předpisy. VYSVĚTLIVKY K SYMBOLŮM Symbol Význam IT Katalogové číslo In vitro diagnostický zdravotnický prostředek Výrobce PT Teplotní rozmezí od do Použitelné do SV Číslo šarže Pozitivní kontrola Nepoužívat, je-li obal poškozen CS Směrnice o zdravotnických prostředcích Viz návod k použití Pro jednorázové použití PL Sterilizováno etylenoxidem Udržujte mimo přímé sluneční záření RU Lze použít pro <n> testů CLSI je ochrannou známkou firmy Clinical and Laboratory Standards Institute, Inc. Jakýkoliv další název nebo zapsaná ochranná známka jsou majetkem jejich příslušných držitelů. bioNexia® Influenza A + B 63 TR BIOMERIEUX, modré logo a bioNexia jsou používanými, přihlášenými a/nebo registrovanými ochrannými známkami firmy bioMérieux SA nebo některé z jejích poboček. bioMérieux SA 69280 Marcy-l‘Etoile-France Tel: 33 (0)4 78 87 20 00 Fax: 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 64 410918 FR DE ES IT Chociaż istnieje wiele różnorodnych czynników wirusowych mogących powodować infekcje dolnych dróg oddechowych u dzieci i dorosłych, najczęściej przyczyniają się do nich wirusy grypy typu A i B, syncytialny wirus oddechowy (RSV), wirusy paragrypy 1, 2 i 3 oraz adenowirus. Wśród nich wirusy grypy typu A i B oraz wirus RSV stanowią najważniejszą przyczynę leczonych chorób dróg oddechowych o ostrym przebiegu. Należy mieć świadomość, że oprócz podobnego rozpowszechnienia sezonowego, wirusy grypy typu A i B oraz wirus RSV charakteryzują zbliżone objawy kliniczne oraz podobny potencjał wywołania infekcji w przypadku określonych grup pacjentów wysokiego ryzyka (np. bardzo młodych lub w podeszłym wieku, cierpiących na schorzenia sercowo-płucne oraz osób z immunosupresją). PT STRESZCZENIE I OBJAŚNIENIA Grypa to bardzo zaraźliwa, ostra infekcja dróg oddechowych spowodowana wirusami określanymi jako wirusy grypy. Znane są trzy typy wirusów grypy: A, B i C, jednak wiadomo, że tylko typy A i B systematycznie powodują infekcje u ludzi. Wirusy typu A są najbardziej powszechne i są często wiązane z najcięższymi epidemiami. Wirusy typu B wywołują objawy łagodniejsze od spowodowanych wirusami typu A. Wirusy typu A i B mogą krążyć jednocześnie, jednak podczas epidemii sezonowej zazwyczaj dominuje jeden typ wirusów (1). EN ZASTOSOWANIE bioNexia® Influenza A+B jest szybkim testem immunochromatograficznym, służącym do jakościowego wykrywania antygenów wirusów grypy typu A i typu B w ludzkich próbkach nosowo-gardłowych. Test jest pomocny w diagnozowaniu infekcji grypowej. Test jest przeznaczony wyłącznie do specjalistycznego zastosowania w diagnostyce in vitro. TR RU PL CS SV ZASADA bioNexia® Influenza A+B jest jakościowym testem immunochromatograficznym, służącym do wykrywania antygenów wirusów grypy typu A i typu B w ludzkich próbkach nosowo-gardłowych. Test bioNexia® Influenza A+B wykrywa nukleoproteiny, będące niezmienną częścią wirusów, umożliwiając w ten sposób wykrywanie podtypów A i B wirusów. Test nie jest przeznaczony do wykrywania antygenu wirusa grypy typu C. Podczas testu próbka reaguje z cząsteczką powleczoną przeciwciałami skierowanymi przeciwko wirusowi grypy. Kompleksy antygen-przeciwciało migrują kapilarnie wzdłuż membrany pokrytej wstępnie monoklonalnymi przeciwciałami skierowanymi przeciwko wirusom grypy typu A i B w obszarze linii testu. W przypadku wyniku pozytywnego specyficzne przeciwciała znajdujące się na membranie będą reagowały z mieszaniną koniugatu, powodując powstanie jednej lub dwóch kolorowych linii w obszarze FLU A (kolor czerwony) i/lub obszarze FLU B (kolor niebieski). Jeśli próbka nie zawiera antygenu wirusa grypy, linie w obszarach FLU A i FLU B się nie pojawią. Zielona linia pojawiająca się w obszarze linii kontrolnej (C) umożliwia kontrolę proceduralną i wskazuje, czy migracja podczas testu przebiegała prawidłowo. bioNexia® Influenza A + B 65 ZAWARTOŚĆ ZESTAWU (10 TESTÓW) 10 Kaset z testem 1 butelka zawierająca bufor. R1 10 probówek ekstrakcyjnych z nasadkami dozującymi 1 wacik — dodatni materiał kontrolny EXT 10 jałowych wacików Pojedyncze, zapieczętowane woreczki z jednorazową pipetą do próbek oraz osuszaczem. Membrana kasety z testem jest pokryta przeciwciałami monoklonalnymi myszy skierowanymi przeciwko antygenom wirusów grypy typu A i B. Plastikowa fiolka zawierająca 6 ml roztworu buforu. Gotowy do użycia. Bufor PBS zawierający detergent i azydek sodu o stężeniu <0,1%. Plastikowa probówka z nasadką dozującą jednorazowego użytku. W pojedynczym, zapieczętowanym woreczku z osuszaczem. Wacik jest pokryty nieaktywnym ekstraktem szczepów wirusów grypy typu A i B. Przyrządy jednorazowego użytku do pobierania próbek z noso-gardła (Zgodne z dyrektywą 93/42/EWG, CE 0123). Wyjałowiono za pomocą tlenku etylenu. Jałowe tylko wtedy, gdy woreczek jest nienaruszony. 1 Uchwyt na odczynniki 1 Skrócona instrukcja obsługi wydrukowana na pudełku 1 Ulotka informacyjna MATERIAŁY WYMAGANE, ALE NIE WCHODZĄCE W SKŁAD ZESTAWU Pojemnik do pobierania próbek Rękawiczki jednorazowego użytku Przyrząd do odsysania, jałowy cewnik do odsysania Zegar OSTRZEŻENIA I ŚRODKI OSTROŻNOŚCI • • • • • • • 66 Tylko do diagnostyki in vitro. Wyłącznie do specjalistycznego zastosowania. Zestaw ten zawiera produkty pochodzenia zwierzęcego. Wiedza o pochodzeniu i/lub o stanie sanitarnym zwierząt nie gwarantują całkowicie braku czynników zakaźnych. Dlatego zaleca się, aby te produkty były traktowane jako potencjalnie zakaźne. Posługując się nimi, należy przestrzegać środków ostrożności. Nie używać odczynników po upływie terminu ważności wskazanego na opakowaniu. Do czasu użycia kaseta z testem, jałowy wacik i dodatni materiał kontrolny powinny znajdować się w zapieczętowanym woreczku zawierającym osuszacz. Nie używać ich, jeżeli opakowanie foliowe jest uszkodzone. Wszystkie składniki oprócz buforu (R1) są jednorazowego użytku. Nie wolno używać ich ponownie. Wszystkie odczynniki powinny być traktowane jako potencjalnie zakaźne. Posługując się nimi, należy przestrzegać zalecanych środków ostrożności (CLSI® M29-A, Protection of Laboratory Workers from Instrument Biohazards and Infectious Disease Transmitted by Blood, Body Fluids, and Tissue; Approved Guideline — Bieżąca wersja). Dodatkowe środki ostrożności zawarte są w dokumencie „Biosafety in Microbiological and 410918 FR • Biomedical Laboratories — CDC/NIH — Ostatnie wydanie” lub są regulowane przepisami właściwymi dla poszczególnych państw. Roztwór buforu (R1) zawiera azydek sodu (środek konserwujący) w stężeniu niższym od wartości progowej wynoszącej 0,1%. • DE • Przechowywać zestaw w temperaturze 2 – 30°C. NIE ZAMRAŻAĆ. Jeśli zestaw przechowywany jest w zalecanych warunkach, wszystkie składniki są stabilne do upływu terminu ważności wskazanego na opakowaniu. Nie używać po upływie terminu ważności. Urządzenie testujące powinno znajdować się w zapieczętowanych woreczkach do czasu użycia. Kasety testowej oraz kontroli dodatniej należy użyć w ciągu godziny od ich otwarcia. EN WARUNKI PRZECHOWYWANIA I STABILNOŚĆ • • • POBIERANIE I PRZYGOTOWYWANIE PRÓBEK Metoda wymazu z noso-gardła – Wprowadzić wacik poprzez nozdrze do tylnej nosogardzieli. Obrócić wacik kilkakrotnie, aby pobrać zainfekowane komórki (uważać, aby nie złamać patyczka z wacikiem w części przegubowej). – Aby pobranie próbki było optymalne, powtórzyć procedurę dla drugiego nozdrza. Niezwłocznie przygotować próbkę, zgodnie z opisem w części Instrukcja obsługi. Wkroplić kilka kropli roztworu soli fizjologicznej do każdego nozdrza. Wprowadzić cewnik poprzez nozdrze do tylnej nosogardzieli. – Zastosować delikatne ssanie. Wycofać powoli cewnik ruchem obrotowym. – Aby pobranie próbki było optymalne, powtórzyć procedurę dla drugiego nozdrza. Niezwłocznie przygotować próbkę, zgodnie z opisem w części Instrukcja obsługi. IT Metoda aspiracji lub wypłukania wydzieliny nosowo-gardłowej ES – – PT – – – – Użyć oddzielnej probówki ekstrakcyjnej dla każdej próbki. Dodać 15 kropli roztworu R1 do probówki ekstrakcyjnej. Umieścić wacik z wymazem nosowo-gardłowym (lub wacik z kontrolą dodatnią) w probówce ekstrakcyjnej i dokładnie wymieszać zawartość. Wycisnąć jak najwięcej cieczy z wacika. Wyjąć wacik i nałożyć na probówkę nasadkę dozującą. Wyjąć test bioNexia® Influenza A+B z zapieczętowanego woreczka. Przytrzymać probówkę ekstrakcyjną pionowo i wkroplić dokładnie 3 krople do studzienki na próbki (S). Odczytać wynik 10 minut po wkropleniu próbki. Należy ściśle przestrzegać zalecanego czasu, aby zapewnić uzyskanie prawidłowych wyników. Procedura dla próbek uzyskanych przez aspirację lub wypłukanie wydzieliny nosowogardłowej (patrz skrócona instrukcja obsługi, punkty 1a–1c) – Otworzyć woreczek i wyjąć jednorazową pipetę do próbek. bioNexia® Influenza A + B 67 CS PL – – RU – TR Procedura dla wymazów nosowo-gardłowych i kontroli dodatniej (patrz skrócona instrukcja obsługi, punkty 1a’–1b’) SV INSTRUKCJA OBSŁUGI Przed wykonaniem testu odczekać, aż testy, próbki i odczynniki osiągną temperaturę pokojową (15 – 30°C). Nie otwierać schłodzonego woreczka, aby uniknąć skraplania wilgoci atmosferycznej na membranie testu. – Za pomocą pipety wkroplić 6 kropli wypłukanej lub zaaspirowanej próbki wydzieliny nosowo-gardłowej do probówki ekstrakcyjnej (poszczególne próbki umieścić w oddzielnych probówkach). – Dodać 3 krople roztworu R1, nałożyć nasadkę dozującą na probówkę ekstrakcyjną i dokładnie wymieszać zawartość. – Wyjąć test bioNexia® Influenza A+B z woreczka. – Przytrzymać probówkę ekstrakcyjną pionowo i wkroplić dokładnie 3 krople do studzienki na próbki (S). – Odczytać wynik 10 minut po wkropleniu próbki. Należy ściśle przestrzegać zalecanego czasu, aby zapewnić uzyskanie prawidłowych wyników. STABILNOŚĆ PRÓBEK PO PRZETWORZENIU WSTĘPNYM Rozcieńczoną próbkę można użyć natychmiast lub przechowywać w temperaturze 18 – 25°C lub 2 – 8°C do 8 godzin. INTERPRETACJA WYNIKÓW WYNIK DODATNI • • • Wynik dodatni dla wirusów grypy typu A: W oknie wyników pojawiają się dwie oddzielne linie: jedna czerwona w obszarze FLU A i jedna zielona w obszarze linii kontrolnej (C). Wynik dodatni dla wirusów grypy typu B: W oknie wyników pojawiają się dwie oddzielne linie: jedna niebieska w obszarze FLU B i jedna zielona w obszarze linii kontrolnej (C). Wynik dodatni dla wirusów grypy typu A+B: W oknie wyników pojawiają się trzy oddzielne linie: jedna czerwona w obszarze FLU A, jedna niebieska w obszarze FLU B i jedna zielona w obszarze linii kontrolnej (C). Natężenie koloru w obszarach linii testu może się różnić w zależności od stężenia antygenów wirusów grypy w próbce. Za pomocą niniejszego testu jakościowego nie można jednak oznaczyć stężenia antygenów wirusów grypy. Bladą linię czerwoną/niebieską należy uznać za wynik dodatni. WYNIK UJEMNY Jedna zielona linia pojawia się w obszarze linii kontrolnej (C). Brak widocznych linii w obszarach FLU A i FLU B. WYNIK NIEWAŻNY Zielona linia w obszarze kontrolnym (C) nie pojawia się. W takim przypadku wynik jest nieważny, nawet jeśli widoczna jest linia testu (czerwona linia w obszarze FLU A i/lub niebieska linia w obszarze FLU B). Brak zielonej linii w obszarze linii kontrolnej (C) oznacza nieprawidłową migrację próbki i nieważny wynik. Należy sprawdzić poprawność wykonanej procedury i powtórzyć oznaczenie za pomocą nowego paska testowego. Jeżeli problem nie zostanie usunięty, należy zaprzestać stosowania zestawu testu i niezwłocznie skontaktować się z lokalnym dystrybutorem. C FLU A C FLU A C FLU A FLU B FLU B FLU B Odczytać wynik po upływie 10 minut Influenza A+B FLU A+B FLU A FLU A FLU B FLU B Wynik dodatni + C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B Wynik ujemny Wynik nieważny x 68 410918 EN FR KONTROLA JAKOŚCI W zestawie znajduje się jeden wacik z dodatnim materiałem kontrolnym. Wynik uzyskany przy jego użyciu powinien być dodatni pod kątem wirusów grypy typu A+B. Kontrolę należy przeprowadzić natychmiast po otwarciu nowego zestawu, aby działanie odczynnika nie uległo zmianie. Jeśli wyniki kontroli są różne od przewidywanych, nie można zatwierdzić wyników testu. Urządzenie testujące zawiera wewnętrzną procedurę kontrolną — obecność czerwonej linii w obszarze kontrolnym (C) oznacza prawidłową migrację probki. Jeżeli linia w obszarze kontrolnym nie pojawia się, test jest nieważny. Obowiązkiem użytkownika jest przeprowadzenie kontroli jakości zgodnie z lokalnymi uregulowaniami. IT ES DE OGRANICZENIA METODY 1. Test bioNexia® Influenza A+B umożliwia jedynie wskazanie obecności wirusów grypy w próbce (wykrywanie jakościowe) i należy go używać wyłącznie do wykrywania antygenów wirusów grypy typu A i B w próbkach nosowo-gardłowych (wymazach i próbkach uzyskanych poprzez aspirację lub wypłukiwanie). Za pomocą niniejszego testu nie można oznaczyć stężenia antygenów wirusów grypy ani wskaźnika wzrostu tego stężenia. 2. Jeśli wynik testu jest ujemny, a objawy kliniczne się utrzymują, zaleca się przeprowadzenie dodatkowych testów za pomocą innych metod. Wynik ujemny w żadnym wypadku nie wyklucza możliwości infekcji grypowej. 3. Test umożliwia przypuszczalną diagnozę infekcji grypowych. Wszystkie wyniki należy interpretować wraz z innymi dostępnymi informacjami klinicznymi i wynikami badań laboratoryjnych. H1N1 VR-95 Swine/Iowa/15/30 A H1N1 VR-333 Victoria/3/75 A H3N2 VR-822 Swine/1976/31 A H1N1 VR-99 Weiss/43 A H1N1 VR-96 New Jersey/8/76 (Hsw N1) NWS/33 A H1N1 VR-897 A H1N1 VR-219 Port Chalmers/1/73 California/07/09 A H3N2 VR-810 A H1N1 - Paris/5509/09 A H1N1 - Niger/2090/06 A H5N1 - Vietnam/1203/04 Solomon Islands/3/2006 South Dakota/6/2007 A A H5N1 H1N1 - A H1N1 - 105 TCID[50]/ml bioNexia® Influenza A + B 69 SV A CS PR/8/34 Minimalny poziom wykrywania 8,89 x 105 CEID[50]/ml 8,89 x 106 CEID[50]/ml 1,58 x 105 CEID[50]/ml 8,89 x 105 CEID[50]/ml 8,89 x 108 CEID[50]/ml 1,58 x 105 CEID[50]/ml 1,58 x 105 CEID[50]/ml 1,58 x 106 CEID[50]/ml 5 x 104 TCID[50]/ml 5 x 104 TCID[50]/ml 5 x 105 TCID[50]/ml 106 TCID[50]/ml 105 TCID[50]/ml PL Typ Pod- ATCC # wirusa typ RU Szczep wirusa TR Czułość analityczną określono, używając łącznie 22 szczepów ludzkich wirusów grypy: 14 typu A i 8 typu B. PT PRZEDSTAWIENIE WYNIKÓW Czułość analityczna Szczep wirusa Typ Pod- ATCC # wirusa typ R22 Barbara B - VR-788 Maryland/1/59 B - VR-296 GL/1739/54 B - VR-103 Lee/40 B - VR-101 Hong Kong/5/72 B - VR-823 Russia/69 B - VR-790 Jiangsu/10/2003 Brisbane/60/2008 B B - - Minimalny poziom wykrywania 8,89 x 103 CEID[50]/ml 8,89 x 102 CEID[50]/ml 1,58 x 105 CEID[50]/ml 8,89 x 103 CEID[50]/ml 8,89 x 103 CEID[50]/ml 8,89 x 104 CEID[50]/ml 105 TCID[50]/ml 105 TCID[50]/ml TCID[50]/ml: 50% dawki zakaźnej z hodowli tkankowej CEID[50]/ml: 50% dawki zakaźnej z hodowli tkanek zarodka kurzego KLINICZNA CZUŁOŚĆ I SWOISTOŚĆ Wymazy oraz uzyskane przez aspirację lub wypłukiwanie próbki nosowo-gardłowe pochodzące od 72 pacjentów z objawami grypy zbadano za pomocą testu bioNexia® Influenza A+B oraz techniki RT-PCR. Test bioNexia® Influenza A+B (linia typu A +B) Łącznie + - Technika RT-PCR + Łącznie 55 0 55 1 16 17 56 16 72 Czułość: 98,2%; Swoistość: >99%; Ponadto w badaniach próbek o potwierdzonym klinicznie wyniku ujemnym: – Uzyskano wynik ujemny pod kątem wirusów typu A i B dla 75 próbek pochodzących od 77 pacjentów zbadanych za pomocą testu bioNexia® Influenza A+B. Swoistość wyniosła 97,4%. – Uzyskano wynik ujemny pod kątem wirusów typu A dla 85 próbek pochodzących od 86 pacjentów zbadanych za pomocą testu bioNexia® Influenza A+B. Swoistość wyniosła 98,8%. – Uzyskano wynik ujemny pod kątem wirusów typu B dla 83 próbek pochodzących od 84 pacjentów zbadanych za pomocą testu bioNexia® Influenza A+B. Swoistość wyniosła 98,8%. Zgodność z innym szybkim testem Działanie testu bioNexia® Influenza A+B oceniono w porównaniu do innego szybkiego testu immunochromatograficznego. Pobrane od 93 pacjentów z objawami grypy próbki nosowo-gardłowe (wymazy oraz próbki uzyskane za pomocą aspiracji lub wypłukiwania) przebadano, używając obu technik. Oznaczenie immunochromatograficzne wirusów grypy typu A + Łącznie Test bioNexia® Influenza + 4 4 8 A+B (linia typu A) 0 85 85 Łącznie 4 89 93 Ogólna zgodność 95,7% CI95% [89,3 – 98,3] 70 410918 FR EN Oznaczenie immunochromatograficzne wirusów grypy typu A/B + Łącznie Test bioNexia® Influenza + 11 5 16 A+B (linia typu A/B) 2 75 77 Łącznie 13 80 93 Ogólna zgodność 92,5% CI95% [85,1 – 96,4] DE Oznaczenie immunochromatograficzne wirusów grypy typu B + Łącznie Test bioNexia® Influenza + 7 1 8 A+B (linia typu B) 2 83 85 Łącznie 9 84 93 Ogólna zgodność 96,8% CI95% [90,8 – 98,9] IT PT Testy przeprowadziło niezależnie trzech różnych użytkowników, z których dwie osoby należą do doświadczonego personelu laboratoryjnego, a jedna ocenia szybkie testy sporadycznie (charakter pracy porównywalny do asystenta lekarza). Próbki dodatnie przygotowano, rozcieńczając ekstrakt dodatniego materiału kontrolnego w buforze ekstrakcyjnym, aby uzyskać próbkę kontrolną o wyniku dodatnim średnim i wyniku dodatnim wysokim. Próbkę ujemną (zawierającą tylko roztwór buforowy) oraz próbki dodatnie przetestowano 10-krotnie, w trzech seriach. W przypadku wszystkich testów dla próbek ujemnych uzyskano wyniki ujemne, a dla próbek dodatnich — wyniki dodatnie. Powtarzalność (w obrębie jednej serii, tego samego dnia) i odtwarzalność (między seriami, różni operatorzy) były dopuszczalne w przypadku wszystkich badanych próbek. ES Precyzja Przeprowadzono badanie mające na celu określenie reaktywności krzyżowej testu bioNexia® Influenza A+B. Nie zaobserwowano reaktywności krzyżowej z następującymi patogenami dróg oddechowych, występującymi niekiedy w próbkach nosowo-gardłowych: • Syncytialny wirus oddechowy • Adenowirus SV Reaktywność krzyżowa TR 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. RU PL LITERATURA CS UTYLIZACJA ODPADÓW Utylizację wszystkich zużytych i nieużytych składnikow oraz innych skażonych materiałow należy przeprowadzać zgodnie z procedurą dotyczącą produktow potencjalnie zakaźnych. Za odpowiednie obchodzenie się i utylizację wytworzonych odpadów oraz ścieków odpowiedzialne jest laboratorium, które musi obchodzić się z nimi i utylizować je (lub powierzyć do utylizacji) stosownie do stopnia ich niebezpieczeństwa oraz zgodnie z odpowiednimi regulacjami prawnymi. bioNexia® Influenza A + B 71 INDEKS SYMBOLI Symbol Znaczenie Numer katalogowy Wyrób medyczny przeznaczony do diagnostyki in vitro Producent Temperatura przechowywania Użyć przed Kod partii Kontrola dodatnia Nie używać, jeśli opakowanie jest uszkodzone Dyrektywa dotycząca wyrobów medycznych Sprawdź w instrukcji obsługi Produkt jednorazowego użytku Wyjaławianie wykonano tlenkiem etylenu Przechowywać z dala od światła słonecznego Zawartość wystarczy do <n> oznaczeń BIOMERIEUX i jego niebieskie logo oraz bioNexia są znakami towarowymi używanymi, w trakcie rejestracji i/lub zastrzeżonymi, należącymi do bioMérieux SA lub jednego z przedstawicielstw. CLSI jest znakiem towarowym należącym do Clinical and Laboratory Standards Institute, Inc. Wszelkie inne nazwy lub znaki towarowe są własnością odpowiednich właścicieli. bioMérieux SA 69280 Marcy-l‘Etoile-France Telefon: 33 (0)4 78 87 20 00 Faks: 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 72 410918 FR DE EN НАЗНАЧЕНИЕ Тест bioNexia® Influenza A+B — это иммунохроматографический экспресс-тест для качественного определения антигенов к вирусу гриппа типа А и В в образцах, полученных из носоглотки человека. Тест предназначен для использования в качестве вспомогательного средства при диагностике гриппа. Только для профессиональной диагностики in vitro. IT PT SV Хотя инфекцию нижних дыхательных путей у детей и взрослых могут вызывать различные вирусы, наиболее распространенными возбудителями являются вирусы гриппа А и В, респираторно-синцитиальный вирус (РСВ), вирусы парагриппа 1, 2 и 3, а также аденовирус. Среди этих возбудителей грипп А и В, а также РСВ являются наиболее значимыми причинами острых респираторных заболеваний, требующих медицинского ухода. Кроме того, что для этих инфекции характерна сходная сезонная распространенность, важно осознавать тот факт, что грипп А и В, а также РСВ имеют перекрывающуюся клиническую симптоматику и вероятность заражения в группах пациентов высокого риска (например, пожилые пациенты, пациенты с фоновыми сердечно-легочными заболеваниями и иммуносупрессией). ES КРАТКОЕ ОПИСАНИЕ Грипп представляет собой высококонтагиозную острую инфекцию дыхательных путей, вызываемую так называемыми «вирусами гриппа». Выделяют три типа вирусов гриппа: А, В и С, но считается, что только вирусы типа А и В вызывают инфекцию у человека на регулярной основе. Вирус типа А наиболее распространен и является причиной большинства тяжелых эпидемий. Вирус типа В обычно вызывает менее тяжелые симптомы по сравнению с типом А. Возможна одновременная циркуляция вирусов типа А и В, однако во время сезонной эпидемии один тип обычно преобладает (1). TR RU PL CS ПРИНЦИП Тест bioNexia® Influenza A+B — это качественный иммунохроматографический тест для определения антигенов вирусов гриппа типа А и В в образцах, полученных из носоглотки человека. Тест bioNexia® Influenza A+B позволяет определять входящий в состав вируса нуклеопротеин, который никогда не меняется, и, следовательно, определять подтипы А и В. Тест не предназначен для выявления антигена гриппа С. При тестировании образец взаимодействует с частицей, покрытой антителами к вирусу гриппа. Под действием капиллярных сил комплексы антиген-антитело мигрируют по мембране, которая в зоне тестовой линии предварительно покрыта моноклональными антителами к антигенам гриппа типа А и В. При положительном результате специфические антитела, присутствующие на мембране, реагируют со смесью конъюгатов и формируют одну или две окрашенные полосы в зоне FLU A (красная) и/или FLU B (синяя). Если образец не содержит антиген гриппа, в зоне FLU A и FLU B полоса не проявляется. Зеленая полоса, появляющаяся в зоне контрольной линии (C), необходима для контроля качества процедуры и указывает на правильность осуществления тестовой миграции. 73 bioNexia® Influenza A + B СОСТАВ НАБОРА (10 ТЕСТОВ) 10 тестовых кассет 1 флакон с буфером R1 10 пробирок EXT для экстракции с колпачкомдозатором 1 зонд-тампон для положительного контроля 10 стерильных зондовтампонов Индивидуальные запечатанные пакеты с одноразовой пипеткой для образца и влагопоглотителем. На мембрану тестовой кассеты нанесен слой мышиных моноклональных антител к антигенам гриппа типа А и В. Пластиковый флакон, содержащий 6 мл буферного раствора. Готовый к применению. Фосфатно-солевой буфер, содержащий детергент и < 0,1 % натрия азида. Пластиковая пробирка и колпачок-дозатор с фильтром только для однократного применения. Индивидуальный запечатанный пакет с влагопоглотителем. Зонд-тампон покрыт инактивированными экстрактами, полученными из штаммов гриппа А и В. Одноразовое приспособление для взятия мазков из носоглотки (согласно Директиве 93/42/EEC, CE 0123). Стерилизовано этиленоксидом. Стерильно только в том случае, если пакет не поврежден. 1 штатив для реактива 1 краткое руководство пользователя, напечатанное на коробке 1 листок-вкладыш НЕОБХОДИМЫЕ РЕАКТИВЫ И МАТЕРИАЛЫ, НЕ ВКЛЮЧЕННЫЕ В НАБОР Контейнер для взятия образца Одноразовые перчатки Отсос, стерильный катетер для аспирации Таймер МЕРЫ ПРЕДОСТОРОЖНОСТИ • • • • • • 74 Только для профессиональной диагностики in vitro. Только для профессионального использования. В набор входят продукты животного происхождения. Сертификат, подтверждающий происхождение и/или санитарный статус животных, не гарантирует полностью отсутствие инфекционных патогенов. Поэтому рекомендуется обращение с данными продуктами как с потенциальным источником инфекции, с соблюдением стандартных мер безопасности. Не использовать реактивы после истечения срока годности, указанного на упаковке. Тестовую кассету, стерильный зонд-тампон и положительный контроль до момента использования следует хранить в запечатанном пакете, содержащем влагопоглотитель. Не допускается использование компонентов из пов-режденных упаковок. Все компоненты, кроме буфера (R1), предназначены для однократного применения; не подлежат повторному использованию. 410918 • • Хранить набор при температуре 2—30 °C. НЕ ЗАМОРАЖИВАТЬ. При хранении с соблюдением рекомендованных условий все компоненты являются стабильными до истечения срока годности, указанного на упаковке. Не использовать после истечения срока годности. Набор для тестирования должен находиться в упаковке до момента использования. Тестовую кассету и положительный контроль необходимо использовать в течение одного часа после вскрытия упаковки. ОБРАЗЦЫ (СБОР И ПОДГОТОВКА) Метод получения мазков из носоглотки с помощью зонда-тампона Проведите зонд-тампон через носовой ход до задней стенки носоглотки. Проверните зонд-тампон несколько раз, чтобы захватить инфицированные клетки (постарайтесь не сломать зонд в месте его припайки). – Для оптимального взятия образца повторите процедуру через другой носовой ход. Подготовьте образец незамедлительно, как описано в разделе «Применение». FR EN DE ХРАНЕНИЕ И СТАБИЛЬНОСТЬ РЕАКТИВОВ • • • ES • Все образцы должны рассматриваться как потенциальные источники инфекции, при обращении с ними следует соблюдать следующие рекомендации по мерам предосторожности (CLSI® M29-A, Protection of Laboratory Workers from Instrument Biohazards and Infectious Disease Transmitted by Blood, Body Fluids, and Tissue; Approved Guideline — в действующей редакции). Для получения дополнительной информации о мерах предосторожности при обращении см. «Biosafety in Microbiological and Biomedical Laboratories — CDC/NIH — последняя редакция» или действующие нормативные документы страны использования. Буфер образца (R1) содержит натрия азид (консервант) в концентрации менее порогового предельного значения 0,1 %. IT • – PT – – Внесите несколько капель солевого раствора в каждый носовой ход. Проведите катетер через носовой ход к задней стенке носоглотки. – Выполните аккуратную аспирацию. Вращательным дви-жением медленно извлеките катетер. – Для оптимального взятия образца повторите процедуру через другой носовой ход. Подготовьте образец незамедлительно, как описано в разделе «Применение». SV Метод аспирации содержимого носоглотки или смыва из полости носа CS – – – – Для каждого образца используйте отдельную пробирку для экстракции. Добавьте 15 капель буфера R1 в пробирку для экстракции. Поместите зонд-тампон для взятия мазков из носоглотки (или зонд-тампон для положительного контроля) в пробирку для экстракции и тщательно перемешайте. Извлеките из зонда-тампона как можно больше жидкости. bioNexia® Influenza A + B 75 RU TR Процедура обработки мазков, взятых с помощью зонда-тампона из носоглотки, и положительного контроля (см. краткое руководство, 1a’—1b’) PL ПРИМЕНЕНИЕ Перед тестированием доведите тесты, образцы и реактивы до комнатной температуры (15—30 °C). Не следует открывать пакет, вынутый из холодильника, для предотвращения конденсации атмосферной влаги на тестовой мембране. – – – Извлеките зонд-тампон и наденьте на пробирку колпачок-дозатор. Достаньте тест bioNexia® Influenza A+B из запечатанного пакета. Держите пробирку для экстракции вертикально и перенесите точно 3 капли раствора в лунку для образца (S). Результат необходимо оценивать через 10 минут после добавления образца. Для получения точных результатов необходимо строго соблюдать этот срок. Процедура обработки аспирата или смыва из носоглотки (см. краткое руководство, 1a—1c) – Вскройте пакет и извлеките одноразовую пипетку для взятия образца. – С помощью пипетки перенесите 6 капель смыва или аспирата из носоглотки в пробирку для экстракции (каждый образец в отдельную пробирку). – Добавьте 3 капли буфера R1, наденьте на пробирку для экстракции колпачок-дозатор и тщательно перемешайте. – Достаньте тест bioNexia® Influenza A+B из пакета. – Держите пробирку для экстракции вертикально и перенесите точно 3 капли раствора в лунку для образца (S).Результат необходимо оценивать через 10 минут после добавления образца. Для получения точных результатов необходимо строго соблюдать этот срок. СТАБИЛЬНОСТЬ ОБРАЗЦОВ ПРЕДВА-РИТЕЛЬНОЙ ОБРАБОТКИ ПОСЛЕ Разведенный образец можно использовать немедленно или в течение не более 8 часов, храня его при температуре 18—25 °C или 2—8 °C. УЧЕТ И ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ ПОЛОЖИТЕЛЬНЫЙ • • • Положительный на вирус гриппа А. Появились две хорошо заметных полосы в окне результата: одна красная полоса в зоне FLU A и одна зеленая полоса в зоне контрольной линии (C). Положительный на вирус гриппа В. Появились две хорошо заметных полосы в окне результата: одна синяя полоса в зоне FLU В и одна зеленая полоса в зоне контрольной линии (C). Положительный на вирус гриппа А и В. Появились три хорошо заметных полосы в окне результата: одна красная полоса в зоне FLU А, одна синяя полоса в зоне FLU В и одна зеленая полоса в зоне контрольной линии (C). Интенсивность окрашивания в зонах тестовой линии варьируется в зависимости от концентрации антигенов вируса гриппа в образце. Тем не менее, с помощью данного качественного теста определить концентрацию антигенов вируса гриппа в образце невозможно. При появлении едва заметной красной/синей полосы результат следует считать положительным. ОТРИЦАТЕЛЬНЫЙ Появилась одна зеленая полоса в зоне контрольной линии (C). В зоне FLU A и FLU B полоса не появилась. НЕДЕЙСТВИТЕЛЬНЫЙ Зеленая контрольная полоса (C) не появилась. В этом случае результат считается недействительным, даже если появилась тестовая линия (красная линия в зоне FLU A и/или синяя линия в зоне FLU B). Отсутствие зеленой полосы в зоне контрольной линии (C) означает, что тестовая миграция не была проведена правильно, и результат тестирования недействителен. Проведите поиск возможной ошибки в процедуре и повторите тест с использованием новой кассеты. При сохранении проблемы следует немедленно прекратить использование тестового набора и связаться с местным дистрибьютором. 76 410918 C FLU A C FLU A FLU B FLU B FLU B FR C FLU A Оцените результат через 10 минут FLU A FLU B FLU B Положительный + C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B EN Influenza A+B FLU A+B FLU A Отрицательный Недействительный x ES IT В набор включен один зонд-тампон для положительного контроля. Положительный образец должен обеспечивать получение положительного результата на вирус гриппа А и В. Этот контрольный тест необходимо выполнять непосредственно после вскрытия нового набора, чтобы убедиться в том, что рабочие характеристики реактивов не изменились. Результатам невозможно доверять, если результат контрольного теста не соответствует ожидаемым. Тест имеет собственную систему контроля качества процедуры, наличие окрашенной полосы в зоне (C) указывает на правильность осуществления тестовой миграции. Если контрольная линия не проявляется, тест является недействительным. Проведение процедур контроля качества в соответствии с местными нормативными требованиями находится в сфере ответственности пользователя. DE КОНТРОЛЬ КАЧЕСТВА CS SV PT ОГРАНИЧЕНИЯ МЕТОДА 1. Тест bioNexia® Influenza A+B обнаруживает только наличие вируса гриппа в образце (качественное определение). Его следует использовать для определения антигенов к вирусу гриппа типа А и В только в образцах, полученных из носоглотки человека (мазок, аспират или смыв). Этот тест не позволяет определить ни количественный показатель, ни скорость нарастания концентрации антигена вируса гриппа. 2. Если отрицательный результат сопровождается стойкими клиническими симптомами, рекомендуется провести дополнительное обследование с помощью других мето-дов. Отрицательный результат ни при каких условиях не исключает вероятность инфицирования вирусом гриппа. 3. Этот тест обеспечивает предварительную диагностику инфицирования вирусом гриппа. Все результаты необходимо интерпретировать совместно с остальной клинической информацией и данными лабораторных исследований, доступными врачу. Для определения аналитической чувствительности исполь-зовалось в общей сложности 22 штамма вирусов гриппа человека: 14 штаммов вируса гриппа А и 8 штаммов вируса гриппа В. bioNexia® Influenza A + B 77 RU Штамм вируса TR Тип Под- ATCC № Минимально ви- тип обнаруруса живаемый уровень PR/8/34 A H1N1 VR-95 8,89 x 105 CEID[50]/мл Swine/Iowa/15/30 A H1N1 VR-333 8,89 x 106 CEID[50]/мл Victoria/3/75 A H3N2 VR-822 1,58 x 105 CEID[50]/мл Swine/1976/31 A H1N1 VR-99 8,89 x 105 CEID[50]/мл PL ЭФФЕКТИВНОСТЬ Аналитическая чувствительность Штамм вируса Weiss/43 New Jersey/8/76 (Hsw N1) NWS/33 Port Chalmers/1/73 California/07/09 Paris/5509/09 Niger/2090/06 Vietnam/1203/04 Solomon Islands/3/2006 South Dakota/6/2007 R22 Barbara Тип Под- ATCC № Минимально ви- тип обнаруруса живаемый уровень A H1N1 VR-96 8,89 x 108 CEID[50]/мл A H1N1 VR-897 1,58 x 105 CEID[50]/мл A H1N1 VR-219 1,58 x 105 CEID[50]/мл A H3N2 VR-810 1,58 x 106 CEID[50]/мл A H1N1 5 x 104 TCID[50]/мл A H1N1 5 x 104 TCID[50]/мл A H5N1 5 x 105 TCID[50]/мл A H5N1 106 TCID[50]/мл A H1N1 105 TCID[50]/мл A H1N1 - 105 TCID[50]/мл B - VR-788 Maryland/1/59 B - VR-296 GL/1739/54 B - VR-103 Lee/40 B - VR-101 Hong Kong/5/72 B - VR-823 Russia/69 B - VR-790 Jiangsu/10/2003 Brisbane/60/2008 B B - - 8,89 x 103 CEID[50]/мл 8,89 x 102 CEID[50]/мл 1,58 x 105 CEID[50]/мл 8,89 x 103 CEID[50]/мл 8,89 x 103 CEID[50]/мл 8,89 x 104 CEID[50]/мл 105 TCID[50]/мл 105 TCID[50]/мл TCID[50]/мл: 50%-я инфекционная доза для клеточной культуры CEID[50]/мл: 50%-я инфекционная доза для куриного эмбриона КЛИНИЧЕСКАЯ ЧУВСТВИТЕЛЬНОСТЬ СПЕЦИ-ФИЧНОСТЬ И Образцы, полученные с помощью мазка, аспирата или смыва из носоглотки у 72 пациентов с симптомами гриппа, были исследованы с помощью теста bioNexia® Influenza A+B и метода RT-PCR. Метод RT-PCR + Итого Тест bioNexia® Influenza + 55 0 55 A+B (линия типа A и B) 1 16 17 Итого 56 16 72 Чувствительность: 98,2%; специфичность: > 99 % Кроме того, в образцах с клинически подтвержденной отрицательной реакцией на вирус гриппа, получены следующие результаты: – 77 пациентов исследованы с помощью теста bioNexia® Influenza A+B: 75 из 77 образцов были отрицательными на вирусы линии А и В. Специфичность составила 97,4 %. – 86 пациентов исследованы с помощью теста bioNexia® Influenza A+B: 85 из 86 образцов были отрицательными на вирусы линии А. Специфичность составила 98,8 %. 78 410918 84 пациента исследованы с помощью теста bioNexia® Influenza A+B: 83 из 84 образцов были отрицательными на вирусы линии В. Специфичность составила 98,8 %. FR – Иммунохроматографический анализ вируса гриппа АиВ + Итого Тест bioNexia® Influenza + 11 5 16 A+B (линия типа A/B) 2 75 77 Итого 13 80 93 Общая сходимость 92,5 % ДИ95 % (85,1—96,4) DE ES IT Иммунохроматографический анализ вируса гриппа В + Итого Тест bioNexia® Influenza + 7 1 8 A+B (линия типа В) 2 83 85 Итого 9 84 93 Общая сходимость 96,8 % ДИ95 % (90,8—98,9) PT Эффективность теста bioNexia® Influenza A+B оценивалась в сравнении с другим быстрым иммунохроматографическим тестом. Образцы из носоглотки (мазок, аспират или смыв) от 93 пациентов с симптомами гриппа были протестированы обоими методами. Иммунохроматографический анализ вируса гриппа А + Итого Тест bioNexia® Influenza + 4 4 8 A+B (линия типа A) 0 85 85 Итого 4 89 93 Общая сходимость 95,7 % ДИ95 % (89,3—98,3) EN Соответствие другим экспресс-тестам CS PL Тесты независимо проводились тремя различными пользователями, два из которых были опытными лабораторными работниками, а один — лицом, периодически использующим экспресстесты (по аналогии с врачом). Для получения среднеположительного и сильноположительного контрольного образца, положительный контроль разводили в буфере для экстракции. Как отрицательные (только буфер), так и положительные образцы тестировались с десятью повторениями в трех партиях. Во всех тестах отрицательный образец давал отрицательные результаты, а положительный образец — положительные результаты. Получена приемлемая повторяемость (в пределах партии, в один день) и воспроизводимость (между партиями, различные операторы) для всех исследуемых образцов. SV Погрешность УТИЛИЗАЦИЯ ОТХОДОВ Использованные и неиспользованные реактивы, а также любые другие загрязненные материалы однократного применения после процедур следует утилизировать как bioNexia® Influenza A + B 79 TR Целью исследования было определение перекрестной реактивности теста bioNexia® Influenza A+B. Для следующих возбудителей респираторных инфекций, иногда встречающихся в образцах из носоглотки, перекрестная реактивность отсутствовала: • Респираторно-синцитиальный вирус • Аденовирус RU Перекрестная реактивность инфекционные или потенциально инфекционные продукты. Хранение, обработка и утилизация твердых и жидких отходов, с учетом их характера и степени опасности, в соответствии с применимыми нормами находится в сфере ответственности каждой конкретной лаборатории. СПИСОК ЛИТЕРАТУРЫ 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. ТАБЛИЦА СИМВОЛОВ И ОБОЗНАЧЕНИЙ Символ Обозначение Номер по каталогу Для диагностики in vitro Средство медицинского назначения Произведено Температурные ограничения Использовать до Номер партии Положительный контроль Не использовать, если упаковка повреждена Директива по медицинским устройствам Перед использованием прочтите инструкцию Не использовать повторно Стерилизовано этиленоксидом Не подвергать воздействию солнечного света Содержимого достаточно для <n> тестов BioMerieux, логотип и bioNexia являются зарегистрированными (или находящимися в процессе регистрации) торговыми марками компании bioMerieux SA. Все права защищены. CLSI является торговой маркой, принадлежащей Clinical and Laboratory Standards Institute, Inc. Другие названия или торговые марки являются собственностью соответствующих владельцев. bioMérieux SA 69280 Marcy-l‘Etoile-France Тел.: 33 (0)4 78 87 20 00 Факс: 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 80 410918 FR DE ES PT PRENSİBİ PL RU TR bioNexia® Influenza A+B testi insan nazofarangeal numunelerindeki İnfluenza tip A ve tip B antijenlerinin tespitinde kullanılan kalitatif bir immünokromatografik testtir. bioNexia® Influenza A+B testi, virüsün hiç değişmeyen bölümü olan nükleoproteini tespit eder ve buna bağlı olarak A ve B alt tiplerini tanımlar. Test İnfluenza C antijeninin tespit edilmesi için tasarlanmamıştır. Test işlemi sırasında, numune anti-İnfluenza antikorları ile kaplı partikül ile reaksiyona girer. Antijen-antikor kompleksleri, test çizgisi bölgesinde İnfluenza tip A ve tip B antijenlerine karşı yönlendirilen monoklonal antikorlar ile önceden kaplanmış membran boyunca kapiler faaliyet yoluyla hareket eder. Pozitif sonuç durumunda, membran üzerinde bulunan spesifik antikorlar karışım konjugatı ile reaksiyona girer ve FLU A ve/veya FLU B bölgesinde bir ya da iki renkli çizgi oluşturur. Numune İnfluenza antijeni içermiyor ise, FLU A (kırmızı) ve FLU B (mavi) bölgesinde hiçbir çizgi görülmez. Kontrol çizgisi bölgesinde (C) görülen yeşil renkli çizgi, prosedürel bir kontrol işlevi görür ve test migrasyonunun doğru yapıldığını gösterir. CS Çocuk ve yetişkinlerde çok çeşitli viral ajanlar alt solunum yolları enfeksiyonlarına neden olabilse de, en yaygın ajanlar İnfluenza A ve B, Respiratuvar Sinsitiyal Virüs (RSV), para İnfluenza virüsleri 1, 2, 3 ve adenovirüstür. Bunlar arasında, İnfluenza A, B ve RSV, tıbbi tedavi gerektiren akut solunum yolu hastalıklarının en önemli nedenleridir. Benzer bir mevsimsel yaygınlığı paylaşmanın yanı sıra, gerek İnfluenza A ve B gerekse RSV’nin yüksek risk grubundaki belli hastalar için (çok yaşlı hastalar, altta yatan kardiyopulmoner hastalık ve immünosupresyon rahatsızlıkları olan hastalar) örtüşen klinik özelliklere ve enfeksiyon potansiyeline sahip olduğunun farkında olunması önemlidir. SV IT ÖZET VE AÇIKLAMA İnfluenza hastalığı, İnfluenza virüsleri olarak bilinen virüslerin neden olduğu, son derece bulaşıcı, akut bir solunum yolları enfeksiyonudur. Üç tip İnfluenza virüsü vardır: A, B ve C, ancak insanlarda sadece A ve B tiplerinin devamlı olarak enfeksiyonlara neden olduğu bilinmektedir. Tip A virüsleri en yaygın olarak görülenlerdir ve sıklıkla en şiddetli salgın hastalıklarla ilişkilendirilir. Tip B virüsler, tip A’nın neden olduğu semptomlardan daha hafif semptomlara yol açar. Tip A ve tip B virüsleri aynı zamanlarda dolaşım halinde olabilir, ancak mevsimsel bir salgın sırasında tiplerden biri baskındır (1). EN KULLANIM AMACI bioNexia® Influenza A+B testi insan nazofarangeal numunelerindeki İnfluenza tip A ve tip B antijenlerinin tespitinde kullanılan kalitatif bir hızlı immünokromatografik testtir. Bu test İnfluenza enfeksiyonunun tanısına yardımcı olmak üzere tasarlanmıştır. Test sadece profesyonel vücut dışı tanı amaçlı kullanım içindir. bioNexia® Influenza A + B 81 KİT İÇERİĞİ (10 TEST) 10 Test kaseti 1 Tampon şişesi R1 10 adet EXT damlalık başlıklı Ekstraksiyon tüpü 1 Pozitif kontrol svabı 10 Steril svab Tek kullanımlık numune pipeti ve nem önleyici içeren tekli kapalı poşetler içinde. Test kaset membranı İnfluenza tip A ve tip B antijenlerine karşı yönlendirilen fare monoklonal antikorları ile kaplanmıştır. 6 mL tampon solüsyonu içeren plastik flakon. Kullanıma hazırdır. Deterjan ve <%0,1 sodyum azid içeren PBS tamponu. Tek kullanımlık filtreli plastik tüp ve damlalık başlığı. Nem önleyici içeren tekli kapalı poşet içinde. Svab İnfluenza A ve İnfluenza B suşlarının inaktif ekstraktı ile kaplanmıştır. Nazofarangeal numune almak için tek kullanımlık aparat. (93/42/EEC Yönetmeliği çerçevesinde, CE 0123). Etilen oksit kullanılarak sterilize edilmiştir. Steril poşetin bozulmaması durumunda sterildir. 1 Reaktif tutucu Kutu üzerine baskılı 1 Kullanıcı hızlı kılavuzu 1 Prospektüs GEREKLİ ANCAK SAĞLANMAYAN MATERYALLER Numune alım kabı Tek kullanımlık eldivenler Aspirasyon aparatı, steril aspirasyon kateteri Süre ölçer UYARILAR VE ÖNLEMLER • • • • • • • • 82 Sadece vücut dışı tanı amaçlı kullanım içindir. Sadece profesyonel kullanım içindir. Bu kit hayvan kaynaklı ürünler içermektedir. Hayvanların kökeni ve/veya sıhhi durumu ile ilgili onaylanmış bilgiler, bulaşıcı patojenik ajanların yokluğunu tam olarak garanti etmez. Bu nedenle, bu ürünler potansiyel olarak bulaşıcı kabul edilmeli ve genel güvenlik önlemleri alınarak kullanılmalıdır. Reaktifleri ambalaj üzerinde belirtilen son kullanma tarihinden sonra kullanmayınız. Test kaseti, steril svab ve pozitif kontrol kullanılana kadar nem önleyici içeren kapalı poşet içinde saklanmalıdır. Poşet folyo paketi zarar görmüş ise kullanmayınız. Tampon (R1) dışındaki tüm bileşenler tek kullanımlıktır, tekrar kullanılmamalıdır. Tüm numunelerin bulaşıcı olduğu düşünülmeli ve tavsiye edilen şu önlemlere göre kullanılmalıdır (CLSI® M29-A Protection of Laboratory Workers from Instrument Biohazards and Infectious Disease Transmitted by Blood, Body Fluids, and Tissue; Approved Guideline – Güncel revizyon). Önlemlerin uygulanmasına ilişkin ek bilgiler için, “Biosafety in Microbiological and Biomedical Laboratories – CDC/NIH – Son baskı” ya da kullanıldığı ülkede yürürlükteki düzenlemelere başvurunuz. Numune tamponu (R1) %0,1’lik eşik limit değerinin altındaki bir konsantrasyonda sodyum azid (koruyucu) içerir. 410918 • EN • Kiti 2 – 30°C’de muhafaza ediniz. DONDURMAYINIZ. Önerilen koşullarda muhafaza edildiği takdirde tüm içerik etiket üzerinde yazılı son kullanma tarihine kadar stabil kalır. Son kullanma tarihinden sonra kullanmayınız. Test aparatı kullanılana kadar poşet içerisinde tutulmalıdır. Test kasetini ve pozitif kontrolü ambalajı açıldıktan sonra bir saat içinde kullanın. FR MUHAFAZA VE STABİLİTE • • • NUMUNE ALIMI VE HAZIRLIĞI Nazofarangeal sürüntü yöntemi – Svabı burun deliği yoluyla posterior nazofarenkse sokunuz. Enfekte hücreleri almak için svabı birkaç defa çeviriniz (kırma noktasındaki şafta zarar vermemeye dikkat ediniz). – Optimum numune alımı için, diğer burun deliğinde prosedürü tekrarlayınız. Kullanım talimatları paragrafında açıklandığı gibi numuneyi hemen hazırlayın. Her burun deliğine birkaç damla salin solüsyonu damlatınız. – Kateteri burun deliği yoluyla posterior nazofarenkse yerleştiriniz. – Nazikçe aspirasyon uygulayınız. Kateteri döndürme hareketi ile yavaşça geri çekiniz. – Optimal numune alımı için, diğer burun deliğinde prosedürü tekrarlayınız. Kullanım talimatları paragrafında açıklandığı gibi numuneyi hemen hazırlayın. ES – IT Nazofarangeal aspirasyon veya burun yıkama yöntemleri DE – PT KULLANIM TALİMATLARI Test işlemi öncesinde test, numune ve reaktiflerin oda sıcaklığına (15 – 30°C) gelmesini sağlayınız. Atmosferdeki nemin test membranı üzerinde yoğunlaşmasını önlemek için soğutulmuş poşeti açmayınız. – Nazofarangeal aspirat veya yıkama numuneleri prosedürü (bkz. hızlı kılavuz 1a ila 1c) – – – – – TR – Poşeti açınız ve tek kullanımlık numune pipetini çıkarınız. Bu pipet yardımıyla, 6 damla nazofarangeal yıkama veya aspirat numunesini bir ekstraksiyon tüpüne (her numune için bir adet) damlatınız. 3 damla R1 ekleyiniz, damlalık başlığını ekstraksiyon tüpüne yerleştiriniz ve iyice karıştırınız. bioNexia® Influenza A+B testini poşetinden çıkarınız. Ekstraksiyon tüpünü dik tutunuz ve tam olarak 3 damlayı numune kuyucuğuna (S) damlatınız. Numuneyi damlattıktan 10 dakika sonra sonucu okuyunuz. Doğru sonuçların elde edilebilmesi için, bu zaman sınırlarına harfiyen uyulması gerekir. CS – PL – Her numune için ayrı bir ekstraksiyon tüpü kullanınız. Ekstraksiyon tüpüne 15 damla R1 ekleyiniz. Nazofarangeal svabı (veya pozitif kontrol svabı) ekstraksiyon tüpüne yerleştiriniz ve iyice karıştırınız. Svabdan mümkün olduğunca fazla sıvı çıkarınız. Svabı çıkarınız ve damlalık başlığını tüpe yerleştiriniz. bioNexia® Influenza A+B testini kapalı poşetinden çıkarınız. Ekstraksiyon tüpünü dik tutunuz ve tam olarak 3 damlayı numune kuyucuğuna (S) damlatınız. Numuneyi damlattıktan 10 dakika sonra sonucu okuyunuz. Doğru sonuçların elde edilebilmesi için, bu zaman sınırlarına harfiyen uyulması gerekir. RU – – – SV Nazofarangeal sürüntü numuneleri ve pozitif kontrol prosedürü (bkz. hızlı kılavuz 1a’ ila 1b’) bioNexia® Influenza A + B 83 ÖN İŞLEMİN ARDINDAN NUMUNE STABİLİTESİ Dilüe edilmiş numune hemen kullanılabilir veya en fazla 8 saat süreyle 18 – 25°C ya da 2 – 8°C’de saklanabilir. SONUÇLAR VE DEĞERLENDİRME POZİTİF • • • İnfluenza A pozitif: Sonuç penceresinde birbirinden farklı iki çizgi görülür: FLU A bölgesinde kırmızı bir çizgi, kontrol çizgisi bölgesinde (C) ise yeşil bir çizgi görülür. İnfluenza B pozitif: Sonuç penceresinde birbirinden farklı iki çizgi görülür: FLU B bölgesinde mavi bir çizgi, kontrol çizgisi bölgesinde (C) ise yeşil bir çizgi görülür. İnfluenza A+B pozitif: Sonuç penceresinde birbirinden farklı üç çizgi görülür: FLU A bölgesinde kırmızı bir çizgi, FLU B bölgesinde mavi bir çizgi ve kontrol çizgisi bölgesinde (C) yeşil bir çizgi görülür. Test çizgisi bölgesindeki rengin yoğunluğu, numunede bulunan İnfluenza antijenlerinin konsantrasyonuna bağlı olarak değişebilir. Bununla birlikte, numunedeki İnfluenza antijenlerinin konsantrasyonu bu kalitatif test ile belirlenemez. Açık kırmızı/mavi çizgi pozitif olarak değerlendirilmelidir. NEGATİF Kontrol çizgisi bölgesinde (C) yeşil bir çizgi görülür. FLU A ve FLU B bölgelerinde herhangi bir çizgi görülmez. GEÇERSİZ Yeşil renkli kontrol çizgisi (C) görülmez. Bu durumda, test çizgisi (FLU A bölgesinde kırmızı çizgi ve/veya FLU B bölgesinde mavi çizgi) belirgin olsa bile sonuç geçersizdir. Kontrol çizgisi bölgesinde (C) yeşil çizgi bulunmaması, test migrasyonunun doğru yapılmadığını ve test sonucunun geçersiz olduğunu gösterir. Prosedürü gözden geçiriniz ve testi yeni bir test kaseti ile tekrarlayınız. Sorunun devam etmesi durumunda, test kitinin kullanımını hemen sonlandırınız ve yerel dağıtımcınız ile iletişim kurunuz. C FLU A C FLU A C FLU A FLU B FLU B FLU B 10. dakikada sonucu okuyun FLU A FLU A FLU B FLU A+B FLU B Pozitif + Influenza A+B C FLU A C FLU A C FLU A C FLU A FLU B FLU B FLU B FLU B Negatif Geçersiz x KALİTE KONTROL Kit içinde bir pozitif kontrol svabı bulunur. Pozitif kontrol İnfluenza A+B pozitif sonucu sağlamalıdır. Reaktif performansının değişmediğinden emin olmak için yeni kit açıldıktan hemen sonra bu kontrol yapılmalıdır. Kontrol sonuçları beklenen sonuçlardan farklı olduğunda sonuçlar onaylanamaz. Test dahili bir prosedürel kontrol içerir ve renkli çizgi (C) test migrasyonunun doğru yapıldığını gösterir. Kontrol çizgisi görülmez ise, test geçersizdir. Yerel uygulanabilir yönetmeliklere uygun olarak Kalite Kontrol çalışmasının yapılması kullanıcının sorumluluğundadır. YÖNTEM SINIRLAMALARI 1. bioNexia® Influenza A+B testi sadece numune içinde İnfluenza varlığını gösterir (kalitatif tespit) ve sadece nazofarangeal numunelerdeki (sürüntü, aspirat veya yıkama kaynaklı) İnfluenza tip A ve tip B antijenlerinin tespiti için kullanılmalıdır. İnfluenza antijen konsantrasyonunun artış hızı veya kantitatif değeri bu test ile belirlenemez. 84 410918 FR 2. Test sonucu negatif ise ve klinik semptomlar devam ediyor ise, diğer yöntemler kullanılarak ek testlerin yapılması önerilir. Negatif sonuç hiçbir zaman İnfluenza enfeksiyonu olasılığını tamamen ortadan kaldırmaz. 3. Bu test muhtemel İnfluenza enfeksiyonlarının tanısını sağlar. Tüm sonuçlar hekimin elindeki diğer klinik bilgiler ve laboratuvar bulguları ile birlikte değerlendirilmelidir. Analitik hassasiyet toplam 22 insan İnfluenza virüsü suşu kullanılarak belirlenmiştir: 14 İnfluenza A ve 8 İnfluenza B. TCID[50]/mL: %50 doku kültürü bulaşıcı dozu CEID[50]/mL: %50 tavuk embriyosu bulaşıcı dozu PL CS SV PT IT ES DE Viral suş RU Viral Alt tip ATCC Minimum Tip No. Tespit Seviyesi PR/8/34 A H1N1 VR-95 8,89 x 105 CEID[50]/mL Swine/Iowa/15/30 A H1N1 VR-333 8,89 x 106 CEID[50]/mL Victoria/3/75 A H3N2 VR-822 1,58 x 105 CEID[50]/mL Swine/1976/31 A H1N1 VR-99 8,89 x 105 CEID[50]/mL Weiss/43 A H1N1 VR-96 8,89 x 108 CEID[50]/mL New Jersey/8/76 A H1N1 VR-897 1,58 x 105 (Hsw N1) CEID[50]/mL NWS/33 A H1N1 VR-219 1,58 x 105 CEID[50]/mL Port A H3N2 VR-810 1,58 x 106 Chalmers/1/73 CEID[50]/mL California/07/09 A H1N1 5 x 104 TCID[50]/mL Paris/5509/09 A H1N1 5 x 104 TCID[50]/mL Niger/2090/06 A H5N1 5 x 105 TCID[50]/mL Vietnam/1203/04 A H5N1 106 TCID[50]/mL Solomon A H1N1 105 Islands/3/2006 TCID[50]/mL South A H1N1 105 Dakota/6/2007 TCID[50]/mL R22 Barbara B VR-788 8,89 x 103 CEID[50]/mL Maryland/1/59 B VR-296 8,89 x 102 CEID[50]/mL GL/1739/54 B VR-103 1,58 x 105 CEID[50]/mL Lee/40 B VR-101 8,89 x 103 CEID[50]/mL Hong Kong/5/72 B VR-823 8,89 x 103 CEID[50]/mL Russia/69 B VR-790 8,89 x 104 CEID[50]/mL Jiangsu/10/2003 B 105 TCID[50]/mL Brisbane/60/2008 B 105 TCID[50]/mL EN PERFORMANS Analitik Hassasiyet bioNexia® Influenza A + B 85 TR KLİNİK HASSASİYET VE ÖZGÜLLÜK Grip semptomları olan 72 hastadan alınan nazofarangeal sürüntü, aspirat veya yıkama numuneleri bioNexia® Influenza A+B testi ve RT-PCR tekniği ile test edilmiştir. bioNexia® Influenza A+B Testi (Tip A +B çizgisi) Toplam + - RT-PCR tekniği + Toplam 55 0 55 1 16 17 56 16 72 Hassasiyet: %98,2; Özgüllük: >%99; Ayrıca, klinik onaylı influenza-negatif numuneler üzerinde: – 77 hasta bioNexia® Influenza A+B Testi ile test edilmiştir: 77 numunenin 75’i A ve B çizgileri için negatif çıkmıştır. Özgüllük %97,4 olarak bulunmuştur. – 86 hasta bioNexia® Influenza A+B Testi ile test edilmiştir: 86 numunenin 85’i A çizgisi için negatif çıkmıştır. Özgüllük %98,8 olarak bulunmuştur. – 84 hasta bioNexia® Influenza A+B Testi ile test edilmiştir: 84 numunenin 83’ü B çizgisi için negatif çıkmıştır. Özgüllük %98,8 olarak bulunmuştur. Başka bir hızlı test ile uyuşma bioNexia® Influenza A+B testinin performansı, başka bir hızlı immünokromatografik test ile karşılaştırmalı olarak belirlenmiştir. İnfluenza semptomları gösteren 93 hastaya ait nazofarangeal numuneler (sürüntü, aspirat veya yıkama) her iki teknik ile test edilmiştir. İnfluenza tip A İmmünokromatografik testi + Toplam bioNexia® Influenza A+B + 4 4 8 Testi (Tip A çizgisi) 0 85 85 Toplam 4 89 93 Genel uyuşma %95,7 CI%95 [89,3 – 98,3] İnfluenza tip B İmmünokromatografik testi + Toplam bioNexia® Influenza A+B + 7 1 8 Testi (Tip B çizgisi) 2 83 85 Toplam 9 84 93 Genel uyuşma %96,8 CI%95 [90,8 – 98,9] İnfluenza tip A/B İmmünokromatografik testi + Toplam bioNexia® Influenza A+B + 11 5 16 Testi (Tip A/B çizgisi) 2 75 77 Toplam 13 80 93 Genel uyuşma %92,5 CI%95 [85,1 – 96,4] Kesinlik Testler bağımsız olarak üç farklı kullanıcı tarafından yapılmıştır; bunlardan ikisi deneyimli laboratuvar personeli ve biri de zaman zaman hızlı testleri değerlendiren bir kişi (doktor asistanı) idi. Orta pozitif ve yüksek pozitif kontrol numunesi elde etmek için ekstraksiyon tamponu içindeki pozitif kontrol ekstraktı dilüe edilerek pozitif numuneler hazırlanmıştır. Bir negatif numune (sadece tampon) ve pozitif numunelerin her biri üç lotta on kopya halinde test edilmiştir. Tüm testlerde, negatif numune negatif sonuçlar vermiş, pozitif numuneler de pozitif sonuçlar vermiştir. Tekrarlanabilirlik (parti içi, aynı gün) ve tekrar üretilebilirlik (lotlar arası, farklı operatörler) test edilen tüm numuneler için yeterlidir. 86 410918 bioNexia® Influenza A+B testinin çapraz reaktivitesini belirlemek için bir değerlendirme yapılmıştır. Nazofarangeal numunelerde zaman zaman bulunan aşağıdaki solunum patojenleri ile çapraz reaktivite gözlenmemiştir: • Respiratuvar Sinsitiyal Virüs • Adenovirüs FR Çapraz Reaktivite DE EN ATIK YÖNETİMİ Kullanılmış veya kullanılmamış reaktifler ve diğer kontamine olmuş tüm tek kullanımlık malzemeleri bulaştırıcı veya potansiyel bulaştırıcı ürünlere yönelik prosedürleri takip ederek atınız. Her laboratuvar, atıkların ve oluşan atık maddelerin yapılarına ve tehlikelilik derecelerine göre kullanılmasından ve uygulanabilir düzenlemelere göre işleme tabi tutulup atılmasından (ya da işleme tabi tutturulup attırılmasından) sorumludur. ES LİTERATÜR REFERANSLARI 1. ZAMBON M. “Epidemiology and pathogenesis of Influenza“. J. Antimicrob. Chemother. November 1999, Vol. N° 44, Suppl 2, p. 3-9. 2. BARENFANGER et al., “Clinical and Financial Benefits of Rapid Detection of Respiratory Viruses: an Outcomes Study”. Journal of Clinical Microbiology. August 2000, Vol 38 No 8, p. 2824-2828. SEMBOLLERİN ANLAMI Anlamı IT Sembol Ürün katalog numarası Vücut Dışı Tanı için Medikal Ürün PT Üretici Muhafaza edilmesi gereken ısı aralığı Son kullanma tarihi SV Üretim lot numarası Pozitif kontrol CS Paket zarar görmüş ise kullanmayınız Tıbbi Cihaz Yönetmeliği Kullanım talimatlarına başvurun PL Tekrar kullanmayınız Etilen Oksit ile sterilize edilmiştir Güneş ışığından uzak tutunuz RU Yeterli olduğu test miktarı CLSI, Clinical Laboratory and Standards Institute, Inc. firmasına ait olan ticari markadır. Diğer tüm ad ya da ticari markalar, ilgili sahiplerinin mülkiyetindedir. bioNexia® Influenza A + B 87 TR Kullanılan bioMérieux, mavi logo ve bioNexia, bioMérieux SA ya da temsilcilerinden birinin kullanımına ait olan, devam eden ve/veya tescilli ticari markasıdır. bioMérieux SA 69280 Marcy-l‘Etoile-France Tel: 33 (0)4 78 87 20 00 Faks: 33 (0)4 78 87 20 90 www.biomerieux.com/bionexia RCS LYON 673 620 399 16352 A - 2011/04 88 410918