1 Alcoholes y fenoles y éteres
Anuncio
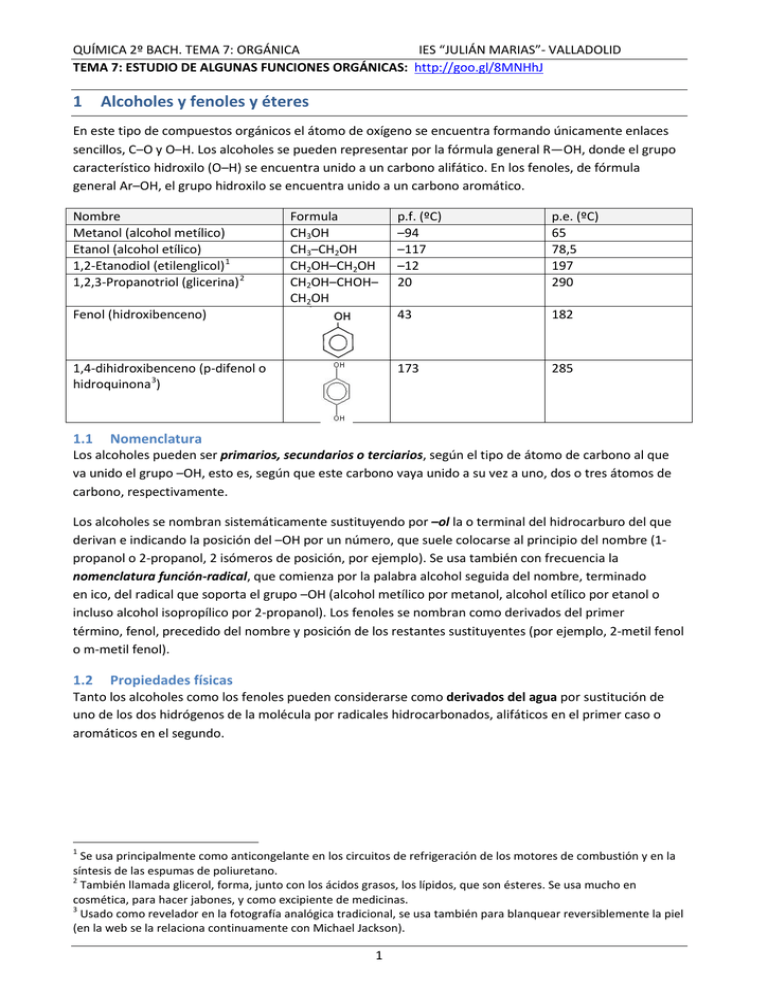
QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID TEMA 7: ESTUDIO DE ALGUNAS FUNCIONES ORGÁNICAS: http://goo.gl/8MNHhJ 1 Alcoholes y fenoles y éteres En este tipo de compuestos orgánicos el átomo de oxígeno se encuentra formando únicamente enlaces sencillos, C–O y O–H. Los alcoholes se pueden representar por la fórmula general R—OH, donde el grupo característico hidroxilo (O–H) se encuentra unido a un carbono alifático. En los fenoles, de fórmula general Ar–OH, el grupo hidroxilo se encuentra unido a un carbono aromático. Nombre Metanol (alcohol metílico) Etanol (alcohol etílico) 1,2-Etanodiol (etilenglicol) 1 1,2,3-Propanotriol (glicerina) 2 Fenol (hidroxibenceno) Formula CH3OH CH3–CH2OH CH2OH–CH2OH CH2OH–CHOH– CH2OH 1,4-dihidroxibenceno (p-difenol o hidroquinona 3) 1.1 p.f. (ºC) –94 –117 –12 20 p.e. (ºC) 65 78,5 197 290 43 182 173 285 Nomenclatura Los alcoholes pueden ser primarios, secundarios o terciarios, según el tipo de átomo de carbono al que va unido el grupo –OH, esto es, según que este carbono vaya unido a su vez a uno, dos o tres átomos de carbono, respectivamente. Los alcoholes se nombran sistemáticamente sustituyendo por –ol la o terminal del hidrocarburo del que derivan e indicando la posición del –OH por un número, que suele colocarse al principio del nombre (1propanol o 2-propanol, 2 isómeros de posición, por ejemplo). Se usa también con frecuencia la nomenclatura función-radical, que comienza por la palabra alcohol seguida del nombre, terminado en ico, del radical que soporta el grupo –OH (alcohol metílico por metanol, alcohol etílico por etanol o incluso alcohol isopropílico por 2-propanol). Los fenoles se nombran como derivados del primer término, fenol, precedido del nombre y posición de los restantes sustituyentes (por ejemplo, 2-metil fenol o m-metil fenol). 1.2 Propiedades físicas Tanto los alcoholes como los fenoles pueden considerarse como derivados del agua por sustitución de uno de los dos hidrógenos de la molécula por radicales hidrocarbonados, alifáticos en el primer caso o aromáticos en el segundo. 1 Se usa principalmente como anticongelante en los circuitos de refrigeración de los motores de combustión y en la síntesis de las espumas de poliuretano. 2 También llamada glicerol, forma, junto con los ácidos grasos, los lípidos, que son ésteres. Se usa mucho en cosmética, para hacer jabones, y como excipiente de medicinas. 3 Usado como revelador en la fotografía analógica tradicional, se usa también para blanquear reversiblemente la piel (en la web se la relaciona continuamente con Michael Jackson). 1 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID Este parentesco se pone de manifiesto en que tienen ciertas propiedades que recuerdan a las del agua. Así, por ejemplo: • • • 1.3 • • 1.4 En estado sólido y en estado líquido, las moléculas de los alcoholes y fenoles están muy asociadas mediante enlaces de hidrógeno, formando cadenas de varias moléculas, lo que explica sus puntos de fusión y de ebullición anormalmente elevados. Como ocurre, en general, en todas las series homólogas, los puntos de fusión y de ebullición de los alcoholes de cadena lineal aumentan con el número de átomos de carbono. Así, los alcoholes inferiores son líquidos incoloros, muy fluidos y relativamente volátiles; los de 6 a 11 átomos de carbono son ya líquidos viscosos; y el dodecanol, esto es, con 12 átomos de carbono (alcohol laurílico), es el primer alcohol de cadena lineal que es sólido a la temperatura ambiente. Los primeros términos de la serie de los alcoholes, de uno a tres átomos de carbono, son completamente miscibles con el agua, con la que forman enlaces por puente de hidrógeno, análogos a los que existen entre las propias moléculas de agua o de los alcoholes entre sí. Al aumentar el número de átomos de carbono de la cadena hidrocarbonada, se hace cada vez menor la influencia relativa del grupo hidroxilo, por lo que disminuye mucho su solubilidad en agua, siendo ya prácticamente insolubles los alcoholes con diez o más átomos de carbono. El fenol, C6H5OH, como representante de los fenoles, es un sólido cristalino de color blanco a temperatura ambiente, con p.f. de 40°C y una solubilidad en agua pequeña, de unos 9 g/100 mL de agua, a 20°C. Esa baja solubilidad se la debe a la cadena aromática. Propiedades químicas El hidrógeno del grupo –OH tiene cierto carácter ácido, al estar unido a un elemento muy electronegativo como es el O, pero su acidez en tan débil (su Ka≈10–18, menor que la del agua) que se consideran neutros. Sin embargo, los fenoles, con Ka≈10–10, son más ácidos que el agua y pueden catalogarse de ácidos muy débiles. La acidez de los alcoholes se demuestra por su reacción con metales muy activos, como el Na, para liberar hidrógeno gaseoso y formar alcóxidos, R–O–: R–OH + Na → R–O–Na+ +1/2 H2 Los alcoholes pueden actuar como bases de Lewis, debido al par de electrones sin compartir del oxígeno y de hecho dará reacciones típicas de una base frente a un ácido fuerte, salvo que en vez de producir una sal, compuesto típicamente iónico, dará lugar, con los ácidos hidrácidos, a un derivado halogenado. R–OH + HX → R-X+ H2O Métodos de obtención Los principales métodos de obtención de alcoholes son: a) Hidratación de alquenos (adición) Los alquenos adicionan agua. Se trata de una reacción de adición electrófila, que esquemáticamente puede representarse mediante la ecuación: 2 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID 𝐻2 𝑆𝑂4 R—CH=CH2 + H2O �⎯⎯⎯� R— CHOH—CH3 El grupo OH (parte negativa de la molécula de agua, que podemos representar como OH– H+) se adiciona al átomo de carbono más sustituido (con más enlaces carbono-carbono) del doble enlace y el hidrógeno al átomo de carbono que contiene más hidrógenos 4. Por ello, éste es un método muy apropiado para la obtención de alcoholes secundarios y terciarios, algunos de los cuales se preparan así industrialmente a partir de las fracciones de alquenos procedentes del craqueo del petróleo. Asimismo, éste es el método industrial más importante de fabricación de alcohol etílico, por hidratación del etileno, CH2=CH2 en presencia de ácido sulfúrico. Por cierto, esta reacción de adición a los alquenos también se produce con halógenos o con ácidos hidrácidos: C2H4(g) + HX(g) ⎯→ CH3⎯ CH2X(g) C2H4(g) + X2(g) ⎯→ CH2X⎯ CH2X(g) donde X representa un halógeno (Cl, Br o I).La adición de un halogenuro de hidrógeno a un alqueno no simétrico, como el propeno, sigue la misma regla vista antes y aunque teóricamente se puedan obtener 2 productos, el 1-bromopropano y el 2-bromopropano, solo se obtiene en la práctica el segundo, el 2-bromopropano, al ir el H al carbono con más hidrógenos. b) Hidrólisis de halogenuros de alquilo (sustitución) Los derivados halogenados de los hidrocarburos, también conocidos como halogenuros de alquilo, se obtienen al sustituir un H de un hidrocarburo por un halógeno. Se suelen obtener por halogenación directa de un alcano, en presencia de luz ultravioleta, o por adición de un ácido hidrácido de halógeno (HF, HCl, HBr, HI) a un alqueno, como hemos visto anteriormente. Estos compuestos son muy reactivos y sufren hidrólisis, que se lleva a cabo normalmente en una disolución básica en una reacción de sustitución nucleofílica. R–X+OH–→R–OH+X– H2C=CH2 (g) + HCl(g) → CH3⎯ CH2Cl(g) ; CH3⎯ CH2Cl(g) + NaOH( ac)→ CH3–CH2OH + NaCl Rara vez se usa para la síntesis de alcoholes, ya que los halogenuros de alquilo por lo normal se preparan a partir de alcoholes, por reacción de éstos con un ácido hidrácido de halógeno, como vimos ya en las propiedades químicas de los alcoholes. 4 Esta es la conocida como Regla de Markovnikov., Fue formulada por el químico ruso Vladimir Vasilevich Markovnikov en 1870. En una reacción química encontrada particularmente en química orgánica, la regla establece que, con la adición de un reactivo asimétrico del tipo H-X (o H–OH) a un alqueno o alquino, el átomo de hidrógeno se une al átomo de carbono del doble o triple enlace con el mayor número de átomos de hidrógeno, y el grupo X (halogenuro u OH) se une al átomo de carbono del doble o triple enlace con el menor número de átomos de hidrógeno. 3 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID c) Reducción de compuestos carbonílicos, aldehídos y cetonas. Esta reacción puede realizarse industrialmente con hidrógeno, en presencia de catalizadores, o bien en el laboratorio, mediante el hidruro de litio y aluminio (tetrahidruroaluminato de lítio), LiAlH4 Con aldehídos se obtienen alcoholes primarios y con cetonas alcoholes secundarios, según las siguientes ecuaciones: 𝐿𝑖𝐴𝑙𝐻4 Aldehídos. R–CHO �⎯⎯⎯� R-CH2OH , alcohol primario 𝐿𝑖𝐴𝑙𝐻4 Cetonas, R–CO–R’ �⎯⎯⎯� R–CHOH–R’ , alcohol secundario d) Hidrólisis de los ésteres Como veremos más adelante, los ésteres se forman por reacción entre un ácido carboxílico y un alcohol. Al calentar un éster en una disolución acuosa de ácido o base se produce la hidrólisis, la reacción inversa a la esterificación, la formación del éster. En la hidrólisis se forman el alcohol y el ácido que forman el éster, pudiendo estar el ácido en forma R-COOH (en medio ácido) o R–COO– (en medio básico). 𝐻2 𝑂, 𝑂𝐻 – , Δ R–COO–R’ �⎯⎯⎯⎯⎯⎯⎯⎯⎯� R–COO– + HO–R’ 𝐻2 𝑂, 𝐻 + , Δ R–COO–R’ �⎯⎯⎯⎯⎯⎯⎯⎯� R–COOH + HO–R’ (el ácido reconstituye el ácido a partir del R-COO–, base débil) e) Métodos especiales Los dos primeros miembros de la serie de alcoholes alifáticos, metanol y etanol, se obtienen también por métodos especiales que conviene mencionar. El metanol se obtenía antiguamente por destilación seca de la madera, de donde procede el nombre de alcohol de madera con que a veces se le conoce. Modernamente, casi todo el metanol que se consume en la industria se obtiene por hidrogenación catalítica del monóxido de carbono, según la reacción: que se lleva a cabo a unos 400 °C y 200 atm, en presencia de catalizadores formados corrientemente por una mezcla de óxidos de cromo y de cinc. El metanol es un líquido incoloro, que hierve a 65°C y se mezcla con agua en todas proporciones. Es tóxico; beber apenas 30 ml es mortal. Cantidades menores pueden producir ceguera. Se añade al alcohol etílico (desnaturalización) para producir alcoholes industriales que no puedan usarse para adulterar las bebidas. El etanol (alcohol del vino) se ha venido produciendo desde la antigüedad por fermentación de los azúcares (como glucosa), contenidos en jugos de frutos, para la fabricación de bebidas alcohólicas. La fermentación se produce por la acción de enzimas (o fermentos), que son 4 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID catalizadores orgánicos complejos segregados por las células de levaduras, obteniéndose, como productos finales, etanol y CO2, según la reacción global: C6H12O6 → 2CO2 + 2CH3—CH2OH glucosa etanol Además de la glucosa pueden también fermentar por la acción de levaduras otros azúcares más complejos y el almidón, contenido en la patata y cereales, que primero se desdoblan en azúcares simples, antes de la fermentación alcohólica propiamente dicha. Una concentración elevada de alcohol impide el proceso de fermentación, por lo que sólo pueden obtenerse concentraciones del 10 al 18 % en etanol, que son típicas de los vinos naturales. Por destilación fraccionada puede lograrse aumentar la riqueza en etanol hasta el 95 %, con 5% de agua, que es la composición que circula en el comercio y se vende en las farmacias como alcohol “puro”. El llamado alcohol absoluto, sin nada de agua, puede obtenerse destilando la mezcla anterior sobre una sustancia que reaccione químicamente con el agua, como el CaO. f) Obtención de fenoles El fenol, que es el más importante de todos por su empleo para la fabricación de plásticos (ver luego la baquelita), suele obtenerse también por síntesis, bien por fusión con NaOH del ácido bencenosulfónico C6H5SO3H, obtenido combinando el benceno con ácido sulfúrico concentrado, o por hidrólisis del clorobenceno, a temperatura y presión elevadas (350 °C y 200 atm). Modernamente se obtiene también por oxidación catalítica del isopropilbenceno (cumeno), proceso en donde, además del fenol, se produce acetona, que es también un producto muy cotizado industrialmente. 1.5 Reacciones de los alcoholes a) Formación de ésteres: Esterificación Los alcoholes reaccionan con los ácidos carboxílicos dando lugar a la formación de ésteres. También se forman ésteres cuando reacciona un alcohol con un ácido inorgánico. Por ejemplo los ésteres carbónicos derivan del ácido carbónico y los ésteres fosfóricos, de gran importancia en Bioquímica, derivan del ácido fosfórico. CH3OH + HNO3 → H2O + CH3NO3 metanol ácido nítrico nitrato de metilo CH3—CH2OH + H2SO4 → H2O + CH3—CH2SO4H etanol ácido sulfúrico sulfato ácido de etilo La formación de ésteres con ácidos inorgánicos es un proceso rápido y el equilibrio está muy desplazado hacia la formación de ésteres, a diferencia de la formación de ésteres de ácidos orgánicos, que no transcurre de modo completo sino que se alcanza una situación de equilibrio (lentamente en ausencia de catalizadores). CH3COOH + ácido acético HOCH2—CH3 → H2O + CH3—COOCH2—CH3 etanol acetato de etilo 5 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID Un éster inorgánico muy importante es el trinitrato de glicerina, llamado comúnmente nitroglicerina 5, y que se obtiene por cuidadosa reacción de una mezcla de ácidos nítrico y sulfúrico concentrados con propanotriol (glicerina). La nitroglicerina es un líquido aceitoso incoloro y extraordinariamente explosivo. Para poderla manejar con cierta seguridad se impregna con ella un polvo inerte (tierra de diatomeas), lo que constituye la dinamita, descubierta por el célebre químico sueco A. Nobel, creador, con los intereses de su fortuna, de los famosos premios Nobel. Otros dos ésteres especialmente importantes en la industria farmacológica son el ácido acetilsalicílico y la benzocaína. El ácido acetilsalicílico (tiene un grupo ácido y otro éster, ver final del tema para su síntesis) o aspirina, como es conocido comercialmente, es el más popular de los medicamentos sintéticos, debido a su acción analgésica, antipirética, anti-inflamatoria y antirreumática, y por ser utilizado en la prevención y tratamiento del infarto agudo al miocardio, además de su bajo coste. La benzocaína o p-aminobenzoato de etilo es un anestésico local, empleado como calmante del dolor, obtenido también por esterificación. b) Formación de éteres. Si tratamos un alcohol con un halogenuro de alquilo obtenemos un éter: CH3–CH2OH + CH3I → CH3–CH2–O–CH3 + HI c) Reacciones de sustitución: Reacción con los halogenuros de hidrógeno Los alcoholes reaccionan con los halogenuros de hidrógeno para dar lugar a la formación de halogenuros de alquilo, por ejemplo: 𝐶𝑙2 𝑍𝑛 CH3—CH2OH + HCl �⎯⎯� H2O + CH3—CH2Cl etanol cloruro de etilo Con un alcohol determinado el IH reacciona más rápidamente que el BrH y éste más que el ClH. Con un halogenuro de hidrógeno determinado, los alcoholes terciarios reaccionan más rápidamente que los secundarios y éstos más que los primarios. Así, la reacción entre el ClH y un alcohol primario conviene catalizarla con Cl2Zn a fin de que tenga lugar con velocidad apreciable. d) Reacciones de eliminación: Deshidratación A excepción del metanol, los alcoholes se deshidratan en caliente por la acción del ácido sulfúrico dando lugar a alquenos. Los alcoholes terciarios son los que se deshidratan con mayor facilidad, seguidos de los secundarios y los primarios por este orden: 5 Por cierto, la nitroglicerina se conoce en farmacología como trinitrato de glicerilo y se utiliza por su potente propiedad vasodilatadora en hipertensión. Es útil en situaciones agudas, como el tratamiento de una crisis de angina de pecho y se usa como la célebre pastilla sublingual o los parches dérmicos. 6 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA e) IES “JULIÁN MARIAS”- VALLADOLID Oxidación Cuando los alcoholes se calientan en el aire o en oxígeno, arden formando CO2 y H2O, siendo más fácil la combustión de los términos inferiores. Los calores de combustión de los alcoholes son bastante menores que los de los hidrocarburos correspondientes, lo que es lógico, puesto que los alcoholes se encuentran ya en un estado de oxidación superior al de los hidrocarburos. No obstante, se pueden emplear como combustibles, en particular los dos primeros términos (metanol y etanol), y a veces se añaden también como aditivos a los carburantes ordinarios. Aparte de la combustión, que supone la oxidación completa, se puede realizar una oxidación controlada, que suele llevarse a cabo en el laboratorio con dicromato o permanganato potásico en medio sulfúrico diluido. Así, los alcoholes primarios se transforman en aldehídos, aunque el proceso suele continuar hasta la formación de ácidos carboxílicos. Los alcoholes secundarios bajo la acción del mismo agente oxidante dan lugar a cetonas y la oxidación no prosigue. 2 Ácidos carboxílicos El grupo funcional de los ácidos orgánicos o carboxílicos se denomina carboxilo: 2.1 Nomenclatura. Los ácidos carboxílicos se nombran anteponiendo la palabra ácido al nombre del alcano correspondiente, al que se ha cambiado la terminación -o por -oico. La cadena principal se numera empezando por donde está el grupo funcional. Cuando en un compuesto existen 3 o más grupos carboxilo (si hubiese 2 forman la cadena principal y el ácido acaba en –dioico), los que pertenecen a las cadenas laterales se indican con el prefijo carboxi–, si a veces se trata en este caso a todos por igual, acabando en -carboxílico. Ácido 3-carboxi pentanodioico o ácido 1,2,3 propanotricarboxílico. Muchos de ellos reciben nombres especiales: 7 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID Nombre trivial Nombre IUPAC Estructura Carbonos p.f (°C) p.e. (°C) Ka Ácido fórmico Ácido metanoico HCOOH C1 8,4 101 1,8·10–4 Ácido acético Ácido etanoico CH3COOH C2 16,6 118 1,8·10–5 Ácido propiónico Ácido propanoico CH3CH2COOH C3 –22 141 1,3·10–5 Ácido butírico Ácido butanoico CH3(CH2)2COOH C4 –8 163 1,4·10–5 Ácido palmítico Ácido hexadecanoico CH3(CH2)14COOH C16 63 351 Ácido esteárico Ácido octadecanoico CH3(CH2)16COOH C18 69 361 Algunos ácidos orgánicos insaturados Nombre trivial Estructura química Ácido palmitoleico CH3(CH2)5CH=CH(CH2)7COOH Ácido oleico CH3(CH2)7CH=CH(CH2)7COOH Ácido linoleico CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH Ácido α-Linolénico CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)7COOH Compuestos con dos grupos COOH Formula Nombre IUPAC Nombre trivial HOOC-COOH Ac. Etanodioico Ácido oxálico HOOC-CH2-COOH Ac. Propanodioico Ácido malónico HOOC-(CH2)2-COOH Ac. Butanodioico Ácido succínico Otros: Nombre vulgar Ácido láctco Ácido cítrico Ácido pirúvico Ácido málico Ácido maleico Ácido tartárico 2.2 • Nombre IUPAC ácido 2-hidroxi-propanoico Ácido 2-hidroxi- 1,2,3-propanotricarboxílico Ácido oxopropanoico Ácido hidroxibutanodióico (o hidroxisuccínico) Ácido cis-butenodioico Ácido 2,3-dihidroxibutanodióico Propiedades físicas Presentan puentes de hidrógeno, como en los alcoholes. Esto da lugar a la formación de dímeros: 8 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID • Los ácidos carboxílicos en estado sólido y líquido están formados casi completamente por moléculas de dímeros de este tipo. Eso hace que los puntos de fusión y ebullición de los ácidos sean mayores que los de los alcoholes de igual peso molecular. • Como puede formar puentes de hidrógeno con las moléculas de agua son muy solubles en esta. Los primeros términos de la serie, hasta el butírico, son solubles en agua en todas proporciones, pero según va aumentando la cadena hidrocarbonada disminuye la solubilidad, siendo el de 5 carbonos parcialmente soluble e insolubles los de 6 en adelante. • Los puntos de fusión y ebullición aumentan, como siempre, con la masa molecular, haciendo que los ácidos caboxílicos que tienen más de ocho átomos de carbono sena por lo general sólidos, a menos que contengan dobles enlaces. Los puntos de fusión son también elevados, debido a que el enlace de hidrógeno persiste en el estado sólido. 2.3 Propiedades químicas Su propiedad más importante es su carácter ácido, debido a que el grupo CO atrae fuertemente a los electrones del enlace O—H, con lo cual aumenta la polaridad de este grupo. Al ser tan polar el enlace O– H, el protón H+ se desprende fácilmente. Por ejemplo, el anión procedente del ácido acético se llama ion acetato. Al grupo R–COO– se le denomina carboxilato. -5 Los ácidos orgánicos de la serie normal son débiles, siendo su constante de acidez del orden de 10 . Aunque mucho más débiles que los ácidos minerales fuertes (H2SO4, HCl, HNO3) los ácidos carboxílicos son mucho más ácidos que el agua, por lo que los hidróxidos acuosos los convierten en sus sales con facilidad, y los ácidos minerales acuosos reconvierten las sales en los ácidos carboxílicos correspondientes. Los ácidos carboxílicos son abundantes en la naturaleza. Así, el ácido metanoico (ácido fórmico) no sólo se encuentra en las hormigas, donde actúa como feromona de alarma, sino también en las plantas. Así, las ortigas son irritantes debido a que cuando se tocan inyectan ácido fórmico. El ácido etanoico (ácido acético) se forma en la naturaleza por oxidación enzimática (bacterias Acetobacter) del etanol producido por fermentación. Las fuentes de ácidos carboxílicos alifáticos más importantes son las grasas animales y vegetales, que son ésteres de ácidos carboxílicos de cadena larga, de las que se pueden obtener ácidos carboxílicos de cadena recta con un número par de carbonos, debido a que derivan biológicamente del ácido etanoico, con una pureza superior al 90 %. 2.4 Métodos de obtención Se puede hablar de 2 métodos principales: a) Hidrólisis de derivados de ácidos Aunque algunos están libres en la naturaleza, la mayoría forma ésteres. Muchas frutas y flores contienen ésteres de bajo peso molecular, a los que deben sus olores. Los ésteres de ácidos alifáticos lineales de cadena larga constituyen las ceras, aceites y grasas, de donde procede el nombre de ácidos grasos con el que a veces se denomina a los ácidos alifáticos. Las grasas y aceites naturales son mezclas de ésteres de los ácidos grasos con la glicerina (propanotriol), pudiendo encontrarse la glicerina esterificada por un solo ácido, por dos o por tres. 9 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID Cuando un aceite o grasa se calienta, con una disolución acuosa básica (de NaOH, KOH o Na2CO3) el grupo éster sufre una reacción de hidrólisis, que en este caso se suele llamar saponificación, por obtenerse las sales alcalinas de los ácidos grasos, que constituyen los jabones, junto con la glicerina. Si lo que queremos es obtener los ácidos en lugar de sus sales alcalinas trataremos el jabón con un ácido mineral fuerte, que hará que la base conjugada del ácido orgánico se comporte como base y regenere el ácido carboxílico. Las principales hidrólisis, para resumir, son: • • • • b) Sal de un ácido (jabón) con un ácido. Al ser la sal de un ácido su base conjugada, en presencia de un ácido, se restituye el ácido. 𝐻+ R–COO–Na+ �� R–COOH Hidrólisis de ésteres, que se produce especialmente en medio básico, regenerando el ácido y el alcohol de procedencia: 𝑂𝐻 – R–COO–R’�⎯�R–COOH + R’OH Hidrólisis de halogenuros de acilo (sustitución), que se pueden obtener con un ácido carboxílico y PCl5 (para los cloruros de acilo) y que regeneran el ácido al añadirlos agua, bien en medio ácido o básico: 𝑂𝐻 – /𝐻 + R-CO-Cl�⎯⎯⎯⎯�R–COOH + HCl Hidrólisis de nitrilos: Los halogenuros de alquilo primarios y secundarios reaccionan con cianuro de sodio para formar nitrilos. La hidrólisis posterior del nitrilo produce ácidos carboxílicos. Deben emplearse derivados halogenados con un carbono menos que el ácido que se desea obtener. Oxidación Como hemos visto antes, los alcoholes primarios se pueden oxidar en dos etapas; en la primera se forma un aldehído que sufre con facilidad una oxidación posterior para dar lugar al ácido carboxílico correspondiente, según la reacción esquemática: La oxidación en el laboratorio se realiza con oxidantes fuertes, como el KMnO4, Na2Cr2O7 (en medio ácido) HNO3, etc, mientras que en la industria se hace con oxígeno en presencia de catalizadores metálicos. Esta es la principal manera de obtener ácido acético industrialmente: 10 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID También pueden oxidarse las cadenas laterales de los hidrocarburos aromáticos con oxidantes fuertes, como el KMnO4 o K2Cr2O7 en ácido sulfúrico caliente: También pueden ser oxidados los alquenos o las metil-cetonas (Reacción de haloformo): R CH CH R´ KMnO4 calor R O C R 2.5 a) COOH + R´ COOH O CH3 1) X2/NaOH 2) H + C R + COOH CHX3 haloformo Reacciones Reacciones ácido-base Los ácidos carboxílicos, al igual que los ácidos inorgánicos, reaccionan con metales desprendiendo hidrógeno y con bases inorgánicas produciendo sales. R—COOH + Na → R—COONa + 1/2 H2 Ácido Sal R—COOH + KOH → R—COOK + H2O Ácido Sal b) Reacciones de esterificación. Ésteres Los ácidos reaccionan con los alcoholes formando ésteres (R—COO—R') y agua. La reacción similar a la de la neutralización (en química inorgánica), se denomina esterificación: 2 R—OH + HO—SO3H Alcohol Ácido inorgánico (ácido sulfúrico) R'—OH + Alcohol → R—O—SO2—O—R + 2 H2O Éster inorgánico R—COOH → Ácido inorgánico R—CO—O—R' + H2O Éster carboxílico Ésta es la reacción de sustitución más importante del grupo —OH de los ácidos orgánicos. 𝐸𝑠𝑡𝑒𝑟𝑖𝑓𝑖𝑐𝑎𝑐𝑖ó𝑛 R—COOH + HO—R' ����������� R—COO—R' + H2O 𝐻𝑖𝑑𝑟ó𝑙𝑖𝑠𝑖𝑠 Ácido + alcohol Éster + agua 11 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID Por ejemplo en la reacción entre el ácido esteárico y la glicerina se obtiene estearato de glicerina (estearina, grasa). De forma análoga, el ácido palmítico (C15H31—COOH) da palmitina, y el ácido oleico, (C17H33—COOH) da la oleína. Si se esterifica un diácido con un dialcohol se puede obtener un poliéster. Los poliésteres tienen un gran campo de aplicación en la síntesis de polímeros de interés industrial, como veremos luego. c) Formación de amidas: Cuando se combinan con el NH3 o con una amina se produce la amida correspondiente, con eliminación de H2O R–COOH+R’–NH2→R–CO–NH-R’+H2O R–COOH+NH3→R–CO–NH2+H2O 3 3.1 Ésteres Nomenclatura de los ésteres Por su analogía con las sales, los ésteres se nombran cambiando la terminación -ico del ácido por -ato y poniendo a continuación el nombre del radical acabado en ilo y precedido de la preposición de. Ejemplos: ClO3C2H5 Clorato de etilo CH3—COOCH3 Etanoato de metilo (Acetato de metilo) CH3—COO—C2H5 Etanoato de etilo (Acetato de etilo) Algunas esencias naturales deben su aroma a la presencia de distintos ésteres: Esencias Ésteres responsables del aroma Albaricoque Coñac y vino Frambuesa Jazmín Manzana Melocotón Naranja Pera Piña Plátano Ron Rosas Uvas Butiratos de etilo y amilo. Heptanoato de etilo. Formiato y acetato de isobutilo. Acetato de bencilo. Isovalerianato de isoamilo y butirato y propionato de etilo. Formiato, butirato e isovalerianato de etilo. Acetato de octilo. Acetato de isoamilo. Butiratos de metilo, etilo, butilo e isoamilo Acetatos de amilo, e isoamilo e isovalerianato de isoamilo. Formiato de etilo Butirato y nonanoato de etilo y undecilato de amilo. Formiato y heptanoato de etilo. Notas: Amilo = pentilo. Isoamilo = isopentilo. El ácido isovaleriánico es (CH3)2CHCH2COOH. El ácido undecílico es CH3(CH2)9COOH. Los métodos de obtención y sus reacciones más importantes se han visto antes, al tratar de los ácidos. 12 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA 4 IES “JULIÁN MARIAS”- VALLADOLID Síntesis de la aspirina El ácido acetilsalicílico o AAS (C9H8O4) (conocido popularmente como aspirina), es un fármaco de la familia de los salicilatos, usado frecuentemente como antiinflamatorio, analgésico (para el alivio del dolor leve y moderado), antipirético (para reducir la fiebre) y antiagregante plaquetario (indicado para personas con riesgo de formación de trombos sanguíneos). Los efectos adversos de la aspirina son principalmente gastrointestinales, es decir, úlcera pépticas gástricas y sangrado estomacal, ya que es un ácido moderado (El ácido salicílico o salicilato, producto metabólico de la aspirina, es un ácido orgánico simple con un pKa de 3,0, o sea, Ka=10–3. La aspirina, por su parte, tiene un pKa de 3,5 a 25 °C) El propio ácido salicílico 6 (o ácido 2-hidroxibenzoico), que recibe su nombre de Salix, la denominación latina del sauce de cuya corteza fue aislado por primera vez, es un analgésico. Inicialmente, el fármaco se administró en forma de sal sódica. Sin embargo, el uso del salicilato sódico producía molestos efectos secundarios, y pronto se buscó una modificación del fármaco que retuviese las terapéuticas de este compuesto, sin presentar los efectos secundarios indeseables. Por tratamiento del ácido salicílico con anhídrido acético se obtiene el ácido acetilsalicílico, un compuesto tan eficaz como el salicilato sódico, pero de reducidos efectos secundarios. El mismo tipo de estrategia se empleó más tarde para la modificación de otro potente analgésico, la morfina. En este caso el problema consistía en su capacidad de crear adicción y, con la idea de solventarlo, se acetiló la morfina, obteniéndose la diacetilmorfina o heroína. No hay que decir que, en este caso, la estrategia no tuvo el mismo éxito que con el ácido salicílico. El ácido acetilsalicílico es un éster de ácido acético y ácido salicílico (este último actúa como "alcohol"). Aunque se pueden obtener ésteres de ácido por interacción directa del ácido acético con un alcohol o un fenol, se suele usar un sustituto del ácido acético, anhídrido acético, como agente acetilante. Éste permite producir ésteres de acetato con velocidad mucho mayor, que por la acción directa del ácido acético. La reacción de esterificación que tiene lugar se indica a continuación: 6 Industrialmente se obtiene hoy día a partir de dióxido de carbono y fenolato de sodio- la sal de sodio del fenol- por sustitución electrofílica y posterior liberación del ácido de su sal mediante adición de un ácido fuerte. Es la conocida síntesis de Kolbe-Schmitt. El fenol puede prepararse a partir de diversos compuestos aromáticos (como el benceno, el clorobenceno o el isopropilbenceno) procedentes del petróleo. De este modo, el precio del petróleo puede determinar, en última instancia, el coste y disponibilidad de fármacos como la aspirina. 13 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID La preparación de la aspirina en el laboratorio de química es una práctica habitual en las facultades de química. He aquí un extracto de la práctica (extraída de http://goo.gl/UeEOG6) : En un erlenmeyer de 100 ml se coloca aproximadamente 1 g de ácido salicílico (tomar nota de la cantidad pesada) y con precaución se añaden 3 ml de anhídrido acético y unas gotas de ácido fosfórico al 85%. Se agita suavemente el matráz para homogeneizar la mezcla y se sumerge en un vaso de precipitado de 500 ml lleno de agua caliente durante 10 minutos. A continuación, se añade con lentitud y gota a gota 1 ml de agua a fin de descomponer el exceso de anhídrido acético (Nota: el anhídrido acético reacciona violentamente con el agua y la mezcla puede salpicar). Se añaden ahora 10 ml de agua, se calienta hasta que la solución se aclare y se deja enfriar. Cuando se inicie el enturbiamiento, se rasca la pared del vaso con una varilla de vidrio hasta que cristalice la aspirina. Se deja enfriar, se filtra a gravedad con un embudo cónico con papel de filtro, lavando los cristales con dos porciones de 3 ml de agua fría. El ácido acetilsalicílico puede purificarse por recristalización en una mezcla de disolventes. Para ello se coloca la aspirina obtenida en un vaso de precipitado de 100 ml y se le añaden de 8 a 10 ml de etanol. Se calienta al baño María, hasta que los cristales se disuelvan. A continuación, se añaden lentamente 15 ml de agua destilada y se continúa la calefacción hasta que la disolución entre en ebullición. Seguidamente se separa el vaso de precipitado de la llama y se deja enfriar. Cuando se inicie el enturbiamiento, se rasca la pared del vaso con una varilla de vidrio, hasta que recristalice la aspirina. A continuación, se filtra a vacío, lavando los cristales con dos porciones de 3 ml de agua fría y se secan, comprimiéndolos sobre papel de filtro. Una vez secos se pesan para saber la cantidad de producto obtenido tras la recristalización. 5 Polímeros o macromoléculas. tipos. Son moléculas muy grandes, con una masa molecular que puede alcanzar millones de unidades de masa atómica (u o uma) , que se obtienen por la repeticiones de una o más unidades simples llamadas “monómeros” unidas entre sí mediante enlaces covalentes. Forman largas cadenas que se unen entre sí por fuerzas de Van der Waals, puentes de hidrógeno o interacciones hidrofóbicas. Se pueden clasificar según diversos criterios: • • • • Según su origen: o Naturales: Caucho, polisacáridos (celulosa, almidón), proteínas, ácidos nucléicos… o Artificiales: Plásticos, fibras textiles sintéticas, poliuretano, baquelita… Según su composición: o Homopolímeros: Un sólo monómero o Copolímeros: Dos o más monómeros Según su estructura: o Lineales: Los monómeros se unen por dos sitios (cabeza y cola) o Ramificados: Si algún monómero se puede unir por tres o más sitios. Por su comportamiento ante el calor: o Termoplásticos: Se reblandecen al calentar y recuperan sus propiedades al enfriar. Se moldean en caliente de forma repetida. o Termoestables: Una vez moldeados en caliente, quedan rígidos al ser enfriados por formar nuevos enlaces y no pueden volver a ser moldeados. 14 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA 5.1 IES “JULIÁN MARIAS”- VALLADOLID Tipos de polimerización. Existen dos tipos fundamentales de polimerización: • • Adición. Condensación. a) Polimerización por Adición. La masa molecular del polímero es un múltiplo exacto de la masa molecular del monómero, pues al formarse la cadena los monómeros se unen sin perder ningún átomo. Suelen seguir un mecanismo en tres fases, con ruptura hemolítica: • • • Iniciación: CH2=CHCl + catalizador ⇒ ·CH2–CHCl· Propagación o crecimiento: 2 ·CH2–CHCl· ⇒ ·CH2–CHCl–CH2–CHCl· Terminación: Los radicales libres de los extremos se unen a impurezas o bien se unen dos cadenas con un terminal neutralizado. En el cuadro siguiente vemos algunos de los polímeros de adición más importantes, sus principales aplicaciones, así como los monómeros de los que proceden. Nótese que los polímeros basan su nomenclatura en el nombre comercial de los monómeros. MONÓMERO CH2=CH2 Eteno (etileno) CH2=CH–CH3 Propeno (propileno) CH2=CHCl Cloroeteno (cloruro de vinilo o cloruro de etileno) CH2=CH fenileteno (estireno) CF2=CF2 tetraflúoreteno CH2=CCl–CH=CH2 2-clorobutadieno CH2=CH–CN propenonitrilo (acrilonitrilo) CH3 | CH2=C–COOCH3 metil-propenoato de metilo (metacrilato de metilo) POLÍMERO –CH2–CH2–CH2–CH2– polietileno –CH2–CH–CH2–CH– | | CH3 CH3 polipropileno –CH2–CHCl–CH2–CHCl– Policloruro de vinilo (PVC) USOS PRINCIPALES Bolsas, botellas, juguetes... –CH2–CH–CH2–CH– Juguetes, embalajes, aislante térmico y acústico. poliestireno –CF2–CF2–CF2–CF2– PTFE (teflón) –CH2–CCl=CH–CH2– cloropreno o neopreno –CH2–CH–CH2–CH– | | CN CN poliacrilonitrilo CH3 CH3 | | –CH2–C—CH2—C— | | COOCH3 COOCH3 PMM (plexiglás) 15 Películas, útiles de cocina, Ventanas, sillas, aislantes. Antiadherente, aislante... Aislante térmico, neumáticos Tapicerías, alfombras, tejidos Muebles, lentes y equipos ópticos QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID b) Polimerización por Condensación. En cada unión de dos monómeros se pierde una molécula pequeña, por ejemplo agua. Por tanto, la masa molecular del polímero no es un múltiplo exacto de la masa molecular del monómero. Los principales polímeros de condensación son: • • Homopolímeros: o Polietilenglicol o Siliconas Copolímeros: o Baquelitas. o Poliésteres. o Poliamidas. Polietilenglicol: El polietilenglicol (PEG) es un poliéter ampliamente empleado en la industria. Su nombre generalmente aparece asociado a un número que hace referencia a la masa molecular del polímero u oligómero; por ejemplo, un PEG con n=80 poseerá una masa molecular media de unos 3500 u, por lo que se llamará PEG 3500. Su estructura química puede representarse como HO-(CH2-CH2-O-)n-H. Suele producirse por la pérdida de una molécula de agua entre 2 grupos (OH) formándose puentes de oxígeno: CH2OH–CH2OH etanodiol (etilenglicol) → CH2OH–CH2–O–CH2–CH2OH + H2O → ...–O–CH2–CH2–O–CH2–CH2–O... (polietilenglicol) La reacción está catalizada por compuestos de magnesio, aluminio o calcio. Para preparar polietilenglicol de bajo peso molecular se usan catalizadores alcalinos como NaOH O Na2CO3. Siliconas: Las siliconas son polímeros inorgánicos, es decir, no contienen átomos de carbono en su cadena principal. Esta es una cadena alternada de átomos de silicio y de oxígeno. Cada silicona tiene dos grupos unidos a la misma y éstos pueden ser grupos orgánicos. Esquemáticamente: La figura de la parte inferior muestra grupos metilo unidos a los átomos de silicio. Este polímero se llama polidimetilsiloxano (PDMS) y es la silicona más común. Es transparente, generalmente inerte, inocuo y no inflamable. Sus aplicaciones varían desde lentes de contacto y artilugios médicos hasta elastómeros. También lo podemos encontrar en champús, como aditivo en alimentos (como antiespumante), lubricantes y recubrimientos resistentes al calor. Lo último son los moldes para el horno. 16 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA IES “JULIÁN MARIAS”- VALLADOLID Las siliconas son polímeros de fórmula general (R2SiO)n. en donde R es un radical orgánico. Se pueden formar polímeros con cadenas entrecruzadas como polímeros cíclicos. Proceden de monómeros del tipo R2Si(OH)2 Estos compuestos poseen unas propiedades muy útiles. La presencia de los grupos hidrocarbonados en las siliconas hacen que sea una sustancia hidrófuga, siendo muy utilizadas en tejidos impermeables para evitar la humedad. Su elevada resistencia al calor permite emplearlas como sustituyentes del caucho y de los lubricantes cuando éstos pierden sus propiedades a causa de la temperatura. Se cuenta que en el frío invierno del 1942, los norteamericanos facilitaron lubricantes a base de siliconas para que los carros de combate de sus aliados soviéticos pudieran emprender una ofensiva contra las tropas alemanas. Son también muy buenos aislantes eléctricos. En la construcción permiten aislar y restaurar edificios y monumentos. Las metilsiliconas se emplean en cirugía ya que son biológicamente inertes y, además, no provocan la coagulación de la sangre ni se adhieren sobre los tejidos corporales. El primer implante de silicona se hizo en 1955, colocando un by-pass en un niño. En 1961 se empezó a estudiar su uso en implantes de mama. Se usan también en cosmética (cremas antisolares y de afeitar, dentífricos, lacas, etc.) y en imprenta (soporte etiquetas adhesivas) Baquelita: La baquelita fue la primera sustancia plástica totalmente sintética, creada en 1907 y nombrada así en honor a su creador, el belga Leo Baekeland (Premio Nobel en Química). Este producto puede moldearse a medida que se forma y endurece al solidificarse. El alto grado de entrecruzamiento de la estructura molecular de la baquelita le confiere la propiedad de ser un plástico termoestable: una vez que se enfría no puede volver a ablandarse. Esto lo diferencia de los polímeros termoplásticos, que pueden fundirse y moldearse varias veces, debido a que las cadenas pueden ser lineales o ramificadas pero no presentan entrecruzamiento. Se obtiene por copolimerización entre el fenol y el metanal (formaldehído). Se forman cadenas que se unen entre sí debido al grupo hidroximetil en posición “para”. Se utiliza como cubierta en diferentes electrodomésticos, como televisores... OH OH H2 C OH H2 C OH CH2 H2 C OH OH + + HCHO H CH2 CH2 CH2 OH OH CH2OH + CH2 OH CH2OH 17 C H2 CH2 OH QUÍMICA 2º BACH. TEMA 7: ORGÁNICA Poliésteres: IES “JULIÁN MARIAS”- VALLADOLID Se producen por sucesivas reacciones de esterificación (alcohol y ácido). El tereftalato de polietileno, politereftalato de etileno, polietilentereftalato o polietileno tereftalato (más conocido por sus siglas en inglés PET, polyethylene terephtalate) es un tipo de plástico muy usado en envases de bebidas y textiles. Es el poliéster formado por la polimerización por condensación (pérdida de H2O) entre el ácido tereftálico (ácido p-benceno-dicarboxilico) y el etilenglicol (etanodiol) Fue producido por primera vez en 1941 por los científicos británicos Whinfield y Dickson, quienes lo patentaron como polímero para la fabricación de fibras. Se debe recordar que su país estaba en plena guerra y existía una apremiante necesidad de buscar sustitutos para el algodón proveniente de Egipto. A partir de 1946 se empezó a utilizar industrialmente como fibra textil (denominada “tergal”) y su uso ha proseguido hasta el presente. En 1952 se comenzó a emplear en forma de filme para envasar alimentos. Pero la aplicación que le significó su principal mercado fue en envases rígidos, a partir de 1976. Pudo abrirse camino gracias a su particular aptitud para la fabricación de botellas. Al ser un termoplástico puede calentarse e inyectarse en moldes o “inflarse” para producir las botellas partiendo de las denominadas “preformas”. Se puede ver un vídeo ilustrativo en http://goo.gl/vhQw6J. Poliamidas: Se producen por sucesivas reacciones entre el grupo ácido y el amino con formación de amidas. La cantidad de átomos de carbono en las cadenas de la amina y del ácido se puede indicar detrás de las iniciales de poliamida (PA). La poliamida más conocida es el nailon o nilón (grafia en español del nombre comercial nylon) o PA6.6 formado por la copolimerización del ácido adípico (ácido hexanodioico) y la 1,6hexanodiamina: HOOC–(CH2)4–COOH + H2N–(CH2)6–NH2 → –[OC–(CH2)4–CO–NH–(CH2)6 –NH]n– + H2O El nailon es una fibra textil elástica y resistente, no la ataca la polilla, no precisa planchado y se utiliza en la confección de medias, tejidos y telas de punto, también cerdas y sedales. El nailon moldeado se utiliza como material duro en la fabricación de diversos utensilios, como mangos de cepillos, peines, cuerdas, paracaídas, etc. Otra poliamida muy utilizada hoy día es el kevlar, material con el que se diseñan los chalecos antibalas. Para fabricarlo se realiza una polimerización por pasos a partir de la p-fenilendiamina y el dicloruro del ácido tereftálico o cloruro de tereftaloílo. 18 QUÍMICA 2º BACH. TEMA 7: ORGÁNICA 6 1. 2. 3. 4. 5. 7. ORGÁNICA: (50-J09) Nombre los compuestos orgánicos y los grupos funcionales que contienen. Señale el tipo de hibridación que presentan los átomos de carbono. a. CH3 – CH2 – CONH2 (0,5 puntos) b. CH3 – CHOH – CH2 – CH3 (0,5 puntos) c. CH3 – CH2 – NH – CH3 (0,5 puntos) d. CH3 – CH2 – COOCH3 (0,5 puntos) (94-SE10) Responda a las cuestiones siguientes: a. Escriba las fórmulas de los siguientes compuestos orgánicos: dimetiléter; ciclohexanol; acetato de metilo; propilamina. (1,0 puntos). b. Explique por qué la molécula de eteno, C2H4, es plana con ángulos de enlace de, aproximadamente, 120 grados, mientras que la molécula de acetileno, C2H2, es lineal. ¿En cuál de las dos moléculas anteriores la distancia entre los átomos de carbono debe ser menor? (1,0 puntos). (108-J11) Nombre los siguientes compuestos: a) CH2=CH-CH3 ; CH2OH-CH2-CH2-CH2OH ; CH3 -O- C6H5 ; CH3 –CO-CH3 ; CH3-CH2-COOCH3. (1,0 puntos) b) Formule los siguientes compuestos: 2-metilheptano; 1,3-butadieno ; fenol; ácido propanoico; etilamina. (1,0 puntos) (135-S12) Responda las siguientes cuestiones: a) Nombre los siguientes compuestos: (1,0 puntos) CH3– CH2 – CH = CH – C ≡ C – CH = CH – CH3 CH3– CH2 – CH2 – CH2 – CHO CH3 – CH2 – CO – CH2 – CH2 – CH3 CH3 – COOH b) Formule los siguientes compuestos: (1,0 puntos) Butil metil amina Etil propil éter 2-buteno 4-metil-1-hexanol (155-S13) a. Nombre los siguientes compuestos: CH3-COOH; CH3-COO-CH2-CH3; NH2-CH2-CH2-CH3; CH3-CH=CH-CH3; CH3-CH2-CHO (1,0 puntos) b. Formule los siguientes compuestos: Fenilamina; Ácido metanoico; 1-Butanol; Butanal; Propino (1,0 puntos) 7 6. IES “JULIÁN MARIAS”- VALLADOLID Reacciones: (15-S07) Escriba la reacción química que tiene lugar, formulando todos los compuestos que intervienen cuando: a) El etino reacciona con una molécula de cloro. (0,6 puntos) b) El propeno reacciona con una molécula de bromuro de hidrógeno. (0,7 puntos) c) El 2-buteno reacciona con una molécula de cloruro de hidrógeno. (0,7 puntos) S: adición al doble enlace. Regla de Markonikov en el b) (30-J08) Escriba las siguientes reacciones orgánicas, nombrando los productos que se obtienen en cada una de ellas e indicando a qué tipo de reacciones pertenece: a) Ácido propanoico con 2-butanol. (1,0 puntos) b) 2-Buteno con hidrógeno en presencia de platino como catalizador. (1,0 puntos) S: a) Esterificación y b) adición 19






