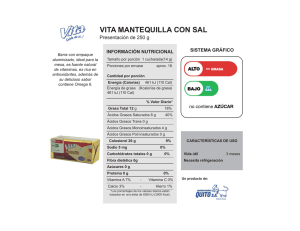
determinación del efecto producido por diferentes tipos de aceites
Anuncio

DETERMINACIÓN DEL EFECTO PRODUCIDO POR DIFERENTES TIPOS DE ACEITES VEGETALES Y COMBINACIONES EN LA BIOSÍNTESIS Y COMPOSICIÓN DEL POLIHIDROXIALCANOATO PRODUCIDO POR Pseudomonas putida IPT 046 Y Pseudomonas aeruginosa IPT 171 IVÁN ALEJANDRO AVILA LEÓN PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGÍA INDUSTRIAL São Paulo, SP, Brasil Enero 2007 DETERMINACIÓN DEL EFECTO PRODUCIDO POR DIFERENTES TIPOS DE ACEITES VEGETALES Y COMBINACIONES EN LA BIOSÍNTESIS Y COMPOSICIÓN DEL POLIHIDROXIALCANOATO PRODUCIDO POR Pseudomonas putida IPT 046 Y Pseudomonas aeruginosa IPT 171 IVÁN ALEJANDRO AVILA LEÓN TRABAJO DE GRADO Presentado como requisito parcial para optar al título de MICROBIOLOGO INDUSTRIAL PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS CARRERA DE MICROBIOLOGÍA INDUSTRIAL São Paulo, SP, Brasil Enero 2007 NOTA DE ADVERTENCIA “La Universidad no se hace responsable por los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al dogma y a la moral católica y por que las tesis no contengan ataques personales contra persona alguna, antes bien se vea en ellas el anhelo de buscar la verdad y la justicia”. Artículo 23 de la Resolución N° 13 de Julio de 1946 DETERMINACIÓN DEL EFECTO PRODUCIDO POR DIFERENTES TIPOS DE ACEITES VEGETALES Y COMBINACIONES EN LA BIOSÍNTESIS Y COMPOSICIÓN DEL POLIHIDROXIALCANOATO PRODUCIDO POR Pseudomonas putida IPT 046 Y Pseudomonas aeruginosa IPT 171 IVÁN ALEJANDRO AVILA LEÓN Dr. JOSE GREGORIO CABRERA GOMEZ Biólogo, Ph.D. Director Dra. LUIZIANA FERREIRA DA SILVA Bióloga, Ph.D Jurado SONIA REGINA SILVA QUEIROZ Ing. Química M.Sc Jurado DETERMINACIÓN DEL EFECTO PRODUCIDO POR DIFERENTES TIPOS DE ACEITES VEGETALES Y COMBINACIONES EN LA BIOSÍNTESIS Y COMPOSICIÓN DEL POLIHIDROXIALCANOATO PRODUCIDO POR Pseudomonas putida IPT 046 Y Pseudomonas aeruginosa IPT 171 IVÁN ALEJANDRO AVILA LEÓN Dra. ANGELA UMAÑA MUÑOZ Ph.D Decana Académica Facultad de Ciências Dr. LUIS DAVID GOMEZ M.Sc Director de la Carrera Microbiologia Industrial A Ana, el ángel guardián que me ha cuidado y amado toda la vida; A Samuel, por ser el soporte y apoyo a todas mis metas; A mis 3 padres que siempre me han dado consejos y fuerzas Y a todos los miembros de mi familia que se han preocupado siempre por mí. Christian y Rafael, jamás se borrarán sus huellas en mi vida, sus sueños continúan. AGRADECIMIENTOS A mi padre por apoyarme económicamente, por sus consejos, ayuda y ánimo durante toda mi carrera. Al Dr. José Gregorio Cabrera Gomez por permitirme trabajar bajo su orientación, por su apoyo, su paciencia y por compartir su conocimiento a lo largo de la realización de este trabajo. A Sonia Queiroz por su apoyo, colaboración y consejos durante este trabajo. Al Instituto de Pesquisas Tecnológicas del Estado de São Paulo por permitirme realizar los ensayos en sus instalaciones y a los funcionarios del Centro Tecnológico de Procesos y Productos por su ayuda. A mis amigos por su motivación, fuerza y consejos, en especial a Luisa Velásquez, Mónica Cubillos, Cecilia Romero, Adriana Quintero, Andrés Salcedo y Killian Nylander. A mis hermanos, tíos y primos por su apoyo, palabras de aliento, ayuda y motivación durante toda la carrera y en especial en los momentos más difíciles de mi vida. TABLA DE CONTENIDO RESUMEN 13 1. INTRODUCCIÓN 14 2. REVISIÓN BIBLIOGRÁFICA 16 2.1 POLIHIDROXIALCANOATOS 16 2.1.1 Definición 16 2.1.2 Historia 17 2.1.3 Estructura química 18 2.1.4 Propiedades físicas 19 2.1.5 Aplicaciones 20 2.1.6 Biosíntesis 22 2.1.6.1 β-Ketoacil-CoA tiolasa 22 2.1.6.2 Acetoacetil-CoA reductasa 23 2.1.6.3 P(3HB) Polimerasa 23 2.1.6.4 Formación de gránulos 23 2.1.7 Otras rutas biosintéticas 25 2.1.7.1 Biosíntesis de PHAscl 25 2.1.7.2 Biosíntesis de PHAmcl 26 2.1.7.2.1 Biosíntesis a partir de carbohidratos 26 2.1.7.2.2 Biosíntesis a partir de ácidos grasos 27 2.1.8 Detección y cuantificación de PHA 27 2.2 GÉNERO Pseudomonas 28 2.3 METABOLISMO DE ÁCIDOS GRASOS 30 3. FORMULACIÓN DEL PROBLEMA Y JUSTIFICACIÓN 35 4. OBJETIVOS 37 4.1 Objetivo General 37 4.2 Objetivos específicos 37 5. MATERIALES Y MÉTODOS 38 5.1 Recuperación de los linajes 39 5.2 Producción de PHAmcl a partir de aceites vegetales 39 5.3 Transesterificación BF3 para aceites vegetales 40 5.4 Determinación masa seca celular 41 5.5 Caracterización del polímero 42 5.5.1 Liofilización 42 5.5.2 Cantidad y composición del PHA 42 6. RESULTADOS Y DISCUSIÓN 44 6.1 Determinación de la composición de los aceites vegetales 44 6.2 Producción y composición de PHA 47 6.3 Influencia del pH 51 6.4 Modulación en la composición del polímero producido 53 6.5 Análisis de flujos metabólicos 58 7. CONCLUSIONES 63 8. RECOMENDACIONES 65 9. REFERENCIAS BIBLIOGRÁFICAS 66 10. ANEXOS 73 Anexo 1: Medios de cultivo empleados 73 LISTA DE TABLAS Tabla 1 Monómeros esperados como constituyentes en la formación de PHA 34 Tabla 2 Composición de los aceites vegetales a utilizar y las mezclas de estos 40 Tabla 3 Composición de aceites vegetales obtenida por análisis de cromatografía gaseosa 46 Tabla 4 Producción de PHA por P. putida IPT 046 a partir de diferentes aceites vegetales y/o combinaciones de estos 48 Producción de PHA por P. aeruginosa IPT 171 a partir de diferentes aceites vegetales y/o combinaciones de estos 49 Tabla 6 Variación del pH luego de 72h de cultivo 52 Tabla 7 Producción de 3HDd∆6 por Pseudomonas putida IPT 046 a partir de ácido linoléico 61 Tabla 8 Producción de 3HDd∆6 por Pseudomonas aeruginosa IPT 046 a partir de ácido linoléico 62 Tabla 5 LISTA DE FIGURAS Figura 1. Gránulos de Polihidroxialcanoato acumulado en bacterias. 17 Figura 2. Formula estructural de los polihidroxialcanoatos 19 Figura 3. Diversos objetos formados por PHB. 21 Figura 4. Mecanismo propuesto para la formación de gránulos de PHA. 25 Figura 5. Vías metabólicas involucradas en la síntesis de PHA. 26 Figura 6. Vía metabólica de la β-oxidación 30 Figura 7. Actividades para la determinación de producción de PHA en linajes IPT 046 e IPT 171 a partir de aceites vegetales 38 Comparación entre la composición de monómeros en los PHA sintetizados por P. putida IPT 046 y P. aeruginosa IPT 171 a partir de un mismo aceite vegetal 50 Correlación entre la concentración de ácido linoléico suministrada y la fracción molar de 3HDd∆6 detectado en el PHA producido por P. putida IPT 046 55 Figura 8. Figura 9. Figura 10. Correlación entre la concentración de ácidos grasos precursores de monómeros insaturados y la fracción molar de estos en el PHA producido por P. putida IPT 046. 55 Figura 11. Correlación entre la concentración de ácidos grasos precursores de monómeros saturados y la fracción molar de estos en el PHA producido por P. putida IPT 046. 56 Figura 12. Correlación entre la concentración de ácido linoléico suministrada y la fracción molar de 3HDd∆6 detectado en el PHA producido por P. aeruginosa IPT 171. 56 Correlación entre la concentración de ácidos grasos precursores de monómeros insaturados y la fracción molar de estos en el PHA producido por P. aeruginosa IPT 171 57 Correlación entre la concentración de ácidos grasos precursores de monómeros saturados y la fracción molar de estos en el PHA producido por P. aeruginosa IPT 171 57 Figura 15. Representación del análisis de flujo metabólico de los aceites vegetales y su incorporación al PHA. 58 Figura 16. Relación para determinar la cantidad de monómeros formados a partir de la síntesis de novo de ácidos grasos, basada en la cantidad detectada de 3HDd∆5 59 Figura 13. Figura 14. RESUMEN La producción de polihidroxialcanoatos (PHA) en Pseudomonas aeruginosa IPT171 y P. putida IPT046 fue evaluada utilizando 11 aceites vegetales y 10 combinaciones de estos. Los valores de PHA acumulados por el linaje IPT046 fueron significativamente superiores a aquellos observados para el linaje IPT171 y alcanzó hasta 60% de la masa seca celular. 3-Hidroxioctanoato (3HO) y 3hidroxidecanoato (3HD) representaron un porcentaje mayor que 65% de los monómeros detectados en el PHA producido por los dos linajes bacterianos, utilizando cualquiera de los dos aceites. Se observó una tendencia de incorporación mas eficiente de 3HO en el linaje IPT171 en comparación con el linaje IPT046. Por otro lado, el sistema de biosíntesis de PHA del linaje IPT046 fue más eficiente en la incorporación de 3-hidroxihexanoato (3HHx) y 3-hidroxi6-dodecenoato (3HDd∆6). La cantidad de monómeros insaturados pudo ser modulada en función del aceite vegetal suministrado e fueron obtenidos PHA conteniendo de 0 a 17 mol% de estos monómeros. Menos que 29% del ácido linoleico suministrado fue efectivamente incorporado como monómero 3HDd∆6. Por medio del análisis de flujo metabólico, se determinó que en los dos linajes bacterianos se usaron las dos vías metabólicas para la formación de monómeros constituyentes del PHA, cuando son cultivados en diversos ácidos grasos; la síntesis de novo de ácidos grasos se detectó por la cantidad de 3HDd∆5 detectado, y la presencia de la β-oxidación por la existencia de 3HDd∆6. Estos dos linajes lograron producir monómeros con conformaciones especiales que pueden hacer factible la modificación química del polímero y su mejoramiento de las características físicas. 1. INTRODUCCIÓN Los polihidroxialcanoatos (PHA) son polímeros acumulados por diversas bacterias en forma de gránulos intracelulares, que alcanzan hasta el 90% de la masa seca celular (Marchessault, 1996), bajo condiciones desbalanceadas de crecimiento, como un exceso de fuente de carbono disponible y limitación de por lo menos un nutriente esencial para la multiplicación celular (Sanchez et. al., 2003) Estas moléculas de PHA presentan, una vez extraídas de la célula, propiedades similares a algunos plásticos comunes, como el polipropileno. El origen bacteriano del PHA hace de este poliéster un material natural, y por ende, muchos microorganismos como bacterias y hongos han desarrollado la capacidad de degradar estas moléculas para usarlas como fuente de carbono; aparte de esta biodegradabilidad, el PHA es reciclable como los termoplásticos petroquímicos (Poirier et. al., 2001). Es grande la cantidad de microorganismos productores de PHA; entre los más estudiados se encuentran Ralstonia eutropha, Methylobacterium y especies del género Pseudomonas (P. denitrificans, P. putida, P. oleovorans, P. aeruginosa). Existen también otras especies menos estudiadas, como Agrobacterium, Actinobacillus, Azotobacter, Rhodobacter y Sphaerotilus. (Madison y Huisman, 1999). Gran variedad de sustratos para la producción de PHA han sido utilizados; cabe destacar el uso de alcanos, alcoholes, ácidos grasos, aceites vegetales y carbohidratos. Los aceites de origen vegetal son una buena opción para la obtención de PHA, puesto que son una fuente de carbono renovable y económica y muchos de los ácidos grasos constituyentes de los aceites vegetales son insaturados, por lo que pueden funcionar como precursores de monómeros insaturados que son incorporados al polímero, lo que es esencial para algunas modificaciones químicas (Silva-Queiroz, 2003). La actual preocupación por la polución ambiental causada por los plásticos petroquímicos descartados, ha dado mayor ímpetu al estudio de la producción y degradación de PHA en el ambiente natural (Anderson y Dawes, 1990). Por tal motivo, es de vital importancia la optimización de la producción de PHA, observando no solamente la productividad volumétrica y el contenido final de PHA en la célula (Hazenberg y Witholt, 1997), sino también el sustrato empleado, para obtener polímeros que presenten características deseadas y que sean de bajo costo. Dentro de las estrategias empleadas para el aumento de la productividad, se describen el uso de cepas mas productivas, la optimización de los medios de cultivo y el uso de fuentes de carbono de menor costo (Almeida et. al., 2004), una vez que la fuente de carbono puede contribuir con 40% del costo de producción de este bioproducto (Choi y Lee, 1999). Analizando este aspecto, los aceites vegetales se colocan como una buena alternativa de fuente de carbono, puesto que según Kahar et. al., (2004), el rendimiento máximo teórico de conversión de aceites vegetales a PHA está en el orden de 1,00 g/g, comparado con el valor de conversión de sacarosa de 0,33 g/g, obtenido en la práctica industrial (Nonato et. al., 2001). Adicional a ello, el empleo de aceites vegetales y mezclas de estos no sólo contribuye a una reducción en los costos de producción, sino que permite la obtención de polímeros con diferentes conformaciones, debido al metabolismo empleado por los linajes de Pseudomonas en la asimilación de los ácidos grasos y la posterior biosíntesis del polímero, lo que permitiría mejorar las propiedades del PHA para su producción a grande escala. 2. REVISIÓN BIBLIOGRÁFICA 2.1 POLIHIDROXIALCANOATOS 2.1.1 Definición Los Polihidroxialcanoatos (PHAs) son estructuralmente simples macromoléculas sintetizadas por muchas bacterias Gram-positivas y Gram-negativas. Los PHAs son acumulados en gránulos (Figura 1) hasta niveles del 80% del peso seco de la célula y juegan un rol como material de reserva de energía, carbono y equivalentes reductores; al polimerizar intermediarios solubles a moléculas insolubles, la célula no sufre alteraciones de su estado osmótico y se evita así la pérdida de compuestos valiosos, con lo que las reservas de nutrientes permanecerán disponibles por un relativo bajo costo (Madison y Huisman, 1999). La formación de estas macromoléculas se da normalmente bajo condiciones de privación nutricional de elementos como N, P, S, O o Mg, en presencia de un exceso de fuente de carbono (Castro y Rendón, 2003). La utilización de dicho polímero también es considerada una estrategia desarrollada por las bacterias para incrementar su supervivencia en ambientes cambiantes. Los PHA son utilizados como fuente de carbono y energía en condiciones de escasez de nutrientes, como fuente de carbono y energía para el enquistamiento (en Azotobacter) y la esporulación (en Bacillus), para la degradación de compuestos tóxicos, como fuente de poder reductor (Almeida et. al., 2004; Anderson y Dawes, 1990) y como protección de la nitrogenasa de las bacterias fijadoras de nitrógeno, puesto que el PHA actúa como un sustrato oxidable en ausencia de sustratos exógenos que puedan ser oxidados (Anderson y Dawes, 1990). Asimismo, los PHA han sido detectados como constituyentes de la membrana celular citoplasmática, en complejos con calcio e polifosfato o asociados a proteínas (Gomez y Bueno-Netto, 2001) B A Figura 1: Gránulos de Polihidroxialcanoato acumulado en bacterias. (A). Azotobacter chroococcum (Lenz y Marchessault, 2005). (B). Pseudomonas fluorescens (Lee et. al., 2001) 2.1.2 Historia El primer PHA descubierto fue el poli(3-D-hidroxibutirato) (PHB), un homopolímero que fue detectado en la especie Bacillus megaterium en el año 1927 (Lenz y Marchessault, 2005). Desde entonces, una larga variedad de PHAs con diferentes longitudes de cadena de carbonos y grupos R se han estudiado, con por lo menos 150 diversos componentes de PHA y por lo menos cinco diversos caminos biosintéticos diferentes (Rehm et al., 1998). Esta variabilidad en la composición depende de la especificidad del sistema de polimerización, de la naturaleza del sustrato suministrado, así como de las rutas metabólicas que llevan a la formación de los monómeros (Silva-Queiroz, 2003). Los procesos comerciales para la producción de PHAs fueron desarrollados inicialmente por W.R. Grace en los años sesenta y desarrollados mas adelante por Imperial Chemical Industries, ICI, en el Reino Unido entre los años setenta y ochenta. Desde los años noventa, Metabolix Inc. y Monsanto han sido las fuerzas impulsoras tras la explotación comercial de los polímeros de PHA en Estados Unidos (Castro y Rendón, 2003). Actualmente, existen 4 marcas: Biopol™ (copolímero de hidroxibutirato e hidroxivalerato), Biomer™ (homopolímero de hidroxibutirato), Nodax™ (copolímero de hidroxibutirato e hidroxihexanoato) y Biocycle™ (homopolímero de hidroxibutirato, copolímero de hidroxibutirato e hidroxivalerato) (Lemos et. al., 2006). En Latinoamérica, este biopolímero viene siendo producido por la empresa brasileña PHB Industrial S.A. desde el año 2000, con capacidad inicial de 50 toneladas/año e ya en fase de ampliación (Nonato et. al., 2001). Recientemente, copolímeros de 3HB y 3-hidroxialcanoatos de cadena media (3HAmcl) han sido objeto de diferentes patentes presentadas por la empresa Procter & Gamble (Noda & Bond, 2002; Noda & Satkowski, 2003; Noda et al., 2005; Hassan et al., 2006), los cuales son polímeros de gran interés, puesto que poseen propiedades intermediarias entre PHAscl y PHAmcl, como alongamiento superior al 600% (Sudesh et al., 2000) 2.1.3 Estructura química Estructuralmente, los PHA son polímeros lineales de (R)-3-hidroxiácidos en los cuales el grupo carboxilo de un monómero forma un enlace tipo éster con el grupo hidroxilo del monómero siguiente (Figura 2). El radical R puede ser un átomo de hidrógeno o una cadena de hasta trece átomos de carbono, que puede contener instauraciones, cadenas cíclicas, grupos aromáticos e inclusive otros átomos como bromo, flúor o cloro (Almeida et. al., 2004). Mas de 150 diferentes tipos de ácidos hidroxialcanoicos han sido identificados como constituyentes de PHA, cuando la bacteria es cultivada bajo condiciones limitadas de nitrógeno (Steinbüchel y Valentin, 1995). Thakor et. al., 2005). Esta variación en la composición monomérica depende del sustrato suministrado durante la acumulación, por lo que para la síntesis e incorporación de la mayoría de los monómeros es necesario proporcionar un sustrato estructuralmente relacionado a estos (Silva-Queiroz, 2003). Figura 2. Formula estructural de los polihidroxialcanoatos. (Romero, C. 2006) Los PHA pueden ser divididos en dos clases de polímeros: polímeros de cadena corta o PHAscl (“short chain length”), conteniendo ácidos 3-hidroxibutírico (3HB) y 3-hidroxivalerico (3HV), y polímeros de cadena media o PHAmcl (“medium chain length”), que contienen monómeros de C6 (3-hidroxihexanoato) a C14 (3hidroxitetradecanoato) (Hazenberg y Witholt, 1997). Esta diferencia parece deberse a la PHA sintasa de los microorganismos, que puede ser dividida en dos tipos distintos, a pesar que las bases moleculares para la especificidad de sustrato aun es desconocida (Gomez et al., 1996). Los PHAscl son encontrados en Ralstonia eutropha, Alcaligenes latus, Azotobacteri vinelandii, Azotobacter chrococcum y Methylobacterium organoplhilum entre otras (Choi y Lee, 1999), mientras que los PHAmcl son encontrados en Pseudomonas oleovorans, Pseudomonas aeruginosa y otras Pseudomonas fluorescentes (Silva-Queiroz, 2003). 2.1.4 Propiedades físicas La masa molecular varia dependiendo del microorganismo productor de PHA, pero generalmente esta en el orden de 50,000 a 1,000,000 Da. Dentro de la célula, el polihidroxibutirato P(3HB) existe en un estado liquido y amorfo; sin embargo, después de la extracción de la célula por solventes orgánicos, el P(3HB) se convierte en un estado altamente cristalino, lo que le da bastante dureza, pero a su vez lo hace un material muy quebradizo. Su punto de fusión es relativamente alto (180oC), pero cerca del punto de degradación térmica (200oC) (Kim y Lenz, 2001). Los polímeros de cadena corta son mas duros y quebradizos, mientras que los de cadena media son mas flexibles y tienen un punto mas bajo de cristalinidad, por lo que cada polímero tiene diferentes rangos de aplicación (Madison y Huisman, 1999). Los PHAscl son catalogados como termoplásticos, mientras que los PHAmcl, por tener menor cristalinidad y puntos de fusión menores son reconocidos como elastómeros (Poirier et al., 2001). Los PHAmcl tienen un alongamiento para ruptura mayor que 100%, mientras que los PHAscl poseen un alongamiento para ruptura menor que 5%; la incorporación de unidades de 3HV al P3HB permite aumentar la maleabilidad y resistencia, alcanzándose valores de alongamiento para ruptura cerca de 50% (Sudesh et al., 2000). 2.1.5 Aplicaciones Además de sus propiedades termoplásticas, los PHA poseen otras características interesantes: su biodegradabilidad y el hecho de que pueden ser producidos a partir de recursos renovables. Su producción fermentativa utiliza productos derivados de la agricultura como fuente de carbono. En la naturaleza los microorganismos son capaces de degradar los PHA, mediante la acción de PHA depolimerasas y PHA hidrolasas extracelulares, hasta CO2 y agua (Almeida et al, 2004). Como se mencionó anteriormente, las diferencias estructurales de los polímeros producidos permiten diferentes lugares de aplicación. Los PHAmcl, debido a su baja rigidez, tienen aplicaciones potenciales en películas medicas y dispositivos especiales (Sánchez et al., 2003), como transportadores de fármacos, suturas quirúrgicas, implantes médicos temporarios, como soporte para regeneración de arterias y sutura para venas de pacientes con deficiencias vasculares; entre otras aplicaciones estudiadas, especialmente para polihidroxibutirato-co- hidroxivalerato (P3(HB-co-3HV), un copolímero de PHAscl, hay tecnicas de microencapsulación para la liberación controlada de drogas y otros agentes activos tales como albúmina de suero bovina, hormona folículo estimulante y tionicotinamida para el control de la enfermedad de Chagas (Silva-Queiroz, 2003). También se han empleado en aplicaciones de moldeado, en particular en embalajes de productos de consumo como botellas, recipientes para cosméticos, bolígrafos, y palos de golf (Madison y Huisman, 1999) (Figura 3). Adicional a su potencial como material plástico, los PHA sirven como precursores quirales para la síntesis de compuestos ópticamente activos; estos compuestos son usados como portadores biodegradables para dosificación a largo plazo de insecticidas y herbicidas y son usados como materiales osteosintéticos en la estimulación del crecimiento de huesos, debido a sus propiedades piezoeléctricas (Khanna y Srivastava, 2005) Figura 3: Diversos objetos formados por PHB. Se ha comprobado que la degradación de estos objetos en suelo es de 3 meses. (Lenz y Marchessault, 2005) 2.1.6 Biosíntesis Los pasos individuales para la biosíntesis de PHB han sido estudiados en detalle para algunas bacterias, teniendo en cuenta 3 enzimas de vital importancia en dicho proceso (Castro y Rendón, 2003): 2.1.6.1 β -Cetoacil-CoA tiolasa: cataliza el primer paso en la formación del P(3HB). Se dividen en dos grupos dependiendo en la especificidad de sustrato. El primer grupo consiste en tiolasas con una amplia especificidad por el βketoacil-CoAs en un rango de C4 a C16 (Castro y Rendón, 2003). Esta clase de enzimas están involucradas principalmente en la degradación de ácidos grasos y están localizadas en el citoplasma de procariotas y en mitocondrias y peroxisomas de células vegetales y de mamíferos (Madison y Huisman, 1999) El segundo tipo de β-Ketoacil-CoA tiolasas esta considerada como biosintética y tiene un estrecho rango de especificidad por el tamaño de la cadena, de C3 a C5; estas tiolasas biosintéticas están especializadas para una variedad de roles, como formación de cuerpos ketónicos y biosíntesis de isoprenoides y esteroides (Madison y Huisman, 1999). El mecanismo de acción consiste en dos medias reacciones, de las que resulta la condensación de dos moléculas de acetil-CoA a acetoacetil-CoA. En la primera parte de la reacción, el sitio activo con cisteína ataca una molécula de acetil-CoA para formar el intermediario acetil-S-enzima; en la segunda parte de la reacción, una segunda cisteína deprotona la otra molécula de acetil-CoA, resultando una molécula inactiva de acetil-CoA que es capaz de atacar el complejo acetil-S-enzima y formar de esta manera acetoacetil-CoA. Por lo anterior, se expone que la enzima contiene dos sitios activos de cisteína, y se cree que estas tiolasas usan el mismo mecanismo enzimático para condensar acetil-CoA con acetil-CoA o acil-CoA (Madison y Huisman, 1999). 2.1.6.2 Acetoacetil-CoA reductasa: esta enzima es una (R)-3-hidroxiacil-CoA deshidrogenasa y cataliza el segundo paso en la biosíntesis del p(3HB), convirtiendo el acetoacetil-CoA en 3-hidroxibutiril-CoA (Castro y Rendón, 2003). Esta enzima, junto con la P(3HB) polimerasa, estimulan la reacción de condensación, puesto que la tiolasa tiene preferencia por la ruptura tiolítica, lo cual ocurre en dirección opuesta a la biosíntesis de P(3HB); sin embargo, bajo condiciones de acumulación de P(3HB), la tiolasa actúa contra su dirección termodinámicamente favorable, cuando la acetoacetil-CoA reductasa reacciona, la cual necesita de equivalentes reductores en forma de NADPH, por lo cual la disponibilidad de estos equivalentes es considerada la fuerza directriz de la formación de P(3HB) (Madison y Huisman, 1999). 2.1.6.3 P(3HB) Polimerasa: es la tercera enzima involucrada en la biosíntesis de P(3HB). La actividad de polimerización de esta enzima se basa en la formación de enlaces éster con un residuo de cisteína como sitio activo. Se ha descubierto que la polimerasa se encuentra en estado hidrofílico e hidrofóbico, por lo que se supone que la evolución ha seleccionado enzimas que sean catalíticamente eficientes cuando se presenten problemas relacionados con la “superficie-zona hidrofóbica-proteína”. La gran variedad de microorganismos productores de PHA representaría un vasto espectro de condiciones intracelulares en donde estas enzimas tendrían que haberse adaptado; esto explicaría el bajo nivel identidad total de secuencias dentro de las diferentes PHA polimerasas (Madison y Huisman, 1999). Se presume también que el rol de transferencia de monómeros en la cadena, hecho por la PHA polimerasa, debe ejercer algún control en el peso molecular del polímero producido, lo cual es una característica típica de cada microorganismo (Anderson y Dawes, 1990) 2.1.6.4 Formación de gránulos: Los gránulos tienen un diámetro típico entre 0,2 y 0,5 µm y poseen una membrana como cobertura de cerca de 2 nm de grosor, compuesto por lípidos y proteínas, representando el 0,5 y el 2%, respectivamente, del peso del gránulo. Parece que el número de gránulos por célula es fijado en los estados tempranos de la acumulación del polímero, y durante la acumulación, la célula pierde su conformación típicamente cilíndrica para acomodar polímero adicional, hasta el punto en que la síntesis de PHA disminuye. El cese en la acumulación de polímero puede deberse a la cantidad acumulada, puesto que al alcanzar su porcentaje máximo de reserva, la PHA polimerasa permanece activa, lo que sugiere que constricción física opera e impide que la célula acomode más polímero dentro de ella, a pesar de la disponibilidad de sustrato y de la polimerasa activa (Anderson y Dawes, 1990). La formación de los gránulos puede seguir 4 pasos (Figura 4): 1) la polimerasa soluble actúa con concentraciones cada vez mayores de 3-hidroxibutiril-CoA en el citoplasma. Durante la fase lag, oligómeros de hidroxibutiril (HB) son formados y se mantienen unidos con la enzima. 2) Estos oligómeros de HB forman micelas que aumentan en tamaño e hidrofobicidad. Consecuentemente, estas partículas proveen una unión de dos fases, con la polimerasa en la interfase. 3) La enzima entonces procede rápidamente con la síntesis de P(3HB) dentro del gránulo en crecimiento, la cual precisa de una superficie disponible. 4) Eventualmente las micelas coalescen formando grandes gránulos que pueden ser fácilmente visualizados en el microscopio de contraste de fases (Madison y Huisman, 1999) Por último, la PhaP es una proteína de unión de PHA que determina el tamaño de los gránulos. Esta proteína parece que está involucrada en el mantenimiento de las condiciones óptimas para la síntesis de PHA y la formación de los gránulos; actúa de manera similar a las oleosinas de las plantas productoras de aceites y mantiene la integridad de los cuerpos oleosos previniendo su coalescencia (Madison y Huisman, 1999). Figura 4. Mecanismo propuesto para la formación de gránulos de PHA. (Madison y Huisman, 1999) 2.1.7 Otras rutas biosintéticas Debido a la gran variedad de microorganismos que producen PHA y que viven en diferentes ambientes y con diferentes fuentes de carbono, la ruta biosintética que envuelve las enzimas tiolasa, reductasa y polimerasa no es la única empleada. 2.1.7.1 Biosíntesis de PHAscl (Madison y Huisman, 1999) La biosíntesis de ese grupo de PHA involucra dos rutas metabólicas diferentes, dependiendo del sustrato empleado; la primera está mediada por el uso de monómeros generados durante la oxidación de ácidos grasos, como el enoilCoA, por lo que no implica a las enzimas tiolasa y reductasa. Se produce PHA principalmente con monómeros de 3-hidroxivalerato (3HV), pero también se encuentran pequeñas cantidades de 3HB. La segunda vía envuelve el uso de carbohidratos, por la ruta metilmalonil-CoA. En esta ruta, se acumula PHA con monómeros de 3HV, con acetil-CoA y propionil-CoA como precursores: el succinil-CoA es convertido a metilmalonilCoA, el cual es descarboxilado a propionil-CoA; por su parte, el acetil-CoA proviene de la glicólisis. Este tipo de vía es característica de los Actinomycetes. 2.1.7.2 Biosíntesis de PHAmcl La biosíntesis de PHAmcl posee varias rutas metabólicas, que son esquematizadas en la figura 5: Transacilase Figura 5: Vías metabólicas involucradas en la síntesis de PHAmcl. (Park et al., 2006) 2.1.7.2.1 Biosíntesis a partir de carbohidratos: cuando el microorganismo es cultivado con carbohidratos como única fuente de carbono, el PHA producido está compuesto principalmente por monómeros de C10 y C8. Por tal motivo, se sugiere que estos monómeros son derivados de intermediarios de la biosíntesis de ácidos grasos a partir de glucosa, lo cual es confirmado por experimentos de inhibición: cuando la cerulenina (inhibidor de la biosíntesis de ácidos grasos) es adicionado a cultivos celulares, no se forma PHA a partir de glucosa, aunque sí hay producción a partir de ácidos grasos. (Madison y Huisman, 1999). Se forman moléculas de 3-hidroxiacil a partir de la condensación de moléculas de AcetilCoA, via malonil –CoA, para formar el hidroxiácido que será incorporado al polímero, que es trasferido de la ACP (Acyl Carrier Protein) para la coenzima A por la transacilasa, para luego realizar la reacción de polimerización catalizada por la PHA sintasa (Rehm et. al., 1998) 2.1.7.2.2 Biosíntesis a partir de ácidos grasos: la composición de estos polímeros está directamente relacionada con la estructura de la fuente de carbono, lo cual sugiere que la ruta biosintética es una rama directa de la oxidación de ácidos grasos. Cuando la fuente de carbono es de C6 a C12, los monómeros de PHA tienen la misma longitud que el sustrato disponible, o tienen dos, cuatro o seis átomos menos. Cuando se administran ácidos grasos de C13C18, la composición del PHA no es relacionada con la longitud del sustrato, puesto que el monómero más largo insertado tiene 11 o 12 carbonos, aunque es dependiente para configuraciones como insaturaciones. Cuando se emplean los ácidos heptadecanoico u octadecanoico, no se observa acumulación de PHA, puesto que esta fuente de carbono no permite el crecimiento de los microorganismos, aunque Ballistreri et. al., (2001) lograron obtener acumulación de PHA a partir de ácido eicosanoico. Como los intermediarios de la oxidación de ácidos grasos presentan una conformación (S)-3-hidroxiacil-CoA, se necesita un paso adicional para transformarlos a (R)-3-hidroxiacil-CoA, puesto que la polimerasa para PHAmcl presenta especificidad para este tipo de monómeros (Madison y Huisman, 1999); por lo tanto, enzimas como una (R)-específica enoilCoA hidratasa, una hidroxiacil-CoA epimerasa y una 3-cetoacil reductasa han sido postuladas para unir la β-oxidación con la biosíntesis de PHA (Hoffmann y Rehm, 2004). 2.1.8 Detección y cuantificación de PHA Para la determinación de la producción de PHA en las células, las bacterias son teñidas con colorante Negro Sudan B, indicando la naturaleza lipídica de los gránulos. Asimismo, pueden teñirse los gránulos con Azul Nilo A, una oxazina que produce fluorescencia naranja con excitación a 460nm (Khanna y Srivastava, 2005) La cuantificación de polímeros del tipo polihidroxialcanoato, se lleva a cabo en la mayoría de los estudios reportados mediante cromatografía de gases, empleándose un patrón interno de ácido benzoico, el cual establece los tiempos de retención mediante los cuales se informa el tipo de estructura y la cantidad de carbonos que puede tener (Castro y Rendón, 2003). Sin embargo, para usar la cromatografía de gases es necesario realizar una depolimerización del PHA una vez extraído de la célula, formando metil-ésteres ó propil-ésteres, dependiendo si el método empleado es metanólisis (Braunegg et. al, 1978) o propanólisis (Riis y Mai, 1988), respectivamente. Se ha empleado el análisis espectroscópico con Resonancia Magnética Nuclear con 13 C (13C-NMR) para el estudio de la estructura de PHA. Sin embargo, para PHA con monómeros saturados e insaturados de cadena larga la 13 C-NMR es mucho mas complicada por la equivalencia de los cambios químicos de los átomos de carbono y los patrones protónicos del espectro de NMR, lo que dificulta la determinación estructural (Lee y Choi, 1995) 2.2 GENERO Pseudomonas Son bacilos rectos o curvados Gram.-negativos que se encuentran en suelos, aguas dulces y de mar, lodo, vegetación en descomposición y en diferentes asociaciones con plantas y animales. Su diversidad ecológica refleja sus requerimientos nutricionales simples y la habilidad por metabolizar un amplio rango de componentes orgánicos. Son quimiorganotróficos y quimiolitotróficos, usando CO2 y H2 como fuente de energía. Crecen a pH casi neutro y a temperaturas en la zona de mesofilia, hasta 43ºC; algunas especies usan más de cien compuestos diferentes como fuente de carbono y solo unas pocas especies usan menos de veinte. Utilizan azúcares, ácidos grasos, ácidos dicarboxílicos y tricarboxílicos, alcoholes, glicoles, compuestos aromáticos aminoácidos y otros, pero normalmente no pueden descomponer polímeros en sus componentes monómeros (Moreno y Rios, 1995) Las Pseudomonas son particularmente ricas en lipasas catalíticamente útiles. Enzimas de este tipo en las especies P. fluorescens y P. aeruginosa presentan hidrólisis de éster enantioselectiva, lo cual las hace altamente procuradas en las reacciones de biotransformación y reacciones de esterificación; adicional a ello, preparados de estas enzimas no requieren de cofactores para su uso. Las biotransformaciones también están siendo favorecidas por el uso de cepas recombinantes, en las que este género bacteriano también presenta grandes ventajas: los genes de Pseudomonas son frecuentemente más eficientes en su transcripción y trasducción en las especies originales que en hospederos heterólogos. Además, pseudomonadas, mucho más que otros microorganismos Gram-positivos y Gram-negativos, se acomodan mejor para su uso en sistemas acuosos/solventes por su inherente resistencia a solventes; esta tolerancia a compuestos tóxicos puede servir para almacenar enzimas a partir de DNA recombinante que sean eficaces en convertir sustratos insolubles en agua, tales como los ácidos grasos (Montie, 1998) Los primeros reportes de la formación de PHAmcl por especies de Pseudomonas fueron de la especie P. oleovorans, describiendo la producción del polímero conteniendo 3-hidroxioctanoato por la asimilación de ácidos grasos de cadena media y cadena larga; esta capacidad también es expresada para el crecimiento en alcanos (Kessler y Palleroni, 2000). Sin embargo, la síntesis de PHAmcl es ahora considerada pertinente no sólo para P. oleovorans, sino también común para todas las Pseudomonas fluorescentes (Ballistreri et. al., 2001) Una característica fascinante de muchas especies de Pseudomonas como organismos productores de PHA es su capacidad de sintetizar estos polímeros con varios grupos funcionales como halógenos, alquilos ramificados, fenilos, fenoxilos, olefinas y ésteres, cuando son cultivados en sustratos conteniendo las estructuras químicas correspondientes. Los PHA que contienen grupos funcionales son de gran interés, puesto que estos grupos pueden mejorar las propiedades físicas de los PHAmcl. Además, algunos grupos funcionales pueden ser modificados por reacciones químicas para obtener más grupos útiles, que pueden extender la potencial aplicación de los PHA como polímeros biodegradables y biomateriales funcionales para aplicaciones biomédicas (Kim et al., 2000) 2.3 METABOLISMO DE ACIDOS GRASOS Muchas bacterias pueden crecer en ácidos grasos de cadena larga, que son oxidados a acetil-CoA por una vía llamada β-oxidación (Figura 6). Ácidos grasos fabD Acetil-CoA acil-CoA sintetasa Acil-CoA β-cetotiolasa 3-Cetoacil-CoA Acil-CoA deshidrogenasa Via de la β-oxidación 3-hidrxiacil-CoA desidrogenasa Enoil-CoA Enoil-CoA hidratasa (S)-3-Hidroxiacil-CoA Figura 6: Vía metabólica de la β-oxidación para la formación de Acetil-CoA a partir de ácidos grasos. (Adaptado de Stryer, 1998) Esta vía consiste en una serie cíclica de cuatro reacciones, al final de las cuales el acil-CoA es cortado en moléculas con 2 carbonos, liberados bajo la forma de Acetil-CoA (White, 2000). El acetil-CoA producido a partir de la oxidación de ácidos grasos de cadena media y larga, y del catabolismo de ácidos grasos de cadena corta, puede servir como sustrato para la biosíntesis de novo de ácidos grasos y fosfolípidos, o puede ser metabolizado por la vía del ciclo de Krebs, para servir como fuente de carbono y energía (Black y DiRusso, 1994) Los ácidos grasos de cadena larga entran a la célula por un sistema de transporte auxiliado por proteínas. La proteína FadL se localiza en la membrana externa, donde actúa como un receptor de ácidos grasos y auxilia su paso a través de la membrana externa. La acil-CoA sintetasa es responsable por la activación de acido graso y su paso por la membrana interna; esta molécula activada (acil-CoA) es oxidada por las enzimas acil-CoA deshidrogenasas, sintetizadas a partir de los genes fadF y fadG. Estas enzimas presentan especificidades diferentes, puesto que la codificada por el primer gen posee especificidad por acil-CoA de cadena media o larga, mientras que la codificada por el gen fadG presenta especificidad para acil-CoA de cadena corta. El resultado de la oxidación es un enoil-CoA (acil-CoA insaturado en la posición 2) (Silva-Queiroz, 2003). Los siguientes pasos en la β-oxidación de ácidos grasos están asociados a un complejo multienzimático codificado por los genes fadA y fadB. En este complejo se encuentran las enzimas enoil-CoA hidratasa, 3-hidroxiacil-CoA hidrogenasa y 3-β-cetoacil-tiolasa. Esta última enzima está codificada exclusivamente por el gen fadA, mientras que las otras 2 son codificadas por el gen fadB (SilvaQueiroz, 2003). La hidratación del enoil-CoA por la enzima enoil-CoA estereospecífica. Cuando se hidrata el doble enlace trans- hidratasa 2 es solamente se forma el L-isómero del 3-hidroxiacil-CoA. La enzima hidrata también un doble enlace cis- 2 , pero el producto es entonces el D-isómero. Esta hidratación es el preludio de la segunda reacción de oxidación, que convierte el grupo hidroxilo del carbono 3 en un grupo ceto y genera NADH, mediada por la enzima 3hidroxiacil-CoA hidrogenasa, que es específica para el L-isómero del sustrato hidroxiacilo (Stryer, 1998). Las reacciones precedentes han oxidado el grupo metileno en el carbono 3 hasta un grupo ceto. La etapa final es la escisión del 3-cetoacil-CoA por el grupo tiol de una segunda molécula de CoA, que produce acetil-CoA y un acil-CoA acortado en dos átomos de carbono. Esta escisión tiolítica es catalizada por la 3β-cetoacil-tiolasa. A diferencia de las acil-CoA deshidrogenasas, la β-cetoaciltiolasa tiene una especificidad muy amplia con respecto a la longitud del grupo acilo (Stryer, 1998). Los ácidos grasos insaturados, presentes en la mayoría de aceites vegetales, requieren de dos nuevas enzimas, una isomerasa y una reductasa, para su total degradación. Esta degradación sigue los pasos normales de la β-oxidación, pero al llegar a la instauración se requiere de las enzimas adicionales, puesto que la enzima encargada de la primera oxidación, la acil-CoA deshidrogenasa, no puede tomar como sustrato un cis- 3 -enoil-CoA, por lo cual la isomerasa convierte este doble enlace en un doble enlace trans- 2 , logrando así que la oxidación del ácido graso continúe normalmente. Por otra parte, cuando el ácido graso posee instauraciones en carbonos pares, luego de la acción de la acil-CoA deshidrogenasa se produce el 2,4-dienoil-intermediario, que no es un sustrato adecuado para la siguiente enzima de la vía de la β-oxidación. El obstáculo se salva por la acción de la 2,4-dienoil-CoA reductasa, una enzima que usa NADPH para reducir el 2,4-dienoil-intermediario en cis- 3 -enoil-CoA; la isomerasa lo convierte entonces en forma trans, un intermediario habitual de la β-oxidación (Stryer, 1998; Schulz y Kunau, 1987). De esta manera, los dobles enlaces situados en posiciones impares son manipulados por la isomerasa, y los situados en posiciones pares, por la reductasa y la isomerasa (Stryer, 1998). Finalmente, cabe resaltar que el uso de lípidos como fuente de carbono involucra ruptura de triglicéridos por acción de lipasas bacterianas, formando glicerol y los ácidos grasos correspondientes. El glicerol es fosforilado y oxidado a dihidroxiacetona fosfato, el cual es un intermediario de la glicólisis, para convertirse posteriormente a ácido pirúvico y finalmente a Acetil-CoA, que puede tener 3 destinos: el ciclo de Krebs, la biosíntesis de PHA y la biosíntesis de ácidos grasos (Romero, 2006). La síntesis de PHA ocurre luego de la incorporación tanto de intermediarios en el metabolismo de los ácidos grasos precursores como de sus derivados (Steinbüchel y Hein, 2001). Por tal motivo, luego de la β-oxidación de los ácidos grasos administrados como sustrato, se espera observar una incorporación de monómeros en el PHA relacionados a la fuente de carbono adicionada, con las correspondientes estructuras químicas (Kim, et. al., 2000); estos monómeros pueden observarse en la Tabla 1 (Gomez, 2006) Tabla 1: Monómeros esperados como constituyentes en la formación de PHA, generados por la b-oxidación de ácidos grasos Monómeros esperados Ácido graso C6 C8 C10 C12 C8 Octanóico 3HHx 3HO C10 Decanóico 3HHx 3HO 3HD C12 Dodecanóico 3HHx 3HO 3HD 3HDd C14 Mirístico 3HHx 3HO 3HD 3HDd C16 Palmítico 3HHx 3HO 3HD 3HDd C16:1 9-hexadecenóico 3HHx 3HO 3HD 3HDd∆ ∆5 C18 Esteárico 3HHx 3HO 3HD 3HDd C18:1 Oleico 3HHx 3HO 3HD 3HDd C18:2 Linoleico 3HHx 3HO 3HD 3HDd∆ ∆6 C18:3 Linolénico 3HHx 3HO 3HDd∆ ∆6,9 3HD∆ ∆7 Alfa-oleosteárico 3HHx 3HO C18:3 3HD∆ ∆5 3HDd∆ ∆5,7 3,6dHDd C18:1 Ricinolêico 3HHx 3HO 3HD/4HD C20 Eicosanóico 3HHx 3HO 3HD 3HDd 3HHx: 3-hidroxihexanoato. 3HO: 3-hidroxioctanoato. 3HD: 3-hidroxidecanoato. 3HDd: 3hodroxidodecanoato. 3HDd∆5: 3-hidroxi-5-dodecenoato. 3HDd∆6: 3-hidroxi-6dodecenoato. 3HD∆7: 3-hidroxi-7-decenoato. 3HDd∆6,9: 3-hidroxi-6,9-dien-dodecanoato. 3HD∆5: 3-hidroxi-5 decenoato. 3HDd∆5,7: 3-hidroxi-5,7-dien-dodecanoato. 4HD: 4hidroxidecanoato. 3,6dHDd: 3,6-dihidroxidodecanoato 3. FORMULACION DEL PROBLEMA Y JUSTIFICACION Debido al aumento de la población mundial, se ha generado una creciente demanda de productos derivados del petróleo, lo cual contrasta bruscamente con el agotamiento de este recurso no renovable y su consecuente aumento del precio en el mercado internacional, actualmente encima de US$ 50/barril (www.mem.gob.ve/preciopetroleo). Ante esta perspectiva, las investigaciones que involucren el descubrimiento y mejoras en la producción de productos que logren reemplazar a los derivados de este combustible fósil, han tomado un nuevo impulso, y los polihidroxialcanoatos aparecen como una alternativa altamente prometedora. Por otra parte, la gran cantidad de residuos generados por la actividad humana, ha suscitado una preocupación extendida por el manejo y disposición de los desechos, de los cuales los plásticos están entre los que tienen más impacto ambiental por su lenta degradación y en muchos casos su difícil disposición. Aunque el reciclaje alivie en parte la problemática actual, se requieren de acciones más eficaces para lograr obtener soluciones con mejores resultados, puesto que el reciclaje presenta un costo elevado y desprecia el material polimérico. Por otro lado, la incineración libera, durante su proceso, gases tóxicos que son nocivos al medio ambiente (Costa, 1995). Por este motivo, el reemplazo de los plásticos no degradables por biopolímeros totalmente degradables obtenidos a partir de fuentes de carbono renovables sería una solución mucho más completa para los diferentes aspectos de este problema. Sin embargo, el precio de los bioplásticos sigue siendo demasiado alto como para que puedan desplazar a los plásticos tradicionales, sumado al hecho que algunos pueden no cumplir con las expectativas de aplicación por sus propiedades mecánicas. Debido a esto, es necesario diseñar estrategias para obtener polihidroxialcanoatos a un costo similar y que logren satisfacer las exigencias de los procesos a los que serían sometidos para su uso. El uso de sustratos como los aceites vegetales, muestra una perspectiva positiva para solucionar los costos de producción y las exigencias en las propiedades de los polímeros, puesto que estos sustratos permiten reducir los costos de elaboración del polímero, por ser Latinoamérica una fuente de gran abundancia vegetal. Según Akiyama et al. (2003), los aceites vegetales podrían representar factores de producción de PHA mayores, cuando son comparados con los factores de producción usando glucosa o sacarosa como fuente de carbono, puesto que los aceites contienen mayor cantidad de carbono que los azúcares, reduciendo así los costos de producción y consumo de energía. Asimismo, la composición de los diferentes aceites vegetales permite añadirle monómeros con diferentes conformaciones, como instauraciones y radicales acilos con mayor cantidad de carbonos, lo que daría a los biopolímeros las propiedades deseadas y mejoradas, junto con una posible potencialización en la acumulación del polihidroxialcanoato en las bacterias, ayudando de esta manera en la optimización de la producción de los bioplásicos a escalas mayores. 4. OBJETIVOS 4.1 OBJETIVO GENERAL. Determinar el efecto producido por el suministro de diversos aceites vegetales y mezclas de estos, en la biosíntesis y composición del biopolímero producido por dos linajes bacterianos del género Pseudomonas, (P. putida IPT 046 y P. aeruginosa IPT 171) conocidas por su producción de este polímero. 4.2 OBJETIVOS ESPECÍFICOS • Evaluar cuantitativamente la formación de PHA por Pseudomonas putida IPT-046 y Pseudomonas aeruginosa IPT-171 mediante cromatografía gaseosa con aceites vegetales como única fuente de carbono. • Determinar los diferentes monómeros generados a partir de los aceites vegetales utilizados como sustrato (tungue, mamona, girasol, coco, linaza, palma, arroz, canola, maíz, soya y algodón) mediante cromatografía gaseosa. • Establecer las rutas metabólicas implicadas en la degradación de los ácidos grasos y su acumulación o no dentro del PHA, mediante un análisis de flujo metabólico. • Crear una matriz para determinar la interferencia de los diversos ácidos grasos componentes de los aceites vegetales en la formación de PHA. 5. MATERIALES Y METODOS El estudio fue realizado en los laboratorios del Centro Tecnológico de Procesos y Productos del Instituto de Pesquisas Tecnológicas del Estado de São Paulo, Brasil (IPT). La metodología empleada para el presente estudio se ve esquematizada en la figura 7. Linajes IPT 046 e IPT 171 en glicerol Recuperación de linajes en Agar nutriente Siembra en caldo nutriente Siembra en medio mineral con los diferentes aceites vegetales y/o mezclas Medición pH Centrifugación Suspensión células en solución salina con tween 0,1m/v Centrifugación Filtración Secado Determinación masa seca Cromatografía gaseosa Suspensión células en agua destilada Liofilización Propanólisis Figura 7: Actividades para la determinación de producción de PHA en linajes IPT 046 e IPT 171 a partir de aceites vegetales 5.1. RECUPERACIÓN DE LOS LINAJES Se tomaron muestras conservadas en glicerol de cada linaje del banco de cepas de los laboratorios del IPT, que fueron aisladas de suelos de plantaciones de caña de azúcar (Gómez et. al., 1996). Los linajes fueron reactivados por estriamiento en placas de Agar Nutriente (Anexo 1) y cultivados por 72h a 30oC. Colonias aisladas de cada cultivo se utilizaron para inocular 125mL de Caldo Nutriente, e incubadas por 24h (30oC, 150rpm). Una vez incubadas, se tomaron muestras para analizar la axenidad del cultivo por medio de una coloración de Gram. 5.2. PRODUCCIÓN DE PHAmcl A PARTIR DE ACEITES VEGETALES Los aceites vegetales utilizados se observan en la Tabla 2. También se pueden observar las diferentes mezclas de los aceites vegetales que fueron empleadas en el estudio, las cuales fueron deducidas teniendo en cuenta la cantidad de los respectivos ácidos grasos en cada aceite citados por literatura (Silva-Queiroz, 2003; Vieira et al., 2005), para obtener diferentes concentraciones y poder de esta manera correlacionar la formación de los monómeros de PHA, con la cantidad de sustrato relacionado (ácido graso) que es adicionado al cultivo (Gómez, J.G.C., 2006). Se inocularon 20mL del cultivo anterior a 200mL de Medio Mineral (Anexo 1) con 1g/L de (NH4)2SO4, para que el nitrógeno sea el nutriente limitante, teniendo como única fuente de carbono los diferentes aceites vegetales y sus mezclas (concentración 1%v/v), y se incubaron por 72h a 30oC y 150 rpm; pasado el tiempo de incubación, se hizo la respectiva medición de pH en potenciómetro (Mettler modelo Delta 350), utilizando patrones de pH 4,7 y 9 (Silva-Queiroz, 2003). Tabla 2: Composición de los aceites vegetales a utilizar y las mezclas de estos, de acuerdo con los datos de literatura (Silva-Queiroz, 2006) ACEITE VEGETAL O MEZCLA Tungue Mamona Girasol Linaza Palma Arroz Canola Maíz Soya Algodón Coco Mamona (20%), Palma (80%) Arroz (50%), Maíz (50%) Palma (15%), Canola (85%) Palma (50%), Soya (50%) Girasol (80%), Soya (20%) Linaza (25%), Algodón (75%)* Linaza (40%), Algodón (60%)* Linaza (50%), Algodón (50%)* Linaza (70%), Algodón (30%)* Linaza (80%), Algodón (20%)* C12 C14 0,1 50,9 18,4 48,2 1,0 16,6 PORCENTAJE DE ACIDOS GRASOS (%m/m) A C16 C18 C18:1 C18:1 C18:2 C18:3 4,0 1,0 8,0 4,0 3,0 1,2 1,0 3,3 89,2 3,6 0,2 7,0 3,3 14,3 75,4 5,5 3,5 19,1 15,3 56,5 8,7 1,9 14,6 1,2 17,5 1,3 39,9 39,1 0,3 5,4 1,6 56,3 25 11,5 2,2 26,6 58,7 10,5 3,2 22,3 54,5 8,3 25,0 2,8 17,1 52,7 8,0 3,8 5,0 2,5 35,4 3,8 33,5 8,3 14,5 1,8 33,3 48,9 5,9 1,6 50 21,4 9,8 2,7 19,2 33,2 5,0 8,4 3,3 17,5 67,04 3,3 14,5 22,6 28,3 39,6 45,3 C18:3 80 A C12: ácido láurico. C14: ácido mirístico. C16: ácido palmítico. C18: ácido esteárico. C18:1: ácido oléico. C18:1A: ácido ricinoléico. C18:2: ácido linoleico. C18:3: ácido linolénico. C18:3A: ácido α-eleosteárico. *Las mezclas de aceite de linaza y de algodón son para tener diferentes concentraciones de ácido linolénico 5.3. TRANSESTERIFICACIÓN BF3 (Trifluoruro de boro) PARA ACEITES VEGETALES Para comprobar la composición de los aceites empleados en este estudio, se realizó el método descrito por Williams (1984), una preparación de ésteres metílicos para análisis de ácidos grasos por cromatografía en fase gaseosa. Se pesaron 0,3g de cada uno de los aceites empleados en beaker de 50mL, a los cuales se les adicionó 6mL de solución de NaOH al 20% en metanol y fue agitado y calentado cada beaker en baño de maria por 5 minutos. Se agregaron 8mL de BF3-metanol al 20% y esta mezcla se hizo hervir por 3 minutos, luego de enfriar a temperatura ambiente, se adicionaron 5mL de éter de petróleo y 3mL de solucón saturada de NaCl, descartando el precipitado formado y recuperando el sobrenadante, al cual le fue agregado sulfato de sodio para retirar agua residual. Finalmente, la fracción etérea resultante fue analizada por cromatografía gaseosa, en un cromatógrafo gaseoso Hewlett Packard HP 6890 Series equipado con una columna HP-20M, con 1mL/min de nitrógeno como fase móvil (Silva-Queiroz, 2006). 5.4. DETERMINACION MASA SECA CELULAR Se tomaron 10mL de cada cultivo y se centrifugaron 10min (10000rpm, 10oC). Se resuspendió el pellet en solución salina con Tween 0,1%m/v y nuevamente se centrifugó por 10min (10000rpm, 10oC); se suspendió en agua destilada y se filtró en membranas de poro 0,45µm (Millipore). La membrana junto con las células se secó por 4h a 100oC; luego de ser retiradas del horno, este conjunto permaneció 20min en desecador y, después de este período, se determinó la masa seca celular (MS) por la siguiente ecuación: MS = MMC − MM + UM x1000 VOL Ecuación 1: Determinación de masa seca. En donde: MMC: Masa de la membrana y células después del secado (g) MM: Masa de la membrana (g) UM: Humedad media del lote de membrana (g) VOL: Volumen de suspensión centrifugada (mL) 5.5. CARACTERIZACIÓN DEL POLÍMERO 5.5.1. Liofilización Se tomaron 10mL de cada cultivo y se centrifugaron 10min (10000rpm, 10oC). Se resuspendió el pellet en solución salina con Tween 0,1%m/v y nuevamente se centrifugó por 10min (10000rpm, 10oC); se suspendió en 2mL de agua destilada y fue congelado a -20oCpara su posterior liofilización, que fue realizada en un equipo Labconco modelo 5-75050/75150 con cámara de control de temperatura durante 24h (Silva-Queiroz, 2003). 5.5.2. Cantidad y composición del PHA Para determinar la cantidad y la composición del PHA, se realizó el método de propanólisis descrito por Riis y Mai (1988), en donde se tomaron 20mg de células liofilizadas, se les adicionaron 2mL de solución de ácido clorhídrico (HCl) 0,1N en propanol (1:4v/v), 2mL de 1,1-dicloroetano (solvente que extrae el polímero) y 200µL de solución de 40g/L de ácido benzoico en propanol, como patrón interno. Los tubos fueron cerrados, agitados y sometidos por 3 horas a 100oC en baño de María, agitándolos después de los primeros 30 minutos. Se enfriaron a temperatura ambiente y se adicionaron 4mL de agua Milli-Q, agitando vigorosamente por 30seg. La fase acuosa (superior) se descartó y la fase orgánica (inferior) que contiene los propil-ésteres fue analizada con un cromatógrafo gaseoso Hewlett Packard HP 6890 Series equipado con una columna HP-5 (Gomez et al., 1996), con ácido benzóico como patrón interno y polímeros producidos por P. oleovorans fueron utilizados como patrones externos (Silva-Queiroz, 2003). Para el análisis de monómeros conteniendo insaturaciones, especialmente en la región de 12 carbonos, se admitió el mismo factor de respuesta del componente saturado con 12 carbonos, es decir, el 3HDd. 6. RESULTADOS Y DISCUSIÓN 6.1 Determinación de la composición de los aceites vegetales Para confirmar la composición de los ácidos grasos contenidos en los aceites, estos fueron analizados por cromatografía gaseosa. Los resultados son presentados en la Tabla 3. Comparando las tablas 2 y 3, se puede observar que la composición de ácidos grasos obtenida para los aceites de algodón, arroz, coco, girasol, maíz, soya y palma, a pesar de no ser exactamente iguales a los datos de literatura, presentaron grande semejanza. Para el aceite de canola, se observó una grande diferencia entre los datos de la literatura y los resultados del análisis. Se esperaba encontrar un alto contenido de acido oleico (aproximadamente 50%) y un contenido de acido linoleico de 25%; sin embargo, la composición de ácidos grasos fue mucho mas semejante a aquella encontrada en el aceite de soya o maíz, es decir, cerca de 25% de ácido oleico y 50% de acido linoleico. En el aceite de linaza también se observó una diferencia significativa en la composición. Se esperaba cerca de 50-60% de acido linolénico, sin embargo, el análisis por cromatografía gaseosa reveló apenas cerca de 7%. Entretanto, el acido linoleico que debería corresponder a cerda del 15% fue detectado en concentraciones elevadas (cerca de 60%). Esta variación pudo ser causada por una alteración del aceite con otro aceite vegetal, o bien por el envejecimiento y la degradación oxidativa propia que sufre este aceite, provocando un aumento en el acido linoleico a partir de la oxidación del acido linolenico (Schönemann et. al., 2006) Para los aceites de mamona y tungue se esperaba encontrar dos componentes en cantidades elevadas que no estarían presentes en los demás aceites. En el caso del aceite de mamona, el pico más expresivo del análisis cromatográfico presentaba el mismo tiempo de retención el ácido linoleico. Así, fue interpretado que este pico correspondería al ácido ricinoléico, lo que impidió determinar la cantidad de ácido linoleico presente en la muestra. Adicional a ello, la cantidad de ácido ricinoléico detectada fue bastante menor que aquella esperada en la literatura, siendo detectado el ácido oleico en cantidades mucho mayores que las esperadas. En el caso de aceite de tungue, el pico más expresivo del análisis cromatográfico presentaba el mismo tiempo de retención del ácido linolénico. De esta manera, fue interpretado que este pico correspondería al ácido αeleosteárico, lo que impidió determinar la cantidad de ácido linolénico presente en la muestra. Otro punto a tener en cuenta es que la cantidad de acido αeleosteárico detectada fue bastante menor que la esperada con base en la literatura (aprox. 80%) (Schönemann et. al., 2006), siendo detectados los ácidos oleico y linoléico en cantidades mucho mayores que las esperadas. Estos resultados frustraron en parte la propuesta inicial que consistía en evaluar el PHA producido a partir de aceites vegetales con composición de ácidos grasos diferenciados. Aceites octanóico decanóico Algodón 0,00 0,00 Arroz 0,00 0,00 Canola 0,22 0,26 Coco 2,21 2,63 Girasol 0,00 0,00 Linaza 0,00 0,00 Mamona 0,00 0,00 Maíz 0,13 0,15 Palma 0,02 0,02 Soya 0,00 0,00 Tungue 0,00 0,00 Láurico 0,00 0,00 4,05 43,15 0,00 0,00 0,00 2,37 0,25 0,00 0,00 Composición de ácidos grasos de los aceites vegetales (% m/m) Mirístico Palmítico Esteárico Oleico Ricinoleico Linoleico Linolênico α-eleosteárico 0,27 14,64 3,78 21,77 0,00 55,08 4,46 0,00 0,00 16,79 3,96 36,99 0,00 39,77 2,49 0,00 1,55 11,60 3,97 20,65 0,00 51,32 6,38 0,00 16,32 9,68 3,71 18,94 0,00 3,33 0,04 0,00 0,08 8,95 4,16 20,70 0,00 62,42 3,70 0,00 0,00 11,29 3,26 21,29 0,00 57,30 6,86 0,00 0,00 10,66 6,55 27,74 49,71 ? 5,35 0,00 0,91 11,38 3,93 24,83 0,00 50,84 5,45 0,00 0,82 41,42 4,99 42,35 0,00 9,89 0,24 0,00 0,00 11,16 3,73 24,46 0,00 54,87 5,78 0,00 0,00 8,63 6,52 22,75 0,00 19,41 ? 42,69 Tabla 3: Composición de aceites vegetales obtenida por análisis de cromatografía gaseosa 6.2 Producción y composición de PHA Los resultados obtenidos de la producción de polihidroxialcanoato son presentados en las tablas 4 y 5, para P. putida IPT 046 y P. aeruginosa IPT171 respectivamente. Fue observado una acumulación mucho más expresiva por el linaje IPT 046 que por el linaje IPT 171. Mientras que P. putida IPT 046 alcanzó hasta 62% de PHA acumulado, los valores obtenidos con P. aeruginosa IPT 171 fueron inferiores a 20%. Con el objetivo de analizar las diferencias en la eficiencia de incorporación de monómeros por los linajes bacterianos, fue correlacionado el valor obtenido de cada monómero a partir de un mismo aceite vegetal o mezcla (Figura 8). Se observó una tendencia de incorporación más eficiente de 3HO y 3HDd en el linaje IPT 171 en comparación con la IPT 406 (Figura 8B y 8D). Por otro lado, el sistema de biosíntesis de PHA de éste último linaje fue más eficiente en la incorporación de 3HHx, 3HD y 3HDd∆6 (Figura 8A, 8D y 8F). Estos resultados son confirmados por el experimento realizado por Silva-Queiroz (2003), en donde el linaje IPT 171 acumuló hasta 35% de 3HO, mientras que en el linaje IPT 046 el PHA contenía mayor cantidad de 3HD (hasta 50%), confirmado también por los ensayos realizados por Ballisteri et al. (2001). Para el monómeros 3HD∆5 no se observó diferencia en la eficiencia de incorporación de estos monómeros por el sistema de biosíntesis de los dos linajes evaluados (Figura 8). En la figura 8-G, se observa una mayor eficiencia en la incorporación de monómeros insaturados por el sistema de biosíntesis de PHA de P. putida IPT 046, comparada con P. aeruginosa IPT 171. Al analizar la cantidad de 3HO y 3HD producido por estos dos linajes, ambos monómeros predominantes en el PHA producido por estas bacterias, se puede corroborar la observación que ha sido analizada en bastantes ocasiones, en la que sustratos no relacionados con PHAmcl, como glucosa, gluconato y glicerol, producen PHA con 3HO como principal constituyente (Solaiman et al., 2006). Los precursores para la biosíntesis de ácidos grasos vienen del Acetil-CoA generado de varios sustratos como carbohidratos. El Acetil-CoA es convertido a alonil-CoA, que es usado para alargar la cadena de carbonos del ácido graso en dos átomos (Sanchez et al, 2003); esta vía biosintética produce moléculas alifáticas de (R)-3-hidroxiacil-ACP que son convertidas a R-3-hidroxiacil-CoA por una transacilasa codificada por el gen phaG, que actúa como sustrato para la PHA polimerasa (Tobin y O’connor, 2005). En el PHA producido a partir de aceite de tungue por el linaje IPT 046, fue observado un pico próximo a la región con monómeros insaturados de 12 carbonos, no detectado en los PHA producidos en los otros aceites. Una vez que el aceite de tungue presentaría el ácido α-eleosteárico, este pico fue considerado correspondiente al propil éster 3-hidroxi-5,7-dodecenoato (3HDd∆5,7), que sería generado por la β-oxidación de este ácido graso. Este componente no fue detectado en el PHA producido por el linaje IPT 171. Xr PHA 3HB 3HHx 3HO 3HD 3HDd 3HDd∆5,7 3HDd∆5 3HDd∆6 (%MSC) (g/L) 0,9 5,0 22,6 45,3 9,1 0,0 3,1 14,0 48,63 1,49 0,8 5,6 23,7 48,8 8,1 0,0 3,6 9,4 43,20 3,07 0,9 5,1 23,7 49,1 10,7 0,0 2,8 7,8 40,40 2,37 0,4 4,8 24,8 44,8 15,6 0,0 2,8 6,8 19,81 3,21 0,6 5,6 26,8 49,1 16,0 0,0 1,5 0,4 56,70 2,16 1,3 6,5 25,8 47,4 6,2 0,0 2,8 9,9 36,20 3,35 1,0 5,6 24,0 47,3 6,9 0,0 3,4 11,7 26,06 2,92 1,1 6,8 27,5 45,7 6,4 0,0 3,2 9,3 44,08 2,46 1,0 6,4 25,8 47,0 6,8 0,0 3,3 9,6 42,67 3,32 0,9 6,4 25,8 46,1 7,2 0,0 3,5 10,1 45,84 2,69 0,9 6,1 24,9 46,4 7,1 0,0 3,9 10,7 46,89 2,75 1,0 6,5 26,4 46,9 6,2 0,0 3,3 9,7 45,32 2,76 0,9 6,3 25,9 46,8 6,2 0,0 3,5 10,5 41,59 2,96 1,3 6,9 31,4 53,9 3,0 0,0 1,6 N.D 41,54 1,79 1,3 6,2 25,0 45,7 8,3 0,0 3,4 10,1 41,91 2,62 0,6 4,9 24,2 49,8 9,3 0,0 3,5 7,7 62,19 2,00 1,3 8,6 28,9 46,2 7,9 0,0 2,5 4,6 25,45 3,73 0,7 5,8 26,2 50,2 12,6 0,0 2,1 2,4 49,12 2,61 0,7 5,8 25,7 51,0 13,1 0,0 1,8 1,9 52,34 2,52 1,0 6,2 25,0 46,0 7,2 0,0 3,5 11,0 42,88 1,73 0,2 4,2 22,5 48,1 8,1 5,5 8,4 2,9 17,57 2,70 Composición PHA (mol%) MSC – Masa Seca Celular; 3HB – 3-hidroxibutirato; 3HHx – 3-hidroxihexanoato; 3HO – 3-hidroxioctanoato; 3HD – 3-hidroxidecanoato; 3HDd – 3-hidroxidodecanoato; 3HDd∆5,7 – 3-hidroxi-5,7-dodecenoato; 3HDd∆5 – 3-hidroxi-5-dodecenoato; 3HDd∆6 – 3-hidroxi-6-dodecenoato. PHA – polihidroxialcanoato; Xr – biomasa residual. ACEITES Algodón Arroz50/Maiz50 Arroz Canola Coco Girasol80/Soya20 Girasol Linaza25/Algodón75 Linaza40/Algodón60 Linaza50/Algodón50 Linaza70/Algodón30 Linaza80Algodón20 Linaza Mamona Maiz Palma15/Canola85 Palma50/Soya50 Palma80/Mamona20 Palma Soya Tungue MSC (g/L) 2,90 5,40 3,97 4,00 4,98 5,25 3,95 4,39 5,78 4,96 5,18 5,05 5,06 3,06 4,51 5,28 5,00 5,12 5,29 3,02 3,27 Tabla 4: Producción de PHA por P. putida IPT 046 a partir de diferentes aceites vegetales y/o combinaciones de estos MSC (g/L) 2,58 2,69 2,49 4,61 2,40 2,61 2,69 2,66 2,43 2,58 2,72 2,72 2,67 2,19 2,03 2,30 3,28 4,07 2,73 4,97 2,96 Composición PHA (mol%) 3HB 3HHx 3HO 3HD 3HDd 3HDd∆5,7 3HDd∆5 0,00 2,33 0,88 3,60 33,27 45,64 9,86 0,83 3,28 30,51 48,96 9,46 0,00 3,16 0,76 3,49 28,14 50,65 11,32 0,00 2,69 0,00 4,24 34,36 44,57 9,68 0,00 2,47 1,05 4,87 44,07 35,02 14,99 0,00 0,00 0,88 3,75 30,69 46,73 9,06 0,00 3,28 0,94 3,72 35,11 43,57 9,95 0,00 1,47 1,01 4,46 40,47 35,84 9,83 0,00 1,91 1,11 4,90 38,65 35,72 9,72 0,00 3,18 2,28 4,31 38,55 37,51 10,30 0,00 1,55 0,00 4,87 34,95 41,67 9,22 0,00 3,31 0,00 5,06 35,35 42,93 10,55 0,00 1,35 1,12 4,38 38,92 37,53 9,19 0,00 2,87 0,00 4,87 29,07 38,32 18,56 0,00 3,59 0,00 3,88 33,39 49,17 9,39 0,00 2,82 0,76 3,63 35,12 41,24 11,90 0,00 3,11 0,77 3,73 33,64 46,67 10,99 0,00 2,10 0,64 3,24 31,30 50,01 12,62 0,00 1,62 0,00 4,12 37,14 41,89 13,88 0,00 1,42 0,00 3,70 30,12 50,85 9,23 0,00 2,52 1,09 5,30 29,38 42,43 6,05 0,00 9,80 3HDd∆6 4,42 3,80 2,96 4,69 0,00 5,59 5,25 6,49 6,71 5,51 5,98 4,76 5,99 5,60 1,35 4,23 2,08 0,56 1,56 3,58 5,95 %PHA (%MSC) 11,51 14,15 16,62 6,80 18,45 13,79 11,78 13,94 13,03 11,05 10,95 8,38 12,53 6,22 10,76 11,04 15,25 15,93 17,29 6,05 6,47 Xr (g/L) 2,29 2,31 2,08 4,30 1,96 2,25 2,38 2,29 2,12 2,30 2,43 2,50 2,34 2,06 1,81 2,05 2,78 3,42 2,26 4,67 2,77 MSC – Masa Seca Celular; 3HB – 3-hidroxibutirato; 3HHx – 3-hidroxihexanoato; 3HO – 3-hidroxioctanoato; 3HD – 3-hidroxidecanoato; 3HDd – 3-hidroxidodecanoato; 3HDd∆5,7 – 3-hidroxi-5,7-dodecenoato; 3HDd∆5 – 3-hidroxi-5-dodecenoato; 3HDd∆6 – 3-hidroxi-6-dodecenoato. PHA – polihidroxialcanoato; Xr – biomasa residual. ACEITES Algodón Arroz50/Maiz50 Arroz Canola Coco Girasol80/Soya20 Girasol Linaza25/Algodón75 Linaza40/Algodón60 Linaza50/Algodón50 Linaza70/Algodón30 Linaza70/Algodón30 Linaza80Algodón20 Linaza Mamona Palma15/Canola85 Palma50/Soya50 Palma80/Mamona20 Palma Soya Tungue Tabla 5: Producción de PHA por P. aeruginosa IPT 171 a partir de diferentes aceites vegetales y/o combinaciones de estos 3HHx (mol%) 10 9 8 7 6 5 4 3 2 1 0 0,0 3HO (mol%) B IPT046 IPT046 A 50 45 40 35 30 25 20 15 10 5 0 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 0 10,0 5 10 15 20 3HD (mol%) C 25 30 35 40 45 50 IPT171 IPT171 3HDd (mol%) D 20,0 60,0 15,0 40,0 IPT046 IPT046 50,0 30,0 10,0 20,0 5,0 10,0 0,0 0,0 10,0 20,0 30,0 40,0 50,0 0,0 0,0 60,0 IPT171 F 15,0 20,0 3HDd∆ ∆6 (mol%) 10 9 10 8 7 6 8 9 7 IPT046 IPT046 10,0 IPT171 3HDd∆ ∆5 (mol%) E 5,0 5 4 3 2 6 5 4 3 2 1 1 0 0 1 2 3 4 5 6 7 8 9 0 0,0 10 1,0 2,0 3,0 4,0 5,0 6,0 7,0 8,0 9,0 10,0 IPT171 IPT171 G 3HAInsaturados (mol%) 20,0 IPT046 15,0 10,0 5,0 0,0 0,0 5,0 10,0 15,0 20,0 IPT171 Figura 8: Comparación entre la composición de monómeros en los PHA sintetizados por P. putida IPT 046 y P. aeruginosa IPT 171 a partir de un mismo aceite vegetal El monómero 3-hidroxi-5-dodecenoato (3HDd∆5) es producido por la síntesis de novo de ácidos grasos (Huijberts et al., 1992), siendo normalmente detectado en los PHA producidos a partir de carbohidratos (Sanchez et. al., 2003), y también de otras fuentes de carbono que son metabolizadas a acetil-CoA, como gluconato, acetato y etanol (Rehm et. al., 2001). Para todas las muestras de aceite fue observada la presencia del monómero 3HDd∆5, probablemente proveniente de la síntesis de novo de ácidos grasos a partir del Acetil-CoA derivado de la β-oxidación de los ácidos presentes en los aceites, o de la oxidación del glicerol proveniente de los triglicéridos. En el PHA producido a partir de carbohidratos por P. putida IPT 046, fue detectado cerca de 4-5mol% de este monómero (Sanchez et al., 2003). Utilizando aceite de tungue, se observó un valor significativamente mayor de 3HDd∆5 tanto para el linaje IPT 046 como para el IPT 171, en comparación con los demás aceites; Este valor observado es mucho mayor del reportado a partir de carbohidratos como sustrato, lo que sugeriría la presencia de un ácido graso en el aceite de tungue que sería precursor de este monómero, una vez que la fracción molar obtenida no podría ser explicada considerando su síntesis solamente a partir del AcetilCoA resultante de la β-oxidación y de la oxidación del glicerol. Tsuzuki y colaboradores (2003) verificaron la presencia del ácido 9,11-octadecenóico en el hígado y lípidos plasmáticos de ratones alimentados con ácido α-eleosteárico; si esa conversión también ocurriera en bacterias, la metabolización subsiguiente del ácido 9,11-octadecenóico por el ciclo de la β-oxidación llevaría a la formación del monómero 3HDd∆5. 6.3 Influencia del pH De acuerdo a lo propuesto anteriormente por Gomez et. al., (1997), el pH ideal que favorece tanto el crecimiento como la acumulación por bacterias productoras de PHA está en el orden de 7, por lo cual el pH inicial de todos los medios de cultivo para la acumulación de PHA fue ajustado a este valor. Después de 72h de cultivo, se midió la variación de pH. Los resultados están presentados en la Tabla 6 Tabla 6: Variación del pH luego de 72h de cultivo LINAJE ACEITE Y/O MEZCLA IPT171 IPT046 Soya 4,896 6,512 Canola 4,097 6,527 Arroz 4,606 6,532 Palma 4,779 6,543 Linaza 6,142 6,476 Girasol 5,021 6,668 Mamona 4,979 6,446 Algodón 4,892 6,503 6,442 Palma80/Mamona20 4,738 Arroz50/Maiz50 4,643 7,267 Palma15/Canola85 4,980 6,606 Palma50/Soya50 4,940 6,219 Girasol80/Soya20 4,644 7,288 Linaza25/Algodón75 5,304 6,563 Linaza40/Algodón60 5,288 6,392 6,326 Linaza50/Algodón50 5,154 Linaza70/Algodón30 5,146 6,387 Linaza80Algodón20 5,138 5,360 Tungue 6,638 6,493 Coco 5,960 6,572 Maiz 4,715 6,503 Se observa que todos los cultivos de P. aeruginosa IPT171 presentaron un descenso mayor en el pH comparados con los cultivos de P. putida IPT046. Esto pudo repercutir en la formación de PHA, lo que se puede inferir por las bajas concentraciones de polímero acumulado por el linaje IPT 171, puesto que en el ensayo realizado por Silva-Queiroz (2003), se acumuló hasta 23% de PHA con este linaje, cuando el pH bajó hasta 5,7, mientras que en este ensayo la media de pH es de 5,083. El descenso del pH puede ser atribuido al consumo de los iones de amonio, bien como al metabolismo de los ácidos grasos libres provenientes de la ruptura de los triglicéridos por acción de las lipasas bacterianas (Romero, 2006). A pesar de poder tener un elevado consumo de las fuentes te carbono y nitrógeno, probablemente los valores de PHA y biomasa totales alcanzados podrían haber sido mayores si el pH y otros factores que son difíciles de controlar en frascos agitados hubiesen sido mantenidos en niveles más adecuados, como acontece en biorreactores. Con respecto al linaje IPT 046, el pH también tuvo un ligero descenso en comparación con el ensayo anterior realizado por Silva-Queiroz (2003), aunque se observó una mayor acumulación de polímero en el presente ensayo. Probablemente las PHA sintasas en este linaje actúan bajo un pH mas ácido, lo que favoreció la producción del polímero en mayores cantidades. 6.4 Modulación en la composición del polímero producido Con el objetivo de verificar la posibilidad de modular la composición del PHA producido a partir de diferentes aceites o combinaciones de estos, fue correlacionada la cantidad de ácidos dada y la composición del PHA obtenido para los dos linajes (Figuras 9 a 14) Se obtuvo una correlación linear entre la concentración de ácido linoléico suplida y la fracción molar de 3HDd∆6, tanto para P. putida IPT046 como para P. aeruginosa IPT171 (Figuras 9 y 12), siendo que en media, el linaje IPT 046 se mostró mas eficiente (el doble de eficiencia) en la incorporación de 3HDd∆6 a partir de las mismas cantidades de ácido linoléico adicionadas, con base en los coeficientes angulares de ajuste de las rectas. Experimentos anteriores de acúmulo de PHA por P. putida IPT 046 realizados por Silva-Queiroz (2003), revelaron que la fracción molar de 3HDd∆6 en el PHA acumulado varió con la cantidad de ácido linoléico adicionada como fuente de carbono, hasta alcanzar un valor constante de 15mol%, alcanzado con la administración de 2,5g/L de ácido, no aumentando la cantidad del monómero al incrementar los gramos de acido (hasta 5g/L). En el presente ensayo, considerando la composición de ácidos grasos presentes en los aceites vegetales, fueron realizados experimentos en los cuales se adicionó hasta 5g/L de ácido linoléico; se observó una variación aproximadamente linear de la fracción molar de este monómero con relación a la cantidad de acido adicionada, alcanzando hasta 14mol% de 3HDd∆6. una vez que, el acido linoleico debe ser inicialmente liberado del triglicérido para luego ser utilizado por la célula, se tiene un sistema dinámico de liberación de ácidos grasos y consumo de estos, que son factores que determinan la concentración de este acido en el medio de cultivo. Así, a pesar de haberse administrado hasta 5g/L en forma de triglicéridos en el aceite vegetal, la concentración de ácido linoléico disponible para la célula a lo largo del cultivo podo haber sido muy inferior a ese valor. También fue obtenida una correlación linear al analizar la presencia de monómeros insaturados y los ácidos precursores de estos monómeros incorporados en los aceites (Figuras 10 y 13). Por tanto, la cantidad de monómeros insaturados pudo ser modulada en función del aceite vegetal suministrado, obteniendo PHA con valores de 0 a 17mol% de estos monómeros. Asimismo, se analizó la correlación entre la cantidad de ácidos grasos precursores de monómeros saturados suministrados e la fracción molar de monómeros observados (Figuras 11 y 14). Inicialmente, se observa un aumento prácticamente linear en la cantidad de monómeros saturados a medida que se adicionan más ácidos grasos precursores. Sin embargo, hay una tendencia a la estabilización en el valor de 97-98mol%. Este resultado era esperado, una vez que la formación de 3HDd∆5 por la biosíntesis de ácidos grasos esta siempre contribuyendo para la composición del PHA sintetizado. Todos los datos presentados refuerzan la posibilidad de modular el PHA sintetizado a partir de aceites vegetales o ácidos grasos. Como fue escrito anteriormente, la posibilidad de modular estos polímeros aumenta su aplicabilidad, una vez que las propiedades físicas son diferenciadas por su composición. 16 14 y = 0,0007x + 0,1765 R2 = 0,8531 3HDd 6 (mol%) 12 10 8 6 4 2 0 0 5000 10000 15000 20000 ácido linoleico (µmol/L) Figura 9: Correlación entre la concentración de ácido linoléico suministrada y la fracción molar de 3HDd∆6 detectado en el PHA producido por P. putida IPT 046. 18 Monômeros Insaturados (mol%) 16 y = 0,0007x + 1,422 R2 = 0,8715 14 12 10 8 6 4 2 0 0 5000 10000 15000 20000 25000 Ac. Graxos Insaturados (µmol/L) Figura 10: Correlación entre la concentración de ácidos grasos precursores de monómeros insaturados y la fracción molar de estos en el PHA producido por P. putida IPT 046. Monomeros saturados (mol%) 100 95 90 y = 12,078Ln(x) - 27,792 R2 = 0,854 85 80 10000 15000 20000 25000 30000 35000 40000 Ac. graxos saturados (µmol/L) Figura 11: Correlación entre la concentración de ácidos grasos precursores de monómeros saturados y la fracción molar de estos en el PHA producido por P. putida IPT 046. 16 14 y = 0,0003x + 0,808 R2 = 0,5821 3HDd ∆6 (mol%) 12 10 8 6 4 2 0 0 5000 10000 15000 20000 Ac. Linoleico (µmol/L) Figura 12: Correlación entre la concentración de ácido linoléico suministrada y la fracción molar de 3HDd∆6 detectado en el PHA producido por P. aeruginosa IPT 171. 18 Monômeros Insaturados (mol%) 16 y = 0,0004x + 1,3767 14 R20,5695 = 12 10 8 6 4 2 0 0 5000 10000 15000 20000 25000 Acidos Graxos Insaturados (µmol/L) Figura 13: Correlación entre la concentración de ácidos grasos precursores de monómeros insaturados y la fracción molar de estos en el PHA producido por P. aeruginosa IPT 171. 100 Monômeros saturados (mol%)) y = 7,2522Ln(x) + 23,138 R 20,5841 = 95 90 85 80 0 5000 10000 15000 20000 25000 30000 35000 40000 Acidos Graxos saturados (µmol/L) Figura 14: Correlación entre la concentración de ácidos grasos precursores de monómeros saturados y la fracción molar de estos en el PHA producido por P. aeruginosa IPT 171. 6.5 Análisis de Flujos Metabólicos Para comprender mejor el metabolismo de los ácidos grasos administrados al cultivo y su posterior incorporación en la síntesis de PHA, se esquematizó el flujo metabólico en la Figura 15. Figura 15: Representación del análisis de flujo metabólico de los aceites vegetales y su incorporación al PHA. 1: µmoles de ácidos grasos suministrados. 2: Intermediarios exclusivos de la β-oxidación de ácidos grasos. 3: µmoles de Acil-CoA teóricos resultantes de la β-oxidación. 4: Intermediarios formados de condensación de AcetilCoA provenientes de la β-oxidación. 5: µmoles Acetil-CoA no utilizado para la formación de monómeros; 6: µmoles de Acetil-CoA usado para la biosíntesis de novo de ácidos grasos. 7: µmoles de Acetil-CoA utilizado para respiración y formación de biomasa. 8: µmoles de Acetil-CoA convertidos a CO2 por el Ciclo de Krebs. 9: µmoles de Acetil-CoA resultantes de la oxidación del glicerol. El análisis de flujos metabólicos fue realizado para cada uno de los cultivos realizados con los dos linajes bacterianos e con los diferentes aceites vegetales suministrados. Las concentraciones de los ácidos grasos adicionados fueron estimadas con base en la composición de los ácidos grasos de los aceites vegetales, que fue obtenida mediante el análisis realizado por cromatografía gaseosa de metilésteres. El análisis por cromatografía gaseosa determino la cantidad de cada uno de los monómeros formados. Monómeros obtenidos exclusivamente a partir de la β-oxidación de ácidos grasos (3HDd∆6 y 3HDd∆5,7) o de la biosíntesis de ácidos grasos (3HDd∆5) fueron fácilmente detectados. Para los monómeros que pueden ser producidos tanto a partir de la β-oxidación como por la biosíntesis de ácidos grasos (3HHX, 3HO, 3HD y 3HDd), con el objetivo de cuantificar la contribución de cada una de esas vías metabólicas en la formación de esos monómeros, fue utilizado el siguiente criterio: se admitió que las cantidades de 3HHX, 3HO, 3HD, 3HDd y 3HDd∆5 producidos por la síntesis de novo guardan la proporción 3:20:70:3:4; o sea, guardan la misma proporción obtenida cuando únicamente la biosíntesis de ácidos grasos contribuye con los monómeros para la biosíntesis de PHA, como por ejemplo son suministrados carbohidratos como fuente de carbono (Sanchez et al., 2003). Así, los monómeros derivados de la boxidación de ácidos grasos fueron estimados considerando la diferencia entre aquellos que habrían sido provenientes de la biosíntesis de ácidos grasos e el total de monómeros detectados por cromatografía gaseosa. Ese criterio utilizado se mostró inadecuado, pues, en la mayoría de los casos, la cantidad de monómeros que serían obtenidos por la biosíntesis de ácidos grasos (con base en la cantidad de 3HDd∆5 detectado) fue superior al total de monómeros detectados por la cromatografía gaseosa. En otras palabras, la síntesis de monómeros a partir de la biosíntesis de ácidos grasos no ocurre de la misma forma en la síntesis de PHA a partir de aceites vegetales que cuando una fuente de carbono que utiliza exclusivamente esa vía metabólica es suministrada; de esta forma, no fue posible establecer la contribución de cada una de las vías metabólicas (β-oxidación y síntesis de novo de ácidos grasos) para la biosíntesis de PHA. En las tablas 7 y 8 se puede observar la incorporación de 3HDd∆6 por los dos linajes estudiados. Con estas tablas se puede inferir que la ruta de la β-oxidación contribuyó en la formación de monómeros, puesto que, este monómero es obtenido exclusivamente a través de esta vía metabólica (Tabla 1). El porcentaje de conversión de este ácido a 3HDd∆6 alcanzó un máximo de %YP/S de 28%. Esto indica que la mayor cantidad de ácido linoléico fue metabolizado eficientemente por la β-oxidación, no permitiendo de esta manera su incorporación como 3HDd∆6; el porcentaje de conversión del ácido linoléico a este monómero fue mucho menor por el linaje IPT171 (Tabla 8), lo que pudo ser causado por el descenso del pH en el medio de cultivo, lo cual debió haber impedido la metabolización eficiente de ese substrato por ese linaje bacteriano Tabla 7: Producción de 3HDd∆6 por Pseudomonas putida IPT 046 a partir de ácido linoléico Aceite Vegetal y/o Mezcla Algodón Arroz50/Maiz50 Arroz Canola Coco Girasol80/Soya20 Girasol Linaza25/Algodón75 Linaza40/Algodón60 Linaza50/Algodón50 Linaza70/Algodón30 Linaza80Algodón20 Linaza Mamona Palma15/Canola85 Palma50/Soya50 Palma80/Mamona20 Palma Soya Tungue Maiz Ac. Linoleico (µ µmol/L) 15917,02 13102,04 11506,88 14819,46 940,97 17631,77 18069,14 14758,72 14063,73 13600,41 12673,76 12210,44 11283,79 0,00 13024,69 9368,32 2283,46 2854,33 15882,30 5618,28 14697,19 3HDd∆ ∆6 (µ µmol/L) 1183,35 1331,04 755,16 324,31 144,86 2629,76 727,34 2536,04 3315,79 3208,49 3594,93 3109,19 1344,98 152,90 1526,00 835,44 374,49 315,04 868,48 100,73 1166,71 %YP/S: Porcentaje del Rendimiento producto-sustrato %YP/S 7,43 10,16 6,56 2,19 15,40 14,91 4,03 17,18 23,58 23,59 28,37 25,46 11,92 0,00 11,72 8,92 16,40 11,04 5,47 1,79 7,94 Tabla 8: Producción de 3HDd∆6 por Pseudomonas aeruginosa IPT 171 a partir de ácido linoléico Aceite Vegetal y/o Mezcla Algodón Arroz50/Maiz50 Arroz Canola Coco Girasol80/Soya20 Girasol Linaza25/Algodón75 Linaza40/Algodón60 Linaza50/Algodón50 Linaza70/Algodón30 Linaza80Algodón20 Linaza Mamona Palma15/Canola85 Palma50/Soya50 Palma80/Mamona20 Palma Soya Tungue Ac. Linoleico (µ µmol/L) 15917,02 13102,04 11506,88 14819,46 940,97 17631,77 18069,14 14758,72 14063,73 13600,41 12673,76 12210,44 11283,79 N.D 13024,69 9368,32 2283,46 2854,33 15882,30 5618,28 3HDd∆ ∆6 (µ µmol/L) 80,81 88,58 74,72 90,45 0,00 121,69 102,83 150,24 132,39 98,57 109,75 124,87 44,90 18,26 66,20 64,25 22,15 45,60 65,77 69,68 %YP/S: Porcentaje del Rendimiento producto-sustrato %YP/S 0,51 0,68 0,65 0,61 0,00 0,69 0,57 1,02 0,94 0,72 0,87 1,02 0,40 N.D 0,51 0,69 0,97 1,60 0,41 1,24 7. • CONCLUSIONES Aceites vegetales con diferentes composiciones de ácidos grasos fueron suministrados tanto para P. aeruginosa IPT171 como para P. putida IPT046. Se verificó que la composición del PHA depende tanto de la especie bacteriana como de los ácidos grasos proporcionados. • Se corroboró que el linaje P. putida IPT 046 es mas eficiente en la acumulación de PHA, alcanzando un 62% del monómero en la biomasa generada, comparado con el linaje P. aeruginosa IPT 171, que alcanzó hasta un 20%; se determinó también que el pH es un factor importante en la actividad enzimática de los linajes estudiados y por ende en la formación del PHA, puesto que el linaje IPT 171 acidificó en mayor cantidad el medio y produjo menos PHA, comparado con el linaje IPT 046 • En la síntesis de 3HDd∆6, se observó una correlación linear entre la cantidad de ácido linoleico abastecida y la fracción molar acumulada de este monómero. Sin embargo, menos que 28% de este acido fue efectivamente incorporado en forma de este monómero, indicando un bajo potencial en la incorporación de 3HDd∆6 por el sistema de biosíntesis de PHA de las dos bacterias evaluadas. • Se determinó que en los dos linajes bacterianos se usaron las dos vías metabólicas para la formación de monómeros constituyentes del PHA, cuando son cultivados en diversos ácidos grasos; la síntesis de novo de ácidos grasos se detectó por la cantidad de 3HDd∆5 detectado, y la presencia de la β-oxidación por la existencia de 3HDd∆6. • A pesar de las divergencias entre las concentraciones de ácidos grasos detectadas y las esperadas de acuerdo con la literatura, la matriz fue parcialmente usada, como una extrapolación de los posibles resultados obtenidos; esto pudo observarse al analizar la cantidad de ácido linoléico que fue incorporada al polímero en forma de 3HDd∆6, y en la cantidad de ácido αeleosteárico convertido a 3HDd∆5,7, aunque determinados ácidos grasos no produjeron los monómero o no fueron detectados, como en el caso del aceite de mamona. • El modelo usado para detectar la presencia de monómeros provenientes de la biosíntesis de ácidos grasos no se adapta a las exigencias del ensayo anterior, puesto que se detectaron menores cantidades de monómeros producidos que los calculados. • Se lograron producir monómeros con conformaciones especiales que pueden hacer factible la modificación química del polímero y su mejoramiento de las características físicas, puesto que los linajes empleados tomaron intermediarios de la β-oxidación para su incorporación, como cadenas con dobles enlaces carbono-carbono; sin embargo, se notó una deficiencia en la incorporación de monómeros a partir del ácido ricinoléico presente en el aceite de mamona, probablemente a que fue metabolizado por otras vías que impidieron su incorporación a partir de la β-oxidación. 8. • RECOMENDACIONES Se recomienda realizar una caracterización del PHA producido a partir de aceites vegetales que representen extremos diferentes, bien como puntos centrales, en su composición de ácidos grasos, para visualizar la formación de PHA con constitución monomérica diferente y más evidente. • Se recomienda realizar un análisis de resonancia magnética junto con la cromatografía gaseosa, para lograr determinar con mayor exactitud los picos correspondientes a los monómeros con instauraciones. • Se recomienda evaluar el modelo utilizado para la determinación de monómeros conformacionales provenientes de la biosíntesis de ácidos grasos, puesto que el usado presentaba valores teóricos mayores de estos monómeros que los detectados por cromatografía gaseosa. • Se recomienda analizar la cantidad de aceite vegetal no consumido después del tiempo de fermentación, según el método descrito por Kahar et al. (2004), para evaluar la cantidad de aceite asimilada por el microorganismo. 9. REFERENCIAS BIBLIOGRAFICAS ALMEIDA, A.; RUIZ, J.; LOPEZ, N.; PETTINARI, J. 2004. Bioplásticos: una alternativa ecológica. Revista QuímicaViva, 3,3. <http://www.quimicaviva.qb.fcen.uba.ar> [Recurso Electrónico]. [Consulta: enero 2006] ANDERSON, A.; DAWES, E. 1990. Occurrence, metabolism, metabolic role and industrial uses of bacterial polyhydroxyalkanoates. Microbiological Reviews. 5,4: 450-472 AKIYAMA, M.; TSUNGE, T.; DOI, Y. Enviromental life cycle compararison of polyhydroxyalkanoates produced from renewable carbon resources by bacterial fermentation. Polymer Degradation and Stability, 80:183-194. BALLISTRERI, A.; GIUFFRIDA, M.; GUGLIELMINO, S.P.P.; CARNAZZA, S.V.; FERRERI, A.; IMPALLOMENI, G. 2001. Biosynthesis and structural characterization of medium-chain-length poly(3-hydroxyalkanoates) produced by Pseudomonas aeruginosa from fatty acids. International Journal of Biological Macromolecules 29: 107-114 BLACK, P.; DiRUSSO, C. 1994. Molecular and biochemical analyses of fatty acid transport, metabolism, and gene regulation in Escherichia coli. Biochimica et Biophysica Acta 1210: 123-145 BRAUNEGG, G.; SONNLEITNER, B.; LAFFERTY, R.M. 1978. A Rapid Gas Chromatographic Method for the Determination of Poly-β-hydroxybutyric Acid in Microbial Biomass. European Journal of Applied Microbiology and Biotechnology. 6:29-37 CASTRO, N.; RENDON, M. 2003. Aislamiento, caracterización y evaluación de Actinomycetes nativos colombianos como productores de polihidroxialcanoatos. Trabajo de Pregrado Microbiología Industrial. Pontificia Universidad Javeriana. Bogotá, Colombia. 74 pp. CHOI, J.; LEE, S. 1999. Factors affecting the economics of polyhydroxyalkaoate production by bacterial fermentation. Appl. Microbiol. Biotechnol. 51: 13-21 COSTA, V. R. 1995. Plásticos: a caminho da reciclagem. Ciência Hoje, 18.107:9-15. GOMEZ, J.G.C. 2006. Instituto de Ciências Biomédicas, Universidade de São Paulo, Brasil. Comunicación personal. E-mail: [email protected] GOMEZ, J. G. C.; BUENO-NETTO. 2001. Produção de poliésteres bacterianos. En: LIMA, U. A.; AQUARONE, E.; BORZANI, W.; SCMIDELL, W. (Ed.). Biotecnologia Industrial, Editora Edgard Blücher, São Paulo, Brasil. Pp. 219-248. GOMEZ, J.G.C.; RODRIGUES, M.F.A.; ALLI, R.C.P.; TORRES, B.B.; BUENONETO, C.L.; OLIVEIRA, M.S.; SILVA, L. F. 1996. Evaluation of soil gramnegative bacteria yielding polyhydroxyalkanoic acids from carbohydrates and propionic acid. App. Microbiol. Biotechnol. 45: 785-791 GOMEZ, J. G. C.; FONTOLAN, V.; ALLI, R. C. P.; RODRIGUES, M. F. A.; BUENO-NETTO, C. L.; SILVA, L. F.; SIMÕES, D. A. 1997. Production of P3HBco-3HV by soil isolated bacteria able to use sucrose. Reviews Microbiology, 1:43-48,. HASSAN, M. K.; ABOU-HUSSEIN, R.; ZHANG, X. J.; MARK, J. E.; NODA, I. 2006. Biodegradable copolymers of 3-hydroxybutyrate-co-3hydroxyhexanoate (Nodax™), including recent improvements in their mechanical properties. Molecular Crystals and Liquid Crystals, 447: 341-362 HAZENBERG, W.; WITHOLT, B. 1997. Efficient production of medium-chainlength poly(3-hydroxyalkanoates) from octane by Pseudomonas oleovorans: economic considerations. App. Microbiol Biotechnol., 48: 588-596 HOFFMANN, N.; REHM, B. 2004. Regulation of polyhydroxyalkanoate biosynthesis in Pseudomonas putida y Pseudomonas aeruginosa. FEMS Microbiology Letters 237: 1-7 HUIJBERTS, G.N.M.; EGGINK, G.; DE WAARD, P.; HUISMAN, G.W.; WITHOLT, B. 1992. Pseudomonas putida KT2442 cultivated on glucose accumulates poly(3-hydroxyalkanoates) consisting of saturated and unsaturated monomers. Applied and Environmental Microbiology, 58: 536-544 KAHAR, P.; TSUGE, T.; TAGUCHI, K.; DOI, Y. 2004. High yield production of polyhydroxyalkanoates from soybean oil by Ralstonia eutropha and its recombinant strain. Polymer Degradation and Stability, v. 83, Pp. 79-86. KESSLER, B.; PALLERONI, J. 2000. Taxonomic implications of synthesis of an Poly-β-hydroxybutyrate pseudomonads. other International Poly-β-hydroxyalkanoates Journal of Systematic and by aerobic Evolutionary Microbiology 50: 711-713 KHANNA, S.; SRIVASTAVA, A. 2005. Recent advances in microbial polyhydroxyalcanoates. Process Biochemistry 40: 607-619 KIM, D.Y.; KIM, Y.B.; RHEE, Y.H. 2000. Evaluation of various carbon substrates for the biosynthesis of polyhydroxyalkanoates bearing functional groups by Pseudomonas putida. International Journal of Biological Macromolecules 28: 2329 KIM, Y.; LENZ, R. 2001. Polyesters from microorganisms. En: SCHEPER, Th. (Ed). Advances in Biochemical Engineering/Biotechnology, Vol. 71. SpringerVerlag. Berlin. Pp: 52-74 LEE, E.Y.; CHOI, C.Y 1995. Gas chromatography-mass spectrometric analysis and its application to a screening procedure for novel bacterial polyhydroxyalkanoic acids containing long chain saturated and unsaturated monomers. Journal of fermentation and bioengineering. 80,4: 408-414 LEE, H-J; CHOI, M.; KIM, T-U.; YOON, S. 2001. Accumulation of Polyhydroxyalkanoic Acid Containing Large Amounts of Unsaturated Monomers in Pseudomonas fluorescensBM07 Utilizing Saccharides and Its Inhibition by 2Bromooctanoic Acid. Applied And Environmental Microbiology, 67,11: 4963-4974 LEMOS, P.; SERAFIM, L.; REIS, M. 2006. Synthesis of polyhydroxyalkanoates from different short-chain fatty acids by mixed cultures submitted to aerobic dynamic feeding. Journal of Biotechnology 122: 226-238 LENZ R.; MANCHESSAULT, R. 2005. Bacterial Polyesters: Biosynthesis, Biodegradable Plastics and Biotechnology. Biomacromolecules 6,1. MADISON, L.; HUISMAN, G. 1999. Metabolic Engeneering of Poly(3Hydroxyalkanoates): From DNA to Plastic. Microbiology and molecular biology reviews, 63,1: 21-53. MARCHESSAULT, R.H, 1996. Tender morsels for bacteria: recent developments in microbial polyesters. Trends in Polymer. Science, 4,5: 163–168. MINISTERIO DE ENERGIA Y PETROLEO, GOBIERNO BOLIVARIANO DE VENEZUELA. Precios del Petróleo <http://www.mem.gob.ve/preciopetroleo/index.php> [Recurso Electrónico]. [Consulta: Diciembre 2006] MONTIE, T (Editor). 1998. Pseudomonads – Biotechnology Handbooks 10. Plenum Press, New York. United Status of America. Pp: 271-313 MORENO, A.; RIOS, M. 1995 Optimización de las condiciones de crecimiento microbianas en la producción de un biofertilizante obtenido a partir de subproductos de la Industria Licorera de Caldas. Trabajo de pregrado. Pontificia Universidad Javeriana. NODA, I.; BOND, E.C. 2002. Polyhydroxyalkanoate copolymer and polylactic acid polymer composition or laminate films. US Pattent 2002143136. NODA, I.; GREEN, P.R.; SATKOWSKI, M.M.; SCHETCHTMAN, L.A. Preparation and properties of a novel class of polyhydroxyalkanoate copolymers. Biomacromolecules, 6:580-586 NODA, I.; SATKOWSKI, M.M. 2003. Agricultural items and agricultural methods comprising biodegradable copolymers. US Patent 2003143261. NONATO, R. V.; MANTELATTO, P. E.; ROSSELL, C. E. V. 2001. Integrated production of biodegradable plastic, sugar and ethanol. Applied Microbiology Biotechnology, 57:1-5 POIRIER, Y.; ERARD, N.; PETÉTOT, J.M-C. 2001. Synthesis of polyhydroxyalkanoate in the peroxisome of Saccharomyces cerevisiae by using intermediates of fatty acid b-oxidation. Applied and Environmental Microbiology, 67,11: 5254-5260. RHEM, B.; KRÜGER, N.; STEINBÜCHEL, A. 1998. A new metabolic link between fatty acid de novo synthesis and polyhydroxyalkanoic synthesis. Journal Biol. Chem., 273: 24044-24051. REHM, B.; MITSKY, T.; STEINBÜCHEL, A. 2001. Role of Fatty Acid De Novo Biosynthesis in Polyhydroxyalkanoic Acid (PHA) and Rhamnolipid Synthesis by Pseudomonads: Establishment of the Transacylase (PhaG)-Mediated Pathway for PHA Biosynthesis in Escherichia coli. Applied And Environmental Microbiology, 67.7:3102-3109 RIIS, V.; MAI, W. 1988. Gas chromatography determination of poly-βhydroxybutyric acid in microbial biomass after hydrochloric acid propanolysis. J. Chromatogr 445:285–289 ROMERO, C. 2006. Estudo da Biossíntese de Poli-3-hidroxibutirato (P3HB) a partir de Óleo de Soja. Trabajo de Pos-grado, Maestría en Biotecnologia. Instituto de Ciências Biomédicas, Universidade de São Paulo, São Paulo, Brasil, 111pp. SANCHEZ, R.J.; SCHRIPSEMA, J.; SILVA, L.F.; TACIRO, M.K.; PRADELLA, J.G.C.; GOMEZ, J.G.C. 2003. Medium-chain-length polyhydroxyalkanoic acids (PHAmcl) produced by Pseudomonas putida IPT 046 from renewable sources. European Polymer Journal 39: 1385-1394 SCHÖNEMANN, A.; WOLFGANG, F.; UNGER, A.; KENNDLER, E. 2006. An investigation of the fatty acid composition of new and aged tung oil. Studies in Conservation, 51:99-110 SCHULZ, H.; KUNAU, W-H. 1987. Beta-oxidation of unsaturated fatty acids: a revised pathway.Trends Biochem. Sci. 12: 403-406 SILVA-QUEIROZ, S.R.A. 2003. Biossíntese de polihidroxialcanoatos de cadeia meia (PHAMCL) por bactérias a partir de óleos vegetais. Trabajo de Pos-grado, Maestria en Biotecnologia. Interunidades en Biotecnologia USP – IPT – I. Butantan. São Paulo, Brasil. 99 pp. SILVA-QUEIROZ, S.R.A. 2006. Instituto de Pesquisas Tecnológicas do Estado de São Paulo, Brasil. Comunicación personal. E-mail: [email protected]. SOLAIMAN, D.; ASHBY, R.; HOTCHKISS, A.; FOGLIA, T. 2006. Biosynthesis of medium-chain-length poly(hydroxyalkanoates) from soy molasses. Biotechnology Letters, 28: 157–162 STEINBÜCHEL, A.; HEIN, S. 2001. Biochemical and Molecular Basis of Microbial Synthesis of Polyhydroxyalkanoates in Microorganisms. En: SCHEPER, Th. (Ed). Advances in Biochemical Engineering/Biotechnology, Vol. 71. Springer-Verlag. Berlin. Pp: 82-116 STEINBÜCHEL, A.; VALENTIN, H.E. 1995. Diversity of bacterial polyhydroxyalkanoic acids. FEMS Microbiology Letters. 128:219–228. STRYER, L. 1998. Bioquímica. Cuarta Edición. Editorial Reverté, S.A. Barcelona. Pp: 606-610. SUDESH, K.; ABE, H.; DOI, Y. 2000. Synthesis, structure and properties of polyhydroxyalkanoate: biological polyesters. Prog. Polym Sci, 25:1503-1555. THAKOR, N.; TRIVEDI, U.; PATEL, K.C. 2005. Biosynthesis of medium chain length poly(3-hydroxyalkanoates) (mcl-PHAs) by Comamonas testosteroni during cultivation on vegetable oils. Bioresource Technology 96:1843-1850 TOBIN, K.; O’CONNOR, K. 2005 Polyhydroxyalkanoate accumulating diversity of Pseudomonas species utilising aromatic hydrocarbons. FEMS Microbiology Letters 253: 111–118 TSUTZUKI, T.; IGARASHI, M.; KOMAI, M.; MIYAZAWA, T. 2003. The metabolic conversion of 9,11,13-eleostearic acid (18:3) to 9,11-conjugated linoleic acid (18:2) in the rat. Journal of Nutritional Science and Vitaminology, 49: 195-205 VIEIRA, F.C.V.; PIERRE, C.T.; CASTRO, H.F. 2005. Influência da composição em ácidos graxos de diferentes óleos vegetais nas propriedades catalíticas de uma preparação comercial de lípase pancreática. Faculdade de Engenharia Química de Lorena. VI Congresso Brasileiro de Engenharia Química em Iniciação Científica. WILLIAMS, S (Editor), 1984. AOAC-IUPAC method. Fatty acids in oils and fats preparation of methyl esters. Final action, Boron trifluoride method. Official Methods of Analysis of the Association of Official Analytical Chemists, Arlington, Canada. P. 513. WHITE, D. 2000 The physiology and biochemistry of prokariotes, 2nd Ed. Oxford University Press. 10. ANEXOS ANEXO 1. MEDIOS DE CULTIVO EMPLEADOS 1. Agar Nutriente Componente Extrato de carne Peptona bacteriológica Ágar bacteriológico Concentración (g/L) 3 5 20 2. Medio mineral (Ramsay et. al., 1990) Componente (NH4)2SO4 Na2HPO4 KH2PO4 Concentración (g/L) 1 3,5 1,5 MgSO4.7H2O 0,2 CaCl2.2H2O 0,01 Citrato férrico amoniacal 0,06 Solución elementos trazos 1mL/L 3. Solución de elementos trazos Componente H3BO3 CoCl2..6H4O ZnSO4.7H2O MnCl2.4H2O Concentración (g/L) 0,3 0,2 0,1 0,03 NaMoO4.2H2O 0,03 NiCl2.6H2O 0,02 CuSO4.5H2O 0,01