Obstrucción del bronquio principal derecho en una paciente
Anuncio

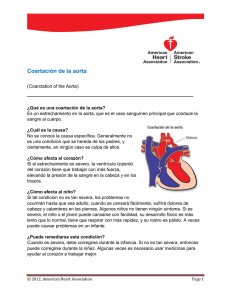
(Rev. Esp. Anestesiol. Reanim. 2006; 53: 315-318) CASO CLÍNICO Obstrucción del bronquio principal derecho en una paciente intubada con un tubo de doble luz izquierdo para cirugía de la aorta torácica J. Valdivia, M. Ferrá, P. Moyano, P. Garrido* Servicio de Anestesiología, Reanimación y Terapia del dolor. Hospital Universitario Son Dureta. Palma de Mallorca. Resumen Una mujer de 29 años, portadora de una prótesis tubular en la aorta torácica tras haber sido operada de un aneurisma aórtico postcoartación, fue reintervenida debido a la infección fúngiga de la prótesis. Se practicó una toracotomía izquierda y ventilación unipulmonar mediante un tubo de doble luz izquierdo, seguido de circulación extracorpórea (CEC), hipotermia profunda y parada circulatoria. La cánula de drenaje venoso se colocó en la arteria pulmonar derecha, y la del retorno arterial en la aorta descendente. Una vez sustituida la prótesis aórtica infectada, se procedió a interrumpir la CEC, pero todos los intentos de ventilar el pulmón derecho fracasaron. Entonces la fibroscopia reveló que la carina y la pared de la tráquea ocluían por completo el orificio del bronquio principal derecho. La CEC pudo interrumpir mientras se ventilaba únicamente el pulmón izquierdo. Después de retirar la cánula situada la arteria pulmonar y de recolocar a la paciente en decúbito supino, el índice de oxigenación y la ventilación del pulmón derecho mejoraron. La paciente fue extubada transcurridas 20 horas y dada de alta del hospital 6 semanas después. Palabras clave: Coartación aórtica. Tubo de doble luz. Ventilación unipulmonar. Fibrobroncoscopia. Right main bronchus obstruction in a patient intubated with a left double-lumen tube for thoracic aortic surgery Summary A 29-year-old woman with a tubular thoracic aortic graft prosthesis, placed after repair of a postcoarctation site aneurysm, was reoperated due to fungal infection of the prosthesis. A left thoracotomy was performed and single lung ventilation established through a double lumen tube followed by extracorporeal circulation (ECC), deep hypothermia, and cessation of blood circulation. The venous drainage tube was placed in the right pulmonary artery and arterial return was located in the descending aorta. After replacement of the prosthesis and interruption of ECC, attempts to ventilate the right lung failed. Fiberoptic examination revealed that the carina and tracheal wall completely occluded the opening of the right main bronchus. ECC was interrupted and the left lung was ventilated, but after withdrawal of the tube from the pulmonary artery and repositioning the patient in supine decubitus, oxygenation and right lung ventilation improved. The patient was extubated after 20 hours and discharged home 6 weeks later. Key words: Aortic coarctation. Double lumen tube. Pulmonary ventilation: one lung. Bronchoscopy, fiberoptic. Introducción En la cirugía de la aorta torácica la técnica quirúrgica, el manejo anestésico y las condiciones del paciente interaccionan de una forma compleja1,2. Entre todos los retos *Jefe de Servicio. Correspondencia: José Valdivia Santandreu. C/ Pere Martell, 41-1ºA. 07003 Palma de Mallorca (Illes Balears) E-mail: [email protected] Aceptado para su publicación en enero de 2006. 51 que plantea hay dos que son capitales: el primero, la exposición de la aorta mediante disección quirúrgica del mediastino (generalmente a través de una toracotomía izquierda) y, el segundo, la prevención de la isquemia medular, cerebral y visceral mediante diferentes modalidades de perfusión o de circulación extracorpórea (con o sin parada circulatoria e hipotermia profunda). En un sistema de circulación extracorpórea (CEC) para cirugía de la aorta torácica, la ubicación de las cánulas de perfusión admite diferentes posiciones. La elección de la arteria pulmonar para situar la cánula venosa, ha sido defendida por algunos grupos, ya de forma electiva3, ya como segunda opción cuando la vena femoral no es practicable4. 315 Rev. Esp. Anestesiol. Reanim. Vol. 53, Núm. 5, 2006 El colapso intencionado del pulmón izquierdo es otra medida que facilita el acceso a la aorta cuando ésta se aborda mediante una toracotomía izquierda. Para lograr este objetivo, la intubación endobronquial con un tubo de doble luz (TDL) resulta un método excelente, aunque no exento de riesgos5. Se presenta un caso en el que un tubo de doble luz izquierdo (TDL-izquierdo) no permitió mantener la ventilación del pulmón derecho durante una operación de la aorta torácica. Se analizan los hechos y se discuten cuestiones relativas al uso de los tubos de doble luz. Caso clínico Mujer de 29 años (58 Kg y 168 cm) que ingresó tras presentar una hematemesis masiva y colapso cardiovascular. La angiografía reveló la existencia de una coartación de la aorta torácica y un aneurisma postcoartación que englobaba y obstruía el origen de la arteria subclavia izquierda. Se practicó una toracotomía izquierda y ventilación unipulmonar (VU) mediante un TDL-izquierdo. Dado que el acceso al arco aórtico fue imposible, se instauró CEC mediante dos cánulas de perfusión (cánula venosa en el tronco de la arteria pulmonar y cánula arterial en la aorta descendente), seguido de hipotermia profunda y parada circulatoria (57 minutos). En ese intervalo se resecaron el aneurisma y la coartación, y se descubrió un orificio en la pared de la aorta que fistulizaba en el esófago. La aorta fue reparada con una prótesis tubular de Dacrón de 15 cm de longitud. Tras completar las suturas se ventiló el pulmón derecho y se concluyó la CEC. El postoperatorio fue satisfactorio y el día 16º fue dada de alta del hospital. El día 36º la paciente reingresó. Presentaba signos de bacteriemia, hepatoesplenomegalia, ascitis, ictericia, coluria, y hemocultivo positivo para Candida albicans. La tomografía computarizada (TC) torácica objetivó aire mediastínico, derrame pleural izquierdo e imágenes intraluminales a nivel del injerto. Ante la sospecha de infección fúngica de la prótesis y perforación esofágica residual, se decidió reintervenirla. 37 Fr. Mallinckrodt), cuya correcta colocación se comprobó por auscultación. En primer lugar se practicaron una esofagostomía cervical y una gastrostomía de descarga. Luego se colocó a la paciente en decúbito lateral derecho con un rodillo debajo de la axila y se comprobó de nuevo el TDL. Cuando el cirujano practicó la incisión en el 4º espacio intercostal izquierdo, el anestesiólogo interrumpió la ventilación a través la luz bronquial del TDL-izquierdo. El inicio de la ventilación unipulmonar (VU) ocasionó un aumento de la presión de las vías aéreas (Pvías) y una disminución del índice PaO2/FiO2 desde 333 a 78. Se requirió un fibroscopio para comprobar la posición del TDL, pero no fue posible porque el diámetro externo (DE) del fibroscopio disponible (Pentax FB-15X 5,8 mm OD) era superior al diámetro interno del TDL. El volumen corriente y la frecuencia respiratoria se ajustaron de forma que la Pvías no excediera de 40 cmH2O, permitiéndose una hipercapnia moderada. El gradiente PaCO2ETCO2 pasó de 14 mmHg a 11 mmHg tras iniciarse la VU. Concluida la disección de la prótesis se administró heparina (Tiempo de Coagulación Activado 480 segundos), y se insertaron dos cánulas de perfusión: una en la arteria pulmonar derecha para el drenaje venoso, y otra en la aorta descendente para el retorno arterial (Figura 1). Tras 130 minutos de VU, se inició la CEC y se aplicó CPAP (2 cm H2O) al pulmón derecho, pero dado que esta medida desplazaba el mediastino, tuvo que interrumpirse. Se practicó hipotermia profunda (16ºC de temperatura nasofaríngea y vesical) y una parada circulatoria (42 minutos) durante la cual se realizó la anastomosis proximal de una nueva prótesis. Una vez hecho esto, se reanudó la CEC (perfusión distal a través de la cánula aórtica y proximal a través de una cánula transprotésica), y se concluyó la anastomosis distal (Figura 2). Durante la CEC (205 minutos), la cánula situada en la arteria pulmonar derecha se tuvo que revisar en repetidas ocasiones porque el drenaje venoso era irregular y ocasio- Reintervención Al llegar a quirófano se monitorizaron el electrocardiograma (ECG) y la saturación periférica de oxígeno (SatpO2); se insertaron dos cánulas venosas periféricas, un catéter de tres luces en la vena subclavia derecha, y dos cánulas arteriales (humeral derecha y femoral derecha) para monitorización de la presión arterial proximal y distal a la prótesis. Para la inducción se administraron etomidato, cisatracurio y fentanilo; y para el mantenimiento, cisatracurio, fentanilo e isofluorano, que se sustituyó por propofol durante la CEC. Dado el antecedente de exposición a la aprotinina, se administró ácido epsilón aminocaproico. Para la intubación endobronquial se utilizó un TDL-izquierdo (Broncho-Cath 316 Fig. 1. Esquema del circuito de circulación extracorpórea inmediatamente antes de la parada circulatoria. 52 J. VALDIVIA ET AL– Obstrucción del bronquio principal derecho en una paciente intubada con un tubo de doble luz izquierdo para cirugía de la aorta torácica Fig. 2. Exposición de las estructuras mediastínicas. Cánula venosa situada en la arteria pulmonar derecha y cánula aórtica introducida a través de la pared de la prótesis. La cánula aórtica supradiafragmática (aorta descendente) ya ha sido retirada. Se observa la anastomosis proximal de la prótesis tubular. naba descensos en el nivel del reservorio, que se compensaron administrando volúmenes adicionales de fluidos y hemoderivados. Por el contrario, el pulmón izquierdo se ventilaba sin dificultad a través de la luz bronquial del TDL. Se intentó recolocar “a ciegas” el TDL, pero dado que todas las maniobras fracasaron, el TDL fue sustituido por un tubo endotraqueal (TET) de 7 mm de diámetro interno ((Mallinckrodt®). El cambio se ejecutó antes de concluir la CEC con la ayuda de un intercambiador. A continuación, la fibroscopia (Pentax FB-15X 5,8 mm OD) que se practicó a través del TET mostró que la carina traqueal y la pared de la tráquea ocluían por completo el orificio del bronquio principal derecho (BPD); y que el bronquio principal izquierdo (BPI), por el contrario, era permeable y contenía secreciones hemáticas procedentes de las vías aéreas distales de ese lado. Ante la imposibilidad de ventilar el pulmón derecho, se finalizó la CEC ventilando únicamente el izquierdo. Cuando el cirujano retiró la cánula venosa del interior de la arteria pulmonar, el índice PaO2/FiO2, aumentó (tabla 1) y la SatpO2 pasó de 93% a 99%. Cuando la intervención concluyó y se colocó a la paciente en supino, se observó una mejoría de la ventilación del pulmón derecho y un aumento adicional del PaO2/FiO2. El comportamiento gasométrico en las distintas fases se resume en la tabla 1. Se administraron protamina, hematíes, plasma, y plaquetas. Los valores finales de hemoglobina y hematocrito fueron 9,5 g dL-1 y 28%, respectivamente. El balance de líquidos, tras 12 horas de intervención, fue muy positivo (9.500 mL), y la paciente presentaba gran edema facial. La radiografía postoperatoria mostraba un aumento de densidad en ambos pulmones, pero mejoró tras forzar balance negativo. Fue extubada transcurridas 20 horas y no presentó focalidades neurológicas. El día 10º tras la reintervención, pasó a planta, donde se continuaron la rehabilitación respiratoria y la terapia con meropenem, caspofungina y anfotericina. Fue dada de alta del hospital 6 semanas después. Fin de la CEC y dificultad para ventilar el pulmón derecho Discusión Restablecida la normotermia se procedió a reanudar la ventilación del pulmón derecho, pero esta maniobra resultó infructuosa debido a que una gran resistencia impedía la VU. Tal como mostró la fibroscopia, las tentativas para ventilar el pulmón derecho al finalizar la CEC fracasaron a causa del colapso del orificio del BPD. ¿Se TABLA 1 Descripción de la situación clínico-gasométrica de la paciente en los diferentes tiempos de la intervención Tiempo quirúrgico Tipo de intubación* Cánula arteria pulmonar Posición del paciente PH pCO2 pO2/FiO2 Bicarbonato VC (ml) Pvías (cm H2O) FR (ciclos.min-1) Pre-toracotomía TDL-izdo Supino 7,29 47 394 22,7 600 30 12 Toracotomía TDL-izdo** Decúbito derecho 7,29 41,2 78,3 19,7 500 40 17 Toracotomía TDL-izdo** Sí Decúbito derecho 7,42 39,6 112,7 25 620 40 14 Post-CEC TET Sí Decúbito derecho 7,29 49,8 89 23,3 600 34 15 Post-CEC TET Decanulada Decúbito derecho 7,21 56,2 202 22 500 36 15 Post-CEC TET Decanulada Supino 7,25 51,4 225 22 550 39 15 VC (Volumen Corriente), Pvías (Presión en las vías aéreas), FR (frecuencia respiratoria). *TDL-izdo (Tubo de doble luz izquierdo 37Fr), TET (Tubo endotraqueal 7 mm DE). **Ventilación Unipulmonar. 53 317 Rev. Esp. Anestesiol. Reanim. Vol. 53, Núm. 5, 2006 habría evitado esta complicación si la paciente hubiese sido intubada con un tubo de doble luz derecho (TDL-derecho) en lugar de con un TDL-izquierdo? Para muchos expertos 5-7 el TDL-izquierdo es la mejor opción en la mayoría de las intubaciones endobronquiales, dado su mayor margen de seguridad. En el caso expuesto se utilizó un TDL-izquierdo siguiendo estas directrices, y aunque cabe la posibilidad de que un TDL-derecho tal vez hubiese impedido esta complicación, no se puede afirmar, porque no conocemos la extensión del colapso del BPD. ¿Era correcta la posición del TDL tras la intubación? El TDL permitió colapsar el pulmón izquierdo y administrar VU durante los 130 minutos que precedieron la CEC, pero el pinzado de la luz bronquial ocasionó cambios inquietantes: a) aumento de la Pvías, que se manejó limitando la presión y permitiendo una moderada hipercapnia, y b) disminución del índice PaO2/FiO2, que se atribuyó al aumento del cortocircuito intrapulmonar. Actualmente sabemos que en 2048% de los casos, tubos de doble luz aparentemente bien colocados en realidad no están en “posición óptima”8. Sin embargo, tubos cuya posición se consideraría subóptima desde un punto de vista fibroscópico son aceptables desde un punto de vista funcional9. Por todos estos motivos, mientras que algunos expertos sostienen que la confirmación visual mediante fibroscopio constituye un imperativo en todas las intubaciones con tubos de doble luz10, otros11 sostienen que el uso del fibroscopio no disminuye la incidencia de malposiciones, y que la baja frecuencia con que éstas ocurren no justifica su uso sistemático. En este caso la fibroscopia evidenció que la causa del problema era el colapso del BPD, y no la posición del TDL, y esta evidencia se vio reforzada por el hecho de que la dificultad para ventilar el BPD persistió incluso después de sustituir el TDL por un TET sencillo. En consecuencia, pensamos que esta experiencia demuestra hasta qué punto la fibroscopia resulta una asistencia imprescindible a la hora de esclarecer la naturaleza de las complicaciones relacionadas con los tubos de doble luz. Esta complicación no ha sido comunicada antes; únicamente Benumof y cols12 reportaron un caso de obstrucción del BPD en un paciente de 10 años que presentaba una recidiva de un cordoma espinal y que fue intubado con un TDL-izquierdo. Una vez que aquél fue colocado en decúbito derecho con un rodillo de 6 cm de altura debajo de la axila, la fibroscopia alertó al operador de que la pared lateral de la tráquea 318 se había desplazado sobre la carina, colapsando el BPD. Fue suficiente retirar el rodillo para que se restaurara la permeabilidad del BPD; los autores atribuyeron esta complicación a la altura excesiva del rodillo. En resumen, en la cirugía de la aorta torácica que se acompaña de canulación de la arteria pulmonar para la CEC, el colapso del BPD es una grave complicación que impide restablecer la función pulmonar tras la CEC y para cuyo diagnóstico la fibroscopia es imprescindible. Agradecimientos Al Dr. Fernando Enríquez, por su decisiva ayuda en la elaboración de las figuras. Al Dr. Oriol Bonnin, porque su afán por lo bien hecho siempre nos estimula. A las señoritas Carolina Valdivia y Neus Cerdá, por asesorarnos en cuestiones de gramática inglesa. BIBLIOGRAFÍA 1. Murray JM, Shine TSJ. Surgery of thoracic and abdominal aorta. En: Vascular Anesthesia. Kaplan J. New York. Churchill Livingstone 2004. 2. Reyes A, de la Gala F, Canal I, Barrio JM, Hortal J, Riesgo M. Coartación aórtica y aneurisma micótico postcoartación en gestante de 20 semanas: manejo anestésico. Rev Esp Anestesiol Reanim 2005;52(3): 172-176. 3. Westaby S, Katsumata T. Proximal aortic perfusion for complex arch and descending aortic disease. J Cardiovasc Surg 1998;115(1):162167. 4. Stoica L, Chocron S, Falcoz PE, Bonneville JF, Etievent JPh. Surgical pitfalls during explantation of a thoracic aortic endoprosthesis. J Torac Cardiovasc Surg 2004;127(6):1815-1817. 5. Campos JH. Current techniques for perioperative lung isolation in adults. Anesthesiology 2002;97(5):1295-1301. 6. Cohen E. Double-lumen tube position should be confirmed by fiberoptic bronchoscope. Curr Opin Anaesthesiol 2004;17:1-6. 7. Benumof JL. Separation of the two lungs (doble-lumen tubes, bronchial bloquers, and endobronchial single-lumen tubes). En: Airway Management. Principles and practice. Editor: Benumof JL. Sant Louis: Mosby-Year Book; 1996:412-443. 8. Saito S, Dohi S, Naito H. Alteration of double lumen endobronchial tube position by flexion and extension of the neck. Anesthesiology 1985;62(5):696-697. 9. Seymour AH, Lynch L. An audit of Robertshaw double lumen placement using the fibreoptic bronchoscope. Br J Anaesth 2002;89(4):661662. 10. Klein U, Karzai W, Bloos F, Wohlfarth M, Gottschall R, Fritz H, Gugel M, Seifert A. Role of fiberoptic bronchoscopy in conjuncion with the use of double-lumen tubes for thoracic anesthesia: A prospective study. Anesthesiology 1998;88(2):346-350. 11. Seymour AH, Prasad B, Mckenzie RJ. Audit of double-lumen endobronchial intubatuion. Br J Anaesth 2004;93(4):525-527. 12. Benumof JL, Harwood I, Pendleton S. Major obstruction of the right maintem bronchus caused by placement of a axillary roll. J Cardiothorac Vasc Anesth 1993;7(2):200-201. 54