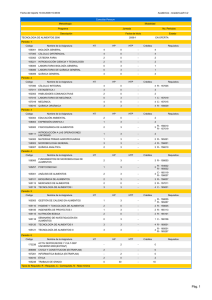
En el presente trabajo se encontr que las concentraciones
Anuncio

EXPRESION DEL GEN CYP1A1 HEPATICO DE TILAPIA COMO BIOINDICADOR DE CONTAMINACION ACUATICA EN 2 LAGUNAS COSTERAS NORVERACRUZANAS Pablo SAN MARTIN1,2, Luisa C. R. HERNANDEZ3, Humberto GARZA4, Graciela GARCIA1*, Omar ZAPATA5 y Arturo ORTEGA3. 1 Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, San Nicolás de los Garza, Nuevo León. 2Facultad de Ciencias Biológicas y Agropecuarias, Universidad Veracruzana-Tuxpan, carretera Tuxpan-Tampico, Km. 7.5, Tuxpan, Veracruz, 3Depto. de Genética y Biología Molecular, CinvestavZacatenco, Apdo. postal 14-740 México, D.F., 4ALS-Indequim, Monterrey, Nuevo León, 5Depto. de Recursos del Mar, Cinvestav-Mérida, Km 6 Antigua Carretera a Progreso, Cordemex, 97310, Mérida, Yucatán. *Av. Pedro de Alba s/n, Facultad de Ciencias Biológicas/UANL (Jefatura de Alimentos), San Nicolás de los Garza, Nuevo León; Tel: 01 (81) 83768771, [email protected] Palabras clave: PAH; HTP; mRNA; sedimentos, Oreochromis niloticus RESUMEN Se determinó la concentración de Hidrocarburos Aromáticos Policíclicos (HAP) e Hidrocarburos Totales del Petróleo (HTP) en sedimentos, agua y organismos de dos lagunas costeras veracruzanas y evaluó la capacidad de los extractos de sedimentos para inducir la expresión del CYP1A1 en la tilapia (Oreochromis niloticus), como bioindicador de contaminación. El área de estudio incluyó las lagunas costeras de Tamiahua y Tampamachoco en el norte del estado de Veracruz, para cada laguna se establecieron 6 estaciones, se realizaron muestreos preliminares y definitivos de: sedimento, agua y organismos bajo la metodología propuesta por la EPA 823B95001, 1995. Se optimizó la extracción, concentración y purificación de HAP y HTP, para los análisis se utilizaron los métodos EPA 418.1 y EPA 8270 respectivamente y para organismos el método EPA 8310. En ambas lagunas y en todas las muestras los HAP se situaron por debajo del límite de detección, mientras que los HTP fueron registrados en los sedimentos de la estación 4 y 5 con 2637.52 y 75.41 mg/kg de HTP en Tamiahua y para Tampamachoco en la estación 5 y 6 con 97 y 204 mg/kg de HTP. Por ello se elaboraron extractos de sedimentos de las estaciones 4, 5 y 2 de la laguna de Tamiahua con contaminación alta, moderada y baja respectivamente; los mismos se inyectaron intraperitonealmente a tilapias, al término de 24 h, los organismos fueron sacrificados y disectados para obtener los hígados y fueron analizados por RT-PCR para determinar los niveles del mRNA CYP1A1, se encontró que los peces tratados con extractos de sedimentos de la estación 4 presentaron un incremento significativo en más de 16 veces respecto al control (aceite de maíz), mientras que los peces de las estaciones 2 y 5 presentaron un incremento de 5 veces. El incremento significativo del mRNA hepático en tilapias expuestas a 1 extractos de sedimentos sugiere que la inducción del CYP1A1 puede ser utilizada como herramienta para el monitoreo de HTP en ecosistemas acuáticos. INTRODUCCIÓN Entre los ecosistemas costeros del país sobresalen por diversas causas, las lagunas costeras, las cuales están catalogadas como los ecosistemas que poseen las más elevadas tasas de productividad conocidas, tanto primaria como secundaria, además son áreas utilizadas comúnmente para la protección, alimentación y reproducción de muchos organismos marinos, por lo que gran número de pesquerías litorales, como la mayoría de las especies de camarón, dependen de la conservación de estos ecosistemas; por pequeñas que sean, mantienen una vida particular en su interior y generalmente son sitios donde la biodiversidad asociada es un atributo muy importante (Contreras y Castañeda, 2004). El petróleo es un insumo estratégico para la economía mundial, pues es la principal fuente de energía en el mundo. Por su importancia en la economía, el petróleo es un producto codiciado y se invierten grandes cantidades de recursos en su búsqueda, extracción y refinación (Gold, 2000). Por otra parte, las mayores pesquerías del mundo se concentran en áreas con una alta productividad biológica, como son las zonas costeras. En algunas partes del mundo, éstas comparten su alta productividad con las actividades de la industria petrolera, tal es el caso de México, donde la producción del petróleo en la plataforma continental alcanza volúmenes considerables. Por ello, las pesquerías del área estarán sujetas a una contaminación crónica y a derrames de petróleo intermitentes por muchos años (Vázquez y Páez, 1987). La contaminación de suelos y aguas con compuestos derivados de la actividad petrolera, se ha convertido en un problema en gran número de sitios de explotación, refinación y almacenamiento de hidrocarburos. Se estima que 1.6 millones de barriles (2.5 108 l) se derraman anualmente en el mar, que representa aproximadamente el 0.1 % del consumo mundial por año (Internacional Oil Spill Statistic, 1999; OECD, 1991, en Fernández 2003). Volke y Velasco 2002 mencionan que en México dentro de los compuestos peligrosos más comúnmente involucrados en emergencias ambientales entre 1997 y 1999 se encuentran el petróleo y sus derivados (gasolina, combustóleo, diesel), agroquímicos, gas LP y natural, y que dentro de los contaminantes considerados prioritarios debido a su alta toxicidad y a su persistencia en el ambiente se incluyen entre otros a los hidrocarburos poliaromáticos (HAP), los cuales se encuentran como componentes de los hidrocarburos totales del petróleo (HTP). Los organismos marinos pueden ser utilizados como bioindicadores e integradores de la calidad de agua en los ecosistemas marinos, debido a que proveen de información útil acerca del potencial de biomagnificación en la cadena alimenticia (Peña et al.1996), además se sabe que HAP, bifenilos policlorados (PCBs), dioxinas, etc. estimulan la expresión de varios miembros de la superfamilia de genes del citocromo P450, particularmente de la familia CYP1A (Rees et al. 2003). Actualmente, la inducción del CYP1A en peces es analizada de manera rutinaria 2 en diferentes laboratorios alrededor del mundo y ha sido incorporada a varios programas de vigilancia internacionales como NOAA (Nacional Oceanic and Atmospheric Administration). Por otra parte, una combinación de las mediciones de la inducción del CYP1A junto con otros bioindicadores, pueden dar una señal de alerta temprana sobre los efectos que puedan causar los contaminantes en los organismos expuestos y en los ecosistemas. MATERIALES Y METODOS El área de estudio (figura 1) incluye las lagunas costeras de Tampamachoco y Tamiahua en el norte del Estado de Veracruz, ubicadas en la porción occidental de las costas del Golfo de México entre las coordenadas 20º 18´ y 21º 02´ latitud norte, 97º 19´ y 97º 22´ longitud este con un área aproximada de 1,500 Hectáreas para Tampamachoco; 21º 06´ y 21º 20´ latitud norte, 97º 23´ y 97º 46´ longitud este con un área de 88,000 Hectáreas para Tamiahua (Contreras y Castañeda, 1995) Se prospectó el área de estudio, se elaboró el plan y se realizaron los muestreos con la metodología propuesta por EPA 823B95001, 1995. Para cada laguna se establecieron 6 estaciones, el punto exacto de la estación fue registrado con un sistema de posicionamiento global (GPS). Los sedimentos y organismos fueron colectados durante los meses de enero y marzo del 2002 en Tampamachoco y en marzo y octubre del 2003 en Tamiahua. De cada estación, sedimentos superficiales a una profundidad de 0-5 cm fueron colectados con una draga de acero inoxidable y colocados en frascos de vidrio de boca ancha, las muestras fueron colocadas in situ en hielo y posteriormente transferidas en almacenamiento a -20ºC hasta el análisis. 10 gr de sedimento fueron sometidos a extracción con soxhlet durante 16 hrs con hexano grado analítico, los extractos fueron concentrados a 2 ml utilizando un aparato Kuderna-Danish (K-D) siguiendo el método EPA 3540C. La cuantificación del PAH en las muestras fue realizada con un cromatógrafo de gases (GC) Hewlett Packard HP-5890 series II, con interfaz a un detector selectivo de masas (MS) HP 5971 y una columna capilar HP-5 MS, 30 m X 0.25 mm i.d. (0.25 μm film). Las temperaturas programadas fueron 30ºC – 290ºC (a una tasa de 7ºC/min), la temperatura fue de 250ºC para el inyector y 280ºC para el detector. Se utilizó Helio como gas acarreador (flujo 1 ml/min). El MS fue operado en modo “scanning” de 35 a 550 uma. 2 μl de muestra fueron inyectados y el análisis se realizó de acuerdo al método EPA 8270 C. Peces, camarones, ostras y jaibas fueron colectadas frescas con la ayuda de pescadores de la región. Después de la colecta, las muestras fueron colocadas en bolsas de papel aluminio protegidas adentro de un frasco de vidrio y congeladas a -70ºC hasta el análisis. Únicamente músculo de cada especie fue analizado individualmente. Las muestras fueron homogeneizadas utilizando diclorometano (100 ml) y sometidas a extracción en soxhlet por 24 hr. Los extractos de cada especie fueron purificados utilizando columnas de vidrio para remover los lípidos co-extraídos. La cuantificación de los PAH se utilizando un equipo HPLC siguiendo el método EPA 8310. 3 La extracción de HTP se realizó utilizando el método EPA 418.1 modificado, el solvente fue vertido a la muestra y se agitó vigorosamente por 2 minutos para realizar la extracción. Se dejó reposar para permitir la separación de las capas, la del solvente se filtró a un matraz volumétrico de 100 ml con un embudo y papel filtro. Los lavados se repitieron 2 ó más veces con otros 30 ml de solvente fresco y recuperando todo en el matraz, finalmente se aforó a 100 ml y la muestra fue leída en un espectrofotómetro de infrarrojo a una longitud de onda de 2950 cm-1. La cuantificación de los HTP se realizó con la ecuación de una curva de calibración de absorbancia contra concentración en mg/L de una mezcla de hexadecano, isooctano, clorobenceno y aceite de referencia. Figura 1. Mapa del área de estudio mostrando la localización de las estaciones de muestreo en las lagunas de Tamiahua y Tampamachoco, Veracruz. Para determinar el efecto de HAP y HTP sobre la expresión del CYP1A como bioindicador de contaminación se seleccionaron 3 estaciones de muestreo solamente de la laguna de Tamiahua, correspondientes a San Jerónimo, Boca de Tancochín y Salto el Tigre previamente caracterizadas por presentar alta, moderada y baja contaminación por HAP y HTP respectivamente. Para ello 10 g de sedimento (n=6) de las estaciones de fueron sometidos a extracción por 4 Soxhlet durante 16 h y los extractos fueron concentrados por K-D a 5 ml, el resto del solvente fue evaporado completamente bajo atmósfera de nitrógeno. La mezcla de residuos orgánicos resultante fue reconstituida con 1 ml de aceite de maíz en un sonicador Branson (modelo 2510) por 2 h a 60ºC. 12 peces (4 por tratamiento) fueron inyectados intraperitonealmente (IP) con los extractos de sedimentos a una dosis de 100 μL del extracto por cada 100 g de peso del pez y 4 peces fueron inyectados solamente con aceite de maíz, los cuales fueron utilizados como control. Los peces tratados con extracto de sedimentos y con aceite de maíz, fueron sacrificados 24 h después de la inyección. Cada pez fue disectado para extraerle el hígado, el cual fue inmediatamente colocado en nitrógeno líquido y posteriormente almacenado en ultracongelación a –70 ºC para su posterior análisis. El método utilizado para la extracción de RNA total es el descrito por Chomczynski y Sacchi (1987), los hígados de tilapia (Oreochromis niloticus) fueron homogeneizados en mortero y nitrógeno líquido en presencia del isotiocianato de guanidina, una solución 4 M de β-mercaptoetanol, sarcosil al 0.6%, citrato de sodio al 0.5% (solución “D”, pH 7). Para la cuantificación del RNA extraído, 1 μL de RNA total fue diluido en 499 μL de agua estéril libre de RNAasas, la cuantificación del RNA total se realizó en un espectrofotómetro Beckman DU 640 UV/VIS (260, 280, 260/280 y 280/260 nm). La tasa resultante entre la absorción de 260/280 fluctuó entre 1.75 a 2.0. Adicionalmente la integridad del RNA se verificó electroforéticamente, para ello se colocaron aproximadamente 1-3 μL de RNA total por carril en un gel de agarosa al 1.5%, previamente teñido con bromuro de etidio para observar las bandas de RNA con un transiluminador Biometra TI 3. A partir del RNA total, el mRNA presente en cada muestra fue convertido a cDNA en una reacción de volumen final de 20 μL, que contenía 0.5 μg de Oligo (dT), RNA muestra (2 μg) y como componentes adicionales 5X first strand buffer, cloruro de magnesio (MgCl2) 50 mM, 0.1 M DTT y la enzima M-MLVRT Moloney Murine Leukemia Virus Reverse Transcriptase (200 u, Gibco BRL), la reacción fue incubada a 37 ºC durante 1 hora. El cDNA elaborado previamente (2 μL) se utilizó en conjunto con los oligonucleótidos para realizar las reacciones de PCR, además de 100 mM dNTPs (incluyendo los 4 desoxinucleótidos), 10 pmol de cada oligonucleótido y 0.05 u/μL de Taq DNA polimerasa (Thermus aquaticus, Gibco BRL-Life Technologies, Rockville MD) y como componentes adicionales: Buffer 10X PCR y MgCl2 50 mM. Las amplificaciones del mRNA CYP1A fueron llevadas a cabo en un termociclador PTC-100 MJ Research, bajo las siguientes condiciones: desnaturalización (1 min a 95 ºC), alineamiento (1 min a 58 ºC) y elongación (1 min a 72 ºC), durante 36 ciclos, además de una incubación final a 72 ºC por 7 min. Los productos de PCR fueron resueltos junto con un marcador de peso molecular de 100 pares de bases (pb) por electroforesis en geles de agarosa al 1.5% y teñidos en bromuro de etidio. Las imágenes fotográficas fueron obtenidas del gel con luz ultravioleta (UV), colocando el gel en un transiluminador Biometra TI 3. El volumen total de las bandas (densidad óptica OD x mm) de los productos amplificados fueron 5 calculados mediante el software Kodak Digital Science EDAS 120 System Densitometer (Eastman Kodak, CO, Rochester, N.Y.). RESULTADOS Y DISCUSION En el presente trabajo se encontró que las concentraciones individuales de los HAP en muestras de sedimentos de la laguna de Tamiahua estuvieron situadas por debajo del límite de detección de 1 mg/kg; lo que contrasta con los valores observados por Botello y Calva (1998), en un trabajo realizado en la misma laguna en el año de 1995. En dicho trabajo se reporta que para la estación 4 (Cabo Rojo) se encontraron valores de 1.01, 1.95 y 4.08 para fluoreno, pireno y benzo(a) antraceno respectivamente. En el presente estudio, la estación correspondiente es la estación 3, del mismo nombre, donde los valores fueron inferiores a aquellos para los mismos HAP. Otras estaciones con presencia de HAP reportadas por los mismos autores son la estación 2 y 6 donde se encontró para la primera estación 1.40 y 1.02 μg/g para pireno y benzo(a)antraceno respectivamente; mientras que para la última 1.02 y 1.63 μg/g para pireno e indeno; sin embargo en esta última (Estero Cucharas) fue la única estación donde se detectó benzo(a)pireno con un valor de 0.46 μg/g. Del presente estudio, las estaciones más próximas a las anteriormente mencionadas corresponden a las estaciones 1 (Punta Arenas) y 2 (Salto El Tigre) en las cuales no se detectaron valores superiores de 1 mg/kg para cada HAP individual. Al igual que para Tamiahua, en la laguna de Tampamachoco, las concentraciones de HAP individuales en las muestras de sedimentos estuvieron situadas por debajo del límite de detección de 1 mg/kg, dichos valores son inferiores a los que reporta Botello y Calva (1998) para la misma laguna, por ejemplo, los autores mencionan que en la estación 3 (Frente a la Termoeléctrica) encontraron valores de 1.62, 4.81 y 1.13 μg/g para pireno, benzo(a)antraceno y benzo(k)fluoranteno respectivamente, y es la única estación en esta laguna en donde se encontró un valor de 0.42 μg/g para Benzo(a)pireno. En el presente estudio las estaciones más próximas a la anterior son estación 2 (Banda Mar Norte) y estación 4 (Banda Mar Sur), en las cuales no se detectó valores superiores al límite de detección. Bajo este esquema, las concentraciones de HAP individuales en muestras de agua de las estaciones de muestreo, analizadas en ambas lagunas también se situaron por debajo del límite de detección de 0.02 – 0.05 mg/l, dichos valores guardan concordancia a los valores encontrados en las muestras de sedimentos, que también fueron bajos. Una de las principales causas a las que se puede atribuir los bajos valores de HAP en el presente estudio es a que en el mes de octubre del año de 1999, en el área de estudio se produjo la peor inundación ocurrida en los últimos 50 años, donde grandes masas de agua y sedimentos fueron aportadas a las lagunas de Tamiahua y Tampamachoco, Veracruz y que las muestras al ser de sedimentos recientes y superficiales, las mismas estarían presumiblemente no contaminadas, que fue lo que se presentó este estudio. 6 Respecto a los HTP en las muestras de sedimentos de la laguna de Tamiahua, la mayoría de las estaciones mostraron concentraciones inferiores al límite de detección de 50 mg/kg (tabla I), excepto la estación 4 (San Jerónimo) y estación 5 (Boca Tancochín), donde se encontraron 2,637.52 y 75.41 mg/kg de HTP. Los valores de HTP registrados en el presente estudio están principalmente relacionados de manera directa e indirectamente con actividades de la industria petrolera, ya que cercana a la estación 4 se encuentra un área de 20 Hectáreas denominado pozo “Dos Bocas”, el cual fue explotado a principios de 1900 y que actualmente se encuentra abandonado, sin embargo, en el mismo hay emanaciones naturales que hoy en día es incosteable explotar y que por tal razón principalmente en época de lluvias al incrementarse el nivel de crudo desborda, vertiendo y aportando hidrocarburos a la laguna en este sitio. En Boca Tancochín, los aportes de HTP, puede ser atribuida a la existencia de líneas de conducción (ductos) que transportan crudo de mar a tierra y que al sufrir ruptura vierten crudo al sistema lagunar en este sitio. Tabla I. Concentración de HTP (mg/kg) determinado en sedimentos de las lagunas de Tamiahua y Tampamachoco, Veracruz. LAGUNA DE TAMPAMACHOCO LAGUNA DE TAMIAHUA E S T A C I O N E S E S T A C I O N E S 1 *2 3 *4 *5 6 1 2 3 4 5 6 <50 <50 <50 2637.52 97 204 <50 <50 <50 2637.52 75.41 <50 En Tampamachoco, sólo las estaciones 5 (Torres) y 6 (Tubito) presentaron valores de 97 y 204 mg/kg de HTP (tabla I). Éstos valores pueden explicarse por la cercanía (aproximadamente 1 km) con el muelle de PEMEX, donde atracan barcos los cuales muy posiblemente transportan crudo y que además por las actividades de limpieza vierten el agua de lastre a este lugar, por lo que sin duda este sitio puede ser un lugar de carga o descarga y por ende de introducción de petróleo, que al ubicarse frente a la boca de la laguna y por la acción de las corrientes, los hidrocarburos son transportados hacia el interior. Considerando que no existe para estos contaminantes, límites máximos permisibles en sedimentos (marinos, de ríos, lagos, lagunas costeras) afectados por hidrocarburos, se tomó como referencia la normatividad establecida para suelos, Norma Oficial Mexicana (NOM) de Emergencia NOM-EM-138-ECOL-2002 (uso: agrícola, forestal, recreativo y de conservación – residencial y comercial; en ppm) que establece un máximo de 200 a 1,000 mg/kg (ppm). Para el caso de la laguna de Tamiahua, sólo la estación 4 (San Jerónimo) fue la que sobrepasó en más del doble el límite máximo permisible con un valor de 2,637.52 mg/kg de HTP (tabla 21); mientras que para Tampamachoco, fue la estación 6 (tubito), la que presentó un valor de 200 mg/kg de HTP (tabla I), todas las demás estaciones en ambas lagunas presentaron valores situados por debajo del límite máximo 7 permisible establecido en la NOM. Las concentraciones de HTP en las muestras de agua, presentaron valores inferiores al límite de detección de 5 mg/l. En el presente estudio se analizaron especies de importancia económica de peces, crustáceos y moluscos, mismas que constituyen un alimento importante para las comunidades locales y que además son comercializadas en los principales mercados de la región e incluso de la ciudad de México. El hecho que ninguna de las especies analizadas de ambas lagunas presentaran valores superiores al límite de detección de 0.17 – 0.25 mg/kg, guarda lógica, toda vez que valores no detectables de HAP se presentaron en las muestras de sedimentos y muestras de agua. Aunque el ostión americano es una especie abundante en ambas lagunas y la misma es utilizada como indicador biológico debido a su capacidad de bioacumular una gran variedad de contaminantes del agua y de los sedimentos, en el presente trabajo concentraciones indetectables de HAP fueron encontradas en estos organismos en ambas lagunas. Por su parte Krahn et al., (1984) reportó que en análisis de rutina de HAP (pares) en peces capturados en áreas contaminadas, frecuentemente muestren sólo trazas de HAP, aún cuando los sedimentos contengan altas concentraciones de estos compuestos; lo anterior descrito apoyaría a los resultados encontrados en el presente trabajo, ya que al encontrar bajos valores de HAP en sedimentos, se esperaría por ende bajos o nulos valores de los mismos en las especies bajo el análisis. En el presente estudio el análisis de HAP se realizó sólo en tejido del muscular y para peces es necesario considerar diferentes órganos y tejidos ya que Al Hassan et al., (2003) no detectó ningún HAP individual tal como el benzo(a)pireno entre músculo, branquia e hígado en peces comestibles provenientes de áreas contaminadas del Mar de Arabia. Aunque son relativamente pocos los trabajos realizados utilizando al mRNA CYP1A1 como bioindicador de contaminación, en ellos se ha observado un incremento en los niveles de expresión del gen. Similares resultados fueron encontrados en el presente estudio, donde una fuerte inducción del CYP1A1 causó un incrementó significativo (p< 0.01) de más de 17 veces respecto al control en los niveles de mRNA CYP1A1 hepático, 24 h después de que los peces fueron inyectados intraperitonealmente (IP) con extractos de sedimentos de la estación 4 (San Jerónimo) de la laguna de Tamiahua, una expresión moderada de 5 veces más se observó para los peces inyectados con extractos de la estación 5 (Boca Tancochín) y estación 2 (Salto El Tigre), mientras que una débil expresión se observó en los peces control (figura 2). Un patrón similar fue observado por Wong et al., 2001, quienes observaron que la más alta expresión del mRNA del CYP1A1 hepático y del intestino en peces tratados con extractos de los sedimentos costeros de las estaciones más contaminadas por HAP y PCBs del área de Hong Kong y mencionan que en estudios ecotoxicológicos es esencial el uso de métodos químicos y biológicos. 8 Figura 2. Gráfico de columnas que muestra la cuantificación de la expresión del gen CYP1A1 mRNA (n=4). Las columnas con un mismo número de asteriscos no son significativamente diferentes (p< 0.05) comparadas con el control, de acuerdo a los resultados del ANOVA (one way) seguida de una comparación múltiple de medias con rangos de Dunnet. CONCLUSIONES Los resultados de este estudio muestran que no existe contaminación evidente por Hidrocarburos Aromáticos Policíclicos en los sedimentos, muestras de agua y en tejido de algunas especies explotadas y de interés comercial en las lagunas costeras de Tamiahua y Tampamachoco, Veracruz; durante el período en el que se desarrolló el presente trabajo. En este trabajo se detectaron Hidrocarburos Totales del Petróleo en los siguientes sitios: 2,637 mg/kg de HTP en la estación 4 (San Jerónimo) y 75.41 mg/kg de HTP en la estación 5 (Boca Tancochín) en la laguna de Tamiahua y 204 mg/kg de HTP en la estación 6 (Tubito) en la laguna de Tampamachoco. 9 Los extractos de sedimentos de “San Jerónimo”, “Boca Tancochín” y “Salto El Tigre”, tuvieron la capacidad de inducir la expresión del mRNA del CYP1A1 en la tilapia (Orechromis niloticus). La más elevada expresión del mRNA del CYP1A1 correspondió a “San Jerónimo”, que también fue la estación con la concentración más alta de HTP. El incremento significativo del mRNA del CYP1A1 hepático en tilapias expuestas a extractos de sedimentos, sugieren que la inducción del CYP1A1 puede ser una herramienta para el monitoreo de HTP en ecosistemas acuáticos. REFERENCIAS Al-Hassan JM, Afzal M, Rao CVN, Fayad S (2003). Polycyclic aromatic hydrocarbons (PAHs) and aliphatic hydrocarbons (AHs) in edible fish from the Arabian Gulf. Bull. Environ. Contam. Toxicol. 70: 205-212. Botello AV y Calva BL (1998). Polycyclic aromatic hydrocarbons in sediments from Pueblo Viejo, Tamiahua and Tampamachoco lagoons in the southern Gulf of Mexico. Bull. Environ. Contam. Toxicol. 60: 96-103. Contreras EF y Castañeda LO (1995). Los ecosistemas costeros del Estado de Veracruz. Gobierno del Estado de Veracruz y Secretaria de Desarrollo Agropecuario, Forestal y Pesquero, 144 p. Contreras EF y Castañeda LO (2004). La biodiversidad de las lagunas costeras. Ciencias 76: 46-56. EPA, 823B95001 (1995) QA/QC guidance for sampling and analysis of sediments water and tissue for dredged material evaluations - chemical evaluations. Available from: URL: http://www.epa.gov/waterscience/library/sediment/evaluationguide.pdf Fernández LL. (2003). Biorremediación y atenuación natural de sitios contaminados con hidrocarburos. p. 53-58. En: Galan W. L., Elías S. M., Tamez G. P., Quintero R. R. y Quintero Z. I. (eds). Procesos Biotecnológicos. Universidad Autónoma de Nuevo León. Gold BG. (2000). El petróleo: características e impacto ambiental. En: Petróleo, medio ambiente y sociedad, Ramírez CA, Gold BG, Florencia GJ, Durán GR, Trejo TJ, Olmsted I, Juun-Qui VM, Morales AL (eds). Senado de la República, 107 p. Krahn MM, Myers MS, Burrows DG, Malin DC (1984). Determination of metabolites of xenobiotics in the bile of fish from polluted waterways. Xenobiotic 14:622-646 Rees CB, McCormick SD, Vanden-Heuvel JP, Li W (2003) Quantitative PCR analysis of CYPIA induction in Atlantic salmon (Salmo salar). Aquat Toxicol 62:6778 Vázquez BA y Páez F. 1987. El problema crucial: la contaminación. Ecodesarrollo, 180 p Volke ST, Velasco TJ (2002) Tecnología de remediación para suelos contaminados. INE-SEMARNAT, 64 p Wong CKC, Yeung HY, Woo PS, Wong MH (2001) Specific expression of cytochrome P4501A1 gene in gill, intestine and liver of tilapia exposed to coastal sediments. Aquat Toxicol 54:69-80 10