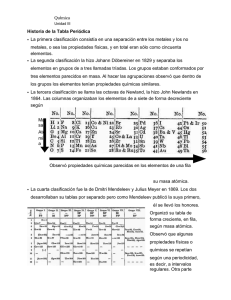
La tabla periódica 8.1 Desarrollo de la tabla periódica 240 8.2 Clasificación periódica de los elementos 241 Configuración electrónica de cationes y aniones 8.3 Variación periódica de las propiedades físicas 244 Carga nuclear efectiva • Radio atómico • Radio iónico 8.4 Energía de ionización 250 8.5 Afinidad electrónica 253 8.6 Variación de las propiedades químicas de los elementos representativos 255 Tendencias generales de las propiedades químicas a lo largo de un periodo • Propiedades de los óxidos Conceptos básicos CHANG08.indd 239 • Desarrollo de la tabla periódica En el siglo xix, algunos químicos detectaron una repetición periódica de las propiedades químicas y físicas de los elementos. En concreto, la tabla elaborada por Mendeleev agrupaba los elementos con gran precisión y era capaz de predecir las propiedades de varios elementos que no habían sido descubiertos. • Clasificación periódica de los elementos Los elementos se agrupan de acuerdo con las configuraciones electrónicas de su capa exterior, que es responsable de la semejanza en su comportamiento químico. A cada uno de estos grupos se le asigna un nombre específico. • Variación periódica de propiedades En conjunto, las propiedades físicas, tales como los radios atómicos y iónicos de los elementos, varían de una manera regular y periódica. En las propiedades químicas se aprecian variaciones similares. Las propiedades químicas de especial importancia son la energía de ionización, que mide la tendencia que tiene un átomo de un elemento a perder un electrón, y la afinidad electrónica, que mide la tendencia de un átomo de aceptar un electrón. La energía de ionización y la afinidad electrónica son la base para la comprensión del mecanismo de formación de los enlaces químicos. Tabla de los elementos de John Dalton, desarrollada a principios del siglo xix. Apoyo interactivo Resumen de actividades 1. Animación interactiva: Atracción del núcleo (8.3) 2. Animación: Radio atómico y iónico (8.3) 3. Animación interactiva: Radios atómicos (8.3) 4. Animación interactiva: Radios iónicos (8.3) 5. Animación interactiva: Energía de ionización (8.4) 11/28/07 1:29:19 AM 240 Capítulo 8 La tabla periódica 8.1 Desarrollo de la tabla periódica En el siglo xix, cuando los químicos sólo tenían una vaga idea de los átomos y las moléculas, y sin saber aún de la existencia de los electrones y los protones, desarrollaron una tabla periódica utilizando su conocimiento de las masas atómicas. Ya se habían hecho mediciones exactas de la masa atómica de muchos elementos. Ordenar los elementos de acuerdo con sus masas atómicas en una tabla periódica parecía una idea lógica a los químicos de aquella época, que pensaban que el comportamiento químico debería estar relacionado, de alguna manera, con la masa atómica. En 1864 el químico inglés John Newlands observó que cuando los elementos se ordenaban de acuerdo con sus masas atómicas, cada octavo elemento mostraba propiedades semejantes. Newlands se refirió a esta peculiar relación como la ley de las octavas. Sin embargo, esta “ley” resultó inadecuada para elementos de mayor masa atómica que el calcio, de manera que el trabajo de Newlands no fue aceptado por la comunidad científica. Cinco años más tarde el químico ruso Dimitri Mendeleev y el químico alemán Lothar Meyer, independientemente, propusieron una disposición mucho más amplia para los elementos, basada en la repetición periódica y regular de sus propiedades. El sistema de clasificación de Mendeleev superó en mucho al de Newlands, sobre todo en dos aspectos. Primero, porque agrupó los elementos en forma más exacta de acuerdo con sus propiedades; y segundo, e igualmente importante, porque hizo posible la predicción de las propiedades de varios elementos que aún no se habían descubierto. Por ejemplo, Mendeleev propuso la existencia de un elemento desconocido, al que denominó eka–aluminio (Eka es una palabra en sánscrito que significa “primero”; así, el eka–aluminio sería el primer elemento bajo el aluminio, en el mismo grupo). Cuando se descubrió el galio, cuatro años más tarde, se observó que sus propiedades coincidían notablemente con las propiedades predichas para el eka–aluminio. Masa atómica Punto de fusión Densidad Fórmula del óxido Eka–Aluminio (Ea) 68 uma Bajo 5.9 g/cm3 Ea2O3 Galio (Ga) 69.9 uma 29.78°C 5.94 g/cm3 Ga2O3 De todas maneras, las primeras versiones de la tabla periódica mostraron algunas incongruencias. Por ejemplo, la masa atómica del argón (39.95 uma) es mayor que la del potasio (39.10 uma). Si los elementos se hubieran ordenado solamente de acuerdo con su masa atómica creciente, el argón debería aparecer en la posición que ocupa el potasio en la tabla periódica moderna (observa la parte final del libro). Pero ningún químico colocaría al argón, un gas inerte, en el mismo grupo que el litio y el sodio, dos metales muy reactivos. Dichas discrepancias sugirieron que otra propiedad, diferente a la masa atómica, debería ser la base de la periodicidad observada. Resultó que esta propiedad se relaciona con el número atómico. Utilizando los datos experimentales de dispersión de partículas α (consulta la sección 2.2), Rutherford fue capaz de calcular el número de cargas positivas que había en el núcleo de algunos elementos. Sin embargo, no fue sino hasta 1913 que se estableció un procedimiento general para calcular el número atómico. Fue en este año cuando un joven físico inglés, Henry Moseley, descubrió una correlación entre lo que él llamó número atómico y la frecuencia de los rayos X que se generaban al bombardear un elemento con electrones de alta energía. Con muy pocas excepciones, Moseley encontró que el número atómico aumenta en el mismo orden que la masa atómica. Por ejemplo, el calcio es el vigésimo elemento según el orden de masa atómica creciente y tiene un número atómico de 20. Así se pudieron entender las discrepancias que antes habían encontrado los científicos. El número atómico del argón es 18 y el del potasio es 19, por lo que el potasio debe ir después del argón en la tabla periódica. CHANG08.indd 240 11/28/07 1:29:20 AM 241 8.2 Clasificación periódica de los elementos Por lo general, una tabla periódica moderna muestra el número atómico junto al símbolo del elemento. Como se sabe, el número atómico también indica el número de electrones en los átomos de un elemento. La configuración electrónica de los elementos ayuda a explicar la repetición de las propiedades físicas y químicas. La importancia y la utilidad de la tabla periódica radican en el hecho de que mediante el conocimiento de las propiedades generales y las tendencias dentro de un grupo o un periodo se pueden predecir con bastante exactitud las propiedades de cualquier elemento, incluso cuando sea un elemento poco conocido. En el apéndice 4 se explican los nombres y los símbolos de los elementos. 8.2 Clasificación periódica de los elementos En la figura 8.1 se muestra la tabla periódica junto con la configuración electrónica de los electrones externos de los elementos. (Las configuraciones electrónicas de los elementos también se encuentran en la tabla 7.3.) Empezando con el hidrógeno, se puede observar cómo los subniveles se llenan en el orden que se muestra en la figura 7.23. De acuerdo con el tipo de subnivel que se está llenando, los elementos pueden dividirse en distintas categorías: los elementos representativos, los gases nobles, los elementos de transición (o metales de transición), los lantánidos y los actínidos. Los elementos representativos (también conocidos como elementos del grupo principal) son los elementos de los Grupos 1A hasta 7A, todos los cuales tienen incompletos los subniveles s o p del máximo número cuántico principal. Con excepción del helio, los gases nobles (los elementos del Grupo 8A) tienen completamente lleno el subnivel p. (Las configuraciones electrónicas son 1s2 para el helio y ns2np6 para el resto de los gases nobles, donde n es el número cuántico principal del nivel más externo). Los metales de transición son los elementos de los Grupos 1B y 3B hasta 8B, los cuales tienen incompleto el subnivel d, o forman fácilmente cationes con el subnivel d incompleto. (Algunas veces se hace referencia a estos metales 1 1A 18 8A 1 1 H 1s1 2 2A 13 3A 14 4A 15 5A 16 6A 17 7A 2 He 1s2 2 3 Li 2s1 4 Be 2s2 5 B 2s22p1 6 C 2s22p2 7 N 2s22p3 8 O 2s22p4 9 F 2s22p5 10 Ne 2s22p6 3 11 Na 3s1 12 Mg 3s2 3 3B 4 4B 5 5B 6 6B 7 7B 8 9 8B 10 11 1B 12 2B 13 Al 3s23p1 14 Si 3s23p2 15 P 3s23p3 16 S 3s23p4 17 Cl 3s23p5 18 Ar 3s23p6 4 19 K 4s1 20 Ca 4s2 21 Sc 4s23d1 22 Ti 4s23d2 23 V 4s23d 3 24 Cr 4s13d5 25 Mn 4s23d5 26 Fe 4s23d6 27 Co 4s23d 7 28 Ni 4s23d 8 29 Cu 4s13d10 30 Zn 4s23d10 31 Ga 4s24p1 32 Ge 4s24p2 33 As 4s24p3 34 Se 4s24p4 35 Br 4s24p5 36 Kr 4s24p6 5 37 Rb 5s1 38 Sr 5s2 39 Y 5s24d1 40 Zr 5s24d2 41 Nb 5s14d 4 42 Mo 5s14d5 43 Tc 5s24d5 44 Ru 5s14d 7 45 Rh 5s14d 8 46 Pd 4d10 47 Ag 5s14d10 48 Cd 5s24d10 49 In 5s25p1 50 Sn 5s25p2 51 Sb 5s25p3 52 Te 5s25p4 53 I 5s25p5 54 Xe 5s25p6 6 55 Cs 6s1 56 Ba 6s2 57 La 6s25d1 72 Hf 6s25d2 73 Ta 6s25d 3 74 W 6s25d4 75 Re 6s25d5 76 Os 6s25d6 77 Ir 6s25d 7 78 Pt 6s15d9 79 Au 6s15d10 80 Hg 6s25d10 81 Tl 6s26p1 82 Pb 6s26p2 83 Bi 6s26p3 84 Po 6s26p4 85 At 6s26p5 86 Rn 6s26p6 7 87 Fr 7s1 88 Ra 7s2 89 Ac 7s26d1 104 Rf 7s26d2 105 Db 7s26d 3 106 Sg 7s26d4 107 Bh 7s26d5 108 Hs 7s26d6 109 Mt 7s26d 7 110 Ds 7s26d8 111 112 113 114 115 (116) (117) (118) 7s26d9 7s26d 10 7s27p1 7s27p2 7s27p3 58 Ce 6s24f 15d1 59 Pr 6s24f 3 60 Nd 6s24f 4 61 Pm 6s24f 5 62 Sm 6s24f 6 63 Eu 6s24f 7 64 Gd 6s24f 75d1 65 Tb 6s24f 9 66 Dy 6s24f 10 67 Ho 6s24f 11 68 Er 6s24f 12 69 Tm 6s24f 13 70 Yb 6s24f 14 71 Lu 6s24f 145d1 90 Th 7s26d2 91 Pa 7s25f 26d1 92 U 7s25f 36d1 93 Np 7s25f 46d1 94 Pu 7s25f 6 95 Am 7s25f 7 96 Cm 7s25f 76d1 97 Bk 7s25f 9 98 Cf 7s25f 10 99 Es 7s25f 11 100 Fm 7s25f 12 101 Md 7s25f 13 102 No 7s25f 14 103 Lr 7s25f 146d1 Figura 8.1 Configuraciones electrónicas en el estado fundamental de los elementos. Por simplificación sólo se muestra la configuración de los electrones externos. CHANG08.indd 241 11/28/07 1:29:23 AM 242 Capítulo 8 La tabla periódica TABLa 8.1 Configuración electrónica de los elementos de los Grupos 1A y 2A Grupo 1A Li Na K Rb Cs Fr [He]2s1 [Ne]3s1 [Ar]4s1 [Kr]5s1 [Xe]6s1 [Rn]7s1 Grupo 2A Be Mg Ca Sr Ba Ra [He]2s2 [Ne]3s2 [Ar]4s2 [Kr]5s2 [Xe]6s2 [Rn]7s2 Para los elementos representativos, los electrones de valencia son simplemente aquellos electrones en el nivel principal n de mayor energía. como los elementos de transición del bloque d). Los elementos del Grupo 2B son Zn, Cd y Hg, y no son elementos representativos ni metales de transición. Los lantánidos y los actínidos algunas veces son denominados los elementos de transición del bloque f porque tienen incompleto el subnivel f. Al analizar la configuración electrónica de los elementos de un grupo en particular, se observa claramente que siguen un patrón. Las configuraciones electrónicas para los Grupos lA y 2A se muestran en la tabla 8.2. Todos los miembros del Grupo lA, los metales alcalinos, tienen configuraciones electrónicas externas semejantes; todos tienen un Kernell de gas noble y un electrón externo ns1. De igual manera, los metales alcalinotérreos, el Grupo 2A, tienen un núcleo de gas noble y una configuración electrónica externa ns2. Los electrones externos de un átomo, que son los implicados en el enlace químico, generalmente reciben el nombre de electrones de valencia. La semejanza en la configuración electrónica externa es lo que hace que los elementos del mismo grupo se parezcan entre sí en su comportamiento químico. Esta observación es válida para los halógenos (elementos del Grupo 7A), cuya configuración electrónica externa es ns2np5 y presentan propiedades semejantes. Sin embargo, es necesario ser cauteloso al predecir las propiedades para los Grupos 3A hasta 7A. Por ejemplo, todos los elementos del Grupo 4A tienen la misma configuración electrónica externa, ns2np4, pero hay variaciones en las propiedades químicas entre estos elementos: el carbono es un no metal, silicio y germanio son metaloides, y estaño y plomo son metales. Como grupo, los gases nobles se comportan de manera muy similar. Con excepción del kriptón y el xenón, el resto de estos elementos son totalmente inertes desde el punto de vista químico. La razón radica en que estos elementos tienen llenos por completo los subniveles externos ns2np6, lo que les confiere una gran estabilidad. A pesar de que la configuración electrónica externa de los metales de transición no es siempre igual dentro de un grupo y no hay un patrón regular en el cambio de configuración electrónica de un metal al siguiente en el mismo periodo, todos los metales de transición comparten muchas características que los colocan aparte de otros elementos. Esto se debe a que todos estos metales tienen incompleto el subnivel d. De igual forma, los elementos lantánidos (y los actínidos) se parecen entre sí porque tienen incompleto el subnivel f. La figura 8.2 muestra los grupos de elementos estudiados aquí. EJEMPLO 8.1 Un átomo neutro de cierto elemento tiene 15 electrones. Sin consultar la tabla periódica, contesta las siguientes preguntas: (a) ¿Cuál es la configuración electrónica en estado basal del elemento? (b) ¿Cómo debería clasificarse al elemento? (c) ¿Los átomos de este elemento son diamagnéticos o paramagnéticos? Planteamiento (a) Basándose en el principio de construcción tratado en la sección 7.9, se comienza a completar la configuración electrónica a partir del número cuántico principal n = 1 y se continúa hasta que se han colocado todos los electrones. (b) ¿Cuál es la configuración electrónica característica de los elementos representativos?, ¿y de los elementos de transición?, ¿y de los gases nobles? (c) Examina el esquema de apareamiento de los electrones de la órbita más externa. ¿Qué determina si un elemento es diamagnético o paramagnético? Solución (a) Se sabe que para n = 1 se tiene un orbital 1s (2 electrones); para n = 2 se tiene un orbital 2s (2 electrones) y tres orbitales 2p (6 electrones); para n = 3 se tiene un orbital 3s (2 electrones). El número de electrones restantes es 15 – 12 = 3; estos tres electrones están localizados en los orbitales 3p. La configuración electrónica es 1s22s22p63s23p3. (Continúa) CHANG08.indd 242 11/28/07 1:29:28 AM 243 8.2 Clasificación periódica de los elementos 1 1A 1 H 3 Li 11 Na 19 K 37 Rb 55 Cs 87 Fr 2 2A 4 Be 12 Mg 20 3 3B 21 Ca Sc 38 39 Sr 56 Ba 88 Ra Y 57 Elementos representativos Zinc Cadmio Mercurio Gases nobles Lantánidos Metales de transición Actínidos 4 4B 5 5B 22 23 Ti 40 Zr 41 Nb 42 Mo 43 Tc 44 10 27 28 Co Ni 45 Ru Rh 46 Pd 29 Cu 47 Ag 30 Zn 48 Cd N O 13 14 15 16 Al 31 Ga 49 In P 32 Ge 50 33 As 51 Sn Sb 35 Se Br 52 53 Te 54 Xe Hg Tl Pb Bi Po At Rn 89 104 105 106 107 108 109 110 111 112 113 114 115 (116) (117) (118) 90 Th 59 60 Nd 91 92 Pa U 61 Pm 93 Np 62 63 Sm 94 Pu Eu 95 Am 64 Gd 96 Cm 65 Tb 97 Bk 66 Dy 98 Cf 67 Ho 99 Es 68 Er 100 Fm 69 85 36 Kr Au Pr 84 I 18 Ar Pt 58 83 34 17 Cl Ir Ce 82 S 10 Ne 77 Ds 81 Si 9 F 76 Mt 80 C 2 He Os Hs 79 12 2B 8 B 17 7A Re Bh 78 11 1B 7 16 6A W Sg 75 26 Fe 9 8B 6 15 5A Ta Db 74 25 Mn 8 5 14 4A Hf Rf 73 24 Cr 7 7B 13 3A La Ac 72 V 6 6B 18 8A 70 86 71 Tm Yb Lu 101 102 103 Md No Lr Figura 8.2 Clasificación de los elementos. Observa que los elementos del Grupo 2B se clasifican con frecuencia como metales de transición a pesar de que no muestran las características de los metales de transición. (b)Debido a que el subnivel 3p no está completamente lleno, es un elemento representativo. Basándose en la información proporcionada, no se puede decir si se trata de un metal, un no metal o un metaloide. (c)De acuerdo con la regla de Hund, los tres electrones de los orbitales 3p tienen espines paralelos (tres electrones desapareados). Como consecuencia, los átomos de este elemento son paramagnéticos. Comentario Para (b), nótese que un metal de transición tiene una subcapa d incompleta y un gas noble tiene el orbital externo completo. Para (c), es importante señalar que si los átomos de un elemento contienen un número impar de electrones, entonces el elemento debe ser paramagnético. Problema similar: 8.16 . Ejercicio de práctica Un átomo neutro de cierto elemento tiene 20 electrones. (a) Escriba la configuración electrónica del estado basal del elemento, (b) clasifica al elemento y (c) determina si los átomos del elemento son diamagnéticos o paramagnéticos. Configuración electrónica de cationes y aniones Debido a que muchos compuestos iónicos están formados por aniones y cationes monoatómicos, es útil saber cómo se escriben las configuraciones electrónicas de estas especies iónicas. Para escribir la configuración electrónica de los iones sólo es necesario un pequeño cambio respecto al método ya empleado para átomos neutros. Para su análisis, los iones se agruparán en dos categorías. CHANG08.indd 243 11/28/07 1:29:30 AM 244 Capítulo 8 La tabla periódica Iones derivados de los elementos representativos En la formación de un catión a partir del átomo neutro de un elemento representativo se pierden uno o más electrones del nivel n más alto ocupado. A continuación se muestran las configuraciones electrónicas de algunos átomos neutros y de sus cationes correspondientes: Na: [Ne]3s1 Ca: [Ar]4s2 Al: [Ne]3s23p1 Na1: [Ne] Ca21: [Ar] Al31: [Ne] Observa que cada ion tiene la configuración estable de un gas noble. En la formación de un anión se agregan uno o más electrones al nivel n más alto, que está parcialmente lleno. Considera los siguientes ejemplos: H: 1s1 F: 1s22s22p5 O: 1s22s22p4 N: 1s22s22p3 H2: 1s2 o [He] F2: 1s22s22p6 o [Ne] O22: 1s22s22p6 o [Ne] N32: 1s22s22p6 o [Ne] De nuevo, todos estos aniones también tienen la configuración estable de un gas noble. Así, una característica de la mayoría de los elementos representativos es que los iones derivados de sus átomos neutros tienen la configuración electrónica exterior de un gas noble ns2np6. Se dice que son isoelectrónicos porque tienen el mismo número de electrones y por tanto, la misma configuración electrónica fundamental. Así, H– y He también son isoelectrónicos; F –, Na+ y Ne son isoelectrónicos; y así sucesivamente. Cationes derivados de los metales de transición En la sección 7.9 se estudió que en los metales de la primera serie de transición (desde Sc hasta Cu), el orbital 4s siempre se llena antes que los orbitales 3d. Considera el manganeso, cuya configuración electrónica es [Ar]4s23d 5. Cuando se forma el ion Mn2+ se esperaría que los dos electrones salieran de los orbitales 3d para formar [Ar]4s23d3. De hecho, ¡la configuración electrónica del Mn2+ es [Ar]3d 5! La razón es que las interacciones electrón-electrón y electrón-núcleo en un átomo neutro pueden ser muy diferentes de las que se presentan en su ion. Así, mientras que el orbital 4s siempre se llena antes que los orbitales 3d en el Mn, los electrones se pierden primero del orbital 4s para formar Mn2+ debido a que los orbitales 3d son más estables que el orbital 4s en los iones de los metales de transición. Por tanto, cuando se forma un catión a partir de un átomo de un metal de transición, los electrones que siempre se pierden primero son los del orbital ns y, después, los de los orbitales (n – 1)d. Recuerda siempre que la mayoría de los metales de transición pueden formar más de un catión y que frecuentemente dichos cationes no son isoelectrónicos con el gas noble que los precede. Recuerda que el orden de entrada de los electrones no determina o predice el orden en que se quitan los electrones en los metales de transición. 8.3 Variación periódica de las propiedades físicas 1A 2A 3A 4A 5A 6A 7A Incremento de la carga nuclear efectiva de izquierda a derecha a lo largo de un periodo, y de abajo a arriba en un grupo, para elementos representativos. CHANG08.indd 244 8A Como ya se ha visto, la configuración electrónica de los elementos muestra una variación periódica al aumentar el número atómico. Como consecuencia, los elementos también presentan variaciones en sus propiedades físicas y en su comportamiento químico. En esta sección y en las secciones 8.4 y 8.5 se examinarán algunas propiedades físicas de los elementos que están en el mismo grupo o periodo, así como otras propiedades que influyen en el comportamiento químico. Se comenzará por analizar el concepto de carga nuclear efectiva, que está directamente relacionado con el tamaño atómico y con la tendencia para formar iones. Carga nuclear efectiva En el capítulo 7 se estudió el efecto pantalla que ejercen los electrones cercanos al núcleo sobre los electrones de los niveles externos en los átomos polielectrónicos. La presencia de electrones internos reduce la atracción electrostática entre los protones del núcleo, que 11/28/07 1:29:32 AM 245 8.3 Variación periódica de las propiedades físicas tienen carga positiva, y los electrones externos. Más aún, las fuerzas de repulsión entre los electrones en un átomo polielectrónico compensan la fuerza de atracción que ejerce el núcleo. El concepto de carga nuclear efectiva permite entender el efecto pantalla en las propiedades periódicas. Considera, por ejemplo, el átomo de helio cuya configuración electrónica fundamental es 1s2. Los dos protones del helio le confieren al núcleo una carga de +2, pero la fuerza total de atracción de esta carga sobre los dos electrones 1s está parcialmente balanceada por la repulsión entre los electrones. En consecuencia, se dice que cada electrón 1s está apantallado del núcleo por el otro electrón. La carga nuclear efectiva (Zeff) que es la carga que se ejerce sobre un electrón, está dada por: Animación interactiva: Atracción del núcleo. OLC Zeff 5 Z 2 σ donde Z es la carga nuclear real (es decir, el número atómico del elemento) y σ (sigma) es la constante de apantallamiento (también denominada constante de protección). La constante de pantallamiento es mayor que cero pero menor que Z. Una forma de mostrar el apantallamiento de los electrones es considerar la energía necesaria para quitar los dos electrones del átomo de helio. Las mediciones muestran que se requiere una energía de 2 373 kJ para quitar el primer electrón de 1 mol de átomos de He, y una energía de 5 251 kJ para quitar el electrón restante en 1 mol de iones de He+. La razón por la cual se necesita mucha más energía para quitar el segundo electrón es que cuando sólo está presente un electrón no existe el efecto pantalla contra la carga nuclear de +2. Para átomos con tres o más electrones, los electrones de un determinado nivel están apantallados por los electrones de los niveles internos (es decir, los más cercanos al núcleo) pero no por los electrones de los niveles externos. Así, en un átomo neutro de litio, cuya configuración electrónica es 1s22s1, el electrón 2s está apantallado por los dos electrones 1s, pero el electrón 2s no tiene ningún efecto pantalla sobre los electrones 1s. Además, los niveles internos llenos apantallan más a los electrones externos comparados con los electrones del mismo subnivel, que se apantallan entre sí. Véase la figura 7.23 para las gráficas de probabilidad radial de los orbitales 1s y 2s. Radio atómico Existen numerosas propiedades físicas, incluidas la densidad, el punto de fusión y el punto de ebullición, que están relacionadas con el tamaño de los átomos, pero el tamaño atómico es algo difícil de definir. Como se expuso en el capítulo 7, la densidad electrónica de un átomo se extiende más allá del núcleo, aunque generalmente se piensa en el tamaño atómico como el volumen que contiene alrededor de 90% de la densidad electrónica total alrededor del núcleo. Cuando se tiene que ser más específico, se define el tamaño de un átomo en términos de su radio atómico, que es la mitad de la distancia entre los dos núcleos de dos átomos metálicos adyacentes. Para los átomos que están unidos entre sí formando una red tridimensional, el radio atómico es simplemente la mitad de la distancia entre los núcleos de dos átomos vecinos [figura 8.3(a)]. Para elementos que existen como moléculas diatómicas sencillas, el radio atómico es la mitad de la distancia entre los núcleos de los dos átomos de una molécula específica [figura 8.3(b)]. En la figura 8.4 se muestran los radios atómicos de muchos elementos, de acuerdo con su posición en la tabla periódica, y en la figura 8.5 se muestra una gráfica de los radios atómicos de los mismos elementos contra su número atómico. Las tendencias periódicas son claras. Al estudiar las tendencias se debe recordar que los radios atómicos están determinados en gran medida por la fuerza de atracción entre los electrones del nivel externo y núcleo. Cuanto más fuerte es la carga nuclear efectiva, mayor es la fuerza con que los electrones son atraídos por el núcleo y menor es el radio atómico. Considera los CHANG08.indd 245 (a) (b) Figura 8.3 (a) En los metales como el berilio, el radio atómico se define como la mitad de la distancia entre los centros de dos átomos adyacentes. (b) Para los elementos que existen como moléculas diatómicas, el yodo por ejemplo, el radio atómico se define como la mitad de la distancia entre los centros de los átomos que forman la molécula. 11/28/07 1:29:34 AM 246 Capítulo 8 La tabla periódica Figura 8.4 Radios atómicos (en picómetros) de los elementos representativos, de acuerdo con su posición en la tabla periódica. Observa que no hay un acuerdo general en cuanto al tamaño de los radios atómicos. Aquí se muestran sólo las tendencias en cuanto a los radios atómicos y no respecto sus valores exactos. Aumento del radio atómico Aumento del radio atómico Animación: Radio atómico y iónico. OLC Animación interactiva: Radios atómicos. OLC CHANG08.indd 246 elementos del segundo periodo, desde el Li hasta el F, por ejemplo. Al desplazarse de izquierda derecha se encuentra que el número de electrones del nivel interno (1s2) permanece constante, en tanto que la carga nuclear aumenta. Los electrones que se agregan para balance del aumento de la carga nuclear no pueden ejercer un efecto pantalla entre sí. En consecuencia, la carga nuclear efectiva aumenta constantemente mientras el número cuántico principal permanece constante (n = 2). Por ejemplo, el electrón externo 2s del litio está protegido del núcleo (que tiene 3 protones) por los dos electrones ls. Como aproximación, se puede suponer que el efecto pantalla de los dos electrones ls cancela las dos cargas positivas del núcleo. Así, el electrón 2s sólo siente la atracción debida a un protón del núcleo; la carga nuclear efectiva es +1. En el berilio (1s22s2), cada uno de los electrones 2s está apantallado por los dos electrones internos ls, que cancelan dos de las cuatro cargas positivas del núcleo. Debido a que los electrones 2s no se apantallan entre sí de manera importante, el resultado total es que la carga nuclear efectiva para cada electrón 2s es mayor que +1. Así, a medida que la carga nuclear efectiva aumenta, el radio atómico disminuye de manera constante desde el litio hasta el flúor. En un grupo de elementos, el radio atómico aumenta a medida que aumenta el número atómico. Para los metales alcalinos del Grupo 1A, el electrón externo se encuentra en el orbital ns. Como el tamaño de los orbitales aumenta a medida que aumenta el número cuántico principal n, el tamaño de los átomos del metal aumenta desde el Li hasta el Cs. Se puede aplicar el mismo razonamiento para los elementos de otros grupos. 11/28/07 1:29:38 AM 8.3 Variación periódica de las propiedades físicas Figura 8.5 Gráfica de los radios atómicos (en picómetros) de los elementos, contra sus números atómicos. 300 Cs 250 Radio atómico (pm) Rb K 200 247 Na Li 150 Po I Br 100 Cl F 50 0 10 20 30 40 50 Número atómico 60 70 80 90 EJEMPLO 8.2 Consulta una tabla periódica y ordena los siguientes átomos en orden creciente de su radio: P, Si, N. Planteamiento ¿Cuáles son las tendencias de los radios atómicos en un grupo y en un periodo particular? ¿Cuáles de los siguientes elementos están en el mismo grupo? Solución A partir de la figura 8.2 se observa como N y P están en el mismo grupo (Grupo 5A). Por tanto, el radio del N es menor que el radio del P (el radio atómico aumenta a medida que se avanza hacia abajo en un grupo). Tanto el Si como el P están en el tercer periodo, y el Si está a la izquierda del P. En consecuencia, el radio del P es menor que el radio del Si (el radio atómico disminuye a medida que se avanza de izquierda a derecha a lo largo de un periodo). Así, el orden creciente de radio es N < P < Si. Ejercicio de práctica Ordena los siguientes átomos en orden decreciente según su radio Problemas similares 8.37, 8.38. atómico: C, Li, Be. Radio iónico El radio iónico es el radio de un catión o de un anión. El radio iónico afecta a las propiedades físicas y químicas de un compuesto iónico. Por ejemplo, la estructura tridimensional de un compuesto iónico depende del tamaño relativo de sus cationes y aniones. Cuando un átomo neutro se convierte en un ion, se espera un cambio en el tamaño. Si el átomo forma un anión, su tamaño (o radio) aumenta debido a que la carga nuclear permanece constante, pero la repulsión, producto de la adición de un electrón (electrones) adicional(es), aumenta la extensión de la nube electrónica. Por otra parte, al quitar uno o más electrones de un átomo se reduce la repulsión electrón-electrón, pero la carga nuclear permanece constante, con lo cual la nube electrónica se contrae, y el catión es CHANG08.indd 247 Animación interactiva: Radios iónicos (8.3). OLC 11/28/07 1:29:41 AM Capítulo 8 La tabla periódica Figura 8.6 Comparación del radio atómico con el radio iónico. (a) Metales alcalinos y cationes de los metales alcalinos. (b) Halógenos y iones halogenuro. 300 300 Cs 250 200 Radio (pm) Rb K 250 I− 200 Na Li Radio (pm) 248 Cs+ 150 Rb+ K+ 100 Li+ 50 0 10 Cl − 150 F− I 100 Na+ Cl 60 Br F 50 20 30 40 50 Número atómico (a) Br − 0 10 20 30 40 50 Número atómico (b) 60 más pequeño que el átomo. En la figura 8.6 se muestran los cambios de tamaño que se producen cuando los metales alcalinos se convierten en cationes y los halógenos, en aniones; en la figura 8.7 se muestran los cambios de tamaño que ocurren cuando un átomo de litio reacciona con un átomo de flúor para formar una unidad de LiF. En la figura 8.8 se muestran los radios de los iones derivados de los elementos más comunes, colocados de acuerdo con su posición en la tabla periódica. Se puede observar que existen tendencias paralelas entre el radio atómico y el radio iónico. Por ejemplo, tanto el radio atómico como el radio iónico aumentan a medida que se avanza de arriba hacia abajo en un grupo. Para los iones derivados de elementos de diferentes grupos, la comparación sólo tiene significado si los iones son isoelectrónicos. Si se examinan iones isoelectrónicos, se encuentra que los cationes son más pequeños que los aniones. Por ejemplo, Na+ es menor que F–. Ambos iones tienen el mismo número de electrones, pero el Na (Z = 11) tiene más protones que el F (Z = 9). La mayor carga nuclear efectiva del Na+ origina un menor radio. Al analizar los cationes isoelectrónicos puede verse que el radio de los iones tripositivos (iones que tienen tres cargas positivas) son más pequeños que los radios de los iones dipositivos (iones que tienen dos cargas positivas) los cuales, a su vez, son más pequeños que los iones monopositivos (iones que tienen una carga positiva). Esta tendencia se aprecia en forma adecuada observando el tamaño de tres iones isoelectrónicos del tercer periodo: Al3+, Mg2+ y Na+ (observa la figura 8.8). El ion Al3+ tiene el mismo número de electrones que el Mg2+, pero tiene un protón más. Así, la nube electrónica del Al3+ es atraída hacia el núcleo con más fuerza que en caso del Mg2+. El radio menor del Mg2+, comparado con el radio del Na+, puede explicarse de manera semejante. Al revisar Figura 8.7 Cambios de tamaño del Li y del F cuando reaccionan para formar LiF. + Li CHANG08.indd 248 F Li + F– 11/28/07 1:29:45 AM 249 8.3 Variación periódica de las propiedades físicas Li+ 78 Be2+ O2– F– 171 140 133 S2– Cl– 184 181 Se2– Br– 198 195 Te2– I– 211 220 34 Na Mg2+ 98 78 + N3– Al3+ Fe3+ Sc3+ Ti3+ V5+ Cr3+ Fe2+ Cu2+ Mn2+ Co2+ Cu+ Ni2+ 57 Zn2+ Ga3+ 2+ K+ Ca 133 106 83 68 59 64 91 67 82 82 78 72 96 83 62 In3+ Sn4+ Rb+ Sr2+ Ag+ Cd2+ 148 127 113 103 92 74 Sb5+ 62 Pb4+ Cs+ Ba2+ Au+ Hg2+ Tl3+ 165 143 137 112 105 84 Figura 8.8 Radios iónicos (en picómetros) de algunos elementos comunes, acomodados de acuerdo con su posición en la tabla periódica. los aniones isoelectrónicos, se encuentra que el radio aumenta a medida que se avanza desde los iones mononegativos (con carga [–]) hacia los iones dinegativos (con carga 2–), y así sucesivamente. De esta manera, el ion óxido es mayor que el ion fluoruro porque el oxígeno tiene un protón menos que el flúor; la nube electrónica se extiende más en el O2–. EJEMPLO 8.3 Indica, para cada uno de los siguientes pares, cuál de las dos especies es mayor: (a) N3 – o F –; (b) Mg2 + o Ca2 +; (c) Fe2 + o Fe3 +. Planteamiento En paralelo con el radio iónico, es útil clasificar los iones en tres categorías: (1) iones ioselectrónicos, (2) iones con la misma carga y que se generan a partir de átomos del mismo grupo, y (3) iones con distintas cargas pero que se generan a partir del mismo átomo. En el caso (1), los iones con carga negativa son siempre mayores; en el caso (2), los iones de átomo con un número atómico mayor son también más grandes; en el caso (3), los iones que tienen carga negativa son siempre más grandes. Solución (a) N3 – y F – son aniones isoelectrónicos, ambos contienen 10 electrones. Debido a que N3 – tiene sólo siete protones y F – tiene nueve, la menor atracción ejercida por el núcleo sobre los electrones origina que el N3 – sea mayor. (b)Tanto el Mg como el Ca pertenecen al Grupo 2A (metales alcalinotérreos). El ion Ca2 + es mayor que el Mg2 + porque los electrones de valencia del Ca se encuentran en un nivel mayor (n = 4) que los del Mg (n = 3). (c)Ambos iones tienen la misma carga nuclear, pero Fe2 + tiene un electrón más y por tanto la repulsión electrón-electrón es mayor. El radio de Fe2 + es mayor. Problemas similares: 8.43, 8.45. Ejercicio de práctica Selecciona el ion más pequeño en cada uno de los siguientes pares: (a) K+, Li+; (b) Au+, Au3 +; (c) P3 –, N3 –. CHANG08.indd 249 11/28/07 1:29:47 AM 250 Capítulo 8 La tabla periódica 8.4 Energía de ionización Como ya se ha visto a lo largo de este libro, las propiedades químicas de cualquier átomo están determinadas por la configuración de los electrones de valencia de sus átomos. La estabilidad de estos electrones externos se refleja directamente en la energía de ionización de los átomos. La energía de ionización es la energía mínima (en kJ/mol) que se requiere para quitar un electrón de un átomo en estado gaseoso, en su estado fundamental. En otras palabras, la energía de ionización es la cantidad de energía en kilojoules que se necesita para quitar un mol de electrones a un mol de átomos en estado gaseoso. En esta definición se especifica el estado gaseoso de los átomos porque un átomo en estado gaseoso no está influido por los átomos vecinos y, por tanto, no existen fuerzas intermoleculares (es decir, fuerzas entre las moléculas) que deban tomarse en cuenta al realizar la medición de la energía de ionización. La magnitud de la energía de ionización es una medida de lo fuertemente unido que está el electrón al átomo. Cuanto mayor es la energía de ionización más difícil es quitar el electrón. Para los átomos polielectrónicos, la cantidad de energía requerida para quitar el primer electrón del átomo en su estado fundamental: Animación interactiva: Energía de ionización. OLC energía 1 X(g) ~n X1(g) 1 e2 (8.1) se denomina primera energía de ionización (I1). En la ecuación (8.1), X representa un átomo de cualquier elemento y e– es un electrón. La segunda energía de ionización (I2) y la tercera energía de ionización (I3) se muestran en las siguientes ecuaciones: energía 1 X1(g) ~n X21(g) 1 e2 segunda ionización energía 1 X21(g) ~n X31(g) 1 e2 tercera ionización El patrón continúa para quitar los electrones subsecuentes. Cuando se quita un electrón de un átomo neutro disminuye la repulsión entre los electrones restantes. Debido a que la carga nuclear permanece constante, se necesita más energía para quitar otro electrón del ion cargado positivamente. Así, las energías de ionización aumentan siempre en el siguiente orden: I1 , I2 , I3 , · · · 1A 2A 3A 4A 5A 6A 7A 8A Incremento de la primera energía de ionización de izquierda a derecha en un periodo, y de abajo a arriba en un grupo para elementos representativos. CHANG08.indd 250 En la tabla 8.2 se muestran las energías de ionización de los primeros 20 elementos. La ionización siempre es un proceso endotérmico. Por convenio, la energía absorbida por los átomos (o iones) durante el proceso de ionización tiene un valor positivo. Así, todas las energías de ionización son cantidades positivas. En la figura 8.9 se muestra la variación de la primera energía de ionización con el número atómico. La gráfica muestra con claridad la periodicidad en la estabilidad del electrón atraído con menos fuerza. Observa que, salvo por algunas irregularidades, la primera energía de ionización de los elementos de un periodo aumenta a medida que aumenta el número atómico. Esta tendencia se debe al incremento de la carga nuclear efectiva de izquierda a derecha (como en el caso de la variación de los radios atómicos). Una mayor carga nuclear efectiva significa que el electrón externo es atraído con más fuerza y, por tanto, la primera energía de ionización es mayor. Una característica importante de la figura 8.9 son los máximos, que corresponden a los gases nobles. La elevada energía de ionización de los gases nobles, originada por su configuración electrónica estable en el estado fundamental, explica el hecho de que la mayoría de ellos son químicamente inertes. De hecho, el helio (ls2) tiene la primera energía de ionización más elevada entre todos los elementos. En la parte inferior de la gráfica de la figura 8.9 están los elementos del grupo 1A (los metales alcalinos), que tienen las menores energías de ionización. Cada uno de estos metales tiene un electrón de valencia (la configuración electrónica externa es ns1) apantallado de manera eficaz por los niveles internos que están llenos por completo. En consecuencia, es energéticamente fácil quitar un electrón de un átomo de un metal alcalino para formar un ion positivo (Li+, Na+, K+, ...). En forma significativa, la configuración electrónica de cada uno de estos cationes es isoelectrónica con el gas noble que los precede en la tabla periódica. 11/28/07 1:29:49 AM 8.4 Energía de ionización 251 Tabla 8.2 Energías de ionización (kJ/mol) de los primeros 20 elementos Z Elemento Primera Segunda Tercera Primera energía de ionización (kJ/mol) Quinta 1 H 1 312 2 He 2 373 5 251 3 Li 520 7 300 11 815 4 Be 899 1 757 14 850 21 005 5 B 801 2 430 3 660 25 000 32 820 Sexta 6 C 1 086 2 350 4 620 6 220 38 000 47 261 7 N 1 400 2 860 4 580 7 500 9 400 53 000 8 O 1 314 3 390 5 300 7 470 11 000 13 000 9 F 1 680 3 370 6 050 8 400 11 000 15 200 10 Ne 2 080 11 Na 495.9 3 950 6 120 9 370 12 200 15 000 4 560 6 900 9 540 13 400 16 600 12 Mg 738.1 1 450 7 730 10 500 13 600 18 000 13 Al 577.9 1 820 2 750 11 600 14 800 18 400 14 Si 15 P 786.3 1 012 16 S 17 Cl 1 251 999.5 1 521 1 580 3 230 4 360 16 000 20 000 1 904 2 910 4 960 6 240 21 000 2 250 3 360 4 660 6 990 8 500 2 297 3 820 5 160 6 540 9 300 18 Ar 2 666 3 900 5 770 7 240 8 800 19 K 418.7 3 052 4 410 5 900 8 000 9 600 20 Ca 589.5 1 145 4 900 6 500 8 100 11 000 2 500 Figura 8.9 Variación de la primera energía de ionización con el número atómico. Observa que los gases nobles tienen valores altos de energía de ionización, en tanto que los metales alcalinos y los metales alcalinotérreos tienen bajos valores de energía de ionización. He Ne 2 000 Ar 1 500 Kr H Xe Rn 1 000 500 0 CHANG08.indd 251 Cuarta Li Na 10 Rb K 20 30 Cs 40 50 Número atómico (Z) 60 70 80 90 11/28/07 1:29:54 AM 252 Capítulo 8 La tabla periódica Los elementos del Grupo 2A (los metales alcalinotérreos) tienen valores más altos para la primera energía de ionización que los metales alcalinos. Los metales alcalinotérreos tienen dos electrones de valencia (la configuración electrónica externa es ns2). Debido a que los dos electrones s no se apantallan bien entre sí, la carga nuclear efectiva para un átomo de un metal alcalinotérreo es mayor que la del metal alcalino que le precede. La mayoría de los compuestos de los metales alcalinotérreos contienen iones dipositivos (Mg2+, Ca2+, Sr2+, Ba2+ ). El ion Be2+ es isoelectrónico con el Li+ y con el He, en tanto que el Mg2+ es isoelectrónico con el Na+ y con el Ne, y así en forma sucesiva. Como se muestra en la figura 8.9, los metales tienen energías de ionización más o menos bajas comparadas con los no metales. Los valores de las energías de ionización de los metaloides por lo general se encuentran entre las de los metales y las de los no metales. La diferencia en las energías de ionización explica por qué los metales siempre forman cationes y los no metales forman aniones en los compuestos iónicos. (El único catión no metálico importante es el ion amonio, NH4+). En un determinado grupo, la energía de ionización disminuye a medida que aumenta el número atómico (es decir, hacia abajo del grupo). Los elementos de un mismo grupo tienen configuraciones electrónicas externas semejantes. Sin embargo, a medida que aumenta el número cuántico principal n, aumenta de igual manera la distancia promedio de los electrones de valencia respecto del núcleo. Una mayor separación entre el electrón y el núcleo significa que hay menor atracción, por lo que es más fácil quitar un electrón al ir de un elemento a otro hacia abajo de un grupo. De la misma manera, el carácter metálico de los elementos de un grupo aumenta de arriba hacia abajo. Esta tendencia es particularmente notoria para los elementos de los Grupos 3A al 7A. Por ejemplo, en el Grupo 4A, el carbono es un no metal, el silicio y el germanio son metaloides y el estaño y el plomo son metales. Aun cuando la tendencia general en la tabla periódica es que la primera energía de ionización aumenta de izquierda a derecha, existen algunas irregularidades. La primera excepción se encuentra entre los elementos del Grupo 2A y 3A del mismo periodo (por ejemplo, al ir del Be al B, y del Mg al Al). La primera energía de ionización de los elementos del Grupo 3A es menor que la de los elementos del Grupo 2A porque sólo tienen un electrón en el subnivel externo p (ns2np1), el cual está bien apantallado por los electrones internos y por los electrones ns2. En consecuencia, se necesita menos energía para quitar un solo electrón p que para quitar un electrón s apareado del mismo nivel energético principal. La segunda irregularidad se encuentra entre los Grupos 5A y 6A (por ejemplo, del N al O y del P al S). En los elementos del Grupo 5A (ns2np3) los electrones p se encuentran en tres orbitales diferentes, de acuerdo con la regla de Hund. En el Grupo 6A (ns2np4) el electrón adicional debe estar apareado con uno de los tres electrones p. La proximidad entre dos electrones en el mismo orbital produce una gran repulsión electrostática, lo que facilita la ionización de un átomo de un elemento del Grupo 6A, aun cuando la carga nuclear aumente en una unidad. Por tanto, las energías de ionización para los elementos del Grupo 6A son menores que las de los elementos del Grupo 5A en el mismo periodo. 1A 2A Li Be 8A 3A 4A 5A 6A 7A O S EJEMPLO 8.4 (a) ¿Qué átomo debería tener la menor primera energía de ionización: el oxígeno o el azufre? (b) ¿Qué átomo debería tener una segunda energía de ionización mayor: el litio o el berilio? Planteamiento (a) La primera energía de ionización decrece a medida que se desciende en el grupo debido a que el electrón más externo está más lejos del núcleo y sufre menor atracción. (b) Quitar el electrón más externo requiere menos energía si está apantallado por un nivel interno completo. Solución (a) El oxígeno y el azufre son miembros del Grupo 6A. Tienen la misma configuración electrónica de valencia (ns2np4), pero el electrón 3p del azufre está más alejado del núcleo y experimenta menor atracción nuclear que el electrón 2p del (Continúa) CHANG08.indd 252 11/28/07 1:29:55 AM 8.5 Afinidad electrónica 253 oxígeno. Así, siguiendo la regla general de que la energía de ionización de los elementos disminuye a medida que se avanza hacia abajo en un grupo, puede predecirse que el azufre tendrá una menor primera energía de ionización. (b) Las configuraciones electrónicas del Li y del Be son 1s22s1 y 1s22s2, respectivamente. La segunda energía de ionización es la mínima energía necesaria para quitar un electrón de un ion gaseoso monopositivo en su estado basal. Para el proceso de segunda energía de ionización se escribe: Li1(g) ~n Li21(g) 1 e2 1s2 1s1 1 Be (g) ~n Be21(g) 1 e2 1s22s1 1s2 Debido a que los electrones 1s apantallan a los electrones 2s en forma más eficaz de lo que se protegen entre sí, se puede predecir que debe ser mucho más fácil quitar un electrón 2s del Be+ que quitar un electrón ls del Li+. Comentario Compara tus resultados con los datos que se muestran en la tabla 8.2. En (a), ¿es tu predicción consistente con el hecho de que el carácter metálico del elemento se incrementa a medida que se desciende en un grupo? En (b), ¿tiene en cuenta tu predicción que los metales alcalinos forman iones +1 mientras que los metales alcalinotérreos forman iones +2? Problema similar: 8.53. Ejercicio de práctica (a) ¿Cuál de los siguientes átomos tendrá una mayor primera energía de ionización: N o P? (b) ¿Cuál de los siguientes átomos tendrá una menor segunda energía de ionización: Na o Mg? 8.5 Afinidad electrónica Otra propiedad de los átomos que influye fuertemente en su comportamiento químico, es su capacidad para aceptar uno o más electrones. Esta propiedad se denomina afinidad electrónica, que es el cambio de energía que ocurre cuando un átomo, en estado gaseoso, acepta un electrón para formar un anión. X(g) 1 e2 ~n X2(g) (8.2) Considérese el proceso en el cual un átomo gaseoso de flúor acepta un electrón: F(g) 1 e2 ~n F2(g) DH 5 2328 kJ/mol A la afinidad electrónica del flúor se le asigna un valor de +328 kJ/mol. Cuanto más positiva es la afinidad electrónica de un elemento, mayor es la tendencia de un átomo para aceptar un electrón. Otra forma de pensar en la afinidad electrónica es como la energía que se debe suministrar para quitar un electrón del anión. Para el ion fluoruro, se tiene: F2(g) ~n F(g) 1 e2 DH 5 1328 kJ/mol En consecuencia, un valor elevado positivo de la afinidad electrónica significa que el ion negativo es muy estable (es decir, el átomo tiene una gran tendencia a aceptar un electrón), al igual que una alta energía de ionización de un átomo significa que el átomo es muy estable. Experimentalmente, la afinidad electrónica se determina quitando el electrón adicional de un anión. Sin embargo, en contraste con la energía de ionización, la afinidad electrónica es difícil de medir porque los aniones de muchos elementos son inestables. En la tabla 8.3 se muestran los valores de la afinidad electrónica de algunos elementos representativos y de los gases nobles. La tendencia general a aceptar electrones aumenta (los valores de CHANG08.indd 253 11/28/07 1:29:57 AM 254 Capítulo 8 La tabla periódica Tabla 8.3 Afinidades electrónicas (kJ/mol) de algunos elementos representativos y de los gases nobles* 1A 2A 3A 4A 5A 6A 7A 8A H 73 Li Be B C N O F 60 ≤ 0 27 122 0 141 328 Na Mg Al Si P S Cl 53 ≤ 0 44 134 72 200 349 K Ca Ga Ge As Se Br 48 2,4 29 118 77 195 325 Rb Sr In Sn Sb Te I 47 4,7 29 121 101 190 295 Cs Ba Tl Pb Bi Po At 45 14 30 110 110 ? ? He <0 Ne <0 Ar <0 Kr <0 Xe <0 Rn <0 *Las afinidades electrónicas de los gases nobles, del Be y del Mg no se han determinado experimentalmente, pero se estima que son próximas a cero o negativas. La afinidad electrónica es positiva si la reacción es exotérmica y negativa si la reacción es endotérmica. afinidad electrónica se hacen más positivos) al moverse de izquierda a derecha en un periodo. Las afinidades electrónicas de los metales por lo general son menores que las de los no metales. Dentro de un grupo la variación de los valores es pequeña. Los halógenos (Grupo 7A) tienen los valores más altos de afinidad electrónica. Esto no es sorprendente si se observa que al aceptar un electrón, cada átomo de halógeno adquiere la configuración electrónica estable del gas noble que aparece de inmediato a su derecha. Por ejemplo, la configuración electrónica del F – es 1s22s22p6, o [Ne]; para el Cl– es [Ne] 3s23p6 o [Ar], y así sucesivamente. Algunos cálculos han demostrado que los valores de afinidad electrónica de los gases nobles son menores que cero. Así, los aniones de estos gases, si se pudieran formar, serían muy inestables. La afinidad electrónica del oxígeno tiene un valor positivo (141 kJ/mo1), lo que significa que el proceso: O(g) 1 e2 ~n O2(g) DH 5 2141 kJ/mol es favorable (exotérmico). Por otra parte, la afinidad electrónica del ion O– es altamente negativa (–780 kJ/mol), lo que significa que el proceso: O2(g) 1 e2 ~n O22(g) DH 5 780 kJ/mol es endotérmico, aun cuando el ion O2– es isoelectrónico con el gas noble Ne. Este proceso no es favorable en fase gaseosa porque el aumento resultante en la repulsión electrón-electrón supera la estabilidad ganada al adquirir la configuración de un gas noble. Sin embargo, observa que el ion O2– es común en los compuestos iónicos (por ejemplo, Li2O y MgO); en los sólidos, los cationes vecinos estabilizan al ion O2–. 1A 2A Be Mg Ca Sr Ba 3A 4A 5A 6A 7A 8A EJEMPLO 8.5 ¿Por qué los valores de afinidad electrónica de los metales alcalinotérreos que se muestran en la tabla 8.3 son negativos o ligeramente positivos? Planteamiento ¿Cuál es la configuración electrónica de los metales alcalinotérreos? ¿Deberían estar fuertemente atraídos por el núcleo los electrones ganados por los átomos correspondientes? (Continúa) CHANG08.indd 254 11/28/07 1:30:01 AM 255 8.6 Variación de las propiedades químicas de los elementos representativos Solución La configuración electrónica externa de los metales alcalinotérreos es ns2, donde n es el número cuántico principal más alto. Para el proceso: M(g) 1 e2 ~n M2(g) ns2 ns2np1 donde M representa un miembro del Grupo 2A, el electrón extra debe entrar en el subnivel np, que está eficazmente apantallado por los dos electrones ns (los electrones np están más alejados del núcleo que los electrones ns) y por los electrones internos. Como consecuencia, los metales alcalinotérreos no tienden a aceptar un electrón extra. Problema similar: 8.62. Ejercicio de práctica ¿Es probable que el Ar forme el anión Ar– ? 8.6 Variación de las propiedades químicas de los elementos representativos La energía de ionización y la afinidad electrónica ayudan a los químicos a entender los tipos de reacciones en las que participan los elementos, así como la naturaleza de los compuestos que forman. Desde un punto de vista conceptual, estas dos medidas están relacionadas de manera sencilla: la energía de ionización se refiere a la atracción que ejerce un átomo por sus propios electrones, en tanto que la afinidad electrónica expresa la atracción que experimenta un átomo por un electrón adicional, que proviene de alguna otra fuente. Juntos, permiten conocer la atracción que experimenta un átomo por los electrones. Con estos dos conceptos se puede estudiar, de forma sistemática, el comportamiento químico de los elementos, y poner especial atención en la relación que existe entre las propiedades químicas y la configuración electrónica. Se ha visto que el carácter metálico de los elementos disminuye de izquierda a derecha a lo largo de un periodo y que aumenta de arriba hacia abajo al avanzar dentro de un grupo. Con base en estas tendencias y en el conocimiento de que los metales generalmente tienen bajas energías de ionización, mientras que los no metales por lo general tienen altos valores de afinidad electrónica, se puede predecir con frecuencia el desarrollo de una reacción en la que intervenga alguno de estos elementos. Tendencias generales de las propiedades químicas Antes de estudiar los elementos en grupos individuales, se hará una revisión general de algunas tendencias. Se ha dicho que los elementos del mismo grupo se parecen entre sí en su comportamiento químico porque tienen configuraciones electrónicas externas semejantes. Esta afirmación, aunque es correcta en términos generales, debe aplicarse con precaución. Los químicos saben, desde hace mucho tiempo, que el primer miembro de cada grupo (el elemento del segundo periodo, desde el litio hasta el flúor) difiere del resto de los miembros del mismo grupo. Por ejemplo, el litio presenta muchas, pero no todas las propiedades características de los metales alcalinos. De forma semejante, el berilio es, hasta cierto punto, un miembro atípico del Grupo 2A, y así sucesivamente. La diferencia puede atribuirse al excepcionalmente pequeño tamaño del primer miembro de cada grupo (véase la figura 8.4). Otra tendencia en el comportamiento químico de los elementos representativos son las relaciones diagonales. Las relaciones diagonales se refieren a las semejanzas que existen entre pares de elementos de diferentes grupos y periodos en la tabla periódica. De manera específica, los tres primeros miembros del segundo periodo (Li, Be y B) presentan muchas semejanzas con los elementos localizados según la diagonal debajo de ellos en la tabla periódica (figura 8.10). La explicación de este fenómeno es la semejanza en la densidad de carga de sus cationes. (Densidad de carga es la carga de un ion dividida por su volumen). Los cationes con densidad de carga parecida reaccionan de manera semejante CHANG08.indd 255 1A 2A 3A 4A Li Be B C Na Mg Al Si Figura 8.10 Relaciones diagonales en la tabla periódica. 11/28/07 1:30:03 AM 256 Capítulo 8 La tabla periódica con los aniones y, por tanto, forman el mismo tipo de compuestos. Así, la química del litio, en algunos aspectos, es semejante a la del magnesio. Lo anterior se puede afirmar también para el berilio y el aluminio y para el boro y el silicio. Se dice que cada uno de estos pares tiene una relación diagonal. Más adelante se verán diversos ejemplos que muestran esta relación. Se debe recordar que la comparación de las propiedades de los elementos del mismo grupo es más válida si se trata de elementos del mismo tipo en relación con su carácter metálico. Estos lineamientos se aplican a los elementos de los Grupos 1A y 2A, ya que todos son metálicos, y a los elementos de los Grupos 7A y 8A, que son todos no metales. En el caso de los Grupos 3A al 6A, donde los elementos cambian de no metales a metales o de no metales a metaloides, es natural esperar una gran variación en las propiedades químicas aun cuando los miembros del mismo grupo tengan configuraciones electrónicas externas semejantes. A continuación se revisarán las propiedades químicas de los elementos representativos y de los gases nobles. (La química de los metales de transición se estudiará en el capítulo 20). Hidrógeno (1s 1) No hay una posición totalmente adecuada para el hidrógeno en la tabla periódica. Por tradición, el hidrógeno se presenta en el Grupo lA, pero en realidad forma una clase independiente. Al igual que los metales alcalinos, tiene un solo electrón s de valencia y forma un ion monopositivo (H +), el cual se encuentra hidratado en disolución. Por otra parte, el hidrógeno también forma el ion hidruro (H –) en compuestos iónicos como NaH y CaH2. En este aspecto el hidrógeno se parece a los halógenos, ya que todos ellos forman iones mononegativos (F –, Cl –, Br– y I –) en los compuestos iónicos. Los hidruros iónicos reaccionan con agua para producir hidrógeno gaseoso y el hidróxido metálico correspondiente: 2NaH(s) 1 2H2O(l) ~n 2NaOH(ac) 1 H2(g) CaH2(s) 1 2H2O(l) ~n Ca(OH)2(s) 1 2H2(g) Por supuesto, el compuesto más importante del hidrógeno es el agua, que se forma cuando el hidrógeno se quema en el aire: 2H2(g) 1 O2(g) ~n 2H2O(l) 1A 8A 2A Li Na K Rb Cs 3A 4A 5A 6A 7A Elementos del grupo 1A (ns 1, n ≥ 2) En la figura 8.11 se muestran los elementos del Grupo lA, los metales alcalinos. Todos estos elementos tienen baja energía de ionización y, por tanto, una gran tendencia a perder el único electrón de valencia. De hecho, en la gran mayoría de sus compuestos forman iones monopositivos. Estos metales son tan reactivos que nunca se encuentran libres en la naturaleza. Reaccionan con agua para producir hidrógeno gaseoso y el hidróxido metálico correspondiente: 2M(s) 1 2H2O(l) ~n 2MOH(ac) 1 H2(g) donde M representa un metal alcalino. Cuando se exponen al aire, pierden gradualmente su apariencia brillante debido a que se combinan con el oxígeno gaseoso para formar óxidos. El litio forma óxido de litio (que contiene el ion O2– ): 4Li(s) 1 O2(g) ~n 2Li2O(s) Todos los demás metales alcalinos forman óxidos y peróxidos (que contienen el ion O2– 2 ). Por ejemplo, 2Na(s) 1 O2(g) ~n Na2O2(s) CHANG08.indd 256 11/28/07 1:30:05 AM 8.6 Variación de las propiedades químicas de los elementos representativos Litio (Li) Potasio (K) 257 Sodio (Na) Rubidio (Rb) Cesio (Cs) Figura 8.11 Elementos del Grupo 1A: los metales alcalinos. El francio (no se muestra) es un elemento radiactivo. El potasio, el rubidio y el cesio también forman superóxidos (que contienen el ion O2– ): K(s) 1 O2(g) ~n KO2(s) La razón por la cual se forman diferentes tipos de óxidos cuando los metales alcalinos reaccionan con el oxígeno tiene que ver con la estabilidad de los óxidos en el estado sólido. Debido a que todos estos óxidos son compuestos iónicos, su estabilidad depende de la fuerza con que se atraen los cationes y los aniones. El litio tiende a formar predominantemente el óxido de litio porque este compuesto es más estable que el peróxido de litio. La formación del resto de los óxidos de los metales alcalinos se puede explicar de manera semejante. Elementos del Grupo 2A (ns 2, n ≥ 2) En la figura 8.15 se muestran los elementos del Grupo 2A. Como grupo, los metales alcalinotérreos son un poco menos reactivos que los metales alcalinos. Tanto la primera como la segunda energía de ionización disminuyen desde el berilio hacia el bario. Así, la tendencia es a formar iones M2+ (donde M representa un átomo de un metal alcalinotérreo), y el carácter metálico aumenta de arriba hacia abajo. La mayoría de los compuestos del berilio (BeH2 y los halogenuros de berilio, como el BeCl2), así como algunos compuestos del magnesio (MgH2, por ejemplo) son por naturaleza moleculares, antes que iónicos. La reactividad de los metales alcalinotérreos con el agua varía en forma considerable. El berilio no reacciona con el agua; el magnesio reacciona en forma lenta con el vapor de agua; el calcio, el estroncio y el bario son lo suficientemente reactivos para reaccionar con agua fría: 1A 8A 2A Be Mg Ca Sr Ba 3A 4A 5A 6A 7A Ba(s) 1 2H2O(l) ~n Ba(OH)2(ac) 1 H2(g) CHANG08.indd 257 11/28/07 1:30:10 AM 258 Capítulo 8 La tabla periódica Berilio (Be) Magnesio (Mg) Estroncio (Sr) Bario (Ba) Calcio (Ca) Radio (Ra) Figura 8.12 Elementos del Grupo 2A: los metales alcalinotérreos. La reactividad de los metales alcalinotérreos hacia el oxígeno también aumenta desde el Be hasta el Ba. El berilio y el magnesio forman óxidos (BeO y MgO) sólo a temperaturas elevadas, en tanto que CaO, SrO y BaO se forman a temperatura ambiente. El magnesio reacciona con los ácidos en disolución acuosa liberando hidrógeno gaseoso: Mg(s) 1 2H1(ac) ~n Mg21(ac) 1 H2(g) El calcio, el estroncio y el bario también reaccionan con disoluciones acuosas de ácidos para producir hidrógeno gaseoso. Sin embargo, como estos metales también reaccionan con el agua, ocurren dos reacciones diferentes de manera simultánea. Las propiedades químicas del calcio y del estroncio proporcionan un ejemplo interesante de semejanza periódica de grupo. El estroncio-90, un isótopo radiactivo, es uno de los productos principales en la explosión de una bomba atómica. Si una bomba atómica se explotara en la atmósfera, el estroncio-90 formado se depositaría poco a poco en la tierra y en el agua y llegaría a los humanos a través de una cadena alimenticia más o menos corta. Por ejemplo, si las vacas se alimentan con hierba y toman agua contaminada, el estroncio‑90 se encontrará en su leche. Debido a que el calcio y el estroncio son químicamente semejantes, los iones Sr2+ pueden reemplazar a los iones Ca2+ en los huesos de los humanos. Una exposición constante del cuerpo a la radiación de alta energía que emiten los isótopos de estroncio‑90 puede producir anemia, leucemia y otras enfermedades crónicas. 1A 8A 2A 3A 4A 5A 6A 7A B Al Ga In Tl Elementos del Grupo 3A (ns 2np1, n ≥ 2) El primer miembro del Grupo 3A, el boro, es un metaloide; el resto son metales (figura 8.13). El boro no forma compuestos iónicos binarios y no reacciona con el oxígeno gaseoso ni con el agua. El siguiente elemento, el aluminio, forma fácilmente óxido de aluminio cuando se expone al aire: 4Al(s) 1 3O2(g) ~n CHANG08.indd 258 2Al2O3(s) 11/28/07 1:30:14 AM 8.6 Variación de las propiedades químicas de los elementos representativos 259 Figura 8.13 Elementos del Grupo 3A. El bajo punto de fusión del Galio (29.8ºC), provoca su fusión en contacto con la mano. Boro (B) Aluminio (Al) Galio (Ga) Indio (In) El aluminio, que tiene una capa protectora de óxido de aluminio, es menos reactivo que el aluminio elemental. El aluminio sólo forma iones tripositivos. Reacciona con ácido clorhídrico como sigue: 2Al(s) 1 6H1(ac) ~n 2Al31(ac) 1 3H2(g) Los demás elementos metálicos del Grupo 3A forman tanto iones monopositivos como iones tripositivos. Al moverse hacia abajo del grupo, se encuentra que los iones monopositivos son más estables que los iones tripositivos. Los elementos metálicos del Grupo 3A también forman muchos compuestos moleculares. Por ejemplo, el aluminio reacciona con el hidrógeno para formar AlH3 que se parece al BeH2 en sus propiedades. (Esto constituye un ejemplo de las relaciones diagonales). Así, al desplazarse de izquierda a derecha en la tabla periódica, se observa un cambio gradual de carácter metálico a no metálico en los elementos representativos. Elementos del Grupo 4A (ns 2np2, n ≥ 2) El primer miembro del Grupo 4A, el carbono, es un no metal y los dos miembros siguientes, silicio y germanio, son metaloides (figura 8.14). Estos elementos no forman compuestos iónicos. Los elementos metálicos de este grupo, estaño y plomo, no reaccionan con agua pero sí reaccionan con ácidos (ácido clorhídrico, por ejemplo) para liberar hidrógeno gaseoso: 1A 8A 2A 3A 4A 5A 6A 7A C Si Ge Sn Pb Sn(s) 1 2H1(ac) ~n Sn21(ac) 1 H2(g) Pb(s) 1 2H1(ac) ~n Pb21(ac) 1 H2(g) Los elementos del Grupo 4A forman compuestos con estados de oxidación +2 y +4. Para el carbono y el silicio, el estado de oxidación +4 es el más estable. Por ejemplo, el CO2 es más estable que el CO y el SiO2 es un compuesto estable, en tanto que el SiO no existe en condiciones normales. Sin embargo, a medida que se desciende en el grupo se invierte la tendencia en estabilidad. En los compuestos del estaño, el estado de oxidación +4 es sólo ligeramente más estable que el estado de oxidación +2. En los compuestos del plomo el estado de oxidación +2 es, sin duda, el más estable. La configuración electrónica externa del plomo es 6s26p2, y tiende a perder sólo los electrones 6p (para formar Pb2+ ) en lugar de perder tanto los electrones 6p como los 6s (para formar Pb4+ ). CHANG08.indd 259 11/28/07 1:30:17 AM 260 Capítulo 8 La tabla periódica Carbono (grafito) Carbono (diamante) Silicio (Si) Germanio (Ge) Estaño (Sn) Plomo (Pb) Figura 8.14 Elementos del Grupo 4A. 1A 8A 2A 3A 4A 5A 6A 7A N P As Sb Bi Elementos del Grupo 5A (ns2np3, n ≥ 2) En el Grupo 5A, el nitrógeno y el fósforo son no metales, el arsénico y el antimonio son metaloides y el bismuto es un metal (figura 8.15). Así, es posible esperar una mayor variación en las propiedades dentro del grupo. El nitrógeno elemental es un gas diatómico (N2). Forma numerosos óxidos (NO, N2O, NO2, N2O4 y N2O5) de los cuales sólo el N2O5 es un sólido; los otros son gases. El nitrógeno tiene tendencia a aceptar tres electrones para formar el ion nitruro, N3– (adquiriendo así la configuración electrónica 1s22s22p6, que es isoelectrónica con el neón). La mayoría de los nitruros metálicos (Li3N y Mg3N2, por ejemplo) son compuestos iónicos. El fósforo existe como moléculas de P4. Forma dos óxidos sólidos de fórmulas P4O6 y P4O10. Los oxácidos importantes, HNO3, y H3PO4, se forman cuando los siguientes óxidos reaccionan con agua: N2O5(s) 1 H2O(l) ~n 2HNO3(ac) P4O10(s) 1 6H2O(l) ~n 4H3PO4(ac) El arsénico, el antimonio y el bismuto tienen estructuras tridimensionales extensas. El bismuto es un metal mucho menos reactivo que los metales de los grupos anteriores. 1A 8A 2A CHANG08.indd 260 3A 4A 5A 6A 7A O S Se Te Po Elementos del Grupo 6A (ns 2np4, n ≥ 2) Los tres primeros miembros del Grupo 6A (oxígeno, azufre y selenio) son no metales, y los dos últimos (telurio y polonio) son metaloides (figura 8.16). El oxígeno es un gas diatómico; el azufre y el selenio elementales tienen la fórmula molecular S8 y Se8, respectivamente; el telurio y el polonio tienen estructuras tridimensionales más extensas. (El polonio es un elemento radiactivo difícil de estudiar en el laboratorio). El oxígeno tiene tendencia a aceptar dos electrones para formar el ion óxido (O2– ) en muchos compuestos iónicos. El azufre, el selenio y el telurio también forman aniones dinegativos (S2–, Se2– y Te2– ). Los elementos de este grupo (especialmente el oxígeno) forman una gran cantidad 11/28/07 1:30:23 AM 261 8.6 Variación de las propiedades químicas de los elementos representativos Nitrógeno (N2) Arsénico (As) Fósforo blanco y rojo (P) Antimonio (Sb) Bismuto (Bi) Figura 8.15 Elementos del Grupo 5A. El nitrógeno molecular es un gas incoloro e inodoro. Azufre (S8) Selenio (Se8) Telurio (Te) Figura 8.16 Elementos del Grupo 6A, azufre, selenio y telurio. El oxígeno molecular es un gas incoloro e inodoro. El polonio (no se muestra) es radiactivo. CHANG08.indd 261 11/28/07 1:30:28 AM 262 Capítulo 8 La tabla periódica Figura 8.17 Elementos del Grupo 7A, cloro, bromo y yodo. El flúor es un gas amarillo verdoso que ataca al vidrio común. El astato es radiactivo. de compuestos moleculares con los no metales. Los compuestos importantes del azufre son SO2, SO3 y H2S. El ácido sulfúrico se forma cuando el trióxido de azufre reacciona con agua: SO3(g) 1 H2O(l) ~n H2SO4(ac) 1A 8A 2A 3A 4A 5A 6A 7A F Cl Br I At Elementos del Grupo 7A (ns 2np5, n ≥ 2) Todos los halógenos son no metales con la fórmula general X2, donde X representa un elemento halógeno (figura 8.17). Debido a su gran reactividad, los halógenos nunca se encuentran en estado elemental en la naturaleza. (El último miembro del Grupo 7A, el astato, es un elemento radiactivo, del cual se conocen pocas propiedades). El flúor es tan reactivo que reacciona con agua y genera oxígeno: 2F2(g) 1 2H2O(l) ~n 4HF(ac) 1 O2(g) En realidad, la reacción entre el flúor molecular y el agua es muy compleja; los productos formados dependen de las condiciones de la reacción. La reacción mostrada aquí es uno de varios posibles cambios. Los halógenos tienen altas energías de ionización y alta afinidad electrónica. Los aniones derivados de los halógenos (F –, Cl –, Br–, I –) se denominan halogenuros. Son isoelectrónicos con los gases nobles que se localizan a su derecha en la tabla periódica. Por ejemplo, el F– es isoelectrónico con el Ne, el Cl – con el Ar, y así sucesivamente. La gran mayoría de los halogenuros de los metales alcalinos y alcalinotérreos son compuestos iónicos. Los halógenos también forman muchos compuestos moleculares entre ellos mismos (como el ICl y BrF3) y con elementos no metálicos de otros grupos (como el NF3, PCl5, y SF6). Los halógenos reaccionan con hidrógeno para formar halogenuros de hidrógeno: H2(g) 1 X2(g) ~n 2HX(g) Esta reacción es explosiva cuando se utiliza flúor, pero se vuelve cada vez menos violenta según se sustituye por cloro, bromo y yodo. Los halogenuros de hidrógeno se disuelven en agua para formar los ácidos halhídricos. El ácido fluorhídrico (HF) es un ácido débil (es decir, es un electrolito débil) pero los otros ácidos halihídricos (HCI, HBr y HI) son ácidos fuertes (electrólitos fuertes). 1A 2A CHANG08.indd 262 8A 3A 4A 5A 6A 7A He Ne Ar Kr Xe Rn Elementos del Grupo 8A (ns2np6, n ≥ 2) Todos los gases nobles existen como especies monoatómicas (figura 8.18). Sus átomos tienen completamente llenos los subniveles externos ns y np, lo que les confiere una gran estabilidad. (El helio es ls2). Las energías de ionización de los elementos del Grupo 8A se encuentran entre las más altas de todos los elementos, y no tienen tendencia a aceptar electrones extra. Durante muchos años a estos elementos se les llamó gases inertes por 11/28/07 1:30:32 AM 263 8.6 Variación de las propiedades químicas de los elementos representativos Helio (He) Neón (Ne) Argón (Ar) Kriptón (Kr) Xenón (Xe) Figura 8.18 Todos los gases nobles son incoloros e inodoros. Estas fotografías muestran los colores emitidos por los gases en un tubo de descarga. su falta de reactividad. Hasta 1962 nadie había logrado preparar un compuesto que contuviera alguno de estos elementos. El químico británico Neil Bartletts cambió la visión de los químicos sobre estos elementos cuando expuso el xenón frente al hexafluoruro de platino, un agente oxidante fuerte, teniendo lugar la siguiente reacción (figura 8.19): 2 Xe(g) 1 2PtF6(g) ~n XeF1Pt2F11 (s) Desde entonces, se han preparado numerosos compuestos de xenón (XeF4, XeO3, XeO4, XeOF4) y unos cuantos compuestos de kriptón (KrF2, por ejemplo) (figura 8.20). Sin embargo, a pesar del gran interés por la química de los gases nobles, sus compuestos no tienen ninguna aplicación industrial y no están involucrados en procesos biológicos naturales. No se conocen compuestos con helio, neón o argón. Figura 8.19 (a) Xenón gaseoso (incoloro) y PtF6 (gas rojo) separados entre sí. (b) Cuando se permite que se mezclen los dos gases, se forma un compuesto sólido de color amarillo anaranjado. Nota que el producto fue inicialmente etiquetado con una fórmula incorrecta: XePtF6. CHANG08.indd 263 En el año 2000, un grupo de químicos preparó un compuesto que contenía argón (HArF), que es estable sólo a muy bajas temperaturas. Figura 8.20 Cristales de tetrafluoruro de xenón (XeF4). 11/28/07 1:30:36 AM 264 Capítulo 8 La tabla periódica Propiedades de los óxidos a lo largo de un periodo 1A 8A 2A 3A 4A 5A 6A 7A Na Mg Al Si P S Cl Una manera de comparar las propiedades de los elementos representativos a lo largo de un periodo es examinar las propiedades de una serie de compuestos semejantes. Debido a que el oxígeno se combina con casi todos los elementos, se compararán las propiedades de los óxidos de los elementos del tercer periodo para ver cómo difieren los metales de los metaloides y de los no metales. Algunos elementos del tercer periodo (P, S y Cl) forman varios tipos de óxidos, pero para simplificar se tomarán en cuenta sólo aquellos óxidos en los que los elementos tengan el mayor estado de oxidación. En la tabla 8.4 se presentan algunas características generales de estos óxidos. Ya se ha visto que el oxígeno tiende a formar el ion óxido. Esta tendencia se favorece cuando el oxígeno se combina con metales que tienen bajos valores de energía de ionización, como los del Grupo 1A, del Grupo 2A y el aluminio. De este modo, Na2O, MgO y Al2O3 son compuestos iónicos, como lo indican sus altos puntos de fusión y de ebullición. Tienen estructuras tridimensionales extensas en las cuales cada catión está rodeado por un número específico de aniones y viceversa. Como la energía de ionización de los elementos aumenta de izquierda a derecha, ocurre lo mismo con la naturaleza molecular de los óxidos que se forman. El silicio es un metaloide y su óxido (SiO2) también forma una gran red tridimensional, a pesar de que no hay iones presentes. Los óxidos del fósforo, azufre y cloro son compuestos moleculares constituidos por pequeñas unidades discretas. Las atracciones débiles entre estas moléculas tienen como resultado bajos puntos de fusión y de ebullición. La mayoría de los óxidos se pueden clasificar como ácidos o básicos, dependiendo de si producen ácidos o bases cuando se disuelven en agua o si reaccionan como ácidos o como bases en ciertos procesos. Algunos óxidos son anfóteros, lo que significa que tienen propiedades tanto ácidas como básicas. Los óxidos de los dos primeros elementos del tercer periodo, Na2O y MgO, son óxidos básicos. Por ejemplo, el Na2O reacciona con agua para formar hidróxido de sodio, que es una base: Na2O(s) 1 H2O(l) ~n 2NaOH(ac) El óxido de magnesio es bastante insoluble; no reacciona con el agua en forma apreciable. Sin embargo, reacciona con ácidos de forma que parece una reacción ácido-base: MgO(s) 1 2HCl(ac) ~n MgCl2(ac) 1 H2O(l) Observa que los productos de esta reacción son una sal (MgCl2) y agua, que son los productos usuales en una neutralización ácido-base. El óxido de aluminio es todavía menos soluble que el óxido de magnesio; tampoco reacciona con el agua. Sin embargo, muestra propiedades básicas cuando reacciona con ácidos: Al2O3(s) 1 6HCl(ac) ~n 2AlCl3(ac) 1 3H2O(l) Tabla 8.4 A lgunas propiedades de los óxidos de los elementos del tercer periodo Na2O MgO Al2O3 SiO2 P4O10 SO3 Cl2O7 Tipo de compuesto Iónico Estructura Tridimensional extensa Punto de fusión (°C) 1275 2800 2045 1610 Punto de ? 3600 2980 2230 ebullición (°C) Naturaleza. Básico Básico Anfótero ácido-base CHANG08.indd 264 Molecular Unidades moleculares discretas 580 16.8 291.5 ? 44.8 82 Ácido 11/28/07 1:30:42 AM 265 8.6 Variación de las propiedades químicas de los elementos representativos También muestra propiedades ácidas cuando reacciona con bases: Al2O3(s) 1 2NaOH(ac) 1 3H2O(l) ~n 2NaAl(OH)4(ac) Así, el Al2O3, se clasifica como un óxido anfótero porque muestra ambas propiedades, ácidas y básicas. Otros óxidos anfóteros son ZnO, BeO y Bi2O3. El dióxido de silicio es insoluble en agua y no reacciona con ella. Sin embargo, tiene propiedades ácidas porque reacciona con bases concentradas: Observa que esta neutralización ácido-base produce una sal pero no produce agua. SiO2(s) 1 2NaOH(ac) ~n Na2SiO3(ac) 1 H2O(l) Por esta razón, las bases fuertes, en disolución acuosa concentrada, como el NaOH(ac), no deben almacenarse en recipientes de vidrio Pyrex, porque están fabricados con SiO2. Los óxidos de los elementos restantes del tercer periodo son ácidos. Reaccionan con agua para formar ácido fosfórico (H3PO4), ácido sulfúrico (H2SO4) y ácido perclórico (HClO4): P4O10(s) 1 6H2O(l) ~n 4H3PO4(ac) SO3(g) 1 H2O(l) ~n H2SO4(ac) Cl2O7(l) 1 H2O(l) ~n 2HClO4(ac) Ciertos óxidos como CO y NO son neutros; esto significa que no reaccionan con agua para producir una disolución ácida o básica. En general, los óxidos que contienen elementos no metálicos no son básicos. Este breve análisis de los óxidos de los elementos del tercer periodo muestra que a medida que disminuye el carácter metálico de los elementos, de izquierda a derecha a lo largo del periodo, sus óxidos cambian de básicos a anfóteros y a ácidos. Los óxidos metálicos generalmente son básicos y la mayoría de los óxidos de los no metales son ácidos. Las propiedades intermedias de los óxidos (como lo muestran los óxidos anfóteros) las presentan los elementos cuyas posiciones son intermedias dentro del periodo. Observa también que, debido a que el carácter metálico aumenta de arriba hacia abajo dentro de un grupo de los elementos representativos, se espera que los óxidos de los elementos con mayor número atómico sean más básicos que los óxidos de los elementos más ligeros. Así sucede en realidad. EJEMPLO 8.6 Clasifica los siguientes óxidos como ácidos, básicos o anfóteros: a) Rb2O, b) BeO, c) As2O5. Planteamiento ¿Qué tipo de elementos forman los óxidos ácidos?, ¿y los óxidos básicos?, ¿y los óxidos anfóteros? 1A 2A Be Rb 3A 4A 5A 6A 7A 8A As Solución (a) Debido a que el rubidio es un metal alcalino, se espera que el Rb2O sea un óxido básico. (b)El berilio es un metal alcalinotérreo. Sin embargo, debido a que es el primer miembro del Grupo 2A, se espera que de alguna manera difiera respecto de los otros miembros del grupo. En el texto se mencionó que el Al2O3 es anfótero. Además, el berilio y el aluminio tienen una relación diagonal, por lo que el BeO se parece al Al2O3 en cuanto a las propiedades. Resulta que el BeO es un óxido anfótero. (c)Debido a que el arsénico es un no metal, se espera que el As2O5 sea un óxido ácido. Problema similar: 8.70. Ejercicio de práctica Clasifca los siguientes óxidos como ácidos, básicos o anfóteros: (a) ZnO, (b) P4O10, (c) CaO. CHANG08.indd 265 11/28/07 1:30:44 AM 266 Capítulo 8 La tabla periódica • Resumen de hechos y conceptos 1. Los químicos del siglo xix desarrollaron la tabla periódica acomodando los elementos en orden creciente de sus masas atómicas. Algunas discrepancias de las primeras versiones de la tabla periódica se resolvieron acomodando los elementos en orden creciente de sus números atómicos. 2. La configuración electrónica determina las propiedades de un elemento. La tabla periódica moderna clasifica los elementos de acuerdo con sus números atómicos y también de acuerdo con su configuración electrónica. La configuración de los electrones de valencia afecta directamente a las propiedades de los átomos de los elementos representativos. 3. Las variaciones periódicas de las propiedades físicas de los elementos son un reflejo de la diferencia en la estructura atómica. El carácter metálico de los elementos disminuye a lo largo de un periodo, empezando con metales, pasando por metaloides y finalmente no metales, y aumenta de arriba hacia abajo dentro de un grupo específico de elementos representativos. 4. El radio atómico varía periódicamente con la colocación de los elementos en la tabla periódica. Disminuye de izquierda a derecha y aumenta de arriba hacia abajo. 5. La energía de ionización es una medida de la tendencia de un átomo a evitar la pérdida de un electrón. A mayor energía de ionización, mayor es la fuerza de atracción del núcleo sobre el electrón. La afinidad electrónica es una medida de la tendencia de un átomo a ganar un electrón. Cuanto más positivo es el valor de la afinidad electrónica, mayor es la tendencia del átomo a ganar un electrón. Generalmente, los metales tienen baja energía de ionización y los no metales, alta afinidad electrónica. 6. Los gases nobles son muy estables debido a que sus subniveles externos ns y np están completamente llenos. Los metales de los elementos representativos (de los Grupos 1A, 2A y 3A) tienden a perder electrones hasta que sus cationes se vuelven isoelectrónicos con el gas noble que los precede en la tabla periódica. Los no metales de los Grupos 5A, 6A y 7A tienden a aceptar electrones hasta que sus aniones se vuelven isoelectrónicos con el gas noble que les sigue en la tabla periódica. • Palabras clave Afinidad electrónica, p. 253 Electrones de valencia, p. 242 Elementos representativos, p. 241 Energía de ionización, p. 250 Isoelectrónico, p. 244 Óxido anfótero, p. 264 Radio atómico, p. 245 Radio iónico, p. 247 Relación diagonal, p. 255 • Preguntas y problemas Desarrollo de la tabla periódica Preguntas de repaso 8.1 8.2 8.3 8.4 Describe brevemente la importancia de la tabla periódica de Mendeleev. ¿Cuál fue la contribución de Moseley a la tabla periódica moderna? Describe la distribución general de la tabla periódica moderna. ¿Cuál es la relación más importante entre los elementos de un mismo grupo en la tabla periódica? Clasificación periódica de los elementos Preguntas de repaso 8.5 ¿Cuáles de los siguientes elementos son metales, cuáles no metales y cuáles metaloides: As, Xe, Fe, Li, B, Cl, Ba, P, I, Si? CHANG08.indd 266 8.6 Compara las propiedades físicas y químicas de los metales y de los no metales. 8.7 Dibuja un esquema general de una tabla periódica (no se requieren detalles). Indica dónde se localizan los metales, los no metales y los metaloides. 8.8 ¿Qué es un elemento representativo? Proporciona nombre y símbolos de cuatro elementos representativos. 8.9 Sin consultar la tabla periódica, escribe el nombre y el símbolo de un elemento de cada uno de los siguientes grupos: 1A, 2A, 3A, 4A, 5A, 6A, 7A, 8A y de los metales de transición. 8.10 Indica si los siguientes elementos existen como especies atómicas, como especies moleculares o formando grandes estructuras tridimensionales, en su estado más estable a 25°C y 1 atm y anota la fórmula empírica o molecular de cada uno: fósforo, yodo, magnesio, neón, arsénico, azufre, boro, selenio y oxígeno. 11/28/07 1:30:48 AM Preguntas y problemas 8.11 A una persona se le proporciona un sólido oscuro, brillante y se le pide que determine si se trata de yodo o de un elemento metálico. Sugiere una prueba que no destruya la muestra y que permita responder correctamente. 8.12 Define el concepto de electrón de valencia. Para los elementos representativos, el número de electrones de valencia de un elemento es igual al número del grupo al que pertenece. Demuestra que esto se cumple para los siguientes elementos: Al, Sr, K, Br, P, S, C. 8.13 Escribe la configuración electrónica externa de: (a) los metales alcalinos, (b) los metales alcalinotérreos, (c) los halógenos, (d) los gases nobles. 8.14 Utiliza los elementos de la primera serie de transición (desde Sc hasta Cu) como ejemplo, explica las características de las configuraciones electrónicas de los metales de transición. Problemas 8.15 En la tabla periódica, el elemento hidrógeno algunas veces se agrupa con los metales alcalinos (como en este libro) y otras veces, con los halógenos. Explica por qué el hidrógeno puede ser similar a los elementos del Grupo lA y a los del Grupo 7A. 8.16 Un átomo neutro de cierto elemento tiene 17 electrones. Sin consultar la tabla periódica, (a) escribe la configuración electrónica del estado fundamental del elemento, (b) clasifica al elemento, (c) determina si los átomos de dicho elemento son diamagnéticos o paramagnéticos. 8.17 Agrupa las siguientes configuraciones electrónicas en parejas que puedan representar átomos con propiedades químicas semejantes: (a)1s22s22p63s2 (b)1s22s22p3 (c)1s22s22p63s23p64s23d104p6 (d)1s22s2 (e)1s22s22p6 (f)1s22s22p63s23p3 8.18 Agrupa las siguientes configuraciones electrónicas en parejas que puedan representar átomos con propiedades químicas semejantes: (a)1s22s22p5 (b)1s22s1 (c)1s22s22p6 (d)1s22s22p63s23p5 (e)1s22s22p63s23p64s1 (f) 1s22s22p63s23p64s23d104p6 8.19 Sin consultar la tabla periódica escribe la configuración electrónica de los elementos cuyos números atómicos son los siguientes: (a) 9, (b) 20, (c) 26, (d) 33. Clasifica dichos elementos. 8.20 Especifica el grupo de la tabla periódica en el que se encuentran cada uno de los siguientes elementos: (a) [Ne]3s1, (b) [Ne]3s23p3, (c) [Ne]3s23p6, (d) [Ar]4s23d 8. CHANG08.indd 267 267 8.21 Un ion M2+ derivado de un metal de la primera serie de transición tiene sólo cuatro electrones en el subnivel 3d. ¿Qué elemento podría ser M? 8.22 Un ion metálico con una carga neta de +3 tiene cinco electrones en el subnivel 3d. Identifica el metal. Configuración electrónica de iones Preguntas de repaso 8.23 ¿Cuál es la característica de la configuración electrónica de los iones estables derivados de los elementos representativos? 8.24 ¿Qué quiere decir que dos iones, o un átomo y un ion, son isoelectrónicos? 8.25 ¿Qué es incorrecto en la siguiente afirmación: “Los átomos de los elementos X son isoelectrónicos con los átomos del elemento Y”.? 8.26 Proporciona tres ejemplos de iones de metales de transición de la primera serie de transición (desde Sc hasta Cu) cuya configuración electrónica se represente por el argón como kernell de gas noble. Problemas 8.27 Escribe la configuración electrónica en el estado fundamental de cada uno de los siguientes iones: (a) Li1, (b) H2, (c) N32, (d) F2, (e) S22, (f ) Al31, (g) Se22, (h) Br2, (i) Rb1, ( j) Sr21, (k) Sn21. 8.28 Escribe la configuración electrónica en el estado fundamental de los siguientes iones, los cuales desempeñan un papel importante en los procesos bioquímicos del cuerpo humano: (a) Na1, (b) Mg21, (c) Cl2, (d) K1, (e) Ca21, (f) Fe21, (g) Cu21, (h) Zn21. 8.29 Escribe la configuración electrónica en el estado fundamental de los siguientes metales de transición: (a) Sc31, (b) Ti41, (c) V51, (d) Cr31, (e) Mn21, (f) Fe21, (g) Fe31, (h) Co21, (i) Ni21, ( j) Cu1, (k) Cu21, (l) Ag1, (m) Au1, (n) Au31, (o) Pt21. 8.30 Nombra los iones con carga +3 que tienen las siguientes configuraciones electrónicas: (a) [Ar]3d 3, (b) [Ar], (c) [Kr]4d 6, (d) [Xe]4f 145d 6. 8.31 ¿Cuáles de las siguientes especies son isoelectrónicas entre sí: C, Cl2, Mn21, B2, Ar, Zn, Fe31, Ge21? 8.32 Agrupa las especies que son isoelectrónicas: Be21, F2, Fe21, N32, He, S22, Co31, Ar. Variación periódica de las propiedades físicas Preguntas de repaso 8.33 Define radio atómico. ¿Tiene un significado preciso el tamaño de un átomo? 8.34 ¿Cómo cambia el radio atómico (a) de izquierda a derecha a lo largo de un periodo, y (b) de arriba hacia abajo dentro de un grupo? 8.35 Define radio iónico. ¿Cómo cambia el tamaño de un átomo cuando se convierte en (a) un anión y (b) un catión? 11/28/07 1:30:49 AM 268 Capítulo 8 La tabla periódica 8.36 Explica por qué, para iones isoelectrónicos, los aniones son mayores que los cationes. Problemas 8.37 Con base en la posición en la tabla periódica, selecciona el átomo de mayor radio atómico en cada uno de los siguientes pares: (a) Na, Cs; (b) Be, Ba; (c) N, Sb; (d) F, Br; (e) Ne, Xe. 8.38 Acomoda los siguientes átomos en orden decreciente de su radio atómico: Na, Al, P, Cl, Mg. 8.39 ¿Cuál es el átomo más grande del Grupo 4A? 8.40 ¿Cuál es el átomo más pequeño del Grupo 7A? 8.41 ¿Por qué el radio de un átomo de litio es bastante mayor que el radio de un átomo de hidrógeno? 8.42 Utiliza el segundo periodo de la tabla periódica como ejemplo y demuestra que el tamaño de los átomos disminuye a medida que se avanza de izquierda a derecha. Explica esta tendencia. 8.43 En cada uno de los siguientes pares, indica qué especie tendrá un tamaño menor: (a) Cl o Cl2, (b) Na o Na1, (c) O22 o S22, (d) Mg21 o Al31, (e) Au1 o Au31. 8.44 Ordena los siguientes iones en orden creciente de radio iónico: N32, Na1, F2, Mg21, O22. 8.45 Explica cuál de los siguientes cationes es mayor y por qué: Cu1 o Cu21. 8.46 Explica cuál de los siguientes aniones es mayor y por qué: Se22 o Te22. 8.47 Indica el estado físico (gaseoso, líquido o sólido) de los elementos representativos del cuarto periodo (K, Ca, Ga, Ge, As, Se, Br) a 1 atm y 25°C. 8.48 Los puntos de ebullición del neón y del kriptón son –245.9°C y –152.9°C, respectivamente. Con estos datos calcula el punto de ebullición del argón. (Nota: Las propiedades del argón son intermedias entre las del neón y el kriptón.) Energía de ionización Preguntas de repaso 8.49 Define energía de ionización. En general, las energías de ionización se miden en átomos en estado gaseoso. ¿Por qué? ¿Por qué la segunda energía de ionización siempre es mayor que la primera energía de ionización para cualquier elemento? 8.50 Dibuja un esquema de la tabla periódica y muestra las tendencias de la primera energía de ionización de los elementos en un grupo y en un periodo. ¿Qué tipo de elementos tienen las mayores energías de ionización y qué tipo de elementos tienen las menores energías de ionización? Problemas 8.51 Utiliza el tercer periodo de la tabla periódica como ejemplo para explicar el cambio en la primera energía de ionización de los elementos al avanzar de izquierda a derecha. Explica esta tendencia. CHANG08.indd 268 8.52 En general, la energía de ionización aumenta de izquierda a derecha a lo largo de un determinado periodo. Sin embargo, el aluminio tiene una energía de ionización menor que el magnesio. Explica por qué. 8.53 La primera y la segunda energías de ionización del K son 419 kJ/mol y 3 052 kJ/mol, en tanto que las del Ca son 590 kJ/mol y 1 145 kJ/mol, respectivamente. Compara los valores y elabora un comentario sobre las diferencias. 8.54 Dos átomos tienen las siguientes configuraciones electrónicas 1s22s22p6 y 1s22s22p63s1. La primera energía de ionización de uno de ellos es 2 080 kJ/mol y la del otro es 496 kJ/mol. Asigna cada uno de los valores de energía de ionización a cada una de las configuraciones electrónicas proporcionadas. Justifica tu elección. 8.55 Un ion hidrogenoide sólo contiene un electrón. La energía del electrón en un ion hidrogenoide está dada por: ⎝ n ⎞⎠ En = −(2.18×10−18 J)Z 2 ⎛ 1 2 donde n es el número cuántico principal y Z es el número atómico del elemento. Calcula la energía de ionización (en kJ/mol) del ion He+. 8.56 El plasma es un estado de la materia que consiste en iones positivos gaseosos y electrones. En el estado de plasma, un átomo de mercurio puede liberar sus 80 electrones y existir como Hg80+. Utiliza la ecuación 8.55 para calcular la energía requerida para el último paso de ionización, es decir, Hg791(g) ~n Hg801(g) 1 e2 Afinidad electrónica Preguntas de repaso 8.57 (a) Define afinidad electrónica. Las mediciones de la afinidad electrónica se efectúan en átomos en estado gaseoso. ¿Por qué? (b) La energía de ionización siempre es una cantidad positiva en tanto que la afinidad electrónica puede ser positiva o negativa. Razona la afirmación anterior. 8.58 Explica las tendencias en la afinidad electrónica desde el aluminio hasta el cloro (véase la tabla 8.3). Problemas 8.59 Acomoda los elementos de cada uno de los siguientes grupos en orden creciente de afinidad electrónica: (a) Li, Na, K; (b) F, Cl, Br, I. 8.60 Especifica cuál de los siguientes elementos se esperaría que tuviera mayor afinidad electrónica: He, K, Co, S, Cl. 8.61 Considerando los valores de afinidad electrónica de los metales alcalinos, ¿sería posible que formaran un anión M –, donde M representa al metal alcalino? 11/28/07 1:30:51 AM 8.62 Explica por qué los metales alcalinos tienen mayor afinidad por los electrones que los metales alcalinotérreos. Variación de las propiedades químicas de los elementos representativos Preguntas de repaso 8.63 ¿Qué significa relación diagonal? Indica dos pares de elementos que presenten esta relación. 8.64 ¿Qué elementos tienen mayor probabilidad de formar óxidos ácidos?, ¿y óxidos básicos?, ¿y óxidos anfóteros? Problemas 8.65 Utiliza los metales alcalinos y los metales alcalinotérreos como ejemplos para mostrar cómo se pueden predecir las propiedades químicas de los elementos, simplemente a partir de su configuración electrónica. 8.66 Con base en el conocimiento de la química de los metales alcalinos, predice algunas de las propiedades químicas del francio, el último miembro del grupo. 8.67 Como grupo, los gases nobles son muy estables químicamente (sólo se conocen compuestos de Kr y de Xe). ¿Por qué? 8.68 ¿Por qué los elementos del Grupo 1B son más estables que los elementos del Grupo 1A a pesar de que ambos parecen tener la misma configuración electrónica externa, ns1, donde n es el número cuántico principal del último nivel? 8.69 ¿Cómo cambian las propiedades de los óxidos al avanzar de izquierda a derecha a lo largo de un periodo?, ¿y de arriba hacia abajo dentro de un grupo específico? 8.70 Escribe las ecuaciones balanceadas para la reacción entre cada uno de los siguientes óxidos y el agua: (a) Li2O, (b) CaO, (c) CO2. 8.71 Escribe las fórmulas y nombra los compuestos binarios de hidrógeno y los elementos del segundo periodo (del Li hasta el F). Describe cómo cambian las propiedades físicas y químicas de estos compuestos de izquierda a derecha a lo largo del periodo. 8.72 ¿Qué óxido es más básico, MgO o BaO? ¿Por qué? Problemas adicionales 8.73 Determina si cada una de las siguientes propiedades de los elementos representativos generalmente aumenta o disminuye (a) de izquierda a derecha a lo largo de un periodo, y (b) de arriba hacia abajo dentro de un grupo: carácter metálico, tamaño atómico, energía de ionización, acidez de los óxidos. 8.74 Consulta la tabla periódica y nombra (a) un elemento halógeno del cuarto periodo, (b) un elemento semejante al fósforo en relación con sus propiedades químicas, (c) el metal más reactivo del quinto periodo, (d) un elemento que tenga un número atómico menor que 20 y que sea semejante al estroncio. CHANG08.indd 269 Preguntas y problemas 269 8.75 ¿Por qué los elementos que tienen elevadas energías de ionización tienen, normalmente, afinidades electrónicas más positivas? 8.76 Acomoda las siguientes especies isoelectrónicas en orden de (a) radio iónico creciente, y (b) energía de ionización creciente: O22, F2, Na1, Mg21. 8.77 Escribe la fórmula empírica (o molecular) de los compuestos que forman los elementos del tercer periodo (del sodio hasta el cloro) con (a) oxígeno molecular, y (b) cloro molecular. En cada caso, indica si se espera que el compuesto tenga caracter iónico o molecular. 8.78 El elemento M es un metal brillante y muy reactivo (con punto de fusión 63°C), y el elemento X es un no metal muy reactivo (punto de fusión –7.2°C). Reaccionan entre sí para formar un compuesto de fórmula empírica MX, sólido incoloro y quebradizo que se funde a 734°C. Cuando se disuelve en agua o cuando se encuentra fundido, conduce la electricidad. Cuando se burbujea cloro gaseoso en una disolución acuosa que contiene MX, se produce un líquido café rojizo y se forman iones Cl–. A partir de estas observaciones, identifica M y X. (Puede ser necesario consultar un manual de química para los valores de los puntos de fusión.) 8.79 Relaciona cada uno de los elementos de la derecha con la descripción de la izquierda: (a)Líquido rojo oscuro Calcio (Ca) Oro (Au) (b)Gas incoloro que arde en oxígeno Hidrógeno (H2) (c)Metal reactivo Neón (Ne) atacado por el agua Bromo (Br2) (d)Metal brillante utilizado en joyería (e)Gas totalmente inerte 8.80 Acomoda las siguientes especies en parejas isoelectrónicas: O1, Ar, S22, Ne, Zn, Cs1, N32, As31, N, Xe. 8.81 ¿En cuál de los siguientes conjuntos están escritas las especies en orden decreciente del tamaño de su radio? a) Be, Mg, Ba, b) N32, O22, F2, (c) Tl31, Tl21, Tl1. 8.82 ¿Cuál de las siguientes propiedades muestra una clara variación periódica? (a) primera energía de ionización, (b) masa molar de los elementos (c) número de isótopos de un elemento, (d) radio atómico. 8.83 Cuando se burbujea dióxido de carbono en una disolución clara de hidróxido de calcio, la disolución se vuelve lechosa. Escribe una ecuación para la reacción y explica cómo muestra esta reacción que el CO2 es un óxido ácido. 8.84 A una persona se le proporcionan cuatro sustancias: un líquido rojo fumante, un sólido oscuro de apariencia metálica, un gas de color amarillo pálido y un gas de color verde amarillo que ataca al vidrio. Si se te informa que dichas sustancias son los primeros cuatro miembros del Grupo 7A, los halógenos, identifica a cada uno. 11/28/07 1:30:52 AM 270 Capítulo 8 La tabla periódica 8.85 Menciona tres propiedades que muestren la semejanza química de cada uno de los siguientes pares de elementos: (a) sodio y potasio, y (b) cloro y bromo. 8.86 Menciona el nombre del elemento que forma compuestos, en las condiciones apropiadas, con los demás elementos de la tabla periódica, excepto con He y Ne. 8.87 Explica por qué la primera afinidad electrónica del azufre es 200 kJ/mol pero la segunda afinidad electrónica es – 649 kJ/mol. 8.88 El ion H– y el átomo de He tienen dos electrones 1s cada uno. ¿Cuál de las dos especies tiene mayor tamaño? Justifica. 8.89 Los óxidos ácidos son aquellos que reaccionan con agua para producir disoluciones ácidas, mientras que las reacciones de óxidos básicos con agua producen disoluciones básicas. Predice los productos de cada uno de los siguientes óxidos con agua: Na2O, BaO, CO2, N2O5, P4O10, SO3. Escribe una ecuación para cada reacción. 8.90 Escribe las fórmulas y los nombres de los óxidos de los elementos del segundo periodo (del Li al N). Identifica dichos óxidos como ácidos, básicos o anfóteros. 8.91 Establece si cada uno de los siguientes elementos es un gas, un líquido o un sólido en condiciones atmosféricas y también si existen en forma elemental como átomos, como moléculas o como redes tridimensionales: Mg, Cl, Si, Kr, O, I, Hg, Br. 8.92 ¿Qué factores explican la naturaleza única del hidrógeno? 8.93 La fórmula para calcular la energía de un electrón en un ion hidrogenoide es: ⎝ n ⎞⎠ En = −(2.18×10−18 J)Z 2 ⎛ 1 2 Esta ecuación no puede aplicarse a los átomos polielectrónicos. Una forma de modificar la ecuación para átomos más complejos es reemplazar Z por (Z – σ), donde Z es el número atómico y σ es una cantidad positiva adimensional denominada constante de apantallamiento. Considera el átomo de helio como ejemplo. El significado físico de σ es que representa la magnitud del efecto pantalla que ejercen entre sí los dos electrones ls. Por lo que la cantidad (Z – σ) se denomina, apropiadamente, “carga nuclear efectiva”. Calcula el valor de σ si la primera energía de ionización del helio es 3.94 3 10–18 J por átomo. (Para los cálculos, ignora el signo negativo de la ecuación.) 8.94 Para medir la energía de ionización de los átomos se utiliza una técnica conocida como espectroscopia fotoelectrónica. Al irradiar una muestra con luz ultravioleta (UV), esta emite electrones de su capa de valencia. Se mide la energía cinética de los electrones emitidos. Como se conoce la energía del fotón UV así como la energía cinética de los electrones emitidos, se puede escribir: hv = I + 12 mu 2 CHANG08.indd 270 donde ν es la frecuencia de la luz UV, m y u son la masa y la velocidad del electrón, respectivamente. En un experimento se encuentra que la energía cinética del electrón emitido por el potasio es de 5.34 3 10–19 J, utilizando una fuente UV cuya longitud de onda es de 162 nm. Calcula la energía de ionización del potasio. ¿Cómo se puede asegurar que esta energía de ionización corresponde al electrón de la capa de valencia (es decir, al electrón atraído con menos fuerza)? 8.95 Una estudiante recibe muestras de tres elementos, X, Y y Z, que podrían ser un metal alcalino, un miembro del Grupo 4A y un miembro del Grupo 5A. Se realizan una serie de observaciones que se enlistan a continuación: el elemento X tiene brillo metálico y conduce la electricidad, reacciona lentamente con ácido clorhídrico para producir hidrógeno gaseoso; el elemento Y es un sólido amarillo pálido que no conduce la electricidad; el elemento Z tiene brillo metálico y conduce la electricidad y cuando se expone al aire lentamente forma un polvo blanco; una disolución acuosa del polvo blanco es básica. ¿Qué se puede concluir sobre los elementos a partir de estas observaciones? 8 .96 Utilizar los siguientes datos de puntos de ebullición para calcular el punto de ebullición del francio: Metal Li Na K Rb Cs Punto de fusión (°C)180.5 97.8 63.3 38.9 28.4 (Nota: representa gráficamente los puntos de fusión contra el número atómico.) 8.97 Experimentalmente, la afinidad electrónica de un elemento se puede determinar utilizando un rayo láser para ionizar el anión de un elemento en estado gaseoso: X2(g) 1 hν ~n X(g) 1 e2 Consulta la tabla 8.3 y calcula la longitud de onda del fotón (en nanómetros) que corresponde a la afinidad electrónica del cloro. ¿A qué región del espectro electromagnético pertenece esta longitud de onda? 8.98 Menciona un elemento del Grupo lA o del Grupo 2A que sea un constituyente importante de las siguientes sustancias: (a) remedio contra la acidez estomacal, (b) enfriador para reactores nucleares, (c) sal de Epsom, (d) levadura en polvo, e) pólvora, (f) una aleación ligera, (g) fertilizante que también neutraliza la lluvia ácida, (h) cemento e (i) arena para caminos con hielo. Puede ser necesario pedir al profesor más información relacionada con algunos puntos. 8.99 Explica por qué la afinidad electrónica del nitrógeno es aproximadamente cero, mientras que los elementos carbono y oxígeno tienen afinidades electrónicas positivas. 8.100 Se conoce muy poco acerca de la química del astato, el último miembro del Grupo 7A. Describe las características físicas que se esperaría que tuviera este halógeno. Nombra los productos de la reacción entre el astaturo de sodio (NaAt) y el ácido sulfúrico. (Nota: el ácido sulfúrico es un agente oxidante.) 11/28/07 1:30:54 AM 271 Respuestas a los ejercicios de práctica 8.101 Las energías de ionización del sodio (en kJ/mol), empezando con la primera y acabando con la décimaprimera, son 495.9, 4 560, 6 900, 9 540, 13 400, 16 600, 20 120, 25 490, 28 930, 141 360, 170 000. Representa el logaritmo de la energía de ionización (eje y) contra el número de ionización (eje x); por ejemplo, el log (495.9) se representa contra 1 (denominado I1, primera energía de ionización), el log (4560) se representa contra 2 (denominado I2, segunda energía de ionización), y así sucesivamente. (a) Relaciona desde I1 hasta I11 con los electrones de los orbitales 1s, 2s, 2p y 3s. (b) ¿Qué se puede deducir acerca de los niveles electrónicos a partir de los altibajos de la curva? 8.102 Calcula la máxima longitud de onda de la luz (en nanómetros) que se requiere para ionizar un solo átomo de sodio. 8.103 Las cuatro primeras energías de ionización de un elemento son aproximadamente 738 kJ/mol, 1 450 kJ/mol, 7.7 3 103 kJ/mol y 1.1 3 104 kJ/mol. ¿A qué grupo de la tabla periódica pertenece este elemento? ¿Por qué? 8.104 Relaciona los elementos de la derecha con su descripción, a la izquierda: Nitrógeno (N2) (a) Gas amarillo pálido que reacciona con agua. Boro (B) (b)Metal suave que reacciona con Aluminio (Al) agua para producir hidrógeno. Flúor (F2) (c)Metaloide de consistencia dura Sodio (Na) que tiene un punto de fusión elevado. (d)Gas incoloro e inodoro. (e)Metal más reactivo que el hierro, pero que no sufre corrosión en el aire. 8.105 Cuando el magnesio metálico se quema en aire, forma dos productos A y B. A reacciona con agua para formar una solución básica. B reacciona con agua para formar una solución similar a la formada por A, mas un gas de olor picante. Identifica A y B y escribe las ecuaciones para las reacciones. • Problemas especiales 8.106 A finales de 1800, el físico británico Lord Rayleigh determinó con precisión las masas atómicas de ciertos elementos, pero no obtuvo un resultado preciso con el nitrógeno. Uno de sus métodos para preparar nitrógeno era mediante la descomposición de amoniaco: 2NH3(g) ~n N2(g) 1 3H2(g) Otro método era empezar con aire y eliminar el oxígeno, dióxido de carbono, y el vapor de agua originados. En todos los casos, el nitrógeno procedente del aire era un poco más denso (cerca de un 0.5%) que el procedente del amoniaco. Más tarde, el químico inglés Sir William Ramsay llevó a cabo un experimento que consistía en hacer reaccionar nitrógeno, obtenido mediante el procedimiento de Rayleigh, con magnesio calentado al rojo, para obtener nitruro de magnesio: 3Mg(s) 1 N2(g) ~n Mg3N2(s) Después de que todo el nitrógeno hubiera reaccionado con magnesio, Ramsay obtuvo un gas desconocido que no se combinaba con nada. La masa atómica de este gas era 39.95 uma. Ramsay le llamó gas argón, que significa “perezoso” en griego. (a) Más tarde Rayleigh y Ramsay, con la ayuda de Sir William Crookes, el inventor del tubo de descarga, concluyeron que el argón era un nuevo elemento. Describe el tipo de experimento que les llevó a esta conclusión. (b)¿Por qué se tardó tanto en descubrir el argón? (c)Una vez que se descubrió el argón, ¿por qué se necesitó relativamente poco tiempo para descubrir el resto de los gases nobles? (d)¿Por qué fue el helio el ultimo gas noble que se descubrió? (e)El único compuesto confirmado de radón es el fluoruro de radón, RnF. Proporciona dos razones que expliquen la existencia de tan pocos compuestos de radón. 8.107 En la misma gráfica representa la carga nuclear efectiva (en paréntesis) y el radio atómico (figura 8.4) contra el número atómico para los elementos del segundo periodo: Li (1.30), Be (1.95), B (2.60), C (3.25), N (3.90), O (4.55), F (5.20), Ne(5.85). Comenta las tendencias que notes. • Respuestas a los ejercicios de práctica 8.1 (a) 1s22s22p63s23p64s2, (b) es un elemento representativo, (c) diamagnético. 8.2 Li . Be . C. 8.3 (a) Li1, (b) Au31, (c) N32. 8.4 (a) N, (b) Mg. 8.5 No. 8.6 (a) Anfótero, (b) ácido, (c) básico. CHANG08.indd 271 11/28/07 1:30:56 AM
Anuncio
Documentos relacionados
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados