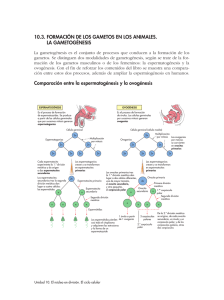
Estudio morfológico de las alteraciones producidas por el
Anuncio

ö £
o t o
Ç C O
iß<
7 k ì
Ô=î
c
u
Lil-J
h W
TES!)
1020127848
UNIVERSIDAD AUTONOMA DE NUEVO LEON
FACULTAD DE MEDICINA
SUB-DIRECCION DE ESTUDIOS DE POSTGRADO
"ESTUDIO MORFOLOGICO DE LAS (ALTERACIONES PRODUCIDAS POR EL
ETILMETANOSULFONATO, EN CELULAS ESPERMATOGENICAS DE RATON"
TESIS:
Que presenta la Dra. Guadalupe Gallegos de Lerma para
obtener el grado de MAESTRO EN CIENCIAS CON ESPECIALIDAD
EN MORFOLOGIA.
a
r
-V
.-lonterrey, N.LcV
20 de Junio de 1984.
ï H
T'a
La presente i n v e s t i g a c i ó n fué r e a l i z a d a en el Departamento de P a t o l o g í a , y el Departamento de U l t r a e s t r u c t u r a de l a Facultad
de Medicina, de l a U.A.N.L. con el apoyo económico del
Fideico
miso (CONACYT-Gobierno del Estado-U.A.N.L.), destinada a l a in.
v e s t i g a c i ó n c i e n t í f i c a de l a Universidad Autónoma de Nuevo León.
(Ref.
301.02/81/00073).
Asesor:
Q.F.B. Enrique Ramírez Bon
Co-Asesor: Dr. Sergio de l a Garza
Dedico
este
mi m e j o r
y a la
trabajo
esfuerzo
memoria
y
de
superación
a mi
esposo:
fng.
a mi
hi j o :
Jorge
de mi
Sr.
Fermín
Alberto
padre:
Eleuterio
Gallegos
Lerma
Salinas
Romero
Lerma
Galleg
Por
e s t e medio
más s i n c e r o y p r o f u n d o
aquéllas
personas,
brindaron
éste
Dr.
Sergio
Bon,
por
durante
Sepúlveda,
por
la
tesis
ha s i d o
liosa
colaboración
nicos
y secretarias
motivo,
tud.
manifiesto
así
lectura
Debo r e c o n o c e r
ésta
el
Garza y Q . F . B .
sus e n s e ñ a n z a s ;
Enrique
que l a
solo
de p e r s o n a l
de é s t a
a todos
que me
estimula-
a mis
como a l
Dr.
de
-
asesores:
Ramírez
Julio
a éste
-
trabajo.
presentación
de
gracias
va-
a la
profesional,
Facultad.
ellos
mi
todas
desarrollo
crítica
posible
a
y me
y muy e s p e c i a l m e n t e
de l a
patente,
compañeros,
desinteresado
adelante
trabajo,
hacer
agradecimiento,
maestros y
su a p o y o
ron a s e g u i r
deseo
téc-
Por é s t e
mi e t e r n a
-
gratis
INDICE DE CAPITULOS
CAPITULO
PAGINA
I . - INTRODUCCION
1
I I . - ANTECEDENTES:
A . - LA ESPERMATOGENESIS EN EL RATON
B.- ALTERACIONES PRODUCIDAS EN LA ESPERMATOGENESIS DEL
RATON POR AGENTES FISICOS Y QUIMICOS
I I I . - MATERIAL Y METODOS
4
41
52
I V . - RESULTADOS:
A . - INDUCCION DE ALTERACIONES EN LA FORMA DEL ESPERMATOZOO
DE DE RATON POR ETILMETANOSULFONATO (EMS)
56
B.- ALTERACIONES PRESENTADAS EN EL EPITELIO SEMINIFERO DE
RATONES TRATADOS CON EMS
59
C-- ALTERACIONES ULTRAESTRUCTURALES EN LA ESPERMATOGENESIS
DEL RATON INDUCIDAS POR EMS
V . - DISCUSION
V I . - RESUMEN Y CONCLUSIONES
,
70.
87
94
V I I . - PERSPECTIVAS
97
V I I I . - BIBLIOGRAFIA
99
ABREVIATURAS
A.-
Espermatogenia A
AN.-
A n i l l o Nuclear
an.-
Anulo
B.-
Espermatogonia B
C.-
Centríolo
ce.-
Cuerpo cromatoide
CF.-
Canal f l a g e l a r
CR.-
Cuerpo r e s i d u a l
Dia.Dipí.E.EN.ENR.F.FI.G.GA.-
Y SIMBOLOS
Espermatocito en d i a c i n e s i s
Espermatocito en d i p l o t e n o
Espermátides (Estadio
1 , 2 , . 1 6 )
Envoltura nuclear
Envoltura nuclear redundante
Flagelo
Fosa de implantación
Aparato de Golgi
Granulo acrosómico
I.-
Espermatogonia
L.-
Espermatocito en leptoteno
LB.M.M-I.mt.-
intermedia
Lámina basal
Manchette
Metafase del espermatocito p r i m a r i o
Mi crotúbulos
N.-
Núcleo
P--
Espermatocito en paquiteno
PL.-
Espermatocito en p r e l e p t o t e n o
S.-
Célula de S e r t o l i
VA.-
Vesícula acrosomal
VS.-
Vesícula Sexual
Z.-
Espermatocito en zigoteno
I.-
INTRODUCCION.La presente i n v e s t i g a c i ó n m o r f o l ó g i c a , se r e l a c i o n a con
l a Patología experimental específicamente con el área de Carcinogénesis, campo
que ha tenido gran auge en los ú l t i m o s años y se encamina hacia l a detección de agentes químicos ó f í s i c o s con acción carcinogénica para el hombre, e indaga
sobre el mecanismo de acción de los carcinógenos.
Son los datos epidemiológicos los que han señalado con
mayor certeza a los agentes carcinogénicos para el hombre ( 23, 83 h
s i n em-
bargo se requiere un l a r g o tiempo para l a evaluación de los efectos en v a r i a s
generaciones de i n d i v i d u o s , y solo pueden a p l i c a r s e a agentes a los que grandes poblaciones se encuentran expuestos ( 93 ) .
Por este motivo, muchos investigadores (Ames 1973; Pur^
chase 1976; Ashby 1977; Soares 1979; Zeeland 1983 e n t r e o t r o s ) » se han dedica
do a la búsqueda de modelos experimentales, que permitan la detección de agen
tes de p o t e n c i a l acción carcinogénica para el hombre. La mayoría de e l l o s se r e a l i z a n en sistemas i n - v i t r o y en organismos situados a diversos n i v e l e s taxo
nómicos, por l o que la p r i n c i p a l objeción que se puede poner a su v a l i d e z , es
la d i f i c u l t a d de e x t r a p o l a c i ó n de sus resultados al hombre ( 22, 78 ) .
Una c l a s i f i c a c i ó n de l o s p r i n c i p a l e s modelos experimenta
les para l a detección de agentes carcinogénicos se presenta en l a F i g . l
14,22,45,49,89,93,102
( 2,13,
).
Entre las pruebas de carcinogénesis a c o r t o p l a z o , en -
mamíferos " i n - v i v o "
destaca el modelo propuesto por A.J. Wyrobeck (1975), en
el que l a elevación del porcentaje de espermatozoides de forma anormal, es indi_
c a t i v a del daño al m a t e r i a l genético de las c é l u l a s espermatogénicas expuestas
( 10,57,97,98 ) . Esta prueba ha resultado ser de gran u t i l i d a d , ya que su bajo
costo y corta
duración
permite su a p l i c a c i ó n a un gran número de agentes ( 98 ) .
La prueba d e s c r i t a por Wyrobeck, se ha enfocado a l a de
tección del aumento en el número de formas anormales de los espermatozoides;
-
sin p r o f u n d i z a r en los d e t a l l e s e s t r u c t u r a l e s de las c é l u l a s malformadas ni en
los de las c é l u l a s predecesoras. En v i s t a de e s t o , se propone que los cambios
inducidos en l a morfología de los espermatozoides del r a t ó n , a consecuencia de
l a a d m i n i s t r a c i ó n de agentes mutagénicos y / ó c a r c i n o g é n i c o s , son antecedidos por cambios en l a espermatogénesis cuyo aspecto m o r f o l ó g i c o puede ser estudiado
con microscopía de luz y e l e c t r ó n i c a . Ya que esos cambios no han sido
suficien-
temente a n a l i z a d o s , los o b j e t i v o s de ésta i n v e s t i g a c i ó n son:
1 . - D e s c r i b i r los cambios morfológicos producidos por un agente mutagénico; el
e t i l - m e t a n o - s u l f o n a t o , sobre el e p i t e l i o seminífero en el t e s t í c u l o del
ratón.
2 . - I d e n t i f i c a r los cambios u l t r a e s t r u c t u r a l e s que conducen a l a producción de
espermatozoides de forma anormal.
IQ
O 3 o
OI c 03
"i r+ r+
ID
O
-i.uaCUO
3 ÍDvO
O» 3 —p.
US ->•O»
ÍD o 3
3 O
O.
O
(/) O. fD
• fD
fD
o -h
to fD
n
[
o
tO 3 to O
0» —Ol fD
3 w Q. <-+
—•' 3 O fD
O o
O
O
. ) Q.Ol-oO
—.i
fD O»
C7 3
CU 3
n 3* QO
-J. " fD
0\ r>
3 O CL
3 O)
O o 31
cu O
-5 3
n o» n
-••O Cu
3 QJ1, c
lo 1
3 tD W
((33
3
rtOJ C
CL
tuI 3—1.no
(D 3
cu
.I/i —13
fD
l/i Q.
n>
Q.
IT» Z
fD
fD O
X TD
TD —'
fD toa>
—1»
1 o>
<s>
« a n m co -D
3 c
c •
</>
QJ o
O
fD cu a> QJ rt O
CU
n 3
-5
n- tO _J. "O -5
o
z O 3" —.i
«/I
3
O
r+ « 3
o fD
in O iD
o
cu
to
.•
co
co co "a
fD
• 3 m
—j
fD
cu
OC
3
1= ft) 3 o
a
o
_i. O
3 —1
to
O) —
3 i. <-1. -••
QJ
(/i
rt1 1 fD
fß
1
i
ZT O 3" o
C
C C c—1
= —i 3
QJ c+ Cur+
3 -1. Z5 —i.
O
< O <
l/l O
to O
3 CL 3 Q.
O ft) O fD
-s
"5
3 -h 3 3"
CU CU fD
O" —'TD
-5 <T>a>
ft)
(/) O V
cr
—i• O
—i.
o;
IO r+
0+ O
l/i
o
to
3
QJ
3 »i
—
—h
fD
-s
"O O
fD </>
-5
S
O tO
to fD
3
O» fD
"5
-5U a>
C
<-i- 3
O fD
3 3
fl> <-t
</> fD
<-+
TO
o
fD
Q.
O
-s
ft)
(j0
—i
Cu
3
f+
Qj
to
-$
•
•
3=
•
O
o
-a
OI
•
*
<
-h
a>
O"
o>
<-+
•
<"!
3
O
3
O
I/>
•#
^
<
/>i
i—
CO
3s
CO
X
"O
TD
CO
00
—1
m
3
3=»
CI
—t
r~
»—i
M
3»
O
O
«
*—*
CO
TD
3»
T
>D
3=»
O
O
o
o
£
co
o
3»
T3
O
N 3» 3
O —' ->•
—<-t- O
Û. (D T
f.D "5
Q>O3
O O
-•• r>
o —•
3 fD
ft) O
to to
fD fD
3 3
—•
Cu fD
-h ->•
OO
-5 C
3 —«
ai o
n
a. ->•
fD
—> o
to
fD
to
"O
fD
-5
3
a>
<-tO
3» 3 O C~)
3 —> C Cl Qj CU CU
<-+ Cu rf _Û —13 3
fD <>
/ Q) C fD cr cr
-S r+ O -1. to —i. -J.
O O — to
• o o
Cu tú o —J. to to
3 fD» 3 n
—I.
O" 3 fD
fD tO Os f3D 3fD
O to
——i 3
—• ft)
Cl to fO
Q. O —'
fD • • n- fD io
CU
Ol
n -î —« S
-s í/>
fD ft> "O
-s C fD
O T3 IO VI JD fD
c n
3 c-i0)i c Cl to
fD <•+
rt
-5
Q
-ï
—J.o
-•. Q) 3
f
D
D. to -j. 3
3 CfD
L
-j.
fio
D n ai
3
n
—i. fD
3
QJ 3 —i
3" O r+
ri- a>
QJ O to
fD 3 fD
-5 O to
to
C
3 to
n
O; O»
3
= <?1
3 3
Q
J
c
—
QJ
<-!• o
to O
CL -5
—.i 3—>•
• Ol
-s
to
n qj
O
tQ
—to
QJ IO •
<-+
••
"O CO
O
-5 3
fD
3 to
n
o to
-Î
TD Cl
O fD
-s
QJ O
T9
O
—i. >
O»
3 3
O
Cl
ft> TD
-5
-H
—».toO
3 -s
QJ
Q. 3
CU
3 Cl
QJ QJ
.w.
3
O.
r+ —.i
O
QJ QJ
Cl Q_
o> CU
—
<-+
TO
ft)
to
—1.
to
«-+
fD
3
Oi.
Q>
o>
CU
cy>
o
c
QJ
C
T
CU
3
QJ
—
fD -H
3 "5
Ol
—i 3
O) to
-h
3 O
ft) -5
O 3
-5 Cu
o n
"O ->•
to 0\
3
O)
• 3
fD
O
TD
on
ioi.
o
QJ
CL
fD
3
O
io
r+
CU
Û.
QJ
C^ "O
m I»
•-H 3»
O 3
Om
• -H
TD
O
i—i
2
O
O
>
O
o
TD
O
m
i—
m
-n
m
O
—1
O
o
O
IO
O
CD
O
o
I I . - ANTECEDENTES.
Dados l o s o b j e t i v o s de ésta i n v e s t i g a c i ó n , es necesario presentar en éste
c a p i t u l o , primeramente una d e s c r i p c i ó n de l a espermatogénesis en el r a t ó n , así
como de las c a r a c t e r í s t i c a s morfológicas de las c é l u l a s espermatogénicas del Túbulo Seminífero en ésta especie. En segundo término se presentará, l o que en
la b i b l i o g r a f í a se r e p o r t a acerca de las a l t e r a c i o n e s producidas a n i v e l del e p i t e l i o germinal masculino, en especial sobre las c é l u l a s espermatogénicas y
los espermatozoides d e l r a t ó n , por diversos agentes químicos y f í s i c o s .
A . - La Espermatogénesis en el Ratón.
La espermatogénesis en los mamíferos, es un proceso continuo de diferencia_
ción c e l u l a r , que comprende t r e s eventos p r i n c i p a l e s : l a p r o l i f e r a c i ó n y renova_
ción de las espermatogonias, l a meiosis y la espermiogénesis, que conducen a l a
formación de c é l u l a s altamente e s p e c i a l i z a d a s : los espermatozoides.
Este proceso c o n s t i t u y e un sistema p a r t i c u l a r m e n t e f a v o r a b l e para el e s t u dio de los eventos de d i f e r e n c i a c i ó n c e l u l a r , por conducir a un solo t i p o de c£
l u l a , ser altamente s i n c r ó n i c o y l o c a l i z a r s e en un órgano e s p e c í f i c o , acompañan
dose de notables cambios en l a e s t r u c t u r a y composición química de éstas c é l u l a s
( ? )•
La espermatogénesis se l l e v a a cabo en el t e s t í c u l o , que en el ratón se lo
c a l i z a en l a región i n g u i n a l
( 6 6 ) ; l a anatomía macroscópica y microscópica de -
esta g l á n d u l a , así como su d e s a r r o l l o embrionario han sido ampliamente
descri-
tas en v a r i a s especies ( 5 , 5 8 , 6 6 ) , por este motivo nos enfocaremos a l a d e s c r i p ción del e p i t e l i o seminífero en el ratón haciendo é n f a s i s en l a
ultraestructura
de las c é l u l a s espermatogénicas. Por ú l t i m o citaremos brevemente l a s í n t e s i s de
macromoléculas en la espermatogénesis, con l a f i n a l i d a d de e x p l i c a r n o s con bases moleculares, sus p r i n c i p a l e s eventos m o r f o l ó g i c o s .
a ) . - Estructura del Tùbulo Seminifero.
Los túbulos seminíferos constituyen l a p a r t e exócrina del t e s t í c u l o ( 5 ) ;
cada t ù b u l o está rodeado por una làmina propia ó l i m i t a n t e , que a su vez consta
de dos hojas, i n t e r n a y externa, con f i b r a s de colágena dispuestas paralelamente
al eje del tùbulo e i n c l u i d a s en una substancia de moderada e l e c t r o d e n s i d a d . Am
bas hojas encierran una capa de c é l u l a s aplanadas con grumos densos de heterocro
matina y agregados perinucleares de organelos citoplásmicos ( 29 ) . Estas c é l u las se han d e s c r i t o como c é l u l a s mioides ó c o n t r á c t i l e s , por presentar c a r a c t e r í s t i c a s de c é l u l a s musculares l i s a s ( 5 ) .
La población c e l u l a r del e p i t e l i o germinal del tùbulo s e m i n í f e r o , comprende
dos líneas c e l u l a r e s : las células sustentaculares de S e r t o l i y las c é l u l a s espermatogénicas. La organización y e s t r u c t u r a del t ù b u l o puede ser apreciada en
la F i g . 2 .
La Célula de S e r t o l i es de forma p i r a m i d a l , y se extiende desde l a lámina
propia hasta l a luz del tùbulo s e m i n í f e r o . Su parte p r i n c i p a l descansa sobre l a
lámina propia y contiene al núcleo, c l a r o y de nucléolo muy c a r a c t e r í s t i c o . La
porción intermedia de ésta c é l u l a emite proyecciones citoplásmicas l a t e r a l e s er^
t r e las cuales quedan colocadas las c é l u l a s espermatogénicas; finalmente sus proyecciones apicales encierran a los espermátides j u s t o antes de que salgan a
l a luz del tubulo seminífero ( 5, 20 ) .
La u l t r a e s t r u c t u r a de l a c é l u l a de S e r t o l i , se conoce bastante bien ( 5,
20, 28 ) y se i l u s t r a esquemáticamente en l a F i g . 2 . Los l í m i t e s entre dos c é l u las de S e r t o l i adyacentes pueden d i s t i n g u i r s e
fácilmente por la presencia de
e s p e c i a l i z a c i o n e s de unión, sobre todo en l a región basai. Se t r a t a de uniones
estrechas modificadas, de gran r e s i s t e n c i a , que a l t e r n a n con uniones de nexo ( 28,29,32,67
).
En v i r t u d de l a presencia de t a l e s uniones estrechas, la c é l u l a de S e r t o l i
cumple además de las funciones t r a d i c i o n a l m e n t e señaladas (soporte y n u t r i c i ó n
de las c é l u l a s espermatogénicas), con el establecimiento de l a barrera hemato-
Fig-
o
D
oblacion c e l u l a r
' tubulo ernmar-ro. ' r p a n i z a c i o t . de los
'
compartimentos vasal y yuxxalum-: .1.
t e s t i c u l a r y con l a compartimentalización del túbulo s e m i n í f e r o , en v i s t a de
que impiden l a llegada de muchas substancias provenientes de l a sangre a l a
luz del túbulo y de que se establece un compartimiento basal e n t r e las u n i o nes ocluyentes de la c é l u l a de S e r t o l i y l a lámina p r o p i a , y un compartimien^
to luminal e n t r e las mismas uniones y l a luz del t ú b u l o ( 5,20,29,73
).
Las c é l u l a s que se s i t ú a n en el compartimiento basal: espermatogonias y
espermatocitos p r e l e p t o t é n i c o s , tienen acceso a las substancias provenientes
de l a sangre, por l a v í a del t e j i d o conectivo i n t e r s t i c i a l y l o s espacios in_
t e r c e l u l a r e s de l a t ú n i c a p r o p i a ; al parecer el proceso de renovación de célu^
las madres puede o c u r r i r independientemente de l a c é l u l a de S e r t o l i
Cuando las c é l u l a s germinales del t e s t í c u l o i n i c i a n
( 16, 20 ) .
la profase de la -
primera d i v i s i ó n m e i ó t i c a , salen del compartimiento basal y entran al microam
biente del compartimiento l u m i n a l , en donde no están expuestas directamente a
las substancias provenientes del plasma sanguíneo ( 20,53,73 ) . Para alcanzar
a las c é l u l a s germinales avanzadas t a l e s m a t e r i a l e s
deben atravezar al
cito-
plasma de l a c é l u l a de S e r t o l i , en donde están sujetos a modificaciones ( 16 ) ,
y p a r t e del mismo quedará r e t e n i d o en los cuerpos densos m u l t i f o r m e s , del
tipo
de los lisosomas, para su u l t e r i o r degradación ( 73 ) .
La profase m e i ó t i c a y las dos d i v i s i o n e s de maduración, son procesos úni_
eos en l a gónada, que pueden r e q u e r i r el ambiente especial p r o v i s t o por los complejos de unión de l a c é l u l a de S e r t o l i y l a barrera he;r,atotesticular ( 20 ) .
Por o t r a p a r t e , l o s fenómenos de expansión y r e t r a c c i ó n con pérdida del citoplasma a p i c a l , y reabsorción de espermatozoides i n v o l u t i v o s y espermatogon lasen degeneración, son o t r a s modificaciones morfológicas que en las c é l u l a s
de S e r t o l i acompañan a l a espermatogénesis ( 58 ) .
b) El C i c l o del E p i t e l i o
Seminífero.
El l i n a j e del túbulo seminífero de los mamíferos, compuesto de espermatogonias, espermatocitos, espermátides y c é l u l a s de S e r t o l i , s u f r e una r í g i d a y
M
tí)
"0
PI
00
w
o
c
z
o
>
50
M
O
>
>-î
M
O
w
w
CO
M
<73
G
Z
O
T)
50
—
i i
M
50
PI
pi
H
>
T)
>
>
T3
>
>
-9
O
O
—
i i
H
O
>
n
o
c
25
O
>
W
H
>
TJ
>
IsD
TJ
M
H
>
>
O
n
c
n
M
o
c
o
Z
-T3
50
co
£>
en
c/)
fi
s?
s
>
H
O
(73
O
en
co
T3 TI
50 n
M
3
> >
50
O
O
M
H
O
m
t/3
•n
pi
H
M
T)
O
f—I
T3
O
PI
P
>O
M
H
w
H
ET)
50
S
>
O
>
>
03
M
•P
s» : M
-0
03
T)
03
T)
ai
-0
•"d
w
T3
50
03
!
I
>
I <
>
: <
>
•
M<
<
>
M
I1
f t "
50
-0
>
IS
3 CO
I
1—t
>
O
H.
-a
tsi
I S O
I I MMÛ»
TJ
N
<
M
' M
I t-H
, X
>
, X
>
i X
M
>
X
M
r e p e t i t i v a s e r i e de cambios, conocida como el C i c l o d e l E p i t e l i o Seminífero ( 7 ).
Clermont (1969). Define al c i c l o del e p i t e l i o seminífero como "una s e r i e
completa de asociaciones c e l u l a r e s sucesivas que aparecen en una área dada de
un túbulo s e m i n í f e r o " . Las c é l u l a s espermatogénicas en d i f e r e n t e s etapas del d e s a r r o l l o no se encuentran d i s t r i b u i d a s al azar en el e p i t e l i o s e m i n í f e r o , sino que se presentan en una s e r i e de asociaciones ó combinaciones bien definí^
das y f á c i l m e n t e i d e n t i f i c a b l e s ( 5, 12 ) .
En el r a t ó n , se han d e s c r i t o 12 asociaciones c e l u l a r e s d i s t i n t a s , corres^
pondientes cada una de e l l a s a las 12 etapas del c i c l o del e p i t e l i o
seminífero
{ 68 ) , y el aspecto de túbulos seminíferos adyacentes.varía de acuerdo a d i f e r e n t e s asociaciones c e l u l a r e s . Estas asociaciones c e l u l a r e s se muestran en la F i g . 3, y fueron propuestas por primera vez por Oakberg (1955) quien hizo
una i n t e r p r e t a c i ó n de l a espermatogénesis en el r a t ó n , basada en estudios de
l a espermiogénesis, en t e s t í c u l o s i r a d i a d o s y con l a Técnica de S h i f f con A c i do Peryódico.
Las f i g u r a s 5, 6 y 7 muestran asociaciones c e l u l a r e s d i f e r e n t e s ,
vistas
en c o r t e s semifinos de túbulos seminíferos de r a t ó n .
Un c i c l o del e p i t e l i o seminífero t i e n e una duración de 8.63 + 0.26 d í a s ,
y se requieren cuatro v u e l t a s al c i c l o para que una espermatogonia l l e g u e a ser espermatozoide que se l i b e r a en l a luz del túbulo s e m i n í f e r o ; la duración
t o t a l de l a espermatogénesis es por l o tanto de 33.5 a 35.5 días ( 69 ) . Estu_
dios por captación de t i m i d i n a t r i t i a d a y r a d i o a u t o g r a f í a , p e r m i t i e r o n conocer la duración r e l a t i v a de cada etapa del c i c l o , basándose en observación de
secciones transversas de túbulos s e m i n í f e r o s , en las que l a frecuencia de pre
sentación de v a r i a s etapas, obtenidas del examen de un gran número de secciones
es i n d i c a t i v o de su duración r e l a t i v a en porcentaje ( 12 ) . Sin embargo,
ya que el c i c l o es un proceso c o n t i n u o , y sus etapas c o n s t i t u y e n t e s son p o r -
r
f1
m
Cl
TJ
(0
g
g
çu\
rt
Ha.
A
ta
ro
fO
LÛ
fO
•
rt
w
fD
3
P
r+
0
n
H.
r+
0
CO
a
Q
c
3
ûOJ
^
p.
O
pi
o
0
p
o
p.
&
o
p*
3
ro
co
H.
en
•+
3
ÍÍ
rt
ft)
ûj
w
ro
«
Mi
o
p
w
0)
TJ
CD
3
CU
rt
0
O
p.
rt
O
-o
-3
M.
3
ai
p.
o
o
pTi
H
O
H3
p.
O
0
ro1
H
M
W
'O
CD
w
w
•o
o
^
3
Ol
rt
O
0
p.
rt
O
T3
P»
3
&
•3
p.
O
TJ
CU
•û
C
p.
r+
(t>V
3
p.
O
O
Û)
rt
0
0
p.
rt
0
"O
>ï
p.
S
ÛJ
^
p.
O
[SI
p.
oo
o
r+
a»
3
p.
O
O
co
-j
-J
en
P
m
co
ti
<T>
y
(1)
r+
0
0
P«
rt
0
-J
P.
g
QJ
p.
°
ro
13
r+
0
r+
rov
3
p.
O
O
r;
T?
ro
T
Cu
rt
0
era
0
s
p.
ai
es
M
ro
T
3
Cu
r+
0
O
Prt
0
U
P.
3
tu
••s
p.
o
o
3
•
r>
V
"î
o
3
ai
*
0
M
0
3
H0)
p>
3
rt
n
CJ/
ro
—
f—i
>
M
O
û)
0
Od
0
3
h"
eu
l1
>
1
rt-
I—i
Ci
fí>
3
ro
Q.
p.
01
O
TJ
0
M
O
a
c
>
o
í—<
o
z
IO
co
pk
to
P
c
M
C
>
W
en
•"O
w
S
>
H
O
ÍD
M
Z
w
co
M
CO
ITI
Z
en
t"
CO
1 pro i a
3
»
TJ
>
r*
o
hH
ro
i
ro t
j O
-4
TJ
i
z
H
co
ro
M
ro
3
1i I-+
(D
if
s»
•-3
o
z
o
-p
p
t-* 1 ^
p
en
•
co
h-»
a>
1
to
co
•
p
1^
M
en
•
CO
rO
ai
•
co
!1 w
•
Í
01
ro
CD
•
C»
CO
co
•
en
a
H»
C
»U
ÍD
m
TJ
ro
T
3
ÖJ CU
rf f-1
Oo
N
O
p. TJ
a»
a •s
(D ai
<b
a
CD
H
-p
-p
p^
p
CD
en
to
CÌ
to
co
to
en
ro
«
co
to
-J
O"
•
1
1
10
œ
1 ^
CO
o
co
en
en
.
3
>
X
M
S
o
/«s
a.
H»
eu
en
r+
O
tr
c
H
O
• >-h
O
>3
3
CU
3
tu
a
c
"S
eu
a
ro
t-1
o
s»
03
M
Ci
co
en
-J
Etapa II del ciclo del epítalio seminífero: Se observan espermatocitos pa_
quiténicos, espermátides en fase de Golgi, y una generación más avanzada
de espermátides alargados en maduración (estadio 13), incluidos en el ci_
topiasma de la célula de Sertoli. Se
señala la lámina basal.C Objetivo 40X)
F i g u r a
Etapa VII del ciclo del epitelio semi
nifero del ratón. Se observan la lámi
na basal circundante, espermatogonias
B, dos filas de espermatocitos paquiténicos y espermátides en fase de cas_
quete. (Objetivo 100X).
F i g u r a
No. 6
No. 5
Etapa IX. del ciclo del epitelio seminífero del ratón. Se observan e s —
permatocitos leptoténicos, zigoténicos, paquiténicos y espermátides en
elongación. Sobre la lámina basal se
observan los núcleos de algunas célu
las de Sertoli. (Qbjetívo 40X).
F i g u r a
No. 7
Esquema que representa los modelos de
renovación de e tiernatogonias en el rarón; proyuest-as por Bustos Obregon,
19bS (a) y Vackins, 1971 (b), molificados de acuor v
OackDerg,
(Ver explicación en el texto).
Los números
ronaios indican
etapas del ci_lo en que se
den
las
células.
F i e u r a
las
divi
lío. 3
Espermatocitos
(a)
Espermatocitos
(b)
ratón prepuberal ( 4 ) . Las espermatogenias A, miden unas 12 mieras de diámet r o , presentan una cromatina nuclear homogénea y nucléolos m ú l t i p l e s y reticu^
lados cerca de l a envoltura n u c l e a r . El citoplasma es escaso, finamente grani¿
l a r , pobre en r e t í c u l o eridoplásmico y pequeñas mitocondrias ovoides ó e s f é r i cas v e s i c u l a r e s . Las espermatogenias B, son v i s t a s con más frecuencia y tienen
un diámetro de 8 a 9 mieras. El núcleo presenta mayor cantidad de heterocromat i n a en masas c e n t r a l e s y un f i n o borde de heterocromatina alrededor de l a mem
brana nuclear ( 29 ) ; el nucléolo simple y r e t i c u l a d o es v i s t o cerca del cent r o del núcleo ( 4 ) . El citoplasma y los organelos son s i m i l a r e s a l o s descri_
tos para las espermatogenias A ( 5 ) .
A pesar de v a r i a s i n v e s t i g a c i o n e s la forma exacta de renovación de las es^
permatogonias A en roedores, aún no se d e f i n e b i e n , y prevalecen dos puntos de
v i s t a d i f e r e n t e s . Uno propuesto por Clermont y Bustos Obregón (1968), sugiere
la presencia de dos grandes categorías de espermatogenias A: las " c é l u l a s madres reserva" ó t i p o Aq y las " c é l u l a s madres en renovación" ó t i p o A^ a A^.
El t i p o Aq corresponde a espermatogenias A aisladas ó por pares, de bajo í n d i ce m i t ó s i c o (0.19) que aunque se encuentran presentes en todas las etapas del
c i c l o , solo esporádicamente contribuyen a la formación de nuevas espermatogen i a s . Los t i p o s A j a A^ son más numerosos, forman grupos l i n e a l e s a l o l a r g o
de l a membrana l i m i t a n t e del t ú b u l o , y se d i v i d e n durante el c i c l o para aumer^
t a r su número y renovarse así mismas. Según este modelo l a s espermatogonias A
e I provienen de l a s espermatogonias A^.
El segundo modelo, propuesto por Huckins y Oakberg (1971) considera a las espermatogonias Aq, responsables de l a renovación y a los t i p o s A^ a A^,
así como las espermatogonias I y B, c é l u l a s en d i f e r e n c i a c i ó n .
Estos dos mo-
delos de renovación se presentan en esquema de l a F i g . 8 , tomado de Bratmaska
y Clermont (1983), cuyos r e c i e n t e s estudios concuerdan con el primero de los
modelos que -bemos d e s c r i t o .
< 1 11 - : x i
(IX-Xi I
- o
t
>v
*
M-l
DIA
F 13.9
. \».V ' 1
MORFOLOGIA
DE
ESPERMATOGONIAS
Y
ESPERMATOCITOS
A pesar de que no puede hacerse una c l a r a d i s t i n c i ó n entre los d i f e r e n t e s
t i p o s de espermatogonias A,basándose en l o s datos aportados por v a r i o s autores
( 4,36,70 ) se presentan esquemáticamente en l a F i g . 9. Las d i f e r e n c i a s morfológicas son mínimas y r e f e r e n t e s sobre todo a l a t i n c i ó n n u c l e a r , l a presencia
y tamaño del núcleo, y l a cantidad y l o c a l i z a c i ó n de pequeñas masas de heterocromatina. La i d e n t i f i c a c i ó n del t i p o de espermatogonia A^ a A^ se hace sobre
todo por l a etapa
manos en l a Fig.
del c i c l o en l a que se presentan (indicados con números r o 9).
d) Meiosis: Morfología de l o s Espermatocitos.
Como r e s u l t a d o de una s e r i e de d i v i s i o n e s m i t ó s i c a s y fenómenos de d i f e renciación c e l u l a r ,
las espermatogonias producen un s i n c i t i o de espermatocitos
primarios ( 24 ) , los cuales entran j u n t o s a l a fase f i n a l de s í n t e s i s de DNA
y después de un período de crecimiento c e l u l a r , i n i c i a n el proceso de meiosis
( 7 ).
La meiosis es una forma de d i v i s i ó n c e l u l a r , cuyas f i n a l i d a d e s son: reducin a l a mitad e l número de cromosomas de una c é l u l a ,
es d e c i r p r o d u c i r l a -
condición haploide en las c é l u l a s h i j a s , y p e r m i t i r el intercambio del m a t e r i a l genético ( 82 ) . Esto se logra a t r a v é s de dos d i v i s i o n e s : La meiosis I
que culmina con l a formación de los Espermatocitos Secundarios, que entran r £
pidamente a l a Meiosis I I para formar espermátides ( 4,52,82
).
La profase de l a meiosis I , es marcadamente l a r g a , e i n c l u y e las etapas
de Leptoteno, Zigoteno, Paquiteno, Diploteno y D i a c i n e s i s . Los p r i n c i p a l e s
-
eventos que acontecen en e l l a son el apareamiento de los cromosomas homólogos
y e l intercambio de segmentos de sus cromátides ( 4,82 ) .
La s i g u i e n t e d e s c r i p c i ó n morfológica de los espermatocitos está basada escencialmente en los t r a b a j o s de Gardner (1964) y Bel 1 vé (1977). Los esperma_
t o c i t o s primarios en etapa de preleptoteno y leptoteno están presentes en el
ratón a los 10 días después del nacimiento; en ratones adultos son observables
en las etapas I X , X y XI temprana del c i c l o del e p i t e l i o seminífero ( 4 ) .
Los espermatocitos p r e l e p t o t é n i c o s son los mas pequeños de las c é l u l a s germi_
n a l e s , miden 7 . 5 a 8.2 mieras de diámetro y están separados de l a membrana basal por procesos c i t o p l á s m i c o s de l a c é l u l a de S e r t o l i . Areas l o c a l i z a d a s
de heterocromatina se presentan esparcidas en el núcleo y ocasionalmente cer.
ca de l a membrana nuclear. La cromatina r e s t a n t e está dispersa en forma homo
génea pero es más densamente granular que en las espermatogenias t i p o B ( F i g .
9).
Característicamente el preleptoteno contiene una cantidad l i m i t a d a de citoplasma. El Leptoteno se c a r a c t e r i z a por l a a p a r i c i ó n
de f i n o s
filamentos
l o n g i t u d i n a l e s en el núcleo que representan el i n i c i o de l a formación de los
cromosomas. En o t r a s áreas la cromatina de l o s espermatocitos l e p t o t é n i c o s es
homogénea y g r a n u l a r y la cromatina condensada v i s t a en preleptoteno empieza
a comprimirse sobre l a envoltura nuclear. Frecuentemente se observan fragmentos de nucleonema. Estas c é l u l a s tienen un diámetro de 8 a 10 mieras y son si_
milares en tamaño a las Espermatogonias B ( F i g s . 9 y 10).
Los Espermatocitos primarios zigoténicos se observan por primera vez hac i a el día 12 después del nacimiento y una vez establecido el c i c l o de la espermatogénesis del ratón a d u l t o , se presentan en las etapas XI y X I I temprana
( 68 ) . Se c a r a c t e r i z a n morfológicamente por l a presencia de segmentos cortos
de complejos sinaptonémicos. La condensación de los cromosomas X y Y forma l a
"vesícula sexual" que también se i n i c i a en ésta etapa de l a profase m e i ó t i c a .
Un nucléolo r e t i c u l a d o se observa situado tangencialmente ó en l a vecindad de
la vesícula sexual. Estas c é l u l a s tienen un diámetro de 10 a 12 mieras y son
por l o t a n t o mayores que los espermatocitos p r e l e p t o t é n i c o s . El citoplasma contiene cantidades c r e c i e n t e s de r e t í c u l o endoplásmico rugoso en p i l a s de c i s t e r n a s estrechas. Las mitocondrias se vuelven más alargadas con unas pocas
c r e s t a s d i l a t a d a s ( F i g s . 9 y 11). La t r a n s i c i ó n de zigoteno a paquiteno es g r a d u a l ; los autosomas están ahora apareados
por los Complejos Sinaptonémi-
Microfotoprafía electrónica en la que
se observan espermatocitos leptoténicos en el compartimiento yuxtaluminal
del tiibulo seminífero, separadas de la lámina basal por el citoplasma de
una célula de Sertoli. Complejos de unión entre las células de Sertoli
—
adyacentes, están señalados con flechas. (b, 6U0 X )
F i g u r a
Espermatocito zigoténico de la profase meiótica T. La croiriatina empieza a
condensarse; pequeñas porciones de ma
terial electrodenso están en relación
a la vesícula sexual. El citoplasma es muy abundante y contiene mitocon—
drias vesiculosas y una gran cantidad
de pequeñas vesículas membranosas.
(5, 700 X)
F i g u r a
No. 11
No. 10
Espermatocito primario paquiténico.
L1 nticleo presenta grumos más gruesos de heterocromatina y se observan
los compiojos sinaptonémicos (fie—
chas), así como la envoltura nuclear.
En el citoplasma, que es menos abundante que en etapas anteriores, se observan nutocondrias y cisternas de
retículo endoplásmico rugoso.
(8, 70u X)
F i g u r a
Espermatocito primario diploténico.
En el núcleo se observan segmentos de
cronu-tina muy conúensada que corres—
ponden a los cromosomas. La vesícula
sexual está asociada a la envoltura nuclear, que en algunos sitios ha desaparecido (flechas). Aun se observa
roatei ial nu:2eolar. L1 citoplasma es
muy escaso, presenta mitocondrias y
una red muy extensa de cisternas membranosas, que se continúa con la cisterna perinuclear. Se señalan la lámina basal y la célula de Sertoli.
(9,000 X)
F i
E
u r a
No. 13
No. 12
En la Diacinesis el proceso de " t e r m i n a l i z a c i ó n , por el que los s i t i o s
de unión e n t r e los cromosomas anteriormente apareados se desplazan a los extremos, es l o mas prominente, además de la desaparición de l a e n v o l t u r a nuclear.
( 82 )
En la Anafase I l o s centrómeros de cada par homólogo se desplazan hacia
los polos opuestos del espermatocito, a r r a s t r a n d o con e l l o s ambos cromátides
( 82 ) .
Espermatocitos en Diacinesis pueden ser v i s t o s en l a etapa X I I del
del e p i t e l i o seminífero del r a t ó n , al igual que metafases de
ciclo
espermatocitos
p r i m a r i o s , espermatocitos secundarios y metafases meióticas I I ( 68 ) F i g s . 9 ,
14, 15.
Los estudios u l t r a e s t r u c t u r a l e s ,
confirman l a escasez de Espermatocitos
Secundarios; que tienden a ser más pequeños que los espermatocitos primarios
t a r d í o s ; su núcleo es e s f é r i c o con agregados de substancia cromatínica c e n t r a j
mente l o c a l i z a d o s . Las mitocondrias muestran s i m i l i t u d a las de los espermáti_
des; grandes magnificaciones muestran que las paredes engrosadas de las m i t o condrias es debida a crestas que se disponen paralelamente a l a membrana e x terna ( 29 ). En general e x i s t e poca información respecto a l a morfología del
espermatocito secundario; en l a b i b l i o g r a f í a d i s p o n i b l e no se encontraron mas
d e t a l l e s de su u l t r a e s t r u c t u r a .
e) Espermiogénesis.
La espermiogénesis, fase f i n a l de l a espermatogénesis, c o n s i s t e en una compleja transformación morfológica de l a c é l u l a s germinal haploide que culmi_
na con la s a l i d a de espermatozoides maduros a l a luz del túbulo s e m i n í f e r o .
Aunque los fenómenos generales de l a espermiogénesis pueden seguirse con
el microscopio ó p t i c o , l o s d e t a l l e s más f i n o s y exactos han sido estudiados con microscopía
electrónica.
Los cambios morfológicos que conducen a l a formación de espermatozoides
Espermatocito primario en la etapa de
la Diacinesis de la profase meiótica
1. Aún se observa la envoltura n u —
olear, aunque el nucléolo y la vesícula sexual no se aprecian en ésta se
cción. La condensación del material cromatínico es mayor. El escaso cito
plasma presenta los organelos ya des
critos.
(6, 600 X)
F i g u r a
Espermatocito primario durante la metafase de la primera división robotica. Los cromosomas se encuentran alineados en el ecuador de la célula.
(8, 900 X)
F i g u r a
No. 15
No.
m
quedan comprendidos en cuatro grandes fases ó etapas: l a Fase de G o l g i , l a Fa
se de Casquete, l a Fase Acrosomal y l a Fase de Maduración ( 5 ) , que en el r a t ó n
incluyen 16 estadios d i f e r e n t e s , d e s c r i t o s en base a cambios acrosomales y nu_
cleares ( 68 ) , observables en cortes de 5 mieras de g r o s o r , de t e j i d o
testi-
c u l a r f i j a d o en Zencker-Formol y teñidos con P A - S c h i f f .
Estudios con microscopía e l e c t r ó n i c a , analizando los cambios u l t r a e s t r u c ^
t u r a l e s comprendidos en este proceso de d i f e r e n c i a c i ó n c e l u l a r han sido repo£
tados por diversos autores ( 13,15,25,30,41,43,80,85,86",100 y 101).
A continuación presentamos una d e s c r i p c i ó n de los p r i n c i p a l e s eventos en
cada etapa, que se i l u s t r a n esquemáticamente en l a Fig.
16.
Fase de G o l g i . - Se i n i c i a con l a a p a r i c i ó n de espermátides redondos ó p i l i é d r i _
eos que r e s u l t a n de l a d i v i s i ó n de los espermatocitos secundarios, ( e s t a d i o 1 ) ,
los cuáles pueden ser i d e n t i f i c a d o s con c e r t e z a , cuando uno ó más gránulos pe_
queños se aprecian en el i n t e r i o r de l o s sáculos del Aparato de Golgi de p o s i ción yuxtanuclear (estadio 2 ) . Generalmente se t r a t a de dos ó t r e s gránulos lj_
mitados por una membrana de G o l g i ; éstos gránulos se t i ñ e n con el r e a c t i v o de
S c h i f f y su contenido es r i c o en carbohidratos ( 5,30,68 ) . La f u s i ó n de los gránulos proacrosómicos en un gran gránulo adyacente a l núcleo, marca el
inicio
de l a etapa 3; el gránulo acrosómico queda contenido en una gran vesícula limi^
tada por una membrana que se adhiere a l a envoltura nuclear en el estadio 4 , Figs. 17 y 18. El punto de adherencia marca la f u t u r a punta a n t e r i o r del esper
matozoíde.
Durante l a Fase de Golgi el núcleo es e s f é r i c o , grande y c l a r o , con un carioplasma finamente p a r t i c u l a d o , de electrodensidad moderada; es común ver
uno ó más grumos de heterocromatina ( 30 ) . La evolución del r e t í c u l o endoplás^
mico en la espermiogénesis fué d e s c r i t a por Clermont (1978); en l a F i g . 21 se
i l u s t r a su d i s p o s i c i ó n en etapa de casquete; se ha propuesto que l a c o n t i n u i dad del r e t í c u l o endoplásmico a través de los puentes i n t e r c e l u l a r e s pueda con
Pag. 2U
Fig. 16. Espermiogénesis en el ratón.
2ri
-
—
K%*
4
'
Lsperni.ítiae en fase de Golgi. El nucleo presenta una cromatina finamente
gì anular, y aigunos grumos densos cen
erales. El citoplasma es abundante,
** i •
con numerosas mitocondrias vesiculosas de paredes engrosadas, t.1 aparato
. GA
r
O-
* '*
k
2 Ml;-.
ae Golgi y la vesícula acroscmica ob
r
o*-^'
o
& i
servan en el polo anterior de la célu
la. En una de las células se observa
..
L>
? '
i"
A
'
a
•o
W
^
"
0
/ v
el granulo acrosómico y en otra el -
_y
cuerpo cromatoide.
3
V > "t ^
(3, 60u X)
*
'
'
1
„o
/
- -
rJ*
Extremo anterior de un espfermaticre en
fase de Golgi faumento de la region indicada en la Fig. anterior). Pequeñas vesículas se desprenden de la cara de maduración ael Golgi y se dirigen hacia la v.¿sí<;ula acrosomal, a la
que se fusionan agregándole su conter>~"_!o. La envoltura nuclear aparece en
grosada en el sitio donde la vesícula
acrosomal se adhiere a ella, se señala con flechas.
(7, 3CO X)
F i f u r a No. 13
F i g u r a
No. 17
t r i b u i r a l a s i n c r o n i z a c i ó n del proceso de d i f e r e n c i a c i ó n del espermátide.
(94)
Las mitocondrias tienden a l o c a l i z a r s e p e r i f é r i c a m e n t e ( 41 ) , y grandes magrii
f i c a c i o n e s permiten observar d i l a t a d o s espacios i n t r a c r í s t i c o s , que a baja magnificación dan el aspecto de mitocondrias vacuoladas. En muchos casos las crestas se disponen paralelamente a l a s u p e r f i c i e m i t o c o n d r i a l
( 30 ) . En el
citoplasma yuxtanuclear presenta además un corpúsculo densamente teñido y de
forma i r r e g u l a r , que ha sido llamado cuerpo cromatoide ( 76 ) , F i g . 17.
Fase de Casquete.- La membrana l i m i t a n t e de l a vesícula acrosómica aumenta su
zona de adherencia a l a e n v o l t u r a n u c l e a r , formando un delgado p l i e g u e que se
extiende sobre el polo del núcleo para r e c u b r i r todo su hemisferio a n t e r i o r
-
como un casquete c e f á l i c o membranoso ( e s t a d i o 5 ) . Mientras t a n t o el gránulo acrosómico permanece l o c a l i z a d o en el polo a n t e r i o r del núcleo ( 5 ) . El Apar a t o de Golgi es s u b s t i t u i d o completamente por v e s í c u l a s , las más grandes de
las cuales se encuentran cerca de la vesícula acrosomal y se fusionan a e l l a
( 30 ) , F i g s . 19 y 20.
En el citoplasma los c e n t r í o l o s se desplazan al polo abacrosomal del ni¿
c l e o , donde uno de e l l o s se dispone perpendicularmente a l a s u p e r f i c i e c e l u l a r
y produce un f l a g e l o , el cual crece en una estrecha hendidura e x t r a c e l u l a r
-
que hay e n t r e e l espermátide redondo ó p o l i é d r i c o y l a c é l u l a de S e r t o l i adya^
cente ( 25 ) , F i g s . 21 y 22. El cuerpo cromatoide emigra ligeramente hacia el
polo c e n t r i o l a r y las mitocondrias continúan en p o s i c i ó n p e r i f é r i c a .
( 13 )
La fase de casquete corresponde a los estadios 5, 6 y 7 de l a espermiogé
nesis en e l ratón ( F i g . 3 ) .
Fase Acrosomal.-
Se i n i c i a en el estadio 8 de l a espermiogénesis del r a t ó n ,
cuando los espermátides jóvenes se o r i e n t a n a sí mismos con el sistema acrosó
mico hacia l a membrana basal y la
elongación del núcleo comienza ( 68 ) .
Durante-esta fase se c o n s t i t u y e el acrosoma, e s t r u c t u r a l i m i t a d a por una
membrana que ha sido comparada a un lisosoma, por su contenido r i c o en carbo-
Espermátide en fase de casquete. La
envoltura nuclear subyacente al cas^
quete membranoso está engrosada al
igual que en la fosa de implanta
ción. En éste sitio se observan el
par de centriolos, el annulus (felcha) y el cuerpo cromatoide en reía
ción con el flagelo en formación. El
citoplasma es abundante y contiene
las mitoeondrias ya descritas y gran
cantidad de vesículas revestidas por
una unidad de membrana, de contenido electrodenso. Se observa también
el canal flagelar. (4,300 X).
Figura 19
Es¡ermátide en fose de casquete. El núcleo muestra un agregado electroderi
so de cromatina. En el extremo ante—
rior del casquete se observa el granu
lo acrosómico, cuyo material empieza
a distribuirse en el interior de esta
estructura. En el citoplasma vecino el
aparato de Golf i se encuentra en pos i
ción lateral al casquete. En el extre_
mo posterior del acrosoma, entre este
y la envoltura nuclear, el citoplasma
muestra mayor densidad. (6,600 X).
Figura 20
Dibujo esquemático en el que se observa un e s p e r t ó t ¿ d e en f a s e de oae
quete. El retículo endoplásBico se
dispone en una red tridimensional de
tubulos y esférulas conectadas entre
si» carentes de rilx»so»as. Se extien
de sobre la superficie convexa del
Aparato de Golgi, y delinea i a membra
na continuándose a las células veci
ñas a través de los puentes interce
lulares. (Clernont 1978).
F i
Dibujo esquemático de un e s p ^ á t i d e
60 ÍSSe
de
^ s o ^ a l . Se ilustra la
P a c i ó n del manchette
en
r e l a ci5n con
el anillo nuclear. El citoplasma se des
Plaza caudalmente, para circundar la
P«rci6n próxima1 del flagelo,
tnyendo el ^
b¿erto en „
^
^
en
fIageiar
. ^
consti
^
extremo posterior)
ei
anterior se invagina
« f i e j a sobre el flagelo.
(Clermont X9?8),
,
^
^
y
~
u r a No. 21
h i d r a t o s y enzimas h i d r o l í t i c a s ( 5 ) . El acrosoma presenta una subestructura
ordenada y c a r a c t e r í s t i c a , al parecer debido a l a d i s t r i b u c i ó n e s p e c í f i c a por
r e g i o n e s , de las enzimas que c o n t i e n e , en a r r e g l o s p a r a c r i s t a l i n o s
( 77 ) .
Aunque se encuentra presente en todos l o s mamíferos, el acrosoma v a r í a de f o r .
ma y tamaño según l a especie ( 5 ) .
En e l r a t ó n l a Fase Acrosomal corresponde a l o s estadios 8 , 9 , 10 y 11 de l a espermiogénesis ( 68 )» y durante e l l a el sistema acrosomal se extiende
para c u b r i r l a s u p e r f i c i e dorsal y a p i c a l del núcleo y su s u p e r f i c i e externa
se a p l i c a estrechamente a l a membrana plasmática ( 30 ) , F i g s . 11 y 12.
En el núcleo, l a cromatina se condensa formando grumos densamente empaquetados; por m o d i f i c a c i o n e s en su forma el núcleo empieza a aplanarse, y d¿
j a de ser redondo para volverse primero ovoide y luego estrecharse en su extremo a n t e r i o r alargándose y adquiriendo su extremo p o s t e r i o r una forma angj¿
lada ( 68 ) , F i g s . 23 y 24.
Simultáneamente a los dos eventos a n t e r i o r e s , se presenta un alargamiento del espermátide. Cuando l a condensación de l a cromatina se i n i c i a aparecen
numerosos microtúbulos que se asocian l a t e r a l m e n t e circundando al extreno cau
da! del núcleo ( 25,43,62,80 ) , F i g . 22. Se t r a t a de un organelo
el Manchette ó Vaina Caudal, cuya formación parece i n i c i a r s e en e l
transitorio,
espermáti-
de redondo ó p o l i é d r i c o , el cual contiene muchos microtúbulos que predominan
en el extremo caudal del núcleo y se extienden por todo el citoplasma (estadio
7 ) , Figs. 23 y 24, y en el que el margen p o s t e r i o r del casquete acrosomal está
c u b i e r t o por una banda electrodensa aplanada: depósito de m a t e r i a l f i b r o s o electrodenso en su lado citoplásmico que circunda al núcleo y r e c i b e el nombre
de a n i l l o nuclear ( 5,80 ) , F i g . 24. En r e l a c i ó n con ésta e s t r u c t u r a los e l e mentos microtubulares del manchette son rápidamente polimerizados y se extier^
den caudalmente hacia el citoplasma de la pieza del c u e l l o en formación.
Ini-
cialmente los^microtúbulos del manchette t i e n e n un t r a y e c t o o b l i c u o siguiendo
el contorno del núcleo, desde e l a n i l l o nuclear a l a base del f l a g e l o , pero su
Micrografía electrónica de un espermátide en fase acrosomal. El cito—
plasma del polo anterior ha sido des
plazado caudalmente, y la membrana acrosomal externa está adherida a la
membrana citoplásmica. El núcleo es
más alargado, y se observan masas de
h<=M e-focrorratina en la periferia.
(35, 000 X)
Espermátide en faje acrosomal. La clon
gación del nlucieo es más evidente, y
••u extremo
t
oteríor e > de forma c u a -
drada. La 2romatina condensada en la periferia es nis abundante;en el extre
mo caudal del r.úcleo se observa la fosa de implantación y lo¿ elementos pro
pios del cuello en formación. En el citoplasma se ven claramente los micro_
tübulos dél manchctte de trayecto recto
Se observan también el cuerpo cromatoide, una porción del canal flag lar y del flagelo.
(C750 X)
F i g u ra
No. 24
tendencia a ser rectos parece m o d i f i c a r l a forma del extremo p o s t e r i o r d e l n£
cleo a l a de una pirámide de base truncada, extendiéndose paralelamente a l
-
e j e l o n g i t u d i n a l del espermátide en
-
elongación. Por su asociación l a t e r a l
los microtúbulos forman una especie de c i l i n d r o alrededor del núcleo en su p£
l o caudal y l a base del f l a g e l o ( 5,SO ) . Los microtúbulos del Manchette, aumentan de l o n g i t u d y cuando el núcleo t i e n e forma e l i p s o i d e , se extienden a
v a r i a s mieras de l a región del c u e l l o ( F i g s . 25 y 26). Un estudio m o r f o l ó g i c o
y morfométrico, cuidadosamente r e a l i z a d o ha revelado las dimensiones de los microtúbulos del Manchette y su r e l a c i ó n con l a envoltura n u c l e a r , mediante "brazos" que se extienden hacia ésta ( 80 ) .
Mientras ésto sucede y cuando el Acrosoma ha alcanzado su volúmen defini_
t i v o , e l Aparato de Golgi abandona su s u p e r f i c i e y se desplaza hacia l a región
caudal de l a c é l u l a ; el desplazamiento del Golgi parece ser p a r t e del f l u j o
-
c i t o p l á s m i c o en sentido a n t e r o p o s t e r i o r . El cuerpo Cromatoide se s i t ú a en éste
momento e n t r e el núcleo y el extremo proximal del f l a g e l o ( 76 ) , y a l parecer
contribuye a l a formación del Anulo, e s t r u c t u r a que c o n t r i b u y e a l a formación
de l a cola del espermatozoide como veremos después ( 5,13 ) , F i g s . 22 y 24.
Fase de Maduración.-
A d i f e r e n c i a del humano, durante ésta fase suceden p r o -
fundas modificaciones en l a forma del acrosoma que son c a r a c t e r í s t i c a s en el
r a t ó n ; comprendiendo los estadios 12 a 16 de l a espermiogénesis en ésta espec i e ( 68 ) . Así en el estadio 12, cuando el espermátide alcanza su tamaño máximo, el acrosoma presenta un extremo a n t e r i o r cuadrado ( F i g s . 7 y 2 4 ) , y apa
rece como una e s t r u c t u r a en forma de cuña, subyacente al núcleo, que crece más
en su extraño y forma un pico muy agudo ( F i g s . 29,30 y 31). El núcleo a su vez
forma una expansión a n t e r i o r subyacente al acrosoma. En el e s t a d i o 13 se p r e senta un abrupto acortamiento de l a l o n g i t u d del espermátide de cerca del 20».
Los ángulos caudales asumen l a forma del espermatozoide maduro, que se mantiene durante l d ^ estadios 14 y 15; el espermatozoide abandona el túbulo seminífe
ro en el e s t a d i o 16 ( 67 ) , F i g . 31.
Pag. 32
Fig. 25 Representación esquemática de un espermátide del estadio 14 mostrando la
configuración del Retículo Endoplásmico Rugoso, (Clermont 1978). En A y
B se muestra la conformación del Retículo Endoplásmico a nivel de la
vaina caudal. En C y D se ilustra la configuración a nivel del flagelo,
(descripción más detallada en el texto).
Polo caudal de un espermátide en eloii
gación. Se observa la fosa de implantación en la que los centríolos se disponen perpendicularmente uno al otro. Adyacente a ellos puede verse
una masa de material electrodenso c£
rrespondiente al cuerpo cromatoide.
Se observan también los microtúbulos
del manchette.
(39, 000 X)
F i g u r a
Esquema que muestra la formación del
cuello y pieza intermedia del espermatozoide. Se observa el capitulum y una
de las columnas estriadas de la pieza
de conexión. El centríolo distal ha de_
saparecido y el proximal está dispuesto
perpendicularmente al eje del flagelo.
Las mitocondrias rodean la vaina fibro
sa de la pieza intermedia. Puede verse
también la envoltura nuclear redundante.
(Bloom y Fawcett 1972).
F i g u r a
No. 27
No. 26
El manchette c i l i n d r i c o excluye las mitocondrias de l a región del aparato
c e n t r i o l a r , base del f l a g e l o , y del citoplasma que rodea al canal f l a g e l a r ;
-
sin embargo en secciones t r a n s v e r s a s , caudales al núcleo, se observan túbulos
de Retículo Endoplásmico Liso que corren p a r a l e l a s por dentro y por f u e r a de la vaina, conectadas por f i n a s anastomosis ( 13 ) , F i g . 25.
La formación de l a cola del espermatozoide sucede durante l a fase Acrosomal t a r d í a y l a fase de Maduración. I n i c i a l m e n t e el f l a g e l o consta de un comp l e j o a x i l f i l a m e n t o s o ó axonema t í p i c o cuyos microtúbulos p e r i f é r i c o s se continúan con la pared del c e n t r í o l o p o s t e r i o r , mientras que el c e n t r í o l o
ante-
r i o r ocupa una hendidura poco profunda en el polo p o s t e r i o r del núcleo, llamada Fosa de Implantación ( F i g . 19). En ésta etapa los c e n t r í o l o s están rodeados
de una e s t r u c t u r a anular f i b r o s a laxa que hacia l a membrana nuclear se r e l a c i o
na con un pequeño a n i l l o f i b r o s o denso, el Anulo, presente en el s i t i o donde la membrana c i t o p l á s m i c a se r e f l e j a sobre el f l a g e l o y adherido tan fuertemente
a e l l a como lo está el a n i l l o nuclear a l a membrana c e l u l a r suprayacente al
-
acrosoma ( 5,101 ) , Fig. 21 y 22.
Ulteriormente se forman 9 columnas segmentadas f i b r o s a s , orientadas longi_
tudinalmente que se unen entre sí y a l a base del núcleo para formar l a pieza
de conexión ( 101 ) , Figs. 26 y 27.
En sentido d i s t a l
las nueve columnas segmentadas se unen a nueve f i b r a s -
densas l o n g i t u d i n a l e s que se d e s a r r o l l a n en l a p e r i f e r i a de los dobletes del
axonema. C i e r t a c o n t r o v e r s i a e x i s t e con respecto al destino del c e n t r í o l o d i s t a l ; mientras que Zamboni (1971b)índica que p e r s i s t e en forma modificada, Fawc e t t (1978), señala que desaparece al igual que el a n i l l o l a x o , una vez que l a
pieza de Conexión y las f i b r a s externas son formadas. Para Zamboni (1971^) el
c e n t r í o l o próxima!, dispuesto perpendicularmente al f l a g e l o , podría actuar como un cuerpo basa! de o r i e n t a c i ó n ú n i c a , centro de la m o t i l i d a d especial del
f l a g e l o del espermatozoide.
Las f i b r a s densas externas comienzan a d e s a r r o l l a r s e al tiempo que el
flu
3S
Sección oblicua de un espermátide en
elongación. El núcleo es muy largo y
estrecho. En ésta sección ambos extre
mos tienen forma aguda. La cromatina
está más condensada en el centro del
núcleo. El contenido acrosomal presen
ta un aspecto estratificado. El citoplasma de la célula de Sertoli vecino
al aerosoma muestra mayor electrodensidad que el resto de él. Los microtubulos del manchette aparecen en se^
cción transversa.
(25, 000 X)
F i g u r a No. 28
Sección longitudinal de un espermátide en elongación. Las características
aerosomales y nucleares corresponden a
las descritab un la I'ig. anterior. La
sección
permite apreciar el trayecto %
recto de los microtübulos del manchette
que se extienden desde el anillo nu-cledr, caudalmi-nte hasta más aJ la del
cuello en formación.
(25, 600 X)
Espermátide en maduración. El núcleo
1 recenta forma alargada, la cromatina
se ve muy condensada. El extremo ante_
rior del acrosoma presenta una proye£
ción aguda. Los grumos electrodensos
del citoplasma de la célula de Sertoli aún se observan. El anillo nuclear
..c ho desplazado caudalmente al igual
que los microtubulos del manchette que excluyen a lac rrdtocondrias de la
región periflagelar.
(15, 000 X)
F i g u r a
Espermátide en elongación. La condensación de la cr ^at'na na alean? in-> su
grado máximo. El material a-ro^o.n^l e^
' e- ios electro' erto en la vecindid del
n'cleo. Los grunos densos del citoplas
ma de xa cC ul . "c. bert<">li con mis ercasos. Se ..bot jwa también la pieza de
conexión y 1er microtCbulos de la vaina caudal de disposición helicoidal.
(30, 000 X)
F i g u r a
No. 31
No. 30
Espermátide en maduración. La orientación del corte permite observar la
cabeza del espermátide y el acrosoma.
Esté último se extiende casi desde el
extremo caudal del núcleo por el dorso para formar una proyección ante—
rior y aguda. En el extremo caudal se
observa la implantación del flagelo.
Las mitocondrias se disponen alrededor de éste. La mayor parte del cito
plasma se localiza en la región caudal.
(7, 000 X)
F i g u r a No. 32
i'
Espermátide que se encuentra en la últi
v
'
\
• 4,
.
0
%
J
m 1<j
f
1-.
X
fk •
m
fím
ma etapa de maduración. El núcleo y el
acrosoma tienen su aspecto definitivo;
el cuello y la pieza principal están -
i
•
-
VBr
también completamente desarrollados.
%
En la pieza intermedia, el filamento axial aparece rodeado per la vaina fibrosa y la vaina mitocondrial, limitada
caudalmente por el anulo, que se encuera
o
tra en su posición definitiva. En secciones transversas se aprecian xa pieza
principal y la terminal. Se señalan *
(flechas) porciones de citoplasma resi-
»
dual .
(3, 600 X)
F i g u r a
No. 33
A
-
j.o c í t o p l á s m i c o hace que el canal f l a g e l a r aumente de l o n g i t u d , mientras l a d i s t a n c i a e n t r e el a n i l l o nuclear y el anulo permanece constante ( 5 ) .
f ) S í n t e s i s de Macromoléculas Durante l a Espermatogénesis.
Muchos de l o s conocimientos sobre eventos macromoleculares se han d e r i v a
do de estudios citoquímicos ( 7 ) . La Figura 34 reúne los datos sobre s í n t e s i s
de macromoléculas en l a espermatogénesis, que a continuación describimos.
3
S í n t e s i s de DNA.- Estudios r a d i o a u t o g r a f i c o s usando t i m i d i n a H , en t e s t í c u l o s de ratón ( 64 ) , han d e t a l l a d o los eventos de s í n t e s i s de DNA, durante la espermatogénesis, indicando que dicha s í n t e s i s se l l e v a a cabo durante
el recambio y p r o l i f e r a c i ó n de espermatogenias así como en espermatocitos prj_
marios, donde sucede j u s t o antes de ser v i s i b l e l a profase m e i ó t i c a . No hay,
en cambio, s í n t e s i s de 'DNA en las etapas t a r d í a s de l a espermatogénesis.
Igualmente ha sido determinado por Monesi (1962), e l tiempo de duración
del período de s í n t e s i s de DNA en las c é l u l a s en que sucede: En espermatogenias A j a A^, que tienen un promedio de vida y de duración de la etapa presin_
t é t i c a muy semejante (de 27 a 30 h r s . y 10.5 h r s . respectivamente), el
perío-
do de s í n t e s i s de DNA y el p o s t d u p l i c a c i o n a l son muy v a r i a b l e s .
En espermatogonias B l a s í n t e s i s de DNA es muy l a r g a , t i e n e una duración
de 14.5 h r s . ; igual que en espermatogonias I donde es de 12.5 y en espermatogonias A^, en las que l a s í n t e s i s de DNA dura 13 h r s . ; en cambio es mucho más
corta en espermatogonias Ag, ^
y
en
9ue
ciura
de 7 a 8 hrs.
El período p o s t d u p l i c a c i o n a l es por el c o n t r a r i o c o r t o en espermatogonias
B (4.5 h r s . ) , más l a r g o en las I (11 h r s . ) , y mucho más l a r g o en A^, Ag y A^ (14 h r s . ) .
S í n t e s i s de RNA y P r o t e í n a s . - Estudios r a d i o a u t o g r a f i c o s empleando u r i d i na H3 y aminoácidos marcados, en t e s t í c u l o de r a t ó n ( 65 ) , han proporcionado
informaci-én sobre l a s í n t e s i s de RNA y proteínas en l a s c é l u l a s espermatogénicas y de S e r t o l i .
Fig. 34
Síntesis de Macromoléculas en la espermatogénesis del
ratón (citado por Bruce y Meistrich 1972).
- 4—
Espermatogenias A
0
!
DNA
- 2-
Espermatogenias I
- 1-
Espermatogonias B
0 -
Preleptoneno
DNA
DNA
1 23"
4 -
Zigoteno
Sínt. alta de
proteínas
5-
Síntesis elevada de
67 fi
u
RNA
Paquiteno
-
9 10-
Diploteno
11-
Espermatocito See.
12-
Proteínas
Síntesis baja de RHA
Citoplásmicas
1314 '
Espermátide 3
1516-
Espermátide 8
17-
Nucleoproteínas
Ricas en
Arginina
( Protaminas )
181920-
Espermátide 11
2122-
Estructura Nuclear Resistente
2324-
Espermátide 25
2526-
Espermatozoide
En espermatogenias l a tasa de s í n t e s i s de RNA y proteínas es mucho más a l t a en c é l u l a s que son inmaduras es d e c i r t i p o A que en las maduras, t i p o B,
lo cual posiblemente está en r e l a c i ó n a su grado de d i f e r e n c i a c i ó n y condensa_
ción de cromatina. La s í n t e s i s de proteínas nucleares y citoplásmicas ocurre
en todas las etapas del c i c l o y en la d i v i s i ó n c e l u l a r , mientras que l a s í n t e
s i s de RNA se detiene en metafase y anafase.
Durante l a M e i o s i s , l a s í n t e s i s de RNA en r e l a c i ó n con los autosomas cesa ó f a l l a para alcanzar n i v e l e s s i g n i f i c a t i v o s durante l a profase temprana ( l e p t o t e n o y zigoteno) así como en l a profase t a r d í a ( d i a c i n e ' s i s ) , alcanzando
su pico máximo en Paquiteno mediano. En cambio, en r e l a c i ó n con l o s cromosomas sexuales que permanecen como un cuerpo h e t e r o p i c n ó t i c o , no se s i n t e t i z a
-
RNA y permanecen invariablemente s i n marcar a través de l a profase m e i ó t i c a .
La s í n t e s i s de proteínas por el c o n t r a r i o , continúa durante los períodos de
depresión de s í n t e s i s de RNA y está presente también en los cromosomas sexuales.
Durante l a espermiogénesis, l a s í n t e s i s de RNA se detiene tempranamente.
Aunque en espermátides redondos l a tasa de RNA s i n t e t i z a d o puede ser comparable con l a producida en los momentos más a c t i v o s de t r a n s c r i p c i ó n de la meios i s ( 92 ) .
El RNA producido durante l a Meiosis desaparece del núcleo ya sea por r u ¿
t u r a ó t r a n s f e r e n c i a al citoplasma, y hacia l a espermiogénesis media ya no es
p o s i b l e ver RNA en el núcleo. En el citoplasma puede verse RNA escaso, del que ha sido s i n t e t i z a d o en la profase m e i ó t i c a .
La s í n t e s i s de proteínas que se ve en los espermátides de los estadios 9 al 15, es probablemente sostenida por el RNA producido en l a m e i o s i s . Esta
s í n t e s i s r e s u l t a esencial para los marcados cambios morfológicos que tienen
lugar durante esas etapas de l a espermiogénesis. Muchas de las proteínas r e queridas para el ensamblaje de l o s componentes de l a cola son s i n t e t i z a d o s
-
durante l a espermiogénesis, igualmente muchas enzimas que i n c l u y e n l a f o s f o -
g l i c e r a t o c i n a s a e s p e c í f i c a de t e s t í c u l o , l a hexocinasa t i p o espermatozoide, l a hialuroriidasa y l a b e t a - g a l a c t o s i d a s a , aparecen por primera vez durante l a
espermiogénesis ( 92 ) .
Existen evidencias de que un RNAm de " l a r g a d u r a c i ó n " , es s i n t e t i z a d o en
paquiteno y se conserva a través de l a espermiogénesis hasta sus etapas más t a r d í a s . Se ha especulado mucho sobre la p o s i b i l i d a d de que el cuerpo cromatoj_
de, que aparece en paquiteno y es prominente en espermiogénesis temprana ( 7 6 ) ,
s i r v a de s i t i o de almacenamiento para ese RN^ de larga duración. Estudios de
marcación con u r i d i n a t r i t i a d a en espermátides tempranos, sugieren que el RNA^
s i n t e t i z a d o en espermatocitos paquiténicos y espermátides redondos, pudiera ser almacenado en el Cuerpo Cromatoide, aportando una fuente de RNAm para l a
d i f e r e n c i a c i ó n c e l u l a r p o s t - m e i ó t i c a ( 76 ) .
S í n t e s i s de Proteínas Nucleares. Cambios Cromatínicos en Espermiogénesis.El núcleo de los espermátides de l o s mamíferos, s u f r e profundos cambios morfol ó g i c o s , l o s cuales ya hemos d e s c r i t o , y además modificaciones bioquímicas que
involucran a la cromatina, cambios que son claramente adjudicables al proceso
de c i t o d i f e r e n c i a c i ó n , y que ocurren con un contenido constante de DNA y s i n actividad transcripcional
( c i t a d o por Redi 1983).
La t r a n s i c i ó n e s t r u c t u r a l de la cromatina, a una e s t r u c t u r a altamente con_
densada, se acompaña de profundos cambios en l a composición de las proteínas básicas nucleares. Durante el proceso de maduración del espermatozoide, la f o £
mación de puentes d i s u l f u r o entre los grupos t i o l e s de Tas proteínas nucleares
y l a e l i m i n a c i ó n de RNA del núcleo sucede concomitantemente ( 81 ) .
A n i v e l t e s t i c u l a r , e s p a r t i c u l a r m e n t e notable l a s u b s t i t u c i ó n de histonas
r i c a s en L i s i n a por histonas r i c a s en a r g i n i n a , con l a a p a r i c i ó n de proteínas
nucleares básicas e s p e c í f i c a s de t e s t í c u l o ( 44 ) . Estas proteínas nucleares,
las Protaminas, comienzan a s i n t e t i z a r s e en el e s t a d i o 12 de l a espermiogénes i s ; la s u b s t i t u c i ó n de histonas por protaminas, causa una condensación e x t r e ma del genoma paterno ( 7,61 ) .
B.-
Alteraciones Producidas en l a Espermatogénesis del Ratón por Agentes F í sicos y Químicos.
Además de lo d e s c r i t o en la i n t r o d u c c i ó n , con respecto a la inducción de
anomalías morfológicas de espermatozoides de r a t ó n , como prueba carcinogénica
el conocimiento acerca de l a s e n s i b i l i d a d de las c é l u l a s espermatogénicas a la
acción de agentes mutagénicos f í s i c o s y químicos, determina l a e x i s t e n c i a
de una abundante l i t e r a t u r a acerca de éste tema. En esta sección se expondrán
separadamente las a l t e r a c i o n e s producidas en espermatozoides y las producidas
en c é l u l a s espermatogénicas; en éste ú l t i m o caso se d e s c r i b i r á n estudios de t i p o c i t o g e n é t i c o así como estudios morfológicos con microscopía de luz y e l e £
trónica.
a ) . - A l t e r a c i o n e s en Espermatozoides.
Desde hace tiempo se ha indicado que t a n t o en el ratón como en el hombre,
c i e r t o porcentaje de espermatozoides muestra una morfología anormal. La f r e cuencia de anormalidades y el t i p o de e l l a s , puede v a r i a r en d i f e r e n t e s cepas,
pero se mantiene constante para una cepa en p a r t i c u l a r . Se ha sugerido que los
t i p o s y frecuencias están bajo c o n t r o l genético ( c i t a d o por Soares 1979).
Bruce y c o i s .
(1974), observaron que l a r a d i a c i ó n i o n i z a n t e , a dosis ba-
j a s de 30 rads, aumenta l a frecuencia de espermatozoides morfológicamente anor
males, que se extiende por v a r i a s semanas, y propusieron que el estudio de las
anormalidades de los espermatozoides, podría ser usada como una prueba de muta
genicidad en mamíferos.
La inducción de a l t e r a c i o n e s morfológicas en espermatozoides de ratón ha
sido reportada por muchos investigadores ( 8 , 9 , 9 0 , 9 5 , 9 7 , 9 8 , 1 0 3 ) , como prueba
del p o t e n c i a l mutagénico de agentes químicos y r a d i a c i o n e s . Sin embargo, es 'conveniente considerar los reportes hechos de incrementos en espermatozoides
anormales por h i p e r t e r m i a ( 58 )
y r e s t r i c c i o n e s d i e t a r i a s ( 46 ) .
Agentes de conocida acción mutagénica, teratogénica y carcinogénica, pro
ducen una elevación en el porcentaje de formas anormales de espermatozoides ( 9 7 ) , los
cuales son presentados en la f i g u r a 35 . La inducción de m u t a c i o -
nes por r a d i a c i ó n , que afectan l a morfología del espermatozoide, ha sido evj_
denciada recientemente por Hugenholtz
(1983).
La forma en que se inducen éstas anomalías aún no es c l a r a , se han a d j u dicado a aberraciones cromosomales, aunque l a búsqueda de translocaciones
in-
dican que ésto es poco probable ( 8 ) ; parece ser más f a c t i b l e que los cambios
puedan deberse a a l t e r a c i o n e s en los genes responsables de la espermatogénesis
( 97 ) . También es f a c t i b l e que se induscan cambios en l a expresión génica du_
rante l a t r a n s c r i p c i ó n ó el translado de l a información genética.
Sin embargo aún en ausencia de un c l a r o entendimiento del mecanismo de inducción de anomalías morfológicas de espermatozoides, ésta prueba ha r e s u l tado ser de gran v a l o r en l a búsqueda de agentes que pudieran ser de e f e c t o deletéreo para el hombre; ya que los gametos masculinos pueden ser examinados
rápidamente, en forma r e p r o d u c i b l e y en gran número ( 97 ) .
El tiempo de a p a r i c i ó n de las formas anormales de espermatozoides puede
ser i n d i c a t i v a de l a etapa de l a espermatogénesis ó las c é l u l a s espermatogé-nicas que son afectadas por el agente administrado. El Thiram ( s u l f u r o de b i s d i m e t i l - t i o x i l - c a r b a m o i 1 ) , un agente f u n g i c i d a , produce elevaciones del porcen_
t a j e de espermatozoides anormales, 5 semanas después de l a a d m i n i s t r a c i ó n del
t ó x i c o , indicando ésto que el daño ha o c u r r i d o en etapa p r e m i ó t i c a , es d e c i r en espermatogonias t a r d í a s ó espermatocitos tempranos ( 103 ) .
Aunque se ha sugerido por o t r o s autores que muchos mutágenos probados dan
lugar a incrementos de espermatozoides anormales a p a r t i r de espermatogonias t r a t a d a s , como es el caso de la Mitomicina C, ( 95 ) , las anormalidades en espermatozoides inducidas por agentes mutagénicos, son más relevantes 5 semanas
después de l a exposición ( 97 ) . Por o t r a p a r t e l a exposición a mutágenos durante l a espermatogénesis t a r d í a (espermátide), no parece conducir a ningún incremento substancial en anomalías de espermatozoides ( 98 ) .
Fig,
No.
35
Agentes químicos que producen alteraciones morfológicas en espermatozoides de ratón,
(citados por Wyrobeck 1975).
Actividad Reportada:
Agente Químico
Mutagénica
Teratogénica
Carcinogénica
Actioroicina D
+
+
+
Aminopterina
+
+
Benzo
+
+
(a) pireno
Colchicina
+
+
+
Ciclofosfamida
+
+
+
Diclorvós
+
+
+
+
Dietilestilbestrol
Etilmetano Sulfonato
+
+
+
Griseofulvina
+
Hidroxiurea
+
+
Inmurán
+
+
5-Iodo-de-oxiuridina
+
+
Metil-colantreno
+
+
+
Metil-metano-sulfonato
+
+
+
Metepa
+
+
+
Mitomicina C
+
+
+
Myleran
+
+
+
Un aspecto más importante sobre l a inducción de anomalías morfológicas en espermatozoides de r a t ó n , es el hecho de que éstas anomalías pueden ser
heredables, ya que l a progenie F 1 y ?2*
de
raton
e s t r a t a d o s para i n d u c i r
-
es-
permatozoides anormales, presentan incrementos de éstos ( 37,95 ) ; ésto con—
f i r m a e l hecho de que las frecuencias aumentadas de espermatozoides aberrantes,
es i n d i c a t i v a de mutagenesis ( 90 ) y que l a prueba puede ser de u t i l i d a d para
l a i d e n t i f i c a c i ó n de compuestos que causen daño genético t r a n s m i s i b l e en mamíf e r o s ( 95 ) .
A éste r e s p e c t o , estudios c i t o g e n é t i c o s i n d i c a n que l a forma del espermatozoide es altamente heredable; que l a f r a c c i ó n de espermatozoides anormales está controlada por una m u l t i t u d de f a c t o r e s autosómicos y que probablemente i n v o l u c r e a l o s cromosomas sexuales ( 98 ) .
El estudio de las formas anormales de espermatozoides ha sido hecho en f r o t i s ó extensiones del contenido del epidídimo y conducto deferente de l o s
ratones t r a t a d o s , teñidos con Eosina y examinados a 400 X ( 97 ) . La mayoría
de las a l t e r a c i o n e s d e s c r i t a s por éste método corresponden a a l t e r a c i o n e s de
la forma de l a cabeza del espermatozoide, e n t r e las que se describen formas s i n gancho, cabezas con forma de p l á t a n o , cabezas amorfas, formas plegadas y
formas con doble f l a g e l o , las cuales se presentan en l a f i g u r a 3£. D e t a l l e s más f i n o s ó bien estudios u l t r a e s t r u c t u r a l e s de estas formas anómalas de e s permatozoides no han sido presentadas en l a
literatura.
Recientemente se ha propuesto o t r o método c u a n t i t a t i v o que determina l a
producción de espermatozoides anormales para l a evaluación t ó x i c a de agentes
contaminantes ( 11 ) basado en l a obtención de espermatozoides t e s t i c u l a r e s
-
por sonicación y para completar estudios h i s t o p a t o l ó g i c o s del t r a c t o reproduc
t o r ; ésta t é c n i c a ha sido propuesta para d e t e c t a r efectos s u t i l e s t a l e s como
oligospermia en ausencia de lesiones
histopatológicas.
E U e s t u d i o morfológico de los espermatozoides para l a evaluación del
--
efecto genotóxico de agentes químicos, puede ser complementado con o t r o s da-
tos f e n o t í p i c o s del espermatozoide como l o son la m o t i l i d a d , el número de espermatozoides producidos y l a a c t i v i d a d p r o t e o l í t i c a acrosomal ( 26,27 ) . Estos t r e s parámetros se ven afectados cuando e l t r a t a m i e n t o con agentes mutagé
nicos (Mitomiciria C), es dado a n i v e l del espermatocitos p r e l e p t o t é n i c o s y es
permatogonias. En cambio no se producen a consecuencia del t r a t a m i e n t o de espermátides y espermatozoides ( 27 ) . Se ha reportado disminución de l a m o t i l i dad de los espermatozoides a consecuencia de l a a d m i n i s t r a c i ó n también de tera_
tógenos ( 26 ) .
b) A l t e r a c i o n e s en Células Espermatogénicas.
La búsqueda de modelos experimentales apropiados en los que el p o t e n c i a l
mutagénico de substancias químicas pueda ser medido, ha conducido a l a u t i l i z a ^
ción de las c é l u l a s gonadales de mamíferos. El estudio de los gametos se ha complementado con estudios c i t o g e n é t i c o s en las c é l u l a s espermatogénicas del
e p i t e l i o germinal en r a t o n e s , donde los cambios cromosómicos pueden ser d e t e r minados directamente ( 79 ) . Los químicos y las radiaciones producen en general
muerte de las c é l u l a s germinales, e s t e r i l i d a d temprana, mutaciones y r u p t u r a s cromosómicas { 72 ) .
La importancia de a l t e r a c i o n e s cromosómicas en espermatogenias, ha sido
reconocida en v i s t a de que las espermatogenias c o n s t i t u y e n l a población c e l u l a r permanente del t e s t í c u l o y e l daño genético inducido en ésta etapa, puede
ser de gran s i g n i f i c a d o (19,59 y 88).
Se ha reportado que l a a d m i n i s t r a c i ó n de Mitomicina C a dosis de 5 mg/Kg.
de peso produce rupturas en la cromatina pericentromérica de espermatogonias en d i v i s i ó n , así como recambio de cromátides hermanas; igualmente C i c l o f o s f a mida, una droga a n t i n e o p l á s i c a , produce elevaciones del porcentaje de formas
anormales de espermatozoides ( 97 ) , y ontogenéticamente se ha comprobado que
produce rupturas cromosómicas en espermatogonias I y B, además de f a l t a de - disyunción en d i a c i n e s i s con a p a r i c i ó n de univalentes ( 1 , 7 4 , 7 9 ) . Un agente - -
Pag. 46
a r i t i r i e o p l á s i c o , e l s u l f u r o de t r i s
(2 m e t i l - 1 a z i r i d i l ) f o s f i n a ó THIOTEPA, -
produce trarislocaciones en espermatocitos
primarios.
El daño genético y somático inducido por agentes químicos muestra especj_
f i c i d a d y es s e l e c t i v o para d i f e r e n t e s etapas de las c é l u l a s germinales masci¿
l i n a s ( 71 ) . En l a f i g u r a 37_ , se resumen l o s cambios inducidos por diversos
agentes químicos, reportados en l a l i t e r a t u r a , y el t i p o de c é l u l a espermatogénica e s p e c í f i c a que a f e c t a n . Cabe destacar e n t r e e l l o s e l
Etilmetanosulfona
t o , por ser el agente químico que u t i l i z a m o s en nuestro e s t u d i o , el cual como
se i n d i c a , produce mutaciones l e t a l e s dominantes en espermátides y espermatozoides así como mutaciones e s p e c í f i c a s de l o c u s , en estadios p o s t g o n i a l e s , y
translocaciones en ésta misma etapa ( 57 ) .
Cambios t e s t i c u l a r e s en ratones expuestos a r a d i a c i ó n i o n i z a n t e (1000 r a d s ) , y a agentes mutagénicos (Mitomicina C a dosis de 5 mg/Kg de peso), han
sido reportados desde hace tiempo ( 31,53 ) . Ambos agentes tienen efectos
si-
m i l a r e s : disminución del peso t e s t i c u l a r , disminución de espermatogonias hasta
un 10%, de 7 a 14 días después del t r a t a m i e n t o ; disminución de espermatocitos
14 a 28 días después y de espermátides a los 35 d í a s . Estos cambios son prodt¿
cidos por muerte de las espermatogonias, con desaparición de espermatocitos y
espermátides, por f a l t a de s u b s t i t u c i ó n por parte de las espermatogonias en las que l a s í n t e s i s de DNA está deprimida.
Como se ha podido observar en l o presentado hasta el momento, el aspecto
morfológico de los daños inducidos por agentes f í s i c o s ó químicos en el e p i t e
l i o seminífero y sobre las c é l u l a s espermatogénicas en p a r t i c u l a r , ha sido - t r a t a d o muy someramente en la b i b l i o g r a f í a d i s p o n i b l e al respecto, y de hecho,
pocos estudios se han r e f e r i d o a los cambios e s t r u c t u r a l e s que suceden en l a espermatogénesis a consecuencia de agentes mutagénicos.
Parvinen (1979a) r e p o r t a los efectos tempranos de l a Procarbazina, en - segmentos^de túbulos seminíferos dañados, analizados con microscopía de contras
t e de f a s e . Las a l t e r a c i o n e s tempranas se v i e r o n en espermatocitos
zigoténicos
-o
o
n
0)
cr
o
N}
Tf
3
CO
2
0)
0»
3
i..
+
—
.V
QJ
1
O
o>
I
S
o
O
DJ
rt
0
"O
C
"5
P3
01
3
t—'
tt)
•s
Qjv
3
<<
3
Prt
O
3
p.
O
p.
3
ai
o
s
n
H
m
TJ
+
i—i
3
en
3
3
cn
>
X
p.
a
i
o
X
p.
c
^
f
&tj
+
"H
+
.-s
cr
O
cr
i
o
cr
n
i
i
CÎ- a
•—•
'—*
"i
0
co
•ti
n>
co
ri
fD
T
O
n
•z
c
n
3
w
O
T
-V
o
en
-h
tu
3
H"
a
0)
CL
3
et
fD
en
,o
e
pi
g
p.
o
o
to
e- 3
fl>
C
r+ r+
&i Q)
O
(t PW 0
3
a
o «
3
+
0
1
a.
£CD
p.
û)
3
P.
O
P«
3
ÎU
0
1
CL.
\-<
P.
09
CO
«J
oo n
OJ T »-h
tu
>-h o
n pv r+
3 ÎU O
n XJ a
co O a>
XJ 1
(ti
eu
< era
^
3 eu a>
Qj
3
rt —
i * » rt
O o CD
OQ M CO
O
CJ
p. C C
Ol r-t PV
M O 3
-3
/«S rc n
o
a*
co
CO
o
rj
3 OD tr
T
171 to CD
W <7< 1
^
h(î ro ÜJ
CO
•S
3 V
Cu GJ o
r+ i-k (Dv
O
H"
O s»
n C
^
P- e
rt CO Ûl
O en œ
CO
T
(>
C" co
o -J a>
en T
3
m w Û>
o
ÍK,
n
M -o il»
X) to 3
p.
0}
-J n
Oí
£Uv ir m
r-t
p. -0 0)
a CT> 3
!î>
en
T
O
(0
CD ca -4 c
CO
CO
o
-J
eny
—
6
3
ÛJ
—
i
C
ts
0
y ,
—••
•
+
+
Cu
ÖJ
0)
n 3
M C
T.3 f+
0J
o
a p.
(n o
3
C (t>
O co
o
c
co
0
1
ci-
r.
i
G.
+
•f
+
•+
CL
01
1
p-
01
Cu
a.
+
n >
"S cr
0 n>
3 4
O 4
CO D
Ov O
3 M.
p. 0
O3
CU ft>
w CO
O C2
/
2 pk
> 3
rt
3 ce
O p.
V)
TJ M
>-5
O CL
Tu o
^
C
>
S
o
3
OT
rt ^
ft
^
3» 3
n c.
r-t r~
Ñ
— C1
r- '
O
^
*—
- w
.
•
^
•
H H H ^ S 21 hH tn M
as se M S S tn s z S
HH M S en en H en G CO
O
73
M
>
H
T)
>
2 M
T
3
>
>
co
73
trJ
<
M
>
H
G
H
H^
ÛJ
3
-3
rr
p.
o
rt
(0
TJ
ÛJ
H
M
S
73
>
CO
CO
c1
IHi
C
o
o—
/<nS
CD
M.
W
1
a.
p.
o
r+
H*»
>-•
rf
P0
X
P.
1—
1
O
Ol
•J
CT
fiJ
3
O
P.
M
CO
c
I-1
Hl
C
o
Cb
rt)
rt
•S
H.
W
y^s
fO
3
<>
t
rt
HH
1
P»
ÛJ
N
M.
rs
H*
a
p.
H.1 "h
0
w
Hi
p.
3
Cu
H
H
p.
<>
t
rt
p.
(D
3
3
fD
M
Û>
3
p.
3
ai
-a
0
•o
p.
1—•
3
o
rt
ÛJ
3
O
M
C1
IHi
O
3
Û)
rt
O
S
m
rt
p.
M
3
ft>
rt
ÛJ
3
O
M
C
M
Hi
O
3
ÛJ
r+
0
O >-i
X V)
p. O
a tf
o
O
a T3
m p.
M
rt 3
<t
p. rt
en ÛJ
3
ro 0
«
3 C
ÍD H
rt Hi
p. 0
h- 3
1 m
h^ rt
o
PU
N
P.
P.
CL
p.
h1
o
en
-n
p»
3
ÛJ
M
rt
p.
M
3
prt
T
O
Cfl
o
e
^
(t)
ÛJ
M
rt
P.
M
3
<>
t
rt
û>
3
0
M
C1
lPi
O
3
ÛJ
rt
O
o
l
.a
+
o
i
-CL
_-
3
Eu
O
Ov
3
T
7=
CM.
. y medios p a q u i t é n i c o s , especialmente en sus cromosomas. A dosis a l t a s l a Procarbazine produjo daño también en espermátides redondos» y r e t a r d o en l a es—
permiación probablemente a consecuencia de acción p r i m a r i a a n i v e l de l a c é l j j
l a de S e r t o l i .
Un e s t u d i o sobre l a morfología t e s t i c u l a r en casos de a t r o f i a inducida por químicos no relacionados e n t r e s í (Acido f t á l i c o , Oxido de e t i l e n o , Hexafluoroacetona y a c r i l a m i d a ) , proporciona más d e t a l l e s sobre los cambios
hist£
p a t o l ó g i c o s , señalando la a p a r i c i ó n de túbulos a t r o f í e o s , con disminución del
diámetro y depleción del e p i t e l i o g e r m i n a l , donde los espermátides en maduración fueron los más dañados, y con l a a p a r i c i ó n de c é l u l a s gigantes m u l t i n u —
cleadas ocasionalmente; en túbulos más severamente dañados los espermatozoides
y espermátides desaparecieron, y el e p i t e l i o germinal comprendía sólo una capa
delgada de espermatocitos y espermatogonias ó bien sólo una capa de espermatogenias y c é l u l a s de S e r t o l i ; éstas a l i g u a l que las c é l u l a s de Leydig, no mos_
t r a r o n a l t e r a c i o n e s . Túbulos menos dañados presentaron degeneración de espermátides en maduración y numerosos g l ó b u l o s e o s i n ó f i l o s que contienen espermát i d e s maduros p i c n ó t i c o s ; ya que las espermatogonias no presentaban cambios degenerativos n i n e c r ó t i c o s , la a t r o f i a t e s t i c u l a r producida por éstos agentes
químicos se considera r e v e r s i b l e ( 33 ) .
En nuestra búsqueda de a l t e r a c i o n e s u l t r a e s t r u c t u r a l e s en c é l u l a s espermatogénicas a consecuencia del t r a t a m i e n t o con agentes f í s i c o s ó químicos, so^
lamente encontramos las a l t e r a c i o n e s h i s t o l ó g i c a s y u l t r a e s t r u c t u r a l e s en t e ^
t í c u l o s de rata sometidos a i n h a l a c i ó n crónica de adelgazador de p i n t u r a s
(60);
dicho estudio señala la pérdida de peso t e s t i c u l a r y del t e j i d o adiposo vecino,
disminución en l a cuenta de espermatozoides en suspension y en c o r t e s de t e s t í
c u l o , r e t r a c c i ó n y vacuolización del citoplasma de las células espermatogéni—
cas en el estudio con microscopía de luz y l a a p a r i c i ó n de granulos electroden
sos, vacuolas abundantes e i r r e g u l a r e s de contenido electrodenso y mitocondrias
dispersas, en espermatogonias, espermatocitos y espermátides, a n i v e l
ultraes-
tructura").
Igualmente con microscopía e l e c t r ó n i c a se observaron abundantes es
permatides inmaduros y anormales de l o c a l i z a c i ó n anormal. Las anomalías encon
tradas en los espermátides se l o c a l i z a r o n sobre todo a n i v e l del acrosoma. En
c é l u l a s de S e r t o l i se observaron r e t r a c c i ó n y disminución del tamaño, aumento
en el número de lisosomas, vacuolas de m a t e r i a l electrodenso y cuerpos m u l t i
vesiculares.
1020127848
I I I . MATERIAL
Y METODOS
Se u t i l i z ó como m a t e r i a l b i o l ó g i c o , 24 ratones machos de genotipo híbrj_
do (C57 BL X C3H) F l , de 8 a 12 semanas de edad. La selección de ésta cepa de animales se basó en reportes previos de la l i t e r a t u r a , que la señalan como una de las mejores para éste t i p o de ensayos por presentar un porcentaje
muy bajo de anomalías morfológicas de espermatozoides. Los ratones fueron ob
tenidos de Charles R i v e r , Breeding Laboratories
Inc.
Para l a inducción de anomalías morfológicas en espermatozoides se e m pleó una agente mutagénico: El e t i l m e t a n o s u l f o n a t o (de Sigma Che. C o . ) , el
cuál ha sido reportado j u n t o con el metiImetanosulfonato como químicos de una potente acción sobre laforma del espermatozoide ( 97 ) .
Se l l e v a r o n a cabo dos experimentos s i m i l a r e s , en cada uno de los cuáles
se formaron cuatro grupos de 3 ratones cada uno. El e t i l m e t a n o s u l f o n a t o se ad
m i n i s t r ó por v í a i n t r a p e r i t o n e a l a dosis de 200 mg/Kg. de peso, d i a r i a m e n t e ,
durante 5 días consecutivos. Uno de l o s grupos fué usado como c o n t r o l , inyec^
tándosele únicamente el v e h í c u l o ; 0.3 mi. de agua t r i d e s t i l a d a .
Después de l a a d m i n i s t r a c i ó n del e t i l m e t a n o s u l f o n a t o , l o s ratones se man
t u v i e r o n en cuarto a temperatura de 25°C, con c i c l o s controlados de luz-obscu
r i d a d , y alimentados con Purina Lab. Chow.
Los ratones fueron s a c r i f i c a d o s por d i s l o c a c i ó n c e r v i c a l ; el primer grij
po de ratones se s a c r i f i c ó 3 semanas después de l a ú l t i m a inyección de e t i l metanosulfoanto; el segundo grupo y el grupo c o n t r o l se s a c r i f i c a r o n a las 4
semanas y el t e r c e r grupo a las 5 semanas; de ésta forma se cubrió toda la duración del c i c l o del E p i t e l i o Seminífero, reportada por Oakberg (1957) como de 35 d í a s .
Una vez s a c r i f i c a d o s los r a t o n e s , se disecaron; t e s t í c u l o s ,
epidídimos
y conductos d e f e r e n t e s .
Los epidídimos y conductos d e f e r e n t e s , de cada r a t ó n , se fragmentaron -
con t i j e r a s y pinzas y se suspendieron en 0.6 mi. de s o l u c i ó n amortiguadora de
f o s f a t o s , 0.2 m o l a r , de pH 7 . 3 . La suspensión se f i l t r ó dos veces, con r e j i l l a s
de 200 mesh para e l i m i n a r fragmentos de t e j i d o s , y se h i c i e r o n con e l l a 10 f r o
t í s ó extensiones, los cuáles se t r a t a r o n de la s i g u i e n t e manera:
1) Secado al a i r e por 12 horas.
2) F i j a c i ó n en una solución de: Metanol absoluto 85%
Formaldehído
10%
Acido a c é t i c o
5%
durante una hora.
3) Lavado en agua (10 inmersiones).
4) Tinción con Eosina "Y" acuosa al 5%, por una hora.
5) Secado a temperatura ambiente por 24 horas.
6) Lavado en Etanol para r e t i r a r el exceso de c o l o r a n t e .
7) Secado al
aire.
Las l a m i n i l l a s se a n a l i z a r o n con microscopio de luz (Zeiss K7) a 600 X,
y en cada una de e l l a s , se contaron 100 espermatozoides para establecer el
--
porcentaje de anomalías m o r f o l ó g i c a s .
De l o s t e s t í c u l o s disecados en cada r a t ó n , uno de e l l o s se f i j ó en L í q u i
do de Zenker por 12 horas, después de i n c i d i r la albugínea; se lavó con agua
c o r r i e n t e por 24 horas, y se deshidrató con cambios de alcohol en grados ascendentes, para i n c l u i r s e en p a r a f i n a por los métodos convencionales.
Del o t r o t e s t í c u l o se obtuvieron fragmentos de 1 a 2 mm. de espesor, que
se f i j a r o n de inmediato por el método recomendado por Hayat (1972), para el estudio u l t r a m i c r o s c o p i o de espermátides.
Las soluciones empleadas y el método se d e t a l l a n a c o n t i n u a c i ó n :
Solución A.
Solución B.
Glutaraldehído al 25%
25 mi.
B u f f e r de c a c o d i l a t o s 0 . 1 M. pH 7.2
75 mi.
Sacarosa
7.5 g r s .
B u f f e r de c a c o d i l a t o s 0.1 M. pH 7.2
100 mi.
Solución C.
Dicromato de Potasio a l 5%
16 mi.
Hidróxido de Potasio 2.5 N.
2 mi.
Agua d e s t i l a d a
2 mi.
B u f f e r de cacodilatos 0 . 1 M. pH 7.2
Solución D.
Tetraóxido de Osmio
B u f f e r de c a c o d i l a t o s 0 . 1 M.
Sacarosa
20 mi.
1 grs.
100 mi.
.4 M.
METODO:
1.-
F i j a r piezas pequeñas de t e s t í c u l o s en la s o l . A por 1 hora a 4°C.
2.-
Lavar y guardar los especímenes en l a Sol. B por 30 h r s . a 4°C.
3.-
Pasar a l a Solución C por 30 minutos a 4°C.
4.-
Lavar en la solución B y p o s t - f i j a r en l a solución D por 80 minutos a 4°C.
Una vez f i j a d o s los fragmentos de t e j i d o s , se lavaron con l a solución B,
se deshidrataron e incluyeron en Epoxiresina LX112, por l a técnica
habitual-
( 55 ).
E1 t e j i d o t e s t i c u l a r i n c l u i d o en parafina se u t i l i z ó para estudio h i s t o l ó
gico con microscopía de l u z , para l o cuál se obtuvieron secciones de 3 mieras
de g r o s o r , que fueron tratadas con solución Yodo-yodurada de Lugol, para e v i t a r p r e c i p i t a d o s de c l o r u r o mercúrico componente del l í q u i d o de Zenker. Los c o r t e s se t i ñ e r o n por los métodos de Hematoxilina y Eosina, reacción de S c h i f f
y método de Gomori para f i b r a s r e t i c u l a r e s ( 56 ) .
El ú l t i m o de éstos métodos, se u t i l i z ó en v i s t a de que demuestra en forma
rápida y exacta información sobre l a organización del túbulo seminífero y asociaciones c e l u l a r e s , c a r a c t e r í s t i c a s de cada etapa del c i c l o del e p i t e l i o semi_
nífero.
Se estudiaron 3 l a m i n i l l a s con secciones seriadas del t e j i d o de cada r a t ó n , es d e c i r 9 l a m i n i l l a s por grupo y un t o t a l de 72 en los dos experimentos.
Por o t r a parte del t e j i d o i n c l u i d o en LX112 se h i c i e r o n c o r t e s de .25 mieras de g r o s o r , que se t i ñ e r o n con Azul de T o l u i d i n a y cortes de 900 amstrongs
obtenidos con c u c h i l l a de diamante, en e l ultramicrotomo S o r v a l l MT-1, que se
t i ñ e r o n con c i t r a t o de plomo y acetato de u r a n i l o ( 35 ) .
Los cortes del t e j i d o i n c l u i d o en P a r a f i n a , a s i como l o s de .25 mieras de grosor se estudiaron en Microscopio Zeiss K7. El estudio de Microscopía - E l e c t r ó n i c a se l l e v ó a cabo con microscopio e l e c t r ó n i c o de transmisión Zeiss
EM 109; de l a s áreas más r e p r e s e n t a t i v a s se tomaron f o t o g r a f í a s con p e l í c u l a
Agfa-Pan Profesional que se ampliaron e imprimieron en papel Kodabromide. F3.
IV.-
RESULTADOS.
A . - Inducción de a l t e r a c i o n e s en l a forma del espermatozoide de ratón por E t i 1_
metanosulfonato.
(EMS).
En una etapa p r e l i m i n a r a nuestro e s t u d i o , se e s t a b l e c i e r o n los porcentaj e s de formas anormales de espermatozoides y el t i p o de anomalías para l a cepa
de ratones u t i l i z a d a en éste estudio y las cepas p r o g e n i t o r a s .
En l a cepa C57BL/6n se presentaron 10.65% de espermatozoides de forma - anormal; en C3H e l porcentaje fué de 11.6 y para l a cepa h í b r i d a (C57BL X C3H)
Fj fué de 1.65. Esta notable disminución en el p o r c e n t a j e de espermatozoides de forma anormal, r e s u l t ó muy p r o p i c i a para l a detección del efecto del EMS a
éste n i v e l .
Las a l t e r a c i o n e s morfológicas encontradas se c l a s i f i c a r o n en cuatro g r u pos, que se i l u s t r a n en l a f i g u r a 38, y corresponden a defectos del gancho, formas f i l a m e n t o s a s , formas con doble cabeza ó doble cola y espermatozoides amorfos. Hubo d i f e r e n c i a s en cuanto al t i p o de a l t e r a c i ó n morfológica prevale
c i e n t e , siendo para C57BL más frecuente el t i p o amorfo, para C3H l a forma
fi-
lamentosa y para el h í b r i d o (C57BL X C3H)F^, el t i p o amorfo y los defectos del
gancho. Los porcentajes correspondientes se presentan en la f i g u r a 39.
No se observaron efectos tóxicos en los ratones a consecuencia de l a admi_
n i s t r a c i ó n del EMS a las dosis indicadas, ya que s i g u i e r o n comiendo y bebiendo
normalmente, aunque se v i ó disminución de l a a c t i v i d a d f í s i c a en los días s i guientes al t r a t a m i e n t o e i r r i t a c i ó n en el s i t i o de l a i n y e c c i ó n . No se regis_
t r ó muerte de los animales en ninguno de los experimentos.
Se produjo en general una elevación en el p o r c e n t a j e de formas anormales
en los ratones t r a t a d o s con el agente mutagénico, que no se observó en los ra
tones del grupo c o n t r o l a los que solo se les a d m i n i s t r ó agua t n a e s t i l a d a .
Se presentaron d i f e r e n c i a s en los incrementos detectados a 3,4 y 5 sema-
Pag.
57
o
Cn
-J
CD
O f
o
2 X
H
?Ö O
Cto
f re
O
O
cn
cn
-J
-J
CO
W
f
f
M
i-i
MX M X
M
O
O
CO
SC
0
01
-4
CO
f
H
X
o
co
re
o
cn
-o
M
C
X
> o
t-to
re
O
en
-J
CO
t*
I
25
O
O
co
•n
M
Gì
>
•n
m
CO
eo
CO
œ
N5
CO
ID
Ol
CO
en
C
O
«sj
CTI
en
OD
CTI
CO
C/l
to
NO
O
CO
co
en
w
•F
tO
cn
cn
CO
cn
IO
CD
co
cn
CO
CO
CO
CO
cn
Z
O
o
>
a
>
CO M
f
w
co
W
>
a>
l£>
IO
CTI ro
<T> cû
ro
cn
CT>
en
PO
o
S3
-J
cn
cn
CT>
Z
O
w
s
>
c
M
CO
M
<J>
cn
cn
cn
cn
o
-J
•F
CO
N>
cn
CD
35 o a
M M a
M
^
3
Gì
M
>
O
o
CO 25 H
O o
re co
o
to
co
-f
cn
O
<û
-O
O
cn
•f
so
to
cn
<1
cn
fO
CO
cn
co
o
co
a
ro
cn
cn
F
cn
CO
cn
•
CT)
to
en
•
>
CO
fO
cn
3
o
SO
O
co
CD
M
t>
3
CD
3
-3
O
LO
>
CO
F
fO
03
O
cn
o
cn
cn
W
1
i
o 1
•~J 1,
1
1
1
1
1
H1
en
en
•
«ft
o
>
CO M
TJ
O
73
3
>
CO
c
TI
o
w
O
f O 50
cn o 3
3 >
CO
n
a»
133
. > ci
CS3
>
í
i
O
i
!
i
i
i'
oa
CD
tM
n
iro
Z
O
c
o
o
M
O
525
a
tri
>
f
H
M
g
n
M
o
55
M
co
n
s
f>
TI
O
50
>
O
n
w
co
n
50
3
>
H
O
N
O
i-f
O
M
CO
o
M
TO
>
-3
O
22
•n
o
70
177
3
CO
•
ñas del t r a t a m i e n t o , l o mismo que en el t i p o de a l t e r a c i o n e s más f r e c u e n t e s .
La máxima elevación en el porcentaje de formas anormales se observó a las cu£
t r o semanas d e l t r a t a m i e n t o , encontrándose 12.35% de formas anormales de e s permatozoides y fueron más comunes las formas filamentosas y los espermatozoi_
des amorfos t a n t o a
las 3 como a las 4 semanas, mientras que a las 5 se v i e -
ron más los defectos del gancho. Los porcentajes correspondientes se presen-tan en l a f i g u r a 40, en e l que puede apreciarse que los resultados del segundo
experimento son Consistentes con l o s del primero. La prueba e s t a d í s t i c a aplica^
da i n d i c a que e x i s t e un 95% de grado de c o n f i a b i l i d a d para los resultados de éste ensayo ( f i g u r a 40).
B . - A l t e r a c i o n e s presentadas en el e p i t e l i o seminífero de ratones t r a t a d o s con
EMS.
El estudio m o r f o l ó g i c o de l a s a l t e r a c i o n e s producidas en el e p i t e l i o sem i n í f e r o de ratones t r a t a d o s con el agente mutagénico, fué r e a l i z a d o sobre to
do en cortes h i s t o l ó g i c o s de 3 mieras de grosor en l o s que un gran nCrnero de túbulos seminíferos pudo ser estudiado comparativamente. Aunque los c o r t e s de
.25 mieras de grosor del t e j i d o i n c l u i d o en resina LX112, ofrecen una mejor re
s o l u c i ó n , su desventaja fué que sólo unos pocos túbulos pudieran a n a l i z a r s e com
parativamente en un c o r t e ; s i n embargo fueron de u t i l i d a d para corroborar y d£
t a l l a r l o s hallazgos hechos en c o r t e s de 3 mieras, para l a l o c a l i z a c i ó n de espermátides anormales y en l a s e l e c c i ó n de áreas con daño mínimo para el estudio
ultraestructural.
OBSERVACIONES GENERALES.Aunque el tamaño y el peso t e s t i c u l a r no fueron precisados en éste e s t u d i o , no se apreciaron h i p o t r o f i a ó a t r o f i a t e s t i c u l a r en las secciones
histo-
l ó g i c a s . La albugínea apareció í n t e g r a , así como l o s tabiques de t e j i d o cone£
Fig. 40
Determinación estadística del grado de confiabilidad
de los resultados.
N =
-
— —
L
(donde)
t = cte. = 1.96 X 2
P = % de formas normales
Q = % de formas anormales
L = % de significación
(100% - % de Significación = Grado de Confiabilidad).
De nuestros datos :
(22) (P)
(Q)
N
(4)
(94.5)
(6.2)
N
25
N= 93.7
Fig.
41
Tiempo de
sacrificio
(número de células que deben
contarse para obtener un gra_
do de confiabilidad de 95%
en nuestros resultados).
Porcentaje de tubulos alterados por el EMS
% de tubulos
con daño
leve.
% de Tubulos
con daño
moderado
% de túbulos
con daño
severo
Total
de túbulos
lesionados,
3 semanas
23
30
5
58%
4 semanas
32
40
9
81%
5 semanas
28
14
12
54%
t-ivo i n t e r s t i c i a l , vasos sanguíneos y c é l u l a s de Leydig. Comparados con los c o n t r o l e s , los t ü b u l o s seminíferos mostraron mayor f r a g i l i d a d apareciendo con
f r e c u e n c i a d i s t o r s i o n a d o s a causa del e f e c t o mecánico del procesamiento.
El daño t u b u l a r f u é muy evidente aunque no u n i f o r m e , encontrándose túbulos de a p a r i e n c i a normal y o t r o s con d i f e r e n t e grado de l e s i ó n . Para f a c i l i t a r
ésta d e s c r i p c i ó n los túbulos lesionados se c l a s i f i c a r o n de l a s i g u i e n t e manera:
a) Lesión t u b u l a r l e v ? . - En túbulos con membrana basal í n t e g r a , y en los que f a l t a n c é l u l a s en pequeñas áreas y l a organización es de aspecto normal, así como l a t i n c i ó n general del t ú b u l o .
b) Lesión t u b u l a r moderada.- Cuando l a membrana basal aparece i n t e g r a pero e l
e p i t e l i o se ve afectado con disminución de l a c e l u l a r i d a d y pérdida del ordenamiento normal de las c é l u l a s ; l a t i n c i ó n general del túbulo se ve disminuida
y l a f r a g i l i d a d del e p i t e l i o es mayor. ( F i g s . 43,45 y 46).
c) Lesión t u b u l a r severa.- La membrana basal sigue siendo normal aunque por l a mayor f r a g i l i d a d de los túbulos con f r e c u e n c i a se observan rupturas en e l l a ;
el túbulo se ve francamente a l t e r a d o , el e p i t e l i o se reduce a una ó dos capas
de c é l u l a s ó bien f a l t a por completo, por l o que l a t i n c i ó n general es p á l i d a .
( F i g . 47).
PORCENTAJE DE TUBULOS LESIONADOS.
Un recuento de l o s túbulos dañados nos p e r m i t i ó determinar que el grado
de l e s i ó n v a r i ó según e l d i f e r e n t e tiempo t r a n s c u r r i d o después de la administ r a c i ó n del EMS. A las t r e s semanas el 58% de los túbulos presentaron daño, l a
mayor parte de e l l o s moderado a leve y sólo el 5% mostró daño marcado; a las
cuatro semanas e l daño fué más extenso, e l 81% de los túbulos presentaron
le-
s i ó n , 40% daño moderado y 9% mostraron daño marcado; a las cinco semanas 44"
de los túbulos presentaron l e s i ó n , 28% con daño leve y 12% con l e s i ó n marcada.
Estos datos se presentaron en l a F i g . 41. Los cambios producidos a n i v e l de -
cada t i p o c e l u l a r en el túbulo s e m i n í f e r o , se d e s c r i b i r á n a c o n t i n u a c i ó n , seña
lando a l a vez las observaciones hechas con microscopía e l e c t r ó n i c a .
ALTERACIONES EN ESPERMATOGENIAS.
Los cambios producidos en espermatogonias fueron mínimos y éste parece ser el t i p o c e l u l a r menos afectado de las c é l u l a s espermatogénicas.
a) Número.- Hubo disminución en el número de espermatogonias o s t e n s i b l e sobre
todo en túbulos de daño moderado a severo en éstos ú l t i m o s algunas zonas aparecían desprovistas de espermatogonias ( F i g . 4 3 ) . En los ratones
sacrificados
a las t r e s semanas, l a disminución fué poco marcada y v i s i b l e en las primeras
etapas del c i c l o del e p i t e l i o seminífero. A las cuatro semanas la f a l t a de
permatogonias se observó por igual en las primeras y las últimas etapas del c i c l o , mientras que a las cinco semanas l a disminución de espermatogonias se
notó más en las ú l t i m a s etapas del c i c l o del e p i t e l i o
seminífero.
b) M i t o s i s . - Salvo en las etapas IX a X I I , se vieron pocas espermatogonias en
d i v i s i ó n . Sólo ocasionalmente se vieron c é l u l a s de éste t i p o en degeneración,
y específicamente en túbulos con daño l e v e .
c) L o c a l i z a c i ó n . - En éste aspecto no se observaron cambios, ya que las espermatogonias permanecieron siempre en el compartimiento basal del e p i t e l i o semj^
nífero.
d) M o r f o l o g í a . - No se detectaron cambios morfológicos a n i v e l de microscopía
de l u z y e l e c t r ó n i c a .
CAMBIOS EN ESPERMATOCITOS.
Este fué uno de los t i p o s c e l u l a r e s más dañados, encontrándose cambios sobre todo en espermatocitos paquitenicos medianos y t a r d í o s . No se observaron
cambios en z i g o t e n o , y se v i e r o n pocos espermatocitos primarios en d i p l o t e n o y
d i a c i n e s i s así como espermatocitos secundarios. Los cambios observados en es-
X
64
Tübulos seminíferos normales del gru
po control. El túbulo superior muestra una asociación celular correspon
diente a la etapa III del ciclo del epitelio seminífero. La pared del tü
bulo muestra espermatogenias B, célu
las de Sertoli, espermatocitos paqui
tónicos, espermátides redondos y espc-rma^ides 33. El túbulo inferior pre
senta una asociación celular compatible con la etapa V del ciclo del epitelio seminífero. Objetivo 40 X.
F i g u r a
Dos tübulos seminíferos de las etapas
III y IV que presentan lesiones de gra
do moderado a consecuencia de la administración de EMS. En ambos túbulos se
observa una notable disminución de la
población celular a expensas de las cé
lulas e=;permato--'nicas. La disminución
es marcada en cuanto i espeimatogonius
y espermatocitos primarios. El número
de espermátidos tempranos es también mucho menor, (compárese con la fotografía anterior). Objetivo 40 X.
No. 4 2
permatocitos paquiténicos fueron los s i g u i e n t e s :
a) Número.- Se observó una disminución de éstas c é l u l a s en todas las etapas del c i c l o del e p i t e l i o s e m i n í f e r o , aún en túbulos con daño l e v e , donde f a l t a ban espermatocitos en pequeños segmentos, dejando huecos en l o s s i t i o s corres^
pondientes. Las áreas afectadas por éste cambio
fueron mayores en túbulos de
daño moderado, y en l o s de l e s i ó n severa, en los que l l e g a r o n a desaparecer por completo en grandes áreas.
b) L o c a l i z a c i ó n . - En túbulos con l e s i ó n leve no se observaron cambios en el
-
acomodo normal de las c é l u l a s , que se presentaron acompañando a los defectos
en el número de las c é l u l a s , encontrándose espermatocitos aún en l a luz del
-
túbulo s e m i n í f e r o .
c) M o r f o l o g í a . - Se presentaron cambios nucleares y c i t o p l a s m á t i c o s que indican
l e s i ó n c e l u l a r severa que culminó con muerte y desaparición de muchos espermatocitos.
Estos cambios se observaron aún en túbulos con daño l e v e , y en todas
las etapas del c i c l o del e p i t e l i o s e m i n í f e r o , y no se observaron d i f e r e n c i a s
a i n t e r v a l o s d i s t i n t o s de exposición al EMS.
Con microscopía de luz el citoplasma presentó un aspecto filamentoso y disgregado; que en secciones de .25 mieras fué más e v i d e n t e ,
apreciándose
-
además pérdida de las granulaciones propias del citoplasma así como desaparición de l a membrana nuclear y plasmática.
(Fig. 47).
En túbulos con daño leve éstos cambios fueron segmentarios observándose
espermatocitos con d i v e r s o grado de l e s i ó n alternando con espermatocitos de aspecto normal. En túbulos con l e s i ó n moderada a marcada e l daño fué más extenso y l a t o t a l i d a d de los espermatocitos mostraron éstos cambios.
Con microscopía e l e c t r ó n i c a se vieron espermatocitos con francos signos
de muerte c e l u l a r : desaparición de organelos y membranas; o t r o s espermatocitos
no mostraron ningún cambio u l t r a e s t r u c t u r a l .
En el núcleo, coincidiendo con -
éstos cambios c i t o p l á s m i c o s , se observó c a r i ó l i s i s ; apareciendo con microscopía de luz mal d e l i m i t a d o s . Se observó d i s o l u c i ó n de l a cromatina hasta desa-
Tubulo seminífero normal, del grupo
control, correspondiente a la etapa
V ó VI de ciclo del epitelio semini
fero. La pared del tùbulo aparece constituida por espermatogenias, es
permatoeitos paquiténicos, espermáti
des poligonales y una generación más
avanzada de espermátides del estadio
15 de la espermiogénesis. Observese
la gran cantidad de colas que ocupan
la luz del tubulo seminífero.Objetivo 40 X.
F i g u r a
MicrofotografSa que muestra varios tu
bulos seminíferos en los que el daño
producido por el EMS es evidente. El
tübulo señala ir (flecha), aparece
sección longitudinal, lo que permite
observar la extensión del daño. La
minuciór. de Co[ ci n .togonias y osj e
tocitos es muy nurcadi; pocas colas
espermátides avanzados se ven en la
de éste tübulo. (Compárese con la Fi
anterior). Objetivo 25 X,
F i r u r a
No. U5
No. Ui4
parecer por completo. La desaparición de l a envoltura nuclear fué confirmada
con microscopía e l e c t r ó n i c a .
CAMBIOS ESPERMATIDES.
Con microscopía de luz se detectaron f á c i l m e n t e cambios en espermátides
tempranos y algunas formas anormales de espermátides avanzados pudieron obser
varse en cortes de .25 mieras.
a) Número.- Se observó claramente disminución en el número de espermátides en
todas l a s etapas del c i c l o del e p i t e l i o seminífero poco notable en túbulos de
daño l e v e , pero francamente evidente en túbulos de l e s i ó n moderada a severa,
en algunos de l o s cuales los espermátides desaparecieron por completo. Los espermátides f a l t a n t e s correspondieron en su mayor p a r t e a la Fase de Golgi y
de Casquete; l a f a l t a de éstas c é l u l a s dió un aspecto desorganizado al
epite-
l i o s e m i n í f e r o . Estos cambios numéricos fueron más evidentes a las 4 y 5 semanas después de la a d m i n i s t r a q i ó n del EMS, cuando se observó aún en túbulos
con daño l e v e .
b) L o c a l i z a c i ó n . - En túbulos de daño moderado l a f a l t a de espermatocitos oca^
sionó una separación aparente e n t r e l o s compartimientos basal y
a d l u m i n a l ; se
observaron espermátides tempranos en s i t i o s anormales, como l a l u z del túbij
l o s e m i n í f e r o , y r a m i l l e t e s de espermátides se observaron desprendidos del e p i t e l i o . Estos cambios se presentaron siempre acompañando a l a disminución
de l a población de espermátides y espermatocitos.
c) M o r f o l o g í a . - En espermátide en Fase de Golgi y de Casquete (redondos y p¿
l i g o n a l e s ) , se observaron cambios concordantes con muerte de las c é l u l a s , se
mejantes a los v i s t o s en espermatocitos p a q u i t é n i c o s : el citoplasma mostró un aspecto filamentoso y disgregado, con pérdida de los l í m i t e s c e l u l a r e s y
de las granulaciones propias del citoplasma, como se pudo observar en cortes
de .25 ffiieras ( F i g s . 45 y 46). Algunas c é l u l a s mostraron franca a c i d o f i l i a
citoplásmica.
-
Microfotografía en la que se observan
tübuJos seminíferos de las etapas IX
y X'del ciclo del epitelio seminífero.
A este aumento resulta evidente la —
dislución y disgregación del citoplas
rr.a de los espermatocítos primarios y
la resistencia de los espermátides avanzados al efecto tóxico del EMS.
Objetivo 40 X.
F i g u r a
Corte semifino del tejido testicular
incluido en resina LXil. Se observan
espermatogenias A y B sin alteraciones
aparentes, ta porción bisal de la célu
la de Sertoli no muestra alteraciones,
pero su eitopl\sna medio y apicil ha
desaparecido. Va-ios espermatocitos paquitcnicos iiuostr n disolución cito
plásmica y v_arióii? is. Me. st obse. vai.
•acuolizar ion ci op_a^rr i . i ni picioris
nuclear. Objetivo lr>0 X.
I' i " ii i a
. i >
No. 46
Cambios en l a morfología nuclear acompañaron a las a l t e r a c i o n e s citoplás^
micas en éstas c é l u l a s . Los f i n o s grumos de cromatina desaparecieron dando li¿
gar a l a r e t r a c c i ó n y condensación de l a cromatina ( p i c n o s i s n u c l e a r ) . Con f r e
cuencia se observaron grupos de espermatocitos con éstos cambios, en l a l u z del túbulo s e m i n í f e r o . Conmicroscopía e l e c t r ó n i c a se pudieron comprobar los cambios n e c r ó t i c o s en las c é l u l a s
lesionadas.
Pocas c é l u l a s presentaron éstos cambios morfológicos en túbulos con daño
l e v e , y fueron más d i f u s o s y marcados en túbulos con daño moderado-severo y sobre todo a las 4 y 5 semanas de l a a d m i n i s t r a c i ó n del EMS.
No se observaron cambios morfológicos en espermátides en
elongación y -
avanzados, a n i v e l de microscopía de l u z . En algunos casos se observó p i c n o s i s , pero por las c a r a c t e r í s t i c a s normales de éstas c é l u l a s , éste cambio fué
d i f í c i l de evaluar ( F i g . 46).
En cortes semifinos se pudieron observar espermátides en maduración de forma anormal, frecuentes a las t r e s semanas del t r a t a m i e n t o . Estos túbulos fueron seleccionados para el e s t u d i o u l t r a e s t r u c t u r a l de espermátides avanzados con l a f i n a l i d a d de indagar los cambios conducentes a l a a p a r i c i ó n de espermátides de forma anormal.
CAMBIOS EN LA CELULA DE SERTQLI
Pocos cambios fueron v i s t o s en éstas c é l u l a s que e s t u v i e r o n presentes en
todas las etapas del c i c l o del e p i t e l i o seminífero y a las 3, 4 y 5 semanas de l a a d m i n i s t r a c i ó n del EMS. No se apreciaron cambios en su número ni en su
localización.
No se observaron cambios morfológicos en su porción basa! donde el núcleo
t í p i c o y el citoplasma p e r i n u c l e a r fueron de aspecto normal. En las porciones
media y a p i c a l se observó pérdida del citoplasma en r e l a c i ó n con las c é l u l a s
espermatogénicas en d i s o l u c i ó n ; ésto fué más notable en el citoplasma apical
en r e l a c i ó n con grupos de espermátides que se vieron l i b r e s en l a luz del
tú-
bulo ( F i g . 4 7 ) . No se observaron cambios u l t r a e s t r u c t u r a l e s en éstas c é l u l a s
en túbulos de aspecto normal, excepto l a presencia de m a t e r i a l electrodenso filamentoso y radiado en r e l a c i ó n al acrosoma de espermátides
tardíos.
Otros cambios.- Masas a c i d ó f i l a s conteniendo m ú l t i p l e s núcleos p i c n ó t i c o s se
v i e r o n en l a luz del túbulo seminífero con daño moderado a marcado, y sobre
todo a las 4 y 5 semanas de l a exposición al agente mutagénico. Estas masas
se observaron en r e l a c i ó n con áreas donde se observaron espermátides que mos_
traban p i c n o s i s nuclear.
C.- A l t e r a c i o n e s u l t r a e s t r u c t u r a l e s en l a espermatogénesis inducidas por EMS.
Se hizo un a n á l i s i s con microscopía e l e c t r ó n i c a del t e j i d o t e s t i c u l a r
-
de los ratones t r a t a d o s con EMS, para indagar sobre los cambios morfológicos
conducentes a l a a p a r i c i ó n de espermatozoides de forma anormal.
Para éste e f e c t o , se seleccionaron por examen del t e j i d o con microscopio
de l u z , en c o r t e s de .25 mieras, los túbulos en los que no había daño aparente y aquellos en los que fué p o s i b l e i d e n t i f i c a r espermátides avanzados de - forma anormal.
En el examen con microscopio e l e c t r ó n i c o de los túbulos seleccionados, las c é l u l a s espermatogénicas que mostraron cambios morfológicos correspondieron a espermátides avanzados.
No se detectaron cambios a n i v e l de espermatogonias, espermatocitos
pri-
marios y secundarios; tampoco hubo cambios morfológicos durante l a espermio-génesis temprana; las Fases de Golgi y de Casquete no presentaron a l t e r a c i o n e s
al igual que en l a fase acrosoma! temprana no hubo d i f e r e n c i a s entre el
tejido
t u b u l a r de los animales de c o n t r o l y los t r a t a d o s .
Los cambios morfológicos v i s t o s durante la espermiogénesis fueron
refe-
rentes a l a modelación del acrosoma, l a condensación de l a cromatina, l a mode
l a c i ó n del núcleo; l a organización de los microtúbulos y l a implantación del
f l a g e l o , también se observaron fenómenos de d u p l i c a c i ó n a diversos
niveles.
Microfotografía electrónica que muestra espermátides anormales del estadio 9. Al centro aparece uno en sección longitudinal; su núcleo es peque
ño. A la izquierda, otro espermátide
anormal presenta defecto en la elonga
ción de la cabeza; el aerosoma se ve
asociado a un material electrodenso de aspecto filamentoso y radiado.
(7, 200 X)
F i g u r a
Espermátides anormales del estadio 9.
El nucleo está aplanado en su polo an
terior y el aerosoma se limita a este
extremo sin desplazarse caudalmente.
Los microtûbulos del manchette no pre
sentan su organización típica. La posición de la fosa de implantación tam
bien es anormal. (Conpárese con las Figs. 24, 25 y 26). (24, OfQ X).
Fi g u r a
No. 49
No.48
A continuación se d e s c r i b i r á n las formas de espermátides observados, en
los túbulos seminíferos seleccionados para estudio
ultraestructural.
Espermátides de los estadios 9 y_ 10: Fueron i d e n t i f i c a d o s por el
tipo
de asociación del que forman p a r t e . En muchos de e l l o s el defecto p r i n c i p a l
correspondió a l aplanamiento del polo a n t e r i o r del núcleo y a l a f a l t a de - elongación n u c l e a r , que normalmente se presenta en ésta etapa ( F i g s . 48,49 y
50). También se presentaron en éstos e s t a d i o s , a l t e r a c i o n e s acrosomales; en
muchos casos el acrosoma se l i m i t ó a c u b r i r el extremo a n t e r i o r aplanado del
núcleo ( F i g s . 49 y 5 0 ) , conservando su aspecto e s t r a t i f i c a d o normal. Con f r e
cuencia se observó l a asociación del m a t e r i a l acrosomal a.gruesas
estriacio-
nes electrodensas de d i s p o s i c i ó n r a d i a d a , ( F i g s . 49 y 51), que parecen e s t a r
l o c a l i z a d a s en el citoplasma de l a c é l u l a de S e r t o l i .
En l a Fig._48.uno de los espermátides aparece en sección
longitudinal;
el núcleo es pequeño y l a condensación de l a cromatina es ligeramente mayor
que en los espermátides de l a derecha, de aspecto normal. Tal vez debido a l
plano de sección en l a región de l a cabeza no se observa acrosoma, y los m i crotúbulos presentan un t r a y e c t o o b l i c u o , aunque en el extremo caudal no p r ^
sentan e l a r r e g l o l o n g i t u d i n a l c a r a c t e r í s t i c o del Manchette. Se observa l a formación del c u e l l o y l a pieza intermedia del f l a g e l o , de aspecto normal.
En el c u e l l o es p o s i b l e observar a los c e n t r í o l o s proximal y d i s t a l ,
a s i como el ánulo. El f l a g e l o se observa en gran parte de su l o n g i t u d ,
-
inclu£
do en el canal f l a g e l a r . El citoplasma es muy abundante y presenta gran canti_
dad de mitocondrias vesiculosas
típicas.
A r r i b a y a la i z q u i e r d a en ésta misma f o t o g r a f í a se observa un espermá
t i d e también anormal, en el que l a elongación del núcleo ha f a l l a d o y el acro^
soma l o c a l i z a d o al rostrum, se asocia a un m a t e r i a l filamentoso y e l e c t r o d e n so que se i r r a d i a hacia el citoplasma de l a c é l u l a de S e r t o l i del que parece
formar p a r t e .
En algunos espermátides como el que se muestra en l a f i g u r a 50, se o b - -
Espermátide anormal del estadio 9.
El extremo anterior de la cabeza apa
rece aplanado en sentido perpendicular al eje del espermatozoide. El
—
alargamiento nuclear es defectuoso.
La cromatina periférica se presenta
en agregados irregulares. En algunos
sitios la envoltura nuclear no se ob
serva y los microtúbulos del manchette parecen ponerse en contacto direc
tamente con la cromatina (flechas).
(20, 800 X)
Espermátide anormal del estadio 10.
La' sección corresponde al polo caudal
del núcleo, en el cual se observan dos
escotaduras.
r
n una de ellas se obser
van los centríolos y el flagelo, y <_o
rresponde a la io^a de implantación que es más profunda y asimétrica. En
la otra excavación
>e observa una gran
vesícula que ¡odt ía corresponder a la
envoltura nuclear redundante (flechas).
El resto de la célula no presenta alte
raciones. (26, 000 X)
F i g u r a
No. 51
servó fragmentación de l a cromatina p e r i f é r i c a . En éste caso l a envoltura parece haber desaparecido en algunos tramos en l o s que la cromatina nuclear
--
queda expuesta directamente a los microtúbulos del citoplasma.
Otra observación hecha en éstos espermátides, es l a desorganización de
l o s microtúbulos del manchette. En algunos casos, como en l a f i g u r a 49, most r a r o n un t r a y e c t o o b l i c u o anormal. En ésta misma m i c r o g r a f í a l a p o s i c i ó n de
la fosa de implantación parece ser anormal.
En muchos casos l a d i r e c c i ó n del plano de sección es d i f í c i l
de e s t a -
b l e c e r ; s i n embargo espermátides como l o s que se observan en las F i g s . 51 y
52, no se observaron en el grupo c o n t r o l . El grado de condensación cromatíni_
ca y el t i p o de asociación de l a que forman parte indican que corresponden al estadio 10 de l a espermiogénesis. En l a F i g . 51. no se observa el acrosoma,
el núcleo t i e n d e a ser de forma e l í p t i c a , y presenta en uno de sus lados una
doble excavación, separadas entre sí por una proyección estrecha. En una de
las excavaciones se observan unas e s t r u c t u r a s que parecen corresponder a l par
de c e n t r í o l o s y al f l a g e l o . En l a o t r a excavación se observa una formación v e s i c u l a r membranosa que contiene un m a t e r i a l de escasa e l e c t r o d e n s i d a d y que
recuerda a l a e n v o l t u r a nuclear redundante (ver F i g . 2 7 ) . Los m i c r o t ú b u l o s apa
recen en secciones o b l i c u a s y t r a n s v e r s a s ; el citoplasma vecino es muy abundante y presenta algunas mitocondrias v e s i c u l a r e s
típicas.
En l a F i g . 52, se presenta una espermátide que en ésta sección muestra
una forma e l í p t i c a , en el que l a e n v o l t u r a nuclear no puede ser precisada. En
uno de los extremos se observa un c e n t r í o l o en sección t r a n s v e r s a , que podría
señalar el extremo caudal de la c é l u l a , sin embargo, los m i c r o t ú b u l o s del mar^
c h e t t e parecen tener una d i r e c c i ó n opuesta. El acrosoma y la fosa de implanta
ción no se observan, l o que puede ser explicado quizá por e l plano de sección.
Espermátides del estadio 12: Se observaron numerosas espermátides del estadío.42 con gran variedad de a l t e r a c i o n e s , como los que se muestran en la
f i g u r a 53. En muchos de e l l o s se observó de nuevo f a l t a de elongación n u c l e a r ,
Espermátide anormal del estadio 10.
El núcleo es pequeño y elíptico, pre_
senta disgregación de los agregados
densos de cromatina periférica. La en_
voltura nuclear no se observa. Un cen
tríolo aparece cortado transversalmen_
te en uno de los extremos del núcleo,
pero los microtübulos que aparecen en
sección oblicua, se dirigen hacia el
extremo opuesto.
(26, 000 X)
F i g u r a
Espermátidos del estadio 12 normales
(N) y anormales (An), algunos de ellos
se presentan a mayor aumento en las si
guientes figuras. Una forma extremadamente ano "nriril se observa en la parte superior de J s » 1 I?0 i j tografia (flecha)
( 6 , 000 X)
i i g u r a
N . 53
No. 52
aunque l a condensación de la crcmatina fué de aspecto normal en algunos y en
o t r o s fué defectuosa. Estas c é l u l a s mostraban también aplanamiento del extria
mo a n t e r i o r (rostrum) de l a cabeza, como se observa en el espermátide de l a f i g u r a 54. El acrosoma permaneció cubriendo sólo el extremo a n t e r i o r aplanado
del núcleo s i n extenderse caudalmente como sucede normalmente; ésta
altera-
ción se v i o asociada a una p o s i c i ó n muy a n t e r i o r por f a l t a de desplazamiento
caudal, del a n i l l o n u c l e a r . En éstas formas de espermátides anormales, los microtúbulos del manchette parten en d i r e c c i ó n p o s t e r i o r desde el a n i l l o nuc l e a r pero su t r a y e c t o es o b l i c u o y no r e c t o ; además en e l extremo caudal de
l a c é l u l a con frecuencia no es p o s i b l e observar l a fosa de i m p l a n t a c i ó n , aui^
que el f l a g e l o , aparece cortado t r a n s v e r s a m e n t e y a c i e r t a d i s t a n c i a de él
-
se observa un agregado de m a t e r i a l electrodenso que pudiera corresponder al
cuerpo cromatoide.
Otros espermátides del mismo estadio 12 presentaron cambios mucho más severos. El espermátide presentado en la f i g u r a 55, que corresponde a una amp l i f i c a c i ó n de l a zona indicada en l a f i g u r a 53, l a sección parece ser longj_
t u d i n a l , y el núcleo muestra una profunda escotadura que en su extraño caudal
a l o j a a l o s elementos propios de l a fosa de i m p l a n t a c i ó n . Comparándolo con espermátides del e s t a d i o 12 normales, r e s u l t a evidente que l a condensación de
la, cromatina es defectuosa, por l o que el núcleo aparece menos electrodenso.
Los microtúbulos presentan un patrón desorganizado y t r a y e c t o o b l i c u o por l o que parecen tener una d i r e c c i ó n perpendicular al eje l o n g i t u d i n a l de
la célula.
Por el c o n t r a r i o en algunas o t r a s formas anormales de éste e s t a d i o l a
cromatina presentó condensación extrema, asociada a o t r o s defectos como el ya mencionado aplanamiento a n t e r i o r de l a cabeza ( F i g . 5 6 ) ó bien deformidades
graves como l a observada en el espermátide de l a f i g u r a 57, en el que de nue
vo se observa el m a t e r i a l f i l a m e n t o s o electrodenso que en éste caso rodea ca
s i por completo al espermátide, y parece l o c a l i z a r s e en el citoplasma vecino
Espermátide anormal del estadio 12.
Los defectos son múltiples; el núcleo
es muy corto, el acrosoma se limita al extremo anterior del núcleo y su
forma es irregular; el anillo nuclear
permanece en posición muy anterior.
Los microtúbulos presentan un trayec^
to oblicuo. No se observa la fosa de
implantación; el cuerpo cromatoide se ve en el extremo caudal de la ce
lula en relación a estructuras vesi_
culares.
(13, 500 X)
F i g u r ft No. 54
Espermátide anormal del estadio 12.
El núcleo presen La una profunda escotadura, en cuyo extremo caudal se icen
tilica la fo.;a -ir 'implantación, Je po
sición anorrral. Ll citcplaoim es abun
dante.
(22,
800
X)
F i g u r a
No, 55
Erpermátide anormal del estadio 12.
El núcleo es muy corto y la cromatina
está muy condensada. El acrosoma cubre sólo el extremo anterior del núcleo y en sus extremos se asocia a material electrodenso y filamentoso
irradiado hacia la célula de Sertoli.
El anillo nuclear aparece en posición
muy interior i .los microtúbulos presen
tan ni inyecto .«normal.
(.Ib, 000 X)
F i g u r a
Espermátide anormal del estadio 12.
El extremo anterior ^e ^ef.ala con una
i lecha, donde se otserva que ol aeroect-an apl.njdo;-. ^e
son a y el nu
apiec'a dt. r.jf-vo el mure, ial filatoso descrito anteriormente en relición con -1
j
irosona. Una proyección
lateral que pe.ttcu ucr. expender uni_
camente al material acrorcmal es SÍ
mámente anor ul,
(23, 000 A)
F i P u I Í
No.
No. 56
Espermátides del estadio 13. Uno de
ellos normal (N) y otro anormal (An).
En este ultimo se observan alteracio
nes ya descritas como lo son el apla
namiento del polo anterior y la falta
de desplazamiento del acrosoma y del
anillo nuclear. Se observa también un
estrechamiento del núcleo en su parte
media. Los microtübulos del manchette
presentan un trayecto oblicuo anormal
(b, bOO X).
Espermátide «anormal del estadio
1
3.
El núcleo es muy lar?o; jn j eqaefio .».rag
mentó r.uclear aparece separado de la
—
parte principal d«l núcleo. Material electrodenco del citoplasma de la có'u
la de Sertoli so ve en relación con el
extremo anterior del acrosoma (flecha).
(17, 000 X)
F i g u r a
No. 59
•de l a c é l u l a de S e r t o l i .
Espermátides del estadio 13: En muchas c é l u l a s de éste e s t a d i o , pudo
observarse que el aplanamiento r o s t r a l d e s c r i t o en etapas a n t e r i o r e s
persis-
t e y el acrosoma sigue l i m i t a d o al extremo a n t e r i o r del núcleo; s i n embargo,
la elongación del r e s t o del núcleo pudo l l e v a r s e acabo. Esto se observa en la
f i g u r a 58 donde pueden compararse dos espermátides de éste e s t a d i o , uno de - a p a r i e n c i a normal y o t r o francamente anormal. El espermátide anormal presenta
además, un estrechamiento ó escotadura l o n g i t u d i n a l
hacia l a p a r t e media del
núcleo, asociada a microtúbulos de d i r e c c i ó n anormal. En o t r a s formas del mi_s
mo estadio ( F i g . 5 9 ) e l núcleo apareció d i v i d i d o en dos segmentos: un pequeño
fragmento a n t e r i o r rodeado de m a t e r i a l acrosomal y un fragmento mayor alarga,
do de posición caudal, separado del primero por un f i n o f i l a m e n t o
constituido
por el m a t e r i a l acrosomal y el escaso citoplasma p e r i n u c l e a r . Al parecer éstos espermátides alargados podrían ser precursores de las formas filamentosas
de espermatozoides v i s t a s al microscopio de l u z .
Otro t i p o de defecto acrosomal se observó en espermátides del estadio
13: una larga proyección del acrosoma con a p a r i c i ó n de una gran zona c e n t r a l
vacía, l o cual se observa en la f i g u r a 60, y se ve asociada al materia? eTectrodenso; que forma grumos ó filamentos i r r a d i a d o s hacia l a c é l u l a de S e r t o l i .
La pared de ésta proyección acrosomal es muy densa. Por su aspecto la proyección d e s c r i t a señala el extremo a n t e r i o r de la c é l u l a , y la posición de los espermátides vecinos indica que ésta c é l u l a está i n v e r t i d a .
Espermátides de los estadios 14, 15 y 16: Aunque en l o s espermátides de
éstos estadios ya no se observan m i c r o t ú b u l o s , las deformaciones acrosomales
y nucleares s i g u i e r o n observándose. Algunos espermátides presentaron una cabeza c o r t a de polo a n t e r i o r aplanado, en los que el acrosoma se v i o también
a l t e r a d o por su forma i r r e g u l a r y de l o c a l i z a c i ó n r o s t r a l .
Estos cambios pue
den vers« en uno de los espermátides de l a f i g u r a 61, el cual presenta además
una gran vacuola i n t r a n u c l e a r que aunque pudiera r e s u l t a r de la sección en un
Espermátides del estadio 12 ó 13.
Uno de ellos es anormal (An), por pre
sentar en uno de sus extremos una lar
ga proyección acrosomal que además es
vacuolada, y se ve también asociada j1 material electrodenso de la célula
de Sertoli, descrito en otros defectos acrosomales.
(10, 000 X)
F i g u r a
Espermátides
estallo Ib, uno normal
(N) y otro anormal (An). En éste último
el núcleo es corto y aplaT¿ado en su ex
tremo anterior. Se observa también una
estructura vesicular de contenido amor
fo, localizada er, el nú^le , que pudie
ra corresponder a un sitio de flexión
extrema que no
observa en esperná-
tides normales. El acrosoma está lini
tado al extrema anterior del núcleo y
es de forma a n o m a i .
(6, 000 X)
¡ i » u v a
N^.61
No. 60
s i t i o de f l e x i ó n nuclear extrema, en ésta especie no se observa normalmente.
En o t r o s espermátides los defectos fueron menos marcados,
localizándose
sobre todo a n i v e l del acrosoma, e l cual presentó proyecciones anormales que
casi siempre acompañaron a modificaciones leves en l a forma del núcleo; a l t e
raciones de éste t i p o pueden observarse en l a f i g u r a 62, en la que uno de l o s
espermátides muestra una excavación nuclear en el dorso y una implantación del f l a g e l o de s i t u a c i ó n anormal.
Con frecuencia se observó también e l m a t e r i a l acrosoma? de aspecto est r a t i f i c a d o normal asociado a f i n a s proyecciones radiadas del citoplasma vecino de l a c é l u l a de S e r t o l i . Esto es evidente en los espermátides observados
en l a f i g u r a 64.
La f a l t a de formación del gancho ó cuerno a n t e r i o r , fué o t r o de los de
f e c t o s mínimos observados en espermátides muy avanzados en su d e s a r r o l l o (es^
tadíos 15 y 16). Generalmente fué acompañado de defectos en l a modelación de
l a forma del acrosoma,observándose en ocasiones proyecciones del m a t e r i a l
-
acrosomal de p o s i c i ó n anormal. En l a f i g u r a 63 se observa un espermátide del
e s t a d i o 15 que muestra una prolongación v e n t r a l completamente anormal. En éstos espermátides con defectos acrosomales y nucleares mínimos l a formación
del c u e l l o y pieza intermedia de la cola del espermatozoide, fueron aparentemente normales, como puede verse en l a f i g u r a 64. Pero los defectos graves del acrosoma y núcleo se acompañaron de defectos en l a implantación y d i r e c c i ó n del
flagelo.
Fenómenos de d u p l i c a c i ó n : Estos fueron observados en espermátides de d i f e r e n t e s estadios y fueron mucho más frecuentes que en los del grupo c o n t r o l donde no se observaron éste t i p o de fenómenos.
En l a f i g u r a 65, se muestra una espermátide del estadio 9 que posee 2
núcleos, los cuales aparecen fusionados por su lado d o r s a l , mediante el mate
r i a l acrosomal que se encuentran compartiendo. El extremo a n t e r i o r de ambos
Espermátide anormal del estadio 15
(An), que presenta una flexión dorsal
anormal (flecha). El acrosoma se aso
cia al material electrodenso ya descrito. En el extremo caudal del níi-cleo la implantación del flagelo y
dirección del mismo es anormal.
(4, 600 X)
F i g u r a
Espermátide anormal del estadio 15 que
presenta defectos acrosomales. La proyección dorsal está muy acentuada, y
senta una proyección ventral que es c
pletamente anormal (ílecha). Se obser
van también microfilamentos del ei
ma de la célula de Sertoli asociados a
algunas de éstas malformaciones. Compá
rese con la Fig. 32.
(15, 000 X)
No. 62
Espermâtide anormal del estadio 16 en
sección longi Ludinal. El material aero
somal estratificado se ve asociado a
los filamentos electrodensos que se irradian al citoplasma de la célula de
Sertoli, descrito para formas anormales dé estadios anteriores (flecha).
El polo caudal del núcleo es muy pronunciado y la fosa de implantación es
muy profunda. Se observa un puente ci
toplâsmico entre el espermâtide des—-'
crito y uno vecino. (11,200 X).
F i g u r a No. 64
Lspermátide anormal del estadio 9, en
el que se observan dos núcleos fusionados por uno de sus lados mediante el
material acrosomal. El extremo a n t e rior del j.ücHo es a, loriado. La croma
tina nuclear muestra c^reg^dos df-nsos
en el intei ior y <-n la periferia. El
extremo caudal de cada núcleo presenta una exi a>/ac "ón, y juntos constituyen la fosa de implantación; en el ci
toplasma abundante se observan m i t o —
condrias y estructuras vesiculares li
mitadas por una unidad de membrana.
('1,C00 X).
F i g u r a No 65
núcleos está aplanado y en uno de e l l o s e l acrosoma se l i m i t a al r o s t r o del
núcleo. En el extremo caudal se observa una sola fosa de implantación que es
compartida por los dos núcleos.
En etapas más avanzadas se vieron espermátides del estadio 14 ó 15, con
sideradas a s i según el grado de condensación de su cromatina, que presentaban
también dos núcleos. En e l que se observa en la f i g u r a 66, los núcleos aparecen fusionados por uno de sus lados; asociados a la d u p l i c a c i ó n nuclear se observan en éste espermátide defectos de elongación y acrosomales. El m a t e r i a l acrosoma! es muy poco denso y en uno de e l l o s se puede observar una gran
d i l a t a c i ó n del acrosoma, cuyo aspecto recuerda las primeras etapas de f o r m a ción acrosomal.
En l a f i g u r a 67 se observa o t r a forma de espermátide anormal correspor^
d i e n t e al estadio 16. El espermátide es b i c é f a l o , y las dos cabezas aparecen
fusionadas por su extremo caudal. El acrosoma no parece e s t a r bien d e s a r r o l l a
do y el citoplasma p e r i n u c l e a r es muy abundante. La formación del f l a g e l o ,
-
que aparece en sección t r a n s v e r s a , es también aparentemente defectuosa ya que carece de vaina m i t o c o n d r i a l ; la mayor parte del citoplasma ocupa la r e gión caudal y en él pueden i d e n t i f i c a r s e un grupo de m i c r o t ú b u l o s , algunas e s t r u c t u r a s v e s i c u l a r e s y un agregado de m a t e r i a l electrodenso, pero no se observan m i t o c o n d r i a s .
Espermátide anormal en el que se ob
servan dos masas nucleares que apare
cen fusionadas lateralmente. El aero
soma tiene aspecto vacuolar de conté
nido flocular de poca electrodensidad
y semeja la vesícula acrosomal de es
tadíos tempranos del espermiogénesis.
En el citoplasma vecino se observan
microtübulos en corte transversal.
(24, 700 X)
F i g u r a
Espermátides anormales del estadio 16
que presentan dos núcleos en un solo flagelo cortado transversalmente que
carece de vaina fibrosa y mitocondrial
El citoplasma es muy abundante. Los microtübulos del nanchette, el cuerpo
cromatoide y algunas.estructuras membranosas vesiculares se localizan en
el extremo caudal.
(26, 000 X).
F i p u r a
No. 67
No. 66
V. D I S C U S I O N
.
La cepa h í b r i d a u t i l i z a d a en éste e s t u d i o r e s u l t ó de mucha u t i l i d a d por
presentar un porcentaje sumamente bajo de espermatozoides de forma anormal.
A s í , observamos el e f e c t o que l a cruza de las cepas endogámicas produce sobre e l p o r c e n t a j e de formas anormales; c o i n c i d i e n d o con l o d e s c r i t o por Kra
zanowska (1968 y 1976) en sus estudios de h e t e r o s i s , y de acuerdo a l o propuesto por Wyrobeck (1979), el porcentaje de formas anormales de espermatozoides r e s u l t ó ser en éste experimento, menor que en los genotipos paternos.
El e f e c t o del EMS, sobre l a espermatogénesis, fué f á c i l m e n t e detectado
por l a s elevaciones producidas en e l número de espermatozoides anormales. A
éste respecto las observaciones hechas en éste experimento concuerdan con lo reportado por Wyrobeck (1975); aunque las elevaciones en el porcentaje de
formas anormales fueron en nuestro estudio menores (12%) que las reportadas
por Wyrobeck, a dosis y tiempo de exposición comparable (más d e l 20%); la elevación máxima se produjo a las cuatro semanas. Por o t r a p a r t e , l o s t i p o s
de a l t e r a c i o n e s morfológicas v i s t a s correspondieron en general a los descri_
tos por o t r o s autores ( 8,9 ) pero l a forma filamentosa d e s c r i t a en éste es.
t u d i o no había sido reportada.
El i n t e r v a l o entre e l tratamiento y e l tiempo de muestreo de los esper
matozoides indican cuales etapas han sido afectadas con base a la vida media
de las c é l u l a s espermatogénicas (12,69,98). Considerando l o a n t e r i o r , a las
t r e s semanas de tratamiento estaremos observando los cambios producidos en
espermátides tempranos; a l a s cuatro semanas se observará el efecto del
tra-
tamiento sobre espermatocitos y a las cinco semanas sobre espermatogonias.
Las formas anormales de espermatozoides^inducidas a las cuatro semanas
y los espermátides anormales observados a las t r e s semanas del tratamiento representarán por lo tanto a células que fueron expuestas al EMS en etapa de
espermatocito p r i m a r i o .
El mecanismo de producción de éstas anomalías aún se d i s c u t e . Se ha s.u
g e r i d o que en general las etapas de espermatogenias t a r d í a s a espermatocitos
tempranos son los estadios c e l u l a r e s más sensibles a l a acción de l o s agentes
químicos, en l a producción de espermatozoides anormales ( 9 8 ) . Sin embargo el
EMS t i e n e l a capacidad de atravezar l a barrera h e m a t o t e s t i c u l a r , por l o cual
puede actuar sobre estadios postmeióticos (73,102). Se ha reportado que éste
agente produce mutaciones l e t a l e s dominantes, aberraciones cromosomales y mu_
taciones de punto en c é l u l a s e s p e r m a t o g e n i a s , específicamente en espermátides
y espermatozoides^Esto parece e s t a r relacionado con l a f a l t a de sistemas
re-
paradores del daño genético en éstos estadios ( 57 ) .
En cuanto a las a l t e r a c i o n e s gruesas producidas por el EMS en el epite_
l i o seminífero del r a t ó n , el p r i n c i p a l cambio observado fué l a disminución de
l a población c e l u l a r . A d i f e r e n c i a de l o reportado para la Mitomicina C y las
radiaciones i o n i z a n t e s por Leonard y G u i l l i a v o d (1973), la disminución sucede
a expensas de los espermatocitos y no de las espermatogonias.
Aunque se observó disminución en el número de espermatogonias» éste cam
bio fué d i s c r e t o y pudiera deberse a la f a l t a de m i t o s i s , ya que éste agente
a f e c t a l a s í n t e s i s de DNA (102) y ya que no se apreciaron cambios i n d i c a t i v o s
de muerte en éstas c é l u l a s . El e f e c t o c i t o t ó x i c o de l a Mitomicina C sobre las
espermatogonias no fué v i s t o a consecuencia del EMS; los espermátides avanzados tampoco fueron susceptibles al efecto t ó x i c o de ésta droga. Resultaron ser
más susceptibles a éste e f e c t o , los espermatocitos y espermátides tempranos, en l o s que se produjo l a muerte a l a dosis administrada de EMS. También se ha
reportado muerte de espermatocitos y espermátides por 5 - f l u o r o u r a c i l o ,
tinum (63) y por hexafluoroacetona
Cis-pla.
(33).
Los cambios observados más frecuentemente en las c é l u l a s afectadas por
el EMS, fueron c a r i o l i s i s y c i t o l i s i s . La p i c n o s i s nuclear no parece ser un
cambio indicador de muerte en los espermatocitos. Tampoco se observó la franca
v a c u o l i z a c i ó n del citoplasma, d e s c r i t a para o t r o s agentes t ó x i c o s en éstas cé
l u l a s ( 60 ) .
Un aspecto morfológico importante que i n f l u y e sobre el e f e c t o de los agentes mutagénicos sobre las c é l u l a s espermatogénicas, es l a presencia de puentes i n t e r c e l u l a r e s e n t r e espermatogenias y espermatocitos, asi como el englobamiento de espermátides por las c é l u l a s de S e r t o l i
( 2 4 ) ; por éste moti_
vo es p o s i b l e que en cualquiera de éstas etapas el daño producido a una célj¿
l a pueda t r a n s m i t i r s e a todo el grupo, como se ha v i s t o después de l a aplica^
ción de radiaciones i o n i z a n t e s ( 37 ) . La extensión del daño producido
ini--
cialmente en espermatocitos aislados a los de las regiones vecinas, observado en éste experimento, pudiera ser explicado igualmente por la presencia de
t a l e s puentes
intercelulares.
. Para e l e s t u d i o u l t r a e s t r u c t u r a l de los cambios inducidos en c é l u l a s espermatogénicas del r a t ó n , a consecuencia del EMS, se descartaron los túbulos en los que el efecto t ó x i c o de éste agente causó graves a l t e r a c i o n e s y
muerte de las c é l u l a s . La selección de túbulos con daño mínimo ó s i n é l ,
tu-
vo el propósito de detectar cambios s u t i l e s en l a morfología de las c é l u l a s
espermatogénicas, que pudieran dar información relacionada con los mecanismos
que condujeron a las formas anormales de espermatozoides.
Los resultados de éste estudio indican que el daño causado por el EMS,
sea cual f u e r e su índole se m a n i f i e s t a en l a espermiogénesis avanzada.
En l a l i t e r a t u r a se encontraron pocos estudios u l t r a e s t r u c t u r a l e s
sobre
los cambios inducidos en l a espermatogénesis a consecuencia de d i f e r e n t e s
ti-
pos de drogas. Parvinen (1979a), reporta a l t e r a c i o n e s en espermatocitos z i g o ténicos y paquiténicos medios, así cono en espermátides redondos, a consecuer^
c i a de l a a d m i n i s t r a c i ó n de Procarbazina. En nuestro estudio no se detectaron
cambios en ninguna etapa previa a los estadios 9 y 10 de l a espermiogénesis.
Nuestros hallazgos concuerdan con las a l t e r a c i o n e s reportadas en r a t o nes mutantes e s t é r i l e s , que presentan un porcentaje elevado de formas anormales de espermatozoides ( 1 7 , 1 8 , 3 8 , 4 0 ) . Alteraciones en el a r r e g l o de los micro
t ú b u l o s , indentaciones nucleares anormales y f a l l a s en l a elongación n u c l e a r ,
semejantes a las observadas en éste experimento para el EMS, se han reportado
en un ratón e s t é r i l , homocigoto para el a l e l o T ( 1 7 , 1 8 ) .
Igualmente se han d e s c r i t o malformaciones acrosomales y defectos de l a
c i t o c i n e s i s que conducen a l a formación de espermatozoides b i c é f a l o s , en r a t £
nes e s t é r i l e s con un gen mutante que ocasiona además marcha a s a l t o s , polidac^
t i l i a y e s t e r i l i d a d ( 38 ) .
Otro r a t ó n mutante, con e s t e r i l i d a d y o j o rosa, también presenta esper.
miogénesis a l t e r a d a , encontrándose en éste caso defectos en el proacrosoma de espermátides tempranos y formación de colas m ú l t i p l e s ( 40 ) .
Según los cambios observados en espermiogénesis avanzada en nuestro ex
perimento, podríamos deducir que los espermatozoides amorfos v i s t o s con e l e vada frecuencia a las cuatro semanas del t r a t a m i e n t o con EMS, son producidos
por f a l l a p r i n c i p a l m e n t e en los mecanismos de elongación en espermátides de
l o s estadios 9 y 10; l a f a l t a de desplazamiento del a n i l l o nuclear puede ser
e l cambio i n i c i a l aunado a defectos de condensación de l a cromatina. Se ha sugerido que en el caso del EMS, la a l q u i l a c i ó n de la c i s t e í n a podría e v i t a r
l a formación de puentes d i s u l f u r o e i n t e r f e r i r con l a condensación de l a ero
matina ( c i t a d o por Lyon 1981).
La formación de l o s microtúbulos del manchette parece i n i c i a r s e norma]_
mente, pero en algunos casos se v i ó desorganización en r e l a c i ó n a defectos de l a envoltura n u c l e a r . Se ha propuesto que ésta f a l l a en el mantenimiento
en el a r r e g l o de los microtúbulos podría r e f l e j a r una anomalía subyacente en
las c a r a c t e r í s t i c a s e s t r u c t u r a l e s y bioquímicas de las membranas con l a s que
se asocian (17). El papel de los microtúbulos en l a morfogénesis de espermato
zoides anormales se ha evidenciado también con l a a p l i c a c i ó n de c o l c h i c i n a
-
( 34 ).
Las formas filamentosas observadas con microscopía de l u z ; podrían ori_
ginarse por las segmentaciones nucleares que se presentaron en espermátides -
.avanzadas. En éstos casos de nuevo se observa una estrecha r e l a c i ó n con l a presencia de microtúbulos de d i r e c c i ó n anormal,que parecen ser los causantes
de ésta malformación.
Las a l t e r a c i o n e s mínimas del gancho de los espermatozoides detectadas con el microscopio de l u z , corresponden u l t r a e s t r u c t u r a l m e n t e a malformaciones
en el acrosoma y en el polo a n t e r i o r del núcleo, que se ven en esparmátides por l o demás de aspecto normal. Otros cambios que al igual éstas a l t e r a c i o n e s
parecen ser independientes del patrón m i c r o t u b u l a r a l t e r a d o , son las vacuolas
acrosomales y nucleares y los defectos en l a implantación del f l a g e l o . Las - formas b i c é f a l a s y fenómenos de d u p l i c a c i ó n nuclear v i s t a s al microscopio
e l e c t r ó n i c o , podrían o r i g i n a r s e en f a l l a en la
citocinesis.
.Desde hace tiempo se ha sugerido que l a morfogénesis del
se encuentra
—
espermatozoide
bajo un e s t r i c t o c o n t r o l genético ( 4 8 , 6 5 ) . La complejidad del -
proceso de espermiogénesis y l a m u l t i p l i c i d a d de organelos involucrados suge^
r í a n que la forma del espermatozoide era controlada por v a r i o s genes d i f e r e n tes ( 98 ) . Estudios genéticos han i d e n t i f i c a d o cerca de 10 regiones génicas
que afectan l a morfología del espermatozoide, y están d i s t r i b u i d o s en los ero
mosomas X y Y, así como en l o s autosomas ( 8 , 1 7 , 3 8 , 4 0 , 4 8 ) . Estos genes represe»!
tan s i n duda un gran blanco para los agentes mutagénicos.
Los f a c t o r e s genéticos que controlan el n i v e l y t i p o de formas anormales de espermatozoides, tienen un patrón de herencia r e c e s i v a , aunque efectos
a d i t i v o s parecen e s t a r involucrados en la determinación del n i v e l de formas anormales ( 98 ) .
Las anomalías morfológicas inducidas por agentes químicos ó f í s i c o s sobre los espermatozoides pueden ser t r a n s m i t i d a s como una mutación genética do
minante que puede ó no a f e c t a r l a f e r t i l i d a d ó asociarse con aberraciones cro_
mosomales gruesas ( 1 0 , 9 5 ) . Sin embargo las a l t e r a c i o n e s en l a morfología del
espermatozoide no parecen estar ligadas a la i n t e g r i d a d de los cromosomas n i
al contenido de DNA (98).
Algunos autores han señalado que l a s mutaciones l e t a l e s dominantes pro
ducidas por el EMS, se presentan por daño al DNA en l a etapa de t r a n s i c i ó n de histonas a protaminas ( c i t a d o por Lyon 1981). Sega (1978) señala que el
-
EMS produce e t i l a c i ó n del DNA y de l a s protaminas ( 8 7 ) ; s i n embargo no parecen ser éstos los cambios que o r i g i n a n las a l t e r a c i o n e s morfológicas que conducen a espermatozoides anormales.
Se ha postulado que e r r o r e s en l a producción, m o d i f i c a c i ó n ó d e g r a d a ción de las proteínas nucleares, puedan conducir a a l t e r a c i o n e s en l a cabeza
del espermatozoide ( 1 0 , 9 0 ) .
Los resultados de ésta i n v e s t i g a c i ó n parecen i n d i c a r que siendo los cam
bios morfológicos evidentes en espermátides de los estadios 9 , 10 y estadios
poster-iores, el daño producido por el EMS, tendrá lugar en estadios p r e v i o s .
Dado que l a elevación producida en e l n i v e l de espermatozoides anormales ha sido mayor a las cuatro semanas, parece ser que las a l t e r a c i o n e s morfológicas
tendrían su o r i g e n en el daño ocasionado a n i v e l de espermatocitos
primarios
y espermatogonias d i f e r e n c i a d a s , independientemente de que e l daño sea ó no
de naturaleza g e n é t i c a .
En v i s t a de que los cambios u l t r a e s t r u c t u r a l e s en la espermiogénesis,
son muy semejantes a los reportados para mutaciones genéticas que causan est e r i l i d a d en r a t o n e s , las a l t e r a c i o n e s morfológicas producidas por e l EMS, podrían ser o r i g i n a d a s en el daño al DNA y no a las proteínas nucleares.
Al margen de todo ésto débanos considerar a q u í , que l a c é l u l a de S e r t o l i
posiblemente juegue un papel importante en l a génesis, de al menos, algunas de l a s a l t e r a c i o n e s observadas. Desde hace tiempo se reconoce l a
de l a c é l u l a de S e r t o l i en el porceso de espermiogénesis
La consistente
importancia
(25).
observación de l a r e l a c i ó n entre malformaciones acroso-
males y l a presencia de m a t e r i a l electrodenso f i l a m e n t o s o de aspecto r a d i a d o ,
en e l citoplasma v e c i n o , sugiere que t a l e s defectos acrosomales podrían ser -
consecuencia de a l t e r a c i o n e s producidas en l a c é l u l a de S e r t o l i .
VI.RESUMEN Y CONCLUSIONES.
Se a d m i n i s t r ó un agente mutagénico: E t i l m e t a n o s u l f o n a t o , a dosis de
200 mg/Kg de peso, a ratones de l a cepa (C57BL X C3H)F1, diariamente duran^
t e 5 dfas consecutivos, por v i a i n t r a p e r i t o n e a l ; a consecuencia de éste t r a
tamiento,se presentó en l o s ratones una elevación en el porcentaje de formas
anormales de espermatozoides que fué mayor a las 4 semanas del t r a t a m i e n t o (de 1.8 hasta 1 4 . 6 ) ; e n t r e éstas formas anormales de espermatozoides se encon
t r a r o n formas s i n gancho, espermatozoides amorfos, b i c é f a l o s y f i l a m e n t o s o s .
Este ú l t i m o t i p o de espermatozoide anormal no había sido reportado en l a
li-
t e r a t u r a a consecuencia de l a a d m i n i s t r a c i ó n de agentes químicos ó de r a d i a ciones i o n i z a n t e s .
Para indagar sobre l a forma de producción de éstas a l t e r a c i o n e s se h i zo un estudio morfológico con microscopía de luz y e l e c t r ó n i c a de los túbulos
seminíferos de los ratones t r a t a d o s con EMS.
El e s t u d i o con microscopía de luz demostró diversos grados de l e s i ó n
t u b u l a r , observándose mayor número de túbulos lesionados a las 4 semanas des^
pués del t r a t a m i e n t o . Se produjeron notables cambios en l a morfología del epi_
t e l i o s e m i n í f e r o ; la población c e l u l a r disminuyó considerablemente a c o n s e —
cuencia del e f e c t o c i t o t ó x i c o del EMS sobre todo a n i v e l de espermatocitos
y espermátides tempranos, que mostraron c a r i ó l i s i s y c i t ó l i s i s .
Se observó -
también una disminución d i s c r e t a sobre el número de espermatogonias y su í n dice m i t ó s i c o , l o cual r e f l e j a l a f a l t a de s í n t e s i s de DNA producida por el
agente mutagénico. Por el c o n t r a r i o , pocas a l t e r a c i o n e s se observaron
permátides avanzados ( l o c a l i z a c i ó n anormal) y en c é l u l a s de S e r t o l i
ción del c i t o p l a s m a ) y fueron consecutivas a l a desorganización del
s e m i n í f e r o , por l a f a l t a de o t r o s t i p o s
celulares.
en es_
(disrupepitelio
A n i v e l u l t r a e s t r u c t u r a l , los cambios que conducen a l a producción de
espermatozoides anormales, s i bien pudieran tener su origen en a l t e r a c i o n e s
genéticas tempranas, se m a n i f i e s t a n sólo tardíamente en la espermatogénesis
observándose en nuestro estudio solamente cambios en los espermátides de - los estadios 9 a 16.
Estos cambios en l a espermiogénesis implican una gran cantidad de est r u c t u r a s . Se observaron cambios nucleares r e f e r e n t e s a la condensación cro_
matfnica que fué mayor de lo normal en algunas formas de espermátides anormales. Otros cambios cromatínicos v i s t o s , fueron l a formación de agregados
densos e i r r e g u l a r e s en l a p e r i f e r i a , así como modificaciones en la forma del nucléo,
que con frecuencia se observó muy c o r t o y aplanado en su e x t r e
mo a n t e r i o r . Por l o general éstos defectos nucleares se presentaron acompañados de cambios del acrosoma, que en éstas formas permanecía cubriendo solamente el extremo a n t e r i o r del núcleo.
Sin embargo se observaron o t r o s defectos acrosomales independientes de
las a l t e r a c i o n e s nucleares y relacionadas en cambio con a l t e r a c i o n e s en el
citoplasma de la c é l u l a de S e r t o l i . Los defectos acrosomales más graves
(for
mas vacuoladas), parecen corresponder a f a l l a s en estadios tempranos del de
s a r r o l l o de éstas e s t r u c u t r a s .
Los defectos en l a elongación nuclear parecen ser los determinantes de l a producción de espermatozoides amorfos; la f a l t a de desplazamiento cau_
dal del a n i l l o nuclear podría ser uno de los mecanismos implicados en ésta
malformación.
Los microtúbulos del manchette, son importantes en la producción de espermátides sumamente l a r g o s ; el t r a y e c t o o b l i c u o en algunos casos, es res_
ponsable además de segmentación nuclear; éstos cambios fueron v i s t o s en espermátides del estadio 13 y son seguramente antecesores de l a s formas
-
fila-
mentosas de espermatozoides.
Las formas de espermatozoides con defectos mínimos, observados con mi
eroscopía de l u z , corresponden a espermátides con a l t e r a c i o n e s leves, sobre
todo defectos en l a formación del gancho y modelación del acrosoma ó defectos leves en l a forma del núcleo.
finalmente observamos espermátides con dos núcleos que presentaron di_
versos grados de f u s i ó n ó separación. Generalmente éstos fenómenos de duplx
cación nuclear se acompañaron de a l t e r a c i o n e s en el d e s a r r o l l o de o t r a s estructuras.
Se cuestiona sobre el papel de l a c é l u l a de S e r t o l i en la producción
de defectos acrosomales en los que se v i ó constantemente l a asociación ent r e el m a t e r i a l acrosoma! y m a t e r i a l electrodenso de aspecto anormal de l a
c é l u l a de Sertol i .
V I I . PERSPECTIVAS.
A pesar de que en la presente i n v e s t i g a c i ó n no se hayan detectado, es
p o s i b l e que los cambios morfológicos que culminan con l a producción de esper^
matozoides de forma a n o r m a l
se i n i c i e n tempranamente en l a espermiogénesis
y sean evidentes aún en fase de G o l g i . Un e s t u d i o u l t r a e s t r u c t u r a l de los túbulos seminíferos dos semanas después del tratamiento con EMb, pudiera per
m i t i r l a detección de dichas a l t e r a c i o n e s .
De acuerdo con los resultados de éste estudio y con o t r o s reportes
(42,
6 2 ) , los microtubulos constituyen un f a c t o r muy importante en l a producción
de a l t e r a c i o n e s en l a espermiogénesis. Un estudio más minucioso con métodos
que permiten una observación mas d e t a l l a d a de l o s m i c r o t u b u l o s , en espermát i d e s expuestos al EMS, podría proporcionar mayor información sobre l a
mación, número,
for-
d i r e c c i ó n y d i s t r i b u c i ó n de éstas e s t r u c t u r a s .
El modelo experimental u t i l i z a d o podría s e r v i r también para e s t u a i o s u l t r a e s t r u c t u r a l e s enfocados al a n á l i s i s de l a evolución de las a l t e r a c i o n e s
acrosomales, de l a envoltura nuclear
ó de la heterocromatina señaladas en
éste estudio como elementos que i n t e r v i e n e n en l a producción ae espermatozoi_
des anormales morfológicamente. Un estudio del comportamiento del
retículo
endoplásmico, recientemente señalado como uno de los elementos responsables
de la d i f e r e n c i a c i ó n s i n c r ó n i c a en éstas células ( 1 3 ) , podría i n d i c a r su pa
peí en l a producción de espermatozoides anormales, producidos por el tMS.
Igualmente el estudio con microscopía e l e c t r ó n i c a enfocado a l a c é l u l a
de S e r t o l i , sobre todo en lo r e f e r e n t e al c i t o e s q u e l e t o , p e r m i t i r í a
estable
cer su importancia en la inducción de espermatozoides de forma anormal.
Los mecanismos implicados en l a producción de espermatozoides anormal e s , por d i f e r e n t e s t i p o s de drogas podrían ser semejantes ó d i f e r e n t e s ent r e s í . Un estudio morfológico comparativo, con microscopía de "luz y e l e c t r ó n i c a de túbulos seminíferos de ratones tratados con d i s t i n t o s agentes quí
micos, reportados como inductores de espermatozoides anormales
(92,95,103),
podría proporcionar información sobre éstos mecanismos.
En e l campo de l a a p l i c a c i ó n c l í n i c a , los hallazgos de nuestra investi_
gación, podrían s e r v i r como punto de comparación en el estudio con microsco
pía e l e c t r ó n i c a de biopsias t e s t i c u l a r e s en:
a) Pacientes sometidos a t r a t a m i e n t o con drogas o n c o l í t i c a s ó fármacos en los que se sospecha l a inducción de daño en las c é l u l a s espermatogénicas, so
bre todo en i n d i v i d u o s en edad reproductora.
b) Personas expuestas a agentes contaminantes del ambiente ó del lugar de —
t r a b a j o ( 5 0 , 5 1 , 8 4 , 9 1 ) , en los que la potencia
genotóxica
de tales
agentes po
d r í a ser e s t a b l e c i d a por éste t i p o de e s t u d i o s .
c) Pacientes con i n f e r t i l i d a d (21) ó bien en:
d) La i n v e s t i g a c i ó n del f a c t o r masculino en l o s casos de aborto h a b i t u a l
--
( 3 9 ) . En éstos dos ú l t i m o s casos, las a l t e r a c i o n e s u l t r a e s t r u c t u r a l e s en la
espermiogénesis, podrían ser f a c t o r e s determinantes de t a l e s problemas, y semejantes a los producidos por agentes mutagénicos en o t r o s mamíferos.
B I B L I O G R A F I A .
1.-
A d l e r , I . D . (1974). Comparative cytogenetic study a f t e r treatment of
mouse spermatogonia w i t h Mitomycin C.
Mut. Res. 23:369-379
2.-
Ames, B . N . ; W.E. Durston; E. Yamasaki y F.D. Lee (1973). Carcinogens
are mutagens: A simple t e s t system combining l i v e r homogenates f o r a c t i v a t i o n and b a c t e r i a f o r d e t e c t i o n .
Proc. N a t l . Acad. S c i . U.S.A. 70:2281-2285
3.-
Ashby, J . y I . F . A . Purchase (1977). The s e l e c t i o n of a p r o p i a t t e chemj_
cal class c o n t r o l s f o r use w i t h s h o r t - t e r m t e s t s f o r p o t e n t i a l c a r c i nogenicity.
Ann. Occup. Hyg. 20:297-301
4.-
B e l l v é , A.R.; J.C. Cavicchia; C.F. M i l e t t e , D.A. O ' B r i e n ; Y.M. Bhat
nagar y M. Dym. (1977). Spermatogenic C e l l s of the prepuberal mouse.
Isolation.
I n t . J . of Cell B i o l . 74:68-85
5.-
.Bloom, W. y D. Fawcett (1978). Tratado de H i s t o l o g í a . 7a. Ed.
Ed. Labor.
6.-
Bratmanska, J . y Y. Clermont (1983). Renewal of type A Spermatogonia
in adult rats.
C e l l . Tissue K i n e t . 16:135-143
7.-
Bruce, W.R. y M . L . M e i s t r i c h (1972). Spermatogenesis i n the mouse.
Proc. l e s t . I n t e r n a t . Conf. on c e l l d i f f e r e n t i a t i o n . Copenhagen
Munksgaard: 295-299
8.-
Bruce, W.R.; R. Furrer y A . J . Wyrobeck (1974). Abnormalities i n the
shape of murine sperm a f t e r acute t e s t i c u l a r y i r r a d i a t i o n .
Mut. Res. 385-386
9.-
Bruce, W.R. y Heddle (1979). The mutagenic a c t i v i t y of 61 agents as
determined by the micronucleus, Salmonella and sperm abnormality —
assays.
Can. J. Genet. C y t o l . 21:319-333
10.-
B r u s i c k , D.J. (1978). A l t e r a t i o n s of germ c e l l s leading to mutagenes i s and t h e i r d e t e c t i o n .
Envirom. Health Persp. 24:105-112
11.-
Cassidy, S . L . ; K.M. D i x ; T. Jenkins (1983). Evaluation of a t e s t i c u l a r sperm head counting technique using r a t s exposed t o dimethoxye-t h y l phthalate (DMEP), g l y c e r o l Alfa-monochlorohydrin (GMCH), Epichlo
ro hydrin (ECH), Formaldehyde (CFA), or methyl methanesulphonate (MMS).
Arch. T o x i c o l . 53:71-78
-12.
Clermont, Y. y M. T r o t t (1969). Duration of the c y c l e of the seminiferous e p i t h e l i u m i n the mouse and hamster determined by means o f 3
H- thymidine and radioautography.
F e r t and S t e r i l . 20:805-817
13.
Clermont, Y. y A. Rambourg (1978). E v o l u t i o n of the Endoplasmic R e t i c u l u m during r a t Spermiogenesis. The Am. J . of Anat. 151:191-211
14.
Cooper, J . A . ; R. Saracci and P. Cole (1979). Describing the v a l i d i t y
of carcinogen screeening t e s t s .
Br. J. Cancer 39:87-89
15,
C h a l l i c e , C. 1953. E l e c t r o n microscopic s t u d i e s of spermiogenesis.
J . Roy. Micros. Soc. 73:115-127
16.
Dixon, R.L. y I . P . Lee (1973). Possible r o l e of the blood t e s t i c u l a r
b a r r i e r i n dominant l e t h a l t e s t i n g .
Evirom. Health t e s t i n g . 59-63
17,
Dooher, G . B . ; y D. Bennett (1974). Abnormal m i c r o t u b u l a r systems i n
mouse spermatides associated w i t h a mutant gene and the T - l o c u s .
J . Embryo!. Exp. Morph. 32:749-761
18
Dooher, G.B.; y D. Bennett (1977). Spermiogenesis and spermotozoa i n
s t e r i l e mice c a r r y i n g d i f f e r e n t l e t h a l T / t locus haplotypes: A trans
mission and scanning e l e c t r o n microscopic study.
B i o l , of Reproduc. 17:269-288
19
Dunn, G.R. y H . I . Kohn (1981). Some comaprisons betwen induced and
spontaneus mutation rates in mouse sperms and spermatogonia.
Mut. Res. 80:159-164
20
Dym, M. (1973). The f i n e s t r u c t u r e of the monkey (Macaca) S e r t o l i - c e l l s and i t s r o l e in mantaining the b l o o d - t e s t i s b a r r i e r . Anat. Rec
175:639-656
21
E s c a l i e r , D. (1983). Human spermatozoa w i t h l a r g e heads and m u l t i p l e
f l a g e l l a : A q u a n t i t a t i v e u l t r a s t r u c t u r a l study of 6 cases.
B i o l . C e l l . 48:65-74
22
F l a k , H.L. (1981). E x t r a p o l a t i n g carcinogenesis data from animals to
humans. Fed. Proc.
39:76-79
23
Farber, E. (1981). Chemical carcinogenesis. New. Engl,
1379-1389
24
Fawcett, D . ; D. Slautterback y S. I t o (1959). The occurrance of i n t e r c e l u l a r bridges in groups of c e l l s e x h i b i t i n g synchronous d i f f e r e n t i a t i o n . J . B i o p h i s . Biochem C y t o l .
5:453-460
25
Fawcett, D.W.; W.A. Anderson; y D.M. P h i l l i p s (1971). Morphogenetic
f a c t o r s , i n f l u e n c i n g the shape of the sperm head. Dev. B i o l . 26:220251
26
F i c s o r , G.; y L.C. Ginsberg (1980). The e f f e c t of hydroxyures and - mitomycin C on sperm m o t i l i t y i n mice. Mut. Res. 70:383-387
of Med. 305:
27.-
F i c s o r , G.: N.M. Salama; K.K. Block; C.L. M c l n t i r e ; y L.C. Ginsberg (1982). Germ c e l l - s p e c i f i c decrease o f acrosomal proteolytic
activity
sperm m o t i l i t y and number i n mitomycin C t r e a t e d mice.
Teratog. Carcinogen, and Mutag. 2:13-18
28.-
F l i k i n g e r , C., y Fawcett, D.W. ( r 9 6 7 ) . The J u n c t i o n a l
of S e r t o l l i c e l l s i n the seminiferous e p i t h e l i u m .
Anat. Ree. 158:207-222
29.-
Gardner, P.J. y E.A. Holyoke (1964). Fine s t r u c t u r e of the s e m i n i f e rous t u b u l e of the Swiss mouse. I . The l i m i t i n g membrane, S e r t o l l i - c e l l , spermatogonia and spermatocytes.
Anat. Ree. 150:391-404
30.-
Gardner, P.J. (1966). Fine s t r u c t u r e of the seminiferous t u b u l e of the
swiss mouse. The spermatid. Anat. Ree. 155:235-250
31.-
G u i l l i a v o d , N. y A. Leonard (1971). Test f o r mutagenic e f f e c t s of chemicals i n mice. I . E f f e c t s o f mitomycin C on spermatogonia.
Mot. Res. 13:274-275
32.-
GiTula, N.B.; D.W. Fawcett y A. Aoki (1976). The S e r t o l i c e l l oclu—
ding j u n c t i o n s and Gap Junctions i n mature an developing, mammalian t e s t i s . Dev. Biol.
50:142-168
33.-
G u i l l i e s , P.J. y Ki P. Lee (1983). E f f e c t s of Hexafluoroacetone on —
T e s t i c u l a r Morphology and L i p i d Metabolism in the Rat.
T o x i c o l , and Appl. Pharmacol. 68:188-197
34.-
Handel, M.A. (1979). E f f e c t s of c o l c h i c i n e on spermiogenesis i n the
mouse. J . Embryol. exp. Morph. 51:73-83
35.-
Hayat, M.A. (1972). Basic e l e c t r o n microscopic techniques. Van Nostrand
Reinhold Co.
36.-
Huckins, C. (1971). The spermatogonial stem c e l l p i p u l a t i o n i n a d u l t
r a t s . I . Their morphology, p r o l i f e r a t i o n and m a t u r a t i o n .
Anat. Ree. 169:533-558
37.-
Hugenholtz, A.P. y W.R. Bruce (1983). Radiation i n d u c t i o n of
a f f e c t i n g sperm morphology in mice. Mut. Res. 107:177-185
38.-
Hunt, D.M.; and D.R. Johnson (1971). Abnormal spermiogenesis i n two - pink-eyed s t e r i l e mutants i n the mouse.
J . Embryol. Exp. Morph. 26:11-121
39.-
J o e l , C.A. (1966). New e t i o l o g i c aspects of habitual a b o r t i o n and
f e r t i l i t y , w i t h special r e f f e r e n c e to the male f a c t o r .
Fent. and S t e r i l 17:373-380
40.-
Johnson, D.R. y D.M. Hunt (1971). H o p - s t e r i l e , a mutant gene a f f e c t i n g
sperm t a i l development i n the mouse.
J. Embryol. Exp. Morph, 25:223-236
41.—
Kaye, J . (1958). Changes on the f i n e s t r u c t u r e of mitocondria during
spermatogenesis. J. Morph. 102:347-400
specializations
mutations
in-
42.-
Kessel, R.G. (1966). The a s s o c i a t i o n between microtubules and n u c l e i
d u r i n g spermiogenesis i n the d r a g o n f l y .
J. Ultrastructural
Res.
16:293-304
43.-
Kessel, R.G. and Spaziani E. (1969). Nuclear morphogenesis i n r a t
spermatids. J . Cell B i o . , ( A b s t r . 160) 67a.
44.-
Kierzenbaum, A . L . ; y L . L . Tres (1975). S t r u c t u r a l and T r a n s c r i p t i o n a l
f e a t u r e s of the mouse spermatid genome. J . o f C e l l . B i o l . 65:258-270
45.-
K i l b e y , B . J . ; M. L e g a t o r ; N. Nichols and C. Ramel (1977). Handbook o f
m u t a g e n i c i t y t e s t procedures. E l s i v e r , Sc. Pub. Co.
46.-
Komatsu, H.; T. Kakizoc; T. N i i j i m a ; T. Kawachi y T. Sugimura (1982).
Increases sperm abnormal i t i e s due to d i e t a r y r e s t r i c t i o n .
Mut. Res. 93:439-446
47.-
Krazanowska, H. (1969). Factors r e s p o n s i b l e f o r spermatozoan abnormal i t y located on the V chromosome in mice. Genet. Res. 13:17-24
48.-
Krazanowska, H. (1976). I n h e r i t a n c e o f sperm head abnormality types i n mice- the r o l e of the Y chromosome. Genet. Res. Camb. 28:189-198
49.-
Lahdetie, J . (1983). Micronuclei induced during meiosis by ethylmetha
n e s u l f o n a t e , cyclophosphamide and dimethyibenzanthracene i n male r a t s .
Mut. Res. 120:257-260
50.-
Lancranjan, I . ; H . I . Popescu; 0. Gavanescu; I . Klepsch; M. Sarbanescu
(1975). Reproductive a b i l i t y of workmen o c c u p a t i o n a l l y exposed t o lead.
Arch. Environ Health 30:396-401
51.-
Land, P.C.; E.L. Owen; and H.W. Linde (1979). Mouse sperm morphology f o l l o w i n g exposure to anesthetics during e a r l y spermatogenesis.
Anesthesiology 51:42
i
Langman, J . (1981). Embriología Médica. 4a. Ed. Panamericana; Buenos
A i r e s , Argentina.
52.-
-
53.-
Leonard, A. y N. G u i l l i a v o d (1973). T e s t i c u l a r changes i n mice a f t e r treatment w i t h Mitomycin C. T o x i c o l .
1:217-223
54.-
Lu, Ch. C. y M.L. M e s i t r i c h (1979). C y t o t o x i c e f f e c t s of chemotherapeu^
t i c drugs on mouse t e s t i s c e l l s . Ca. Res. 39 (9) :3575-3582
55.-
L u f t s , J.H. (1961). Improvements i n epoxy r e s i n embedding methods.
J . Biophys. and Biochem. Cytol. 9:409-
56.-
Luna, L.G. ( I 9 6 0 ) . Manual of h i s t o l o g i c s t a i n i n g methods, of the Armed
Forces. I n s t , of Pathology. Third Ed. Mc. Graw H i l l Book Co.
57.-
Lyon, F.M. (1981). S e n s i t i v i t y of various germ-cell stages to e n v i r o mental mutagens. Mut. Res. 87:323-345
58.«
Mancini,
(1968): El t e s t í c u l o humano. Bases h i s t o f i s i o l ó g i c a s
de la función t e s t i c u l a r . Simposio organizado para e l fomento de los
estudios endocrinológicos y metabólicos de Rosario.
Ed. Med, Panamericana, Buenos Aires pp 11-45
59.-
Maramatsu, S. (1974). Frequency of spontaneous t r a n s l o c a t i o n s i n mouse
spermatogonia. Mut. Res. 24:81-82
60.-
Márquez-Orozco, M.C.; A. Márquez-Orozco; A. Samano. Bishop; M. Lorenzana-Jiménez y R. Rodríguez-Carranza (1983). H i s t o l o g i c a l and u l t r a s t r u c t u r a l a l t e r a t i o n s of the t e s t i s of r a t induced by chronic i n h a l a t i o n of
p a i n t t h i n n e r . Proc. West. Pharmacol. Soc. 26:81-82
61.-
Mayer, F . F . ; y B.R. Z i r k i n (1979). Spermatogenesis i n the mouse. I .
Autoradiographic studies of nuclear i n c o r p o r a t i o n and loss o f 3H-aminoa c i d s . J . of C e l l . B i o l . 81:403-410
62.-
Me. I n t o s h , J.R. y K.Porter (1967). Microtubules in the spermatids o f
the domestic f o w l . J . of C e l l . B i o l . 35:153-173
63.-
M e i s t r i c h , M.L.; M. Finch; M.F. da Cunha; V. Hacker, W.W. Au.
(1982).
Damaging e f f e c t s of fourteen chemotherapeutic drugs on mouse t e s t i s .
Ca. Res. 42:122-131
64.-
Monesi, V. (1962). Autoradiographic study of DNA synthesis and the c e l l
c y c l e in spermatogonia and spermatocytes of mouse t e s t i s ; using t i t i a t e d
thymidine. J . C e l l . B i o l . 14:1-19
65.-
Monesi, V. (1965). Synthetic a c t i v i t i e s during spermatogenesis i n the
mouse: RNA and p r o t e i n s synthesis. Exp. Cell Res. 39:197-224
66.-
Montagna, W. 1967. Anatomía Comparada. 2da. Ed. E d i t o r i a l Omega, S.A.
Barcelona, España
67.-
Nagano, T. y F. Zuzuki (1976). The postnatal development of the j u n t i o n a l
complexes of the mouse S e r t o l i i c e l l s as revealed by freeze f r a c t u r e .
Anat. Rec. 185:403-418
68.-
Oakberg, E.F. (1956). A d e s c r i p t i o n of spermatogenesis i n the mouse and
i t s use i n a n a l y s i s of the cycle of the seminiferous e p i t h e l i u m and germ
c e l l renewal. Am J. Anat. 99:391-413
69.-
Oakberg, E.F. (1957). Durations of spermatogenesis i n the mouse.
Nature. 180:1137-1138
70.-
Oakberg, E.F. (1971). Spermatogonial stem c e l l renewal i n the mouse. Anat.
Rec. 169:515-532
71.-
Oakberg, E . F . , C.D. Croshwalt y G.D. Rayner (1982). Spermatogenic Stage
S e n s i t i v i t y to 6-mercaptopurine i n the mouse. Mut. Res. 94:165-178
72.-
Oakberg, E.F. y C.D. Crosthwalt (1983). The e f e c t o f e t h y l , methyl and
h i d r o x y e t h y l - n i t r o s o urea on the mouse t e s t i s . Mut. Res. 108:337-344.
73.-
Okumara, K; I . P . Lee and R.L. Dixon (1975). Permeability of selected drugs
and chemicals across the b l o o d - t e s t i s b a r r i e r of the r a t . J . Pharm. and
E x p l t o l . Tox. 194:89-94
74.r
P a c c h i e r o t t i , F . ; D. Bellicampi arid D. C i v i t a r e a l e (1983). Cytogenetic
observations-, i n mouse secondary spermatocytes, on numerical and s t r u c t u r a l chromosome a b e r r a t i o n s induced by cyclophosphamide i n various
stages o f spermatogenesis. Mut. Res. 119:177-183
75.-
Parvinen, L.M. (1979a). Early e f f e c t s of Procarbazine ( N - i s o p r o p y l - L - )
(z-methylhidrazine)-p-Tpluamide h i d r o c l o r h i d e ) on r a t Spermatogenesis.
Exp. Mol. Pathol. 30 ( 1 ) : 1 - 1 1
76.-
Parvinen, M. y L.M. Parvinen (1979b) A c t i v e movements of the chromatoid
body. A. Possible t r a n s p o r t mechanism f o r haploid gene products. J . o f
C e l l . B i o l . 80:621-628
77.-
P h i l i p s , D.M. (1972). Substructure of the mammalian acrosome. J.
U l t r a s t r . Res. 38:591-604
78.-
Purchase, I . F . H . ; J . Ashby (1977). Short term t e s t s f o r
Ann. o f Ocup. Hyg. 20:234.
79.-
Rathenberg, R.y D. M u l l e r (1972). Comparative cytogenetic studies of the
i n f l u e n c e o f Phenylbutazone and cyclophosphamide on spermatogenesis i n
the mouse. Agents and a c t i o n s . 2:180-185
80.-
Rathner, J.B. y B.R. B r i n k l e y (1972). U 1 t r a s t r u c t u r e and morphogenesis
of the manchette d u r i n g rodent spermiogenesis. S. U l t r a s t r . Res.
41:209-218
81.-
Redi, C . A . ; S. Garagna; C. P e l l i c c i a r i (1982). Cytochemical assessment
of chromatin c h a r a c t e r i s t i e s during sperm c y t o - d i f f e r e n t i a t i o n in mouse.
Bass. Appl. Histochem, 26, 279-288
82.-
R o b e r t i s , E. De, y De Robertis ( h ) . (1981). Fundamentos de Biología Celu
l a r .y molecular. Primera Edición. E d i t o r i a l El Ateneo.
83.-
Robbins, S.L. y R.S. Cotran (1980). Patología E s t r u c t u r a l y Funcional.
2da. Ed. Nueva Ed. Interamericana
84.-
S a n d i f e r , S.H.; R.T. W i l k i n s ; C.B. Loadholt, L.G. Lane; and J.C. E l d r i d ge (1979). Spermatogenesis in A g r i c u l t u r a l Workers Exposed to Dibromochiloropropane (DBCP). B u l l . Envirom Contam. T o x i c o l . 23:703-710
85.-
S a r a f i s , V . , R.W. Lambert and W.G. Breed (1981). Sperm head of the p l a i n s
mouse Pseooomys a u s t r a l i s . J. Reprod. F e r t . 61:399-401
86.-
Sawada, T. (1957). An e l e c t r o n microscopic study of spermatid d i f f e r e n t i a t i o n in the mouse; Okajimas Fol. Anat. J a p . , 30:73-80.
87.-
Sega, G.A.; M.R. K e l l y ; J.C. Owens y V.C. C a r r i c a r t e (1983). Caffeine
pretreatmentenhances the unscheduled DNA Syntesis in Spermatids of mice
exposed to methylmethane s u l f o n a t e . Mult. Res. 108 (1983), 345-358
carcinogenecity
88.-
Sharma, R . K . ; G.T. Roberts; F.M. Johnson y H.V. M a i l i n g (1979). Transl o c a t i o n and sperm abnormality asays in mouse spermatogonia t r e a t e d w i t h Procarbazine. Mut. Res. 67:385-388
89.-
Shindo, Y . ; F. Hirano; H. Maeda y V. Takeda (1983). The micronucleus
t e s t w i t h mouse sperm spleen c e l l s . Mut. Res. 121:53-57
90.-
Soares, E.R.; W. Sheridan; J.K. Haseman y M. Segal! (1979). Increased
frequencies of aberrant sperm as i n d i c a t o r s of mutagenic i n mice. Mut.
Res. 64:27-35
91.-
S t e i n b e r g e r , E. (1981). Current s t a t u s of s t u d i e s concerned w i t h eval u a t i o n of t o x i c e f f e c t s of chemicals on the t e s t e s . Envirom Health Persp. 38:29-33
92.-
S t e r n s , L . ; K.C. Kleene; B. Gold y N.B. Hecht (1983). Gene expression
during mammalian spermatogenesis. I I I . Changes in populations of mRNA
during spermiogenesis. Exp. C e l l . Res. 143:247-255
93.-
S t r e i s i n g e r , G. (1983). E x t r a p o l a t i o n s from species to species and from
various c e l l types i n assessing r i s k s from chemical mutagens. Mut. Res.
114:93-105
94.-
Takao, I . (1982). The c o n t i n u i t y of Ebdoplasmis Reticulum i n r a t spermatides observed by Scanning Electron Microscopy. J . Electron Microsc.
31:261-263
95.-
Topham, J.C. (1980). Chemically-induced t r a n s m i s s i b l e a b n o r m a l i t i e s
sperm-head shope. Mut. Res. 70:109-114
96.-
Whorton, D.; R.M. Krauss; S. M a r s h a l l , T.H. Milby (1977).
i n male p e s t i c i d e workers. The Lancet, 17:1259-1261
97.-
Wyrobeck, A.J. and Bruce, A . J . (1975). Chemical Induction of Sperm - a s n o r m a l i t i e s in mice. Proc. N a t l . Acad. S c i . U.S.A. 72:4425-
98.-
Wyrobeck, A.J. (1979). Changes i n mammalian sperm morphology a f t e r Xray and chemical exposures. Genetics.
92:105-119
99.-
Wyrobeck, A . J . ; G. Watchmaker; L. Gordon; K. Wong; D. Moore I I ; and D. Whorton (1981). Sperm shape a b n o r m a l i t i e s in Carbaryl Exposed emplo
yees. Environmental Health Perspectives 40:255-265
in
Infertility
100.- Zamboni, L . ; R. Zemjanis y M. S t e f a n i n i (1971a). The f i n e s t r u c t u r e of
monkey and human spermatozoa. Anat. Res. 169:129-154
101.- Zamboni, L . ; and M. S t e f a n i n i (1971b). The f i n e s t r u c t u r e of the neck
o f mairmalian spermatozoa. Anat. Res. 169:155-172
102.- Zeeland, A.A. Van; G.R. Mohn; C.S. Aaron; B.W. Glickman; M. Brendel;
F . J . Serres; C.Y. Hong y H.E. Brockman (1983). Molecular dosimetry of
the chemical mutagen ethylmethanesulfonate. Mut. Res. 119:45-54
103,- Zdzienicka, M.; M. Hryniewicz y M. Pienkowska (1982). Thiram induced
sperm head a b n o r m a l i t i e s in mice. Mut. Res. 102 (1982). 261-264