RIGHT CHOICE HbsAg - Diagnóstica Internacional
Anuncio

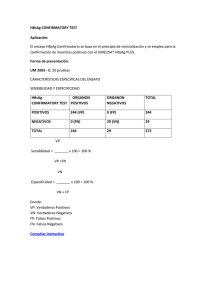
RIGHT CHOICE HbsAg Cat.ORG-BRRI2059 VER 1 Prueba Inmunocromatográfica para la Detección Cualitativa línea coloreada. La presencia de esta línea coloreada indica un re- de Antígeno de Superficie de Hepatitis B (HBsAg) sultado positivo, mientras que su ausencia indica un resultado nega- en suero o plasma. tivo. Como procedimiento de control, una línea coloreada siempre aparecerá en la región de la línea control indicando que el volumen Solo para diagnóstico In Vitro Para uso exclusivo en laboratorios clínicos y de gabinete apropiado de muestra ha sido adicionado y que la migración por la ventana ha ocurrido. Conservar entre 2°C a 30°C REACTIVOS USO PREVISTO La prueba contiene partículas anti-HBsAg y anti-HBsAg recubierto Right Choice HbsAg es una prueba inmunocromatográfica rápida sobre la membrana. para la detección cualitativa de Antígeno de Superficie de hepatitis B en suero o plasma. PRECAUCIONES Para diagnóstico profesional in Vitro únicamente. No usar después RESUMEN de la fecha de expiración. La hepatitis viral es una enfermedad sistémica que involucra princi- No comer, beber o fumar en el área donde las muestras o los kits son palmente el hígado. En la mayoría de los casos las hepatitis virales manipulados. agudas son causadas por el virus de la Hepatitis A, virus de Hepatitis Maneje todas las muestras como agentes potencialmente infeccioso. B (HBV) o el virus de la Hepatitis C. El complejo de antígeno encon- Atienda las precauciones establecidas contra peligros microbiológi- trado en la superficie del VHB es llamado HBsAg. La designación cos comendado que la muestra sea re-examinada. anterior incluía el antígeno Australia o antígeno Au.1 La presencia de En la realización de las pruebas y siga los procedimientos estándar HBsAg en suero o plasma es un indicativo de una infección por Hepa- para disposición adecuada de muestras. titis B activa, cualquiera de las dos aguda o crónica. En una infección Use ropa protectora tal como bata de laboratorio, guantes desech- típica de Hepatitis B, el HBsAg se detectará de 2 a 4 semanas antes ables y protección para los ojos cuando se prueben las muestras. de que los niveles de ALT comiencen a ser anormales y de la 3 a la 5 La humedad y la temperatura pueden afectar los resultados. semana antes de los síntomas o el desarrollo de la ictericia. El HBsAg tiene 4 subtipos principales: adw, ayw, adr y ayr. Debido a ALMACENAMIENTO Y ESTABILIDAD la heterogeneidad antigénica, hay 10 subtipos principales del virus El kit puede ser almacenado a temperatura ambiente o refrigerado. de la Hepatitis B. (2-30°C). La prueba en device es estable hasta la fecha de expi- La prueba HBs Ag Ultra Plasma/Serum Device es una prueba rápida ración impresa en el empaque sellado. La prueba en device debe para la detección cualitativa de la presencia de HBs Ag en muestras permanecer en su empaque sellado hasta su uso. NO CONGELAR. de suero o plasma. La prueba utiliza una combinación de anticuerpos No usar pasada la fecha de expiración. monoclonales y policlonales para la detección selectiva de niveles elevados de HBsAg en suero o plasma. RECOLECCION Y PREPARACIÓN DE LA MUESTRA 1. La prueba Right Choice HBsAg puede ser realizada en suero o PRINCIPIO plasma. El device HBsAg Ultra Plasma/Serum es un dispositivo para inmu- 2. Separar el suero o plasma de la sangre tan pronto como sea noensayo cualitativo, de fase sólida, de dos sitios tipo sándwich para posible para evitar la hemólisis. Únicamente deben ser usadas la detección de HBsAg en suero o plasma. La membrana es recubi- muestras claras no hemolizadas. erta con anticuerpos anti-HBsAg en la región de línea de prueba. Du- 3. El muestreo debe ser realizado inmediatamente después de que rante la prueba, las muestras de suero o plasma reaccionan con las la muestra ha sido tomada. No dejar la muestra a temperatura partículas cubiertas con anticuerpos anti-HBsAg. La mezcla migra a ambiente por períodos prolongados. Las muestras deben ser al- través de la membrana cromatográfica por acción capilar para reaccionar con anticuerpos anti-HBsAg en la membrana y genera una macenadas de 2-8°C por 3 días. 4. Para períodos prolongados de almacenamiento, las muestras DISTRIBUIDO POR: DIAGNÓSTICA INTERNACIONAL S.A. de C.V. www.diagnosticainternacional.com Lada sin costo: 01 800 440 0404 c/ 10 líneas 01 800 024 2352 / 024 6320 / 024 0406 Tel: 01 (33) 3770 1940 c/ 10 líneas 1 deben ser almacenadas por debajo de -20°C. 5. Deje las muestras a temperatura ambiente antes de realizar la prueba. Las muestras congeladas deben estar completamente descongeladas y muy bien mezcladas antes de ser probadas. Las muestras no deben ser congeladas y descongeladas repetidamente. 6. Si las muestras son transportadas, estas deben ser empacadas de conformidad con las regulaciones locales, estatales o federales para el transporte de agentes etiológicos MATERIALES INCLUIDOS EN EL KIT CONTROL DE CALIDAD • 20 casetes individualmente sellados Un control de procedimiento es incluido en la prueba. La aparición de una • Pipeta desechable para la muestra línea roja en la región de control (C) es el control de procedimiento interno. • Instructivo de uso Esto confirma un volumen suficiente de muestra y un procedimiento correcto de la técnica. MATERIALES REQUERIDOS PERO NO INCLUIDOS EN EL KIT Los controles estándar no se suministran con este kit; sin embargo, es re- • Tubos recolectores de muestra comendado que un control positivo (que contenga 10 ng/mL HBsAg) y un • Centrifuga (para plasma únicamente) control negativo (que contenga 0 ng/mL HBsAg) sea probado como bue- • Cronómetro nas prácticas de laboratorio para confirmar el procedimiento de la prueba y para verificar el adecuado desempeño de la prueba. INSTRUCCIONES DE USO Dejar las pruebas en casete, muestras de suero o plasma, y/o controles LIMITACIÓN para equilibrarlos, a temperatura ambiente (15-30°C) antes de la prueba. El HBs Ag Ultra Plasma/Serum Device es para uso diagnóstico in vitro Deje el empaque a temperatura ambiente antes de abrirlo. Re-mueva únicamente. Esta prueba debe ser usada para la detección de Antígeno casete del empaque sellado y úselo lo más pronto posible. Los mejores de Superficie de Hepatitis B en muestras de suero o plasma. Ningún valor resultados se obtienen si el ensayo es realizado dentro de una hora. 15 cuantitativo o porcentaje de concentración de HBsAg puede ser determi- minutos. Es importante que el fondo esté claro antes de que el resultado nado por este test cualitativo. sea leído. Nota: Una baja concentración de HBsAg puede resultar con El HBs Ag Ultra Plasma/Serum Device indicará solamente la presencia de la aparición de una línea tenue en la región de test (T) después de un Antígeno de Superficie de Hepatitis B en la muestra y no debe ser usado período extendido de tiempo; sin embargo, no interprete los resultados como criterio único para el diagnóstico de infección viral de Hepatitis B. después de 20 minutos. Como con todas las pruebas diagnósticas, todos los resultados deben considerarse con otra información clínica disponible por el médico. INTERPRETACION DE RESULTADOS El HBs Ag Ultra Plasma/Serum Device no puede detectar concentracio- (Por favor referirse a la ilustración de arriba) nes bajas extremas de HBsAg en muestras. Si el resultado de la prueba Positivo: Aparición de dos líneas rojas. Una línea debe estar en la región es negativo y los síntomas clínicos persisten, adicionalmente se sugiere de control (C) y otra línea debe estar en la región de test (T). *Nota: La usar otros métodos clínicos. Un resultado negativo a cualquier tiempo no intensidad del color rojo en la región de test (T) dependerá de la concen- excluye la posibilidad de infección de Hepatitis B. tración de HBsAg presente en la muestra. Sin embargo, cualquier matiz rojo en la región de test (T) debe ser considerado positivo. VALORES ESPERADOS El HBs Ag Ultra Plasma/Serum Device ha sido comparado con una im- Negativo: Una línea roja aparece en la región de control (C). No aparece portante prueba comercial de HBsAg EIA. La correlación entre estos dos línea roja o rosada en la región de test (T). sistemas está por encima de 99%. Invalido: La línea de Control no aparece. Insuficiente volumen de muestra CARACTERISTICAS DE DESEMPEÑO o incorrecto procedimiento de la técnica son las principales razones para Sensibilidad que la línea de control falle. Revise el procedimiento y repita la prueba con El HBs Ag Ultra Plasma/Serum Device fue probado contra un panel de un nuevo casete de prueba. Si el problema persiste, descontinúe el uso de sensibilidad incluyendo ambos subtipos ad y ay con rangos de concen- la prueba inmediatamente y contacte su distribuidor local. traciones de 0 a 300 ng/mL. Todos los 10 subtipos de HBsAg produjeron resultados positivos con HBs Ag Ultra Plasma/Serum Device. La prueba 2 puede detectar 1 ng/mL de HBsAg en 15 minutos y 0.5 ng/mL de HBsAg en 20 minutos. Especificidad Los anticuerpos usados para El HBs Ag Ultra Plasma/Serum Device fueron desarrollados contra todo el antígeno de Hepatitis B aislado del virus de Hepatitis B. La Especificidad de HBs Ag Ultra Plasma/Serum Device fue también probado con cepas de un laboratorio de Hepatitis A y Hepatitis C. Todas estas produjeron resultados negativos. HBs Ag Ultra Plasma/Serum Device vs. EIA Total Resultados Sensibilidad Relativa: > 99.0% Especificidad Relativa: > 99.0% Precisión: > 99.0% PRECISION Intra-Ensayo La precisión ha sido determinada usando 15 duplicados de tres muestras que contienen 0 ng/mL, 1 ng/mL y 5 ng/mL de HBsAg. Los valores positivos y negativos fueron correctamente identificados 99% de las veces. Inter-Ensayo Entre las corridas la precisión ha sido determinada usando las mismas tres muestras de 0 ng/mL, 1 ng/mL y 5 ng/mL de HBsAg en 15 ensayos independientes. Tres lotes diferentes de HBs Ag Ultra Plasma/Serum Device han sido probados por un período mayor de tres meses usando muestras negativas, positivas bajas y positivas altas. Las muestras fueron correctamente identificadas 99% de las veces. BIBLIOGRAFIA • Blumberg, B.S. The Discovery of Australian Antigen and its relation to viral hepatitis. Vitro. 1971; 7: 223 FABRICADO POR: ORGENICS LTD P.O.B. 360, YAVNE 70650, ISRAEL 3