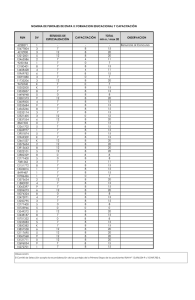
extracción de lignanos de carbón leonarditico por los metodos sosa
Anuncio

EXTRACCIÓN DE LIGNANOS DE CARBÓN LEONARDITICO POR LOS METODOS SOSA- CLORURO DE SODIO Y RUN-CANG SUN Y DETERMINACIÓN DE SU ACTIVIDAD ANTIOXIDANTE KELLY JOHANNA REINOSO JUAN FERNANDO VELASCO Trabajo de grado para optar por el titulo de Químico UNIVERSIDAD DE CIENCIAS APLICADAS Y AMBIENTALES ´´U.D.C.A´´ FACULTAD DE CIENCIA Y TECNOLOGIA QUÍMICA BOGOTÁ D.C 2012 EXTRACCIÓN DE LIGNANOS DE CARBÓN LEONARDITICO POR LOS METODOS SOSA- CLORURO DE SODIO Y RUN-CANG SUN Y DETERMINACIÓN DE SU ACTIVIDAD ANTIOXIDANTE KELLY JOHANNA REINOSO JUAN FERNANDO VELASCO Trabajo de grado para optar por el titulo de Químico TRABAJO DE GRADO M.Sc. CAMILO ANDRES MAHECHA Asesor UNIVERSIDAD DE CIENCIAS APLICADAS Y AMBIENTALES ´´U.D.C.A´´ FACULTAD DE CIENCIA Y TECNOLOGIA QUÍMICA BOGOTÁ D.C 2012 Nota de aceptación _______________________________ _______________________________ _______________________________ _______________________________ _______________________________ Firma del presidente del jurado _______________________________ Firma del jurado _______________________________ TABLA DE TABLAS Tabla 1. Clasificación de carbones.......................................................................... 3 Tabla 2. Calidad de carbones............................................................................... 7-8 Tabla 3. Composición del carbón de muestra ....................................................... 29 Tabla 4. Solubilidad de extracto Run Cang Sun .................................................... 31 Tabla 5. Solubilidad de extracto Sosa – NaCl ...................................................... 32 Tabla 6. Solubilidad de extracto Run Cang Sun derivatizada .............................. 32 Tabla 7. Solubilidad de extracto Sosa – NaCl derivatizada .................................. 33 Tabla 8. Compuestos identificados por análisis cromatográfico extracto Sosa Orgánico parcialmente derivatizado ...................................................................... 40 Tabla 9. Compuestos identificados por análisis cromatográfico extracto Run Cang Sun totalmente derivatizado .................................................................................. 41 Tabla 10. Bandas características de los IR ........................................................... 49 Tabla 11. Datos para la curva de calibración con trólox ...................................... 50 Tabla 12. Datos para la curva de calibración con Vitamina C .............................. 51 Tabla 13. Resultados de actividad antioxidante en términos de inhibición de DPPH de los extractos ..................................................................................................... 53 Tabla 14. Resultados de actividad antioxidante equivalente a trólox (TEAC) de de los extractos .......................................................................................................... 54 Tabla 15. Capacidad antioxidante de los extractos expresada en términos de TEAC .................................................................................................................... 55 TABLA DE FIGURAS Esquema 1. Clases y usos del carbón .................................................................... 4 Diagrama 1. Cadena del carbón.............................................................................. 5 Figura 1: Lignanos simples ........................................................................................... 11 Figura 2. Ciclolignanos ............................................................................................ 11 Figura 3. Neolignanos .............................................................................................. 12 Figura 4. Lignanos mixtos (estibenolignanos, cumarinolignanos y xantonolignanos) ............... 12 Figura5. Estructura de la lignina ............................................................................ 13 Figura 6: Cubebina ..................................................................................................... 13 Figura 7: lignanos furofuranos y flavona ......................................................................... 13 Diagrama 2. Proceso de extracción por Run Cang Sun ................................................... 22 Diagrama 3. Proceso de extracción por Sosa - NaCl ..................................................... 23 Diagrama 4. Proceso de derivatización parcial ................................................................ 24 Diagrama 5. Proceso de derivatización total .................................................................... 25 Figura 8. Extractos iniciales................................................................................... 33 Figura 9. Extractos derivatizados .......................................................................... 28 Gráfico 1. Espectro UV-Vis Extracto Run Cang Sun antes de derivatizar ............................ 34 Gráfico 2. Espectro UV-Vis Extracto Run Cang Sun despues de derivatizar ........................ 35 Gráfico 3. Espectro UV-Vis Extracto Run Cang Sun Derivatización Total en THF ................ 35 Gráfico 4. Espectro UV-Vis Extracto NaOH - NaCl totalmente derivatizado en Piridina .......... 36 Gráfico 5. Espectro UV-Vis Extracto Run Cang Sun totalmente derivatizado en Piridina ........ 36 Gráfico 6. Espectro UV-Vis Sosa Derivatización parcial en THF ....................................... 37 Gráfico 7. Espectro UV-Vis Run Cang Sun Derivatización Total en THF ............................. 37 Gráfico 8. Espectro UV-Vis Sosa Derivatización Total en THF .......................................... 38 Gráfico 9. Espectro UV-Vis Run Cang Sun Derivatización Parcial en EtOH ......................... 38 Cromatograma 1. Sosa Orgánica parcialmente derivatizada ................................ 39 Cromatograma 2. Run Cang Sun Acuoso totalmente derivatizado ....................... 41 Cromatograma 3. Pico 1 (tetrahidro -2- furanol) .................................................... 42 Esquema 2. Rompimiento de masas (Tetrahidro – 2 – furanol) ........................... 42 Cromatograma 4. Pico 2 (Dimetilsulfoxomonio formilmetiluro) .............................. 43 Esquema 3. Rompimiento de masas (Dimetilsulfoxomonio formilmetiluro) ........... 43 Cromatograma 5. Pico 3 ((S)-(+)-3-Hidroxitetrahidrofurano) ................................. 44 Esquema 4. Rompimiento de masas ((S)-(+)-3-Hidroxitetrahidrofurano) .............. 44 Espectro IR 1. Run Cang Sun Acuoso Totalmente Derivatizado........................... 46 Espectro IR 2. Run Cang Sun Orgánica Totalmente Derivatizado ........................ 47 Espectro IR 3.Sosa - NaCl Acuoso Totalmente Derivatizado ................................ 48 Gráfica 10. Curva de calibración del porcentaje de inhibición Vs concentración Trólox ................................................................................................................... 51 Gráfica 11. Curva de calibración del porcentaje de inhibición Vs Vitamina C ...... 52 GLOSARIO Ácido ascórbico: La vitamina C, enantiómero (L) del ácido antiescorbútica, es un nutriente esencial para los mamíferos. ascórbico o Ácido húmico: molécula orgánica compleja formada por la descomposición de materia orgánica vegetal. Ácido fúlvico: molécula orgánica compleja formada por la descomposición de materia orgánica vegetal, poseen menos carbono mas hidrógeno que los ácidos húmicos. Antioxidante: molécula moléculas. capaz de retardar o prevenir la oxidación de otras Fenilpropanoides: estructuras moleculares contienen al menos un grupo fenol, un anillo aromático unido al menos un grupo funcional Leonardita: es una forma de ácidos húmicos encontrada exclusivamente en Dakota del Norte. Lignina: polímero presente en las paredes celulares de las Plantas y de un tipo de bacterias conocidas como Dinophytas. Lignito: carbón que se forma por compresión de la turba, es de estructura frágil y en él se pueden reconocer algunas estructuras vegetales. Es de color negro o pardo y frecuentemente presenta una textura similar a la de la madera de la que procede. Quelato: Estructura molecular en la que los iones metálicos se hallan unidos a un compuesto orgánico. Sosa: El hidróxido de sodio (NaOH) o hidróxido sódico Radical libre: átomo que tiene un electrón (e-) desapareado en capacidad de aparearse, por lo que es muy reactivos Splitless: sistema de inyección para cromatografía de gases masas, se utiliza para analizar muestras muy pequeñas. Trolox: Derivado soluble de la vitamina E. ABREVIATURAS ABTS•+: (ácido 2,2'–azino–bis–(3–etillbenzotiazolin–6–sulfonico) agente oxidante de diversos compuestos químicos. ASTMD: American Society for Testing. DPPH: Radical 2,2-difenil-1-picrilhidrazil. GS: Cromatografía de gases masas HPLC: Cromatografía de alta resolución (por sus siglas en ingles). IR: Infrarrojo. KRAFT: (ácido 2,2'–azino–bis–(3–etillbenzotiazolin–6–sulfonico) MT-CNH2: Tetrametil-silil-diazometano R2 : coeficiente de correlación estadístico lineal. RMN: Resonancia Magnética Nuclear TEAC: Capacidad antioxidante equivalente a trolox (por sus siglas en ingles) UV: Ultravioleta. μM: micro molar. DEDICATORIA A Dios. Por darme la fuerza para alcanzar este sueño y por darme salud para lograr mis objetivos. A mi madre Luz Daris. Por su amor, apoyó, consejo, motivación y ejemplo, que han sido mi fortaleza y refugio en momentos de dificultad. A mí amado Lucas. Por estar este tiempo con migo y por su amor y apoyo permanente. A mis familiares. A mis hermanas Alejandra y Sharon, por ser mi fuente de inspiración, a mis hermanos, mis primas y primos por ser ejemplo de tenacidad y valentía A todos aquellos que participaron directa o indirectamente en la elaboración de esta tesis. ¡Gracias a ustedes! A mi maestro. Lic. Camilo Mahecha Mahecha por su apoyo y motivación para la culminación de mis estudios profesionales. Kelly Johanna Reinoso DEDICATORIA Dedico la presente trabajo a los seres que más amo en este mundo: mis padres, Mariluz Forero y Segundo Velasco que día a día se han esforzado por sacarme a delante, agradezco todo su apoyo y fe en mí; por ser la fuente de mi inspiración y motivación para superarme cada día más y así poder luchar para que la vida nos depare un futuro mejor. Juan Fernando Velasco Forero AGRADECIMIENTOS A Dios, a mi madre y a Lucas, fuente de alegría e inspiración para alcanzar todos mis sueños. Gracias por el amor y la fe que siempre me han profesado. Kelly Johanna Reinoso Primero y antes que nada, dar gracias a mi mamá Mariluz Forero, por estar conmigo, por fortalecer mi vida y brindarme todo su apoyo; al profesor y amigo el M.Sc. CamiloAndres Mahecha porque sin él no habría sido posible la realización de este trabajo ya que su apoyo y dedicación fueron un pilar fundamental en esta investigación, nuevamente gracias por todo lo que hizo por nosotros este trabajo no es solo un logro de los autores sino también de nuestro asesor. Gracias a mi amiga y colega Vanessa Penagos que durante toda esta carrera a sido mi compañera de estudios y de trabajo gracias por toda su colaboración. Doy gracias a mi tía Soraya Forero a la cual le debo mi ingreso a la educación superior ya que sin su apoyo y cariño no hubiese comenzado este camino de vida. En general quisiera agradecer a todas y cada una de las personas que han vivido conmigo la realización de esta carrera, no necesito nómbralas porque tanto ellas como yo sabemos que desde los más profundo de mi corazón les agradezco el haberme brindado todo el apoyo, colaboración, ánimo y sobre todo su cariño y amistad. Juan Fernando Velasco Forero INTRODUCCIÓN El carbón ha proporcionado a la civilización importantes beneficios tanto el campo energético como en el económico, fue descubierto en la prehistoria. En la antigüedad se manufacturaba por medio de la combustión incompleta de materiales orgánicos. Lavoisier 1772 demostró que en la reacción de combustión del diamante se producía CO2. Los primeros compuestos de carbono se identificaron en la materia viva a principios del siglo XIX, y por ello el estudio de los compuestos de carbono se llamó química orgánica. En la actualidad se sabe que del carbón se obtienen sustancias húmicas, como ácidos húmicos, ácidos fúlvicos o lignanos. Estas fracciones se definen basándose estrictamente en su solubilidad ya sea en ácido o álcali. Todas ellas son parte de un sistema supramolecular extremadamente heterogéneo y las diferencias entre estas subdivisiones son debido a variaciones en la acidez, grado de hidrofobicidad, o a la autoasociación de moléculas por efectos entrópicos. Sin embargo y pese a que el carbón ha sido ampliamente estudiado, aun falta descubrir y explotar muchas cualidades de este producto que es abundante en Colombia y que contiene dentro de su matriz grandes secretos que pueden ser utilizados para beneficio de la humanidad. Este trabajo busca extraer de dicha matriz ácidos húmicos por el método de Run Cang Sun, y el método de sosa – cloruro de sodio, una vez extraídos, fragmentarlos y solubilizarlos para determinar su poder antioxidante. Ya que es conocido que una vez fragmentado los ácidos húmicos se obtienen lignanos y estos poseen grandes cualidades que prestan beneficio a la salud humana. En el presente estudio se hace una breve descripción del estado del arte, sobre los ácidos húmicos, la descripción de las características del carbón objeto de estudio; finalizando con una descripción de la metodología empleada para el desarrollo del estudio, los resultados obtenidos y las conclusiones a las que se llegó. 1. OBJETIVOS 1.1 1.2 Objetivo general: Extraer sustancias húmicas de un carbón leonarditico por los métodos de sosa – cloruro de sodio y Run-Cang Sun, derivatización y determinación de actividad antioxidante por el método de DPPH• comparando con Trolox. Objetivos específicos: 1.2.1 Extraer ´´lignina - ácidos húmicos´´ de carbón leonarditico por los métodos de sosa- cloruro de sodio y Run-cang Sun. 1.2.2 Derivatizar los extractos de sustancias húmicas para la obtención de lignanos. 1.2.3 Realizar pruebas físicas y químicas que permitan corroborar la presencia de lignina, Ácidos húmicos, lignanos. 1.2.4 Determinar si las fracciones obtenidas de la extracción y separación poseen actividad antioxidante. 1 2. JUSTIFICACIÓN Los antioxidantes son moléculas capaces de prevenir o retardar la oxidación de otras moléculas, capturando radicales libres u oxidándose ellos mismos. Por lo general estos antioxidantes se encuentran en las plantas ya sea como aceites o metabolítos secundarios. Estas moléculas han empezado a tomar importancia en el sector de la salud ya que ya pueden anular los efectos perjudiciales de los radicales libres en las células previniendo enfermedades. En el proceso de formación del carbón estas moléculas se van degradando por vía microbiana y/o metamórfica, la duración de estos proceso son los que dan la variedad de carbones existentes, siendo los de mayor tiempo los carbones antracita y los de menor tiempo la turba (lignito o leonardita). Colombia es un país que posee grandes reservas de carbón de alto y bajo rango, sin embargo han sido los carbones de alto rango como sub-bituminosos y bituminosos , los que han cobrado mayor importancia por su uso en la industria como fuente para obtención de energía, convirtiéndose en un producto importante de exportación para nuestro país generando un amplio índice de regalías y beneficios para el mismo1; los carbones de bajo rango como el lignito aunque también son empleados en la industria energética, tienen un uso más frecuente en la agronomía, en donde son utilizados como fertilizantes directamente o a través de sus extractos dependiendo del nivel de oxidación de la muestra y aunque su incursión en esta industria ha sido bueno, es importante conocer los componentes que hacen parte de este tipo de carbones, extraerlos y estudiarlos de manera adecuada con el fin de darles un uso distinto al agrícola que permita diversificar su empleo y aprovechar todas las propiedades químicas y físicas que poseen. Una propiedad importante que se ha determinado para algunos lignanos extraidos de plantas es su capacidad antioxidante2; por tanto es necesario determinar si un carbón de bajo rango posee este tipo de moléculas y por ende verificar su capacidad antioxidante empleando la técnica de decoloración del DPPH• y comparando contra Trolox. 2 3. ESTADO DEL ARTE 3.1 Mineral: Sustancia natural homogénea, de origen inorgánico, con composición química definida y en general con estructura cristalina, excluyendo a esta definición las sustancias generadas por la transformación de materia orgánica en ambientes reductores como carbón, petróleo y resinas fósiles. Varios autores a clasifican estos materiales como hidrocarburos como minerales; sin embargo, resulta más adecuado referirse a éstos como materiales energéticos.3 3.2 Carbón: Compuesto principalmente por carbono, hidrógeno, nitrógeno, oxígeno y azufre, se origina en transformaciones físicas y químicas de grandes acumulaciones vegetales depositadas en ambientes palustres (pantanos), lagunares o deltaicos. Una de las clasificaciones más utilizadas es la de American Society for Testing and Materials (ASTMD-388-777), mostrada en la Tabla 1, que lo divide en cuatro clases según las propiedades referidas a la composición de los vegetales y las condiciones de presión y temperatura (grado de metamorfismo) a que fueron sometidos durante su formación.3 Tipo Carbono Fijo (%) Material Volátil (%) Antracita Bituminoso 86 - 98 45 - 86 1 32 Contenido Humedad (%) < 15 15 - 20 Sub bituminoso Lignito y Turba 35 - 45 50 20 - 30 25 - 35 96 > 30 Poder Calorífico (Btu/lb) >14.000 10.50014.000 7.800 10.500 4.000 7.800 Poder Calorífico (MJ/Kg) >32.6 24.5 - 32.6 18.2 - 24.5 9.3 – 18.2 Poder Calorífico Kcal/Kg >7.780 5.8007.780 4.3007.780 2.200 – 4.300 Tabla 1. Clasificación de carbones Fuente: American Society for Testing and Materials (ASTMD-388-777) Tomado de: Unidad de Planeación Minero Energética. Cadena del carbón. [en línea]. [Consultado 12 de marzo de 2012]. Disponible en: < http://www.upme.gov.co/Docs/Cadena_carbon.pdf> 3 Aumenta poder calorífico Aumenta material volátil Antracita • Carbón duro, con alto contenido de carbono (86% al 98%), bajo contenido de materia volátil y poder calorífico superior a 32.6 MJ/Kg. Usado como combustible en generación de calor o vapor en la industria térmica y siderúrgica, también se usa en la fabricación de goma sintética, colorantes y purificación de agua para consumo humano (filtros). Hulla Bituminosa • Carbón posee un menor contenido de carbono y menor poder calorífico que los carbones antracíticos. Por su forma de uso se conocen como carbones coquizables, usados en procesos de obtención del acero, y carbones térmicos, usados en la producción de vapor para generación de energía. Hulla Subbituminosa • Carbón un menor poder calorífico que los carbones bituminosos, su composición en carbono está entre 35% y 45%, tiene un elevado contenido de material volátil, algunos con poder coquizable. Es empleado en la generación de energía eléctrica y en procesos industriales. Lignito y turba • Carbones con alta humedad y alto contenido de ceniza y de material volátil, lo cual hace que posean un bajo poder calorífico. Es empleado para la generación de calórica (calefacción), energía eléctrica, para algunos procesos industriales en donde se requiere generar vapor y más recientemente se han fabricado briquetas de turba y lignito para quemarlas en hornos. Esquema 1. Clases y usos del carbón Fuente: Unidad de Planeación Minero Energética Tomado, modificado y creado de: Unidad de Planeación Minero Energética. Cadena del carbón. [en línea]. [Consultado 12 de marzo de 2012]. Disponible en: < http://www.upme.gov.co/Docs/Cadena_carbon.pdf> Reservas carboníferas: Colombia cuenta con carbón de excelente calidad, siendo participe del mercado mundial por largo tiempo. Las reservas medidas son de 7.063,6 Mt, ubicadas principalmente en la Costa Atlántica, donde se encuentra el 90% del carbón térmico que a su vez corresponde al 98% del carbón nacional. El 95% de las reservas se ubica en los departamentos de La Guajira, Cesar, Córdoba, Norte de Santander, Cundinamarca, Boyacá, Antioquia, Valle del Cauca y Cauca.3 4 Diagrama 1. Cadena del carbón Fuente: Unidad de Planeación Minero Energética Tomado de: Unidad de Planeación Minero Energética. Cadena del carbón. [en línea]. [Consultado 12 de marzo de 2012]. Disponible en: < http://www.upme.gov.co/Docs/Cadena_carbon.pdf> Calidades del Carbón Colombiano: La calidad de los carbones está referida a las propiedades físicas y químicas, que son las que finalmente determinarán el uso final del material. Humedad: Se presenta como humedad total, inherente o de equilibrio, superficial, agua de hidratación o agua de descomposición. Su importancia es contratos de compraventa, en evaluación, control de procesos industriales, en manejo y pulverización del carbón. Cenizas (Cz): Residuo no combustible de origen orgánico e inorgánico. 5 Materias volátiles (Mv): Se determina los rendimientos del coque y sus productos; es criterio de selección del carbón para gasificación y licuefacción. Carbono fijo (CF): Es la medida del material combustible sólido y permite clasificar los carbones y definir los procesos de combustión y carbonización. Azufre total (St): Parámetro para definir gases tóxicos de los procesos de gasificación y licuefacción. Poder Calorífico (PC): Representa la energía de combustión del carbono e hidrógeno y del azufre. Es el más importante en la definición de los contratos de compraventa de carbones térmicos y en la clasificación de los carbones por rango.3 En la Tabla 2 se presenta la calidad de los carbones colombianos discriminada por regiones. De acuerdo con los estudios de caracterización adelantados en las zonas carboníferas del país, en la cordillera Oriental se encuentran los mejores carbones bituminosos para uso térmico y metalúrgico junto con carbones antracíticos, tanto para el consumo interno como de exportación; en la cordillera Occidental se hallan carbones bituminosos y sub-bituminosos en Córdoba, norte de Antioquia, Valle del Cauca y Cauca; en la cordillera Central existen carbones bituminosos en las zonas carboníferas de Antioquia y Antiguo Caldas y, menos conocidos, en Huila y Tolima.3 6 Tabla 2 Calidad de carbones en Colombia: Continúa en la siguiente página 7 Tabla 2. Calidad de carbones Fuente: Ingeominas (2004) Tomado de: Unidad de Planeación Minero Energética. Cadena del carbón. [en línea]. [Consultado 12 de marzo de 2012]. Disponible en: < http://www.upme.gov.co/Docs/Cadena_carbon.pdf> 8 3.3 Leonardita: Forma de ácidos húmicos encontrada por primera vez en Dakota del Norte. Es llamada así en homenaje al Dr. A.G. Leonard, el cual fue primer director del Servicio Geológico del Estado de Dakota del Norte y científico que estudió sus propiedades. La leonardita se forma en la era carbonífera del Paleozoico, cerca de 280 millones de años atrás. La amplia vegetación existente entonces en lo que es hoy Dakota del Norte fue destruida y carbonizada, pero en ese proceso fueron exprimidos los ricos jugos orgánicos formando originalmente lagunas de poca profundidad que también se carbonizaron dando origen a la leonardita. La masa fibrosa se transformó en carbón encima del cual se formó la delgada capa de leonardita. A través de los millones de años de su formación, la leonardita ha estado sujeta a toda clase de acciones físicas y químicas, como también microbiológicas, para llegar a su forma actual. La leonardita es una forma de ácidos húmicos. Lo que todos los ácidos húmicos tienen en común es que son el producto final de la descomposición de materias orgánicas (principalmente vegetales). Pero, lógicamente, el material de origen ha sido diferente en cada caso. También ha sido diferente el proceso de formación y su duración. En contraste se citan los ácidos húmicos encontrados en La Florida que provienen de una muy reciente (máximo 50.000 años) formación de turba. Aunque tratándose en ambos casos de “ácidos húmicos”, hay una gran diferencia en su estructura molecular y sobre todo en sus propiedades biológicas.4 3.4 Lignanos: Grupo de metabolitos secundarios muy difundidos entre las plantas, tanto entre las Gimnospermas como entre las Angiospermas, aunque son más frecuentes en las Pináceas, Podofiláceas, Rutáceas y Lauráceas. Se presentan hasta en un 6,4% de los aceites extraídos de las raíces de las plantas, como Sesamum angolense (Pelalacieae), y alrededor del 35% de los aceites esenciales de las semillas de algunos cultivares del falso hinojo indio, Anethum sowe. Son menos abundantes en las Asteráceas, los lignanos son suficientemente frecuentes para poder utilizarlos con fines taxonómicos.5 Comprenden una clase de productos naturales de plantas que se derivan de derivados de ácido cinámico y que están relacionadas bioquímicamente a la fenilalanina. 9 3.4.1 Tipos de lignanos: Los lignanos se pueden dividir en 4 grandes grupos: a) Lignanos simples: Presentan únicamente una unión carbono carbono en las posiciones β y β’ de sus cadenas laterales. En función de si el oxígeno es o no incorporado a la cadena lateral y del modo en que lo hace, se establecen 4 subtipos (Figura 1)6: • • • • Derivados del dibencilbutano Derivados de la dibencilbutirolactona (lignanólidos) Derivados del tetrahidrofurano (epoxilignanos) Derivados del furofurano (bisepoxilignanos) b) Ciclolignanos: Son el resultado de la formación de otro enlace adicional carbono – carbono, dando lugar a un nuevo anillo; dando como resultado 4 subtipos (Figura 2)6: • • • • Ariltetrahidronaftalenos Arildhidronaftalenos Arilnaftalenos Dibencilciclooctadienos c) Neolignanos: Son dímeros de unidades C6C3que no poseen enlace β y β´ (Figura 4).6 d) Dímeros mixtos: Son heterodímeros mixtos resultantes del acoplamiento de lignanos o neolignanos con otras sustancias como flavonoides, cumarinas, xantonas, etc., formándose de esta manera los denominados flavonolignanos, cumarinolignanos, estilbenolignanos, xantonolignanos, etc. (Figura 5).6 10 Figura 1: Lignanos simples Tomado de: Fitoterapia.net, Revista de fitorterapia [en línea]. [Consultado 05 de abril de 2012]. Disponible en: < http://www.fitoterapia.net/revista/pdf/55-68%20RDF%205.1%20LIGNANOS.pdf> Figura 2: Ciclolignanos Tomado de: Fitoterapia.net, Revista de fitorterapia [en línea]. [Consultado 05 de abril de 2012]. Disponible en: < http://www.fitoterapia.net/revista/pdf/55-68%20RDF%205.1%20LIGNANOS.pdf> 11 Figura 3: Neolignanos Tomado de: Fitoterapia.net, Revista de fitorterapia [en línea]. [Consultado 05 de abril de 2012]. Disponible en: < http://www.fitoterapia.net/revista/pdf/55-68%20RDF%205.1%20LIGNANOS.pdf> Figura 5: Lignanos mixtos (estibenolignanos, cumarinolignanos y xantonolignanos) Tomado de: Fitoterapia.net, Revista de fitorterapia [en línea]. [Consultado 05 de abril de 2012]. Disponible en: < http://www.fitoterapia.net/revista/pdf/55-68%20RDF%205.1%20LIGNANOS.pdf> 12 Muchos lignanos muestran una actividad fisiológica, como las podofilotoxinas que son inhibidores tumorales. Esta actividad específica conduce a la interferencia con la división celular por dos mecanismos diferentes en animales, incluyendo seres humanos. Por otra parte se han realizado estudios que muestran que algunos lignanos son activos en la supresión del sistema nervioso central y la inhibición de la fosfodiesterasa de AMP cíclico; además se utilizan para el tratamiento de la hepatitis viral y la protección del hígado.7 3.5 Lignina: Es un polímero complejo, tridimensional, globular, irregular, insoluble y de alto peso molecular (>10000g/mol), formado por unidades de fenilpropano cuyos enlaces son relativamente fáciles de hidrolizar vía química o enzimática. Ésta molécula tiene diferentes tipos de uniones aromáticas de fenilpropano. Figura 6: Estructura de la Lignina Tomado de: e-limbo.org. Lignina, EAU de biblioteca [en línea]. [Consultado 12 de marzo de 2012]. Disponible en: < http://www.e-limbo.org/articulo.php/Art/3290> 13 En las planta, la lignina se encuentra químicamente unidad a la hemicelulosa y rodeando a las fibras compuestas por celulosa. Es responsable de la rigidez de las plantas y sus mecanismos de resistencia al estrés y a ataques microbianos. Es especialmente abundante (20-30 % del peso de la pared) en células conductoras (vasos xilemáticos) y estructurales (fibras) con engrosamiento secundario. En cuanto a su biosíntesis, se sabe que los precursores de la lignina se forman por conducto de la ruta correspondiente al ácido shiquímico. Este ácido, formado por una unión del ácido fosfoenolpirúvico y eritrosa-4-fosfato, se convierte en el principal escalón de la biosíntesis de los aminoácidos L-tirosina y L-fenilalanina, que están formados por aminación reductiva. Las enzimas desaminantes convierten a continuación los dos aminoácidos en sus respectivas contrapartes de ácido de shiquímico. La hidroxilación en etapas por hidroxilasa, y en su momento la metilación por ometil-transferasas, transforma los ácidos para hidroxi-shinámicos conocidos como precursores de lignina.8 3.6 Extracción de lignina: Existen otros trabajos relacionados con la lignina, los más investigados son los procesos para su eliminación en el blanqueo de la pulpa de madera. Existen artículos que reportan características de diferentes procesos para la obtención de un tipo particular de lignina, debido a que la lignina varía según el método de extracción y separación así como de la materia prima de la cual proviene. Según en el trabajo de grado Extracción de lignina proveniente de residuos agroindustriales para su empleo en procesos de gasificación dan a conocer los usos de la lignina como materia prima de la gasificación existen 3 procesos de extracción como subproducto y la lignina se clasifica según este proceso:: Lignina de sulfito: Proviene del líquido residual sulfitado (solución de bisulfito y anhídrido sulfuroso) de las fábricas de pulpa, la cantidad de lignina que se desprende de la pulpa de madera es de 50 –60%. Lignina alcalina (Kraft): Obtenida del líquido residual (licor negro) de los procedimientos al sulfato y a la sosa (mezcla de hidróxido de sodio y sulfuro de sodio) en la fabricación de la pasta para papel. Por lo general la cantidad de lignina que se obtiene es del 50 – 75% del contenido en la madera. 14 Lignina comercial: Se obtiene como subproducto de procesos relacionados con la celulosa u otros productos primarios; generalmente se nombran de acuerdo al fabricante: Benaloid®, Binderine®, Furafil®; Glutrin®; Goulac®; Indulin®; Isofil®; Marasperse®; Maratan®; Maratex®;Meadol®; Silvacon®; TomLinite®. En el trabajo de grado Extracción de lignina proveniente de residuos agroindustriales para su empleo en procesos de gasificación dan a conocer los usos de la lignina como materia prima de la gasificación, pero no es el único proceso en el que se puede emplear lignina en la industria de la gomas, en calidad de relleno y antioxidante, y demostrando que solo la lignina sulfática (Kraft) sirve para este fin. Otra aplicación es como surfactante, debido su característica lipofilica de la lignina, mencionan que la lignina es la mejor alternativa para la elaboración de estos. Por otra parte en esta misma investigación se describe diversas metodologías para la extracción de lignina proveniente de maderas, utilizando una mezcla de solventes tolueno/etanol a una relación volumétrica de 2:1 y su posterior separación con ácido sulfúrico al 72%. Otro método es Run-Can Sun basado en medio ácido describe la delignificación de tallos de maíz, mostrando diferentes formas de caracterizar éste tipo de lignina; donde se realiza la extracción de lignina proveniente de paja de cebada por métodos alcalinos caracterizándolo por IR. Rojas Aguilar describe dentro de su trabajo formas de caracterización de la lignina que se realiza mediante técnicas como: NMR, HPLC, IR; de estos análisis se obtienen resultados de tipo cuantitativo y cualitativo aportando información útil por la cual se reconocen especies a nivel atómico o molecular, deduciendo características estructurales y/o reconociendo en la muestra la presencia de determinados grupos funcionales como en el caso del espectro UV concluye que la lignina posee una longitud de onda característica situada a los 280nm.9 15 3.7 Ácidos Húmicos: Polímeros complejos de alto peso molecular con núcleos periféricos (grupos radicales) que permiten capturar iones del medio circundante o una mayor polimerización. Hay dos tipos: pardos y grises. 10 3.7.1 Ácidos húmicos pardos: Provienen de la oxidación de la lignina. Son poco estables, pobres en nitrógeno en forma amínica (-NH2) y floculan poco en presencia de calcio. 10 3.7.2 Ácidos húmicos grises: Se forman por acción de microorganismos del suelo. Tiene mayor contenido de nitrógeno, floculan rápidamente en presencia de calcio y forman complejos órgano-minerales (arcillas-humus) muy estables.10 3.8 Antioxidante: Es toda sustancia que retrasa o previene el deterioro, daño o destrucción provocados por una oxidación. Durante muchos años, los químicos han tenido conocimiento de que la acción oxidante de los radicales libres puede ser controlada, o incluso prevenida por una serie de sustancias antioxidantes.11 3.9 Radical libre: Es una molécula con uno o más electrones no ligados en su órbita externa. Los electrones libres, o no ligados, proveen una mayor carga energética. Tal molécula es inestable y tiende a reaccionar activamente con otras moléculas para ligar los electrones libres y generar moléculas estables. Es precisamente esta marcada reactividad y su tendencia a iniciar reacciones redox en cadena lo que constituye un papel citotóxico central en la casualidad de lesiones de células y tejidos.12 16 4. ANTECEDENTES 4.1 Estudios de actividades biológicas y antioxidantes de ácidos húmicos: En estudios realizados sobre ácidos húmicos se ha determinado que inducen la apoptosis en células HL-60 (relacionadas con la leucemia), deteniendo su proliferación y crecimiento, en concentraciones de 50-400 µg / mL13, de igual modo se ha comprobado su efecto antitumoral, también por vía apoptosis, en combinación con As2O3, sobre Adenocarcinoma cervical humano, en líneas celulares HeLa y SiLa, generando una reducción en la CL50 obteniendo resultados de 57,62% a 73,52% (300 µg HA / mL) y 79,03% a 83,67% (500 g de HA / mL), respectivamente.14 También se ha logrado probar su activad antimutagenica en células de ovario de hámster chino en combinación con mutágenos como la mitomicina C y La Hidrazida maleica.15 Se han realizado estudios in vitro en líneas celulares de cáncer de las mitocondrias del hígado, probando ácidos húmicos de una fuente seleccionada en Eslovaquia; los resultados obtenidos mostraron un potencial prometedor de este tipo de sustancias como agentes para mejorar la inmunidad.16 En otros estudios se ha comprobado que al generar complejos con otras sustancias permiten un mejor transporte de las mismas a través de distintos tejidos, mejorando su efecto, como sucede con el complejo Carbamazepina- Acido húmico (1:2), que mejora la permeabilidad y acceso de la sustancia en el cerebro, potencializando su efecto anticonvulsivo.17 En cuanto a la actividad antioxidante se ha determinado esta propiedad a través de la técnica ABTS, en términos de TEAC, para dos muestras de sustancias húmicas, dando como resultado 57,130 ± 0,091 y 22,212 ± 0,059 µmoles de trolox por gramo de peso seco ± la desviación estándar para ambas respectivamente, comparando con 5,671 ± 0,032 µmoles de trolox por gramo de acido ascórbico que fue empleado como sustancia de referencia.18 17 4.2 Estudios de actividades biológicas y antioxidantes de los lignanos: Los lignanos deben sus características una gama amplia de estructuras dando asi una gran diversidad de actividades biológicas. Los lignanos son moléculas muy estudiadas y se conocen algunos con propiedades anti-tumoral, antimitótica, antiviral y pueden inhibir específicamente ciertas enzimas, además de ser toxicas para hongos e insectos.19 Estas sustancias húmicas son constituyentes de alimentos unidos a estrógeno y con actividad anti-estrógeno, lo que contribuye a la prevención de cánceres hormono-dependientes, osteoporosis, enfermedad cardiovascular y síntomas de la menopausia. Esta actividad anti-estrogena a sido evaluda en mamiferos, examinado si lignanos naturales y semi-sintéticos poseen estas caracteristicassiendo los lignanos vegetales los de mayor actividad; mientras que los norlignanos semi-sintéticos eran moderadamente activos lo que apoya la idea de lignanos vegetales que tienen función fitoestrógeno.20 Existen varias explicaciones posibles para las bioactividades observados, incluyendo la participación en el metabolismo hormonal o disponibilidad, la antiangiogénesis, anti-oxidación y la supresión de un gen. Por otra parte, las concentraciones fisiológicamente relevantes del enterolignano se ha demostrado que conducir a la "in vitro" e "in vivo" la activación de los receptores estrogénicos. La Lychnophora ericoides es una planta brasileña que está disponible comercialmente como un agente analgésico y antiinflamatorio. El extracto de las raíces, produjo 10 lignanos, que mostraron actividad analgésica en el test de contorsiones del ratón. El lignano cubebina(Figura 7), fue uno de los más activos, mostro capacidad anti-inflamatoria y antipirética. Además de dos derivados metilo previamente desconocidas. Figura 7: Cubebina Tomado de: Medycyna dawna i współczesna. Lignany w ziołach i ich znaczenie [en línea]. [Consultado 7 de abril de 2012]. Disponible en: < http://rozanski.li/?p=1737> 18 Los lignanos vegetales son convertidos en lignanos mamíferos al ser absorbidos por él organismos y en ocasiones estan presentes en el suero y la orina. Se ha investigado que algunos lingnanos vegetales poseen actividad antitumoral y endocrino modulador de lignanos vegetales, con el fin de aclarar las relaciones estructura-actividad. Como en el estudio de la 7-hidroximatairesinol (HMR) que se convierte en el ENL, y ambos HMR y ENL pueden inhibir el crecimiento de7,12dimetil[a] antraceno (DMBA) inducida por cáncer mamario. Otras investigaciones sobre el papel de los lignanos como los enterolignanos, lariciresinol, pinoresinol, medioresinol, syringaresinol, arctigenina y sesamina consumidos en la dieta inhibiendo o mostrando efectos beneficiosos en el cáncer de mama, colon y próstata. . Estudios recientes muestran que diversos lignanos mostraron inhibir la Vit C / NADPH inducida por la peroxidación lipídica (la formación de malondialdehído (MDA)) de los microsomas de hígado de rata. Estos compuestos, schisanhenol (Sal), S (-) schizandrin C (S (-) sen C) y S (-)schizandrin B (S (-) sen B) muestran ser más potente que la vitamina E en la misma concentración. El Sal y (S (-) sen B) fueron capaces de inhibir la gosipol inducida por la generación de anión superóxido en microsomas de hígado de rata. Además, la administración oral de Sal y (S (-) sen B) reduce notablemente la formación de MDA hígado inducida por etanol, 15 mL/kg en ratones, y aumento de la superóxido dismutasa y las actividades de catalasa en el citosol de hígado de rata. Este trabajo concluye que algunos lignanos, como Sal, tienen una fuerte actividad antioxidante.19, 20 Otrs estudios en el cual después del aislamiento y la identificación de seis conocidos lignanos furofuranos: eudesmin(1), magnolin(2), epimagnolin A(3), aschantin(4), kobusin(5), sesamina(6) y una flavona artemetina(7). Se evaluaron in vitro para su citotoxicidad en un panel de selección que consta de varias líneas de células tumorales de mamíferos, por su actividad contra la malaria resistente a la cloroquina contra el Plasmodium falciparum (FcB1 cepa) y para su citotoxicidad contra células murinas normales (CFU-GM). Si bien no hay una citotoxicidad prometedora contra las células tumorales humanas se notó, potencia marginal y la selectividad se encontró para los compuestos 1-5 contra el colon murino . Además, los compuestos 2-7 mostró leves actividad antiplasmodial, 6 y 7 son los compuestos más activos (IC50 3,37 y 3,50 g / mL, 21 respectivamente). 19 Figura 8: lignanos furofuranos y flavona Tomado de: Journal Ethonopharmacology. Furfuranlignans and a flavone from Artemisia gorgonum Webb and their in vitro activity against Plasmodium falciparum, ScienceDirect [en línea]. [Consultado 7 de abril de 2012]. Disponible en: < http://www.sciencedirect.com/science/article/pii/S0378874111007100> 20 5. METODOLOGÍA Esta investigación se abordó desde 2 aspectos; el químico el cual consistió en la extracción de sustancias húmicas del carbón leonarditico por los métodos de Run Cang Sun y Sosa – Cloruro de sodio y su posterior derivatización para la obtención de lignanos. El segundo aspecto abordado en esta investigación es la biológica la cual consistió en la determinación de la actividad antioxidante de los extractos obtenidos con la técnica de DPPH• dando a conocer esta capacidad antioxidante en equivalentes a trolox. 5.1 Extracción de la lignina: 5.1.1 Método de Run Cang Sun: A una muestra de 200 g de carbón leonarditico, se realizó una extracción soxhlet, con 500 mL de solvente propuesto en el método de Run Cang Sun y colaboradores (tolueno/etanol en relación 2:1)22, a una temperatura de operación de 100°C. El tiempo de extracción de 24 Horas, al terminar el proceso de extracción la mezcla de solventes se recupera en un rotavaporador para así facilitar la separación de las sustancias húmicas, posteriormente al residuo se le agregara agua en proporción 4:1, manteniendo en agitación constante por una hora a 60°C, posteriormente la mezcla se filtra al vacío con papel filtro Whatman No. 40, lavando el producto con 50 mL de Etanol / Agua 2:1 y secando por 10 minutos a 70°C en una estufa. Para eliminar el exceso de agua en la muestra se filtra de nuevo al vacío si es necesario y se calienta a 50° C por 1 hora. 21 A una muestra de 200 g de carbón leonarditico, se realizara una extracción soxhlet, con 500 mL de solvente propuesto (tolueno/etanol en relación 2:1) a una temperatura de operación de 100°C. El tiempo de extracción de 24 Horas, al terminar el proceso de extracción la mezcla de solventes se recupera en un rotavaporador Posteriormente la mezcla se filtra al vacío lavando el producto con 50mL de Etanol / Agua, relación 2:1. Secando por 10 minutos a 70°C en una estufa. Para eliminar el exceso de agua en la muestra se filtra de nuevo al vacío si es necesario y se calienta a 50° C por 1 hora. Diagrama 2. Proceso de extracción por Run Cang Sun. Fuente: Autores 5.1.2 Método Sosa – Cloruro de sodio: El lignito seco y molido (400 g) se mezcla con 2L de una solución de NaOH 2M – 1M de NaCl y se agita durante 3 horas, luego la mezcla se pasa por el ultrasonido, la solución se filtra a través de un filtro de celulosa 60 micrómetros y el filtrado se acidifica por adición de HCl concentrado a pH 1. El precipitado se lava varias veces con una mezcla de HCl 0,25 M y agua destilada hasta que quede libre de cloro y se seca hasta peso constante a 50 °C. 22 Muestra (400 g) en solución de NaOH 2 M- 1 M de NaCl agitar por 3 horas Se pasa por el ultrasonido, se filtra a través de un filtro de celulosa 60 µmetros. Acidificar por adición de HCl concentrado hasta pH 1. El precipitado, se lava con una mezcla de HCl 0,25 M y agua destilada agua hasta que quede libre de cloro y se seca hasta peso constante a 50 ° C. Diagrama 3. Proceso de extracción por Sosa - NaCl. Fuente: Autores 5.2 Derivatización Parcial: a) La derivatización de la muestra se hará de acuerdo al método realizado por S. Amir el en 2006.22Al extracto obtenido se le agrega solución Cloruro de acetilo. La mezcla se mantiene a temperatura ambiente y luego se agita suavemente durante la noche. b) Después de eliminar el disolvente por evaporación rotatoria, el residuo se disuelve en 25 mL de dioxano / ácido acético / agua (05:04:01, v / v / v), se añade Zn en polvo (500 mg) a la solución agitando bien; se continua la agitación durante 30 min. 23 Extracto Adiciona AcCl Disolver en dioxano/ác. acético/ agua y adicionar Zn Adicionar una sln CH2Cl2 /NH4Cl y separa fase acuosa y fase orgánica DERIVATIZACIÓN PARCIAL Diagrama 4. Proceso de derivatización parcial. Fuente: Autores 5.3 Derivatización total: a) Luego la mezcla se transfiere cuantitativamente a un embudo de separación con CH2Cl2 (50 mL) y una solución saturada de NH4Cl (50 mL). b) La solución se mezcla vigorosamente, y las fases orgánica y acuosa se separan. c) La fase acuosa se extrae con CH2Cl2 (2/10 mL). d) La fase orgánica se combina y se seca sobre MgSO4 y, después de adicionar una cantidad conocida de patrón interno (n-undecano en CH2Cl2), el disolvente orgánico se evapora a presión reducida. e) El residuo se acetila durante 40 minutos en 1,5 mL contiene CH2Cl2 0,2 mL de anhídrido acético y 0,2 mL de piridina. f) La fase acuosa se acidifica a un pH <3 con HCl. El filtrado se evapora a presión reducida antes de acetilación y la metilación con trimetilsilidiazometano (MT-CHN2).Todos los componentes volátiles se eliminan por completo por evaporación con EtOH a presión reducida. 24 Fase orgánica Fase Acuosa Sólido Acetilar con CH2Cl2/Anhidrido acético/Piridina Acidular con HCl Solubilizar DMS/Dioxano/Piridi na DERIVATIZACIÓN TOTAL Acetilar con MTCHN2 DERIVATIZACIÓN PARCIAL DERIVATIZACIÓN TOTAL Diagrama 5. Proceso de derivatización total. Fuente: Autores 5.4 Caracterización por Espectrofotometría UV: Se utilizara un espectrofotómetro UV-VIS marca Jenway modelo 6405 serial número 4063 para realizar la caracterización de la lignina, verificando la banda característica 280 a 290 nm. 5.5 Caracterización por Espectroscopía IR: Los espectros de infrarrojo (IR) son tomados en película de Bromuro de potasio utilizando un equipo Shimadsu IR Infinity 1. Estos análisis fueron realizados en el laboratorio de instrumental 2 de la Universidad Francisco José de Caldas, y son de tipo cualitativo. Para ello se ajustaron las variables instrumentales como velocidad, ganancia y velocidad del peine (actividades realizadas por el laboratorista de la universidad) Para analizar las muestras se utilizo el método de KBr, relación en peso 1:100 muestra /KBr. 25 5.6 Caracterización por Espectrofotometría Gases – Masas (GM-MS): El análisis se llevó a cabo en un cromatógrafo de gases Shimadzu GC 2010plus equipado con un puerto de inyección splitess. Se utilizó una columna capilar de dimetilpolisiloxano, (Restek Rxi GC Columns EE.UU.) de 30 m x 0,25 mm (d.i.) x 0,25 μm (df), con fase estacionaria 5% fenilo. La programación de temperatura del horno fue de 50 ºC (2 min) @ 15 ºC/min, hasta 200 ºC (2 min) @ 10 ºC/min, hasta 300°C (10 min). Los espectros de masas se obtuvieron por impacto de electrones (EI) de energía de 70 eV. Las temperaturas de la cámara de ionización y de la línea de transferencia fueron de 230 y 325 ºC, respectivamente. El gas de arrastre utilizado fue helio (99,995%, Aga Fano, S.A, grado 5), con flujo constante de 1,2 mL/min. Los espectros de masas y corrientes iónicas reconstruidas (TIC) fueron adquiridos usando un analizador cuadrupolar, por medio de barrido automático de frecuencia (full scan), a 4,75 scan s-1, en el rango de masas m/z 40-400. DETERMINACIÓN DE ACTIVIDADES BIOLÓGICAS A los ácidos Húmicos, lignina, lignanos obtenidos por aislamiento y extracción se les determinara su actividad antioxidante. 5.7 Actividad antioxidante: La capacidad de las muestras para captar radicales libres se midió con el método DPPH• modificado.23 A 2,0 mL de una solución metanólica de DPPH•, ajustada hasta tener una absorbancia de 0,9 se le añaden 1,0 mL del extracto acuoso u orgánico de la muestra. Se midió la absorbancia a 517 nm hasta que la reacción se estabilizó aproximadamente 15 min. La actividad se midió en un espectrofotómetro jenway modelo 6405 serial N. 4063, usando cubetas de cuarzo. 26 La metodología desarrollada fue la siguiente: 5.7.1 Preparación de soluciones: • Preparación del radical DPPH•: Se peso 3.9 mg de DPPH• en un matraz aforado previamente tarado y se disolvió en 100 mL de metanol, el matraz se cubrió con papel aluminio como protección contra luz. • Preparación de Trolox: Se preparó una solución stock 800 µM disolviendo 2 mg de acido 6-hidroxi-2,5,7,8-tetrametilcromo-2- carboxílico 97% (Trolox) de Aldrich Chemical Co, en 10 mL de metanol, luego se prepararon diluciones con rangos de concentración entre 100 µM y 700 µM, con el fin de realizar la curva de calibración. Como blanco de calibración del equipo se empleó metanol. • Preparación del Acido Ascórbico: Se preparo un solución stock 0,1 µg/mL disolviendo 5µg de acido ascorbico en 50 mL de metanol, luego se prepararon diluciones con rangos de concentración entre 0,005 y 0,06 µg/mL, como blanco del equipo se preparo metanol. 5.7.1.1 Preparación de la curva de calibración: A 2,0 mL DPPH•· se le adicionaron 0,1 mL de cada una de las diluciones de Trolox; la medición se realizó a 517 nm, y el porcentaje de inhibición se calculó con base en la siguiente ecuación 1: % 𝑑𝑑𝑑𝑑 𝑖𝑖𝑖𝑖ℎ𝑖𝑖𝑖𝑖𝑖𝑖𝑖𝑖𝑖𝑖ó𝑛𝑛 = A inicial − A final 𝑋𝑋100 A inicial Ecuación 1. El porcentaje de inhibición representa la pérdida del color violeta del radical DPPH•, cuando le es agregado un compuesto antioxidante, disminuyendo así la absorbancia de la solución, que es medida a 517 nm; la absorbancia inicial se toma en el minuto cero sin adición de trolox, la absorbancia final se toma 8 minutos después de agregar el trolox . 5.7.1.2 Medición de la inhibición generada por el patrón: A 2,0 mL DPPH•· se le adicionaron 0,1 mL de cada una de las diluciones de Ácido ascorbico; la medición se realizó a 517 nm, y el porcentaje de inhibición se calculó con la misma ecuación empleada para realizar la curva de calibración. 27 5.7.1.3 Medición de la actividad antioxidante de los extractos: En una celda de cuarzo se agregó 2,0 mL del radical DPPH• se midió la absorbancia a 517nm, luego se adicionaron 1 mL de la dilución del extracto y nuevamente se midió la absorbancia final a la misma longitud de onda 15 minutos después. 5.7.1.4 Determinación de la actividad total equivalente a trolox(TEAC): La actividad antioxidante total frente al catión radical DPPH• fue calculada mediante la ecuación 2; el TEAC equivale a decir la concentración de Trolox en µM/mL, con una capacidad antioxidante equivalente a la de una concentración 1 µM/mL de la sustancia problema. Para efectos de comparación se calculo el TEAC.24 µM Eq.Trolox/mL muestra= X (m ∗ mL muestra ∗ 1000) Ecuación 2 m: pendiente de la ecuación de la curva de calibración X: Abs inicial – Abs final 28 6. ANÁLISIS DE RESULTADOS Esta investigación fue abordada desde dos aspectos, el químico que consistió en conocer el rendimiento de extracción, que características fisicoquímicas, el análisis espectrofotométrico y el análisis espectroscópico de las muestras obtenidas; por otra parte el biológico que consistió en la actividad antioxidante de las muestras dando las a conocer este resultado en µM equivalentes a trolox. 6.1 Toma de muestra de carbón leonardítico: La muestra de carbón lignito (leonardita), analizada fue aportada por la empresa BIOTROPIC LTDA, de una mina de su propiedad que se encuentra en inmediaciones de la frontera noroccidental entre Boyacá y Santander, la muestra fue entregada pulverizada, tamaño de partícula de 250 µm (tamiz No.60), lista para ser analizada, en la tabla No 3 se describen los resultados obtenidos en cuanto a su composición de la muestra analizada. Parámetro evaluado Carbono Fijo Materia Volátil Humedad Nitrógeno Resultado obtenido 47% 38% 15% 1,2% Tabla 3. Composición del carbón de muestra Fuente: Instituto Agustin Codazzi 29 6.2 Análisis Químico: Este trabajo se realizó dos metodologías diferentes de extracción que consistían una por solventes orgánicos y otra por medio básico. Dando como resultado los siguientes resultados: • El método de Run Cang Sun obteniéndose un extracto seco de 13,58g y un rendimiento del 6,79%. • El método de NaOH – NaCl el extracto seco fue de 14,78g y su rendimiento fue de 4,93%. En la siguiente imagen se muestra como son los extractos sólidos los cuales son de un color marrón oscuro a negro que se observa en la figura 2. Extracto inicial Run Cang Sun Extracto inicial NaOH – NaCl Figura 2. Extractos iniciales Fuente: Autores 30 A estos se le realizaron unas pruebas de solubilidad que se muestran en las siguientes tablas 3 y 4: 6.2.1 Solubilidad de extractos: Extracto Run Cang Sun Solvente Etanol Diclorometano Acetona Tolueno Benceno 1,4 Dioxano Dimetilsulfoxido Piridina Diclorometano – 1,4 dioxano Tetrahidrofurano Dimetilsulfoxido – piridina Diclorometano – dimetilsulfoxido piridina Diclorometano – dimetilsulfoxido piridina – 1,4 dioxano Suspensión Parcialmente soluble Insoluble Insoluble Insoluble Parcialmente soluble Parcialmente soluble Parcialmente soluble Parcialmente soluble Soluble Parcialmente soluble – Parcialmente soluble – Parcialmente soluble Tabla 4. Solubilidad de extracto Run Cang Sun Fuente: Autores Como se aprecia en la Tabla 4 el extracto obtenido por el método de Run Cang Sun es una mezcla poco soluble en diferentes solventes orgánicos de polaridad media alta, dificultando los ensayos de propiedad antioxidantes, por esta razón se realiza una derivatización para mejorar la solubilidad asi reduciendo la complejidad por ende mejorando su solubilidad. El extracto total del método de Run Cang Sun es un extracto de baja polaridad lo hace poco soluble en todos los solventes orgánicos más utilizados. 31 Sosa – NaCl Extracto Solvente Suspensión Diclorometano Parcialmente soluble 1,4 Dioxano Insoluble Dimetilsulfoxido Insoluble Piridina Insoluble Etanol Parcialmente soluble Tolueno Piridina – Dimetilsulfoxido – 1,4 Parcialmente soluble Dioxano Soluble Tetrahidrofurano Tabla 5. Solubilidad de extracto Sosa - NaCl Fuente: Autores En la tabla 5 se apreciar que el extracto por el método de Sosa – NaCl también es un extracto de baja solubilidad como el del método utilizado de solventes orgánicos esto se debe a que las moléculas extraídas son polímeros orgánicos de alto peso molecular y de polaridades muy bajas lo que dificulta su solubilidad en diferentes solventes. A los extractos derivatizados se les realizo pruebas de solubilidad dando como resultado las siguientes tablas 5 y 6: Extracto Solvente Etanol Diclorometano Acetona 1,4 Dioxano Piridina Tetrahidrofurano Run Cang Sun Derivatizada Parcialmente Soluble Insoluble Insoluble Soluble Parcialmente soluble Soluble Tabla 6. Solubilidad de extracto Sosa – NaCl derivatizada Fuente: Autores 32 Extracto Sosa – NaCl Derivatizada Solvente Etanol Diclorometano Acetona 1,4 Dioxano Piridina Tetrahidrofurano Parcialmente Soluble Insoluble Insoluble Insoluble Soluble Soluble Tabla 7. Solubilidad de extracto Run Cang Sun derivatizada Fuente: Autores Se puede apreciar una mejora en solubilidad de estos extractos derivatizados ya que es soluble en solventes de polaridad media alta como el THF, la piridina y el etanol, esto permitió realizar pruebas antioxidantes cuyos resultados se mostraran más adelante. Extracto Sosa Acuoso Totalmente derivatizado. Muestra 1 Extracto Run Cang Sun Acuoso totalmente derivatizado. Muestra 2 Extracto Sosa Orgánico Totalmente derivatizado. Muestra 3 Figura 3. Extractos derivatizados Fuente: Autores 33 Extracto Run Cang Sun Parcialmente derivatizado. Muestra 4 6.2.2 Características espectrales UV-Vis de lignanos: Una característica espectral de algunas moléculas es que producen rotación especifica de la luz polarizada, esto se debe a las conjugaciones con los anillos aromáticos; en un espectro UV generalmente aparecen dos señales de similar intensidad entre 230 – 240 nm y entre 280 – 290 nm. Una característica importante de los lignanos, es que todos producen rotación específica de la luz polarizada. Las insaturaciones conjugadas con los anillos aromáticos originan desplazamientos de las señales. A los extractos obtenidos se les realizo este ensayo espectrofotométrico (gráfica 1 – 9) con el fin de conocer si existían moléculas con estas características espectrales dando como resultado positivo desde el primer extracto hasta su correspondiente derivatización viéndose picos de absorbancia en las longitudes de onda mencionadas anteriormente; conociendo la procedencia del carbón nos permite asegurar que estos extractos son ricos en moléculas de carácter polifenólicos es decir lignina, ácidos húmicos y/o fúlvicos.25 Extracto Run Cang Sun antes de derivatizar 3 2 1 0 200 Absorbancia 4 Longitud de onda (nm) Gráfico 1. Espectro UV-Vis Extracto Run Cang Sun antes de derivatizar Fuente: Autores 34 Extracto Run Cang Sun despues de derivatizar 3,5 Absorbancia 3 2,5 2 1,5 1 0,5 200 0 Longitud de onda (nm) Gráfico 2. Espectro UV-Vis Extracto Run Cang Sun despues de derivatizar Fuente: Autores Extracto Run Cang Sun Der Total en THF 1 0,6 0,4 0,2 -0,2 500 0 200 Absorbancia 0,8 Longitud de onda (nm) Gráfico 3. Espectro UV-Vis Extracto Run Cang Sun Derivatización Total en THF Fuente: Autores 35 Extracto NaOH - NaCl totalmente derivatizado en Piridina 2 Absorbancia 1,5 1 0,5 -0,5 200 0 Longitud de onda (nm) Gráfico 4. Espectro UV-Vis Extracto NaOH - NaCl totalmente derivatizado en Piridina Fuente: Autores Extracto Run Cang Sun totalmente derivatizado en Piridina 2 1 0,5 0 -0,5 200 Absorbancia 1,5 Longuitud de onda (nm) Gráfico 5. Espectro UV-Vis Extracto Run Cang Sun totalmente derivatizado en Piridina Fuente: Autores 36 500 350 0,9 0,8 0,7 0,6 0,5 0,4 0,3 0,2 0,1 0 -0,1 -0,2 200 Absorbancia Sosa Derivatización parcial en THF Longitud de onda (nm) Gráfico 6. Espectro UV-Vis Sosa Derivatización parcial en THF Fuente: Autores Run Cang Sun Derivatización Total en THF 3,5 2,5 2 1,5 1 0,5 500 350 0 200 Absorbancia 3 Longitud de onda (nm) Gráfico 7. Espectro UV-Vis Run Cang Sun Derivatización Total en THF Fuente: Autores 37 Sosa Derivatización Total en THF 3,5 Absorbancia 3 2,5 2 1,5 1 0,5 500 350 200 0 Longitud de onda (nm) Gráfico 8. Espectro UV-Vis Sosa Derivatización Total en THF Fuente: Autores Run Cang Sun Derivatización Parcial en EtOH 3,5 2,5 2 1,5 1 0,5 500 350 0 200 Absorbancia 3 Longitud de onda (nm) Gráfico 9. Espectro UV-Vis Run Cang Sun Derivatización Parcial en EtOH Fuente: Autores 38 6.2.3 Análisis de gases – masas de los extractos obtenidos: Las sustancias húmicas se extrajeron del carbón leonarditico empleando las técnicas Run Cang Sun y sosa de acuerdo con la metodología descrita en los numerales 5.1.1 y 5.1.2: la derivatización se efectuó de acuerdo a lo establecido en el numeral 5.2. En la siguiente figura se observa el perfil cromatográfico característico de las sustancias húmicas obtenidas por la técnica sosa, con derivatización parcial. En la tabla 8 se encuentran los compuestos identificados por comparación con la biblioteca NIST 2,0 a través de la base de datos MSD Chemstation G1701DAD.03.00611; se reportaron los compuestos que por comparación presentaban más de un 90% de coincidencia con el espectro de la biblioteca, también se presentan las concentraciones de cada uno de los componentes del extracto obtenidos por comparación con el patrón interno. Cromatrograma 1. Sosa Orgánica parcialmente derivatizada Fuente: Autores 39 N° Compuesto 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 Tetrahidro-2-furanol Dimetilsulfoxamonio formilmetiluro (S)-(+)-3-Hidroxitetrahidrofurano 1,3-Propanodiol, 2-(hidroximetil)-2-nitro Nonano 2-Metoxitetrahidrofurano Ácido - 4-hidroxi butanoico Undecano (patrón interno) 2-(metoximetil)- tetrahidrofurano Acido tetrahidro – 2 – furanil metil Ácido tetrahidro-2-furanil metil butanoico Anhidrido Butanoico 2-(metoximetil)- tetrahidro Furano 2-(metoximetil)- tetrahidro Furano Ácido tetrahidro-2-furanil metil butanoico Ácido tetrahidro-2-furanil metil butanoico Ácido tetrahidro-2-furanil metil butanoico Hexatriacontano Tetratriacontano Hexatriacontano Tiempo R 4,103 4,473 4,555 5,021 5,192 5,421 5,543 6,577 8,263 8,359 8,551 8,744 8,945 10,264 11,774 18,118 18,194 19,492 21,264 22,783 Área 111322126 8067876 3571612 2666384 3255648 17882361 5456800 291360529 630245 18848923 4956755 15490493 574392 959183 580012 1580192 1106543 3363107 2608550 1213490 ppm 2109040,9 153468,1 68311,6 51167,1 62327,4 339348,5 104015,9 5518859,2 12603,8 357654,6 94545,3 294047,9 11546,0 18833,7 11652,4 30595,3 21624,6 64362,6 50071,7 23650,2 Tabla 8. Compuestos identificados por análisis cromatográfico extracto Sosa Orgánico parcialmente derivatizado El siguiente cromatograma muestra el perfil característico de las sustancias húmicas obtenidas por la técnica Run Cang Sun, totalmente derivatizado. En la tabla 9 se encuentran los compuestos identificados por comparación con la biblioteca NIST 2,0 a través de la base de datos MSD Chemstation G1701DAD.03.00611; se reportaron los compuestos que por comparación presentaban más de un 90% de coincidencia con el espectro de la biblioteca. También se presentan las concentraciones de cada uno de los componentes del extracto obtenidos por comparación con el patrón interno. 40 Cromatograma 2. Run Cang Sun Acuoso totalmente derivatizado Fuente: Autores N° Compuesto 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 Tiempo R Tetrahidro – 2 –furanol Dimetilsulfoxonio formilmetiluro (S)-(+)-3-Hidroxitetrahidrofurano 1,3-Propanediol, 2-(hidroximetil)-2-nitro 3,7 – Dimetil undecano 2-Metoxitetrahidrofurano 3-Hidroxipropil oxirano Undecano (patrón interno) 2,10 – Dimetil undecano 2-Etoxitetraidrofurano Ácido tetrahidro – 2 – furanil metil butanoico Ácido tetrahidro – 2 – furanil metil butanoico Anhidro butanoico Tetrahidro -2 – metoximetil furano Tetrahidro -2 – metoximetil furano Área ppm 4,104 104468207 1979231,91 4,470 8944382 170068,563 4,547 4099833 78315,7405 5,013 2497437 47967,3314 5,192 3243093 62089,6042 5,417 19394498 367987,426 5,535 4775058 91104,0928 6,540 228384621 4326133,7 6,577 67260076 1274532,46 8,263 750139 14874,5663 8,355 20233263 383873,127 8,548 5518583 105186,006 8,741 17309356 328496,1 8,942 753438 14937,0473 10,283 2002490 38593,3352 Tabla 9. Compuestos identificados por análisis cromatográfico extracto Run Cang Sun totalmente derivatizado 41 En los esquemas 2, 3 y 4, se puede observar las posibles rutas de fragmentación de tres de los compuestos identificados por la biblioteca; el tetrahidro-2- furanol, el dimetil sulfoxonio formilmetiluro y el ((S)-(+)-3-Hidroxitetrahidrofurano). Cromatograma 3.Pico 1(Tetrahidro – 2 – furanol) Fuente: Autores Esquema 2. Rompimiento de masas (Tetrahidro – 2 – furanol) Fuente: Autores 42 Cromatograma 4.Pico 2 (Dimetilsulfoxonio formilmetiluro) Fuente: Autores Esquema 3. Rompimiento de masas (Dimetilsulfoxonio formilmetiluro) Fuente: Autores 43 Cromatograma 5.Pico 3 ((S)-(+)-3-Hidroxitetrahidrofurano) Fuente: Autores Esquema 4. Rompimiento de masas ((S)-(+)-3-Hidroxitetrahidrofurano) Fuente: Autores La cromatografía de gases y el uso de ionización química en espectrometría de masas (GC-MS) revelaron patrones de fragmentación diastereoespecíficos que sirvieron para diferenciarlos. A pesar de que los resultados de las muestras por infrarrojo, corroboraron la presencia de grupos funcionales alcohol y acido ligados a anillos aromáticos, el corrimiento de estas mismas por gases masas no confirmo los datos, esto puede ser debido a que la columna utilizada era de polaridad media baja y lo ideal era contar con una columna polar ya que las sustancias allí encontradas tenían estas características de polaridad alta según las pruebas de solubilidad realizadas en el laboratorio, además de esto al contar con sustancias tan altamente polares el 44 analista del laboratorio determinó que la forma de análisis adecuada de las muestras sin poner en peligro la columna era dejar correr el solvente (tetrahidrofurano) por 4 min antes de empezar la identificación de la muestra, acción que abre la posibilidad a que moléculas importantes hayan salido unidas al solvente antes de ser identificadas. 6.2.4 Características espectrales IR de extractos obtenidos: El análisis de los extractos obtenidos por las técnicas Sosa y Run Cang Sun en el infrarrojo se realizó de acuerdo al numeral 5.4, en las siguientes graficas se encuentran los espectro IR obtenidos para los extractos de Run Cang Sun total y parcialmente derivatizados y de Sosa totalmente derivatizado. 45 Espectro IR 1. Run Cang Sun Acuoso Totalmente Derivatizado Fuente: Autores 46 Espectro IR 2. Run Cang Sun Orgánica Totalmente Derivatizado Fuente: Autores 47 Espectro IR 3.Sosa - NaCl Acuoso Totalmente Derivatizado Fuente: Autores 48 En la tabla 10 se puede observar de manera resumida las principales bandas identificadas en los anteriores espectros infrarrojos, así como los grupos funcionales atribuibles a tales bandas Muestra analizada Pico Característico para Run cang sun acuoso derivatizado 1197 1400 1637 1656 2850 2953 3448 c-o-c, C(CH3)3 C=C C=C Anillo aromatico C-H O-H 1002 1172 S=O Sulfonatos sulfonamidas C=N, NO2 Anillo aromatico RCO-O-COR' Anillo aromatico O-H 1637 2850 2920 3037 3446 Run cang sun orgánico derivatizado 1095 1139 1400 3035 3138 Sosa acuosa derivatizada S=O Sulfonatos sulfonamidas C=N, NO2 Anillo aromatico RCO-O-COR' Tabla 10. Bandas características de los IR. Fuente: Autores Al realizar la comparación de las bandas obtenidas en los espectros de las muestras analizadas, con espectros IR reportados en artículos científicos26 para lignanos como el matairresinol, arctigenina, pinoriesinol, entre otros, se confirma la presencia de bandas características, correspondientes a los grupos funcionales como lactona, sulfona, grupos aromáticos, alcoholes, dobles enlaces entre otros. 49 6.3 Análisis Biológico: 6.3.1 Determinación de la capacidad antioxidante: La actividad antioxidante se determinó de acuerdo a los parámetros establecidos en el numeral 5.6.1. 6.3.1.1 Preparación de curvas de calibración y comparación: Con el fin de expresar los resultados de actividad antioxidante en términos de µM equivalentes de trolox/mL (ecuación 1), se realizo la curva de calibración con soluciones de trolox en concentraciones de 100 a 800 µM y se realizó la medición del porcentaje de inhibición empleando la ecuación 2. Los resultados de la medición del porcentaje de inhibición se encuentran en la tabla 11 corroborando una efectividad del trolox entre un 19% y un 79% para las concentraciones evaluadas. TROLOX µM 100 200 400 600 800 Absorbancia inicial (ƛ 517 nm) 0,903 0,910 0,907 0,899 0,907 Absorbancia Final (ƛ 517 nm) 0,729 0,691 0,522 0,345 0,187 % de inhibición 19,0 24,0 42,0 62,0 79,0 Tabla 11. Datos para la curva de calibración con trolox Fuente: Autores Partiendo de los datos obtenidos de la inhibición de DPPH•, por parte del trolox, se construyó una curva de calibración (Gráfica 10) que permite verificar la dependencia lineal del % de inhibición del radical Vs. la concentración del trolox obteniéndose un R2 de 0,996. 50 Inhibición DPPH (%) 1 y = 0,000x + 0,080 R² = 0,996 Inhibición % 0,8 0,6 0,4 0,2 0 0 200 400 600 TROLOX µM 800 1000 Gráfica 10. Curva de calibración del porcentaje de inhibición Vs concentración Trólox Fuente: Autores Se determinó la actividad del ácido ascórbico (vitamina C) en concentraciones de 0,005 a 0,06 µg/mL (tabla 12), para tomarlo como patrón de comparación en cuanto a porcentaje de inhibición. 6.3.1.2 Determinación de la actividad antioxidante de Vitamina C frente a DPPH•: Vitamina C (µg/mL) Vitamina C (ppm) 0,005 0,01 0,02 0,04 0,06 5 10 20 40 60 Absorbancia Inicial (ƛ 517 nm) 0,902 0,891 0,908 0,910 0,900 Absorbancia Final (ƛ 517 nm) 0,603 0,527 0,443 0,186 0,016 Tabla 12. Datos para la curva de calibración con Vitamina C Fuente: Autores 51 Inhibición DPPH• (%) 33,1 40,9 51,2 79,6 98,2 Teniendo en cuenta los resultados obtenidos de la actividad antioxidante de la vitamina C se elaboro la gráfica 11, que nos permite corroborar un comportamiento lineal de la misma. Inhibición DPPH (%) 120,0 Inhibicón (%) 100,0 80,0 60,0 40,0 20,0 0,0 0 0,01 0,02 0,03 0,04 0,05 0,06 0,07 Vitamina C (µg/ml) Gráfica 11. Curva de calibración del porcentaje de inhibición Vs Vitamina C Fuente: Autores 6.3.2 Actividad antioxidante de los extractos: En la tabla 13 se encuentran los resultados obtenidos de la actividad antioxidante de los extractos, en ella se describe el tipo de extracto, concentración inicial, diluciones evaluadas, el cálculo del porcentaje de inhibición obtenido de las dos replicas para cada dilución, el promedio y la desviación estándar correspondiente. 52 Muestra 1 Muestra 2 Muestra 3 Muestra 4 Concentración (µg/mL) % de inhibición Concentración (µg/mL) % de inhibición Concentración (µg/mL) % de inhibición Concentración (µg/mL) % de inhibición 1200 92,0 1200 99,5 1200 79,1 1200 79,5 90,3 98,7 80,5 80,0 Promedio 91,2 Promedio 99,1 Promedio 79,8 Promedio 79,8 Desviación estándar 0,9 Desviación estándar 0,4 Desviación estándar 0,7 Desviación estándar 0,3 600 41,0 600 56,2 600 34,8 600 44,2 42,8 54,3 35,9 43,8 Promedio 41,9 Promedio 55,3 Promedio 35,4 Promedio 44,0 Desviación estándar 0,9 Desviación estándar 1,0 Desviación estándar 0,6 Desviación estándar 0,2 300 27,5 300 34,2 300 19,3 300 24,3 26,0 32,7 17,9 25,0 Promedio 26,8 Promedio 33,5 Promedio 18,6 Promedio 24,7 Desviación estándar 0,8 Desviación estándar 0,8 Desviación estándar 0,7 Desviación estándar 0,4 150 15,8 150 21,8 150 11,6 150 12,3 14,7 22,6 12,9 12,7 Promedio 15,3 Promedio 22,2 Promedio 12,3 Promedio 12,5 Desviación estándar 0,6 Desviación estándar 0,4 Desviación estándar 0,7 Desviación estándar 0,2 Tabla 13. Resultados de actividad antioxidante en términos de inhibición de DPPH• de los extractos. Fuente: Autores Nota: Muestra 1. Sosa acuosa derivatizada totalmente, Muestra 2. Run Cang Sun acuoso totalmente derivatizado, Muestra 3. Sosa orgánica totalmente derivatizada, Muestra 4. Sosa orgánica parcialmente derivatizada 6.3.2.1 Determinación de la actividad antioxidante equivalente a trolox de los extractos (TEAC). La actividad antioxidante total, se calculó de acuerdo al numeral 5.6.1.4, según la ecuación 2, tomando como base la ecuación de la recta de calibración: y = 0,0009x + 0,0809, los resultados son plasmados en la tabla 14 y se reportan en equivalentes trolox/mL de muestra. 53 Muestra 1 Muestra 2 Concentración (µg/mL) % de inhibición µM equivalente a trolox/mL Concentración (µg/mL) % de inhibición µM equivalente a trolox/mL 1200 600 300 150 92 41 26 14,7 0,85 0,29 0,16 0,07 1200 600 300 150 98,7 54,3 34,2 21,8 0,96 0,59 0,27 0,15 Muestra 3 Muestra 4 Concentración (µg/mL) % de inhibición µM equivalente a trolox/mL Concentración (µg/mL) % de inhibición µM equivalente a trolox/mL 1200 600 300 150 79,1 34,8 19,3 11,6 0,71 0,31 0,08 0,02 1200 600 300 150 79,5 44,2 24,3 12,3 0,71 0,33 0,16 0,03 Tabla 14. Resultados de actividad antioxidante equivalente a trolox (TEAC) de los extractos. Fuente: Autores Los valores de Inhibición y TEAC calculados para los extractos obtenidos por ambas técnicas son similares en todos los puntos evaluados, siendo un poco más altos los obtenidos para la técnica Run Cang Sun extracto acuoso totalmente derivatizado (muestra 2). En la tabla 14 se realiza una comparación del valor calculado de TEAC para la dilución que presento el mayor porcentaje de inhibición de cada uno de los extractos, con valores de TEAC reportados en la literatura para flavonoides con alta capacidad antioxidante como la quercitina27, o ácidos fenólicos de mediana capacidad antioxidante como el ácido cafeico.28 Se puede deducir que la capacidad antioxidante de los extractos expresada en términos de TEAC es media, esto debido a la presencia de derivados de fenilpropanoides, fenoles o sustancias donadoras de protones en la composición de los extractos. Comparando el porcentaje de inhibición logrado por los extractos contra la inhibición obtenida por el patrón de ácido ascórbico, los resultados obtenidos por las muestras analizadas fueron un poco bajas, sin embargo se debe tener en cuenta que el ácido ascórbico es una sustancia con una gran capacidad antioxidante, y las muestras analizadas no se encontraban en estado puro, es decir aquellas sustancias que podrían haber tenido capacidad antioxidante, pueden estar ligadas a otras que pueden interferir con esta propiedad. 54 Extracto Muestra 1 Muestra 2 Muestra 3 Muestra 4 Quercitina Ácido Cafeico TEAC (µM) 0,85 0,96 0,71 0,71 4,70 1,26 Tabla 15. Capacidad antioxidante de los extractos expresada en términos de TEAC Fuente: Autores En este trabajo se utilizo el método de decoloración del DPPH• para la determinación de la actividad antioxidante, la cual es una técnica efectiva para la búsqueda de nuevas sustancias o mezclas antioxidantes. Sin embargo, la efectividad de un antioxidante depende de una variedad de factores que, incluyen, la polaridad, solubilidad y la actividad quelante de metales, entre otros, por esta razón, es necesario evaluar las posibles sustancias antioxidantes a través de diferentes metodologías, con el fin de poder descartar una sustancia como antioxidante de manera definitiva. 55 7. CONCLUSIONES • Partiendo de los resultados obtenidos podemos afirmar que el método de Run Cang Sun es más eficiente que el método Sosa en cuanto a eficiencia, sin embargo para valorar un resultado hay que tener en cuenta otros aspectos importantes, como lo son los reactivos empleados en la extracción, el costo de los mismos; en cuanto estos dos últimos factores el método de Run Cang Sun es más costoso y peligroso debido a que uno de los componentes principales de la mezcla extractora es el tolueno • Por medio de análisis espectrofotométricos de UV-Vis se identificaron bandas características reportadas en la literatura para sustancias húmicas permitiendo corroborar de cierto modo la presencia de las mismas, permitiendo así continuar con la investigación, cuyo enfoque principal era la comprobación de la capacidad antioxidante de las mismas. • El análisis infrarrojo realizado a los extractos permitió realizar comparaciones entre las señales identificadas con otras bandas reportadas en estudios realizados sobre lignanos y derivados fenólicos con características antioxidantes, las cuales mostraron gran similitud reconociendo así la presencia de sustancias con características antioxidantes, información que pudo ser corroborada luego por los resultados obtenidos de esta actividad. • El proceso de derivatización fue efectivo permitió romper los polímeros aromáticos aumentando su solubilidad y permitiendo separación de sus sustancias constituyentes por cromatografía de gases. • Las sustancias separadas por cromatografía de gases e identificadas por masas a través de comparación con biblioteca NIST, no poseen actividad antioxidante importante esto debido a que las sustancias antioxidantes que pueden extraerse de la matriz del carbón, (derivados de sustancias húmicas) poseen un carácter bastante polar, siendo estos poco incompatibles con la columna empleada, por tanto se identificaron en el carbón aquellas sustancias que fueron más compatibles con la columna y fueron separadas por ella de manera más adecuada. • El realizar pruebas como la espectrofotometría de masas, UV-Vis y espectroscopía IR permitió corroborar varios aspectos importantes como características estructurales de los compuestos, cuantificación de moléculas existentes, lo que podría permitir la determinación del rendimiento la extracción de cada uno de los compuestos y nos permite afirmar algunas moléculas existentes en los extractos. 56 • Los 4 extractos obtenidos poseen una actividad antioxidante muy similar esto puede ser que tanto el método de extracción como su correspondiente derivatización se realizaron de manera adecuada obteniendo 2 posibilidades la primera es haber obtenido los mismos compuestos por ambos métodos y la segunda que las sustancias obtenidas tengan actividad antioxidante muy cercanas. Los extractos obtenidos presentaron una actividad antioxidante comparada con la que posee el acido caféico, que es una sustancia antioxidante de mediana capacidad. • La muestra N° 2 es la que posee mayor actividad lo que induce a pensar que es un extracto con un porcentaje mayor de compuestos de tipo fenólico lo que permite tener obtener este resultado. 57 8. RECOMENDACIONES • Para próximas investigaciones se recomienda utilizar el método de NaOH – NaCl porque es más económico, menos contaminante y su tiempo de operación es menor que la extracción orgánica. Además el rendimiento del método inorgánico podría mejorarse realizando ensayos aumentando la concentración de los reactivos. • Debido a que el proceso de derivatización empleado fue efectivo y un proceso netamente químico, se puede plantear otra metodología en la cual se utilice reactivos de menor contaminación o un proceso físico como la termoquimolisis. • Es necesario determinar otra metodología para él análisis por CGM ya que la utilizada no permitió corroborar la presencia de moléculas con características antioxidantes. • Se sugiere realizar otros ensayos que permitan corroborar de manera definitiva la actividad antioxidante como lo es el método de ABTS. 58 9. BIBLIOGRAFIA 1. Encolombia.com, El carbón en la sociedad Colombina, [en línea] [10 de septiembre de 2011] disponible en : <http://www.encolombia.com/economia/Elcarbon/Elcarbonencolombia.htm> 2. Boluda Carlos J, Duque Beatriz, Gulgas Gergely, Lignanos (3) enterolignanos y actividad estrogenica, revista de fitoterapia, 2006, Vol 6, Issue 1, 45-57 p. Revista de Fitoterapia. Fitoterapia.net. Disponible en: < http://www.fitoterapia.net/revista/pdf/Lignans3.pdf > 3. MINISTERIO DE MINAS Y ENERGIA. Cadena del carbón [en línea].< http://www.upme.gov.co/Docs/Cadena_carbon.pdf> [citado en 12 de marzo de 2012] 4. OIKOS SOLUTIONS. ¿Qué es la leonardita? [en línea]. <http://www.oikossolutions.com/noticia/26/LEONARDITA%20editada.pdf> [citado en 08 de marzo de 2012]. 5. REGNAULT-ROGER, Catherine. PHILOGÉNE, Bernard J.R., VINCENT. Charles. TERRÓN, Urbano, Biopesticidas de origen vegetal, Madrid, Grupo Mundi-Prensa, 2003. 70 p. ISBN: 84-8476-194-0. 6. BOLUDA. Carlos, DUQUE. Beatriz, Aragón. Zulma. Lignanos (I) estructura y funciones en las plantas.Barcelona, 2005; Vol 5, Issue 1, 55-68 p. Revista de Fitoterapia. Fitoterapia.net. Disponible en: < http://www.fitoterapia.net/revista/pdf/5568%20RDF%205.1%20LIGNANOS. pdf> 7. COLECCIÓN DE TESIS DIGITALES UNIVERSIDAD DE LAS AMÉRICAS PUEBLA. Aislamiento de levaduras que tengan la capacidad de degradar lignina y búsqueda de algunos genes implicados en dicha degradación [en línea].<http://catarina.udlap.mx/u_dl_a/tales/documentos/mbt/olvera_a_p/ca pitulo5.pdfZ>[citado 12 de marzo de 2012] 59 8. ROJAS AGUILAR, Marcela. Extracción de lignina proveniente de residuos agroindustriales para su empleo en procesos de gasificación. Ciudad de México, 2004, 7-9 p. Trabajo de grado (Ingeniera Química).Universidad Autónoma Metropolitana. Facultad de Ingeniería. Disponible en: <http://148.206.53.231/UAMI12063.PDF> 9. NUÑEZ SOLÍS, Jorge. Fundamentos de edafología, Costa Rica, Editorial Universidad Estatal a Distancia San José, 1981. 117p. ISBN: 9977-64-148-x 10. YOUNGSON, Dr. Robert. Antioxidantes y radicales libres, Madrid, Editorial EDAF S.A, 1994. 113 p. ISBN: 84-414-1230-8. 11. PATIÑO, J.F. Lecciones de cirugía, Bogotá, Editorial Medica Panamericana, 2000. 87 p. ISBN: 958-9181-45-7 12. HSIN-LING. Yang, YOU-CHENG. Hseu, YI-TING. Hseu, FUNG-JOU. Lu, ELONG. Lin, JIM-SHOUNG. Lai. Humic acid induces apoptosis in human premyelocytic leukemia HL-60 cells. Taiwan, 2004; Vol. 75, Issue 15, 18171831 p. Life Sciences. SciencieDirect. Elsevier. Disponible en: < http://www.sciencedirect.com/science/article/pii/S0024320504004874> 13. HUNG-CHIH. Ting, CHENG-CHIEH. Yen, WEN-KANG. Chen, WEN-HUEI. Chang, MING-CHIH. Chou, FUNG-JOU. Lu, Humic acid enhances the cytotoxic effects of arsenic trioxide on human cervical cancer cells. Taiwan, 2010; Vol 29, Issue 2, 117-125 p. Environmental Toxicology and Pharmacology. SciencieDirect. Elsevier. Disponible en: < http://www.sciencedirect.com/science/article/pii/S138266890900177X> 14. COZZI. R, NICOLAI. M, PERTICONE. P, DE SALVIA. R, SPUNTARELLI. F. Desmutagenic activity of natural humic acids: inhibition of mitomycin C and maleic hydrazide mutagenicity. Roma, 1993; Vol 299, Issue 1, 37-44 p. Mutation Research/Genetic Toxicology. SciencieDirect. Elsevier. Disponible en: < http://www.sciencedirect.com/science/article/pii/016512189390117V> 15. VASKOVÁ, J., VELIKÁ, B., PILÁTOVÁ, M., KRON, I., & VASKO, L. Effects of humic acids in vitro. República Checa, 2011; Vol 47, Issue 5-6, 376-382 p. In Vitro Cellular & Developmental Biology. US National Library of Medicine National Institutes of Health. NCBI. Elservier. Disponible en: < http://www.ncbi.nlm.nih.gov/pubmed/21487922> 60 16. MOHD. Aamir Mirza, NIYAZ. Ahmad, SURAJ PRAKASH. Agarwal, DANISH. Mahmood, KHALID ANWER. M, IQBAL. Z. Comparative evaluation of humic substances in oral drug delivery. New Delhi, 2011; Vol 1, Issue 1, 16-26 p. Results in Pharma Sciences. SciencieDirect. Elsevier. Disponible en: < http://www.sciencedirect.com/science/article/pii/S2211286311000054> 17. MIROSLAW. T., KRZYSZTOF. D., DANUTA. G., BOGDAN. S., HPLC determination of phenolic acids and antioxidant activity in concentrated peat extract a natural immunomodulator, Wroclawskie, 2006, Vol 14, Issue 1, 182 – 188 p. Journal of Pharmaceutical and Biomedical Analysis. SciencieDirect. Elsevier. Disponible en:< http://www.sciencedirect.com/science/article/pii/S0731708505007144> 18. MACRAE. W.Donald, TOWERS. G.H.Neil. Biological activities of lignans. Vancouver, 1984; Vol 23, Issue 6, 1207-1220 p. Phytochemistry. SciencieDirect. Elsevier. Disponible en: <http://www.sciencedirect.com/science/article/pii/S0031942200804288> 19. AEHLE. E, MÜLLER. U, EKLUND. Pc, WILLFÖR. Sm, SIPPL. W, DRÄGER. B. Lignans as food constituents with estrogen and antiestrogen activity. Halle-Wittenber; 2011; Vol 72, Issue 18, 2396 p. Phytochemistry. NCBI. Elsevier. Disponible en:< http://www.ncbi.nlm.nih.gov/pubmed/21889775> 20. RUN-CANG. Sun. TOMKINSON. J, ZHU. W, WANG. Sq. Delignification of maize stems by peroxymonosulfuric acid, peroxyformic acid, peracetic acid, and hydrogen peroxide. Physicochemical and structural characterization of the solubilized lignins. United Kingdon; 2000; Vol 48, Issue 4, 1253-1262 p. Journal of agricultural and food chemistry. NCBI. Elservier.1 Disponible en:< http://www.ncbi.nlm.nih.gov/pubmed/21889775> 61 21. ORTER. Risoleta, PRADO. Soizic, REGALADO. Erik, VALERIOTE. Frederick, MEDIA. Joseph, MENDIOLA. Judith, THOMAS. Olivier. Furfuranlignans and a flavone from Artemisia gorgonum Webb and their in vitro activity against Plasmodium falciparum. France, 2011; Vol 138, Issue 2, 637-640 p. Journal of Ethnopharmacology. SciencieDirect. Elsevier. Disponible en: < http://www.sciencedirect.com/science/article/pii/S0378874111007100> 22. GRASSET. Laurent, VLCKOVÁ. Zoja, KUCERIK. Jiri, AMBLÉS. André, Characterization of lignin monomers in low rank coal humic acids using the derivatization/reductive cleavage method, 2010; Vol 41, Issue 9, 905 – 909 p. Organic Geochemistry. SciencieDirect. Elsevier. Disponible en: < http://www.sciencedirect.com/science/article/pii/S0146638010000847> 23. W. BRAND, Williams. M.E, Cuvelier. C, Berset. Use of a free radical method to evaluate antioxidant activity. LWT - Food Science and Technology. Francia, 1995; Vol 28, Issue 1, 25 – 30 p. SciencieDirect. Elsevier. Disponible en: < http://www.sciencedirect.com/science/article/pii/S0023643895800085> 24. LEYVA DANIEL. Diana Elizabeth. Determinación de antiocianinas, fenoles totales y actividad antioxidante en licores y fruto de mora. Oaxaca, 2009, 30 -77 p. Tesis (Ingeniera de Alimentos).Universidad Tecnológica de la Mixteca. Facultad de Ingeniería. Disponible en: <http://jupiter.utm.mx/~tesis_dig/10876.pdf> 25. UNIVERSIDAD DE ANTIOQUIA. Facultad de Química Farmaceutica. Introducción al metabolismo secundario compuestos derivados del ácido shikimico [en línea]. < http://farmacia.udea.edu.co/~ff/shikimico.pdf>. 26. OPLETAL. Lubomí, SOVOVÁ. Helena, BÁRTLOVÁ. Milena. Dibenzo[a,c]cyclooctadiene lignans of the genus Schisandra: importance, isolation and determination. Journal of Chromatography B. Republica Checas, 2004; Vol 812, Issue 1-2, 357-371 p. SciencieDirect. Elsevier. Disponible en: < http://www.sciencedirect.com/science/article/pii/S1570023204006464> 62 27. RICE EVANS. Catherine, J MILLER. Nicholas, PAGANGA. George. Activity relationships of flavonoids and phenolic acids. Free Radical Biology and Medicine. Londres, 1996; Vol 20, Issue 7, 933-956 p. SciencieDirect. Elsevier. Disponible en: <http://www.sciencedirect.com/science/article/pii/0891584995022279> 28. GOLDSTEIN. J.L., Changes in tanin in ripening fruits. Phytochem. Cambridge, 1963; Vol 2, Issue 37, 371-383 p. Phytochemistry. SciencieDirect. Elsevier. Disponible en: <http://www.sciencedirect.com/science/article/pii/S0031942200848608> 63