Document
Anuncio
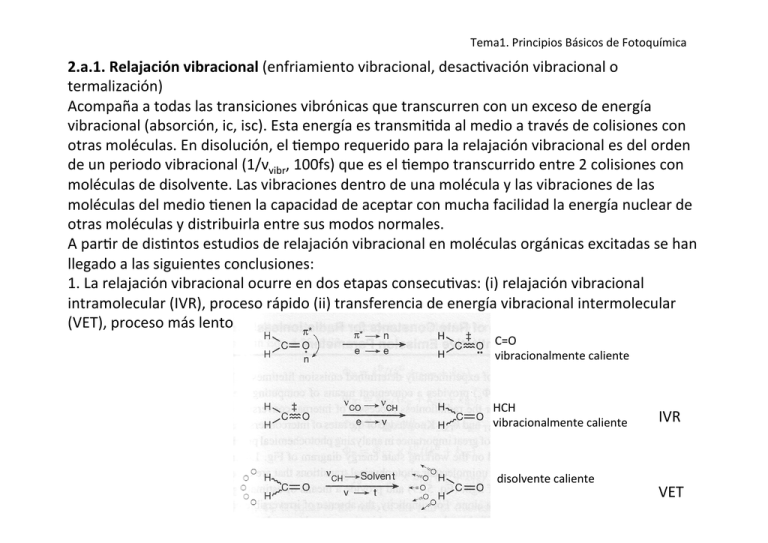
Tema1. Principios Básicos de Fotoquímica 2.a.1. Relajación vibracional (enfriamiento vibracional, desac>vación vibracional o termalización) Acompaña a todas las transiciones vibrónicas que transcurren con un exceso de energía vibracional (absorción, ic, isc). Esta energía es transmi>da al medio a través de colisiones con otras moléculas. En disolución, el >empo requerido para la relajación vibracional es del orden de un periodo vibracional (1/νvibr, 100fs) que es el >empo transcurrido entre 2 colisiones con moléculas de disolvente. Las vibraciones dentro de una molécula y las vibraciones de las moléculas del medio >enen la capacidad de aceptar con mucha facilidad la energía nuclear de otras moléculas y distribuirla entre sus modos normales. A par>r de dis>ntos estudios de relajación vibracional en moléculas orgánicas excitadas se han llegado a las siguientes conclusiones: 1. La relajación vibracional ocurre en dos etapas consecu>vas: (i) relajación vibracional intramolecular (IVR), proceso rápido (ii) transferencia de energía vibracional intermolecular (VET), proceso más lento. C=O vibracionalmente caliente HCH IVR vibracionalmente caliente disolvente caliente VET Tema1. Principios Básicos de Fotoquímica Energía potencial Energía potencial 1. Supongamos el estado excitado S1 de la molécula de formaldehído (S1, v=0). 2. A con>nuación >ene lugar un proceso de ic S1 èS0. De manera que generamos formaldehído vibracionalmente caliente ya que el movimiento del electrón π*-­‐> n se encuentra acoplado con la tensión C=O. Este modo normal es un canal de relajación hasta el S0. 3. El grupo C=O vibracionalmente excitado transferirá su energía intramolecularmente a la flexión C-­‐H (IVR) 4. Finalmente este exceso de energía será transferido al disolvente (VET). Las moléculas de disolvente próximas al formaldehído que se desexcita aumentarán su energía traslacional y vibracional. 2.a.2. Transiciones radia5vas Pueden ser de dos clases: fluorescencia y fosforescencia según la mul>plicidad del estado que emite. Se trata de procesos ver>cales que pueden explicarse a través del principio de Franck-­‐ Condon. La estructura fina vibracional estará determinada p por el solapamiento de las funciones de los niveles vibrónicos del estado fundamental y excitado. Este solapamiento será máximo para la transición más probable (más intensa en los espectros de fluorescencia/ Distancia internuclear Distancia internuclear fosforescencia). Tema1. Principios Básicos de Fotoquímica Fluorescencia: se produce cuando la transición radia>va >ene lugar desde un estado de la misma mul>plicidad que el fundamental. Al tratarse de un proceso permi>do >ene lugar en escalas de >empo rápidas (picosegundos o microsegundos). Coeficiente Intensidad de de Fluorescencia absorción molar Absorción Fluorescencia Caracterís5cas del espectro de fluorescencia: 1. Es bastante común la existencia un plano de simetría entre los espectros de absorción y de emisión. 2. La banda 0-­‐0 para la absorción y fluorescencia ocurre prác>camente a la mima longitud de onda. 3. La emisión por fluorescencia ocurre a longitudes de onda mayores (menor energía) que la banda 0-­‐0, mientras que la absorción ocurre a longitudes de onda menores (mayor energía). Tema1. Principios Básicos de Fotoquímica 4. El espectro de absorción muestra una estructura vibracional caracterís>ca del S1 y el espectro de fluorescencia muestra la estructura vibracional caracterísi>ca del S0. Explicación: La absorción ocurre desde S0 (v=0) y la emisión ocurre desde el S1 (v=0) debido a la rápida relajación vibracional. La fluorescencia debe ocurrir a menores energías que la absorción debido a que la especie excitada cede energía al entorno antes de emi>r (3). A través de los diagramas de energía es sencillo comprender porque la banda 0-­‐0 para la fluorescencia y la absorción ocurren a la misma longitud de onda. Esto es debido a que están involucrados los mismos niveles vibracionales. (2) Las pequeñas diferencias entre estas bandas serán debidas a las dis>ntas estructuras que adoptan las moléculas de disolvente en torno al S0 y al S1. Desplazamiento de Stokes: es el desplazamiento entre el máximo de absorción y emisión. En moléculas muy rígidas donde las geometrías del S0 y el S1 son parecidas vamos a tener una relación especular entre los espectros de absorción y de emisión. Esto es debido a que la separación entre niveles vibracionales en el S0 y el S1 es muy similar. (1 y 4). Tema1. Principios Básicos de Fotoquímica Coeficiente de absorción molar Intensidad de Fluorescencia Absorción Fluorescencia Tema1. Principios Básicos de Fotoquímica Regla de Kasha. Una propiedad general de los espectros de fluorescencia es que normalmente se ob>ene el mismo espectro de emisión independientemente de la longitud de onda de excitación. Tras la excitación a un nivel electrónico y vibracional energé>co, el exceso de energía es rápidamente disipado, generándose el fluoróforo en el estado electrónico excitado de menor energía. Esta relajación ocurre en un >empo de 1fs y suele ser el resultado del fuerte solapamiento entre estados vibrónicos isoenergé>cos. Por regla general la fluorescencia siempre se origina desde el estado vibracional más bajo del estado electrónico excitado menos energé>co. Excepción a la regla de Kasha. El azuleno. 374nm Emisión Absorción Coeficiente de absorción molar Intensidad de Fluorescencia 585nm Absorción Tema1. Principios Básicos de Fotoquímica € El máximo de fluorescencia ocurre a 374 nm mientras que el máximo de la absorción S0-­‐>S1 ocurre a 585 nm. Los estados S2 y el estado S1 se encuentran muy lejos energé>camente, lo que hace que la ic entre estos dos estados (que suele ser muy rápida) sea poco eficiente (al ser los factores Franck-­‐Condon pequeños). Sin embargo los estados S1 y S0 están muy próximos en energía. Rendimiento cuán5co: representa el cociente entre el número de fotones emi>dos y el número de fotones absorbidos, la fracción de moléculas que fluorece. Jf φ f = J abs Las substancias con los rendimientos cuán>cos más elevados (cercanos a la unidad) son los que presentan emisiones más fuertes. Desde el S1, la emisión por fluorescencia compite con otros procesos isicos de desac>vación a través de los cuales las moléculas pueden volver al estado fundamental: ic, isc que también llevan asociados sus correspondientes rendimientos cuán>cos. ϕ oscila entre valores comprendidos entre 0 y 1. ϕf= 0 no se produce fluorescencia, si ϕf= 1, la fluorescencia es el único proceso para volver al estado fundamental. Por lo general el gap energé>co S0-­‐S1 es grande y supone que ϕic< ϕf, ϕisc lo que implica que en la prác>ca ϕf+ ϕisc=1 (Regla de Ermolev). 1 = φ f + φ isc + φ ic Tema1. Principios Básicos de Fotoquímica Ejemplos de procesos naturales de fluorescencia: Algunos corales, algas, peces e invertebrados como las esponjas, moluscos etc… bajo ciertas condiciones de irradiación son capaces de emi>r por fluorescencia. Esta fluorescencia >ene generalmente su origen en pigmentos derivados de la proteína verde fluorescente (GFP) que valió el Premio Nobel en 2008 a los inves>gadores Osamu Shimomura, Mar>n Chalfie, Roger Y. Tsien. Esta proteína fue aislada por primera vez en la medusa Aequorea victoria. Cuando se ilumina esta proteína con luz azul, emite en el rango del verde-­‐amarillo. En biología molecular y biología celular, el gen de la GFP se acopla a otros genes para codificar proteínas de interés cuya función se quiere estudiar. Las nuevas proteínas pueden ser detectadas en células vivas, de manera que es posible conocer su posición y su migración en organismos vivos. Funciones de estos pigmentos: -­‐ Conversión de luz de λ más corta en luz de λ más larga u>lizada para llevar a cabo la fotosíntesis. -­‐ Protección frente al sol para corales en zonas menos profundas. -­‐ Reconocer predadores y defender el territorio. Tema1. Principios Básicos de Fotoquímica Intensidad Fosforescencia: surge como resultado de una transición radia>va entre estados de dis>nta mul>plicidad, T1-­‐>S0. Al tratarse de un proceso prohibido por spín es de esperar que tenga lugar en escalas de >empo mayores que la fluorescencia. La población directa del triplete a par>r de la absorción del singlete cons>tuye un proceso bastante ineficiente al estar prohibido por spín. En su lugar los estados triplete son accedidos indirectamente a par>r de la excitación de estados singlete seguidos de un proceso de cruce entre sistemas. Una vez poblado el triplete se producen procesos rápidos de conversión interna (sólo cuando el isc se produce a un estado Tn donde n>1) y/o relajación vibracional. De acuerdo con la regla Kasha la fosforescencia ocurrirá desde el estado T1. Además de lento la fosforescencia es un proceso de baja intensidad. El espectro de fosforescencia se encuentra a longitudes de onda mayores que el espectro de fluorescencia (Energía del T1 < Energía del S1). Los estados T1 tendrán un >empo de vida mayor que los estados S1. Debido a ello los estados T1 son más suscep>bles de ser inhibidos (quenching) debido a otros procesos no radia>vos que puedan compe>r con él (Colisiones bimoleculares con oxígeno u otras impurezas) Tema1. Principios Básicos de Fotoquímica Ejemplos de procesos naturales de fosforescencia: Auroras: Ocurren generalmente en regiones cercanas a los polos geográficos. Luces coloreadas que aparecen normalmente durante la noche. Boreales (H. Norte) Australes (H. Sur) Origen: emisiones de especies atómicas y moleculares de O y N. Predominan las luces verdes producidas por la transición O(1S →1D) λ= 557.7 nm O(1D→3P2,1) doblete λ= 630.0 y 636.4 nm. Doblete rojo que suele aparecer a mayor al>tud. Tema1. Principios Básicos de Fotoquímica 2.a.3. Transiciones no radia5vas: Pictóricamente, la transiciones no radia>vas y radia>vas suelen representarse como cruces compe>>vos horizontales y ver>cales, respec>vamente, entre el estado vibracional más bajo de un determinado estado electrónico y cualquier otro estado vibracional perteneciente a otro estado electrónico menos energé>co. Transiciones radia>vas: la energía del sistema se disipa mayoritariamente a través de la emisión de un fotón. Transiciones no radia>vas: la suma de la energía electrónica y vibracional permanece constante durante el proceso. Para determinar la eficiencia de las transiciones no radia>vas hay que considerar las energías y solapamiento de las funciones de onda electrónicas y vibracionales. Ley del intervalo de energía La probabilidad de que ocurra una transferencia de energía intramolecular entre dos estados electrónicos es inversamente proporcional a la diferencia de energía entre estos dos estados, (knr disminuye con el tamaño del gap energé>co entre los estados involucrados). Esta ley permite explicar la regla de Kasha. El gap energé>co entre estados Sn (n≥1) es menor que el gap de energía S0-­‐S1. La fluorescencia no puede compe>r con los procesos de conversión interna para los estados más energé>cos mientras que sí que lo hace para las transiciones entre los estados S0-­‐S1. Tema1. Principios Básicos de Fotoquímica En el caso de los cruces entre sistemas su eficiencia vendrá determinada por el gap de energía S-­‐ T. Factores Franck-­‐Condon Al igual que en el caso de las absorciones y emisiones radia>vas, la eficiencia de las transiciones no radia>vas (ic e isc) también depende del solapamiento de las funciones de onda vibracionales iniciales y finales. 2 casos límite: Buen solapamiento Mal solapamiento (a) (b) v (a) Los dos estados electrónicos poseen geometrías de equilibrio similares, pero la diferencia de energía electrónica es significa>va. Nivel v=0 del estado electrónico superior coincide con un nivel vibracional alto (ej. v=6) del estado electrónico inferior. El solapamiento de las Ψvibr es muy pequeño, χ χ ≈ 0 ,y por tanto es de esperar que la conversión interna S0-­‐>S1 sea lenta. Fluorescencia compe>rá con la transferencia no radia>va. (b) Ambos estados electrónicos poseen geometrías de equilibrio muy dis>ntas y la separación € energé>ca entre estados es significa>va. En este caso el solapamiento de Ψvibr es bueno χ χ > 0 La conversión interna S0-­‐>S1 será un proceso rápido. 1 2 1 € 2 Tema1. Principios Básicos de Fotoquímica Para moléculas rígidas (geometría del S0 y S1 parecidas) los procesos radia>vos estarán favorecidos respecto a los no radia>vos cuando exista un solapamiento entre las funciones de onda que sea pobre. En moléculas no rígidas, cualquier diferencia de geometría significa>va de geometrías, favorecerá los procesos de ic y de isc, estando las transiciones radia>vas menos favorecidas. Regla de oro de Fermi Matemá>camente la velocidad de conversión interna se puede expresar a par>r la regla de oro de Fermi 2π 2 ki−> f = Vif ρ f ρf es la densidad de estados vibracionales del estado electrónico final y Vif es un término de acoplamiento vibrónico que acopla el movimiento electrónico y nuclear en el caso de la ic o el spín y el momento angular orbital en el caso del isc. ρf aumenta a medida que aumenta el gap de energía pero cuanto mayor €a mayor gap energé>co peor será el solapamiento de las funciones de onda vibracionales implicadas. Para gaps energé>cos grandes el solapamiento de las funciones de onda domina sobre ρf. kif >> kfi. La densidad de estados para el estado electrónico más bajo es mayor que para el estado electrónico más alto. Por otro lado cualquier proceso de ic o isc es rapidamente seguido de una rápida disipación de la energía vibracional lo que evita que se produzca la reacción inversa y convierte a las transiciones no radia>vas en procesos irreversibles. Tema1. Principios Básicos de Fotoquímica Efecto átomo pesado en el cruce entre sistemas Cruce entre sistemas es un proceso prohibido por spín. El acoplamiento spín-­‐órbita puede ser importante a la hora de determinar la velocidad. Las transiciones entre estados de dis>nta mul>plicidad tendrá lugar si los estados triplete >enen cierto carácter de estado singlete y viceversa. Estas mezclas vienen determinadas por el acoplamiento spín órbita. Las reglas de El-­‐Sayed para el cruce entre sistemas La magnitud de kisc está gobernada por las reglas de El-­‐Sayed: la velocidad del cruce entre sistemas desde el S1 a un estado triplete será importante si la transición involucra un cambio en el >po de orbital. Por tanto el paso 1(nπ*) -­‐> 3(ππ*) o 1(ππ*) -­‐> 3(nπ*) serán más rápidos que el paso 1(nπ*) -­‐> 3(nπ*) o 1(ππ*) -­‐> 3(ππ*). N M 2 e ZA ˆ ˆ ˆ H SO = 3lj * sj 2 2 2m c j=1 A =1 rAj lˆ j * sˆ j invierte el spín electrónico al mismo >empo que produce el movimiento desde un orbital hasta otro rotado 90°. ZA es el número atómico. El acoplamiento spín orbita será tanto más efec>vo cuando se € produce la rotación de un orbital y si >ene lugar sobre un átomo pesado. ∑∑ Tema1. Principios Básicos de Fotoquímica Acetona Benzofenona Tema1. Principios Básicos de Fotoquímica Ejemplos de procesos naturales de conversión interna: Los procesos de conversión interna son responsables de la estabilidad del DNA y RNA frente a la irradiación con luz UV. Bases de DNA absorben en el UVB (290-­‐320 nm)-­‐ UVC (290-­‐200 nm). Fotoquímica de las bases de DNA y RNA: 1. absorción de energía por parte de un estado singlete permi>do 1(ππ*) localizado a 243 nm (U), 258 nm (T), 270 nm (C), 238 nm (A) y 270 (G). 2. El camino de desac>vación de mínima energía a lo largo del estado espectroscópico conduce en los 5 sistemas a un punto de conversión interna (intersección cónica) con el estado fundamental. La mayor parte de la energía absorbida decae no radia>vamente y de forma ultrarrápida. 3. La respuesta de las nucleobases como cromóforos a la absorción de luz UV puede considerarse como un mecanismo de selección natural de la composición del DNA/RNA en una búsqueda para obtener sistemas estables frente a perturbaciones externas. Tema1. Principios Básicos de Fotoquímica 2b. Procesos Rsicos intermoleculares para estados excitados “Quenching” desac>vación del estado excitado de una molécula por el choque o colisión con otra del mismo (auto-­‐quenching) o dis>nto >po (quenching por impureza). El resultado puede ser la molécula en el estado fundamental o en cualquier otro estado excitado de menor energía. Sn + Q è Sm + Q (m < n) “Quencher” cualquier substancia que aumenta la velocidad de desac>vación de otra. O2 es un quencher muy eficiente. Los ϕf se ob>enen se ob>enen en disoluciones muy diluidas libres de impurezas y burbujeando N2 libre de O2 para evitar el quenching. Tema1. Principios Básicos de Fotoquímica 2.b.1.Excímeros: Experimentalmente se observa que cuando se irradia con luz UV una disolución diluida de pireno en tolueno, la disolución emite una fluorescencia violeta. A medida que aumenta la concentración pireno, se observan los siguientes efectos: a. disminución gradual de la intensidad de la fluorescencia a λ correspondientes al violeta b. aparición de una nueva banda de emisión a λ correspondientes al azul. Explicación: formación de un dímero excitado o excímero (excited dimer) de la molécula de pireno, a par>r de un pireno excitado (M*) y un pireno en el estado fundamental (M). 1M*+M 1(MM)* hν -­‐hν -­‐hν M+M (MM) Desde un punto de vista electrónico el sistema adquiere cierta estabilización al formarse el dímero. LUMO M* HOMO M Tema1. Principios Básicos de Fotoquímica La formación de excímeros es bastante común entre hidrocarburos aromá>cos. Mínimo asociado al excímero No hay mínimo asociado a esta curva La emisión del excímero ocurre a energías menores y no >ene estructura vibracional ya que llega a un estado disocia>vo donde no existe mínimo y por tanto tampoco niveles vibracionales. Tema1. Principios Básicos de Fotoquímica 2.b.2.Exciplexes: Nos podemos encontrar con fenómenos análogos al de formación de excímeros cuando las disoluciones con>enen dos >pos de compuestos. Un exciplex es un complejo entre dos moléculas dis>ntas M y Q que sólo es estable en el estado excitado. Este es el caso de disoluciones de N,N-­‐die>lanilina y antraceno en tolueno. Se observa: a. Una inhibición de la fluorescencia del antraceno. b. Aparición de una emisión sin estructura a longitudes de onda mayores. c. La emisión de los exciplexes se ve afectada por la polaridad de los disolventes. Al contrario que en el excímero parte del complejo se encuentra en la forma de par iónico (una componente actúa como dador electrónico y otra como aceptor, D+A-­‐). Al aumentar la polaridad del disolvente disminuye la intensidad de emisión del exciplex debido a la formación del par iónico. 1M*+Q 1(MQ)* hν -­‐hν -­‐hν M+Q (MQ) Tema1. Principios Básicos de Fotoquímica 2.b.3. Transferencia de energía electrónica intermolecular: Se trata del proceso mediante el cual una molécula donadora excitada D* revierte al estado fundamental transfiriendo su energía electrónica a una molécula aceptora A. D* + A D + A* El resultado de este proceso es la inhibición de la emisión o algún proceso fotoquímico asociado a D* y su reemplazo con la emisión o reacción fotoquímica caracterís>ca de A*. En función de la mul>plicidad de A podemos dividir estos procesos en: Transferencia de energía singlete-­‐singlete: 1D* + 1A 1D + 1A* Transferencia de energía triplete-­‐triplete: 3D* + 1A 1D + 3A* Transferencia de energía triplete-­‐singlete: 3D* + 1A 1D + 1A* Transferencia de energía singlete-­‐triplete: 1D* + 1A 1D + 3A* Mecanismos radia5vos: Se trata de un mecanismo en 2 pasos que no involucra interacción directa donador-­‐aceptor. (i) D* D + hν (ii) A + hν A* Mecanismo opera>vo a grandes distancias. Mecanismo que se rige por las reglas de absorción. No >ene lugar para transferencia de energía singlete-­‐triplete o triplete-­‐triplete. Tema1. Principios Básicos de Fotoquímica La probabilidad de que ocurra transferencia de energía dependerá: (i) del rendimiento cuán>co de emisión de D* (ii) del número de moléculas de A (concentración) en el camino de los fotones emi>dos por D* (iii) la habilidad de A para absorber radiación (coeficiente de ex>nción de A) (iv) el solapamiento entre el espectro de emisión de D* y el espectro de absorción de A. (integral de solapamiento espectral) Emisión Absorción Integral de solapamiento espectral Mecanismos no radia5vos: Pueden dividirse en mecanismos (i) coulombiandos (ii) de intercambio electrónico. La velocidad con la que ocurren transiciones no radia>vas puede expresarse mediante la regla de oro de Fermi 2π 2 k = Vif ρ f i−> f Vif = VifCOUL +VifINT Ambos términos representan las interacciones repulsivas entre las nubes electrónicas iniciales y finales. Los círculos sólidos representan electrones pasivos cuya interacción con el resto de electrones se asume será más o menos constante durante el proceso de transferencia de energía. Mecanismo coulombiano (dipolo-­‐dipolo): Interacción más importante entre el electrón 1 en el LUMO (D) y el electrón 2 en el HOMO (A). Tras la transferencia de energía, el electrón 1 se desexcitará al mismo >empo que el electrón 2 se excitará. Se trata de un proceso a larga distancia (10 nm). No es necesario un contacto isico entre D y A. Durante este proceso se conserva la mul>plicidad de D y A. Proceso |pico de transferencia singlete-­‐singlete. Tema1. Principios Básicos de Fotoquímica Tema1. Principios Básicos de Fotoquímica Mecanismo por intercambio electrónico: Representa una reacción de doble subs>tución electrónica, se producen 2 saltos electrónicos simultáneos, siendo el resultado D* + A. Este proceso ocurre a través del solapamiento de nubes electrónicas, siendo necesario el contacto isico entre donador y aceptor (distD*-­‐A 1.0-­‐1.5 nm). Coulombiano por intercambio electrónico Distancias largas (10 nm) no ocurre para distD*-­‐A > 5-­‐10Å depende de las fuerzas osciladoras (TDM) no depende de las fuerzas osciladoras. de D*-­‐> D y A-­‐> A* no existe contacto isico entre D y A. requiere que existan colisiones entre D y A Mecanismo de dipolo inducido Mecanismo por colisión Tema1. Principios Básicos de Fotoquímica Energía Transferencia de energía triplete-­‐triplete: 3D* + 1A 1D + 3A* No puede ocurrir a través de un mecanismo dipolo-­‐dipolo (ya que el εA es demasiado pequeño). Sí ocurre a través de mecanismos de intercambio. Se trata de uno de los mecanismos más importantes en fotoquímica orgánica. A mayor >empo de vida de una molécula excitada, mayor es la probabilidad de transferencia electrónica. Las condiciones más idóneas para observar transferencia de energía triplete-­‐triplete: (i) El estado S1 (D) debe estar por debajo en energía del S1 (A) para evitar la excitación directa de A. (ii) El T1 (D) debe estar por encima en energía de T1 (A). (iii) El isc en D >ene que ser eficiente y rápido. Transferencia de Energía Donador Aceptor Tema1. Principios Básicos de Fotoquímica Fotosensibilización: proceso en el que se produce un cambio fotoisico o fotoquímico en una molécula como resultado de la absorción de luz por parte de otra. La molécula que absorbe inicialmente la luz se llama fotosensibilizador. Fotosensibilización y oxígeno singlete: La mayoría de las especies en el estado fundamental son singletes. El estado fundamental del oxígeno es un triplete. Su primer estado excitado 1O2 no se puede obtener mediante irradiación directa del estado fundamental-­‐> proceso prohibido por spín. Pero sí se puede producir mediante un proceso de fotosensibilización poco usual: 1D + hν 1D* 3D* 3 − 1 Σg Δg 3D* + 3O (3Σ ) 1 1 1 D + O2 ( Δg) 2 g Cualquier molécula con un estado excitado triplete de mayor energía que la necesaria para generar 1O2 a par>r de 3O2 es válida. D: rosa de bengala, azul de me>leno y porfirinas. Tema1. Principios Básicos de Fotoquímica Oxígeno singlete: es una especie altamente reac>va y oxidante que se u>liza para la degradación de compuestos orgánicos. Aplicaciones tratamiento de aguas residuales y la terapia fotodinámica contra el cáncer. Luz Paciente Administración de Irradiación con un Destrucción con tumor fotosensibilizador + láser produce (i) la selec5va del Acumulación excitación del tumor! selec5va de fotosensibilizador fotosensibilizador (ii) se produce un isc 1D*-­‐>3D* 3D* puede seguir 2 caminos: (a) reaccionar fotoquímicamente con moléculas orgánicas de células tumorales (reacciones de abstracción de H que iniciarían reacciones radicalarias que destruirían el tumor). (b) transferenciad de energía hasta 3O2 produciendo 1O2. Tema1. Principios Básicos de Fotoquímica D·∙+ + A·∙-­‐ 2.b.2 Transferencia electrónica fotoinducida: D* + A 1D·∙+ D* A A·∙-­‐ La absorción de un fotón afectará las propiedades redox de los sistemas. El proceso de excitación promociona un electrón hasta un nivel de energía superior, siendo la molécula excitada un mejor donador de lo que lo es el estado fundamental. Al mismo >empo la excitación electrónica crea un hueco en el HOMO, lo que la convierte en un mejor aceptor. En resumen: AE (D*) > AE (D) PI (R*) < PI (R) Este proceso ocurre a través de un mecanismo de intercambio electrónico que requiere el solapamiento de las nubes electrónicas. Tema1. Principios Básicos de Fotoquímica Este proceso va a crear un par iónico que va a interaccionar fuertemente con el disolvente, ya que tendrá que sufrir una reorganización importante para acomodar y estabilizar el nuevo sistema molecular cargado. Una de los procesos naturales más importantes en los que >ene lugar reacciones de transferencia electrónica fotoinducida es la fotosíntesis. En la fotosíntesis la luz solar induce una cadena de reacciones de transferencia de electrones que genera un gradiente de protones a través de una membrana biológica.








