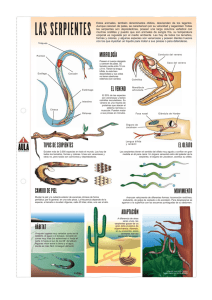
Manual de procedimientos para el manejo de serpientes en
Anuncio

UNIVERSIDAD VERACRUZANA FACULTAD DE MEDICINA VETERINARIA Y ZOOTECNIA Manual de procedimientos para el manejo de serpientes en cautiverio en el herpetario Patrulla animal TRABAJO RECEPCIONAL EN LA MODALIDAD DE: TRABAJO PRÁCTICO COMO REQUISITO PARCIAL PARA OBTENER EL TÍTULO DE MÉDICO VETERINARIO ZOOTECNISTA PRESENTA: ANDRÉS MATA CRUZ ASESOR: MVZ JAVIER HERMIDA LAGUNES VERACRUZ, VER. JULIO 2012 INDICE GENERAL CONTENIDO Página INDICE DE CUADROS .................................................................................... vii INDICE DE FIGURAS ..................................................................................... viii AGRADECIMIENTOS ..................................................................................... xiii DEDICATORIA ................................................................................................. xiv 1. INTRODUCCION ......................................................................................... 15 2. JUSTIFICACION .......................................................................................... 19 3. OBJETIVO ..................................................................................................... 20 4. MATERIAL Y METODO ............................................................................. 21 4.1. Área de estudio .......................................................................................... 21 5. DESARROLLO DEL TEMA ....................................................................... 22 5.1. Generalidades de las serpientes ................................................................ 22 5.1.1. Características de las serpientes ......................................................... 23 5.1.1.1. Sistema óseo................................................................................. 23 5.1.1.2. Piel ................................................................................................ 25 5.1.1.3. Locomoción ................................................................................... 26 5.1.1.4. Órgano de Jacobson ..................................................................... 28 5.1.1.5. Fosetas loreales ............................................................................ 28 5.1.1.6. Dentición ....................................................................................... 29 5.1.1.7. Alimentación .................................................................................. 31 5.1.1.8. Clasificación de venenos en serpientes ........................................ 32 ii 5.1.1.8.1. Veneno neurotóxico ................................................................ 34 5.1.1.8.2. Veneno citotóxico.................................................................... 34 5.1.2. ¿Serpientes, culebras o víboras? ........................................................ 35 5.2. Instalaciones............................................................................................... 37 5.2.1. Terrarios ............................................................................................... 37 5.2.1.1. Diseño del terrario ......................................................................... 41 5.2.2. Equipo y herramientas utilizadas en el manejo de serpientes ............. 44 5.2.2.1. Ganchos herpetológicos ................................................................ 44 5.2.2.2. Pinzas Tong .................................................................................. 45 5.2.2.3. Pinzas para la alimentación de serpientes .................................... 46 5.2.2.4. Abrebocas para serpientes ............................................................ 47 5.2.2.5. Sondas gástricas ........................................................................... 47 5.2.2.6. Estiletes de punta roma ................................................................. 48 5.2.2.7. Caja trampa para serpientes ......................................................... 48 5.2.2.8. Tubo de contención para serpientes ............................................. 49 5.2.2.9 Recipientes plásticos con tapa asegurada ..................................... 50 5.2.2.10 Goggles protectores ..................................................................... 51 5.2.3. Cuarentena .......................................................................................... 51 5.3. Sueros antiofídicos ..................................................................................... 52 5.3.1. Primeros auxilios .................................................................................. 54 5.3.2. Prevención de accidentes .................................................................... 55 5.4. Clasificación de las serpientes para facilitar el manejo en el herpetario Patrulla animal ................................................................................................... 57 5.4.1. Grupo 1: Serpientes no venenosas ...................................................... 58 iii 5.4.1.1. Culebras ........................................................................................ 58 5.4.1.2. Serpientes constrictoras ................................................................ 62 5.4.2. Grupo 2. Serpientes venenosas ........................................................... 65 5.4.2.1. Viperidos y crótalos ....................................................................... 65 5.4.2.2. Elapidos ......................................................................................... 68 5.5. Procedimientos para el manejo de serpientes no venenosas en el herpetario Patrulla animal ................................................................................................... 71 5.5.1. Culebras............................................................................................... 72 5.5.1.1. Procedimiento de manejo empleado para la limpieza del terrario . 72 5.5.1.2. Procedimiento de manejo empleado para la alimentación ............ 75 5.5.1.2.1. Procedimiento de manejo empleado para la alimentación forzada con sonda .................................................................................. 77 5.5.2. Serpientes constrictoras....................................................................... 81 5.5.2.1. Procedimiento de manejo empleado para la limpieza del terrario . 82 5.5.2.2. Procedimiento de manejo empleado para la alimentación ............ 85 5.5.2.2.1. Procedimiento de manejo empleado para la alimentación forzada .................................................................................................... 87 5.6. Procedimientos para el manejo de serpientes venenosas en el herpetario Patrulla animal ................................................................................................... 90 5.6.1. Procedimiento de manejo empleado para la limpieza del terrario ........ 91 5.6.1.1. Procedimiento de manejo empleado para la utilización de la caja trampa ........................................................................................................ 92 5.6.2. Procedimiento de manejo empleado para la alimentación ................... 96 iv 5.6.2.1. Procedimiento de manejo empleado para la alimentación forzada con sonda ................................................................................................... 98 6. CONCLUSIONES .......................................................................................102 7. RECOMENDACIONES .............................................................................103 8. LITERATURA CITADA ..............................................................................104 9. ANEXOS .......................................................................................................108 9.1 Procedimiento de manejo empleado para la utilización del tubo de contención en serpientes ..................................................................................109 9.2. Procedimiento de manejo empleado para el sexado en serpientes ..........111 9.2.1. Procedimiento de manejo empleado para la eversión de los hemipenes ......................................................................................................................112 9.2.2. Procedimiento de manejo empleado para la utilización del estilete con punta roma ....................................................................................................113 9.3. Procedimientos de manejo empleado para la toma de muestras en serpientes .........................................................................................................115 9.3.1. Procedimiento de manejo empleado para la toma de muestras de heces ......................................................................................................................116 9.3.2. Procedimiento de manejo empleado para la toma de muestras de orina ......................................................................................................................119 9.3.3. Procedimiento de manejo empleado para la toma de muestras sanguíneas ...................................................................................................120 9.3.3.1. Procedimiento de manejo empleado para la obtención de muestras sanguíneas utilizando la vena coccígea ventral ........................................122 v 9.3.3.2. Procedimiento de manejo empleado para la obtención de muestras sanguíneas utilizando la cardiocentesis ....................................................125 9.4. Procedimiento de manejo empleado para la extracción de veneno en serpientes .........................................................................................................129 vi INDICE DE CUADROS Página Cuadro 1. Clasificación científica de las serpientes………………………………….23 vii INDICE DE FIGURAS Página Figura 1. Ubicación del Parque Zoológico y Botánico Miguel Ángel De Quevedo.21 Figura 2. Esqueleto de una serpiente………………………………………………….24 Figura 3. Espolones en una Pitón Birmana (Python molurus bivittatus)…………..25 Figura 4. Locomoción en las serpientes………………………………………………28 Figura 5. Órgano de Jacobson…………………………………………………………28 Figura 6. Serpiente detectando a su presa por medio de sus Fosetas loreales….29 Figura 7. Tipos de denticion en las serpientes……………………………………….31 Figura 8. Mazacuata albina (Boa constrictor imperator) capturando a su presa….32 Figura 9. Terrario diseñado para una Pitón real (Python regius) en el herpetario Patrulla animal……………………………………………………………………………38 Figura 10. Vista posterior de los terrarios para culebras ubicados en el herpetario Patrulla animal……………………………………………………………………………38 Figura 11. Terrario diseñado para una Pitón real (Python regius) en el herpetario Patrulla animal……………………………………………………………………………39 Figura 12. Terrario diseñado para una mamba verde (Dendroaspis aungusticeps) en el herpetario Patrulla animal………………………………………………………...40 viii Figura 13. Vista posterior del terrario de una serpiente venenosa………………....40 Figura 14. Ejemplo de ficha técnica utilizada en un terrario del herpetario Patrulla animal…………………………………………………………………………….............43 Figura 15. Ganchos herpetológicos empleados en el herpetario Patrulla animal...45 Figura 16. Pinzas Tong empleadas en el herpetario Patrulla animal………………46 Figura 17. Pinzas de alimentación para serpientes………………………………….47 Figura 18. Sondas para el sexado de serpientes…………………………………….48 Figura 19. Caja trampa para serpientes utilizada en el herpetario Patrulla animal……………………………………………………………………………………..49 Figura 20. Tubos de contención para serpientes…………………………………….50 Figura 21. Recipiente plástico con tapa asegurada…………………………………50 Figura 22. Goggles protectores para los ojos………………………………………...51 Figura 23. Sueros antiofídicos en su lugar de almacenamiento……………………53 Figura 24. Clasificación de las serpientes para su manejo en el herpetario Patrulla animal…………………………………………………………………………………......57 Figura 25. Serpiente voladora (Spilotes pullatus)…………………………………….59 Figura 26. Serpiente chirrionera (Masticophis flagellun)…………………………….59 Figura 27. Serpiente rey de California (Lampropeltis getula californiae)…………..59 ix Figura 28. Serpiente rey de California aberrante (Lampropeltis getula californiae)………………………………………………………………………………..60 Figura 29. Serpiente rey de California striped (Lampropeltis getula californiae)….60 Figura 30. Falsa coral de Nelson (Lampropeltis triangulum nelsoni)………………60 Figura 31. Falsa coral de Nelson albina (Lampropeltis triangulum nelsoni)………61 Figura 32. Serpiente del maíz (Elaphe guttata)………………………………………61 Figura 33. Elafe texana (Elaphe obsoleta lindheimeri)………………………………61 Figura 34. Mazacuata (Boa constrictor imperator)…………………………………...62 Figura 35. Mazacuata albina (Boa constrictor imperator)…………………………...63 Figura 36. Pitón birmano (Python molurus bivittatus)………………………………..63 Figura 37. Pitón birmano albino (Python molurus bivittatus)………………………..64 Figura 38. Pitón reticulado (Python reticulatus)………………………………………64 Figura 39. Pitón reticulado tigre (Python reticulatus)………………………………...64 Figura 40. Pitón real (Python regius)…………………………………………………..64 Figura 41. Víbora de cascabel tropical (Crotalus durissus)…………………………66 Figura 42. Víbora de cascabel diamantada (Crotalus atrox)………………………..66 Figura 43. Víbora cascabel del pacifico (Crotalus basiliscus)………………………66 Figura 44. Víbora de Gabón (Bitis gabonica)…………………………………………67 Figura 45. Víbora bufadora (Bitis arietans)……………………………………………67 Figura 46. Cantil común (Agkistrodon bilineatus)…………………………………….67 x Figura 47. Nauyaca real (Bothrops asper)…………………………………………….68 Figura 48. Cobra de monóculo (Naja kaouthia)………………………………………68 Figura 49. Cobra de monóculo albina (Naja kaouthia)………………………………69 Figura 50. Cobra escupidora negra (Naja siamensis)……………………………….69 Figura 51. Cobra escupidora roja (Naja pallida)……………………………………...69 Figura 52. Mamba verde (Dendroaspis aungusticeps)………………………………70 Figura 53. Alimentación forzada de una Pitón birmana (Python molurus bivittatus)………………………………………………………………………………….89 Figura 54. Contención física de una Víbora de cascabel tropical (Crotalus durissus)…………………………………………………………………………………..91 Figura 55. Túnel ubicado en la parte posterior del terrario de una serpiente venenosa………………………………………………………………………………….92 Figura 56. Colocación de la caja trampa en el terrario………………………………94 Figura 57. Forma de sujetar la cabeza de una especie venenosa (Víbora de cascabel tropical Crotalus durissus)………………………………………………….100 Figura 58. Sexado de una serpiente………………………………………………....114 Figura 59. Obtencion de sangre de la vena coccigea ventral de una pitón real albina (Phyton regius)………………………………………………………………….124 Figura 60. Sistema cardiovascular de una Pitón birmana (Python molurus bivittatus)………………………………………………………………………………...125 Figura 61. Cardiocentesis en una Pitón real (Phyton reguis)……………………...128 xi Figura 62. Extracción de veneno de una cobra de monóculo (Naja Kaouthia)….132 Figura 63. Ubicación de las glándulas de veneno en una serpiente……………..133 xii AGRADECIMIENTOS A Dios por mostrarme el camino que debo seguir y por impulsarme a seguir adelante a pesar de todas las caídas que de una u otra manera, me sirvieron para levantarme con más fuerza que antes y terminar así mi carrera. A mi asesor MVZ Javier Hermida Lagunes por su apoyo y disposición que en todo momento mostro para la realización de este trabajo. A la Facultad de Medicina Veterinaria y Zootecnia por haberme abierto sus puertas y a todos los catedráticos que laboran en ella por haber contribuido a mi formación como profesionista. Al herpetario Patrulla animal por abrirme sus puertas para la elaboración de este manual, asimismo al MVZ Alberto Ojeda, a Luis y a Fernando por apoyarme en la realización de los manejos que hicieron posible este manual. Al MVZ Víctor H. Sánchez Montalvo y al MVZ Maciel Celis Villegas del Zoológico Miguel Ángel de Quevedo por demostrarme su apoyo y amistad durante todo este tiempo. GRACIAS xiii DEDICATORIA A mis padres Andrés Mata Muñoz y Josefina Cruz Monroy por apoyarme durante toda la vida en todas las formas imaginables y por nunca haber permitido que me diera por vencido en la realización de este sueño que ahora se ha vuelto realidad. Padre ahora soy un profesionista. Los quiero muchísimo a ambos. A mi hermana Guadalupe Mata Cruz por ser mi ángel guardián y por seguirme cuidando a pesar de ya no estar en este mundo. Lupita aun vives en mi corazón. A una mujer muy especial a la que quiero mucho, que me encaminó hacia el área de fauna silvestre y que me impulsa día a día a superarme para llegar a ser un mejor hombre y un mejor Médico Veterinario, Yuliana Ojeda García. A todos los amigos que siempre has estado conmigo en las buenas y en las malas y que han creído en mí. xiv 1. INTRODUCCION Las serpientes siempre han sido incluidas en diversos mitos y supersticiones y que tal vez no exista animal que haya producido más temor, sobre todo en países que poseen climas tropicales en donde la abundancia de estos es muy grande, países en los cuales se han producido un gran número de accidentes, en los cuales, las serpientes venenosas han ocasionado mordeduras mortales (Polo, 2006). Por diversos motivos, las serpientes han sido apreciadas en diversas culturas pero repudiadas en otras. En occidente por ejemplo, en las creencias cristianas y del islam el demonio ha sido representado con las serpientes. En cambio en el lejano Oriente la serpiente es considerada un animal sagrado, divino y protector contra las energías negativas que representa fuerza, energía y sabiduría. En la cultura egipcia algunas diosas son representadas en forma de serpiente, diosas tales como Wadjet la diosa cobra que se observa en la frente de los faraones, Meretseger la diosa protectora del Valle de los Reyes y Renenutet la diosa de las cosechas y la abundancia (Vázquez, 1981). La importancia de las serpientes en el arte y la mitología se ve representada en la antigua cultura maya, las más mencionadas u observadas en pinturas son la serpiente de cascabel Crotalus durissus y la Nauyaca real Bothrops asper (Vásquez y Chaquin, 2009). Los mayas pensaban que en el cascabel de la 15 serpiente o ajau can se guardaba el secreto de la vida y la regeneración. Además observaron que en la piel de esta especie, existía un patrón matemático y geométrico, el canamayté, que representaba la cosmovisión sobre la formación del cielo y la tierra, a partir de cuatro esquinas y cuatro lados. Canamayté es básicamente el cuadrado central en la hilada de cuadros en el dorso de la víbora de cascabel, este modelo ayudó a los mayas a resolver diversos problemas relacionados con la construcción (INAH, 2008). Las serpientes son depredadores naturales y en su mayoría, el alimento principal de estas son los roedores, razón por la cual forman parte del delicado equilibrio en los ecosistemas. Dichos reptiles desempeñan un papel importante al contribuir en gran medida a controlar las poblaciones de roedores silvestres que, de otra manera, ocasionarían pérdidas a la agricultura y estimularían la propagación de enfermedades (Vásquez y Chaquin, 2009). El veneno de serpientes no debe ser tomado solamente como un compuesto de toxinas que puede causar la muerte ya que también pueden traer consigo beneficios para la salud. Por ejemplo, diferentes investigaciones han descubierto que en el veneno de la serpiente cabeza de cobre (Agkistrodon contortrix) contiene algunos compuestos químicos que son capaces de ayudar en el tratamiento del cáncer (AOL, 2010). En el mundo existen cerca de 3,000 especies de serpientes, de las cuales 532 son venenosas. En México debido a sus diversos climas y zonas neo árticas y 16 neo tropicales, con desiertos y selvas que enriquecen la flora y fauna del país, se encuentran tres subfamilias de especies venenosas, las cuales son Crotálidos, Elapidos e Hidrófidos (Tay Zavala et al, 2002). De hecho México es considerado el país que cuenta con la mayor variedad de serpientes venenosas en comparación con los demás países de América (Frayre et all, 2006). Durante el lapso que abarca del año 2003 al año 2007, se registraron en México un total 18,848 accidentes por mordedura de serpiente. Los estados que presentaron mayor incidencia por este tipo de lesiones fueron Veracruz, Oaxaca, San Luis Potosí, Hidalgo y Puebla; siendo Oaxaca el estado más afectado, contando con un total de 2,266 mordeduras, seguido por Veracruz con 2,231 casos (Siria y Arellano, 2009). En vida libre gran parte de las mordeduras ocasionadas por serpientes venenosas se debe a que la población se ha expandido tanto que ha invadido regiones naturales en las que habitan estos animales. La mayoría de las personas en áreas rurales les teme y al toparse con alguna especie en particular, lo primero que hace es privarles de la vida sin siquiera tomar en cuenta si esta es venenosa o no. El herpetario Patrulla animal, cuenta con el número de registro SGOA\DGVS\01775\07 ante SEMARNAT (Secretaria de Medio Ambiente y Recursos Naturales). Tiene como misión fomentar la cultura y la conciencia de la importancia de las diferentes especies de animales de México y el mundo, así 17 como su papel en el medio ambiente; además de generar un sentimiento de respeto de la sociedad en general a los animales por medio de exhibiciones y “shows” que marquen la pauta para su conservación. Por otro lado, gran parte de los accidentes que ocurren con serpientes en cautiverio, se deben a que no se emplean las técnicas adecuadas para el manejo de este tipo de reptiles. El manejo de serpientes, en especial el de especies venenosas, requiere de una serie de procedimientos, que, en general, sean seguros tanto para el médico veterinario que los realiza como para el animal. El contar con un manual de procedimientos para el manejo de serpientes en cautiverio, disminuirá la posibilidad de un accidente durante el proceso de manejo en el herpetario y además enriquecerá el conocimiento sobre este tipo de reptiles. 18 2. JUSTIFICACION En el herpetario Patrulla animal diariamente se realizan actividades relacionadas con el manejo de las serpientes, que abarcan desde las más sencillas como la alimentación de dichos animales hasta su contención física. Por tal motivo, es de vital importancia para el médico veterinario que está en contacto directo con los animales, contar con un manual específico para el manejo de serpientes venenosas y no venenosas. Dicho manual servirá para estructurar cada uno de los procedimientos llevados a cabo en un herpetario y en segundo lugar como apoyo para los médicos veterinarios zootecnistas interesados en el manejo de serpientes. 19 3. OBJETIVO Realizar un manual, en el cual se describan los procedimientos de manejo de serpientes en cautiverio, empleados en el herpetario Patrulla animal; así como de algunos otros, que aunque no se realizan en el herpetario, también son importantes. 20 4. MATERIAL Y METODO 4.1. Área de estudio El herpetario Patrulla animal (SGOA\DGVS\01775\07 SEMARNAT), se encuentra ubicado dentro de las instalaciones del Parque Zoológico Botánico Miguel Ángel de Quevedo, situado en la ciudad de Veracruz, en las siguientes coordenadas: 19º 10’ 23.48” n y 96º 08’ 14.80” O (Figura 1). Las características generales de la zona son: temperatura promedio de 25º C, humedad relativa del 78%, con una precipitación media anual de 2,000 mm. (INEGI, 2012). Figura 1. Ubicación del Parque Zoológico Botánico Miguel Ángel De Quevedo (Tomada de Google maps, 2012). 21 5. DESARROLLO DEL TEMA 5.1. Generalidades de las serpientes Los reptiles son un grupo de animales vertebrados de piel fuertemente queratinizada y habitualmente cubierta por escamas protectoras, son considerados como animales ectotermos ya que no pueden regular su temperatura corporal de forma habitual como lo realizan los mamíferos y las aves, razón por la cual se les nombra de manera vulgar como animales de sangre fría. Las serpientes son reptiles ápodos (no poseen extremidades) de cuerpo alargado y flexible, carentes de parpados y de un conducto auditivo externo. Se encuentran ubicadas dentro del orden Squamata (Cuadro 1). 22 Cuadro 1. Clasificación científica de las serpientes (Linnaeus 1758) CLASIFICACIÓN CIENTÍFICA Reino Animalia Filo Chordata Subfilo Vertebrata Subclase Sauropsida Superorden Lepidosauria Orden Squamata Suborden Serpentes 5.1.1. Características de las serpientes 5.1.1.1. Sistema óseo El esqueleto de las serpientes (Figura 2) se encuentra fuertemente osificado y constituido principalmente por un cráneo, la columna vertebral y las costillas (Scribd, 2011). El sistema óseo de estos animales puede estar formado por hasta 400 vertebras, las cuales permiten la fijación de sus poderosos músculos, responsables de la locomoción, la captura de presas y la ingestión de estas. 23 Figura 2. Esqueleto de una serpiente (Tomada de Blogspot, 2010). La boca de las serpientes puede abrirse enormemente, debido a que los huesos de la mandíbula se encuentran unidos por ligamentos elásticos. Además, la mandíbula inferior está unida al cráneo por un hueso largo y móvil, llamado hueso cuadrado, que permite que el cráneo y la mandíbula se separen. Las serpientes no cortan ni mastican a su presa, la tragan comenzando por la cabeza y la hacen progresar lentamente por su tubo digestivo. Si la presa es grande, los huesos de la mandíbula se separan y la mandíbula inferior se aleja del cráneo, ampliándose la cavidad oral. Los dientes están inclinados para atrás de manera tal que el animal, una vez introducida su presa, no pueda volver a retroceder (Maschio, 2001). Las serpientes carecen de extremidades externas, aunque algunas conservan vestigios de las patas traseras. Estos son conocidos como espolones y se encuentran visibles en la base de la cola de las boas y pitones (Figura 3). 24 Figura 3. Espolones en una Pitón birmana (Python molurus bivittatus) (Tomada de Alvarado, 2009). 5.1.1.2. Piel La piel de las serpientes actúa como una superficie impermeable cubierta de escamas de una gran variedad de formas y texturas (Cuetzpalin, 2006). La piel en la cabeza de las serpientes está formada por placas o escudos que son básicamente escamas modificadas. Otro tipo de escamas modificadas en estos reptiles son las que conforman el cascabel en las especies de Crótalos. Regularmente, las serpientes pasan por un proceso conocido como ecdisis que consiste en la muda de la piel que ha sufrido un desgaste natural (Cuetzpalin, 2006). A diferencia de otros reptiles, el cambio de piel es realizado en una sola pieza en la mayoría de las ocasiones, esto se hace a medida que el animal crece y además para reparar heridas y librarse de parásitos externos. 25 La frecuencia de la muda varía de una especie a otra, esto en función de la edad y el tamaño del individuo. Las serpientes jóvenes poseen un crecimiento rápido, por lo cual cambian de piel con más frecuencia que en adultos, ya que estos últimos desarrollan un crecimiento más lento. En algunas especies la muda se produce aproximadamente cada 20 días, en otras sólo una vez al año. 5.1.1.3. Locomoción Una característica sorprendente de las serpientes es su capacidad para desplazarse rápidamente sin tener patas. Utilizan cuatro tipos diferentes de locomoción (Figura 4), los cuales se describen a continuación: 1. Movimiento ondulante. También es conocido como método serpentino, en este tipo de movimiento, la serpiente empuja contra el suelo la parte trasera de cada curva u ondulación y se desplaza suavemente hacia adelante con movimientos fluidos. 2. Movimiento rectilíneo o de oruga. La piel de la superficie ventral de la serpiente se mueve hacia atrás y hacia adelante por la acción de poderosos músculos y las anchas escamas del vientre se clavan en la tierra permitiendo al animal desplazarse hacia adelante en línea recta. Sólo lo utilizan las serpientes constrictoras más pesadas. 26 3. Movimiento golpe de costado. En este método, la serpiente hace rodar lateralmente el cuerpo a lo largo del suelo con un movimiento en forma de bucle. Lo utilizan las serpientes que habitan en el desierto para desplazarse sobre arena suelta. 4. Movimiento de acordeón. En este tipo de movimiento, el cuerpo del animal se estira y se recoge alternativamente mientras la serpiente se mueve desde un punto de anclaje hasta el siguiente; se utiliza para cruzar superficies lisas y para trepar. Figura 4. Locomoción en las serpientes (Tomada de Cano, 2012). 27 5.1.1.4. Órgano de Jacobson El órgano de Jacobson (Figura 5) es un órgano auxiliar del sentido del olfato, las neuronas, dentro de este, detectan diferentes compuestos químicos, habitualmente macromoléculas. Las serpientes lo usan para oler presas, sacando la lengua y atrayendo partículas hasta el interior de la boca (Giraldo, 2009). Figura 5. Órgano de Jacobson (Tomada de Cano, 2012). 5.1.1.5. Fosetas loreales La foseta loreal también conocida como cavidad termoreceptora, es una fosa situada en el área loreal a cada lado de la cabeza de los Crótalos. Este órgano percibe básicamente el calor corporal emitido por una presa, por lo tanto, el cerebro de la serpiente localiza la presa comparando diferencias de temperaturas y puede atacarla incluso en la oscuridad (Gómez y Flores, 2012) (Figura 6). 28 Figura 6. Serpiente detectando a su presa por medio de sus Fosetas loreales (Tomada de Cano, 2012) 5.1.1.6. Dentición Los dientes de las serpientes están diseñados para conseguir alimento, son puntiagudos, afilados como agujas y presentan una curvatura, hacia dentro de la boca, que asegura una total retención de la presa, la cual que al intentar escapar solo logra introducir más a fondo los dientes en su cuerpo (Cuetzpalin, 2006). La dentición en las serpientes puede clasificarse de la siguiente manera (Figura 7): Aglifa. Las serpientes pertenecientes a este grupo, tienen dientes macizos, todos del mismo tamaño, en ambas arcadas dentarias, inclinándose 29 levemente hacia atrás. Carecen de conductos, es decir, no tienen dientes inoculadores especializados. Opistoglifa. Las serpientes de este grupo, poseen un par de dientes inoculadores fijos, más grandes que los demás, situados en la parte posterior del maxilar superior, provistos de una ranura conectada a glándulas venenosas. Dicha ubicación es poco práctica para inocular veneno. Proteroglifa. Las serpientes de este grupo, cuentan con un par de dientes inoculadores inmóviles, con un canal completamente cerrado, situado en la parte anterior del maxilar superior. Solenoglifa. Las serpientes ubicadas dentro de este grupo, presentan un par de dientes anteriores finos, largos, ligeramente curvos y muy móviles que se repliegan con la punta dirigida hacia atrás cuando la boca está cerrada, poseen además un conducto central que se comunica a las glándulas productoras de veneno. En el momento de morder estos dientes se proyectan hacia delante (Camarra y Vera, 2008). 30 Figura 7. Tipos de denticion en las serpientes (Tomada de Van Brussel, 2008) 5.1.1.7. Alimentación La alimentación es uno de los procesos más importantes en las serpientes. Todas ellas son carnívoras, alimentándose de una gran variedad de presas que incluyen aves, anfibios, mamíferos, peces, insectos e incluso otros reptiles, entre los que se encuentran otras serpientes. Pueden recurrir a técnicas como son el uso del veneno o la constricción para abatir la presa antes de comérsela (Figura 8). Las serpientes no pueden masticar el alimento y en su lugar se tragan enteras a sus presas. La carencia de esternón ha resultado una gran ventaja para estos animales, ya que las costillas pueden extenderse para permitir el paso de grandes presas (Cuetzpalin, 2006). 31 Figura 8. Mazacuata albina (Boa constrictor imperator) capturando a su presa (Tomada por el autor, 2012). Las serpientes, al ser animales ectotermos, necesitan de la energía solar para elevar su temperatura y así llevar a cabo el proceso de digestión, razón por la cual pasan largas horas al sol. La digestión es un proceso cuyo tiempo es variable en las diversas especies, por ejemplo la Pitón birmana (Python molurus bivittatus) puede tardar un promedio de 7 días en llevar a cabo la digestión. 5.1.1.8. Clasificación de venenos en serpientes Todos los venenos ya sean de serpientes o de otros animales, son casi tan complejos como el propio animal en sí. Se podría decir que es el súmmum en lo referente a la evolución en sistemas de ataque y defensa dentro del mundo animal (Mundo animal, 2010). Los animales tienen veneno como mecanismo de defensa, 32 en algunos casos o como un resultado secundario para poder capturar a sus presas. Sin que esto implique que el veneno pueda afectar de la misma forma a todos los seres vivos que son mordidos por una serpiente (ZOOBAQ, 2012). Las serpientes son animales apacibles y poco agresivos, en general huyen del hombre. Cuando muerden a una persona lo hacen en defensa propia y casi siempre en su ambiente natural, ya sea porque una persona se interpone casualmente en su camino o porque se las molesta (Educ.ar, 2012). Las mordidas ocasionadas por serpientes venenosas en cautiverio, se deben principalmente a las malas prácticas de manejo por parte del personal. Los responsables del más del 90% de los accidentes ocasionados por serpientes venenosas en América, son especies pertenecientes a la familia Viperidae (De Roodt et al, 2005). El veneno de las serpientes es un líquido de color amarillento, está compuesto por una serie de glucoproteinas, polipéptidos y enzimas que en conjunto pueden afectar a diversos órganos y sistemas, ocasionando daños en los diversos tejidos del cuerpo, alteraciones de la coagulación sanguínea y daños al sistema nervioso central (Van Brussel, 2012). El veneno de las serpientes de la subfamilia Crotalinae, pueden ocasionar un gran número de alteraciones sobre la coagulación sanguínea. Debido a que contiene componentes procoagulantes y anticoagulantes (Maruñak et al, 2006). Para su estudio y por los efectos que ocasiona el veneno de las serpientes, este se ha clasificado a este en dos tipos principalmente, que son el veneno 33 neurotóxico y el veneno citotóxico. Cabe mencionar que cada uno predomina en alguna familia en particular, aunque ambos pueden encontrarse en una misma familia. 5.1.1.8.1. Veneno neurotóxico Este tipo de veneno es característico de la familia Elapidae, ya que este tipo es el que predomina en esta familia. El veneno neurotóxico, como su nombre lo indica, tiene como punto de acción los nervios del cuerpo; éste actúa sobre las placas neuromusculares produciendo un bloqueo en las terminaciones nerviosas, provocando por lo tanto, parálisis muscular y finalmente un paro cardiorrespiratorio. 5.1.1.8.2. Veneno citotóxico Este tipo de veneno es más característico de la familia Viperidae, aunque también puede encontrarse en algunas especies de la familia Elapidae, en conjunto con el veneno neurotóxico. 34 El veneno citotóxico produce efectos devastadores sobre el organismo al cual penetra; el edema y la inflamación inicial pueden ocasionar incluso que la piel se llegue a romper en la zona afectada. Además la necrosis que produce este tipo de veneno puede provocar la amputación del miembro afectado, en caso de que la mordida se hubiese producido en los brazos o en las piernas. Las lesiones en los vasos sanguíneos y en las células de la sangre pueden causar hemorragias internas en los diversos órganos del cuerpo. 5.1.2. ¿Serpientes, culebras o víboras? Serpientes, culebras o víboras, son algunos de los nombres más comunes con los que denominamos a estos bellos animales, cabe señalar que es muy importante saber la diferencia entre cada uno de ellos. El término “serpientes” es el más indicado para generalizar a este tipo de reptiles, ya que, de acuerdo a la clasificación establecida por Linnaeus en 1758, pertenecen al suborden Serpentes. Algunas serpientes no venenosas como lo son la Mazacuata (Boa constrictor imperator) de la familia Boidae y la Pitón reticulada (Pitón reticulatus) de la familia Phytonidae, pertenecen a las denominadas serpientes pesadas o constrictoras. Se denominan “culebras” a todas las serpientes pertenecientes a la 35 familia Colubridae, en su mayoría no venenosas, por ejemplo la serpiente rey de California (Lampropeltis getula californiae) y la serpiente de maíz (Elaphe guttata). Por último, el término “víboras” es utilizado para las serpientes localizadas dentro de la familia Viperidae, las cuales son especies muy venenosas, entre ellas se encuentran la víbora de cascabel diamantada (Crotalus atrox) y la Nauyaca real (Bothrops asper). Cabe señalar que existe una gran diversidad de serpientes venenosas, pero no por eso se les debe denominar a todas como víboras, ya que pertenecen a otras familias, como son el caso de la cobra de monóculo (Naja kaouthia), la mamba verde (Dendroaspis aungusticeps) y la serpiente coralillo elegante (Micrurus elegans), todas pertenecientes a la familia Elapidae. 36 5.2. Instalaciones 5.2.1. Terrarios Un terrario es un microhábitat en el cual se reproducen las condiciones ambientales necesarias para distintos seres de vida total o parcialmente terrestre. Los terrarios deben proporcionar comodidad al ejemplar, deben permitir la facilidad de manejo por parte del técnico, ser seguros. ya que por las características del cuerpo, las serpientes pueden llegar a escapar con facilidad. Además de que deben semejar al hábitat natural de la especie lo más posible (Polo, 2006). Como norma general las serpientes se tienen que mantener en alojamientos individuales (Raiti, 2012). Para aumentar la seguridad en los terrarios de especies venenosas, se recomienda la colocación de candados. Los terrarios pueden ser elaborados de diversos materiales como son madera, plástico o cristal. Los terrarios para culebras que se encuentran en el herpetario Patrulla animal (Figura 9), están elaborados con triplay, poseen una tapa trasera que está unida a la estructura principal por bisagras y contienen un seguro tipo chapa para permitir que ésta se pueda abrir o cerrar. En la parte superior poseen otra tapa unida también por bisagras que permiten levantarla fácilmente. Dicha tapa tiene una especie de rendija cubierta por una malla metálica que favorece la ventilación y la iluminación. La parte frontal está 37 constituida por un cristal de 2 mm de espesor, éste puede deslizarse fácilmente de forma vertical u horizontal dependiendo del tipo de terrario. Este tipo de terrarios se encuentran montados sobre una estructura metálica y cada terrario cuenta unas pequeñas bases de aluminio a cada lado de estos para impedir que se puedan mover hacia los lados, sin embargo pueden desmontarse de las bases de aluminio para poder realizar las labores de limpieza (Figura 10). Figura 9. Terrario diseñado para una serpiente del maíz (Elaphe guttata) en el herpetario Patrulla animal (Tomada por el autor, 2012). Figura 10. Vista posterior de los terrarios para culebras ubicados en el herpetario Patrulla animal (Tomada por el autor, 2012). 38 Los terrarios para especies constrictoras están elaborados a base de cemento, puesto que algunas especies son demasiado pesadas para que el triplay pueda soportar el peso de sus cuerpos (Figura 11). Figura 11. Terrario diseñado para una Pitón real (Python regius) en el herpetario Patrulla animal (Tomada por el autor, 2012). Los terrarios para especies venenosas (Figura 12), están elaborados a base de triplay, no poseen tapa superior y se encuentran montados sobre una estructura metálica a la cual se encuentran fijados con tornillos para evitar que estos se puedan mover. Poseen cerraduras tipo chapa y un túnel con una pequeña puerta fijada al terrario con un tornillo para impedir que la serpiente la pueda abrir, este tipo de túnel facilita el manejo cuando se utiliza la caja trampa para serpientes (Figura 13). 39 Figura 12. Terrario diseñado para una mamba verde (Dendroaspis aungusticeps) en el herpetario Patrulla animal (Tomada por el autor, 2012). Figura 13. Vista posterior del terrario de una serpiente venenosa (Fotografías tomadas por el autor, 2012). 40 5.2.1.1. Diseño del terrario Los terrarios para serpientes pueden clasificarse en 4 tipos, éstos son los terrarios para serpientes excavadoras, los terrarios para serpientes que habitan únicamente en el suelo, los terrarios para serpientes arborícolas y los terrarios para serpientes semiacuáticas (Raiti, 2012). En cualquier caso el sustrato es de vital importancia en la elaboración de un terrario; pueden utilizarse diversos tipos de sustrato como son arena, tierra, fibra de coco o musgo. El tipo de sustrato debe ser elegido con base al tipo de hábitat (tropical, desértico, semiacuático, etcétera) que se quiere recrear para la serpiente. El médico veterinario será el encargado de elegir el más adecuado para cada especie. Las especies excavadoras requieren de un sustrato que abarque unos cuantos cm de espesor y las especies semiacuáticas deben contar además de su sustrato con un estanque en el que puedan sumergirse. Los terrarios deben contar también con un escondite en el cual se puedan introducir las serpientes y un recipiente con agua fresca al que puedan acceder todo el tiempo. En cuanto a especies arborícolas, los terrarios deben ser más altos de lo habitual y deben poseer ramas dispuestas de manera horizontal o vertical situadas a diferentes alturas, en las cuales el ejemplar pueda trepar. 41 En general, el terrario debe poseer una buena ventilación, una fuente de calor (por ejemplo un foco infrarrojo colocado fuera del terrario sobre la parte superior de este), una buena iluminación, un porcentaje de humedad adecuado y una temperatura óptima o preferida dependiendo del tipo de hábitat en el cual se desarrolle la especie. La mayoría de las serpientes tropicales se pueden mantener entre 25 y 30 °C., las serpientes de climas templados se pueden mantener entre 22 y 26 °C. (Raiti, 2012). Se recomienda la instalación de un termómetro para monitorear la temperatura. En cuanto a la humedad, las serpientes tropicales requieren de una humedad relativa alta de entre el 60 y 80%. Las especies desérticas requieren de una humedad de entre el 40 y 50% con picos máximos del 70 % (Cuetzpalin, 2006). Se recomienda la instalación de un higrómetro para monitorear la humedad. En cuanto a las dimensiones del terrario, es importante tomar en cuenta el tamaño máximo que alcanzara la serpiente en su fase adulta. A continuación se describen algunas dimensiones utilizadas para la elaboración del terrario de algunas especies de serpientes: Serpiente del maíz (Elaphe guttata). 60 cm. de largo por 40 cm. de ancho y 50 cm. de alto. 42 Pitón real (Python regius). 90 cm. de largo por 45 cm de ancho y 50 cm. de alto. Mazacuata (Boa constrictor imperator) y Boa cola roja (Boa constrictor constrictor). 120 a 200 cm. de largo por 50 cm. de ancho y 60 cm. de alto (Ambrosi, 2012). Es importante contar con una ficha técnica en la cual se especifiquen las características principales de la especie tales como nombre común, nombre científico, tamaño máximo que llega a alcanzar la especie, longevidad, la localización de la especie, el tipo de hábitat en el que se encuentra (desierto, bosque tropical, selva, etcétera), el tipo de alimentación que realiza la especie en vida libre, la categoría de riesgo de la especie (si se encuentra en peligro de extinción, amenazada, etcétera) y si esta es una especie venenosa o no venenosa. (Figura 14). Figura 14. Ejemplo de ficha técnica utilizada en un terrario del herpetario Patrulla animal (Tomada por el autor, 2012). 43 5.2.2. Equipo y herramientas utilizadas en el manejo de serpientes El equipo y herramientas que se utilizan en un herpetario resultan cruciales en el manejo de serpientes, ya que, cada una de ellas nos facilita los procedimientos de manejo que se requieran emplear. Aunque existen una gran variedad de equipos y herramientas que se pueden utilizar, cabe señalar que el gancho herpetológico es la herramienta que no puede faltar en cada uno de los manejos realizados en un herpetario. Las diversas herramientas y equipo que se utilizan para el manejo de serpientes se describirán a lo largo de este subcapítulo. 5.2.2.1. Ganchos herpetológicos Un gancho herpetológico es una vara de aluminio generalmente de poco peso, que posee un cuerpo largo y delgado. La punta del gancho es ligera pero rígida para que no se doble con el peso del animal y puede tener forma de L, U, Y o T (Figura 15). Esta herramienta se utiliza principalmente para manipular a la serpiente de una manera segura, puesto que evita el contacto directo con el cuerpo del ejemplar. 44 Figura 15. Ganchos herpetológicos empleados en el herpetario Patrulla animal (Tomada por el autor, 2012). 5.2.2.2. Pinzas Tong Este tipo de pinzas constan de un extremo móvil y otro fijo, formando una especie de tenaza. Estas tenazas son distales y están sujetas a un tubo ligero y resistente, que se presenta en varias longitudes y termina en su parte proximal en una empuñadura con la que se controla la acción de la pinza por medio de un gatillo articulado a un mecanismo de soporte. Al igual que los ganchos herpetológicos, permiten mantener una distancia prudente entre la persona que realiza el manejo y el animal; es utilizado principalmente por principiantes en el manejo de especies venenosas (Figura 16). 45 Figura 16. Pinzas Tong empleadas en el herpetario Patrulla animal (Tomada por el autor, 2012). 5.2.2.3. Pinzas para la alimentación de serpientes Las pinzas utilizadas para la alimentación de serpientes son básicamente pinzas que forman parte del instrumental quirúrgico que se utiliza en medicina veterinaria. Entre ellas destacan el Clamp intestinal de Doyen, las pinzas Foerster y las pinzas de disección (Figura 17), siendo estas últimas las que más se utilizan. Los tamaños de dichas pinzas son variables, siendo las de 21 y 45 cm las más ocupadas por los herpetólogos. Estas pinzas están elaboradas a base de acero inoxidable. Al realizar presión sobre un extremo de las pinzas, éstas se cerraran permitiendo sujetar a las presas que se utilizarán como alimento. Con estas pinzas puede mantenerse una distancia prudente entre al animal y la persona que alimentará a la serpiente. 46 Figura 17. Pinzas utilizadas para la alimentación de serpientes. 5.2.2.4. Abrebocas para serpientes Los abrebocas para serpientes, por lo general, vienen en un paquete que contiene varias medidas de éstos. Están elaborados a base de acero inoxidable y contienen un pequeño mango de plástico para poder sujetarlo. Los abrebocas se introducen en la boca de la serpiente para evitar utilizar los dedos, esto trae como beneficio la prevención de mordidas si estos se utilizan adecuadamente. 5.2.2.5. Sondas gástricas Las sondas gástricas se utilizan en la alimentación forzada de serpientes, están elaborados a base de plástico y las podemos encontrar en diversos tamaños y diámetros. 47 5.2.2.6. Estiletes de punta roma Este tipo de sondas pueden ser de plástico o de acero inoxidable, estas últimas son las más utilizadas. Poseen en la punta una pequeña bolita completamente roma. Se utilizan para determinar el sexo en las serpientes, para ello, se introducen en la cloaca del ejemplar (Figura 18). Figura 18. Estiletes de punta roma utilizados para el sexado de serpientes (Tomada de Cuetzpalin, 2006). 5.2.2.7. Caja trampa para serpientes Las cajas trampa son elaboradas principalmente de madera, aunque también pueden ser de plástico. Consisten en una caja cuyo tamaño puede ser variable, en la parte de arriba tienen un pequeño cristal o acrílico por el cual se puede observar a la serpiente. Poseen además un pequeño túnel por el cual puede entrar o salir el 48 ejemplar, dicho túnel tiene en ambos lados una puerta que se encuentra asegurada con tornillos. Se utilizan principalmente para el manejo de serpientes venenosas (Figura 19). Figura 19. Caja trampa para serpientes utilizada en el herpetario Patrulla animal (Tomada por el autor, 2012). 5.2.2.8. Tubo de contención para serpientes Los tubos de contención están elaborados principalmente de acrílico. Existen una gran cantidad de tubos de diversos tamaños y diámetros. Son utilizados principalmente para el manejo de serpientes venenosas, pero pueden ocuparse en cualquier tipo de serpiente. Tienen como ventaja el realizar un manejo seguro en el cual solo se tiene contacto con la parte posterior del ejemplar (Figura 20). 49 Figura 20. Tubos de contención para serpientes (Tomada de Carrasco, 2011). 5.2.2.9 Recipientes plásticos con tapa asegurada Este tipo de recipientes se utilizan como un alojamiento temporal para la serpiente cuando se están haciendo labores de limpieza en su terrario o cuando se va a realizar una posterior contención física. Cabe señalar que dichos botes deben presentar una serie de perforaciones distribuidos a lo largo de todo el recipiente, excepto en la base de este, estos agujeros permitirán una ventilación adecuada para el animal. Figura 21. Recipiente plástico con tapa asegurada. 50 5.2.2.10 Goggles protectores Estos se utilizan para la protección de los ojos cuando se está trabajando con cobras escupidoras. Brindan una buena seguridad a la persona que los esté utilizando. Figura 22. Goggles protectores para los ojos. 5.2.3. Cuarentena Para mantener a largo plazo la salud de cualquier colección de reptiles, es obligatorio colocar todas las nuevas adquisiciones en cuarentena. Dichos ejemplares se mantendrán en cuarentena durante un mínimo de cuatro meses antes de añadirlas a la colección principal (Raiti, 2012). El lugar para los animales en cuarentena debe de ser un cuarto, que se encuentre separado del resto de los ejemplares y debe contar con su propio equipo y mobiliario. Durante el proceso de cuarentena, el animal debe mantenerse en observación y si presenta alguna enfermedad debe atenderse a la brevedad posible. 51 5.3. Sueros antiofídicos Los sueros antiofídicos son productos de origen biológico que se utilizan para el tratamiento de mordeduras producidas por serpientes venenosas. Estos sueros contienen inmunoglobulinas, que son capaces de neutralizar los efectos nocivos del veneno sobre el organismo afectado, pero no pueden invertir los daños ya producidos por lo que deben administrarse lo antes posible. La vía ideal para la administración del suero antiofídico es la intravenosa, aunque también puede administrarse por vía intramuscular y por vía subcutánea. El suero antiofídico es considerado como el único tratamiento que al ser aplicado, de manera efectiva, garantiza las altas posibilidades de recuperación del paciente (Quesada y Rodríguez, 2008). Los sueros antiofídicos pueden ser de dos tipos. Estos pueden ser monovalentes cuando son eficaces contra una determinada especie o polivalentes cuando son eficaces contra varias especies. Las principales especies responsables de los accidentes ofídicos en México son serpientes pertenecientes a los géneros Bothrops y Crotalus. Por lo cual los sueros antiofídicos empleados para el tratamiento de las mordeduras, deben neutralizar los venenos de ambos géneros. (De Roodt et al, 2005). 52 La producción del suero antiofídico consta de cuatro etapas. La primera consiste en la extracción del veneno, la segunda en la inmunización de los animales seroproductores y obtención del plasma hiperinmune, la tercera en el procesamiento y purificación de los anticuerpos y la cuarta etapa consiste en los controles finales (prueba en animales de laboratorio) (Morais, 2007). En de vital importancia contar con sueros antiofídicos en un herpetario, ya que, el contar con éstos, significa que pueden ser administrados inmediatamente después de la mordedura de una especie venenosa. De esta manera, pueden reducirse los efectos nocivos que causa el veneno de la serpiente sobre el cuerpo. Inmediatamente después de la administración del suero, debe trasladarse a la persona que fue mordida a un centro de salud que cuente con sueros antiofídicos para continuar con el tratamiento. En el herpetario Patrulla animal se cuenta con sueros antiofídicos para todas las especies que se encuentran dentro de las instalaciones (Figura 23). Figura 23. Sueros antiofídicos en su lugar de almacenamiento (Tomada por el autor, 2012). 53 5.3.1. Primeros auxilios Los primeros auxilios resultan cruciales durante los primeros minutos que acontecen después de la mordedura de una serpiente venenosa, éstos se mencionan a continuación: 1. Tranquilizar a la persona que fue mordida por la serpiente. 2. Lavar con agua y jabón la herida. 3. Retirar cualquier anillo, pulsera, reloj u otro objeto que pueda comprometer la circulación sanguínea, puesto que algunas especies de serpientes pueden tener un efecto hemotóxico sobre el cuerpo. 4. Identificar la especie de serpiente que originó el accidente. 5. Si se cuenta con suero antiofídico en el herpetario, se deberá administrar inmediatamente, salvo que se trate de una serpiente de la familia Viperidae. Ya que el veneno producido por estas especies causa una coagulopatía y el administrar el suero por vía intramuscular podría conllevar el riesgo de hematomas (ICP, 2009). 54 6. Evitar la utilización de torniquetes, la realización de incisiones en el área afectada, la utilización de compresas frías y la administración de analgésicos; ya que todo esto solo podría agravar la salud de la persona que fue mordida por la serpiente. 7. Trasladar a la persona que fue mordida lo más pronto posible a un centro de salud que cuente con sueros antiofídicos. Se recomienda contar con un escrito en donde se mencionen los procedimientos de primeros auxilios, los números de teléfono de emergencia, los números de teléfono del personal responsable del área y del médico veterinario a cargo de las instalaciones. Dicho escrito deberá estar a la vista para consultarlo en caso de cualquier emergencia. 5.3.2. Prevención de accidentes Para prevenir accidentes dentro de las instalaciones del herpetario es necesario seguir las siguientes recomendaciones: 1. El manejo de serpientes venenosas solo debe ser llevado a cabo por personal con experiencia o bajo la supervisión de éste. 55 2. Durante el manejo de especies venenosas se debe estar siempre atento a lo que se está haciendo. Si se llegase a presentar una situación en la cual el ejemplar se logra liberar durante una contención física, se debe conservar la calma y debe evitarse a toda costa entrar en pánico. 3. Siempre deberán tratar de considerarse las diversas situaciones que pudieran presentarse durante el manejo de serpientes venenosas. 4. En el manejo de cualquier especie animal de vida silvestre es indispensable que se encuentren presentes al menos dos personas durante el procedimiento de manejo. 5. Jamás se debe realizar un manejo en especies venenosas si dicho manejo no se encuentra justificado. 56 5.4. Clasificación de las serpientes para facilitar el manejo en el herpetario Patrulla animal Antes de manipular cualquier especie de serpiente, es de vital importancia, en primer lugar, saber si el espécimen con el que vamos a trabajar es de tipo venenoso o no. Ya que con base en esto, se va a elegir el procedimiento más adecuado para el manejo del ejemplar. Es por ello, que se ha decidido dividir en dos grupos principales a las serpientes. El grupo 1 incluye a las serpientes no venenosas, este a su vez incluye dos subgrupos, que son el de culebras y el de serpientes constrictoras. El grupo 2 incluye a las serpientes venenosas (Figura 24). Figura 24. Clasificación de las serpientes para su manejo en el herpetario Patrulla animal. 57 5.4.1. Grupo 1: Serpientes no venenosas Las serpientes no venenosas son conocidas también como culebras. Algunas de éstas no tienen aparato inoculador de veneno, otras, en cambio, tienen los dientes ponzoñosos ubicados muy atrás en la boca y solo pueden inocular veneno a presas ya introducidas en la cavidad bucal (Maschio 2001). En el grupo 1 se incluyen la familia Colubridae, la mayoría de las especies que se encuentran en el herpetario Patrulla animal pertenecen a este grupo. 5.4.1.1. Culebras El herpetario Patrulla animal cuenta con 9 especies que pertenecen a la familia Colubridae (Figuras 25, 26, 27, 28, 29, 30,31, 32 y 33). Estos animales son de tamaño mediano y de temperamento tímido, ya que, al contacto humano buscan la huida antes que la confrontación, excepto algunas culebras como la Elafe texana (Elaphe obsoleta lindheimeri) que son de temperamento un poco agresivo (Figura 33). 58 Figura 25. Serpiente voladora (Spilotes pullatus) (Tomada por el autor, 2012). Figura 26. Serpiente chirrionera (Masticophis flagellun) (Tomada por el autor, 2012). Figura 27. Serpiente rey de California (Lampropeltis getula californiae) (Tomada por el autor, 2012). 59 Figura 28. Serpiente rey de California aberrante (Lampropeltis getula californiae) (Tomada por el autor, 2012). Figura 29. Serpiente rey de California striped (Lampropeltis getula californiae) (Tomada por el autor, 2012). Figura 30. Falsa coral de Nelson (Lampropeltis triangulum nelsoni) (Tomada por el autor, 2012). 60 Figura 31. Falsa coral de Nelson albina (Lampropeltis triangulum nelsoni) (Tomada por el autor, 2012). Figura 32. Serpiente del maíz (Elaphe guttata) (Tomada por el autor, 2012). Figura 33. Elafe texana (Elaphe obsoleta lindheimeri) (Tomada por el autor, 2012). 61 5.4.1.2. Serpientes constrictoras El herpetario Patrulla animal, cuenta con dos especies que pertenecen a la familia Boidae (Figuras 34 y 35) y cinco especies que pertenecen a la familia Phytonidae (Figuras 36, 37, 38, 39 y 40). Este tipo de serpientes se caracteriza por poseer las especies más grandes del mundo como las grandes anacondas y los pitones reticulados. Estas son serpientes de musculatura increíblemente desarrollada, estas especies por lo general son muy lentas, debido a que son muy pesadas y robustas. La técnica que utilizan para cazar a sus presas es la de emboscada, en la cual esperan a que su presa pase al lado de ellas para que posteriormente lancen su mordida hacia sus víctimas; una mordida que sirve solo para sujetarlas, ya que posteriormente rodearán con sus poderosos músculos a su presa hasta asfixiarla, causándole la muerte. Figura 34. Mazacuata (Boa constrictor imperator) (Tomada por el autor, 2012). 62 Figura 35. Mazacuata albina (Boa constrictor imperator) (Tomada por el autor, 2012). Figura 36. Pitón birmano (Python molurus bivittatus) (Tomada por el autor, 2012). Figura 37. Pitón birmano albino (Python molurus bivittatus) (Tomada por el autor, 2012). 63 Figura 38. Pitón reticulado (Python reticulatus) (Tomada por el autor, 2012). Figura 39. Pitón reticulado tigre (Python reticulatus) (Tomada por el autor, 2012). Figura 40. Pitón real (Python regius) (Tomada por el autor, 2012). 64 5.4.2. Grupo 2. Serpientes venenosas Entre las 3,000 diferentes especies de serpientes que existen en el mundo apenas la sexta parte son verdaderamente venenosas (Tay Zavala et al, 2002). En este subgrupo se incluye a la familia Viperidae y a la familia Elapidae. En el herpetario Patrulla animal se cuenta con una amplia variedad de especies venenosas, que van desde la víbora de cascabel diamantada (Crotalus atrox) localizada en el norte de nuestro país, hasta la cobra escupidora negra (Naja siamensis) localizada en Tailandia. 5.4.2.1. Viperidos y crótalos El herpetario Patrulla animal, cuenta con siete especies que pertenecen a la familia Viperidae (Figuras 41, 42, 43, 44, 45, 46 y 47). Este tipo de serpientes, poseen colmillos móviles que se retraen cuando la boca está cerrada y se vuelven a desplegar cuando lanzan la mordida para atacar a sus presas, su veneno es principalmente del tipo hemolítico, además estas son de cabeza triangular y pupilas verticales. 65 Figura 41. Víbora de cascabel tropical (Crotalus durissus) (Tomada por el autor, 2012). Figura 42. Víbora de cascabel diamantada (Crotalus atrox) (Tomada por el autor, 2012). Figura 43. Víbora cascabel del pacifico (Crotalus basiliscus) (Tomada por el autor, 2012). 66 Figura 44. Víbora de Gabón (Bitis gabonica) (Tomada por el autor, 2012). Figura 45. Víbora bufadora (Bitis arietans) (Tomada por el autor, 2012). Figura 46. Cantil común (Agkistrodon bilineatus) (Tomada por el autor, 2012). 67 Figura 47. Nauyaca real (Bothrops asper) (Tomada por el autor, 2012). 5.4.2.2. Elapidos El herpetario Patrulla animal, cuenta con cinco especies que pertenecen a la familia Elapidae (Figura 48, 49, 50, 51 y 52). En esta familia, se encuentran especies cuyo veneno es principalmente neurotóxico. Son muy semejantes a los colúbridos, ya que también tienen cuerpos largos y finos y pupilas redondas. Figura 48. Cobra de monóculo (Naja kaouthia) (Tomada por el autor, 2012). 68 Figura 49. Cobra de monóculo albina (Naja kaouthia) (Tomada por el autor, 2012). Figura 50. Cobra escupidora negra (Naja siamensis) (Tomada por el autor, 2012). Figura 51. Cobra escupidora roja (Naja pallida) (Tomada por el autor, 2012). 69 Figura 52. Mamba verde (Dendroaspis aungusticeps) (Tomada por el autor, 2012). 70 5.5. Procedimientos para el manejo de serpientes no venenosas en el herpetario Patrulla animal En el herpetario Patrulla animal existen diversos procedimientos para el manejo de serpientes no venenosas, se debe destacar que el procedimiento a utilizar debe ser inofensivo para el animal y al mismo tiempo debe brindar la suficiente seguridad para el personal que va a realizar el manejo. Es por ello que antes de realizar cualquier tipo de manejo se deben plantear las siguientes preguntas: ¿Con que tipo de serpiente vamos a trabajar? (una culebra o una serpiente constrictora). ¿Qué es lo que vamos a hacer? (limpieza del terrario, alimentación de la especie o una contención física). ¿Qué herramientas necesitamos? (Gancho herpetológico, pinzas Tong, costal de manejo, pinzas de alimentación, etcétera). Con el fin de responder a estas interrogantes, se ha subdividido este capítulo en dos apartados: culebras y serpientes constrictoras. En cada uno de ellos se describirán los procedimientos de manejo que se emplean en el herpetario Patrulla animal para la limpieza de terrarios, la alimentación del ejemplar y la contención física del animal, como es en el caso de proporcionarle la alimentación forzada. 71 5.5.1. Culebras El manejo de culebras en el herpetario Patrulla animal es relativamente sencillo de realizar, ya que muchas de estas especies están acostumbradas (por así decirlo) a la presencia humana. Por lo que el manejo se facilita enormemente. No obstante, es importante recordar que aunque estas especies no poseen veneno, que pueda comprometer nuestras vidas, lo compensan con una extraordinaria agilidad y rapidez para desplazarse. Razón por la cual suelen ser muy escurridizas y escapar fácilmente de nuestra presencia a la primera oportunidad que tengan, si no tomamos las medidas adecuadas. Otro factor importante a considerar, es que las personas que realicen el manejo de la serpiente, no deberán confiarse por el hecho de que ésta se muestre aparentemente tranquila; ya que son animales que pueden reaccionar de diversas formas y el exceso de confianza puede ocasionar accidentes. 5.5.1.1. Procedimiento de manejo empleado para la limpieza del terrario La limpieza del terrario constituye una función primordial para la prevención de enfermedades en el herpetario. Ya que las serpientes al estar confinadas en un espacio limitado, conviven constantemente con sus propios excretas, resultado de la digestión de sus presas. Dichos desechos pueden contaminar el agua y el sustrato que comprende el terrario del animal, si estos no son retirados 72 periódicamente, obteniendo como resultado enfermedades que pueden afectar la salud del ejemplar. Por esta razón es importante la limpieza del terrario. Antes de realizar cualquier movimiento del animal, se debe tener a la mano: Un gancho herpetológico. Un recipiente de plástico con tapa para colocar a la serpiente. Un recipiente con agua o una toma de agua. Papel periódico u otro material que pueda ser utilizado para limpieza. Un líquido limpiador para vidrios. Una pala para recoger las excretas. Cabe señalar que en este tipo de procedimiento así como en todos los que se lleven a cabo con animales silvestres, es necesaria la presencia de dos personas que tengan experiencia en el manejo de serpientes. El procedimiento de manejo empleado para la limpieza del terrario se describe a continuación: 1. Colocar el terrario preferentemente en una mesa, para que pueda realizarse el manejo sin necesidad de estarse agachando. Una persona se encargara de hacer el manejo del animal, para ello, debe levantar la tapa del terrario lentamente, esto para evitar estresar al animal. La otra persona debe tomar el recipiente de plástico, lo debe destapar y debe permanecer en espera de que se introduzca a la serpiente en el bote y con la tapa a la mano. 73 2. La persona encargada de realizar el manejo del animal, Introducirá el gancho herpetológico en el terrario de forma que se pueda levantar a la serpiente de la unión imaginaria que existe entre el primer y segundo tercio de su cuerpo, (si lo prefiere, puede utilizar dos ganchos herpetológicos para tomar a la serpiente) después colocara a la serpiente en el recipiente plástico, la otra persona deberá cerrar el recipiente rápidamente para impedir que la serpiente escape. 3. Una vez que la serpiente se encuentra en el recipiente, se deben retirar las excretas del sustrato y verificar si este es necesario cambiarse (dependiendo del sustrato este puede llegar a cambiarse hasta cada 4 meses). Si existe una muda de piel o pedazos de esta retirarlos también. 4. Retirar el recipiente para agua y después de lavarlo muy bien llenarlo con agua fresca, pero no introducirlo sino hasta después de haber limpiado el cristal del terrario. 5. Si es necesario, limpiar el cristal con un líquido para este, rociándolo por ambos lados y secándolo con papel periódico u otro material. Después de limpiar el cristal, una persona introducirá el recipiente con agua en el terrario y permanecerá otra vez en espera de que se introduzca a la serpiente en el terrario sosteniendo la tapa de dicho terrario. 6. La otra persona, deberá sacar a la serpiente del recipiente plástico de la misma forma en que la sacó del terrario al comienzo del procedimiento y la colocara de 74 nueva cuenta en su respectivo terrario, la otra persona cerrara la tapa del terrario una vez que la serpiente se encuentre dentro de este. Por ultimo hay que cerciorarse de que el terrario haya quedado completamente cerrado para evitar que el animal se pueda fugar. 5.5.1.2. Procedimiento de manejo empleado para la alimentación La alimentación, en el caso de los colúbridos en el herpetario Patrulla animal, se realiza cada ocho los días. El día de la semana en que se realiza este procedimiento es el día martes. El alimento utilizado para estos reptiles consiste en ratones árabes (Mus musculus) previamente descongelados (estos pueden descongelarse colocándolos en una bolsa y colocándolos en agua sin que esta los cubra completamente) o recién sacrificados. Dichos ratones son encargados por pedido a un proveedor autorizado. Cabe señalar que al proporcionarles alimento “muerto” a este tipo de reptiles evitamos que el ratón llegue a provocarle lesiones a la serpiente al intentar defenderse de esta. Además disminuimos la agresividad de la especie en cuestión y por tanto tendremos una serpiente de temperamento más dócil que se dejara manipular más fácilmente. Para evitar heridas y disminuir el riesgo de transferencia de parásitos a partir de los roedores, se recomienda ofrecer animales criados en laboratorio previamente muertos y descongelados (Raiti, 2012). 75 La alimentación de las serpientes, a pesar de ser un proceso relativamente sencillo, debe ser llevada a cabo por un mínimo de dos personas con experiencia en el manejo de serpientes. El procedimiento de manejo empleado para la alimentación de describe a continuación: 1. Colocar el terrario de preferencia en un lugar accesible y cómodo para realizar el manejo, en donde no se tenga que estar realizando muchos movimientos y se cuente con una vista total del interior del terrario. Una mesa sería una buena opción. 2. Una persona deberá sujetar al ratón del cuerpo por debajo de las extremidades anteriores con unas pinzas de alimentación para serpientes. La otra persona deberá hacerse cargo de controlar la tapa del terrario, abriéndola para que la persona que va a alimentar al animal pueda introducir el alimento. 3. La persona que va a alimentar introducirá al terrario las pinzas y le ofrecerá a la serpiente el ratón exponiendo la cabeza que es a donde el reptil lanzara la mordida para sujetar a su presa, una vez que la serpiente muerda el ratón retirara las pinzas y la otra persona cerrara la tapa del terrario y la asegurara. Una vez finalizado el procedimiento, se colocara el terrario en su respectivo lugar. 76 5.5.1.2.1. Procedimiento de manejo empleado para la alimentación forzada con sonda La alimentación en serpientes, generalmente se realiza de una forma relativamente sencilla, una serpiente puede dejar de comer por enfermedad, también puede dejar de comer cuando está pasando por un proceso de ecdisis (muda de la piel) o cuando haya estado sometida a estrés, por ejemplo generado por el traslado del animal de su antiguo terrario a otro nuevo o por el manejo físico del ejemplar para la administración de tratamientos. Es por ello que es importante identificar la causa por la cual la serpiente se esté negando a comer y corregirla lo antes posible. La alimentación forzada es una técnica de manejo que se emplea para proporcionarle alimento de manera asistida a la serpiente por medio de una sonda gástrica o sonda de alimentación cuando este se ha negado a comer por si misma por un largo periodo de tiempo. Esta técnica debe ser empleada como último recurso para impedir que la serpiente baje su condición corporal o en el peor de los casos muera por inanición. Para medir la condición corporal del animal, este puede pesarse, para ello una persona deberá tomar un costal de manejo para serpientes, el cual está elaborado a base de manta y lo abrirá sosteniéndolo con un gancho herpetológico a cada extremo del costal y lo apoyara sobre una mesa o en el mismo suelo, otra persona tomara a la serpiente con un gancho herpetológico de la unión del primer y segundo tercio del animal y la depositara 77 dentro del costal, una vez realizado esto, sacara el gancho tomara el costal, le dará unos cuantos giros y apoyara dicho costal sobre el gancho herpetológico, por último la pesara. Después de pesarla, la colocara nuevamente en su terrario vaciando el costal sobre este. Es importante llevar un registro de pesos mensual de todos los animales del herpetario. Para llevar a cabo el procedimiento de alimentación forzada, es necesaria la utilización de una contención física. La contención física es la acción de inmovilizar a los animales con el uso de instrumentos o herramientas físicas (Morales y Mendoza, 2000). En este caso para el manejo de serpientes la herramienta más utilizada es el gancho herpetológico. Antes de realizar el manejo para la alimentación forzada con sonda es necesario contar con lo siguiente: Sonda gástrica. Jeringas estériles (estas pueden ser de 5 o 10 ml). Abrebocas para serpientes. Pinzas de disección. Gancho herpetológico. Recipiente que contenga el alimento a proporcionar. Cabe destacar que todo lo mencionado anteriormente debe ser del tamaño adecuado para la talla de la serpiente que será alimentada, por lo cual puede 78 variar para cada individuo. Para este tipo de manejo es necesaria la presencia de mínimo dos personas con experiencia en el manejo de serpientes, una que se encargara de la contención física del ejemplar y la otra de la administración del alimento. El alimento que se le proporcionara a la serpiente debe licuarse perfectamente y debe poseer una consistencia liquida para facilitar la administración de este a través de la sonda gástrica. El tipo de alimento y la cantidad que se administrará será a criterio del médico veterinario. El procedimiento de manejo empleado para la alimentación forzada con sonda se describe a continuación: 1. Dividir imaginariamente a la serpiente en tres partes, la persona encargada de la contención física, tomara a la serpiente con un gancho herpetológico del primer tercio del cuerpo y la retirara del terrario, después la colocara sobre una mesa para mayor comodidad. 2. La persona encargada de realizar la contención física, con la ayuda de un gancho herpetológico, deberá colocar la parte larga del gancho sobre la región de la nuca del animal, posteriormente sujetara a la serpiente con la otra mano apoyando los dedos pulgar e intermedio por detrás de las mandíbulas y el dedo índice sobre la cabeza de la serpiente. Una vez que la sujete, deberá soltar el gancho herpetológico y sujetara con la otra mano el cuerpo del animal. 79 3. Una vez realizada la contención física, el ayudante deberá tomar la sonda y sumergirá la primera porción de esta en el recipiente que contiene el alimento para lubricarla un poco, se debe seleccionar un abrebocas que sea adecuado para el tamaño de la serpiente y se debe introducir de manera horizontal en la boca del animal de manera lateral a la cabeza de la serpiente, el abrebocas debe girarse para que quede incrustado en la boca y la serpiente no pueda cerrarla. Es importante llenar la sonda con la ayuda de una jeringa (sin ajuga) con una porción del alimento y realizar un pequeño dobles con los dedos sobre la sonda para que al momento de introducirla y empezar a alimentar a la serpiente no entre demasiado aire en el estómago. 4. La persona encargada de la contención física del animal no deberá ejercer mucha presión sobre la cabeza y el cuerpo del ejemplar ya que entre más presión se ejerza sobre este más luchara la serpiente por liberarse. El ayudante deberá tomar la sonda con las pinzas de disección e ir introduciendo esta lentamente en la boca del ejemplar, la sonda debe irse deslizando poco a poco y con mucho cuidado sobre el esófago para evitar lastimar al animal. Debe irse calculando que porción de la sonda se encuentra en el esófago, para calcular esto basta con dividir imaginariamente al animal en 3 partes, la sonda debe llegar aproximadamente hasta la unión entre el primer y segundo tercio. 5. Una vez introducida la sonda, levantar esta de manera que el alimento se vaya desplazando por gravedad, soltar el dobles que se había hecho anteriormente en 80 la sonda y empezar a alimentar a la serpiente, la cantidad de alimento a utilizar dependerá del tamaño del ejemplar. 6. Por último se debe retirar la sonda cuidadosamente para evitar causarle alguna lesión a la serpiente y posteriormente el abrebocas. El ejemplar se colocara de vuelta en su terrario y se mantendrá en observación para comprobar que esta no regurgite el alimento. Si el animal regurgita, se repetirá el procedimiento dos o 3 días después para permitir que disminuya el estrés del animal. 5.5.2. Serpientes constrictoras En el herpetario Patrulla animal, el manejo de serpientes constrictoras se realiza de manera rutinaria en especies tales como la Pitón birmana (Python molurus bivittatus). Esta se saca de su terrario para ser exhibida ante el público y de esta forma, se atrae la atención de las personas que se encuentran fuera del herpetario para que visiten las instalaciones. No obstante en otras especies como la pitón reticulada (Pitón reticulatus), solo se saca de su alberque para realizar la limpieza de este, en caso de que se necesite realizar una alimentación forzada o para aplicarle algún tratamiento ya que es de temperamento muy agresivo y debido a que mide 4 metros de largo y pesa cerca de 40 kg se necesita un mínimo de tres personas para poder manipularla. 81 En general, el manejo de serpientes constrictoras se dificulta un poco en primer lugar por el tamaño y peso que llegan a alcanzar estos animales y en segundo lugar por la agresividad que poseen algunas especies. Es por ello que todo el personal de las instalaciones debe tener conocimiento acerca de la biología de la especie. 5.5.2.1. Procedimiento de manejo empleado para la limpieza del terrario La limpieza el terrario al igual que en las culebras, es indispensable para preservar la salud del animal y aunque el manejo es similar, existen algunas variaciones en el procedimiento. Los materiales y herramientas que necesitamos para el manejo son los mismos que para el manejo de culebras, solo deben ajustarse al tamaño de la serpiente constrictora que se va a manejar, estos se citan a continuación: Ganchos herpetológicos. Un recipiente de plástico de 200 litros con tapa para colocar a la serpiente. Un recipiente con agua o una toma de agua. Papel periódico u otro material que pueda ser utilizado para limpieza. Un líquido limpiador para vidrios. Una pala para recoger las excretas. 82 A diferencia de los terrarios de las culebras que pueden sacarse del área de exhibición, los terrarios de las serpientes constrictoras permanecen fijos y no pueden moverse, razón por la cual la limpieza del terrario debe realizarse en el área de exhibición, todos los terrarios cuentan con un vidrio que puede deslizarse fácilmente para poder acceder al terrario. En este tipo de procedimiento es necesaria la presencia de un minino de dos personas con experiencia en el manejo de serpientes. Una se encargara del manejo del ejemplar y la otra se encargara de ayudar en el proceso de limpieza. El procedimiento de manejo para la limpieza del terrario se describe a continuación: 1. Es indispensable que la zona en donde se va a realizar el manejo se encuentre completamente despejada. La persona encargada de realizar el manejo de la serpiente deberá deslizar el cristal con cuidado (este tipo de cristales se mueven lateralmente), a continuación tomara dos ganchos herpetológicos y con estos tomara a la serpiente colocando un gancho en el primer tercio del cuerpo de la serpiente y el otro gancho entre el segundo y tercer tercio, mientras tanto el ayudante deberá tener a la mano el recipiente de plástico ya destapado. 2. El encargado de realizar el manejo, colocara a la serpiente en el recipiente de plástico introduciendo primero la cabeza del animal y después el cuerpo, el ayudante deberá cerrar el recipiente en cuanto esta se encuentre dentro y lo asegurara. 83 3. Una vez realizado lo anterior, el ayudante debe seguir deslizando todo el cristal hasta que salga por completo, después deberá limpiarlo lo más rápido posible mientras la otra persona colecta las excretas que se encuentran en el terrario con la ayuda de una pala para recolectar heces, saca el recipiente para agua y retira la muda de piel si es que la hay. 4. El ayudante deberá tomar el recipiente y lo deberá lavar muy bien, después lo rellenara con agua fresca y lo colocara de nueva cuenta en el terrario. 5. El ayudante debe colocar nuevamente el cristal deslizándolo con cuidado, pero dejara un espacio suficiente para poder introducir a la serpiente en su terrario. 6. Una vez que se realizó la limpieza del terrario, se deberá colocar a la serpiente en su terrario, para ello el ayudante levantara la tapa del recipiente para que la persona encargada del manejo de la serpiente la tome de nueva cuenta con los dos ganchos herpetológicos, después de esto, el ayudante se mantendrá al pendiente para deslizar el cristal. 7. El encargado de realizar el manejo colocara a la serpiente dentro del terrario introduciendo primero la cabeza del animal y después el cuerpo, en cuanto el animal se encuentre dentro, el ayudante deslizara el cristal hasta cerrarlo completamente. 84 Cabe señalar que para la limpieza del terrario de la Pitón reticulada (Python reticulatus) es necesario que participen en el manejo un mínimo de tres personas con experiencia en el manejo de serpientes, dos de las cuales utilizaran los ganchos herpetológicos para manipular a la serpiente mientras otra persona les asiste. 5.5.2.2. Procedimiento de manejo empleado para la alimentación La alimentación de las serpientes constrictoras, al igual que en las culebras, se realiza con presas recién sacrificadas o con presas previamente descongelas; dependiendo del tamaño del ejemplar pueden utilizarse ratas albinas (Rattus novergicus) o conejos (Oryctolagus cuniculus) principalmente. La alimentación de serpientes constrictoras en el herpetario Patrulla animal se realiza cada 15 días. El día de la semana seleccionado para realizar este procedimiento es el día miércoles. Para realizar este procedimiento, es necesaria la presencia de un mínimo de dos personas con experiencia en el manejo de serpientes, una se encargara de realizar la manipulación de la serpiente y la otra le asistirá. El material que se utilizara se describe a continuación: Ganchos herpetológicos. Recipientes de plástico de 200 litros con tapa. Pinzas para la alimentación de serpientes. 85 Alimento a proporcionar. El procedimiento de manejo para la alimentación de serpientes constrictoras se describe a continuación: 1. El ayudante debe deslizar el cristal del terrario, mientras la persona que manipulara a la serpiente tomara dos ganchos herpetológicos, los introducirá en el terrario y tomara a la serpiente con estos (de igual forma que se describió en el apartado de limpieza del terrario). Mientras tanto el ayudante deberá destapar el recipiente de plástico. 2. Se colocara a la serpiente dentro del recipiente de plástico, una vez hecho esto, el ayudante deberá tapar el bote y lo asegurara. 3. Una persona deberá tomar el alimento de la serpiente, el ayudante deberá destapar nuevamente el bote de plástico y se le ofrecerá la presa a la serpiente de manera que esta al lanzar la mordida, la tome por la cabeza, cuando esto suceda, debe soltarse la presa retirando la pinza rápidamente, asegurarse de cerrar bien el bote al terminar este procedimiento. 4. Después de asegurarse que la serpiente ingirió su alimento, se deberá colocar al animal nuevamente en su terrario con mucho cuidado utilizando los dos ganchos herpetológicos. 86 5.5.2.2.1. Procedimiento de manejo empleado para la alimentación forzada La alimentación forzada en serpientes constrictoras implica la participación de al menos dos personas en la alimentación de especies de tamaño pequeño como en el caso de la Pitón real (Python regius) y al menos tres personas en la alimentación de especies de tamaño mediano como la Pitón birmana (Python molurus bivittatus). A diferencia de la alimentación forzada en culebras en donde se utiliza una sonda, en serpientes constrictoras de gran tamaño se utiliza preferentemente una presa entera, la cual será introducida poco a poco hasta que la serpiente logre tragarla por completo. Las herramientas y materiales que utilizaremos durante el procedimiento son los siguientes: Ganchos herpetológicos de diversos tamaños limpios. Pinzas de alimentación para serpientes. Alimento previamente descongelado o recién sacrificado. El procedimiento de manejo empleado para la alimentación forzada se describe a continuación: 1. Sacar a la serpiente de su terrario y colocarla en una mesa para facilitar el manejo del animal, si esto no es posible, se puede realizar a nivel del suelo. 87 2. Una persona se valdrá de la ayuda de un gancho herpetológico y colocara la parte alargada suavemente sobre la nuca del animal, después sujetara con una mano la cabeza del ejemplar. Al mismo tiempo que se está manipulando la cabeza, otra persona se encargara de sujetar el resto del cuerpo. 3. Posteriormente utilizara un gancho herpetológico pequeño y lo colocara de forma horizontal frente a la boca del paciente y ejercerá una ligera presión para abrir esta, el gancho deberá dejarse dentro de la boca, no debe sacarse. 4. La persona que está ayudando a sostener el cuerpo de la serpiente deberá seguir sujetándola con una mano y con la otra deberá ejercer una ligera presión con el gancho herpetológico hacia la mandíbula inferior del animal para que esta abra la boca. 5. Una vez que la boca del animal se encuentra abierta, la persona que sujeta la cabeza debe tomar con las pinzas de alimentación a la presa por la cola, colocarla en la boca del ejemplar y empujarla lentamente a través del esófago, la presa debe llegar por lo menos hasta la mitad del primer tercio de la serpiente. 6. Estimular el cuerpo de la serpiente con una mano para que trague la presa y con la otra mano seguir sujetando la cabeza. Verificar que la serpiente la degluta completamente y no la devuelva, si esto sucede, realizar el procedimiento nuevamente uno o dos días después. 88 7. Por último debe colocarse a la serpiente en su terrario y verificar que esta no regurgite el alimento que le proporcionamos anteriormente (Figura 53). Colocar alimento en la boca Verificar que no regurgite Empujarlo con unas pinzas Estimular a la serpiente Figura 53. Alimentación forzada de una Pitón birmana (Python molurus bivittatus) (Fotografías tomadas por el autor, 2012). 89 5.6. Procedimientos para el manejo de serpientes venenosas en el herpetario Patrulla animal El manejo de serpientes venenosas es un tema que no debe tomarse a la ligera debido a las consecuencias fatales en que puede resultar un procedimiento mal empleado; es por ello que solo debe ser ejecutado por personas con experiencia o bajo la supervisión de estas. Antes de aventurarse a realizar el manejo de serpientes venenosas es indispensable haber realizado una cantidad razonable de contenciones físicas con especies no venenosas, así como haber estado presente como observador en manejos realizados en especies venenosas. En el herpetario Patrulla animal el manejo de serpientes venenosas solo es realizado por personal con experiencia y al igual que en culebras y serpientes constrictoras, se ejecuta solo cuando se tiene que limpiar el terrario, cuando se alimenta a los ejemplares o cuando se tiene que realizar una contención física para administrarle algún tratamiento a la serpiente (Figura 54). 90 Figura 54. Contención física de una Víbora de cascabel tropical (Crotalus durissus). Como ya se ha mencionado con anterioridad, el manejo de cualquier especie silvestre (en este caso el de serpientes venenosas), requiere de al menos dos personas para ejecutarlo. 5.6.1. Procedimiento de manejo empleado para la limpieza del terrario La limpieza del terrario en serpientes venenosas requiere de una serie de técnicas y herramientas que en conjunto nos brinden seguridad para realizar este tipo de manejo. Es por ello que para la limpieza del terrario nos valemos de la ayuda de la caja trampa, esta además de brindarnos seguridad, nos facilita el trabajo. 91 5.6.1.1. Procedimiento de manejo empleado para la utilización de la caja trampa La caja trampa es una herramienta muy útil en el manejo de serpientes venenosas, esta es básicamente una caja que se coloca como una extensión en el terrario de la serpiente; es necesario que el terrario contenga un tipo de canal o túnel al cual se conecte la caja trampa para que la serpiente pueda salir del terrario e ingresar a dicha trampa, esta a su vez, debe contener una pequeña puerta fijada con tornillos que permitan al personal que realiza la maniobra tener un control sobre la entrada y salida del animal (Figura 55). Figura 55. Túnel ubicado en la parte posterior del terrario de una serpiente venenosa (Tomada por el autor, 2012). 92 La caja trampa puede ser construida en base a diversos materiales y tamaños según se requiera. Es recomendable contar con una caja trampa en la cual pueda caber la especie venenosa más grande que posea el herpetario, esta podrá ser utilizada para todas las serpientes venenosas que se encuentran en las instalaciones. La caja trampa que se utiliza en el herpetario Patrulla animal está elaborada con triplay y contiene una tapa de cristal en la parte superior, el cristal es importante puesto que nos permite observar si el animal está realmente dentro de la caja o no. Antes de ejecutar este tipo de manejo, es importante contar con lo siguiente: Caja trampa para serpientes. Varilla de plástico (Esta deber ser rígida, delgada y larga). Líquido para la limpieza de cristales. Pala para la recolección de excretas. Bomba de aspersión. El procedimiento de manejo empleado para la utilización de la caja trampa es el siguiente: 1. Colocar la caja trampa de manera que el túnel del terrario entre dentro del túnel de la caja trampa, es importante que estos coincidan perfectamente para no dejar un espacio por el cual pueda escapar la serpiente (Figura 56). 93 Figura 56. Colocación de la caja trampa en el terrario (Tomada por el autor, 2012). 2. Como ya se mencionó anteriormente, existen 2 pequeñas puertas de seguridad, una puerta que conecta al túnel con la parte anterior de la caja trampa y otra que permite cerrar la entrada hacia la caja trampa, ambas puertas deben abrirse para permitir que el animal tenga acceso a la trampa. 3. Los terrarios de las serpientes venenosas en el herpetario Patrulla animal poseen un pequeño espacio en la parte trasera del terrario, en el cual se va a introducir una varilla de plástico para obligar a la serpiente a entrar en el túnel que la conducirá a la caja trampa. Cabe destacar que dicho espacio es tan pequeño que solo puede pasar por este la varilla de plástico, por lo cual la serpiente no tendrá forma de accesar a este espacio y escapar. 4. Una vez que se ha cerciorado que la serpiente se encuentra en la caja trampa, debe cerrarse en primer lugar la puerta que conecta al terrario con el túnel y en 94 segundo lugar la puerta que conecta el túnel con la caja trampa, esto debe hacerse lo más rápido posible para impedir que la serpiente regrese por el túnel hacia el terrario. 5. Retirar la caja trampa y colocarla en un lugar seguro (por ejemplo sobre una mesa). 6. Una vez que se hayan cerrado las puertas que conectan al túnel con la caja trampa, se procede a realizar la limpieza del terrario, retirando con una pala las excretas y los restos de la muda de la serpiente (si es que los hay). También se retira el traste para agua, se lava perfectamente, se rellena con agua fresca y se vuelve a colocar dentro del terrario. 7. Verificar la humedad del sustrato, para ello basta con colocarse un guante y tomar un poco del sustrato con este y observar si este no se encuentra demasiado seco (se recomienda la colocación de un higrómetro para verificar fácilmente la humedad), asperjar con una bomba de aspersión este si es que lo requiere. Si el sustrato se encuentra muy deteriorado, sustituirlo. 8. Limpiar los cristales si es que se requiere con un líquido para cristales. 9. Por último antes de colocar a la serpiente en el terrario, verificar que este se encuentre completamente cerrado, una vez que se corroboro esto, volver a colocar la caja trampa, abrir ambas compuertas y con la varilla de plástico, tocar a 95 la serpiente para que esta se deslice de vuelta hacia el terrario, una vez que está dentro de este, cerrar ambas puertas y retirar nuevamente la caja trampa. 5.6.2. Procedimiento de manejo empleado para la alimentación La alimentación de serpientes venenosas, al igual que en serpientes no venenosas y constrictoras, debe adaptarse a las necesidades del ejemplar. Las presas que se utilizan en la alimentación de serpientes venenosas en el herpetario Patrulla animal son principalmente ratones árabes (Mus musculus) y ratas albinas (Rattus novergicus), dicho alimento es encargado a un proveedor autorizado. El tamaño de la presa dependerá del tamaño del animal que se va a alimentar. Cabe señalar que en la alimentación de serpientes venenosas puede utilizarse alimento vivo o muerto. Si se utiliza alimento vivo, el médico veterinario se debe asegurar de que se trata de un animal libre de parásitos para que estos no sean trasmitidos a la serpiente; si se utiliza alimento muerto, la presa debe haberse descongelado previamente o debe de haberse sacrificado recientemente. La alimentación de serpientes venenosas en el herpetario Patrulla animal se realiza cada ocho días. El día de la semana que se utiliza para llevar a cabo este procedimiento es el día jueves. En este tipo de manejo es necesaria la presencia 96 de un mínimo de dos personas con experiencia en el manejo de serpientes venenosas. El procedimiento de manejo para la alimentación de serpientes venenosas se describe a continuación: 1. Sujetar la presa del cuerpo por debajo de las extremidades anteriores con unas pinzas de alimentación. 2. Los terrarios de serpientes venenosas al igual que los terrarios para serpientes no venenosas y serpientes constrictoras, poseen una puerta en la parte trasera; la tarea de la persona que va a servir de asistente en el proceso, es vigilar que el ejemplar se encuentre lejos de esta puerta; si se encuentra demasiado cerca, debe tratar de llamar la atención del animal para que la cabeza del ejemplar no este apuntando hacia la puerta. 3. Una vez que el asistente ha conseguido la atención de la serpiente, la persona que va a alimentar a la serpiente, debe abrir la puerta y colocar con las pinzas de alimentación a la presa dentro del terrario, posteriormente debe cerrar la puerta y asegurarla. Este proceso debe ser ejecutado rápidamente para evitar que la serpiente intente fugarse de su resguardo. 4. Si el alimento que se le proporciono a la serpiente es una presa viva, debe mantenerse en observación al ejemplar hasta que esta haya ingerido su alimento. 97 5.6.2.1. Procedimiento de manejo empleado para la alimentación forzada con sonda La alimentación forzada con sonda en serpientes venenosas, es un procedimiento que requiere de mucha práctica para ser llevado a cabo, es por ello, que se recomienda que antes de realizar este tipo de manejo en especies venenosas, se haya realizado un buen número de sondeos con serpientes no venenosas. La alimentación asistida solo se utilizara como una opción para alimentar a la serpiente temporalmente y por tanto no debe tomarse como un proceso rutinario de alimentación debido al alto riesgo que implica tanto para el personal que realiza el manejo como para el animal. El material y equipo que necesitamos para realizar este procedimiento es el siguiente: Sonda gástrica. Jeringas estériles (estas pueden ser de 5 o 10 ml). Abrebocas para serpientes. Pinzas de disección. Gancho herpetológico. Recipiente que contenga el alimento a proporcionar. 98 La sonda gástrica, el gancho herpetológico y la cantidad de alimento a proporcionar deben ser relativos al tamaño de la serpiente a manejar. Este procedimiento debe ser llevado a cabo por un mínimo de 2 personas. El procedimiento de manejo empleado para la alimentación forzada con sonda es el siguiente: 1. Dividir imaginariamente a la serpiente en tres partes, tomarla con un gancho herpetológico del primer tercio del cuerpo y retirarla del terrario; colocarla sobre una mesa para realizar la posterior contención física. 2. Una persona realizara una contención física del ejemplar, para ello, tomara un gancho herpetológico y colocara lentamente la parte del mango del gancho sobre la articulación de la nuca del animal ejerciendo una ligera presión. 3. Sujetara al ejemplar colocando los dedos pulgar y medio por detrás de la mandíbula de la serpiente y el dedo índice sobre la cabeza del animal, la presión ejercida sobre la cabeza debe ser suficiente para garantizar que el ejemplar no pueda liberarse (Figura 57). Mientras tanto deberá utilizar la otra mano para sujetar el cuerpo de la serpiente. La presión excesiva sobre la cabeza tendrá como consecuencia que la serpiente se estrese demasiado e intente mordernos para liberarse. Es importante que los dedos restantes se retiren lo más posible de la cabeza y bajo ninguna circunstancia se coloquen debajo de la mandíbula inferior 99 de la serpiente, puesto que algunas especies pueden traspasar con sus colmillos su propia piel y por lo tanto puede llegar a inocularnos su veneno. Figura 57. Forma de sujetar la cabeza de una especie venenosa (Víbora de cascabel tropical Crotalus durissus) (Tomada por el autor, 2012). 4. Mientras una persona está realizando la contención física, el ayudante deberá introducir el alimento en la sonda con la ayuda de una jeringa, esto reducirá la cantidad de aire que puede entrar en el estómago de la serpiente durante el procedimiento. 5. Una vez realizada la contención física, el ayudante deberá sujetar la sonda con unas pinzas de disección y sumergirla un poco en el alimento para lubricarla, posteriormente debe ir introduciéndola suavemente por el esófago de la serpiente hasta aproximadamente el segundo tercio del animal. 100 6. Administrar el alimento con la ayuda de las jeringas lo más rápido posible, una vez administrado todo el alimento necesario, retirar suavemente la sonda y colocar a la serpiente en su terrario. Es importante mantener en observación al ejemplar para constatar que este no regurgite el alimento, si el animal llegar a regurgitar el alimento, deberá repetirse el procedimiento dos o tres días después. 101 6. CONCLUSIONES Este manual será de gran utilidad en el herpetario Patrulla animal, ya que el manejo de serpientes en cautiverio constituye la base para la mayoría de las actividades que se realizan dentro de un herpetario. El contar con un manual de procedimientos para el manejo de serpientes, permitirá al médico veterinario realizar cada una de estas actividades de una manera más eficaz y segura. Los apartados que tratan sobre el sexado de serpientes, la toma de muestras y la extracción de veneno, enriquecerán aún más los conocimientos básicos que el médico veterinario enfocado en el manejo de serpientes debe conocer. Al existir poca información respecto al manejo de serpientes en cautiverio, este manual constituirá una guía para el estudiante de medicina veterinaria y para los médicos veterinarios interesados en el área de reptiles. 102 7. RECOMENDACIONES Para aumentar las medidas de seguridad en el herpetario se recomienda lo siguiente: Colocar candados de seguridad en la parte trasera de los terrarios de serpientes venenosas. Colocar letreros de seguridad en la parte posterior de los terrarios de serpientes venenosas en donde se especifique el nombre común de la especie, así como su nombre científico, esto con la finalidad de tener mejor ubicados a los animales. Colocar un letrero en donde se encuentran almacenados los sueros antiofídicos para tenerlos mejor identificados. Contar con un escrito en donde se especifiquen las medidas de primeros auxilios, prevención de accidentes y números de emergencia, este deberá colocarse en un lugar que pueda ser visible para todo el personal que labora en las instalaciones. 103 8. LITERATURA CITADA Alvarado C. A., 2009. Atlas de anatomía de una serpiente. http://www.fororeptiles.org/foros/showthread.php?45299-Atlas-de-Anatom%EDade-una-Serpiente. (Consultado el 8 de febrero del 2012). Ambrosi G., 2012. El terrario de las serpientes. http://www.ophidia.es/terrarioserpientes.htm (Consultado el 16 de febrero del 2012). AOL (America Online) 2010. Venenos que salvan vidas. http://salud.aollatino.com/2010/07/12/venenos-salvan-vidas/. (Consultado el 22 de febrero del 2012). Brotóns N.J. 2001. Patología de reptiles: técnicas diagnósticas y terapéuticas. Canis et felis. 49:9-25. Blogspot, 2010. Esqueleto de una serpiente. http://cmcraextremadura.blogspot.mx/2010/09/el-esqueleto-de-las-serpientes.html. (Consultado el 8 de febrero del 2012). Camarra G. y Vera A. 2008. Manual de procedimientos sobre accidentes ofídicos. http://www.bvsde.paho.org/bvstox/fulltext/accidentesofidicos.pdf. (Consultado el 22 de febrero del 2012). Cano F. J., 2012. Serpientes. http://todosobreserpientes.galeon.com/index.html. (Consultado el 8 de febrero del 2012). Carrasco J., 2011. Serpientes venenosas herramientas para la manipulación de serpientes venenosas y precauciones. http://serpientes-venenosas.blogspot.com/2011/04/serpientes-venenosas-herramientaspara_13.html. (Consultado el 22 de febrero del 2012). Carrasco J., 2011. Serpientes venenosas sueros antiofídicos tipos y características. http://serpientes--venenosas.blogspot.com/2011/04/serpientesvenenosas-sueros.html (Consultado el 22 de febrero del 2012). Carrasco J., 2011. Serpientes venenosas técnicas de ordeño de serpientes. http://serpientes--venenosas.blogspot.com/2011/06/tecnicas-de-ordeno-deserpientes.html. (Consultado el 1 de marzo del 2012). Cuetzpalin 2006. Manual para el mantenimiento de serpientes tercer capítulo: Anatomía y fisiología http://www.fororeptiles.org/blahdocs/uploads/3_tercer_ capitulo_5012.pdf. (Consultado el 8 de febrero del 2012). 104 Cuetzpalin 2006. Manual para el mantenimiento de serpientes cuarto capítulo: Determinación del sexo. http://www.fororeptiles.org/blahdocs/uploads/4_cuarto_capitulo_4261.pdf. (Consultado el 8 de febrero del 2012). Cuetzpalin 2006. Manual para el mantenimiento de serpientes quinto capítulo: Alojamiento. http://www.fororeptiles.org/blahdocs/uploads/5_quinto_capitulo_5710.pdf (Consultado el 8 de febrero del 2012). De Roodt A. R., Estévez J., Paniagua J. F., Litwin S., Carbajal A., Dolab J. A., Robles L. E. y Alagón A. 2005. Toxicidad de venenos de serpientes de importancia médica en México. Gaceta médica de México. 141:13-22. Educ.ar, 2012. Mordeduras. http://coleccion.educ.ar/coleccion/CD14/contenidos/emergencia/pag3/index.html. (Consultado el 23 de febrero del 2012). Frayre M. J., Sevilla E., Orozco M., Armas J. y Celis A., 2006. Mortalidad por contacto traumático con serpiente y lagarto venenosos. México 1979-2003. Gaceta Médica de México. 142 (3):209-213. Fowler M. E., 1993. Zoo and wild animal medicine current therapy. 3rd edition. Ed. W. B. Saunders. Philadelphia, United States Of America. Pág. 144. Giraldo 2009. Consideraciones respecto de las serpientes, el uso de sus órganos sensoriales. http://www.monografias.com/trabajos72/consideraciones-serpientesuso-organos-sensoriales/consideraciones-serpientes-uso-organossensoriales2.shtml. (Consultado el 12 de febrero del 2012). Gómez A. y Flores G. Serpientes. http://www.galeon.com/home3/biologia/ serpientes.html. (Consultado el 12 de febrero del 2012). Google maps 2012 http://maps.google.com.mx/. (Consultado el 9 de febrero del 2012). ICP (Instituto Clodomiro Picado) 2009. El envenenamiento por mordedura de serpiente en Centroamérica. http://icp.ucr.ac.cr/index.php?option=com_docman&task=cat_view&gid= 5&Itemid=30&lang=es. (Consultado el 23 de febrero del 2012). INAH (Instituto Nacional de Antropología e Historia) 2008. Víbora de cascabel. http://www.inah.gob.mx/index.php/boletines/2-actividades-academicas/1686vibora-de-cascabel. (Consultado el 2 de marzo del 2012). 105 INEGI (Instituto Nacional de Estadística y Geografía) 2012 El INEGI en su entidad Veracruz de Ignacio de la Llave. http://www.inegi.org.mx/inegi/default.aspx?s=geo&e=30. (Consultado el 9 de febrero del 2012). Mader D. R. 2006. Reptil medicine and surgery. 2nd edition. Ed. Elsevier Saunders. St. Louis Missouri, United States Of America. Pág. 124. Maruñak S. L., Ruíz de Torrent R. M., Teibler G. P., Gay C. C., Leiva L. y Acosta de Pérez O. 2005. Acción del veneno de Bothrops jararacussu de Argentina sobre la coagulación sanguínea. InVet. 8:119-128. Maschio M., Prieto F., Guerrero H., Venditti E. 2001 Serpientes no venenosas http://www.monografias.com/trabajos10/serpi/serpi.shtml. (Consultado el 15 de febrero del 2012). Morais V. 2007. El suero antiofídico antecedentes históricos, uso presente y perspectivas futuras. Biomedicina. 3:47-53. Morales L. A. y Mendoza C. L., 2000. Manejo de felinos en cautiverio. Diseño y Publicidad Gráfica, S.A. de C.V. Edo. De México. Pág. 19. Mundo animal 2012. El veneno de las serpientes. http://www.mundoanimal.com/animales-exoticos/reptiles/el-veneno-de-las-serpientes/. (Consultado el 3 de marzo del 2012). Polo J. 2006. Manejo de serpientes. http://www.produccionanimal.com.ar/fauna/20-manejo_serpientes.pdf. (Consultado el 20 de febrero del 2012). Quesada J. A. y Rodríguez N. 2008. Manual de prevención y manejo de mordeduras por serpientes. http://www.portalesmedicos.com/publicaciones/articles/1218/1/Manual-deprevencion-y-manejo-de-mordeduras-por-serpientes. (Consultado el 3 de marzo del 2012). Raiti P., 2012. Serpientes. En: Meredith A., Redrobe S. Manual de animales exóticos. 4ta edición. Ed. Ediciones S. Barcelona, España. Pág. 343-350. Rundquist E. M., 2000. Mantenimiento en cautividad de reptiles y anfibios alimentación-cuidados-reproducción. Ed. Hispano Europea. Barcelona, España. Pág. 124. Scribd.com 2011. Anatomía de una serpiente. http://es.scribd.com/doc/48295434/ Anatomía-de-una-serpiente (Consultado el 15 de febrero del 2012). 106 Siria C. G. y Arellano A. 2009. Mordeduras por serpiente venenosa: Panorama epidemiológico en México. http://www.scielosp.org/scielo.php?pid=S003636342009000200002&script=sci_arttext. (Consultado el 5 de marzo del 2012). Tay Zavala J., Díaz J. G., Sánchez J. T., Ruiz D. y Castillo L. 2002. Serpientes y reptiles de importancia medica en México. http://www.medigraphic.com/pdfs/facmed/un-2002/un025e.pdf. (Consultado el 11 de marzo del 2012). Varela N. 2002. Evaluación clínica de reptiles. http://www.produccionanimal.com.ar/produccion_yacares/50-evaluacion_clinica.pdf. (Consulto el 11 de marzo del 2012). Van Brussel E. 2012. Ofidismo. http://ambiental.uaslp.mx/Urgencias/Serpientes.pdf. (Consultado el 5 de marzo del 2012). Vásquez C. R. y Chaquin L. 2009. Manual para la identificación, prevención y tratamiento de mordeduras de serpientes venenosas en Centroamérica Volumen 1: Guatemala. http://bvs1.panaftosa.org.br/local/file/textoc/OPS-serpientesvenenosas-prevencion-tratamiento-Guatemala.pdf. (Consultado el 11 de marzo del 2012). Vázquez A. M. 1981. La serpiente en el mundo antiguo. http://www.twakan.com/numero29/Mitos.htm. (Consultado el 10 de marzo del 2012). ZOOBAQ (Fundación Botánica y Zoológica de Barranquilla) 2012. http://zoobaq.org/planetazoo/Venenos.pdf. (Consultado el 9 de marzo del 2012). 107 9. ANEXOS 108 9.1 Procedimiento de manejo empleado para la utilización del tubo de contención en serpientes La utilización de un tubo de contención para serpientes nos trae grandes beneficios a la hora de ejecutar un manejo, ya sea que estemos trabajando con especies venenosas o no. Su objetivo consiste en inmovilizar al ejemplar para que el médico veterinario pueda manipularlo con seguridad. El tubo de contención para serpientes además de utilizarse para realizar inmovilizaciones físicas, también nos sirve como complemento para otros tipos de manejo, por ejemplo para la administración de anestesia inhalada en serpientes. Esta herramienta consiste básicamente en un tubo hueco y alargado, este puede ser elaborado de diversos materiales, los más utilizados son los construidos con acrílico; este tipo de tubos permiten al médico veterinario manipular el extremo caudal de las serpientes. Es recomendable utilizar tubos de contención transparentes que permitan observar directamente al animal y de esta forma conocer su ubicación exacta dentro de este. El diámetro y largo del tubo de contención será a consideración del médico veterinario que realice el manejo Para efectuar el procedimiento que se describirá a continuación es necesaria la presencia de un mínimo de 2 personas. El procedimiento de manejo empleado para la utilización del tubo de contención es el siguiente: 109 1. Sacar a la serpiente de su terrario, para ello se debe tomar un gancho herpetológico y se debe tomar con este a la serpiente del primer tercio de su cuerpo, después debe colocarse en un recipiente plástico con tapa y dicho recipiente debe colocarse en un sitio en donde se facilite el manejo del ejemplar, por ejemplo sobre una mesa. 2. Debe tomarse con una mano el tubo de contención y con la otra mano un gancho herpetológico, para incitar a la serpiente a introducirse al tubo, basta con tocarla con un gancho herpetológico en la parte posterior del cuerpo, de esta forma la serpiente avanzara hacia el tubo. Este paso requiere de paciencia y una gran destreza con el gancho herpetológico. 3. Una vez que parte del cuerpo de la serpiente se encuentre dentro del tubo, tomar al mismo tiempo con una mano la parte caudal del cuerpo del animal y con la otra el tubo de contención. 4. Si se quiere introducir directamente a la serpiente en su terrario, puede anexarse el tubo directamente al túnel que se localiza en la parte posterior de dicho terrario. 110 9.2. Procedimiento de manejo empleado para el sexado en serpientes El sexado de serpientes es una técnica por medio de la cual se identifica el sexo de un individuo o un grupo de individuos en particular, esto tiene como finalidad establecer parejas viables para reproducción de una especie determinada. Las serpientes no muestran un dimorfismo sexual evidente que nos permita definir el sexo a simple vista, sin embrago existen otros caracteres secundarios cuya observación nos permitirá establecerlo con cierto nivel de seguridad. Por lo general, los machos poseen un mayor número de escamas ventrales y subcaudales que las hembras de una misma especie, el tamaño de los machos suele ser menor que el de las hembras mientras que la longitud de la cola (a partir de la cloaca) suele ser mayor en los machos para alojar a los hemipenes (Cuetzpalin, 2006). La presencia de espolones bien desarrollados en los machos de las familias Boidae y Phytonidae también nos puede orientar en la identificación del sexo en una serpiente (Rundquist, 2000). Existen diversas técnicas para la identificación del sexo en serpientes, en este capítulo se describirán dos de estas técnicas, estas son la técnica de la eversión de los hemipenes y la técnica del estilete de punta roma. 111 9.2.1. Procedimiento de manejo empleado para la eversión de los hemipenes Esta técnica consiste en ejercer presión en la parte anterior y posterior de la cola de la serpiente cercana a la cloaca para lograr que los hemipenes salgan a través de esta, esto en el caso de que el ejemplar sea macho. La realización de esta técnica requiere de la presencia de dos personas con experiencia en el manejo de serpientes. El procedimiento de manejo empleado para la eversión de los hemipenes es el siguiente: 1. Una persona se encargara de la contención física del animal, para ello debe sacar a la serpiente de su terrario con la ayuda de un gancho herpetológico y posteriormente ejecutar la contención física del ejemplar. La contención física puede ser ejerciendo presión sobre la cabeza de la serpiente o utilizando un tubo de contención. En el caso de serpientes venenosas se recomienda la utilización del tubo de contención. 2. La otra persona se encargara del sexado del animal, para ello deberá tomar a la serpiente con ambas manos por la base de la cola y ejercerá una ligera presión con los dedos pulgares hacia la cloaca, de esta manera si el ejemplar es macho, los hemipenes saldrán a través de la cloaca. 112 3. Una vez terminado el procedimiento, se deberá colocar a la serpiente de vuelta en su terrario. 9.2.2. Procedimiento de manejo empleado para la utilización del estilete con punta roma Esta técnica consiste en introducir un estilete de punta roma a través de la cloaca de la serpiente, dicha sonda puede estar elaborada de diversos materiales, las más utilizadas son de acero inoxidable y poseen una punta totalmente roma que al ser introducida en la cloaca, disminuye la posibilidad de provocar una lesión traumática en el ejemplar. Esta técnica requiere de la presencia de dos personas con experiencia en el manejo de serpientes. El procedimiento de manejo empleado para la utilización del estilete de punta roma es el siguiente: 1. Una persona se encargara de la contención física, para ello deberá sacar a la serpiente de su terrario con un gancho herpetológico y la colocara de preferencia sobre una mesa para facilitar el manejo. La técnica empleada para la contención física puede ser sujetar a la serpiente por la cabeza o utilizar un tubo de 113 contención. En serpientes venenosas se recomienda la utilización del tubo de contención. 2. La otra persona se encargara del sexado de la serpiente, para ello, deberá identificar la cloaca del reptil y a continuación deberá tomar un estilete de punta roma de tamaño adecuado y lo lubricara (Con un poco de aceite mineral por ejemplo), posteriormente la introducirá en la cloaca del ejemplar en sentido posterior de esta (apuntando con el estilete hacia la cola del animal). 3. Una vez realizado esto, deberá introducirla muy suavemente hasta sentir un tope o barrera que impida que la sonda penetre más. 4. Deberá contar la cantidad de escamas subcaudales que abarca la sonda dentro de la serpiente. De acuerdo a Varela en el año 2002, en machos la sonda puede penetrar profundamente (entre 8 a 15 escamas subcaudales) mientras que en hembras no se podrá penetrar más de 3 o 4 escamas (Varela, 2002) (Figura 58). Figura 58. Sexado de una serpiente (Tomada por el autor, 2012). 114 9.3. Procedimientos de manejo empleado para la toma de muestras en serpientes La anamnesis y la exploración sistemática en reptiles, constituyen la base para un buen diagnóstico, sin embargo, es necesario realizar pruebas complementarias para no solo establecer un diagnóstico acertado, sino también para llevar a cabo un protocolo terapéutico competente (Brotóns, 2001). Cabe señalar que al no tratarse de especies convencionales como es en el caso de animales domésticos, la idea de tener que trabajar con serpientes en especial de tipo venenoso, suele ocasionar en el médico veterinario cierto temor al desconocer el procedimiento que debe llevar a cabo, no solo en el manejo, sino también en la toma de muestras. Es por ello la importancia de saber tomar las diversas muestras que se necesitan en serpientes. En este capítulo se describirán los procedimientos de manejo empleados para la toma de muestras en serpientes, tales como la toma de muestras de heces, muestras de orina y por supuesto muestras sanguíneas. 115 9.3.1. Procedimiento de manejo empleado para la toma de muestras de heces Como en cualquier toma de muestras, se debe procurar que esta sea tomada lo más asépticamente posible y por supuesto que sea una muestra fresca. En este tipo de procedimiento es recomendable la presencia de un mínimo de dos personas con experiencia en el manejo de serpientes. Las muestras de heces pueden colectarse de 3 formas. La primera consiste en tomarla directamente del terrario de la serpiente en cuanto esta defeque. La segunda consiste en masajear la zona de la cloaca para estimular al ejemplar para que defeque. La tercera consiste en realizar un lavado del colon. El proceso de digestión en estos reptiles es variable en culebras, serpientes constrictoras y serpientes venenosas, en general esta ocurre en un intervalo que va de 4 a 7 días, por lo que es importante tomar en cuenta cuando fue la fecha en la que el animal ingirió su alimento. Cuando se obtiene la muestra directamente del terrario, debe tomarse ya sea con una pala para recolectar excretas o bien con un guante. Para ello, es necesario retirar a la serpiente de su terrario antes de tomar la muestra para evitar estar en contacto directo con el ejemplar, esto como ya se ha mencionado anteriormente. En cualquier caso, una vez recolectada la muestra, se deben retirar 116 los residuos del sustrato que quedaron adheridos a la muestra. La muestra debe colocarse en un medio de trasporte o en un recipiente estéril para muestras. Si la muestra es tomada directamente de la cloaca, es necesario realizar una contención física del animal, el tubo de contención (véase procedimiento empleado para la utilización del tubo de contención en serpientes) para serpientes puede ser el método más recomendable para manipular a la serpiente. Deben utilizarse guantes y un recipiente estéril para depositar la muestra. El masaje debe ser ejecutado suavemente en ambos extremos próximos a la cloaca. Si la muestra es tomada por medio de un lavado del colon, en primer lugar se debe realizar una contención física del ejemplar; puede recurrirse a la utilización del tubo de contención en caso de serpientes venenosas, o bien realizar la inmovilización de la cabeza en serpientes no venenosas. El procedimiento empleado para la toma de muestras de heces en serpientes realizando un lavado del colon es el siguiente: 1. Una persona debe encargarse de la contención física del ejemplar, para ello es recomendable utilizar el tubo de contención (véase procedimiento de manejo empleado para la utilización del tubo de contención) para serpientes para evitar 117 estar en contacto directo con la cabeza del animal, especialmente en serpientes venenosas. 2. Una vez realizada la contención física del ejemplar, otra persona se encargara de la colecta de la muestra. Para ello debe utilizar guantes de látex y a continuación debe introducir suavemente una sonda metálica curva previamente lubricada en la cloaca del animal. La apertura del colon en la cloaca se localiza ventralmente, existiendo un saco ciego en la zona dorsal que debe evitarse (Brotóns, 2001). 3. Una vez ubicado el colon, debe administrarse suero fisiológico dentro de este. La cantidad de suero a administrar puede ser de 10-20 ml/kg. (Raiti, 2012). 4. Por ultimo después de administrar el suero fisiológico, debe masajearse la cavidad celómica del animal y posteriormente debe aspirarse la muestra y colocarse en un medio de trasporte o un envase estéril para muestras. Cabe señalar que se deben tomar las consideraciones adecuadas para la conservación de la muestra dependiendo si esta es para estudio parasitológico, bacteriano o viral. El médico veterinario se encargara de elegir el método de conservación más adecuado para cada caso. 118 9.3.2. Procedimiento de manejo empleado para la toma de muestras de orina La toma de muestras de orina en serpientes se ve dificultada debido a 2 factores principalmente. El primer lugar la orina se encuentra mezclada junto con las heces, por lo cual esta se contamina desde el instante en que el animal defeca. En segundo lugar, las serpientes no poseen vejiga urinaria, por lo que la cistocentesis no puede realizarse. Las serpientes al no poseer vejiga urinaria, almacenan la orina en los uréteres y en la cloaca, razón por la cual esta se mezcla con las heces (Raiti, 2012). Es por ello que para recolectar orina de una serpiente, no queda más remedio que aspirarla directamente de las heces por medio de una pipeta (Brotóns, 2001). El procedimiento para la toma de muestras de orina debe ser realizado por un mínimo de dos personas con experiencia en el manejo de serpientes. El procedimiento de manejo empleado para la toma de muestras de orina es el siguiente: 1. La manera más segura de ejecutar este procedimiento, es mantener a la serpiente dentro de un recipiente plástico, dicho recipiente debe ser de preferencia trasparente para poder observar a la serpiente. 119 2. El ejemplar debe mantenerse en constante observación, cuando la serpiente defeque se debe proceder a sacarla del recipiente con la ayuda de un gancho herpetológico y colocarla en su respectivo terrario. 3. De la muestra de heces contenida en el recipiente, debe aspirarse la mayor cantidad posible de orina con una pipeta estéril. La muestra resultante se colocara en un recipiente para muestras estéril y se mantendrá en refrigeración hasta su envío al laboratorio. 9.3.3. Procedimiento de manejo empleado para la toma de muestras sanguíneas La toma de muestras sanguíneas en serpientes, es un proceso que como en cualquier colecta de muestras, implica un cierto grado de estrés para el animal, es por ello que debe ser realizado con la mayor delicadeza posible, aunque hay que tomar en cuenta que el procedimiento debe ser de igual forma seguro para la persona que realiza el manejo del animal. 120 Las vías por las cuales puede extraerse sangre en serpientes son las venas palatinas, la vena abdominal ventral, la vena coccígea ventral y por medio de la cardiocentesis. La vía de elección para la toma de muestras sanguíneas en serpientes es la vena coccígea ventral, así como la aplicación de la técnica de cardiocentesis; esto debido a que la extracción de sangre a través de las venas palatinas resulta una técnica muy difícil de realizar en condiciones asépticas, ya que la aguja utilizada puede incorporar microorganismos al torrente sanguíneo, de igual forma la extracción de sangre a través de la vena abdominal ventral resulta complicada debido a que resulta difícil realizar una buena hemostasia tras la extracción (Brotóns, 2001). Es por ello que se describirán a continuación los procedimientos de manejo empleados para la toma de muestras sanguíneas en serpientes utilizando la vena coccígea ventral y la cardiocentesis. 121 9.3.3.1. Procedimiento de manejo empleado para la obtención de muestras sanguíneas utilizando la vena coccígea ventral La obtención de muestras sanguíneas a partir de la vena coccígea ventral, es una técnica que se emplea en diversos reptiles tales como iguanas y serpientes. Debido al estrés que este proceso implica, se sugiere sedar a los ejemplares cuyo comportamiento se considere agresivo o a las especies de mayor tamaño para facilitar el manejo (Raiti, 2012). El volumen total de sangre a extraer en las diversas especies de reptiles, representa aproximadamente del 5 al 8% del total del peso corporal del animal (Fowler, 1993). El volumen máximo de sangre a extraer de una serpiente puede ser calculado utilizando la fórmula peso (g) x 1%, con dicha fórmula se obtendrá la cantidad de sangre a extraer expresada en mililitros (Raiti, 2012). Antes de realizar este procedimiento es necesario contar con el material necesario para ejecutarlo. El material utilizado para realizar este procedimiento es el siguiente: Gancho herpetológico. Tubo de contención para serpientes. 122 Jeringas estériles (el calibre y tamaño de la jeringa será a criterio del médico veterinario). Tubos vacutainer que contengan el anticoagulante de elección (Heparina). Antiséptico (Yodo o alcohol isopropilo). Este procedimiento requiere de la presencia de un mínimo de dos personas con experiencia en el manejo de serpientes para realizarlo. El procedimiento de manejo empleado para la obtención de muestras sanguíneas utilizando la vena coccígea ventral es el siguiente: 1. Una persona debe realizar una contención física del animal, se recomienda la utilización del tubo de contención para serpientes venenosas (ver procedimiento de manejo empleado para la utilización del tubo de contención en serpientes), aunque puede utilizarse de igual forma la sujeción de la cabeza del ejemplar. 2. Una vez realizada la contención física, otra persona deberá proceder a extraer la muestra de sangre del ejemplar, para ello deberá colocarse a la serpiente en posición decúbito dorsal y deberá sujetar el cuerpo firmemente. 123 3. A continuación, se deberá localizar el lugar en donde se insertara la aguja. El punto idóneo para la inserción de la aguja se localiza a un tercio de la distancia entre la apertura cloacal y el extremo de la cola (Brotóns, 2001). 4. Una vez localizado el punto de inserción de la aguja, se procederá desinfectar el área con algún antiséptico y posteriormente se insertara la aguja de la jeringa entre las escamas en la línea media del cuerpo de la serpiente de manera caudodorsal en un ángulo de 45 ° hasta alcanzar las vértebras coccígeas. 5. Aspirar suavemente la muestra sanguínea hasta conseguir el volumen deseado (Figura 59). Figura 59. Obtencion de sangre de la vena coccigea ventral de una Pitón real albina (Phyton regius). (Tomada de Botrons, 2001). 124 6. Por último, se deberá retirar la aguja con sumo cuidado y se hará presión con un algodón para realizar la hemostasis. Terminado el procedimiento, se deberá colocar a la serpiente en su respectivo terrario. 9.3.3.2. Procedimiento de manejo empleado para la obtención de muestras sanguíneas utilizando la cardiocentesis El corazón de las serpientes, a diferencia del de los mamíferos, se encuentra dividido en 3 cavidades, estas son 2 atrios y 1 ventrículo (Mader, 2006) (Figura 60). Figura 60. Sistema cardiovascular de una Pitón birmana (Python molurus bivittatus) (Tomada de Alvarado, 2009). 125 La dificultad del procedimiento de toma de muestras sanguíneas utilizando la cardiocentesis, radica en la localización del corazón. El corazón de las serpientes se localiza entre el 15-25 % de su longitud narina-apertura cloacal en especies terrestres y arborícolas (Brotóns, 2001). Básicamente, si se divide el cuerpo de la serpiente en 3 partes (anterior, medio y posterior), el corazón estaría situado aproximadamente entre el tercio anterior y el tercio medio. Se recomienda la utilización de un sistema Doppler para la localización del corazón (Raiti, 2012). El material empleado en el procedimiento para la toma de muestras sanguíneas es el siguiente: Gancho herpetológico. Jeringas estériles (el calibre y tamaño de la jeringa será a criterio del médico veterinario). Tubos vacutainer que contengan el anticoagulante de elección (Heparina). Antiséptico (Yodo o alcohol isopropilo). 126 La ejecución de este tipo de procedimiento requiere de la participación de 2 o más personas. El procedimiento de manejo empleado para la toma de muestras sanguíneas utilizando la cardiocentesis es el siguiente: 1. Realizar una contención física del ejemplar. Para ello se debe sacar a la serpiente de su terrario utilizando un gancho herpetológico y debe colocarse en un recipiente plástico con tapa. 2. Debe tenerse a la mano todo el material necesario para la ejecución del procedimiento y debe elegirse un sitio adecuado para realizar el manejo, el más recomendable es sobre una mesa. 3. Debe colocarse a la serpiente sobre la mesa y a continuación colocar la parte larga del gancho herpetológico sobre la cabeza del animal para contenerlo. Posteriormente debe sujetarse la cabeza del ejemplar utilizando los dedos pulgar, índice y medio. El dedo pulgar y medio se apoyaran sobre la mandíbula superior, mientras el dedo índice se colocara sobre la cabeza del ejemplar. Al mismo tiempo que se sostiene la cabeza, una segunda persona sujetara el cuerpo de la serpiente. 4. Una tercera persona se encargara de localizar el corazón de la serpiente ya sea con un estetoscopio o con un sistema Doppler, debe auscultarse a la serpiente por 127 la parte ventral de su cuerpo. Una vez localizado el corazón deberá desinfectar el área con una solución antiséptica. 5. Tomar una jeringa e introducirla en el borde caudal de la primera y segunda escama ventral dirigiéndola craneodorsalmente en un ángulo de 45 °; introducir la aguja hasta llegar a la cavidad ventricular del corazón. 6. Aspirar para cerciorarse que se encuentra en el corazón, si al realizar esto, se aspira líquido pericárdico, retirar la jeringa y realizar la punción cardiaca nuevamente. 7. Una vez que se tenga la seguridad de estar en corazón, se debe aspirar suavemente la muestra de sangre hasta obtener el volumen deseado (Figura 61). Al terminar se debe retirar la aguja, colocar un algodón en el área en donde se realizó la punción y colocar la muestra en un tubo vacutainer previamente identificado. Figura 61. Cardiocentesis en una Pitón real (Phyton reguis) (Tomada de Brótons, 2001). 128 9.4. Procedimiento de manejo empleado para la extracción de veneno en serpientes La extracción de veneno en serpientes no es un proceso que cualquier persona esté dispuesta a realizar debido a los riesgos que esta actividad implica, dichos riesgos no solo son para la persona que realiza el manejo sino también para el propio animal (Carrasco, 2011). Debido a que este procedimiento implica un alto riesgo para la persona que lo realiza, solo debe ser ejecutado por un médico veterinario con experiencia en serpientes o por alguna otra persona que haya realizado un gran número de manejos en serpientes venenosas, sobre todo en contenciones físicas de diversas especies venenosas. La base para un buen manejo de una serpiente venenosa es la contención física, si se domina esta técnica, la obtención de veneno será un proceso que no se dificultara mucho al médico veterinario que vaya a realizar dicho procedimiento. La extracción de veneno en serpientes conlleva a muchos beneficios, en especial para el herpetario en donde se realice este procedimiento, ya que a partir del veneno se pueden sintetizar sueros antiofídicos paras las diversas especies venenosas mantenidas en cautividad. Cabe señalar que las muestras de veneno deben ser remitidas a un laboratorio de confianza para su procesamiento, este laboratorio se encargara de procesarlos y de obtener los sueros antiofídicos. 129 Antes de realizar este procedimiento deben tomarse en cuenta las siguientes consideraciones: 1. Este procedimiento debe ser llevado a cabo por un mínimo de 2 personas con experiencia en serpientes venenosas. 2. Debe ser ejecutado responsablemente y solo si de verdad se va a utilizar el material biológico obtenido. 3. Las personas que realicen el procedimiento deben tener conocimiento sobre las medidas de primeros auxilios en caso de algún accidente. 4. Se recomienda tenerse a la mano sueros antiofídicos para la especie que se va a manejar, si esto no es posible, debe tenerse ubicado un centro de salud que cuente con estos sueros en caso de alguna emergencia. Los materiales y equipo que necesitamos para realizar este procedimiento son los siguientes: Gancho herpetológico. Vaso de precipitado tipo Griffin. 130 Material para colocar sobre el vaso de precipitado (La elección de este será a criterio del médico veterinario). Liga u otro material que se pueda utilizar para tensar. Guantes de látex. Recipiente de plástico con tapa para depositar a la serpiente. El procedimiento de manejo para la extracción de veneno en serpientes es el siguiente: 1. Preparar el vaso de precipitado. Para ello se debe colocar el material que el médico veterinario haya elegido previamente sobre el vaso de precipitado y a continuación tensarlo con una liga. 2. Utilizando un gancho herpetológico, retirar a la serpiente de su terrario y colocarla dentro de un recipiente plástico con tapa. 3. Elegir un sitio adecuado para realizar el manejo (este puede ser una mesa por ejemplo), después colocar el vaso de precipitado sobre una superficie plana y colocarse los guantes de látex. 131 4. Destapar el recipiente plástico con mucho cuidado y con la ayuda del gancho herpetológico, sacar a la serpiente y colocarla sobre la mesa. 5. Realizar una contención física del ejemplar. Para ello se debe colocar el gancho herpetológico con sumo cuidado sobre la cabeza de la serpiente, una vez realizado esto, tomar a la serpiente por la cabeza utilizando los dedos pulgar, índice y medio; es importante que los dedos restantes se mantengan alejados de la mandíbula de la serpiente. Al mismo tiempo que se asegura la cabeza del ejemplar, otra persona debe sujetar el cuerpo. 6. Colocar la boca de la serpiente sobre el vaso de precipitado para que el ejemplar muerda el material que cubre este. A continuación se debe ejercer una ligera presión en las glándulas de la serpiente para extraer la máxima cantidad de veneno posible (Figura 62). Las glándulas productoras de veneno se encuentran ubicadas sobre la mandíbula superior del ejemplar (Figura 63). Figura 62. Extracción de veneno de una cobra de monóculo (Naja Kaouthia) (Tomada de Carrasco, 2011). 132 Figura 63. Ubicación de las glándulas de veneno en una serpiente (Tomada de educ.ar, 2012). 7. Una vez colectada la muestra de veneno se debe retirar a la serpiente del vaso de precipitado con mucho cuidado y se debe colocar de nueva cuenta en su terrario. Es importante mantener en observación a la serpiente, puesto que este procedimiento genera una gran cantidad de estrés al animal. 133