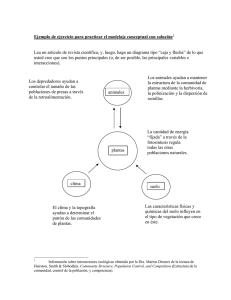
Crecimiento y reproducción de Anthurium schlechtendalii
Anuncio

Herbivoría, crecimiento y reproducción de Anthurium schlechtendalii Kunth (Araceae) en ecosistemas diferentes Tesis que presenta María Azucena Canto Aguilar para obtener el grado de doctor en ciencias Ecología y Manejo de Recursos Naturales Xalapa, Veracruz, México Octubre 2004 A mis padres, hermanas y hermano con todo mi amor y respeto ii Agradecimientos Al CONACYT por la beca-crédito y extensión de beca (118944) recibida desde septiembre de 1997 hasta agosto de 2003. Al CONACYT (proyecto 333128), a Sigma Xi (1999) y al Instituto de Ecología, A.C. (902-17-144) por el apoyo otorgado para la realización de la tesis. A la Universidad Autónoma de Yucatán por facilitarme el uso y abuso de sus instalaciones. Especialmente agradezco el apoyo recibido, tanto en campo como en laboratorio, del personal del Departamento de Ecología de esta Universidad y del Departamento de Ecología Vegetal del Instituto de Ecología, A.C. Cuando reflexionamos sobre nuestro entorno nos damos cuenta que ésta es una “matriz ambiental” formada por una intrincada red de relaciones entre variables de la más diversa índole. Los individuos nos encontramos inmersos en esta matriz y de ella obtenemos el aliento y las herramientas para alcanzar nuestras metas. A lo largo del doctorado fui cada vez más conciente de la esencialidad de esta matriz en el logro de la tesis. Es por eso que agradezco profundamente a las personas que dieron estructura a mi entorno y hago un cariñoso reconocimiento a todas ellas: Gracias a ... José Guadalupe García Franco por la tutoría a lo largo de la tesis y por las pellizcadas mentales; gracias asesor de las tierras aztecas. Víctor Parra Tabla por su multidimensional apoyo. Gracias por solventar un buen porcentaje de salidas al campo, tramitar permisos, facilitar camionetas, materiales varios, libros, consejos, análisis, malos chistes, etc. Gracias por los interludios musicales y principalmente por todos los bajos, pero también sublimes buenos momentos compartidos. Gracias por ser uno de los ejes que dieron dirección a esta tesis. Víctor Rico Gray y Jorge López-Portillo Guzmán por los sucintos y valiosos consejos. Al jurado José Luis Andrade, María Luisa Martínez y Fabián Vargas por la acertada revisión de la tesis. Carlos Herrera y Jorge Navarro por su asesoría en diseño y estadística. Gracias especiales a Mariana “Chútale” Cuautle Arenas por miles de cosas aprendidas juntas en el doctorado, pero especialmente por su magnífica y solidaria amistad, gracias! Susana “Jalisquilla” Valencia y Ceci “Cexi” Castelazo por su incondicional y también magnífica amistad. iii Gracias a Rosalina “La Ponedora” Rodríguez por ponerle muchas porras a este esfuerzo, gracias rosca. Mamá y papá (Profesora Teresita del Rosario Aguilar Capetillo y Profesor Raúl Fernando Canto Torres) por tantas cosas donadas, heredadas y aprendidas durante toda mi vida, pero en particular a lo largo del doctorado. Por supuesto agradezco al maravilloso colage formado por mis hermanas, hermano, sobrinas y sobrinos, porque sin su influencia nunca me hubiera lanzado y mucho menos perseverado en el doctorado. Muchas gracias Carola, Tere, Magui, Jaz, Ana y Raúl; Carito, Marinha, Chino, Rochita, Feri, Chiquitino, Javi, Mariana, Janito y por supuesto, Hialito. A toda una plétora de gente de la más diversa calaña, que en algún momento intervinieron, interesada o desinteresadamente en la tesis. Con estas personas compartí muchos arduos, divertidos, embriagativos y siempre buenos momentos... Gracias Luis “Chaman” Salinas por tu secuaz seductor apoyo. Gracias a Charly Suárez, Licho Hernández, Manito Bojórquez y José Cohuó. A Sergio “Galleto” Hernández por no romperse algo al caer entre las piedras y por no cobrarme sus lentes. Gracias al “Chel” Leirana, Caroline Hattam, Andrés “Vaca” Ruiz y Víctor “Pollito” Novelo, Nico Salinas, Brenda Castillo y Luisa Novelo. Gracias a Patty Alonso, Flor Rodríguez, Luis “Babala” Abdala y Amparo Lázaro por su cuasi-desquicio en el corte de las hojas. A Israel Medina por su apoyo en momentos clave. A Noelia Fraile por sus hermosas palabras de aliento. A Ariadna Martínez Virués y a Javier Tolome por su ayuda en laboratorio. A Dña. Rosita y Dn. Catín, directores del rancho Hobonil, por darnos abrigo, comida y buena compañía en nuestras visitas. Y gracias a todas las demás personas cuyos nombres se pierden en mi mente, pero que han dejado su granito de arena en la construcción de la tesis. Gracias a la Güera Yu-Yú por ser el único ser que logró soportarme en esta última etapa. iv Índice Resumen ........................................................................................................................................... 1 Capítulo I. Introducción ................................................................................................................... 2 ¿Qué es la herbivoría? ..............................................................................................................3 Cómo estimar las respuestas compensatorias...........................................................................4 Influencia del ambiente en las interacciones............................................................................5 Estructura de la tesis.................................................................................................................6 Referencias ...................................................................................................................................8 Capítulo II. Herbivory, growth, and reproduction of Anthurium schlechtendalii (Araceae) in different local conditions ........................................................................................................ 13 Abstract ......................................................................................................................................14 Introduction ................................................................................................................................15 Materials and Methods ...............................................................................................................16 Study species ..........................................................................................................................16 Study sites ..............................................................................................................................17 Site characteristics..................................................................................................................18 Detritus quality.......................................................................................................................18 Leaf quality ............................................................................................................................18 Herbivore abundance..............................................................................................................19 Herbivory, growth and reproduction......................................................................................19 Data analysis ..........................................................................................................................20 Results ........................................................................................................................................22 Site characteristics..................................................................................................................22 Herbivory ...............................................................................................................................23 Growth and reproduction .......................................................................................................23 Effect of herbivory on growth and reproduction....................................................................23 Discussion ..................................................................................................................................24 Acknowledgments ......................................................................................................................27 References ..................................................................................................................................28 v Capítulo III. Variations in leaf production and floral display of Anthurium schlechtendalii (Araceae) in response to herbivory and environment.............................................................40 Summary ....................................................................................................................................41 Introduction ................................................................................................................................42 Materials and methods ...............................................................................................................43 Study Species .........................................................................................................................43 Study area...............................................................................................................................44 Common garden experiments.................................................................................................45 Field experiments ...................................................................................................................46 Data analysis ..........................................................................................................................46 Results ........................................................................................................................................47 Common garden .....................................................................................................................47 Field experiment.....................................................................................................................48 Discussion ..................................................................................................................................49 Acknowledgments ......................................................................................................................52 References ..................................................................................................................................53 Capítulo IV. Factores determinantes del despliegue floral y asignación sexual en Anthurium schlechtendalii (Araceae): herbivoría, tamaño de la planta y variación ambiental................ 63 Resumen .....................................................................................................................................64 Introducción ...............................................................................................................................65 Materiales y Métodos .................................................................................................................67 Descripción de la especie .......................................................................................................67 Área de estudio.......................................................................................................................68 Diseño espacial.......................................................................................................................69 Análisis estadísticos ...............................................................................................................71 Resultados ..................................................................................................................................72 Discusión....................................................................................................................................73 Referencias .................................................................................................................................76 Capítulo V. Discusión General....................................................................................................... 86 Referencias .................................................................................................................................90 vi Lista de Tablas Capítulo II. Herbivory, growth, and reproduction of Anthurium schlechtendalii (Araceae) in different local conditions Appendix. Covariance matrices of the three A. schlechtendalii populations used in the path analysis. Sample sizes (number of plants) are shown in parenthesis beside the population name. ........................................................................................................................................................33 Table 1. Chemical characteristics of the A. schlechtendalii substrate (detritus). Means ± SE for each populations are shown. The univariate F value from MANOVA (Wilks’ Lambda = 0.029, F = 21.32, P < 0.0001) analysis are shown for each characteristics. Different letters indicate significant differences (P < 0.05, Bonferroni adjustment) between populations...........................34 Table 2. Growth and reproduction characteristics (Mean ± SE) of the three A. schlechtendalii populations studied. Different letters indicate significant differences between averages (P < 0.05, polinomial contrast)........................................................................................................................35 Table 3. Multisample comparison of path coefficient between populations using Lagrange Multiplier Test. Asterisks (*) indicate the significant (P < 0.05) chi-square values (χ2), showing the paths contributing to the differences among populations.........................................................36 Capítulo III. Variations in leaf production and floral display of Anthurium schlechtendalii (Araceae) in response to herbivory and environment Table 1. Logistic regression results for leaf and inflorescence production of A. schlechtendalii in the common garden experiment. The Hobonil plant source site and 75% herbivory treatment were used as the reference parameters in the analysis. Only significant (P ≤ 0.05) and marginally significant odds ratios (ratio between probability of leaf or inflorescence production and probability of lack of production), and regression coefficients (β) are shown. .............................57 vii Table 2. Logistic regression comparison between seasons for growth and floral display of A. schlechtendalii. The 2001 season was used as the reference parameter. All significant (P ≤ 0.05) and no significant odds ratios and regression coefficients (β) are shown. .....................................58 Table 3. Logistic regression results for growth and floral display of A. schlechtendalii in the field experiment. The Hobonil population and 75% herbivory treatment were used as reference parameters in the analysis. Only significant (P ≤ 0.05) odds ratios (ratio between probability of leaf or inflorescence production and probability of lack of production) and regression coefficients (β) are shown. .................................................................................................................................59 Capítulo IV. Factores determinantes del despliegue floral y asignación sexual en Anthurium schlechtendalii subp. schlechtendalii (Araceae): herbivoría, tamaño de la planta y variación ambiental Tabla 1. Comparación entre los diseños anidado y libre empleados en el análisis del despliegue floral y asignación sexual de A. schlechtendalii. Se muestran la estimación de la bondad de ajuste para cada variable principal en ambos diseños, los grados de libertad (gl), el Ji-cuadrado (χ2). ...81 Tabla 2. Análisis del despliegue floral y asignación reproductiva de A. schlechtendalii. Se presentan la proporción F (con error tipo III para muestras desbalanceadas), su probabilidad asociada para cada variable en el diseño libre de anidamientos. ...................................................82 Tabla 3. Promedios de las características de despliegue floral y asignación sexual de A. schlechtendalii para cada zona de estudio. Entre paréntesis se muestra el intervalo de 95 % de confianza para cada promedio. Las letras indican diferencias entre las medias (P < 0.05, Bonferroni test). .............................................................................................................................83 viii Lista de Figuras Capítulo II. Herbivory, growth, and reproduction of Anthurium schlechtendalii (Araceae) in different local conditions Figure 1. Abundance of herbivores of A. schlechtendalii in the study sites. Means ± SE are shown for each herbivore taxa and functional guild. (LC) = leaf chewers; (SF) = sap feeders. ...............37 Figure 2. Leaf size changes (a) during an annual cycle of A. schlechtendalii and temporal herbivory pattern at: (b) individual plant level, (c) labeled leaves. Means ± SE for each population are shown. Telchac: Gray circles, Dzemul: Blank circles, and Hobonil: full circles. .38 Figure 3. Path analysis result for each A. schlechtendalii population studied: (a) Telchac, (b) Dzemul, and (c) Hobonil population. Asterisk indicates a significant path (P < 0.05). The minus sign (-) on the path coefficients indicates a negative causal relation between variables. The numbers before the E´s show the residual variance for each dependant variable..........................39 Capítulo III. Variations in leaf production and floral display of Anthurium schlechtendalii (Araceae) in response to herbivory and environment Figure 1. Anthurium schlechtendalii: (a) reproductive individual and; (b) inflorescence (illustration A. Canto). ...................................................................................................................60 Figure 2. Observed events of growth and floral display in A. schlechtendalii in the common garden experiment. The results are shown as percentages of events. Asterisks indicate significant (P < 0.05) odds ratios (with respect to reference parameters: Hobonil plant source and 75 % damage) for each factor level (see text and Table 1 for statistics). ................................................61 Figure 3. Observed events of growth and floral display in A. schlechtendalii in field experiment. The results are shown as percentage of events. Asterisks indicate significant odds ratios (with respect to reference parameters: Hobonil site and 75 % damage) for each factor level (see text and Table 3 for statistics). ..............................................................................................................62 ix Capítulo VI. Factores determinantes del despliegue floral y asignación sexual en Anthurium schlechtendalii subp. schlechtendalii (Araceae): herbivoría, tamaño de la planta y variación ambiental Figura 1. Ubicación de la península de Yucatán en México. Se muestran las zonas y los sitios con poblaciones de A. schlechtendalii en dónde se realizó el estudio. Con líneas punteadas están delimitadas las zonas: (I) duna costera; (II) selva caducifolia espinosa; (III) selva mediana. Los triángulos señalan la ubicación de los sitios dentro de cada zona..................................................84 Figura 2. Anthurium schlechtendalii. (a) Planta reproductiva. (b) Secciones de la inflorescencia: (♀ + ♂) indica la sección de flores que madura como femeninas y después como masculinas; (♀) indica la sección de flores que únicamente maduran como masculinas. .......................................85 x Resumen En el estudio de las interacciones entre plantas y animales es importante entender la manera en que esta interacción cambia con respecto al entorno en la que ocurre. La interacción con herbívoros ha llevado a las plantas a desarrollar dos estrategias evolutivas: resistencia (capacidad para evitar o disminuir el ataque de herbívoros) y tolerancia (capacidad para soportar o recuperarse del daño por herbívoros). En esta tesis se evaluaron las respuestas de tolerancia de la herbácea tropical Anthurium schlechtendalii (Araceae) desde una perspectiva de variación ambiental. La hipótesis abordada apoya el efecto negativo de la herbivoría sobre el crecimiento y la reproducción, pero dicho efecto cambia en función del ambiente, siendo que en ambientes ricos en recursos, la herbivoría no afectaría el crecimiento y la reproducción, mientras que en ambientes pobres sería una limitante. Para evaluar esta hipótesis, se realizó una descripción del sistema de estudio resaltando las diferencias en nutrientes del suelo, calidad de las hojas y herbívoros potenciales entre ambientes (duna costera, selva caducifolia y selva mediana). Se registraron los niveles de herbivoría, producción de hojas, espádices y eficiencia reproductiva (frutos maduros con respecto al total de flores) en cada ambiente. La herbivoría fue mayor en sitios con mayor abundancia de recursos (nutrientes y calidad de las hojas) y herbívoros. Sin embargo, la producción de espádices e infrutescencias fue mayor en el sitio pobre, pero la eficiencia reproductiva fue baja. El crecimiento fue similar en todos los sitios. Se evaluó experimentalmente la respuesta de la planta por herbivoría artificial, siendo evidente que la respuesta depende de las condiciones ambientales. Se observó un compromiso entre crecimiento y reproducción el cual puede ser incrementado por la herbivoría y las condiciones ambientales. El crecimiento se mantuvo a expensas de la reproducción, acentuándose en sitios con limitación de nutrientes. Por último, se evaluó la variación ambiental entre características reproductivas y su relación con el tamaño de la planta y la herbivoría. Los resultados sugirieron que la herbivoría no es relevante en las características reproductivas, pero el tamaño y el ambiente sí lo son. La conclusión general es que la herbivoría afecta el crecimiento y la reproducción pero su importancia depende principalmente de las condiciones ambientales en los que la planta se desarrolla, siendo mayor en sitios pobres en recursos. De esta manera, la heterogeneidad ambiental promueve la diversidad de resultados en la respuesta de A. schlechtendalii a la herbivoría. Finalmente, lo encontrado en el presente estudio subraya la importancia de evaluar las interacciones planta – animal desde una perspectiva de variación ambiental para comprender mejor su impacto en procesos como la diversificación de especies. 1 Capítulo I. Introducción 2 ¿Qué es la herbivoría? La herbivoría pueder ser considerada una fuerza selectiva fundamental en la ecología y evolución de plantas y herbívoros (Marquis 1992). Es una interacción interespecífica que probablemente surgió como consecuencia del origen de las plantas sobre la tierra durante el período Silúrico, hace 439 millones de años (Herrera y Pellmyr 2002). Esta interacción se define como un antagonismo en el que uno de los interactuantes, el herbívoro, se alimenta de partes del tejido vegetal vivo del otro integrante de la interacción, la planta (Crawley 1983, Rico-Gray 2001). La herbivoría es efectuada por una gran diversidad de organismos, desde invertebrados como moluscos e insectos hasta grandes vertebrados como antílopes y jirafas, y ocurre en todos los biomas sobre la tierra. Al nivel mundial, los herbívoros pueden llegar a consumir del 3 al 8 % de la producción anual del follaje (Mattson y Addy 1975). Sin embargo, la intensidad varía considerablemente con respecto al hábitat y a la productividad primaria (Coley y Aide 1991). Generalmente, los ambientes que mayor herbivoría soportan son los de mayor productividad, como las selvas tropicales y los pastizales naturales e inducidos (McNaughton et al. 1989). En particular, la herbivoría vista como el porcentaje de área foliar consumida anualmente, es mayor en las selvas tropicales (10.9 %) que en los bosques templados (7.5%; Dirzo 1987, Coley y Aide 1991 Marquis y Braker 1994, Domínguez y Dirzo 2002). El hecho de que los herbívoros consuman a intervalos partes de la planta ha permitido la evolución de diferentes respuestas para evitar, soportar o contrarrestar el impacto de los herbívoros sobre la adecuación de las plantas (Järemo et al. 1999). Esta diversidad de respuestas puede dividirse en dos estrategias evolutivas claras: resistencia y tolerancia. Estas estrategias no son mutuamente excluyentes y pueden presentarse en mayor o menor grado dentro de una misma especie (Simms y Triplett 1994, Fornoni 2002). La resistencia, definida como las características de las plantas que tienen el atributo de repeler o disminuir el ataque de los herbívoros (Fritz y Simms 1992), incluye barreras físicas como el endurecimiento de las hojas por acumulación de ligninas, la presencia ceras foliares y de espinas, tricomas sobre hojas y tallos (Cano-Santana y Oyama 1992, Eigenbrode y Espelie 1995). Las características de resistencia también incluyen respuestas químicas inducidas como la producción de toxinas y repelentes de herbívoros principalmente derivadas de metabolismo secundario de la planta (Rosenthal y Berenbaum 1991, Karban y Baldwin 1997). 3 La estrategia de tolerancia es definida como la capacidad de la planta para soportar o recuperarse después de la herbivoría (Rosenthal y Kotanen 1994). La tolerancia engloba respuestas de crecimiento y reproducción compensatorios después del daño (Rosenthal y Kotanen 1994, Strauss y Agrawal 1999, Juenger y Bergelson 2000). La reducción del tejido vegetal, en particular del área foliar (tejido fotosintéticamente activo), produce un desbalance de carbono y agua dentro de la planta, el cual origina un nuevo ajuste en la asignación de recursos (Bryant et al. 1983). Esta reasignación ocurre entre las funciones vegetativa, reproductiva y de mantenimiento (Lambers et al. 1998). El impacto de esta nueva asignación puede reflejarse en el crecimiento (Ferraro y Oesterheld 2002), en el despliegue floral (Strauss et al. 1996) y en la asignación sexual entre las funciones masculina y femenina de la planta (Hendrix 1988). Si los organismos tienen un presupuesto finito de recursos, entonces se predice que un desvío de recursos hacia una función dentro disminuye la asignación hacia otras funciones (Charlesworth y Charlesworth 1981). Sin embargo, en las plantas, procesos como almacenamiento, retranslocación de recursos (Tuomi 1992) y fotosíntesis en estructuras reproductivas (Obeso 2002), permiten ampliar o complementar el presupuesto energético de la planta y así, relajar la presión de factores como la herbivoría y la escasez de recursos en el ambiente. El presente trabajo tiene como contexto general las respuestas compensatorias, por lo que a continuación se profundiza en la información referente a la tolerancia y sus procesos compensatorios en las plantas. Cómo estimar las respuestas compensatorias El cambio en la asignación de recursos debido a la herbivoría puede ser estimado en procesos como la fotosíntesis (Meyer 1998), crecimiento de partes vegetativas tales como raíces y renuevos (McNaughton 1983, Juenger y Crawley 1996, Ferraro y Oesterheld 2002), características del despliegue floral (Strauss 1997, Parra-Tabla et al. 2004) y éxito reproductivo (Marquis 1984, Hendrix 1988, Mothershead y Marquis 2000). En estos procesos y características pueden ocurrir tres tipos de respuestas compensatorias a la herbivoría: sub-compensación, compensación y sobre-compensación (Strauss y Agrawal 1999). Cuando la adecuación de las plantas con herbivoría es menor a la de plantas coespecíficas sin herbivoría, hay subcompensación (e.g. Bach 1998). Si las plantas con herbivoría tienen una adecuación similar a la de las plantas sin daño, hay compensación (e.g. Bergelson & Juenger 1996, Gadd et al. 2001). Por último, si las plantas con herbivoría tienen una adecuación superior a la de plantas sin daño, 4 hay sobre-compensación; es decir han obtenido un beneficio en la adecuación debido a la herbivoría (e.g. Paige et al. 2001, ver Crawley 1987). El tipo de respuesta de las plantas depende de varios factores como la especie per se (Obeso 1993, Tuomi 1992), el estado nutricional del individuo (Inbar et al. 2001, De Bruyn et al. 2002), la intensidad del daño (Domínguez y Dirzo 1994, Edwards 1985) y el ambiente en donde se desarrolla la planta (Hilbert et al. 1981, Maschinski y Whitham 1989, Hawkes y Sullivan 2001, Fornoni 2002). En esta tesis se explora el efecto de la herbivoría sobre el crecimiento (producción de hojas) y componentes reproductivos (despliegue floral, asignación sexual y eficiencia reproductiva), con énfasis en la consecuencia del ambiente y tamaño de la planta en las respuestas compensatorias. Influencia del ambiente en las interacciones Sin duda la matriz ambiental (conjunto de variables climáticas, edáficas y bióticas) ha tenido un profundo impacto sobre la ecología y evolución de las plantas, puesto que puede determinar el presupuesto energético para el crecimiento, la reproducción y el mantenimiento (Travis 1996, Hoffmann y Merilä 1999, Hoffmann y Hercus 2000). Las condiciones climáticas se encuentran en íntima relación con las características edáficas y esto determina la disponibilidad de recursos (agua y nutrientes minerales) para las plantas (Chapin 1991). La cantidad de recursos es una limitante en la respuesta de la planta a daños como la herbivoría (Coley et al. 1985; Parra-Tabla y Bullock 1998). En general, las plantas que se encuentran en un ambiente rico en agua y nutrientes cuentan con un presupuesto de recursos amplio. Esto sugiere, por lo tanto, que las plantas de sitios ricos tendrían una mayor capacidad de recuperarse a la disminución de tejido vegetativo que aquellas plantas que habitan sitios pobres en recursos (Maschinski y Whitham 1989). Sin embargo, una ventaja de encontrarse en un sitio pobre, es que las plantas crecen por debajo de su tasa de crecimiento de sus coespecíficos de sitios ricos. Teóricamente, cuando ocurre la herbivoría, las plantas que están por debajo de su tasa máxima de crecimiento tendrían un umbral mayor de respuesta para recuperar el tejido perdido o compensar la herbivoría, que aquellas plantas que están creciendo cerca de su tasa máxima, es decir, aquellas plantas de sitios ricos en recursos (Hilbert et al. 1981). El principal supuesto que sustenta esta teoría es el hecho de que la herbivoría es un disparador del crecimiento (Van der Meijden 1990). De esta manera, al dispararse el crecimiento, aquellas plantas que estaban creciendo lentamente, debido a las condiciones del ambiente, pueden recuperarse con menor inversión energética que aquellas 5 plantas creciendo rápidamente, implicando una mayor inversión energética para recuperar su tasa de crecimiento. Sin embargo, esta posible ventaja solo ocurriría en un escenario en el cual una cantidad de herbivoría no sobrepasa el umbral después del cual el daño causa una importante disminución en la adecuación de la planta. Por otro lado, el ambiente determina la probabilidad de ocurrencia de las interacciones al influir sobre la presencia y abundancia de las contrapartes interactuantes (Thompson 1994). Por ejemplo, en un zona con clima extremo (ambientes áridos) la abundancia de organismos puede ser baja y por lo tanto, también la frecuencia de las interacciones (Bazzaz 1996, Travis 1996). Por ejemplo, las plantas que se desarrollan en un área con baja abundancia de herbívoros pueden presentar una baja intensidad de herbivoría. En contraparte se espera que los ambientes ricos en recursos, los herbívoros también sean abundantes y esto conlleve a una mayor herbivoría. De esta manera, se espera que las poblaciones de una especie de amplia distribución geográfica están sujetas a diferentes condiciones ambientales y a diferentes historias ecológicas por la interacción con su ambiente físico y biológico. Los diferentes escenarios ecológicos son la materia prima para generar diferentes rutas evolutivas entre poblaciones y por lo tanto a conducir a fenómenos de diversificación y coevolución (Miller y Travis 1996, Travis 1996, Thompson 2002). Estructura de la tesis La presente tesis tiene como contexto teórico el efecto de la herbivoría sobre elementos vegetativos y reproductivos de Anthurium schlechtendalii subsp. schlechtendalii Kunth (Araceae) en un escenario de heterogeneidad ambiental. La principal hipótesis que sirvió de base en este trabajo fue que la herbivoría tiene un efecto importante sobre el crecimiento y la reproducción de A. schlechtendalii, pero que la magnitud de este efecto depende del ambiente en el que la planta se desarrolla. La principal predicción de la hipótesis es que la herbivoría, cuando es alta, limita el crecimiento y la reproducción. Sin embargo, si la planta se encuentra en un ambiente con abundantes recursos como agua y nutrientes minerales, entonces compensará (vía crecimiento y reproducción) mejor el daño que aquellas plantas de ambientes pobres. Complementariamente, si un ambiente es rico en recursos, probablemente sostenga una mayor abundancia de herbívoros y por lo tanto, las plantas de tal ambiente presentarán mayor herbivoría que aquellas de sitios pobres y con escasez de herbívoros. Bajo el contexto anterior, el objetivo general de la tesis fue explorar y evaluar el efecto de la herbivoría en la producción de hojas y características reproductivas de A. schlechtendalii en 6 diferentes ecosistemas. En el Capítulo II se describieron y exploraron las características del sistema A. schlechtendalii-herbívoros describiendo cómo varían de un ambiente a otro con el fin de plantear hipótesis de relaciones causales entre los características. Las características estudiadas fueron la calidad del sustrato sobre el que crece, la abundancia de herbívoros, la intensidad de herbivoría y su cambio en el tiempo, la producción de hojas como una medida del crecimiento, la producción de inflorescencia y su eficiencia reproductiva. Con esta información se exploró la red de relaciones causales entre herbivoría y desempeño (crecimiento y reproducción) de la planta y se plantearon hipótesis acerca de la manera en que la disminución de tejido fotosintético impacta el crecimiento y la reproducción de A. schlechtendalii. En el Capítulo III se determinó el efecto de la herbivoría sobre A. schlechtendalii bajo condiciones controladas y en condiciones heterogéneas. En esta parte se pusieron a prueba las hipótesis de Maschinski y Whitham (1989) y Hilbert et al. (1981) sobre los factores que influyen en las respuestas de las plantas a la herbivoría. Estas hipótesis son contrastantes, ya que los primeros autores (Maschinski y Whitham 1989) señalan que la disponibilidad de nutrientes es el principal determinante en las respuestas compensatorias de las plantas ante la herbivoría y que, a mayor disponibilidad de nutrientes las plantas compensaran mejor. La segunda hipótesis (Hilbert et al. 1981), también señala a la calidad del ambiente como un factor importante, pero que en los sitios pobres las plantas, como están creciendo mas lentamente que las plantas en sitios ricos compensarán más fácilmente el daño ya que solamente sería necesario un ligero incremento en el crecimiento para recobrar el tejido perdido. En cambio, cuando se les compara con las plantas de sitios pobres, las plantas de sitios ricos, las cuales están creciendo aceleradamente requerirán una mayor inversión energética para recuperarse de la herbivoría. A través de experimentos en el campo y en jardín común se exploraron ambas hipótesis en la producción de hojas y en el despliegue floral de A. schlechtendalii permitiendo evaluar el efecto de la herbivoría y del ambiente sobre estas características. En objetivo principal del Capítulo IV fue evaluar la variación en el despliegue floral y la asignación sexual entre y dentro de diferentes ecosistemas. La variación espacial en estas características fue evaluada en función de los niveles de herbivoría y del tamaño de la planta, la cual se considera un reflejo del ambiente en el que la planta se desarrolla. Esta parte del trabajo parte de la premisa de que la herbivoría es un factor que limita las características reproductivas como el número de inflorescencias, proporción de flores hermafroditas con respecto a las masculinas, biomasa de las diferentes secciones de la inflorescencia y longitud de éstas. También 7 se predice que el ambiente modifica el efecto de la herbivoría sobre A. schlechtendalii y que esto se reflejará en sus características reproductivas de tal forma que, las plantas de ambientes abundantes en recursos tendrán un mayor despliegue floral y una mayor asignación hacia lo femenino que aquellas plantas de ambientes menos ricos en recursos. La parte final de la tesis resalta la importancia de entender el papel del ambiente en el origen de diferentes rutas ecológicas dentro de la interacción de A. schlechtendalii con sus herbívoros y el impacto que tendrían estas diferentes historias ecológicas en la adecuación y cómo podría ser esta la materia prima para la diversificación entre poblaciones de una misma especie. Referencias Bach, C. E. 1998. Interactive effect of herbivory and sand burial on growth on a tropical dunn plant Ipomea pes-caprae. Ecological Entomology 23: 238-245. Bergelson, J., y Juenger, T. 1996. Regrowth following herbivory in Ipomopsis aggregata: compensation but not overcompensation. American Naturalist 148: 744-755. Bazzaz, F. A. 1996. Plants in changing environments. Cambridge University Press, New York. Begon, M., J. L., Harper, y C. R. Townsend 1996. Ecology. Blackwell Science Ltd., Oxford. Bryant, J. P., F. S. Chapin, y D. R. Klein. 1983. Carbon/nutrient balance of boreal plants in relation to vertebrate herbivory. Oikos 40: 357-368 Cano-Santana, Z., y K. Oyama. 1992. Variation in leaf trichomes and nutrients of Wigandia urens (Hydrophyllaceae) and its implications for herbivory. Oecologia 92: 405-409. Chapin, F. S. 1991. Integrated responses of plants to stress. BioScience 41, 29-36. Charlesworth, D., y B. Charlesworth. 1981. Allocation of resources to male and female functions in hermaphrodites. Biological Journal of the Linnean Society 15: 57-74. Coley, P. D., y T. M. Aide. 1991. Comparison of herbivory and plant defenses in temperate and tropical broad-level forest. Pp. 25-49 in P. W. Price., T. M. Lewinsohn., W. Fernandez and W. W. Benson, eds. Plant-animal interactions: Evolutionary ecology in tropical and temperate regions. John Wiley and Sons, Inc., New York. Coley, P. D., J. P., Bryant, y F. S. Chapin. 1985. Resource availability and plant antiherbivore defence. Science 230: 895-899. Crawley, M. J. 1983. Herbivory, the dynamics of plant-animal interactions. Blackwell Science Ltd., Oxford. Crawley, M. J. 1987. Benevolent herbivores? Trends in Ecology and Evolution 2:167-198. 8 De Bruyn, L., J., Scheirs, y R. Verhagen. 2002. Nutrient stress, host plant quality and herbivore performance of a leaf-mining fly on grass. Oecologia 130: 594-599. Dirzo, R. 1987. Estudios sobre interacciones planta-herbívoro en “Los Tuxtlas”, Veracruz. Revista de Biología Tropical 35: 119-131. Domínguez, C. A., y R. Dirzo. 1994. Effects of defoliation on Erythroxylum havanense, a tropical proleptic species. Ecology 75: 1896-1902. Domínguez, C. A., y R. Dirzo. 2002. Interacciones planta-herbívoro en la selva baja caducifolia de Chamela. Pp. 517-523 in F. A. Noguera, J. H. Vega Rivera, A. N. García-Aldrete, y M. Quesada-Avedaño, eds. Historia Natural de Chamela. Instituto de Biología-UNAM, México. Edwards, J. 1985. Effects of herbivory by moose on flower and fruit production of Aralia nudicaulis. Journal of Ecology 73: 861-868. Eigenbrode, S. D., y K. E. Espelie. 1995. Effects of plant epicuticular lipids on insect herbivores. Annual Review of Entomology 40: 171-194 Ferraro, D. O., y M. Oesterheld. 2002. Effect of defoliation on grass growth. A quantitative review. Oikos 98: 125-133. Fornoni, J. 2002. Evolución de la defensa en plantas contra enemigos naturales. Tesis de doctorado. Universidad Nacional Autónoma de México. México, D.F. Fritz, R. S., y E. L. Simms. 1992. Plant resistance to herbivores and pathogens, ecology, evolution, and genetics. University of Chicago Press, Chicago Gadd, M. E., T. P. Young y T. M. Palmer. 2001. Effects of simulated shoot and leaf herbivory on vegetative growth and plant defence in Acacia drepanolobium. Oikos 92: 515-521. Hawkes, C. V., y J. J. Sullivan. 2001. The impact of herbivory an plant in different resource conditions: a meta-analysis. Ecology 82: 2045-2058. Hendrix, S. D. 1988. Herbivory and its impact on plant reproduction. Pp. 246-263 in J. LovettDoust y L. Lovett-Doust, eds. Plant reproductive ecology, patterns and strategies. Oxford University Press, Oxford. Herrera, C. M. y O. Pellmyr. 2002. Plant-animal interactions: a evolutionary approach. Blackwell, Oxford. Hilbert, D. W., D. M., Swift, J. K., Detling, y M. I. Dyer. 1981. Relative growth rates and the grazing optimization hypothesis. Oecologia 51: 14-18. 9 Hoffmann, A. A., y J. M. Hercus. 2000. Environmental stress as an evolutionary force. BioScience 50: 217-226. Hoffmann, A .A., y J. Merilä. 1999. Heritable variation and evolution under favorable and unfavorable conditions. Trends in Ecology and Evolution 14: 96-101. Inbar, M., H. Doostdar, y R. Mayer. 2001. Suitability of stressed and vigorous plants to various insect herbivores. Oikos 94: 228-235. Järemo, J., J. Tuomi, P. Nilsson, y T. Lennartsson. 1999. Plant adaptations to herbivory: mutualistic versus antagonistic coevolution. Oikos 84:313-320. Juenger, T., y J. Bergelson. 2000. The evolution of compensation to herbivory in scarlet gilia, Ipomopsis aggregata: herbivore-imposed natural selection and the quantitative genetics of tolerance. Evolution 54: 764-777. Juenger, T., y J. Crawley. 1996. Regrowth following herbivory in Ipomopsis aggregata: Compensation but not overcompensation. American Naturalist 148: 744-755. Karban, R., y I. T. Baldwin. 1997. Induced responses to herbivory. University of Chicago Press, Chicago. Lambers, H., F. Stuart, y T. L. Pons. 1998. Plant physiological ecology. Springer-Verlag, New York. Marquis, R. J. 1984. Leaf herbivores decrease fitness of a tropical plant. Science 226: 537-539. Marquis, R. J. 1992. The selective impact of herbivores. Pp. 301-325 in R. S. Fritz, y E. L. Simms, editores. Plant resistance to herbivores and pathogens ecology, evolution, and genetics. University of Chicago Press, Chicago. Marquis, R. J., y H. E. Braker. 1994. Plant-herbivore interactions: diversity, Specificity, and impact. Pp. 262-281 in L. A. McDade, K. S. Bawa, H. A. Hespenheide, y G. S. Hartshorn, editores. La Selva: ecology and natural history of a neotropical rain forest. University of Chicago Press, Chicago. Maschinski, J., y T. G. Whitham. 1989. The continuum of plant responses to herbivory: the influence of plant association, nutrient availability, and timing. American Naturalist 134: 1-19. Mattson, J. W. y N. D. Addy. 1975. Phytophagous insects as regulators of forest primary production. 190: 515-522. McNaughton, S. J. 1983. Compensatory plant growth as a response to herbivory. Oikos 40: 329336. 10 McNaughton, S. J., M., Oesterheld, D. A., Frank, y K. J. Williams. 1989. Ecosystem-level patterns of primary productivity and herbivory in terrestrial habitats. Nature 341: 142-144. Meyer, G. A. 1998. Pattern of defoliation and its effect on photosynthesis and growth of goldenrod. Functional Ecology 12: 270-279. Miller, T., y J. Travis. 1996. The evolutionary role of indirect effects in communities. Ecology 77: 1329-1335. Mothershead, K., y R. J., Marquis. 2000. Fitness impacts of herbivory through indirect effects on plant-pollinator interactions in Oenothera macrocarpa. Ecology 81: 30-40. Obeso, J. R. 1993. Does defoliation affect reproductive output in herbaceous perennials and woody plants in different ways? Functional Ecology 7: 150-155. Obeso, J. R. 2002. The cost of reproduction in plants. New Phytologist 155: 321-348. Paige, K. N., B. Williams, y T. Hickox. 2001. Overcompensation through the paternal component of fitness in Ipomopsis arizonica. Oecologia 128: 72-76. Parra-Tabla, V., y H. Bullock. 1998. Factors limiting fecundity of the tropical tree Ipomoea wolcottiana (Convolvulaceae) in a Mexican tropical dry forest. Journal of Tropical Ecology 14: 615-627. Parra-Tabla, V., V. Rico-Gray, y M. Carbajal. 2004. Effect of defoliation on leaf growth, sexual expression and reproductive success of Cnidoscolus aconitifolius (Euphorbiaceae). Plant Ecology 173: 153-160. Rico-Gray, V. 2001. Interspecific interaction. Macmillan Publisher Ltd. Rosenthal, G., y M. R. Berenbaum. 1991. Herbivores: their interactions with secondary plant metabolites. Academic Press, New York. Rosenthal, J. P., y P. M. Kotanen. 1994. Terrestrial plant tolerance to herbivory. Trends in Ecology and Evolution 9: 145-148 Simms, E. L., y J. Triplett. 1994. Cost and benefits of plant responses to disease: resistance and tolerance. Evolution 48: 1973-1985 Strauss, S. Y. 1997. Floral characters link herbivores, pollinators and plant fitness. Ecology 78: 1640-1645. Strauss, S. Y., y A. A. Agrawal. 1999. The ecology and evolution of plant tolerance to herbivory. Trends in Ecology and Evolution 14: 179-185. 11 Strauss, S. Y., J. K. Conner, y S. L. Rush. 1996. Foliar herbivory affects floral characters and plant attractiveness to pollinators: implications for male and female plant fitness. American Naturalist 147: 1098-1107 Thompson, J. N. 1994. The coevolutionary process. University of Chicago Press, Chicago. Thompson, J. N. 2002. Plant-animal interactions: future directions. Pp. 236-247. in C. M. Herrera y O. Pellmyr. Plant-animal interactions: an evolutionary approach. Blackwell, Oxford. Travis, J. 1996. The significance of geographical variation in species interactions. American Naturalist 148:51-58. Tuomi, J. 1992. Toward integration of plant defence theories. Trends in Ecology and Evolution. 7: 365-367. Van der Meijden, E. 1990. Herbivory as a trigger for growth. Functional Ecology 4:597-598. 12 Capítulo II. Herbivory, growth, and reproduction of Anthurium schlechtendalii (Araceae) in different local conditions Azucena Canto, José G. García Franco, Departamento de Ecología Vegetal, Instituto de Ecología, A.C., Apdo. Postal 63, 91000 Xalapa, Veracruz, México. Víctor Parra Tabla, Departamento de Ecología, Campus de Ciencias Biológicas y Agropecuarias, Universidad Autónoma de Yucatán. Apdo. Postal 4-116 (Itzimná), Mérida, Yucatán 97100, México. Artículo enviado a Biotrópica 13 Abstract Perennial plants with long leaf lifespan give the opportunity to evaluate the effect of accumulated herbivory on fitness. The variation in timing and intensity of herbivory and its relationship to growth and reproduction in Anthurium schlechtendalii were evaluated in three natural populations (Telchac, Dzemul and Hobonil, arranged from drier to wetter environments) on the Yucatan Peninsula, Mexico. Populations were different in climatic conditions, plant-substrate nutrients, and leaf quality and herbivore abundance. Results showed a cumulative pattern of leaf damage throughout the year in all populations, though most herbivory occurred during the growth and flowering period (rainy season). Spatial patterns revealed that Telchac population had less herbivory but high inflorescence and infructescence (immature and mature) production. Dzemul and Hobonil populations, in contrast, had higher herbivory and produced fewer infructescences. Fruit set, however, was significantly higher at Hobonil, even though fewer infructescences were produced. The path analysis did not suggest a direct relationship between A. schlechtendalii performance and herbivory, but suggested a strong relationship between plant performance and leaf area. On the other hand, herbivory intensity, growth and, reproduction varied with leaf area between populations. Our results suggest an important impact of local environmental conditions on A. schlechtendalii performance, besides the weak effect observed of herbivory on plant fitness. Key words: Anthurium schlechtendalii, Araceae, Coastal sand dunes, Dry forest, Fruit set, Herbivory, Inflorescence production, Leaves production, México, Path analysis, Subhumid forest, Yucatán Peninsula. 14 Introduction The study of plant-herbivore interactions requires assessing the effect of frequency and intensity of herbivory in order to determine its ecological importance (Crawley, 1983; Belsky, 1986; Marquis, 1992). Variations in herbivory occur at different temporal and spatial scales and are expressed across a continuum of plant and animal responses that depend on the trade of between plant functions and local environment in which interaction occurs (Whitham et al. 1991, Thompson 1994, Travis, 1996). A result of those variations clear patterns of herbivory can be detected when herbivore damage is addresses among populations. Different patterns of herbivory can lead to different ecological paths and perhaps lead evolutionary divergence among plant populations. On a temporal scale there are critical plant phenology periods during which herbivory is more intensive given a temporal pattern of damage (Aide 1993). In growth season when leaves are emerging and through the leaf elongation phase, leaves may receive a high quantity of damage by herbivores. Growth and elongation are attractiveness periods because they represent abundant and high quality foot events for herbivores. Additionally, if a plant has long lifespan leaves it might suffer considerable herbivory accumulation with every growth and elongation periods and thus experiences long-term impact on its performance (Kursar & Coley 1991, Aide 1993, Farnsworth & Ellison 1993; Kaitaniemi et al. 1999). On a spatial scale, herbivory varies as a function of resources availability (Forkner & Hunter 2000, Hawkes & Sullivan 2001). In water- and nutrient-rich sites, the plant capacity to recover from herbivore damage is not limited (Coley et al. 1985, Meyer & Root 1993, Meyer 2000). However, there may be greater numbers of herbivores in resource-rich sites and thus a greater herbivore intensity (Stanton 1983, Karban 1992, Forkner & Hunter 2000). Herbivory in limited resource sites, however, can show a strong impact on plant due to the trade-off that plants confront between growth, reproduction and maintenance functions. The advantage of resourcepoor sites, however, is that they also limit herbivore populations, maintaining herbivory at low levels (Young 1982, Wolda 1988, Forkner & Hunter 2000, Ritchie 2000). Plants need to allocate their acquired resources between vegetative, reproductive and maintenance functions (Charnov 1982) generating an important trade off between plant functions. The plant process to recover of herbivory (i.e. maintenance function) demands a large quantity of resources thus the damage can strengthen the trade-off between resources allocation to growth 15 and reproductive functions (Freeman et al. 1980, Stephenson 1981, Simms 1992). In plants with synchronous growth and reproduction (both highly resource-demanded processes) a greater resource allocation to recover from herbivory, can represent a constraint on current reproduction (Cipollini & Whigham 1994; Simons & Johnston 1999). Moreover, different environments can lead to different outputs between populations in the vegetative-reproductive trade-off. The effect of herbivore damage in plants with synchronous growth and reproduction, has received little attention. The tropical perennial herb Anthurium schlechtendalii is an excellent model for this kind of studies because it grows in highly different tropical environments (from coastal dunes to rain forests), experiences high levels of herbivory, and its leaves accumulate damage from past seasons (sometimes more than two years). Additionally, this plant has synchronous growth and reproductive events. This study was done to study herbivory patterns through time (current and accumulated) and to explores its effect on growth and reproduction in three A. schlechtendalii populations growing in different environments. The following questions were addressed: (1) How do herbivory patterns vary in time and intensity among populations with different environmental conditions? (2) How do growth and reproduction vary between populations? (3) How are the former variables related with herbivory among populations? Materials and Methods Study species Anthurium schlechtendalii subsp. schlechtendalii (Araceae) is distributed along the Atlantic slope of Mesoamerica from the central portion of the state of Veracruz, Mexico to Nicaragua (Croat 1991). On the Yucatan Peninsula (México) this plant grows in calcareous soils in environments ranging from water- and nutrient-poor coastal scrubs to organically rich, subhumid forests. A. schlechtendalii is a tropical perennial protogynous herb and produces a solitary inflorescence bearing approximately 1000 small (ca. 1 mm) flowers (Croat 1991). All flowers of an inflorescence are perfect but, only the basal flowers are functional hermaphrodites and can produce fruits. Flowers are not self-compatible and fruits are red berries that typically hold two seeds, meaning seed output can be estimated by the fruit set. Both leafing and flowering periods are annual and occur simultaneously just before the rainy season (May–June). A. schlechtendalii produces few (ca 6), but conspicuous (mean foliar area 521.4 ± 30.6 [SE] cm2) leaves with lifespans as long as two years. A mature leaf usually support, structural 16 and nutritionally, the development of an inflorescence. The stem is usually short with internodes and leaf scars hidden by a dense mass of thick, greenish roots called nest roots (Croat 1991). This root structure and the reduced stem produce a “basket shape” in which leaves, twigs and other detritus gather (Mayo et al. 1997). Herbivory of previous seasons can be recorded in this plant and thus, current damage measurements are a good reflection of the herbivory history of a plant. The majority of herbivory damage is caused by grasshoppers (Acrididae) and caterpillars (Noctuidae), both of which can consume large areas of leaf (> 50 %, A. Canto unpubl. data). Study sites The study was carried out in three A. schlechtendalii populations located in the three main regional ecosystems of the state of Yucatan, Mexico: Telchac, Dzemul and Hobonil. The first population, Telchac, is located on the coastal barrier dune in northern Yucatán (21º19’50’’N; 89º21’58’’W, altitude 2 m) and its environment is semi-arid with thorn-scrub vegetation growing on a sandy dry substrate with limited mineral nutrients (Duch 1988). The main species at this site are Metopium brownei, Coccoloba uvifera, Cocothrinax readii, Agave sisalana, Acanthocereus pentagonus, Opuntia dilleni, Caesalpinia versicaria, and Bumelia retusa (Flores & Espejel 1994). Maximum temperatures during the study period were 43.5 ºC (1999), 40.5 ºC (2000) and 40.0 ºC (2001), and annual rainfall was 710 mm (1999), 374 mm (2000) and 584 mm (2001) (National Commission of Water in Mexico – CNA, unpubl. data). Dzemul is located 15 km south of the Telchac population in a dry forest margin (21º16’37’’N; 89º19’09’’W, altitude 7 m). This low-dry forest grows on limestone bedrock soils with abundant leaf-fall accumulation (Duch 1988). Species at this site includes trees such as Acacia collinsii, Lisiloma latisiliqua, Mimosa bahamensis, Piscidia piscipula, Bursera simaruba, Jatropha gaumerii, and herbs such as Bromelia karats, Cnidoscolus aconitifolius, and Ipomea crinicalyx (Flores & Espejel, 1994). Maximum temperatures during the study were 43 ºC (1999), 41 ºC (2000), and 41 ºC (2001). Annual rainfall during the study was 1276.7 mm (1999), 942.3 mm (2000) and 1223 mm (2001) (CNA, unpubl. data). Hobonil is located 150 km south of Dzemul in a subhumid forest (20º00’27’’N, 89º01’36’’W, altitude 36 m).The main vegetation species are Vitex gaumerii, Enterolobium cicloparum, Guazuma ulmifolia, Sabal mexicana, Plumeria rubra, Ceiba aesculifolia and the herbs Aphelandra deppeana, and Hamelia patens (Flores & Espejel 1994). Maximum 17 temperatures during the study were 39.5 ºC (1999), 39.5 ºC (2000) and 41 ºC (2001). Annual rainfall during the study period was 1295.1 mm (1999), 1220.5 mm (2000) and 1347.8 mm (2001) (CNA, unpubl. data). Site characteristics In 2000 quick assessments were performed at each of the study sites in order to characterize the biotic and abiotic factors related to herbivory, growth and reproduction of A. schlechtendalii. These included analyses of, (1) the detritus accumulated between plant roots and stem; (2) leaf quality (N and C content, and the C:N ratio); and (3) abundance of potential herbivores of A. schlechtendalii. Detritus quality Detritus were collected in each population removing from 15 adult plants all the accumulated detritus on the base around theirs roots. Detritus covering roots is considered the main nutrient resource for this plant genus (Mayo, et al. 1997). Each detritus sample was kept on plastic bags and its gravimetric water content determined by drying to a constant weight. Total nitrogen (N) content was estimated using the Kjeldahl method, and extractable (uptake available for plants) phosphorus (P) ions were estimated with the Bray & Kurt method (Binkley & Vitousek 1989). Availability of extractable potassium (K), sodium (Na), calcium (Ca) and magnesium (Mg) were determined by flame emission spectrophotometry (Binkley & Vitousek, 1989), and hydrogen potential (pH) was measured with a potentiometer (Cold Parmer®). Leaf quality Thirty reproductive plants were chosen at each study site using a hierarchical spatial design: three plants by plot, five plots per subpopulation, and two subpopulations in each site. One full expanded leaf without evidence of herbivory was cut from each selected plant and dried to constant weight. Nitrogen content was estimated using the Kjeldahl method and carbon content by the Sample Combustion method. The C:N ratio per leaf was considered as an indicator of the plant’s nutritional condition (Jefferies 1999, Hughes & Bazzaz 2001). 18 Herbivore abundance In order to address the abundance of potential herbivores of A. schlechtendalii, extensive insect collecting was performed at the three study sites. Samplings were done in two areas at each study site. Within each area six 20 m2 (10 m long and 2 m wide) transects were sampled using the sweep-netting method (Southwood & Henderson 2000) to collect insects on the vegetation. Sampled specimens were preserved in 70% alcohol and classified both at taxonomic (order level) and functional (guild) group. Two functional groups of herbivores were identified: leaf chewers (Orthoptera and Lepidoptera) and sap feeders (Homoptera and Hemiptera). Herbivory, growth and reproduction Herbivory, growth and reproduction sampling were carried out from September 1999 to September 2000. Because plants are scattered in small groups (5-15 individuals), one plant was randomly selected from each group until reaching 25 reproductive individuals per site. Herbivory, growth and reproduction were recorded for each selected plant every two months. Individual herbivory was estimated by drawing on paper exactly as a mirror-image all full expanded leaves of each plant. Each drawing included the total area per leaf and its consumed (or damaged) area. Drawings were carefully cut out and leaf areas were measured using an Area Integrator (Li-COR®, Li-3100). Completely consumed leaves were easily identified by the scar left by the petiole or by the remaining unconsumed petiole. Individual herbivory was calculated as the proportion of the consumed area versus total leaf area per individual using the following formula: H = n n i =1 i =1 ∑ Ci ∑ FAi , [1] where H is herbivory, C is area consumed by herbivores of leaf i, and FA is total leaf area for the same leaf i. The time of year with the highest herbivory rates was recorded by monitoring labeled leaves every two months, from sprouting until the end of growing season. We marked, at the beginning of the growth season, one recently emerged leaf with no herbivory per plant (a total of 20 leaves in Telchac, 12 in Dzemul and 12 in Hobonil). Recently emerged leaves were easily identified due to their characteristic pale green color. Every two months drawings were made of each labeled leaf and its herbivory was determined. 19 Individual growth was recorded by counting the new emerged leaves every two months. During the reproductive period, the number of inflorescences per plant was recorded. Later we counted the number of pollinated (i.e. immature infructescences) and mature infructescences reached mature fruits. Fruit set per individual plant as the ratio between mature fruits and total functionally hermaphroditic flowers was also estimated. Because in this plant each fruit produces typically two seeds fruit set it was considered as adequate estimator of seed output. Data analysis A MANOVA (Scheiner & Gurevitch 1993, SYSTAT 6.0 1996) was performed to evaluate detritus nutrients, using site as a predictive factor for water, N, K, P, Na, Ca and Mg content, as well as pH. Variables were not transformed because they met the necessary assumptions for the analysis (i.e. normality and homoscedasticity; Zar 1984). Nitrogen, carbon and the C:N ratio were analyzed using a hierarchical ANOVA, nesting plot within area, and area within site. Leaf nitrogen and carbon variables were used untransformed, but the C:N ratio required transformation ( x + 1 ) to fulfill analysis assumptions. Herbivore abundance data were transformed ( x + 1 ) and were analyzed using a hierarchical ANOVA, nesting areas within site. When necessary, post hoc pairwise comparison tests were done (Sokal & Rohlf 1995). A repeated measures variance analysis (RM–ANOVA) and post hoc polynomial contrasts tests were performed to determine differences in herbivory among populations and months (Sokal & Rohlf 1995, SYSTAT 6.0 1996). Since the herbivory data had a biased distribution, they were arcsine–transformed with a Freeman & Tukey procedure (Zar 1984). The same procedures were applied to determine differences in the amount of herbivory on labeled leaves among populations and months. Changes in leaf size throughout the season were analyzed with an RM-ANOVA to detect increases in damage size and to avoid herbivory overestimation (Farnsworth & Ellison 1993). Differences between populations in leaves, inflorescences, infructescences (immature and mature), and fruit set were addressed with a covariance analysis (ANCOVA; SYSTAT 6.0 1996) using leaf area per plant as a covariable (Zar 1984). All variables were transformed ( x + 1 ) but the fruit set data were transformed using the arcsine of the square root (Zar 1984). When necessary, post hoc pairwise comparison tests were done (Sokal & Rohlf 1995). A path analysis was performed to explore the relationships between herbivory, growth and reproduction in A. schlechtendalii. This multilinear analysis allows 1) the construction of 20 path diagrams of the hypothetically causal relationships; 2) the detection of the magnitude and direction of the direct and indirect effects of the causal variables on the response variables; 3) the detection of spurious effects; and 4) the consideration of unmeasured factors (Schemske & Horvitz 1988, Kingsolver & Schemske 1991). A hypothetical path model was generate from our previous knowledge about the A. schlechtendalii system using the herbivory (i.e. average damage per individual); number of new leaves; number of inflorescences; number of immature and mature infructescences; and leaf size as the main variables in the model. Due to the lost of several mature infructescences, fruit set was not included in the analysis. This model included herbivory as causal variable in new leaves, inflorescences and mature infructescences production because it modified resource allocation in plants. Leaf size was also included as a causal variable in new leaves, inflorescence and mature infructescence production because it may reflect plant resource budget (Jefferies 1999, Hughes & Bazzaz 2001). As leaf size can affect amount of herbivory on a leaf, it was included as factor. Leaf production was established as affecting inflorescence production because growth and reproduction are simultaneous in A. schlechtendalii, and this variable could trigger a trade-off between vegetative and reproductive functions. The critical stages in A. schlechtendalii reproduction were represented in the model as the number of inflorescences, immature infructescences and mature infructescences paths. Structural equations models were generated with EQS 5.7b software (Bentler & Wu 1995) were used to calculate the path coefficients for each population, and the Wald test (Bentler 1995) was used to estimate the statistical significance of each coefficient. The fit of the path diagram to the data covariance structure was estimated by calculating the model’s chi-square (χ2) with the Maximum Likelihood method (ML). The Comparative Fit Index (CFI; Bentler 1995) was also applied, because it allows reliable estimations even with small sample sizes, and it uses a range of zero to a maximum of one, or total fit. The variables, when necessary, were transformed as described above and the required assumptions for the path analyses were verified according to procedures recommended by Wootton (1994) and Petraitis et al. (1996). The correlation matrices used in the analysis are included in the Appendix. To evaluate differences of the correlation matrices among populations, a multisampling analysis was carried out by imposing cross-group constraints on the path models (Bentler & Wu 1995). In this analysis the path coefficients were first constrained to be equal between two populations, and then an iterative ML procedure was done to obtain a fit value for this model. In order to test if path coefficients were different between populations, a pairwise 21 comparison was performed using a Lagrange Multiplier Test (Bentler 1995, Bishop & Schemske 1998). If the constrain imposed diminished the model fitness, the null hypothesis of equal path coefficient between populations was rejected. Results Site characteristics The MANOVA demonstrated a simultaneous variation in detritus characteristics that made significant differences in detritus quality between sites (Table 1). Detritus values for huminity, K, P, Ca and pH were significantly different between sites, while the values for N, Na, and Mg were similar among sites (Table 1). The difference in P was particularly significant because the P detritus content for Telchac was approximately a third of the Dzemul and Hobonil (Table 1). The plant detritus at Hobonil had the highest humidity and Ca content (P < 0.05). Detritus from Dzemul had the highest K and P values (P < 0.05). In contrast, detritus at Telchac had the lowest nutrient and water content values, and the most alkaline pH (P < 0.05; Table 1). The nested ANOVA indicated that leaf nitrogen content per gram of sample (%) differed among sites (F = 39.27, P < 0.0001), but not within the sites (Areas F = 2.22, P = 0.095; Plot F = 0.69, P = 0.844). Leaves at Telchac had the lowest N content (mean 1.09 ± SD 0.25 %, P < 0.0001) in comparison to Dzemul (1.57 ± 0.22 %) and Hobonil (1.55 ± 0.23 %). Leaf carbon content (%) differed between sites (F = 41.01, P < 0.0001) and within sites (Areas F = 19.90 P < 0.0001; Plot F = 5.55 P < 0.0001). The leaves at Telchac (45.69 ± 3.21 %, P < 0.0001) also had significantly less C than those at Dzemul (48.46 ± 1.57 %) and Hobonil (48.34 ± 1.71 %). The C:N ratio was also significantly different between sites (F = 25.20, P < 0.0001), but not within sites (Areas F = 2.67, P = 0.056; Plot F = 0.60, P = 0.915). Telchac had the highest C:N ratio, which was significantly different (44.39 ± 11.62, P < 0.0001) from that at Dzemul (31.35 ± 3.82) and Hobonil (32.02 ± 5.56), though the two latter were not different among each other (P > 0.9). Herbivore abundance was different between (F = 16.55, P < 0.0001) and within sites (Areas F = 8.70, P < 0.0001). Herbivores were less abundant in Telchac and Dzemul when compared to Hobonil (Fig. 1). 22 Herbivory Leaf size in Telchac was significantly smaller than in Dzemul and Hobonil (F = 8.92, P < 0.001; Fig. 2a). Since leaf size remained constant or increased only slightly throughout the season (F = 2.29, P > 0.05), there was no overestimation in herbivory measurement (Fig. 2a). Herbivory at individual level showed significant differences between populations (F = 45.7, P < 0.0001) and between months (F = 5.9, P < 0.0001). The Telchac population had significantly lower herbivory (P < 0.0001; Fig. 2b), than Dzemul and Hobonil which had similar herbivory levels (P = 0.15; Fig. 2b). The temporal pattern of herbivory was roughly linear and cumulative in all the populations (P < 0.0001, polynomial test; Fig. 2b). Additionally, no interaction was observed between population and month (F = 1.7, P > 0.05), indicating similar temporal patterns in all populations (Fig. 2b). Leaf damage in the labeled leaves was similar between populations (F = 2.6, P = 0.09) but differed within populations (across months; F = 3.2, P = 0.005). Herbivory intensity generally increased over time in the three populations (P = 0.014; Fig. 2c). The lowest herbivory levels occurred during the dry season (November 1999 - March 2000), followed by a drastic increase in herbivory during the rainy season (May 2000 - September 2000; Fig. 2c). Herbivory exhibited no significant interaction between populations and months for the labeled leaves (F = 1.3, P > 0.05). Growth and reproduction The growing and reproductive season occurred from May to June before the rainy season. The number of new leaves per individual did not differ significantly among the three populations and was unrelated to leaf size (Table 2). In contrast, there were clear differences in inflorescence, immature and mature infructescences, and fruit set among populations. Additionally those variables are related to leaf size (Table 2). The Telchac population had the highest number of inflorescences, and immature and mature infructescence production (Table 2). Fruit set exhibited a different pattern, Telchac and Dzemul having the lowest proportion of mature fruits while Hobonil had the highest (Table 2). Effect of herbivory on growth and reproduction The Telchac path diagram had a good fit (χ2 = 6.47, df = 5, P = 0.185), with a CFI of 0.94 and it showed no herbivory effect on any of the system variables. Only leaf size had a strong effect on inflorescence production and herbivory. The most significant relationships in the Telchac system 23 occur between the three reproductive phases with a particularly strong relationship between inflorescences and immature infructescences (Fig. 3a). The Dzemul path diagram had a good fit (χ2 = 8.71, df = 5, P = 0.091), with a CFI of 0.89. The path diagram shows the same significant paths as Telchac, with no herbivory effects on new leaves, inflorescences or mature infructescences. Leaf size negatively affected herbivory intensity but positively affected inflorescence production. Like the Telchac population, the three reproductive phases in the Dzemul population were positively related; such that the number of inflorescences determined the number of immature infructescences and consequently the number of mature infructescences (Fig. 3b). The Hobonil path model had a low fit (χ2 = 10.75, df = 5, P = 0.034), with a CFI of 0.68. The significant paths in the model were the effect of leaf size on the inflorescence production, the latter variable on immature infructescences and of these on mature infructescences. As in the Telchac and Dzemul populations, herbivory had no significant effect on leaf production, inflorescence production or mature infructescences (Fig. 3c). The multisampling analysis showed differences in magnitude and direction (+ or -) of the path coefficients between populations (Table 3). Telchac and Dzemul differed in almost all the causal paths, only the effect of inflorescences on immature infructescences was similar in both populations (Table 3). Telchac and Hobonil had a larger number of similar paths between them, particularly the herbivory and leaf size paths showed significant effect on new leaves and inflorescences. Dzemul and Hobonil had similar coefficients in the paths leaf size to mature infructescences, and immature infructescences to mature infructescences (Table 3). Discussion Knowledge of natural variation in the environmental matrix is an essential aspect in the study of ecology of interspecific interactions (Travis 1996, Thompson 1994). Our results suggest that herbivory, growth and reproduction in A. schlechtendalii respond to the environmental conditions present in each site, and that the relation that link these variables also depend on those local conditions. The results also show between population differences in detritus and leaf nutritional quality, as well as in herbivore abundance, such that the site with the least herbivory and reproductive success is also that with the least herbivore abundance, lowest detritus quality, and plant nutritional status (Telchac). 24 The cumulative observed herbivory pattern in the labeled leaves is a consequence of new leaf production timing and leaf development throughout the A. schlechtendalii growth season (May to June). Most of herbivory occurred when new leaves were developing, after which it few herbivory occurred. This consumption pattern is a generalized phenomenon in tropical ecosystems where herbivores synchronize their lifecycles to the periods of greatest food abundance (Smythe 1982, Young, 1982, Wolda 1988, Rico-Gray 1989). Even though this study was a short-term assessment, herbivory intensity at individual level included the accumulated damage from previous growth seasons, as A. schlechtendalii leaves may remain functional for up to two years (A. Canto unpubl. data.). Though the herbivory pattern was cumulative in the three populations, there were shown large differences in herbivory intensity between sites. This suggests a strong site effect that determines the quantity of herbivory in each population. Herbivory can vary according to the degree of resource limitation that plants faced (Price 1991, Karban 1992, Ritchie 2000, De Bruyn et al. 2002), and herbivore abundance (Thompson 1984, Ritchie & Olff 1999, Wolda 1988, Forkner & Hunter 2000). Site and plant quality estimations in this study are just punctual records taken at specific times, thus the results are only an initial approximation of the potential significance that variables explaining the patterns of herbivory, growth and reproduction in A. schlechtendalii. Nonetheless, the between-population differences found in environmental conditions are concordant with the historically reported for each site (INEGI 1981ab, Duch 1988, Flores & Espejel 1994). Therefore differences in leaf quality constitute a plausible explanation of the observed differences in A. schlechtendalii reproduction. Moreover, differences in herbivore abundance among sites may explain the spatial pattern of herbivory. Leaf nutritional quality is an important characteristic for determining herbivory intensity (Coley & Barone 1996). For example, plants at Telchac had the lowest leaf nutritional quality and the least amount of herbivory. In fact, the N content and C:N ratio of A. schlechtendalii leaves, which are plant nutritional status indicators (Jefferies 1999, Hughes & Bazzaz 2001, Awmack & Leather 2002), suggest that leaves at Telchac are not much nutritive, and thus could be less attractive to herbivores. Dzemul and Hobonil, in contrast, had greater leaf quality and higher herbivory intensities. Differences in herbivory abundance between the three sites highlight the importance of herbivore presence on damage intensity since sites with greater quantity of herbivores were also those with greater herbivory intensity. However, the relationship between A. schlechtendalii 25 herbivory intensity and herbivore abundances recorded in this study should be interpreted carefully due the temporal separation in estimation (different years). Nonetheless, A. schlechtendalii has generalist herbivores and the simultaneous and extensive between site comparisons of herbivores (e.g. orthopterans) can be used as an indicator of general herbivore presence (Báldi & Kisbenedek 1997). In addition with observed differences in herbivory intensity and herbivore abundance among populations, we observed differences in inflorescences production but not in leaf production. Two factors may explain the results, the plant environment and the trade-off between growth and reproduction. Environment has been reported as strong effect on plant reproductive output (e.g. Stephenson 1981, LaBarbera 1989, Mothershead & Marquis 2000). For example, though the Telchac population produced the largest quantity of inflorescences, it had the lowest detritus, leaf quality, and fruit set. In contrast, plants at Hobonil had higher levels of herbivory it had highest detritus, leaves quality and fruit set. On another hand, perennial plants under herbivory can maintain growth at expense of reproductive output (Canto et al. in press). This can be seen as a strategy to enhance future reproduction probabilities and individual fitness; since a higher current growth rate may result in a higher future reproduction (Obeso 1993; see Study species). Path analysis results reinforce this idea, since no negative effect of herbivory was observed on leaf production. In addition, populations with different herbivore intensity showed differences in reproduction but not in leaves production. Common garden experiments had showed that even high herbivory intensity A. schlechtendalii maintained its growth, but reproductive effort diminished immediately after foliar damage; however, in the following growth season achieved a high reproductive effort regardless herbivory (Canto et al. 2004). The negative effect of damage on plant fitness is a central idea in the ecology and evolution of the plant-herbivore interaction (Crawley 1983, Belsky 1986). The path analysis in this study, did not suggest a significant herbivory effect on A. schlechtendalii reproduction, despite between-population differences in damage intensity and being a constant element during the life of this species. This result could be explained by two ways: the local environmental matrix in which the interaction occurs (Travis 1996); and the strategy of herbivory tolerance (Rosenthal & Kotanen 1994, Strauss & Agrawal 1999). The environmental matrix can impose conditions that mask the effect of herbivory, and it is a selective force capable of molding species performance and fitness through responses to herbivory (Hoffman & Hercus 2000, Givnish 2002). In this way, the path analysis has strongly suggested that the effect of leaf size, which can 26 be seen as a reflection of the environment on herbivory and reproduction (Lambers et al. 1998), was significantly different between populations in both magnitude and sign. A long-term experiment is needed to separate the role of the environment and explore tolerance as an evolutionary strategy in A. schlechtendalii. Our study demonstrated the existence of variation in the pattern of between-population herbivory intensity in A. schlechtendalii, and that plant responses to herbivory can be hidden by variation in the local environmental matrix (Maschinski & Whitham 1989, Hawkes & Sullivan, 2001).This study emphasizes the importance of evaluating herbivory in a spatial and temporal scale to understand how this biological interaction can be maintained (Dunson & Travis 1991, Thompson 1994, Travis 1996). Acknowledgments We are grateful to L. Salinas, C. Suárez, J. Leirana their help in the field work. In addition, we thank to C. M. Herrera, V. Rico-Gray, S. Magaña, J. Lopez-Portillo for their useful comments to early drafts. We thank to A. Martínez Virúes for her help in the chemical analysis. This research was supported by the CONACYT (grant 333128 to V.P.T, and scholarship 118944 to A.C.); Sigma Xi (grant in 1999 to A.C.); and the Instituto de Ecología (902-17-144 to J.G.G.F.). This study is a partial fulfill of doctoral dissertation at the Ecología y Manejo de Recursos Naturales graduate program of the Instituto de Ecología, A.C. 27 References Agrawal, A. A. 1998. Induced responses to herbivory and increased plant performance. Science 279: 1201-1202. Aide, T. M. 1993. Patterns of leaf development and herbivory in a tropical understory community. Ecology 74: 455-166. Awmack, C. S. & S. R. Leather. 2002. Host plant quality and fecundity in herbivorous insects. Annual Review of Entomology 47: 817-844. Báldi, A. & T. Kisbenedek. 1997. Orthopteran assemblages as indicators of grassland naturalness in Hungary. Agriculture Ecosystems & Environment 66: 121-129. Belsky, A. J. 1986. Does herbivory benefit plants? A review of the evidence. American Naturalist 127: 870-892. Bentler, P. M. 1995. EQS structural equations program manual. Multivariate software, Inc., Encino, California. Bentler, P. M. & E. J. C. Wu. 1995. EQS for Windows user’s guide. Multivariate Sofware, Inc., Encino, California. Binkley, D. & P. Vitousek. 1989. Soil nutrient availability. Páginas 75-96 in R. W. Pearcy, J. Ehleringer, H. A. Mooney & P. W. Rundel, editores. Plant physiological ecology. Chapman and Hall, London. Bishop, J. G. & D. W. Schemske. 1998. Variation in flowering phenology and its consequences for lupines colonizing Mount St. Helen. Ecology 79: 534-546. Canto, A., V. Parra-Tabla & J. G. García-Franco. In press. Variations in leaf production and floral display of Anthurium schlechtendalii (Araceae) in response to herbivory and environment. Functional Ecology. Charnov, E. L. 1982. The theory of sex allocation. Princeton University Press, New Jersey. Cipollini, M. L. & D.F. Whigham. 1994. Sexual dimorphism and cost of reproduction in the dioecious shrub Lindera benzoin (Lauraceae). American Journal of Botany 81: 65-75. Coley, P. D. & J. A. Barone. 1996. Herbivory and plant defenses in tropical forest. Annual Review of Ecology and Systematics 27: 305-335. Coley, P. D., J. P. Bryant & F. S. Chapin. 1985. Resource availability and plant antiherbivore defence. Science 230: 895-899. Crawley, M. J. 1983. Herbivory. Blackwell Science Ltd, Oxford. 28 Croat, T. B. 1991. A revision of Anthurium section Pachyneurium (Araceae). Annals of the Missouri Botanical Garden 78: 539-855. De Bruyn, L., J. Scheirs & R. Verhagen. 2002. Nutrient stress, host plant quality and herbivore performance of a leaf-mining fly on grass. Oecologia 130: 594-599. Duch, J. G. 1988. La conformación territorial del estado de Yucatán. Universidad de Chapingo, Estado de México. Dunson, W. A. & J. Travis. 1991. The role of abiotic factors in community organization. American Naturalist 138: 1067-1091. Farnsworth, E. J. & A. M. Ellison. 1993. Dynamics of herbivory in Belizean mangrove. Journal of Tropical Ecology 9: 435-453. Flores, S. J. & C. I. Espejel. 1994. Tipos de vegetación de la Península de Yucatán. Universidad Autónoma de Yucatán, Mérida. Forkner, R. E. & M. D. Hunter. 2000. What goes up must come down? Nutrient addition and predation pressure on oak herbivores. Ecology 81: 1588-1600. Freeman, D. C., K. T. Harper & E. L. Charnov. 1980. Sex change in plants: old and new observations and new hypotheses. Oecologia 47: 222-232. Givnish, T. J. 2002. Ecological constraints on the evolution of plasticity in plants. Evolutionary Ecology 16: 213-242. Hawkes, C. V. & J. J. Sullivan. 2001. The impact of herbivory on plants in different resource conditions: a meta–analysis. Ecology 82: 2045-2058. Hoffman, A.A. & M. J. Hercus. 2000. Environmental stress as an evolutionary force. Bioscience 50: 217-226. Hughes, L. & F. A. Bazzaz. 2001. Effects of elevated CO2 on five plant-aphid interactions. Entomologia Experimentalis et Applicata 99: 87-96 INEGI. 1981a. Carta de precipitación total anual: Península de Yucatán. Secretaría de Programación y Presupuesto, México, D.F. INEGI. 1981b. Carta de temperaturas medias anuales: Península de Yucatán. Secretaría de Programación y Presupuesto, México, D.F. Jefferies, R. L. 1999. Herbivores, nutrients and trophic cascades in terrestial environments. Páginas 301-330 in H. Olff, V. K. Brown & R. H. Drent, editors. Herbivores: between plants and predators. Blackwell Science Ltd, Oxford. 29 Juenger, T. & J. Bergelson. 2000. Does early season browsing influence the effect of self– pollination in Scarlet gilia? Ecology 81: 41-48. Kaitaniemi, P., S. Neuvonen & T. Nyyssönen. 1999. Effects of cumulative defoliations on growth, reproduction, and insect resistance in mountain birch. Ecology 80: 524-532. Karban, R., 1992. Plant variation: its effects on populations of herbivorous insects. Pages 195215 in R. S. Fritz & E. L. Simms, editors. Plant resistance to herbivores and pathogens: ecology, evolution, and genetics. University of Chicago Press, Chicago. Kingsolver, J. G. & D. W. Schemske. 1991. Path analyses of selection. Trends in Ecology and Evolution 6: 276-280. Kursar, T. A. & P. D. Coley. 1991. Nitrogen content and expansion rate of young leaves of rain forest species: implications for herbivory. Biotropica 23: 141-150. LaBarbera, M. 1989. Analyzing body size as a factor in ecology and evolution. Annual Review of Ecology and Systematics 20: 97-117. Lambers, H., F. S. Chapin & T. L. Pons. 1998. Plant physiological ecology. Springer, New York. Marquis, R. J., 1992. Selective impact of herbivores. Pages 301-325 in R. S. Fritz & E. L. Simms, editors. Plant resistance to herbivores and pathogens: ecology, evolution, and genetics. University of Chicago Press, Chicago. Maschinski, J. & T. Whitham. 1989. The continuum of plant responses to herbivory: The influence of plant association, nutrient availability, and timing. American Naturalist. 134: 1-19. Mayo, S. J., J. Bogner & P. C. Boyce. 1997. The genera of Araceae. Kew Royal Botanic Gardens, Kew, UK. Mendoza, A., D. Piñero & J. Sarukhán. 1987. Effects of experimental defoliation on growth, reproduction and survival of Astrocarum mexicanum. Journal of Ecology 75: 545-554. Meyer, G. A. 2000. Interactive effects of soil fertility and herbivory on Brassica nigra. Oikos 88: 433-441. Meyer, G. A., & R. B. Root. 1993. Effects of herbivorous insects and soil fertility on reproduction of goldenrod. Ecology 74: 117-1128. Mothershead, K. & R. J. Marquis. 2000. Fitness impacts of herbivory through indirect effects on plant–pollinator interactions in Oenothera macrocarpa. Ecology 81: 30-40. Obeso, J. R. 1993. Does defoliation affect reproductive output in herbaceous perennials and woody plants in different ways? Functional Ecology 7: 150-155. 30 Petraitis, P. S., A. E. Dunham & P. H. Niewiarowski. 1996. Inferring multiple causality: the limitations of path analysis. Functional Ecology 10: 421-431. Price, P. 1991. The plant vigor hypothesis and herbivore attack. Oikos 62: 244-251. Rico-Gray, V. 1989. The importance of floral and circum-floral nectar to ants inhabiting dry tropical lowlands. Biological Journal of the Linnean Society 38: 173-181. Ritchie, M. E. 2000. Nitrogen limitation and trophic vs. abiotic influences on insect herbivorous in a temperate grassland. Ecology 81: 1601-1612. Ritchie, M. E. & Olff, H. 1999. Herbivore diversity and plant dynamics: compensatory and additive effects. Pages 175-204 in H. Olff, V. K. Brown & R. H. Drent, editors. Herbivores: between plants and predators. Blackwell Science Ltd, Oxford. Rosenthal, J. P. & P. M. Kotanen. 1994. Terrestrial plant tolerance to herbivory. Trends in Ecology and Evolution 9: 145-148. Scheiner, S. M. & J. Gurevitch. 1993. Design and analysis of ecological experiments. Chapman & Hall, New York. Schemske, D. W. & C. Horvitz. 1988. Plant–animal interactions and fruit production in a neotropical herb: a path analysis. Ecology 69: 1128-1137. Simms, E. L. 1992. Cost of plant resistance to herbivory. Pages 392-425 in R. Fritz & E. L. Simms, editors. Plant resistance to herbivores and pathogens: ecology, evolution, and genetics. University of Chicago Press, Chicago. Simons, A. M. & M. O. Johnston. 1999. The cost of compensation. American Naturalist 153: 683-687. Smythe, N. 1982. The seasonal abundance of night-flying insects in a Neotropical forest. Pages 309-318 in E. G. Leigh, A. S. Rand & D. M. Winsor, editors. The ecology of a tropical forest: seasonal rhythms and long-term changes. Smithsonian Institution Press, Washington, D. C. Sokal, R. R. & F. J. Rohlf. 1995. Biometry. W. H. Freeman and Company, New York Southwood, T. R. E. & P. A. Henderson. 2000. Ecological Methods. Blackwell Science Ltd, Oxford. Stanton, M. L. 1983. Spatial patterns in the plant community and their effects upon insect search. Pages 125-157 in S. Ahmad, editors. Insect herbivorous. Academic Press, London. Stephenson, A. G. 1981. Flower and fruit abortion: proximate causes and ultimate functions. Annual Review of Ecology and Systematic 12: 253-279. 31 Strauss, S. Y. & A. A Agrawal. 1999. The ecology and evolution of plant tolerance to herbivory. Trends in Ecology and Evolution 14: 179-185. SYSTAT 6.0. 1996. Statistics II. SPSS, Inc, Chicago, Illinois. Thompson, J. N., 1984. Insect diversity and the trophic structure of communities. Pages 591-605 in C. B. Huffaker & R. L. Rabb, editors. Ecological Entomology. John Wiley & Sons, New York. Thompson, J. N. 1994. The coevolutionary process. University of Chicago Press, Chicago. Travis, J. 1996. The significance of geographical variation in species interactions. American Naturalist 148: 51-58. Whitham, T. G., J. Maschinski, K. C. Larson & K. N. Paige. 1991. Plant responses to herbivory: the continuum from negative to positive and underlying physiological mechanisms. Pages 227-256 in P. W. Price, T. M. Lewinsohn, G. W. Fernandes & W. W. Benson, editors. Plant-animal interactions: evolutionary ecology in tropical and temperate regions. John Wiley and Sons, New York. Wolda, H. 1988. Insect seasonality: why? Annual Review of Ecology and Evolution 19: 1-8. Wootton, J. T. 1994. Predicting direct and indirect effects: an integrated approach using experiments and path analysis. Ecology 75: 151-165. Young, A. M. 1982. Population biology of tropical insects. Plenum Press, New York. Zar, J. H. 1984. Biostatical Analysis. Prentice-Hall, New Jersey. 32 Appendix. Covariance matrices performed for the three A. schlechtendalii populations used in the path analysis. Sample sizes (number of plants) are shown in parenthesis beside the population name; * P < 0.05. Telchac (24) (A) (B) (C) (D) (E) (F) Herbivory (A) 1 Leaf size (B) 0.46* 1 New leaves (C) 0.06 Inflorescences (D) 0.48* 0.74* 0.07 1 Immature infructescences (E) 0.38 0.5* 0.01 0.65* 1 Mature infructescences (F) 0.13 0.33 -0.26 0.56 0.3 1 0.49* 1 Dzemul (25) Herbivory (A) 1 Leaf size (B) -0.37 1 New leaves (C) 0.33 -0.15 1 Inflorescences (D) 0.03 0.56* -0.15 1 Immature infructescences (E) 0.26 0.32 Mature infructescences (F) 0.18 0.39* -0.19 0.67* 0.73* 1 -0.19 0.55* 1 Hobonil (24) Herbivory (A) 1 Leaf size (B) 0.17 1 New leaves (C) 0.12 -0.15 1 Inflorescences (D) -0.01 0.48* -0.02 1 Immature infructescences (E) 0.11 0.42 -0.14 0.55* 1 Mature infructescences (F) 0.04 0.15 -0.10 0.66* 0.55* 1 33 Table 1. Chemical characteristics of the A. schlechtendalii substrate (detritus). Means ± SE for each population are shown. The univariate F value from MANOVA (Wilks’ Lambda = 0.029, F = 21.32, P < 0.0001) analysis are shown for each characteristics. Different letters in each row indicate significant differences (P < 0.05, Bonferroni adjustment) between populations. Detritus variable Telchac Dzemul Hobonil F P-value Water content (%) 10.17 ± 0.96a 12.24 ± 4.34a 40.87 ± 2.59b 33.29 < 0.0001 Nitrogen (%) 2.19 ± 0.47 3.04 ± 0.48 1.98 ± 0.09 2.08 0.137 Potassium (meq/100g) 1.51 ± 0.21a 3.88 ± 0.38b 2.36 ± 0.32a 14.78 < 0.0001 Phosphorus (µg/g) 5.33 ± 0.29a 24.89 ± 2.57b 19.46 ± 2.89b 20.29 < 0.0001 Sodium (meq/100g) 1.91 ± 0.34 1.61 ± 0.26 1.15 ± 0.10 2.32 0.111 Calcium (meq/100g) 46 ± 1.73a 43.22 ± 2.23a 67.63 ± 2.61b 34.92 < 0.0001 Magnesium (meq/100g) 14.74 ± 1.15 16.27 ± 0.95 15.73 ± 1.65 0.37 0.696 35.59 < 0.0001 pH 7.49 ± 0.10a 6.32 ± 0.12b 6.82 ± 0.06c 34 Table 2. Growth and reproduction characteristics (Mean ± SE) of the three A. schlechtendalii populations studied. Different letters indicate on rows significant differences between averages (P < 0.05, polinomial contrast). Plant variable Telchac Dzemul Hobonil F P-value r2 New leaves 4.9 ± 0.2 4.9 ± 0.4 5.7 ± 0.5 1.34 0.26 0.04 Inflorescences 4.8 ± 0.5a 2.3 ± 0.4b 2.5 ± 0.4b 21.90* <0.0001 0.42 Immature infructescences 1.1 ± 0.2a 0.8 ± 0.1b 0.8 ± 0.2b 4.41* 0.016 0.20 Mature infructescences 1 ± 0.2 a 0.6 ± 0.1b 0.6 ± 0.2b 6.09* 0.004 0.24 Fruit set 0.43 ± 0.08a 0.49 ± 0.14ab 0.79 ± 0.07b 3.55 0.044 0.22 * P < 0.0001 significance level for the covariance analysis with leaf size as covariable. 35 Table 3. Multisample comparison of path coefficient between populations using Lagrange Multiplier Test. Asterisks (*) indicate the significant (P < 0.05) chi-square values (χ2), showing the paths contributing to the differences among populations. χ2 comparison Path Independent variable Dependent variable Herbivory New leaves Herbivory Telchac vs. Dzemul Telchac vs. Hobonil Dzemul vs.Hobonil 3.23* 0.24 31.55* Inflorescences 11.76* 1.73 6.41* Herbivory Mature infructescences 33.19* 3.34* 8.17* Leaf area New leaves 22.93* 0.99 20.46* Leaf area Inflorescences 16.69* 0.25 28.53* Leaf area Mature infructescences 12.04* 12.65* 0.01 Leaf area Herbivory 3.91* 3.08* 3.26* New leaves Inflorescences 6.23* 14.63* 8.92* Inflorescences Inmature infructescences 1.07 4.59* 6.68* Inmature infructescences Mature infructescences 2.74* 7.01* 0.02 36 Abundance (n / 20 m2) 3 2.5 2 Orthoptera (LC) Homoptera (SF) Hemiptera (SF) Larvae (LC) 1.5 1 0.5 0 Telchac Dzemul Hobonil Figure 1. Abundance of herbivores of A. schlechtendalii in the study sites. Means ± SE are shown for each herbivore taxa and functional guild. (LC) = leaf chewers; (SF) = sap feeders. 37 Leaf size (cm2) 1000 Rainy season (a) 800 600 400 200 0 Sep-99 Nov-99 Jan-00 Mar-00 May-00 Jul-00 Sep-00 Mar-00 May-00 Jul-00 Sep-00 Mar-00 May-00 Jul-00 Sep-00 0.35 Herbivory (cm2 leaf area eaten/cm2 total) 0.3 (b) 0.25 0.2 0.15 0.1 0.05 0 Sep-99 Nov-99 Jan-00 0.1 (c) 0.08 0.06 0.04 0.02 0 Sep-99 Nov-99 Jan-00 Sampled months Figure 2. Leaf size changes (a) during an annual cycle of A. schlechtendalii and temporal herbivory pattern at: (b) individual plant level, (c) labeled leaves. Means ± SE for each population are shown. Telchac: Gray circles, Dzemul: Blank circles, and Hobonil: full circles. 38 (a) Leaf size 0.15 0.34 0.45* New leaves -0.1 0.71* -0.14 0.76 E Inflorescences 0.95 E 0.65* 0.86 E 0.46* Immature Mature infructescences infructescences 0.64 E 0.16 Herbivory 0.11 0.88 E (b) Leaf size 0.2 0.03 -0.37* New leaves 0.32 0.66* -0.16 Inflorescences 0.94 E 0.84 E 0.55* 0.66 E Mature Immature 0.66* infructescences infructescences 0.78 E 0.32 Herbivory 0.01 0.93 E (c) Leaf size -0.1 0.18 0.18 New leaves 0.15 0.51* 0.07 Inflorescences 0.97 E 0.83 E 0.98 E Immature 0.59* Mature infructescences infructescences 0.55* 0.87 E -0.11 Herbivory -0.01 0.98 E Figure 3. Path analysis result for each A. schlechtendalii population studied: (a) Telchac, (b) Dzemul, and (c) Hobonil population. Asterisk indicates a significant path (P < 0.05). The minus sign (-) on the path coefficients indicates a negative causal relation between variables. The numbers before the E´s show the residual variance for each dependant variable. 39 Capítulo III. Variations in leaf production and floral display of Anthurium schlechtendalii (Araceae) in response to herbivory and environment Azucena Canto Departamento de Ecología Vegetal, Instituto de Ecología, A.C. Apdo. Postal 63, Xalapa, Veracruz 91000, México. Víctor Parra-Tabla Departamento de Ecología, Campus de Ciencias Biológicas y Agropecuarias, Universidad Autónoma de Yucatán. Apdo. Postal 4-116 (Itzimná), Mérida, Yucatán 97100, México. José G. García-Franco Departamento de Ecología Vegetal, Instituto de Ecología, A.C. Apdo. Postal 63, Xalapa, Veracruz 91000, México. Artículo aceptado en la revista Functional Ecology 2004 40 Summary 1. The study of the impact of herbivory on plant fitness and its relationship with environmental conditions is essential to understand the ecological and evolutionary routes in different populations of the same plant species. This paper addresses the effects of herbivory and environment on growth (leaf production) and floral display (inflorescence production) in the tropical aroid Anthurium schlechtendalii. 2. Defoliation experiments were conducted in three natural A. schlechtendalii populations in Mexico: coastal sand dunes (Telchac), thorny dry forest (Dzemul), and medium–height subhumid forest (Hobonil). Experiments were also conducted in common–garden conditions, using plants transplanted from the three populations. 3. Logistic regression models showed that herbivory did not negatively affect growth, but did affect floral display in A. schlechtendalii. The effect on floral display differed as a function of environment, damage intensity, and season. When the plants experienced no resource limitation (common garden), herbivory inhibited inflorescence production in the first season (2001) and at the highest damage level (75%). When the plants experienced heterogeneous resources conditions (field experiment), inflorescence production was inhibited in the second season (2002) at intermediate damage intensities. 4. Overall, A. schlechtendalii plants maintained growth regardless of damage intensity, but inflorescence production was reduced, indicating a trade–off between growth and floral display due to herbivory. Results also suggested that plants were constrained in their response by the environmental history of their native site. Key words: binary logistic regression, common garden experiment, heterogeneous environments, Mexico, trade-off, tropical perennial plant. 41 Introduction Herbivory can affect plant fitness by modifying growth, reproduction, and maintenance themselves (Crawley 1983; Rosenthal & Kotanen 1994). Herbivory is generally assumed to have negative effects on plants (Belsky 1986), but some studies report fitness benefits for herbivorytolerant plants (e.g. Paige & Whitham 1987; Paige 1999). Indeed, effects of herbivory on fitness can be considered as a continuum from negative to positive (Belsky 1986; Lewin 1987; Paige & Whitham 1987; Whitham et al. 1991). The effect depends on the environment in which a plant grows (Coley, Bryant & Chapin 1985; Chapin 1991), and factors such as damage intensity (Whigham & Chapa 1999) and on the duration of herbivory events (Whitham & Mopper 1985; Obeso & Grubb 1994; Juenger & Bergelson 2000; García & Ehrlen 2002). The interaction of physical and biotic variables where a species is immersed (environmental matrix) may define the plant reproduction, growth and maintenance (Hoffmann & Merilä 1999; Hoffmann & Hercus 2000). The environment can modify plant responses to herbivory mediated by climatic conditions and available resources (recently acquired or stored), which can minimise aid in overcoming the effect of leaf area reduction (Ritchie 2000). The hypothesis of a continuum of plant responses (Maschinski & Whitham 1989) proposes that plants growing in resource-rich sites can completely compensate (i.e. plants with herbivory show similar fitness than plants without herbivory; Strauss & Agrawal 1999), and even overcompensate, for herbivory with less effort than plants in resource-poor environments. Supporting evidence comes from certain groups such as the monocots, but not for several herbaceous and woody dicots species (Hawkes & Sullivan 2001) which may require alternative hypotheses. One such alternative, the growth rate hypothesis (Hilbert et al. 1981), states that plants growing in resource-poor environments, and thus growing below their maximum rate, can better compensate for herbivory at low damage intensities than plants growing in resource-rich environments with growth rates close to their maximum. Even so, plant fitness will be reduced by high intensities of damage in both resource–rich and resource–poor environments (Hilbert et al. 1981; McNaughton 1983). This study evaluated experimentally the effect of herbivory on the perennial herb Anthurium schlechtendalii (Araceae) in common garden and field conditions. Herbivory is a common, constant and intense factor in all A. schlechtendalii populations so that a significant 42 herbivory effect on reproduction and growth can be hypothesized. The following questions were addressed: (1) What is the effect of herbivory on leaf and inflorescence production?; (2) How do herbivory effects vary with respect to damage intensity and the plant environment?; (3) How do these effects differ between leaf production and reproduction seasons? Materials and methods Study Species Anthurium schlechtendalii subsp. schlechtendalii Kunth (Araceae) is a tropical perennial herb distributed along the Atlantic slope of Mesoamerica from the central portion of the state of Veracruz, Mexico to Nicaragua (Croat 1991). On the Yucatan Peninsula (Mexico) this plant grows on calcareous soils in environments ranging from water- and nutrient-poor coastal shrub to organically rich, subhumid forests (A. Canto, pers. obs.). A. schlechtendalii (Fig. 1) produces only a few, but conspicuous (mean area per leaf 519 ± SE 17.5 cm2), leaves per season. Functional leaf life span can be as long as two years, meaning they can serve as nutrient storage organs to support leaf production and reproduction (Chabot & Hicks 1982). Each leaf is associated, at some time, with an inflorescence as the leaf contains a primordium for inflorescence development (Croat 1991; Fig. 1). The stem is usually short with internodes and leaf scars hidden by a dense mass of thick, greenish roots called nest roots (Croat 1991). This root structure and the abbreviated stem produce a “basket shape” in which leaves, twigs and other detritus gather (Mayo, Bogner & Boyce 1997; Fig. 1). This plant is protogynous, and has a solitary inflorescence bearing numerous small (ca. 1 mm), hermaphroditic flowers (A. Canto, pers. obs.). These are arranged in a compact spiral form called a spadix, which serves as the reproductive unit in this plant family (Croat 1991; Méndez 2001; Fig. 1). Inflorescence and leaf development start annually at the beginning of the rainy season (May to June), with very few inflorescences (2 to 4) and leaves (4 to 5) being produced per plant per season (Canto 2004). Herbivory in this plant is primarily foliar, and most of the damage is caused by externally feeding grasshoppers (Acrididae) and caterpillars (Noctuidae), both of which can consume substantial amounts of the leaf area (> 50 % of many leaves can be consumed; Canto 2004). 43 Study area The study was carried out in three A. schlechtendalii populations located in the three main regional ecosystems of the state of Yucatan, Mexico. Field experiments were established in each population and plants were extracted from each for common garden experiments. The first population is Telchac, at an elevation of 2 m a.s.l., on the coastal barrier dune in northern Yucatan (21º19’50’’N; 89º21’58’’W). Its environment is semi-arid with thorn-scrub vegetation growing on a dry, sandy substrate with limited mineral nutrients (Duch 1988). Principal plant species at this site include Metopium brownei, Coccoloba uvifera, Cocothrinax readii, Agave sisalana, and Caesalpinia versicaria (Flores & Espejel 1994). Maximum temperatures during the study period were 40.5 ºC (2000) and 40.0 ºC (2001), and annual rainfall was 374 mm (2000) and 583.6 mm (2001; National Water Commission of Mexico – CNA). The second population, Dzemul, is located 15 km south of the Telchac population, at 7 m a.s.l. in the dry forest margin (21º16’37’’N; 89º19’09’’W). The vegetation consists of a low, thorny forest growing on limestone bedrock soils with abundant leaf-fall accumulation (Duch 1988). The main vegetation at this site includes species such as Lysiloma latisiliquum, Mimosa bahamensis, Piscidia piscipula, Bursera simaruba, and Cnidoscolus aconitifolius (Flores & Espejel 1994). Maximum temperatures during the study were 41ºC (2000), and 41ºC (2001). Annual rainfall during the study was 942.3 mm (2000) and 1223 mm (2001; CNA). The third population, Hobonil, is located 150 km south of Dzemul at 36 m a.s.l. in the subhumid forest (20º00’27’’N, 89º01’36’’W). Principal vegetation species in the area include Vitex gaumerii, Enterolobium cyclocarpum, Guazuma ulmifolia, Aphelandra deppeana, and Hamelia patens (Flores & Espejel 1994). Maximum temperatures during the study were 39.5ºC (2000) and 41ºC (2001). Annual rainfall during the study period was 1220.5 mm (2000) and 1347.8 mm (2001; CNA). All three sites had significant differences in the physical characteristics of the detritus that accumulates among the roots of A. schlechtendalii (Wilks’ Lambda = 0.029, F = 21.32, P < 0.0001; Canto 2004). The detritus in the Telchac population had particularly low phosphorous (5.3 ± 0.29 µg g-1) and potassium (1.5 ± 0.21 meq 100g-1) contents in comparison to the Dzemul and Hobonil populations (mean ± SE for all reported parameters). Dzemul and Hobonil had similar phosphorous (24.9 ± 2.57 µg-1g at Dzemul and 19.5 ± 2.89 µg g-1 at Hobonil) and potassium (3.9 ± 0.38 meq 100g-1 at Dzemul and 2.4 ± 0.32 meq 100g-1 at Hobonil) contents. The 44 moisture content of detritus at these two sites, however, was very different, the highest being at Hobonil (40.8 ± 2.59 %). This parameter was similar at the Telchac (10.2 ± 0.96 %) and Dzemul (12.2 ± 4.34 %) sites. Growth rates (i.e. leaf production as a percentage) recorded for A. schlechtendalii before the study (1999-2000) showed significant differences between populations (F = 11.47, P < 0.0001). The plants at Telchac (32.6 ± 2.29 %) and Dzemul (31.1 ± 3.76 %) grew more slowly than those at Hobonil (52.7 ± 4.31 %; Canto 2004). Common garden experiments In 2000, twenty reproductive A. schlechtendalii plants of similar size were removed from each wild population (i.e. Telchac, Dzemul, and Hobonil), transferred to a nursery and kept under homogeneous irrigation, light and substrate conditions. The individual specimens were planted in 5-liter containers with a detritus-rich substrate (ca. 70% compost and 30% gravel), placed in 80% shade and watered to saturation three times a week. Plants in the common garden were isolated from herbivores for one year to even out the nutritional status of plants and their short-term herbivory history before the experiment began. Plants were assumed to be growing under uniform resource conditions. In January 2001, four months before leaf production and reproduction began, 16 plants from each site were randomly chosen and assigned to one of four herbivory treatments: 0%, 25%, 50% and 75% leaf damage. Leaf damage at the four levels was accomplished by cutting each leaf of each plant to the assigned treatment level, using patterns of damage observed in natural contexts. Defoliation was conducted progressing from the leaf tip towards the leaf base, without damaging the leaf rachis. This procedure was repeated in 2002 to control for the same treatment. The rhythm and constancy of the cuts approximated as nearly as possible the way natural herbivory occurs in all A. schlechtendalii populations (Canto 2004). Leaf and inflorescence production were recorded during each season. The inflorescence was used as the basic unit of floral display because variation in the number of flowers per inflorescence between individuals was small (mean 685 ± SE 18 flowers, C.V. = 0.36). Pollination of a single inflorescence ensures the formation of most seeds in each plant (A. Canto, unpublished data). Growth and floral display were codified as binomial response variables due to their low rates (see Study species). Growth was recorded as zero (0) if, at the end of each season, the plant produced one or no leaves, and as one (1) if it produced more than one leaf. Floral 45 display was recorded as 0 if the plant produced no inflorescences, and as 1 if it developed at least one. Field experiments In January 2001, in situ herbivory experiments were begun at Telchac, Dzemul and Hobonil. Ten groups of 10 to 15 individual A. schlechtendalii individual plants were chosen at each site and three plants randomly chosen within each group. One of three herbivory treatments (50%, 75% or natural herbivory control) was randomly assigned to each one of the selected plants. Defoliation was begun four months before the leaf production season in 2001 and repeated every time one of the plants produced a new leaf. This procedure allowed us to ensure that the responses observed in the plants were mainly a reflection of the herbivory treatments (Whitham et al. 1991) and to avoid as much as possible the influence of initial natural herbivory on the plant. For the 50% and 75% treatments, the natural herbivory received by the plant was augmented to attain the indicated herbivory percentage. Damage received by plants in the natural herbivory control was recorded. This control was considered that of the least damage as long as its damage did not exceed 25%, which was the lowest recorded in A. schlechtendalii populations. The 50% and 75% damage treatments were chosen because they represent intermediate and extreme herbivory levels for this species (Canto 2004). Monthly visits were made to each site during 2001 and 2002 to record leaf and inflorescence production. As in the common garden experiment, these variables were recorded as binomial variables. Data analysis Experimental data from both the common garden and field experiments was analyzed using logistic regression models in the SYSTAT version 10 statistics computer program (Steinberg & Colla 2000). Logistic analysis allows evaluation of the effect of herbivory on probability of leaf and inflorescence production in A. schlechtendalii. Analysis of the common garden experiment included the herbivory treatments, plant source site (Telchac, Dzemul, or Hobonil), and number of leaves per plant at the beginning of the season (initial number of leaves). These were included in the analysis as factors determining the odds ratios of leaf and inflorescence production. The odds value is the ratio between the probability that an event occurs and the probability that it does not occur. In this case it represents the probability of producing a leaf or inflorescence or not 46 producing it (Sincich 1993). Odds ratios can change as a function of explanatory factors such that if a variable has a negative effect on the odds ratio, this will be <1. Reference parameters are needed to compare between factors to calculate the odds ratio and statistical probability associated with each explanatory factor (Sincich 1993). In the common garden experiment the reference parameters were the herbivory treatment with the highest damage (75%) and the plants from the source site richest in resources (Hobonil, see study area). The regression coefficients (β) were also calculated. These represent the rate of change in odds ratio logarithms with respect to changes in the explanatory factors (Sincich 1993). They show the effect (+ or -) on the response and allow, using a Students t-test, calculation of the statistical probability of the effects on the odds ratios. Finally, a logistic regression analysis was done to compare possible differences in leaf production and reproduction between seasons in both the common garden and field experiments. Results Common garden The logistic regression analysis for both seasons (2001 and 2002) showed that herbivory treatments and source sites had no significant effect on the leaf production odds ratio in A. schlechtendalii (P > 0.05; Fig. 2, Table 1). Inflorescence production, in contrast, was significantly affected by herbivory and source site in the first season (Fig. 2, Table 1). Plants from Telchac and Dzemul had inflorescence production odds ratios less than one, even though the odds ratio for Dzemul were marginally not significant (Fig. 2, Table 1). In this same season (2001) plants in the 0%, 25% and 50% herbivory treatments had inflorescence production odds ratios significantly higher than plants in the 75% treatment (Fig. 2, Table 1). In particular, plants in the 25% treatment had considerably higher inflorescence production odds ratio than the 0% and 50% treatments (Table 1). In the second season (2002) the inflorescence production odds ratios were similar between herbivory treatments (P > 0.05; Fig. 2, Table 1) and source sites (P > 0.05; Fig. 2, Table 1). The number of leaves on a plant at the beginning of a season had a positive effect on inflorescence production in A. schlechtendalii in both seasons (Table 1). In 2001, the inflorescence production odds ratios doubled, and in 2002 a ten-fold increase was observed, although changes were only marginally significant in the latter season (Table 1). The leaf 47 production odds ratios were similar between seasons (P > 0.05; Table 2), whereas the inflorescence production odds ratios showed a fifty-fold increase between 2001 and 2002 (Table 2). This analysis consistently showed that the initial number of leaves significantly influenced inflorescence production in both seasons (Table 2). Field experiment The logistic regression results showed that leaf production odds ratios in A. schlechtendalii were site dependent (Fig. 3, Table 3). Thus, in the first season (2001) the Dzemul plants had odds ratios <1 (Fig. 3, Table 3) and the leaf production odds ratios at Telchac were indistinct from those at Hobonil (P > 0.05; Fig. 3, Table 3). In the second season (2002), however, the Dzemul plants had a leaf production odds ratio four times greater than the Hobonil plants (Fig. 3, Table 3), while the Telchac plants had an odds ratio similar to those at Hobonil (P > 0.05; Fig. 3, Table 3). Herbivory had no significant effect on leaf production odds ratios in either season (P > 0.05; Fig. 3, Table 3). Inflorescence production odds ratios differed between sites in the two seasons (Fig. 3, Table 3). In 2001, the Telchac plants had an odds ratio 12 times greater than that for Hobonil, and the Dzemul plants had an odds ratio 6 times higher than at Hobonil (Fig. 3, Table 3). In 2002, the Telchac plants’ odds ratio continued at higher levels than those from Hobonil (Fig. 3, Table 3), but the Dzemul plants had an odds ratio similar to the Hobonil plants (P > 0.05; Fig. 3, Table 3). Herbivory had no effect on inflorescence production during 2001 (P > 0.05; Fig. 3, Table 3). In 2002, however, the plants in the natural herbivory treatment had odds ratios almost 7 times higher than plants in the 75% treatment (Fig. 3, Table 3). On average, the herbivory received by plants in the natural herbivory treatment was 9.11 ± 1.58 % damage (mean ± SE) for all three sites during both seasons (2001 and 2002). The plants in the 50% herbivory treatment had inflorescence production odds ratios similar to those in the 75% treatment (P > 0.05; Fig. 3, Table 3). The initial number of leaves was not significant in 2001 but increased the leaf production odds ratio almost 1.5 times in all plants in 2002 (Table 3). Also, the initial number of leaves approximately doubled the inflorescence production odds ratios in 2002 (Fig. 3, Table 3). As in the common garden, leaf production in the field experiment had similar odds ratios between seasons (P > 0.05; Table 2). In the second season, however, inflorescence production odds ratios 48 were almost twice as high as in the first season, though these were only marginally significant (Table 2). At this level of analysis, the initial number of leaves had a noticeable effect on leaf and inflorescence production, increasing their odds ratios approximately 1.5 (Table 2). Discussion Our results indicate that herbivory did not reduce growth, but did affect floral display in A. schlechtendalii. The effect on floral display depended on function of environment, damage intensity, and season. When the plants experienced no resource limitation, as in the common garden, herbivory inhibited floral display only in the first season (2001) and only at the highest damage level (75%). In the field with natural resource availabilities, floral display was inhibited in the second season (2002) at intermediate damage intensities. One of the most common responses of herbaceous plants to herbivory is to increase growth as a consequence of post-damage compensation (Crawley 1983; McNaughton 1983; Rosenthal & Kotanen 1994). Studies of Ipomopsis aggregata (Paige & Whitham 1987; Paige 1999), Gentianella campestris (Lennartsson, Nilsson & Tuomi 1998), Achillea millefolium, Festuca altaica and Mertensia paniculata (Hicks & Turkington 2000) report growth responses that mitigate, and even decrease, the herbivory effect on fitness. Like A. schlechtendalii, these species are herbaceous and perennial, and experience substantial herbivory episodes throughout their life. Plants with these characteristics can allocate large quantities of resources to vegetative functions and maintain or even increase fitness under herbivory (McNaughton & Chapin 1985). The data in the present study suggest that A. schlechtendalii responds in the same way. Growth remained constant, even at high damage levels, and particularly in the common garden, a benefit was observed in floral display at a moderate (25%) herbivory level. This was a short-term benefit, however, as it was only recorded during the first year of the experiment. A more meaningful result was the negative effect on floral display at high damage level in both the common garden and the field. Growth in response to simulated (and natural) herbivory in the common garden and field experiments suggests a considerable capacity in A. schlechtendalii for maintenance of leaf production even at high levels of herbivory. However, changes in leaf quality (e.g. nutritive quality, Neuvonen & Haukioja 1984; size, Ruohomäki et al. 1997; leaf expansion, Moore et al. 49 2003) probably occurred. These should be evaluated to determine the cost of maintaining growth after herbivory. High resource allocation to vegetative functions (and possibly to defences induced; see below) to recovering from herbivory has a reproductive cost that varies with species (Hendrix 1988; Obeso 1993, 2002). While plants such as Astrocaryum mexicanum (Mendoza, Piñero & Sarukhán 1987) and Lupinus chamissonis (Warner & Cushman 2002) exhibit significant reductions in reproduction after herbivory, others like Ipomopsis aggegata (Paige & Whitham 1987; Paige 1999), Pancratium sickenbergari (Ruiz, Ward & Saltz 2002) and Helianthus annuus (Pilson & Decker 2002) have sufficient resources to attain successful reproduction despite an increase in growth. Results in the present study suggest a possible reproductive cost consequent to increased growth in A. schlechtendalii, at least in terms of reproductive structures. For example, growth in the 75% herbivory treatment in 2001 in the common garden remained unaffected, while floral display was limited. The same phenomenon occurred in the field in 2002, beginning with the 50% herbivory treatment. Thus, a short-term compromise apparently occurred in floral display to maintain growth. The consequence of this trade off may represent a long-term negative impact on fitness since each emergent leaf is closely associated with an inflorescence in the following season. Given the importance of a leaf as structural and physiological support for the reproductive tissues (Haukioja 1991; Ruohomäki et al. 1997; Honkanen & Haukioja. 1998), current damage is probably reflected in inflorescence quality in the following generation and, over the long-term, in fitness. One of the underlying mechanisms of herbivory not addressed here is the cost of defences induced (sensu Karban & Baldwin 1997) unleashed in response to the damage. For example, greater secondary metabolite production after herbivory is common in perennial plants (Karban & Baldwin 1997). These responses have a cost (Simms 1992), which should be included in the final balance of the fitness benefits of plant responses (Agrawal Strauss & Stout 1999). Plant size may determine fitness, as it represents the resource budget from which the plant allocates to growth, reproduction, and survival (LaBarbera 1989). Large plants have a greater capacity for growth, reproduction and recovery from herbivory than smaller plants (Crawley 1983; Sibly 1997). The effect of the initial number of leaves in each season in A. schlechtendalii confirmed the importance of size in plant performance. The more leaves a plant had, the greater 50 its capacity for growth and floral display in both common garden and field conditions, in comparison to plants with fewer leaves. The response of A. schlechtendalii in both common garden and field experiments changed from one season to the next, suggesting an inertia in response as a consequence of the history of the plant-environment interaction. The environment in which a plant develops can modify its growth, reproductive output and fitness (Chapin 1991). The quantity of resources that a plant has for growth, reproduction and maintenance is particularly important in determining its response to herbivory (Meyer 2000). The field experiment supports this idea by suggesting that differences in growth and floral display between populations were due to differences in environmental conditions at each site. According to the Maschinski & Whitham (1989) hypothesis, if plants in resource-poor sites have a lower compensatory capacity than in resource-rich sites then A. schlechtendalii would have both lower growth and lower floral display at Telchac with the least resources. The results are difficult to explain with this hypothesis since the plants at Telchac had similar growth to those at Hobonil (site with the richest resources) and even had greater floral display. Also, the plants at Dzemul (resource-rich site) could not recover from herbivory to the same level as those at Telchac because they had less floral display. Variation in the responses of A. schlechtendalii in different environments apparently supports the growth hypothesis (Hilbert et al. 1981) which proposes a greater compensatory response in a resource-poor site where plants grow slowly (Eckstein & Karlsson 1997) than in a resource-rich site where plants grow near their maximum rate. The A. schlechtendalii growth rates recorded before the field experiment showed that the plants at Telchac had a lower growth rate than those at Hobonil. However, those at Dzemul, a resource-rich site, had growth rates similar to the plants at Telchac. The positive response predicted in the growth hypothesis (Hilbert et al. 1981) may occur at low herbivory intensities, but if damage increases and surpasses the plant’s capacity to recover from herbivory, performance would be negatively affected, independently of the environment in which it occurs (McNaughton 1983). The response of A. schlechtendalii to damage intensity is generally consistent with the above, though the negative effect was recorded in the first season in the common garden and in the second season in the field. This difference between seasons indicates a response inertia reflecting herbivory history, and was particularly evident in the common garden, where a similar response was expected from plants with different source sites. 51 However, clear differences were observed between plants from different sources during the first season, though not the second. According to the above, growth and floral display changed in A. schlechtendalii in response to conditions in the environment where the plants grow. This study has demonstrated the importance of the plant–environment–herbivory interaction history on the performance of a tropical herbaceous perennial plant, A. schlechtendalii. The environmental history at each site has a strong influence on plant fitness and thus defines different ecological and evolutionary routes between populations. The trade-off between growth and floral display is likely a mechanism to compensate herbivory by A. schlectendalii. In this mechanism a resource reassignment occurs, mainly towards growth at the expense of reproduction. This could be especially important in perennial plants that suffer sustained herbivory events. Acknowledgments This work was supported by a grant from the Consejo Nacional de Ciencia y Tecnología (CONACYT 33128-V) to V. Parra-Tabla and a doctoral fellowship from CONACYT (118944.) to A. Canto. We thank Luis Salinas, Jazmín Canto, Margarita Canto, Flor Rodríguez, and Luis Abdala for field assistance. We are grateful to Suzanne Kouptur and two anonymous referees for constructive comments on drafts of this paper. 52 References Agrawal, A., Strauss, S.Y., Stout, M.J. (1999) Cost of induced responses and tolerance to herbivory in male and female fitness components of wild radish. Evolution 53, 1093-1104. Aide, T. M. 1993. Patterns of leaf development and herbivory in a tropical understory community. Ecology 74:455-166. Belsky, A.J. (1986) Does herbivory benefit plants? A review of the evidence. American Naturalist 127, 870-892. Canto, A. (2004) Ecología evolutiva de la herbivoría en Anthurium schlechtendalii subsp. schlechtendalii Kunth (Araceae) en ambientes heterogéneos. Instituto de Ecología, A.C., Xalapa, México. Unpublished Ph.D. Thesis. Chabot, B.F. & Hicks, D.J. (1982) The ecology of leaf life spans. Annual Review of Ecology and Systematics 13, 229-256. Chapin, F.S. (1991) Integrated responses of plants to stress. BioScience 41, 29-36. Coley, P.D., Bryant, J.P. & Chapin, F.S. (1985) Resource availability and plant antiherbivore defence. Science 230, 895-899. Crawley, M.J. (1983) Herbivory, the dynamics of plant-animal interactions. Blackwell Science, Oxford. Croat, T.B. (1991) A revision of Anthurium section Pachyneurium (Araceae). Annals of the Missouri Botanical Garden 78, 539-855. Duch, J.G. (1988) La conformación territorial del estado de Yucatán. Universidad de Chapingo, México. Eckstein, R.L. & Karlsson, P.S. (1997) Above-ground growth and nutrient use by plants in a subarctic environment: effects of habitat, life-form and species. Oikos 79, 311-324. Flores, S. & Espejel, I. (1994) Tipos de vegetación de la Península de Yucatán. Universidad Autónoma de Yucatán, Mérida. García, M.B. & Ehrlen, J. (2002) Reproductive effort and herbivory timing in a perennial herb: Fitness components at the individual and population levels. American Journal of Botany 89, 1295-1302. 53 Haukioja, E. (1991) The influence of grazing on the evolution, morphology and physiology of plants as modular organisms. Philosophical Transactions of Royal Society of London 333, 241-247. Hawkes, C.V. & Sullivan, J.J. (2001) The impact of herbivory an plant in different resource conditions: A meta-analysis. Ecology 82, 2045-2058. Hendrix, S.D. (1988) Herbivory and its impact on plant reproduction. Plant reproductive ecology, patterns and strategies (eds J. Lovett-Doust & L. Lovett-Doust), pp. 246-263. Oxford University Press, Oxford. Hicks, S. & Turkington, R. (2000) Compensatory growth of three herbaceous perennial species: The effects of cliping and nutrient availability. Canadian Journal of Botany 78, 759-767. Hilbert, D.W., Swift, D.M., Detling, J.K. & Dyer, M.I. (1981) Relative growth rates and the grazing optimization hypothesis. Oecologia 51, 14-18. Hoffmann, A.A. & Hercus, M.J. (2000) Environmental stress as an evolutionary force. BioScience 50, 217-226. Hoffmann, A.A. & Merilä, J. (1999) Heritable variation and evolution under favourable and unfavourable conditions. Trends in Ecology and Evolution 14, 96-101. Honkanen, T. & Haukioja, E. (1998) Intra-plant regulation of growth and plant-herbivore interactions. Ecoscience 5, 470-479. Juenger, T. & Bergelson, J. (2000) Does early season browsing influence the effect of selfpollination in Scarlet gilia? Ecology 81, 41-48. Karban, R. & Baldwin, I.T. (1997) Induced responses to herbivory. University of Chicago Press, Chicago. LaBarbera, M. (1989) Analyzing body size as a factor in ecology and evolution. Annual Review of Ecology and Systematics 20, 97-117. Lennartsson, T., Nilsson, P. & Tuomi, J. (1998) Induction of overcompensation in the field gentian, Gentianella campestris. Ecology 79, 1061-1072. Lewin, R. (1987) On the benefits of being eaten. Science 236, 519-520. Maschinski, J. & Whitham, T.G. (1989) The continuum of plant responses to herbivory: the influence of plant association, nutrient availability, and timing. American Naturalist 134, 119. 54 Mayo, S.J., Bogner, J. & Boyce, P.C. (1997) The genera of Araceae. Royal Botanic Gardens, Kew. McNaughton, S.J. & Chapin, F.S. (1985) Effects of phosphorus nutrition and defoliation on C4 graminoids from the Serengeti plains. Ecology 66, 1617-1629. McNaughton, S.J. (1983) Compensatory plant growth as a response to herbivory. Oikos 40, 329336. Méndez, M. (2001) Sexual mass allocation in species with inflorescences as pollination units: A comparison between Arum italicum and Arisaema (Araceae). America Journal of Botany 88, 1781-1785. Mendoza, A., Piñero, D. & Sarukhán, J. (1987) Effects of experimental defoliation on growth, reproduction and survival of Astrocaryum mexicanum. Journal of Ecology 75, 545-554. Meyer, G.A. (2000) Interactive effects of soil fertility and herbivory on Brassica nigra. Oikos 88, 433-441. Moore, J.P., Taylor, J.E., Paul, N.D. & Whittaker, J.B. (2003) Reduced leaf expansion as a cost of systematic induced resistance to herbivory. Functional Ecology 17, 75-81. Neuvonen, S. & Haukioja, E. (1984) Low nutritive quality as defence against herbivores: induced responses in birch. Oecologia 63, 71-74. Obeso, J.R. & Grubb, P.J. (1994) Interactive effects of extent and timing of defoliation, and nutrient supply on reproduction in a chemical protected annual Senecio vulgaris. Oikos 71, 506-514. Obeso, J.R. (1993) Does defoliation affect reproductive output in herbaceous perennials and woody plants in different ways? Functional Ecology 7, 150-155. Obeso, J.R. (2002) The cost of reproduction in plants. New Phytologist 155, 321-348. Paige, K.N. & Whitham, T.G. (1987) Overcompensation in response to mammalian herbivory: the advantage of being eaten. American Naturalist 129, 407-116. Paige, K.N. (1999) Regrowth following ungulate herbivory in Ipomopsis aggregata: geographic evidence for overcompensation. Oecologia 118, 316-323. Pilson, D. & Decker, K.L. (2002) Compensation for herbivory in wild sunflower: response to simulated damage by the head-clipping weevil. Ecology 83, 3097-3107. Ritchie, M.E. (2000) Nitrogen limitation and trophic vs. abiotic influences on insect herbivorous in a temperate grassland. Ecology 81, 1601-1612. 55 Rosenthal, J.P. & Kotanen, P.M. (1994) Terrestrial plant tolerance to herbivory. Trends in Ecology and Evolution 9, 145-148. Ruiz, N., Ward, D. & Saltz, D. (2002) Responses of Pancratium sickenbergeri to simulated bulb herbivory: Combining defence and tolerance strategies. Journal of Ecology 90, 472-479. Ruohomäki, K., Haukioja, E., Repka, S. & Lehtila, K. (1997) Leaf value: effects of damage to individual leaves on growth and reproduction of mountain birch shoots. Ecology 78, 21052117. Sibly, R.M. (1997) Life history evolution in heterogeneous environments: a review of theory. Plant life histories. Ecology, Phylogeny and Evolution (eds J. Silvertown, M. Franco & J.L. Harper), pp. 228-250. Cambridge University Press, Cambridge. Simms E.L (1992) Cost of plant resistance to herbivory. Plant resistance to herbivores and pathogens: Ecology, evolution, and genetics (eds R.S. Fritz & E.L. Simms), pp 392-425. University of Chicago Press, Chicago, Sincich, T. (1993) Statistics by example. Dellen-Macmillan, New York. Steinberg, D. & Colla, P. (2000) Logistic regression. SYSTAT ver 10. SPSS Inc., Chicago. Strauss, S.Y. & Agrawal, A. (1999) The ecology and evolution of plant tolerance to herbivory. Trends in Ecology and Evolution. 14, 179-185. Warner, P.J. & Cushman, J.C. (2002) Influence of herbivores on a perennial plant: variation with life history stage and herbivore species. Oecologia 132, 77-85. Whigham, D. & Chapa, A. (1999) Timing and intensity of herbivory: its influence on the performance of clonal woodland herbs. Plant Species Biology 14, 29-37. Whitham, T. & Mopper, S. (1985) Chronic herbivory: impacts on architecture and sex expression of pinyon pine. Science 228, 1089-1091. Whitham, T., Maschinski, J., Larson, K.C. & Paige, K.N. (1991) Plant responses to herbivory: the continuum from negative to positive and underlying physiological mechanisms. Plantanimal interactions (eds P.W. Price, T.M. Lewinsohn, G.W. Fernandes & W.W. Benson), pp. 227-256. John Wiley & Sons, Inc. New York. 56 Table 1. Logistic regression results for leaf and inflorescence production of A. schlechtendalii in the common garden experiment. The Hobonil plant source site and 75% herbivory treatment were used as the reference parameters in the analysis. Only significant (P ≤ 0.05) and marginally significant odds ratios (ratio between probability of leaf or inflorescence production and probability of lack of production), and regression coefficients (β) are shown. Odds ratio β t-test P-value Population sources -- -- ≤ 0.78 ns Herbivory treatments -- -- ≤ 1.13 ns Initial leaves* -- -- 0.15 ns Population sources -- -- ≤ 1.48 ns Herbivory treatments -- -- ≤ 0.03 ns Initial leaves* -- -- 1.03 ns Telchac source 0.02 -3.76 -2.49 0.013 Dzemul source 0.09 -2.36 -1.85 0.064 0 % herbivory 32.6 3.48 2.19 0.029 25 % herbivory 206 5.33 2.74 0.006 50 % herbivory 15.8 2.76 2.23 0.026 Initial leaves* 2.0 0.69 2.3 0.022 Population sources -- -- ≤ 0.68 ns Herbivory treatments -- -- ≤ 0.04 ns 9.96 2.3 1.89 0.058 Leaf production 2001 Leaf production 2002 Inflorescence production 2001 Inflorescence production 2002 Initial leaves* *Number of leaves per plant at the beginning of each season. 57 Table 2. Logistic regression comparison between seasons for growth and floral display of A. schlechtendalii. The 2001 season was used as the reference parameter. All significant (P ≤ 0.05) and no significant odds ratios and regression coefficients (β) are shown. Odds ratio β t-test P-value 0.90 -0.11 -0.18 0.855 1.23 0.21 1.73 0.083 15.56 2.74 3.97 < 0.0001 1.41 0.34 2.79 0.005 0.70 -0.35 -1.02 0.306 1.46 0.37 3.36 0.001 1.84 0.61 1.88 0.059 1.38 0.32 3.22 0.001 Common garden Leaf production 2002 Initial leaves* Inflorescence production 2002 Initial leaves* Field Leaf production 2002 Initial leaves* Inflorescence production 2002 Initial leaves* *Number of leaves per plant at the beginning of each season. 58 Table 3. Logistic regression results for growth and floral display of A. schlechtendalii in the field experiment. The Hobonil population and 75% herbivory treatment were used as reference parameters in the analysis. Only significant (P ≤ 0.05) odds ratios (ratio between probability of leaf or inflorescence production and probability of lack of production) and regression coefficients (β) are shown. Odds ratio β t-test P-value 0.03 -3.59 -4.35 < 0.0001 Herbivory treatments -- -- ≤ 0.39 ns Initial leaves* -- -- 0.63 ns 4.07 1.4 1.96 0.050 -- -- ≤ 0.05 ns 1.46 0.38 2.42 0.016 Telchac population 12.5 2.52 3.79 < 0.0001 Dzemul population 6.7 1.9 2.87 0.004 Herbivory treatments -- -- ≤ 1.37 ns Initial leaves* -- -- 1.26 ns Telchac population 4.79 1.57 2.25 0.025 Natural herbivory 6.67 1.89 2.67 0.007 Initial leaves* 1.75 0.56 2.95 0.003 Leaf production 2001 Dzemul population Leaf production 2002 Dzemul population Herbivory treatments Initial leaves* Inflorescence production 2001 Inflorescence production 2002 *Number of leaves per plant at the beginning of each season. 59 (a) (b) 1.5 cm 10 cm Inflorescence primordium Figure 1. Anthurium schlechtendalii: (a) reproductive individual and; (b) inflorescence (illustration A. Canto). 60 Growth Floral display 2001 2002 20 15 10 5 25 Percentage (%) Percentage (%) 25 0 20 15 * * 10 5 0 Telchac Dzemul Hobonil Telchac Origin sites Hobonil Origin sites 20 Percentage (%) 20 Percentage (%) Dzemul 15 10 5 0 * 15 10 * * 5 0 0% 25% 50% Herbivory treatment 75% 0% 25% 50% 75% Herbivory treatment Figure 2. Observed events of growth and floral display in A. schlechtendalii in the common garden experiment. The results are shown as percentages of events. Asterisks indicate significant (P < 0.05) odds ratios (with respect to reference parameters: Hobonil plant source and 75 % damage) for each factor level (see text and Table 1 for statistics). 61 Floral display 2001 30 25 20 15 10 5 0 2002 * * Telchac Dzemul Percentage (%) Percentage (%) Growth 30 25 20 15 10 5 0 Hobonil * * * Telchac Sites Hobonil Sites 25 Percentage (%) 20 Percentage (%) Dzemul 15 10 5 0 * 20 15 10 5 0 Natural 50% 75% Herbivory treatment Natural 50% 75% Herbivory treatment Figure 3. Observed events of growth and floral display in A. schlechtendalii in field experiment. The results are shown as percentage of events. Asterisks indicate significant odds ratios (with respect to reference parameters: Hobonil site and 75 % damage) for each factor level (see text and Table 3 for statistics). 62 Capítulo IV. Factores determinantes del despliegue floral y asignación sexual en Anthurium schlechtendalii (Araceae): herbivoría, tamaño de la planta y variación ambiental Azucena Canto Departamento de Ecología Vegetal, Instituto de Ecología, A.C. Apdo. Postal 63, Xalapa, Veracruz 91000, México. Víctor Parra-Tabla Departamento de Ecología, Campus de Ciencias Biológicas y Agropecuarias, Universidad Autónoma de Yucatán. Apdo. Postal 4-116 (Itzimná), Mérida, Yucatán 97100, México. José G. García-Franco Departamento de Ecología Vegetal, Instituto de Ecología, A.C. Apdo. Postal 63, Xalapa, Veracruz 91000, México. Artículo sin enviar 63 Resumen Uno de los principales temas en el estudio de la evolución de las plantas ha sido entender las fuerzas que moldean las características florales. La interacción con los herbívoros, la variación ambiental y el tamaño de la planta pueden ser factores determinantes en el despliegue floral y la expresión sexual. En este trabajo se evaluó la relación entre el despliegue floral y asignación sexual entre las fases hermafrodita y masculina de la herbácea tropical Anthurium schlechtendalii, la variabilidad ambiental y la herbivoría. Los componentes registrados fueron el número de inflorescencias (espádice), la proporción de biomasa hermafrodita con respecto al total de la espádice, la proporción de flores funcionalmente hermafroditas, la longitud del espádice y pedúnculo; así como la herbivoría y el tamaño de la planta. Se estableció un diseño espacial jerarquizado con subpoblaciones dentro de poblaciones y éstas dentro de tres zonas ambientales (duna costera, selva baja caducifolia espinosa y selva mediana). Los datos se analizaron ponderando dos modelos mixtos generalizados (anidado y no anidado) y se encontraron diferencias entre zonas en el número de espádices, proporción de biomasa hermafrodita, proporción de flores hermafroditas y longitud de pedúnculo. Únicamente se observaron diferencias en la longitud del pedúnculo como resultado de la herbivoría. La proporción de biomasa, de flores hermafroditas, longitud de espádice y de pedúnculo se incrementaron en función del área foliar. Las plantas de la duna costera mostraron mayor despliegue floral que las plantas de las otras dos zonas; produciendo más espádices, mayor proporción de flores hermafroditas, mayor biomasa en la sección hermafrodita y espádices más largas, a pesar de ser el ambiente más pobre en agua y nutrientes. Los resultados sugieren que el ambiente y el tamaño de la planta son los factores determinantes del despliegue floral y la asignación sexual en A. schlechtendalii. Palabras clave: ambiente, características florales, herbivoría, hermafrodita, masculino, variación espacial, Yucatán, México. 64 Introducción Uno de los principales intereses en el estudio de la biología evolutiva de plantas ha sido entender cómo y qué fuerzas moldean las características florales y los sistemas reproductivos (Darwin 1877, Richards 1986, Proctor y Yeo 1996). La certidumbre de éxito en la polinización y la fidelidad de los polinizadores son los principales aspectos señalados como modeladores del número, tamaño y morfología de las estructuras reproductivas, así como de recompensas y trayentes florales (Wilson y Thomson 1996). Sin embargo, la herbivoría y el ambiente también pueden ser factores que modifiquen las características florales y por lo tanto, determinar la adecuación de la planta (Hendrix 1988, Escarré et al. 1996, Strauss 1997, Hoffmann y Hercus 2000, Hawkes y Sullivan 2001). La cantidad de nutrientes presentes en el ambiente, así como la intensidad con que ocurre la herbivoría pueden limitar el total de recursos que la planta asigna hacia la reproducción y en particular, al despliegue floral (Mazer 1992, Herrera 1993, Strauss et al. 1996). Por otro lado, la asignación entre las funciones sexuales puede ser moldeada por el ambiente y la herbivoría, determinando que en un ambiente en particular, una planta hermafrodita sea más o menos masculina (Broker y Callaghan 1998, Elle y Hare 2002). Puesto que la probabilidad de que los óvulos sean fecundados y de que el polen llegue a estigmas coespecíficos descansa, en parte, en el despliegue floral y en la expresión sexual, la asignación de recursos hacia tales características determinará, en buena medida, la adecuación de la planta (Wyatt 1983). En general, un mayor despliegue floral conduce a una mayor notoriedad de la planta hacia los polinizadores y esto puede disminuir la incertidumbre inherente en el proceso de la reproducción sexual (Strauss 1997). Se espera que una planta presente mayor despliegue floral e inversión hacia la función femenina si no está limitada por recursos (Charnov 1982, Charlesworth y Charlesworth 1987, Brunet 1992). El ambiente actúa como factor limitante sobre los recursos que la planta puede adquirir y destinar a la reproducción (Freeman et al. 1981). Para maximizar la adecuación, se espera que las plantas sexualmente lábiles y de ambientes con una alta incertidumbre de éxito reproductivo (e.g. suelos pobres en recursos), presenten menor despliegue floral y específicamente, menor asignación en la función femenina (Freeman et al. 1980, Charnov 1983). Por otro lado, la disminución de tejido fotosintético por herbivoría desencadena un ajuste en la asignación de recursos dentro de la planta (Haukioja 1991, Honkanen y Haukioja 1998), el 65 cual puede modificar el despliegue floral y la asignación sexual. Los cambios pueden reflejarse en el tamaño de las partes florales (Strauss 1996, 1997), en un menor número de flores (Edwards 1985, Strauss et al. 2001), en una mayor masculinidad en la planta (Parra-Tabla et al. 2004) o incluso, promover un mayor número de primordios florales a través de la ramificación (Paige y Whitham 1987, Bergelson y Crawley 1990, Martínez y López-Portillo 2003). Otro aspecto vinculado con el ambiente es el tamaño de la planta (Bierzychudek 1984, Clay 1993). Se sabe que plantas grandes tienen mayor capacidad reproductiva y por ende, mayor probabilidad de éxito (LaBarbera 1989, Klinkhamer et al. 1997, Sugiyama y Bazzaz 1998). El vínculo entre tamaño y ambiente es tal, que una planta en ambientes ricos en recursos probablemente tenga un mayor tamaño, y por lo tanto, mayor éxito reproductivo (si no existe limitación por polinizadores) que un coespecífico en sitios pobres (Bazzaz 1996, Karlsson y Jacobson 2001). Dado que ambiente, tamaño y herbivoría pueden ser determinantes del desempeño y la adecuación de las plantas, es importante dilucidar la forma en que las plantas concilian estos dos factores a través de la reproducción. Este conocimiento contribuiría a entender el mecanismo a través del cual estos factores influyen los sistemas reproductivos de las plantas. En el presente trabajo se analiza la variación espacial de las características reproductivas de Anthurium schlechtendalii (Araceae), es una hierba perenne subtropical que presenta protoginia. Es una especie autoincompatible y depende de los polinizadores para la fecundación de sus inflorescencias (Mayo et al. 1997, Canto et al. enviado). Las poblaciones de esta planta se distribuyen en diversos de ambientes con marcadas diferencias en clima y disponibilidad de recursos. En un estudio previo se registraron diferencias importantes entre ambientes en la intensidad de herbivoría (Canto et al. enviado). Experimentalmente, se ha observado que la herbivoría puede afectar la producción de inflorescencias, pero este efecto es diferente en función del ambiente, siendo menor en los sitios pobres (Canto et al. 2004). En particular, la disyuntiva por recursos que existe entre el despliegue floral y la producción de hojas por ser eventos simultáneos, puede ser relajado o intensificado por el nivel de herbivoría y el ambiente de la planta. Por ejemplo, en ambientes favorables la herbivoría puede no representar una limitante del despliegue floral y el crecimiento y esto disminuye la disyuntiva de recursos entre estas funciones. En cambio, en un ambiente con limitación de recursos, la herbivoría puede reducir el despliegue floral aunque el crecimiento se mantenga, por lo que la disyuntiva entre éstos se intensifica (Canto et al. 2004). El efecto del ambiente, tamaño y herbivoría aun no ha sido 66 evaluado en las características de las inflorescencias en esta planta, particularmente en la asignación de recursos a las funciones sexuales y en características que promueven la atracción de polinizadores. En el presente estudio trabajamos bajo el supuesto de que la herbivoría tiene un efecto limitante en la reproducción de A. schlechtendalii, tal que a mayor daño, menor despliegue floral y asignación a la función femenina. Por otro lado, si la variación en el despliegue y asignación sexual está en función del ambiente y tamaño de la planta, las plantas de ambientes con recursos limitados presentarán menor tamaño y menor despliegue floral y asignación hacia la función femenina, independientemente de la intensidad de herbivoría en tal ambiente. Materiales y Métodos Descripción de la especie Anthurium schlechtendalii subsp. schlechtendalii Kunth (Araceae) es una planta herbácea (ca. 1 m de altura) autoincompatible, distribuida a lo largo de la vertiente atlántica desde la parte central de Veracruz en México hasta Nicaragua (Croat 1991). En la Península de Yucatán (México) esta planta crece en ambientes que van desde pobres en agua y nutrientes (como dunas costeras) hasta ambientes con abundante materia orgánica y humedad (selvas medianas y altas; Fig. 1). Cada planta produce solo unas pocas hojas (1-3) por estación, las cuales son conspicuas (promedio ± SE, 520 ± 18 cm2). El tiempo de vida de las hojas es aproximadamente de dos años y por lo tanto puede reflejar la historia de herbivoría de la planta (Chabot y Hicks 1982). El tallo es muy corto y tiene internudos estrechos y escondidos por una agregación densa de raíces gruesas de color verde-pardo (Croat 1991). Este conjunto de raíces, junto con la forma de abreviada del tallo, dan como resultado a la planta una forma similar a la de una canasta en la cual se acumula el detritus de hojas y pequeñas ramitas de la vegetación acompañante (Mayo et al. 1997; Fig. 2). Las inflorescencias son solitarias, acropétalas y protogínicas. Están estructuradas por numerosas flores pequeñas (ca. 1 mm), morfológicamente hermafroditas y dispuestas en espirales paralelas que conforman la estructura llamada espádice. En la sección inferior de la espádice las flores son funcionalmente hermafroditas e inician la floración como femeninas después de lo cual, el polen es liberado por las anteras e inicia la fase masculina. La liberación del polen inicia en la sección hermafrodita y de manera acropétala finaliza hasta el ápice de la espádice. La fase femenina dura aproximadamente 5 días, y es fácilmente reconocible porque los estigmas están expuestos y gotas brillantes de líquido estigmático se pueden observar sobre ellos. Después las anteras emergen y 67 liberan el polen; esta fase masculina puede durar hasta un mes. El pedúnculo de la inflorescencia es conspicuo y eleva al espádice por encima de las hojas. La bráctea floral o espata que acompaña al espádice es poco evidente y se enrolla hacia abajo cuando el espádice es funcional. La floración comienza antes de la temporada lluviosa (marzo) y se producen pocas inflorescencias por planta (ca. 1-2; Canto et al. enviado). La herbivoría en esta planta ocurre principalmente en las hojas y el daño lo realizan ortópteros (Acrididae) y larvas de mariposas (Noctuidae). Ambos herbívoros pueden llegar a consumir gran parte de las hojas (> 50 %; Canto et al., enviado). Los principales polinizadores de A. schlechtendalii son coleópteros de las familias Curculionidae, Phalacridae, Chrysomelidae, Bruchidae y Anthicidae, que llegan a la espádice y se alimentan de las gotas estigmáticas y el polen. Área de estudio El estudio se llevó a cabo en tres zonas dentro del estado de Yucatán que representan los principales ecosistemas de la región. La primera zona es la más norteña y se extiende a lo largo de la costa de Yucatán (21º19’50’’N; 89º21’58’’W); es un ambiente de duna que se eleva a sólo 2 msnm (Duch 1988). El clima es semiárido con escasa precipitación. El promedio de lluvia para los tres años previos del estudio fue de 555.9 mm y el promedio de temperaturas máximas fue de 41.3 °C (Comisión Nacional del Agua-CNA). La vegetación es principalmente de matorral de duna costera con especies como Metopium brownei, Coccoloba uvifera, Cocothrinax readii, Agave sisalana y Caesalpinia versicaria (Flores y Espejel 1994, Chan-Vermont et al. 2002). La segunda zona de estudio se encuentra a aproximadamente 15 km al sur de la duna costera, después de una breve franja de manglares (21º16’37’’N; 89º19’09’’W). Su altitud es de 7 msnm y es un ambiente formado principalmente de roca caliza debajo de una ligera capa de suelo de origen orgánico, principalmente detritus (Duch 1988). El clima es semi-seco con una precipitación promedio de 1147 mm para los tres años previos al estudio y un promedio de temperaturas máximas de 41.6 °C (CNA). La vegetación es de selva caducifolia espinosa constituida principalmente por especies como Lisiloma latisiliqua, Mimosa bahamensis, Piscidia piscipula, Bursera simaruba y Cnidoscolus aconitifolius (Flores y Espejel 1994). La tercera zona estudiada se localiza a 150 km al sur de la selva caducifolia espinosa, a 36 msnm. Es la región más al sur de Yucatán (20º00’27’’N, 89º01’36’’W) y es un ambiente de lomeríos de roca caliza y más cantidad de suelo (Duch 1988). El clima es subhúmedo con un 68 promedio de precipitación anual para los tres años previos al estudio de 1122.9 mm y un promedio de temperaturas máximas de 40 °C (CNA). En la zona se extiende una selva mediana compuesta por especies como Vitex gaumerii, Enterolobium cicloparum, Guazuma ulmifolia, Aphelandra deppeana y Hamelia patens (Flores y Espejel 1994). Entre las zonas existen diferencias en la concentración de nutrientes, en sus formas químicas disponibles, en el sustrato que envuelve a las raíces de A. schlechtendalii (Canto et al. enviado). Para la duna costera las concentraciones promedio (± DE) de fósforo (5.33 ± 0.29 µg/g) y potasio (1.51 ± 0.21 meq/100g), así como el porcentaje de humedad (10.17 ± 0.96 %), son las más bajas en relación con la selva caducifolia espinosa y la selva mediana (P < 0.05). Además, el potencial de hidrógeno (pH) del sustrato en la duna costera determina condiciones más básicas en el sustrato condiciones (7.49 ± 0.10; Canto et al. enviado). En cambio, en la selva caducifolia espinosa y la selva mediana son similares en fósforo (24.89 ± 2.57 y 19.46 ± 2.89 µg/g respectivamente; P > 0.05), pero diferentes en potasio (3.88 ± 0.38 y 2.36 ± 0.32 meq/100g respectivamente; P < 0.05) y en humedad de sustrato (12.24 ± 4.34 y 40.87 ± 2.59 % respectivamente; P < 0.05). El pH en estas zonas determina condiciones más ácidas en el sustrato que con respecto a la duna costera (6.32 ± 0.12 y 6.82 ± 0.06; P < 0.05; Canto et al. enviado). También se han registrado diferencias entre zonas en la abundancia de polinizadores potenciales (escarabajos) de A. schlechtendalii (P = 0.02). Las colectas extensivas realizadas en cada zona durante 2002 mostraron un menor número de polinizadores potenciales (como escarabajos, pequeñas abejas y dípteros) en la duna costera (0.4 ± 0.1 insectos/m2, media ± EE) y en la selva caducifolia espinosa (0.7 ± 0.1 insectos/m2) con respecto a la selva mediana (1.2 ± 0.2 insectos/m2; F = 11.1, P < 0.0001; Canto et al. enviado). Diseño espacial En el año 2002, en cada zona se seleccionaron aleatoriamente dos sitios (separados entre sí por una distancia de entre 3 y 10 km). En cada sitio se eligieron cinco subpoblaciones (aprox. 10-20 plantas reproductivas) separadas aproximadamente 30 m entre sí. Se numeraron todas las plantas en cada subpoblación y se eligieron aleatoriamente 6 individuos reproductivos en cada una. A cada planta seleccionada se le registró la proporción de herbivoría en las hojas dibujando el contorno de cada una, incluidas las perforaciones o área dañada por herbivoría. Los dibujos fueron recortados y se calculó el área foliar total (la que tendría la hoja si no hubiese sido 69 comida) y el área consumida por herbívoros, a través de un integrador de áreas Li-COR®, modelo Li-3100. La proporción de herbivoría fue calculada como la relación entre el área consumida y el área foliar total. El tamaño de la planta fue estimado como el área foliar real por individuo (i.e. suma de área foliar de todas sus hojas aún con herbivoría). Tomando en cuenta la longevidad de las hojas de esta planta, se consideró a la estimación de herbivoría realizada por este método, como una representación de la historia de daño de al menos dos temporadas de crecimiento (Canto et al. enviado). Para estimar el despliegue floral de las plantas marcadas en cada subpoblación, se realizaron censos semanales durante la floración de 2002, y se cosecharon todas las inflorescencias que fueron emergiendo. No se observaron diferencias significativas entre plantas en el número de inflorescencias producidas bajo el proceso de cosecha de inflorescencias y plantas sin cosecha (t = 0.3, gl = 236, p = 0.74). Por lo tanto, consideramos que este proceso no tuvo efecto sobre la producción de inflorescencias observada en este estudio. A cada estructura reproductiva cosechada se le midió la longitud de la espádice y del pedúnculo. Con la ayuda de un microscopio estereoscópico (10 x) se contó el número de flores en cada espádice, tanto en la sección hermafrodita como en la sección masculina, y se calculó la proporción de flores hermafroditas con respecto al total de flores del espádice. Se incluyó la longitud del pedúnculo como parte del despliegue floral debido a que esta estructura eleva y hace visible y accesible el espádice a los polinizadores. Sin embargo, se excluyó a la espata debido a su reducido potencial como atractivo floral. Para estimar la asignación sexual, las secciones de la espádice (Fig. 1) fueron secadas en horno a 60 ºC hasta alcanzar peso constante. Se obtuvo el peso seco de cada sección de la espádice y la asignación sexual se calculó ponderando la biomasa de la sección hermafrodita con respecto a la biomasa total del espádice. Se utilizó la sección hermafrodita (Fig. 1) como base para la estimar el cambio en las proporciones sexuales debido a que es la sección portadora de los gametos femeninos (aunque también libera polen). En A. schlechtendalii no es posible separar la función femenina de la masculina dentro del espádice; sin embargo, por la diferenciación morfológica es posible distinguir la porción hermafrodita dentro de la espádice. A través de los cambios en la proporción hermafrodita / total se puede evaluar el grado en que la espádice asigna más hacia flores femeninas o masculinas. 70 Análisis estadísticos Para el análisis de los datos se emplearon modelos lineales mixtos generalizados (Littell et al. 1996). Los análisis se realizaron poniendo a prueba dos modelos, los cuales fueron comparados entre sí: uno incluyendo el aporte de la variación ambiental (diseño anidado) y el otro excluyéndolo (diseño libre de anidamiento). Este procedimiento se efectuó con la finalidad de estimar el aporte de la variación adentro de cada ambiente (i.e. niveles anidados) a las características reproductivas y de herbivoría. Los niveles de anidamiento (factores aleatorios) fueron: sitio dentro de zona, subpoblación dentro de sitio y planta dentro de subpoblación. En ambos diseños se estableció como único factor fijo a las zonas de estudio y se incluyeron a la herbivoría y al tamaño de la planta como variables independientes en la reproducción de A. schlechtendalii. Tanto para el diseño anidado como para el libre de anidamientos se utilizó el programa macro Glimmix de SAS ver 6.12 (SAS Institute 1996) para realizar el ajuste del modelo a los datos. Este macro utiliza el procedimiento MIXED del programa SAS hasta la convergencia a través de pruebas iterativas de bondad de ajuste reponderado, las cuales aproximan el modelo establecido a los datos. Este macro también calcula y estima a través del método restringido de seudo bondad de ajuste (REPL)”, la probabilidad estadística de cada uno de los coeficientes que componen el modelo mixto. Por la distribución del error residual de la variable producción de espádices, se especificó para su análisis una distribución de error Poisson y una función de liga logarítmica. Para el análisis de esta variable a través del modelo anidado se excluyó el nivel planta dentro de subpoblación porque solamente se obtuvo una respuesta por planta. Para la proporción de flores hermafroditas dentro del espádice se realizó el análisis especificando una distribución de error Binomial y una función de liga logística. Para analizar la asignación de biomasa y la longitud de espádice y pedúnculo se utilizó el módulo para modelos mixtos (PROC MIXED), y no el macro Glimmix, ya que la distribución de los errores aleatorios en estas características mostraron una distribución normal (análisis de residuales vs. valores predichos; Zar 1984). Después de probar el modelo anidado se procedió a analizar todas las variables a través de un modelo libre de anidamientos, pero con las mismas especificaciones de liga. De nuevo se estableció a las zonas, la herbivoría y el tamaño de la planta como factores principales. Ambos modelos fueron comparados para determinar la importancia de la variación dentro de cada ambiente sobre las características reproductivas. En el modelo anidado está variación fue 71 separada del análisis pero en el modelo libre fue incluida por lo que l comparación entre modelos se realizó calculando la diferencia entre la bondad de ajuste del modelo anidado y el libre. Con esta diferencia se calculó un Ji-cuadrado con grados de libertad igual a la diferencia de grados entre modelos (J. Navarro-Alberto com. pers.) y se puso a prueba la hipótesis nula de modelo1 = modelo2. Resultados Al contrastar la estimación en la bondad de ajuste del diseño anidado con respecto al del diseño libre de anidamientos no se observaron diferencias significativas entre ambos en todas las variables analizadas (Tabla 1). Este resultado sugirió que la variación espacial al interior de cada zona, no representa una fuente importante de divergencia en el despliegue floral y asignación sexual en las poblaciones de A. schlechtendalii. Con base en este resultado se escogió al diseño libre de anidamientos para continuar con el análisis de las características reproductivas. Se observaron diferencias significativas entre las zonas de estudio en el número de espádices, proporción de biomasa hermafrodita, número de flores hermafroditas y longitud del pedicelo (Tabla 2). Los valores promedio del número de espádices y la proporción de biomasa hermafrodita fueron mayores en las plantas de la duna costera y menores en la selva mediana (Tabla 3). La proporción de flores hermafroditas fue mayor en las plantas de la duna costera que en las de la selva caducifolia espinosa y selva mediana (Tabla 3). El pedúnculo de la espádice fue más largo en las plantas de la selva caducifolia espinosa que en las de duna costera, mientras que éste último tuvo una longitud similar a las plantas de la selva mediana (Tabla 3). No se observó un efecto importante de la herbivoría sobre el despliegue floral y asignación sexual (Tabla 2); excepto en la longitud del pedúnculo, sobre la cual mostró un efecto negativo (coeficiente de regresión = -234.7, EE = 116.42, t = -2.02, P = 0.045; Tabla 2). Sin embargo, al comparar la herbivoría entre zonas se observaron diferencias significativas en la cantidad de daño. Las plantas de la duna costera presentaron considerablemente menos herbivoría que las plantas de la selva caducifolia espinosa y selva mediana (Tabla 3). En cambio, a pesar de que el tamaño de la planta (área foliar) no mostró efecto sobre el número de inflorescencias producidas, sí afectó positivamente la proporción de flores hermafroditas (coeficiente de regresión = 0.0001, EE = 0.00001, t = 2.78, P = 0.006), la biomasa hermafrodita (coeficiente de regresión = 0.0001, EE = 0.00001, t = 4.36, P = 0.0001), la longitud de la espádice (coeficiente 72 de regresión = 0.013, EE = 0.001, t = 9.45, P = 0.0001) y la longitud del pedúnculo (coeficiente de regresión = 0.055, EE = 0.006, t = 8.14, P = 0.0001; Tabla 2). Así un mayor tamaño de planta se traduce en una mayor cantidad de flores hermafroditas, mayor asignación de biomasa en la sección hermafrodita y espádices grandes con pedúnculos largos (Tabla 3). Discusión De acuerdo con los resultados, la variación ambiental entre zonas y el tamaño de la planta son los principales factores que influyen sobre el despliegue floral y la asignación sexual en A. schlechtendalii. En la duna costera, la zona con menor humedad de sustrato, nutrientes y polinizadores, el despliegue floral y la asignación hacia la función hermafrodita fue mayor que en las zonas de selva caducifolia espinosa y selva mediana, las cuales fueron consideradas como ambientes más favorables. El efecto de la zona y el tamaño de la planta sobre las características reproductivas puede ser reflejo de la combinación de las características del sustrato, nutrientes, clima e interacciones con otros organismos (e.g. polinización, herbívoros). Las plantas que crecen en ambiente de duna costera están limitadas en recursos (Chapin 1991) y por consiguiente, se espera tengan menor despliegue floral y menor asignación a la función femenina que plantas de ambientes más favorables (Charnov 1982). Sin embargo, se encontró que en la duna costera las plantas de A. schlechtendalii tuvieron mayor despliegue floral en términos del número de espádices y mayor asignación hacia la función hermafrodita que las plantas de las selvas caducifolia y mediana. Una explicación plausible incluiría los ajustes fisiológicos que realizan las plantas para mantenerse y crecer en relación a su ambiente, en particular en ambientes pobres en recursos (Hilbert et al. 1981). Los mecanismos de almacenamiento junto con un crecimiento lento son características comunes en plantas de ambientes pobres (Chapin 1991, Orcutt & Nilsen 2000, y ver citas allí). Esto permite relajar la limitación en recursos para la reproducción y tener un importante despliegue reproductivo. En el caso de A. schlechtendalii se ha observado que el tallo podría funcionar como un importante almacén de recursos, que en combinación con el ritmo de crecimiento podría explicar un mayor despliegue floral y mayor asignación reproductiva en el ambiente de duna costera; Sin embargo, esta hipótesis aun necesita ser evaluada en esta especie. El tamaño de la planta es un factor importante de variación en el éxito reproductivo de las plantas y es un claro reflejo de los ajustes que realiza en respuesta a su ambiente (Klinkhamer y de Jong 1993, Klinkhamer et al. 1997). La influencia del tamaño es visible desde las 73 características florales hasta la maduración de los frutos (Stephenson 1981, Fox 1993, ParraTabla & Bullock 2002). En general se ha observado que a mayor tamaño mayor capacidad de reproducirse y mayor probabilidad de éxito tienen los organismos (Silvertown y Lovett-Doust 1993). En concordancia con lo anterior, aunque en A. schlechtendalii no se observaron diferencias entre zonas en el tamaño promedio de las plantas, a nivel individual plantas más grandes tuvieron mayor despliegue floral y asignación hacia la función hermafrodita. Otra posible explicación de un mayor despliegue floral y asignación hacia lo hermafrodita en las dunas costeras es que un ambiente extremo puede ser ventajoso al disminuir la probabilidad de encuentros con enemigos (Pilson 1992). En la duna costera, existe poca herbivoría y las plantas pueden mantener su tamaño sin tener que entrar en un proceso compensatorio intenso. En contraste, las plantas de la selva caducifolia espinosa y de la selva mediana sufren altos niveles de herbivoría y, aunque se encuentren en ambientes con mayor abundancia de recursos, tienen que realizar un proceso compensatorio de mayor intensidad (Canto et al. en prensa). De esta manera, las plantas de la duna costera, a pesar de encontrarse en un ambiente pobre en recursos, tienen la oportunidad de maximizar o acumular recursos y así, realizar un mayor despliegue floral que las plantas de los otros ambientes. Aunque se observaron diferencias entre zonas en la herbivoría, los datos sugieren que el factor zona es más importante sobre el despliegue floral y asignación sexual de A. schlechtendalii que la herbivoría. Sin embargo, como esta planta es una especie perenne, no se puede descartar un posible efecto a largo plazo (Cobb et al. 2002). Plantas con formas de vida similares a la de A. schlechtendalii generalmente presentan mecanismos fisiológicos que permiten solventar la demanda actual de recursos en la reproducción tales como almacenamiento o retranslocación de fotosintatos (McNaughton y Chapin 1985, Haukioja 1991). Cuando se evalúa el impacto de la herbivoría en el corto plazo, estos mecanismos podrían estar ocultando la respuesta a la pérdida acumulada de tejido vegetal (Belsky et al. 1993, Obeso 1993). Una observación a largo plazo podría mostrar el efecto neto del daño por herbívoros (García y Ehrlen 2002). Por lo tanto, en A. schlechtendalii no se puede descartar el efecto de la herbivoría en la reproducción hasta que sea evaluado en varias temporadas. En un experimento previo con A. schlechtendalii se observó una compensación en la reproducción después de la herbivoría, tanto en ambientes pobres como abundantes en recursos. Sin embargo, esta compensación disminuyó claramente después de dos temporadas de herbivoría sostenida (Canto et al. en prensa). Las evidencias indican que la 74 disminución en la reproducción fue el resultado del compromiso que existe entre las funciones vegetativa y reproductiva, puesto que ambas son eventos simultáneos en A. schlechtendalii. Después de la herbivoría, esta planta puede dejar de producir inflorescencias pero continúa produciendo hojas a cualquier nivel de daño. Este costo en la reproducción puede reflejarse en las características a nivel de inflorescencias, pero es un costo que se modifica en función del ambiente de la planta (Canto et al. en presa). No se puede hablar de una mayor asignación femenina en A. schlechtendalii, debido a que la morfología de la espádice no permite separar totalmente la función masculina de la femenina. Sin embargo, se puede observar una mayor o menor proporción de flores que maduran primero como femeninas. Las plantas de la duna costera tuvieron más flores madurando como femeninas y mayor biomasa en esa sección de la espádice, sugiriendo una mayor asignación femenina en A. schlechtendalii en este ambiente que las plantas de la selva caducifolia espinosa y selva mediana. Ante un escenario de heterogeneidad ambiental como en el de A. schlechtendalii, la variación en el despliegue floral y la asignación sexual en función del ambiente confiere ventajas ecológicas. Por ejemplo, en un ambiente en el cual la probabilidad de éxito reproductivo es alta (en Hobonil), pero en el que es necesario ajustarse a factores que limitan la adquisición de recursos, una alta inversión reproductiva puede resultar desventajosa. En contraste, en un ambiente con alta incertidumbre en el éxito reproductivo (en Telchac), pero con poca herbivoría, una gran inversión reproductiva contribuiría a maximizar la adecuación en un ambiente donde la polinización tiene mayor incertidumbre (Canto et al. enviado). Existen numerosos trabajos que resaltan el impacto de la incertidumbre en la polinización como un elemento que modifica fuertemente las características florales (e.g. Bawa et al. 1985, Crepet 1991, Pellmyr 1992, Andersson 1994, Galen 1996, Herrera 1996, Bernhard 2000), y es un factor que necesita ser evaluado aún con mayor detalle en esta planta. Finalmente se puede concluir que la importancia de la heterogeneidad ambiental sobre el proceso reproductivo en A. schlechtendalii y la relevancia de evaluar el papel del ambiente sen el desempeño y evolución de especies con poblaciones de plantas que ocurren en un amplio rango de ambientes. 75 Referencias Andersson, S. 1994. Floral stability, pollination efficiency, and experimental manipulation of the corolla phenotype in Nemophila menziesii (Hydrophyllaceae). American Journal of Botany 81: 1397-1402. Bawa, K. S., S. H. Bullock, D. R. Perry, R. E. Coville, y M. H. Grayum. 1985. Reproductive biology of tropical lowland rain forest trees II. Pollination systems. American Journal of Botany 72: 346-356. Bazzaz, F. A. 1996. Plants in changing environments. Cambridge University Press, Cambridge. Belsky, A. J., W. P. Carson, C. L. Jensen, y G. A. Fox. 1993. Overcompensation by plants: herbivore optimization or red herring? Evolutionary Ecology 7: 109-121. Bergelson, J. y J. Crawley. 1990. Herbivory on Ipomopsis aggregata: the disavantages of being eaten. American Naturalist 139:870-882. Bernhard, P. 2000. Convergent evolution and adaptative radiation of beetle-pollinated angiosperms. Plant Systematics and Evolution 222: 293-320. Bierzychudek, P. 1984. Determinants of gender in Jack-in-the-pulpit: the influence of plant size and reproductive history. Oecologia 65: 14-18. Brooker, R. W. y T. V. Callaghan. 1998. The balance between positive and negative plant interactions and its relationships to environmental gradients: A model. Oikos 81: 196-207. Brunet, J. 1992. Sex allocation in hermaphroditic plants. Trends in Ecology and Evolution 7:7984. Canto, A., V. Parra-Tabla, y J. G. García-Franco. En prensa. Variations in leaf production and floral display of Anthurium schlechtendalii (Araceae) in response to herbivory and environment. Functional Ecology. Chabot, B. F. y D. J. Hicks. 1982. The ecology of leaf life spans. Annual Review of Ecology and Systematics 13: 229-256. Chan-Vermont, C., V. Rico-Gray, y S. Flores. 2002. Guía ilustrada de la flora costera representativa de la Península de Yucatán. Etnoflora Yucatanense. Universidad Autonoma de Yucatán, Merida. Chapin, F. S. 1991. Integrated responses of plants to stress. BioScience 41: 29-36. 76 Charlesworth, D. y B. Charlesworth. 1987. The effect of investment in attractive structures on allocation to male and female functions in plants. Evolution 41:948-968. Charnov, E. L. 1982. The Theory of Sex Allocation. Princeton University Press, Princeton, New Jersey. Clay, K. 1993. Size-dependent gender change in green dragon (Arisaema dracontium; Araceae). American Journal of Botany 80: 769-777. Cobb, N., R. T. Trotter III, y T. G. Whitham. 2002. Long-term sexual allocation in herbivore resistant and susceptible pinyon pine (Pinus edulis). Oecologia 130: 78-87. Crepet, W. L., E. M. Friis, y K. C. Nixon. 1991. Fossil evidence for the evolution of biotic pollination. Philosophical Transactions of Royal Society of London 333: 187-195. Croat, T. B. 1991. A revision of Anthurium section Pachyneurium (Araceae). Annals of the Missouri Botanical Garden 78: 539-855. Darwin, C. 1877. The different forms of flowers on plants of the same species. John Murray, London, UK. Duch, J. G. 1988. La conformación territorial del estado de Yucatán. Universidad de Chapingo, México. Edwards, J. 1985. Effects of herbivory by moose on flower and fruit production of Aralia nudicaulis. Journal of Ecology 73:861-868. Elle, E. y D. Hare. 2002. Environmentally induced variation in floral traits affects the mating system in Datura wrightii. Functional Ecology 16: 79-88. Escarré, J., J. Leppart, y J. J. Sentul. 1996. Effects of simulated herbivory in three old field Compositae with different inflorescence architectures. Oecologia 105: 501-508. Flores, S. y Espejel, I. 1994. Tipos de vegetación de la Península de Yucatán. Universidad Autónoma de Yucatán, Mérida. Fox, J. F. 1993. Size and sex allocation in monoecious woody plants. Oecologia 94: 110-113. Freeman, D. C., E. D. McArthur, K. T. Harper, y A. C. Blauer. 1981. Influences of enviroment on the floral sex ratio of monoecious plants. Evolution 35:194-197. Freeman, D. C., K. T. Harper, y E. L. Charnov. 1980. Sex change in plants: Old and new observations and new hypotheses. Oecologia 47:222-232. Galen, C. 1996. Rates of floral evolution: adaptation to bumblebee pollination in an alpine wildflower, Polemonium viscosum. Evolution 50: 120-125. 77 García, M. B. y J. Ehrlén. 2002. Reproductive effort and herbivory timing in a perennial herb: Fitness components at the individual and population levels. American Journal of Botanic 89: 1295-1302. Haukioja, E. 1991. The influence of grazing on the evolution, morphology and physiology of plants as modular organisms. Philosophical Transactions of Royal Society of London 333: 241-247. Hawkes, C. V., y J. J. Sullivan. 2001. The impact of herbivory an plant in different resource conditions: A meta-analysis. Ecology 82: 2045-2058. Hendrix, S. D. 1988. Herbivory and its impact on plant reproduction. Pages 246-263 in J. LovettDoust y L. Lovett-Doust, editores. Plant reproductive ecology, patterns and strategies. Oxford University Press, Oxford. Herrera, C. M. 1993. Selection on floral morphology and environmental determinants of fecundity in hawk moth-pollinated violet. Ecological Monographs 63:251-276. Herrera, C. M. 1996. Floral traits and plant adaptation to insect pollinators: a devil's advocate approach. Páginas 65-87 in D. G. Lloyd y S. C. H. Barret, editores. Floral Biology. Studies on floral evolution in animal-pollinated plants. Chapman & Hall, New York. Hilbert, D. W., D. M. Swift, J. K. Detling, y M. I. Dyer. 1981. Relative growth rates and the grazing optimization hypothesis. Oecologia 51:14-18. Hoffmann, A. A. y M. J. Hercus. 2000. Environmental stress as an evolutionary force. BioScience 50: 217-226. Honkanen, T., y E. Haukioja. 1998. Intra-plant regulation of growth and plant-herbivore interactions. Ecoscience 5:470-479. Karlsson, P. S., y A. Jacobson. 2001. Onset of reproduction in Rhododendron lapponicum: The effect of shoot size, age, and nutrient status at two subarctic sites. Oikos 94:279-286. Klinkhamer, P. G. L., y T. J. de Jong. 1993. Phenotypic gender in plants: effects of plant size and environment on allocation to seeds and flowers in Cynoglossum officinale. Oikos 67: 81-86. Klinkhamer, P. G. L., T. J. de Jong, y H. Metz. 1997. Sex and size in cosexual plants. Trends in Ecology and Evolution 12: 260-265. LaBarbera, M. 1989. Analyzing body size as a factor in ecology and evolution. Annual Review of Ecology and Systematics 20: 97-117. 78 Little, R. C., G. A. Milliken, W. W. Stroup, y R. D. Wolfinger. 1996. SAS System for mixed models. SAS Institute Inc., Cary. Martínez, A. J. y J. López-Portillo. 2003. Growth and architecture of small honey mesquites under jackrabbit browsing: overcoming the disadvantage of being eaten. Annals of Botany 92: 365-375. Mayo, S. J., J. Bogner, y P.C. Boyce. 1997. The genera of Araceae. Royal Botanic Gardens, Kew. Mazer, S. J. 1992. Environmental and genetic sources of variation in floral traits and phenotypic gender in wild radish: consequences for natural selection. Páginas 281-325 in R. Wyatt, editor. Ecology and evolution of plant reproduction: new approaches, New York. McNaughton, S. J. y F. S. Chapin. 1985. Effects of phosphorus nutrition and defoliation on C4 graminoids from the Serengeti plains. Ecology 66: 1617-1629. Obeso, J. R. 1993. Does defoliation affect reproductive output in herbaceous perennials and woody plants in different ways? Functional Ecology 7: 150-155 Obeso, J. R. 2002. The cost of reproduction in plants. New Phytologist 155: 321-348. Orcutt, D. M. y E. T. Nilsen. 2000. The physiology of plant under stress. Soil and biotic factor. John Wiley & Sons, Inc., New York. Paige, K. N. y T. G. Whitham. 1987. Overcompensation in response to mammalian herbivory: the advantage of being eaten. American Naturalist 129:407-116. Proctor, M., P. Yeo, y A. Lack. 1996. The natural history of pollination. Harper Collins Publishers, London. Parra-Tabla, V., V. Rico-Gray, y M. Carvajal. 2004. Effect of defoliation on leaf growth, sexual expresión and reproductive success of Cnidoscolus aconitifolius (Euphorbiaceae). Plant Ecology 173: 153-160. Parra-Tabla, V. y S. H. Bullock. 2003. Exploring the limiting causes of fruit production in the tropical tree Ipomoea wolcottiana (Convolvulaceae). Plant Ecology 166: 107-115. Pellmyr, O. 1992. Evolution of insect pollination and angiosperm diversification. Trends in Ecology and Evolution 7: 46-49. Pilson, D. 1992. Insect distribution patterns and the evolution of host use. Páginas 120-139 in R. S. Fritz y E. L. Simms, editores. Plant resistance to herbivores and pathogens. University of Chicago Press, Chicago. Richards, A. J. 1986. Plant Breeding Systems. George Allen & Unwin, Boston. 79 Silvertown, J. W. y Lovett-Doust, J. 1993. Introducción to plant population biology. Blackwell, Oxford. Stephenson, A. G. 1981. Flower and fruit abortion: proximate causes and ultimate functions. Annual Review of Ecology and Systematics 12: 253-279. Strauss, S. Y. 1997. Floral characters link herbivores, pollinators and plant fitness. Ecology 78: 1640-1645. Strauss, S. Y., J. K. Conner, y S. L. Rush. 1996. Foliar herbivory affects floral characters and plant attractiveness to pollinators: implications for male and female plant fitness. American Naturalist 147:1098-1107. Strauss, S. Y., J. K. Conner, y K. P. Lehtila. 2001. Effect of foliar herbivory by insects on the fitness of Raphanus raphanistrum: damage can increase male fitness. American Naturalist 158:498-504. Sugiyama, S. y F. A. Bazzaz. 1998. Size dependence of reproductive allocation: The influence of resource availability, competition and genetic identity. Functional Ecology 12:280-288. Wilson, P. y J. D. Thomson. 1996. How do flowers diverge? Páginas 88-111 in D. G. Lloyd & S. C. H. Barrett, editores. Floral Biology. Studies on Floral Evolution in Animal-Pollinated Plants. Chapman & Hall, New York. Wyatt, R. 1983. Pollinator-Plant interactions and the Evolution of Breeding Systems. Páginas 5195 in L. Real, editor. Pollination Biology. Academic Press, Orlando. Zar, J. H. 1984. Biostatical Analysis. Prentice-Hall. New Jersey. 80 Tabla 1. Comparación entre los diseños anidado y libre empleados en el análisis del despliegue floral y asignación sexual de A. schlechtendalii. Se muestran la estimación de la bondad de ajuste para cada variable principal en ambos diseños, los grados de libertad (df), el Ji-cuadrado (χ2). Modelo Modelo anidado Libre Espádices (no.) 219 218. 36 1.0 ns Proporción de biomasa hermafrodita (gr. hermafrodita/ gr. totales) 169 186 65 17.1 ns Proporción de flores hermafroditas (no. hermafrodita / flores totales) 185 191 65 5.7 ns Longitud espádice (mm) 1686 1696 26 10.3 ns Longitud pedúnculo (mm) 2258 2291 26 32.8 ns Variable df χ2 ns = diferencias no significativas (α < 0.05) 81 Tabla 2. Análisis del despliegue floral y asignación reproductiva de A. schlechtendalii. Se presentan la proporción F (con error tipo III para muestras desbalanceadas), su probabilidad asociada para cada variable en el diseño libre de anidamientos. Zona Variables Herbivoría Área foliar F P F P F P Espádices (no.) 10.28 <0.0001 0.33 0.5638 0.48 0.4915 Biomasa hermafrodita (gr. hermafrodita/ gr. totales) 9.74 <0.0001 1.06 0.3046 18.99 <0.0001 Flores hermafroditas (no. hermafrodita / no. totales) 5.18 0.0065 1.87 0.1730 7.71 0.0060 Longitud espádice (mm) 0.61 0.5469 0.47 0.4922 89.29 <0.0001 Longitud pedúnculo (mm) 4.19 0.0166 4.06 0.0453 66.32 <0.0001 82 Tabla 3. Características de despliegue floral y asignación sexual de A. schlechtendalii para cada zona de estudio. Entre paréntesis se muestra el intervalo de 95 % de confianza para cada promedio. Las letras indican diferencias entre las medias (P < 0.05, Bonferroni test). Variables Duna costera Selva caducifolia espinosa Selva mediana Espádices (no.) 1.55 a (1.37-1.73) 0.93 b (0.76-1.10) 0.70 c (0.50-0.89) Proporción de biomasa hermafrodita (gr. hermafrodita/ gr. totales) 0.57 a (0.54-0.60) 0.52 b (0.48-0.56) 0.46 c (0.42-0.49) Biomasa total de espádice 0.62 (0.59-0.66) 0.62 (0.56-0.68) 0.58 (0.54-0.63) Proporción de flores hermafroditas (no. hermafrodita / no. totales) 0.35 a (0.32-0.38) 0.31 b (0.27-0.35) 0.27 b (0.23-0.29) Flores totales 674 (648-700) 686 (652-720) 728 (694-762) Longitud espádice (mm) 88.25 a (83.11- 93.39) 89.63 a (81.82-97.45) 83.36 a (76.45-90.27) Longitud pedúnculo (mm) 379.80 a (356.42-403.18) 417.30 b (380.34-454.26) 380.93 ab (344.44-417.42) Herbivoría (%) 3 a (2-3) 16 b (13-18) 14 b (12-17) Área foliar (cm2) 2236.92 a (1967.71-2506.14) 2094.16 a (1792.1-2396.22) 2321.92 a (1943.05-2700.78) 83 I II III Figura 1. Ubicación de las zonas y los sitios con poblaciones de A. schlechtendalii en dónde se realizó el estudio. (I) duna costera; (II) selva caducifolia espinosa; (III) selva mediana. Los triángulos señalan la ubicación de los sitios en cada zona. 84 (a) (b) ♂ ♀+♂ Figura 2. Anthurium schlechtendalii. (a) Planta reproductiva. (b) Secciones de la inflorescencia: (♀ + ♂) indica la sección de flores que madura como femeninas y después como masculinas; (♀) indica la sección de flores que únicamente maduran como masculinas. 85 Capítulo V. Discusión General 86 Generalmente se considera que la herbivoría tiene un impacto importante, ya sea negativo o positivo, sobre el crecimiento y la reproducción de las plantas. Sin embargo, las condiciones ambientales en las que se desarrolla una planta pueden actuar como una fuerza que determina la intensidad de la herbivoría, pero que también influye sobre la forma en que la planta responde ante los daños (Coley et al. 1985, Brooker y Callaghan 1998, Loreau y de Mazancourt 1999). La hipótesis base de la presente tesis señala que la herbivoría en A. schlechtendalii tiene un efecto negativo sobre crecimiento y reproducción, el cual sin embargo, depende del ambiente en el que la planta crece. Esta hipótesis predice que la herbivoría, cuando es alta, limita el crecimiento y la reproducción, pero si la planta se encuentra en un ambiente con abundantes recursos (agua y nutrientes minerales), entonces compensará mejor el daño (vía crecimiento y reproducción) que aquellas plantas de ambientes pobres. Sin embargo, si un ambiente es rico en recursos, probablemente sostenga una mayor abundancia de herbívoros y por lo tanto, las plantas de tal ambiente presentarán mayor herbivoría que aquellas de sitios pobres y con pocos herbívoros. El ambiente es uno de los principales factores que determinan los caminos por donde las interacciones biológicas transitan ecológica y evolutivamente. No se puede avanzar en el conocimiento de la interacción que ocurre entre plantas y herbívoros si no se aborda desde una perspectiva de variación espacial que integre el efecto de los elementos que componen la matriz ambiental (Thompson 1999). En general, los resultados sugieren que la herbivoría tiene un efecto negativo en la reproducción, pero no en el crecimiento de A. schlechtendalii y que este efecto depende fuertemente del ambiente en el que la planta se desarrolla. En el Capítulo II se observó una importante variación entre poblaciones en características de crecimiento, reproducción y herbivoría, así como, en la abundancia de herbívoros potenciales de esta planta y aspectos climáticos-edáficos. Se registró un patrón de herbivoría entre zonas, siendo las zona con mayor abundancia de recursos para las plantas, la de mayor abundancia de herbívoros y por ende de mayor herbivoría. La zona que puede ser considerada como intermedia en recursos presentó menos herbívoros y menos herbivoría que la zona más abundante. La zona más pobre en recursos presentó considerablemente menor herbivoría que las otras dos zonas. Este patrón concuerda con un menor despliegue floral en las zonas de mayor herbivoría y mayor despliegue en la zona con menor herbivoría. Estos resultados sugirieron un considerable efecto inhibitorio de la herbivoría sobre la floración de A. schlechtendalii. El crecimiento, sin embargo, 87 es un elemento de la adecuación de la planta que no parece ser limitado por la herbivoría ni por la zona en la que crece la planta. En base a lo anterior se exploró experimentalmente (Capítulo III) el efecto de la herbivoría sobre el crecimiento y la reproducción poniendo a prueba dos hipótesis: Maschinski & Whitham (1989) sobre la capacidad de la planta de compensar mejor la herbivoría a mayor abundancia de recursos y la de Hilbert et al. (1981) sobre la capacidad compensatoria de la planta en relación a su tasa de crecimiento determinada por el ambiente y a la intensidad de la herbivoría. Los resultados mostraron un claro compromiso o disyuntiva entre el crecimiento y el despliegue floral de A. schlechtendalii. El crecimiento se mantuvo independientemente de las condiciones ambientales y del nivel de herbivoría, pero a costa de limitar el despliegue floral. Este compromiso entre crecimiento y despliegue floral puede constituir una estrategia en esta especie a través de la cual hace frente a la constante herbivoría a lo largo de su ciclo de vida. En estos experimentos fue evidente que la respuesta ante la disminución del área foliar cambió en función del ambiente. Cuando las plantas experimentaron no limitación de recursos, como en los experimentos de jardín común, la herbivoría inhibió el despliegue floral en la primera temporada del experimento y en el más alto nivel de daño. Esto sugiere una inercia en las respuestas de la planta debido a su historia ambiental y de herbivoría. Cuando las plantas crecen en diferentes ambientes, como en los experimentos de campo, el despliegue floral fue inhibido en la segunda temporada del experimento desde niveles intermedios de daño. De esta parte del trabajo se puede concluir que el efecto de la herbivoría cambia en función del ambiente sobre el compromiso entre producir hojas o inflorescencias y que, en el corto plazo, A. schlechtendalii apuesta a un mayor crecimiento en vez de una mayor reproducción. Este aparente sacrificio podría representar un aumento en las probabilidades de éxito en futuras estaciones reproductivas ya que cada hoja eventualmente sostiene (estructuralmente y probablemente con recursos) a una inflorescencia por lo que, mantener la producción actual de hojas significaría mantener las oportunidades futuras de reproducción. Al evaluar el efecto de la herbivoría y del ambiente sobre características específicas del despliegue floral y asignación sexual (Capítulo IV) se observó que el ambiente donde la planta se desarrolla, así como el tamaño de la planta, son factores que se reflejan fuertemente en las características florales de A. schlechtendalii. En particular se observaron diferencias en el número de inflorescencias y en la asignación de flores hermafroditas/masculinas entre ambientes. Las 88 plantas presentaron más flores por inflorescencia y también más flores hermafroditas en el ambiente más pobre. Por el contrario, menos inflorescencias y menos flores hermafroditas en los ambientes más abundantes de recursos. Aunque el nivel de herbivoría es contrastante entre ambientes, no se observó un efecto sobre las características florales, pero sí se observó un efecto positivo del tamaño de la planta. Una conclusión que se deriva de este capítulo es la importancia del tamaño de la planta y de la variación espacial entre grandes zonas ambientales sobre el despliegue floral y la asignación sexual de A. schlechtendalii. En este punto y con la evidencia observada en el capítulo III se puede sugerir que, aunque experimentalmente la herbivoría sí muestra un efecto limitante en la reproducción, éste podría ser encubierto por el impacto del ambiente en el que la planta se desarrolla, así como por el tamaño que alcanza. De esta tesis se puede concluir que: (1) existe un efecto limitante de la herbivoría sobre el desempeño de A. schlechtendalii, el cual es evidente en el compromiso generado entre crecimiento y reproducción; es decir, se limita el despliegue floral pero se mantiene el crecimiento. (2) Las respuestas ante la herbivoría están mediadas por el ambiente y por el tamaño de la planta, constituyéndose como factores clave en la reproducción de A. schlechtendalii. (3) El ambiente puede también modifica el compromiso entre crecimiento y reproducción. En un ambiente pobre en recursos puede acrecentar el compromiso entre estas funciones y, por el contrario, en un ambiente rico lo puede relajar. Esto probablemente genere diferentes historias ecológicas entre las poblaciones de esta especie. Finalmente, los trabajos realizados sobre el impacto de la herbivoría sobre algún elemento de adecuación de la planta se circunscriben a condiciones ambientales específicas (un ambiente o una población; ver Belsky 1986; Hawkes & Sullivan, 2001). El mayor aporte de la presente tesis fue mostrar que las respuestas de las plantas ante la herbivoría cambian en función de la heterogeneidad ambiental, por lo que es importante tomar en cuenta tal variación a fin de alcanzar conclusiones con validez externa robusta y entender cómo un interacción ocurriendo en un amplio rango de poblaciones, puede dar como resultado una diversidad de historias ecológicas que podrían representar la materia prima para la diversificación evolutiva entre poblaciones. 89 Referencias Belsky, A. J. 1986. Does herbivory benefit plants? A review of the evidence. American Naturalist 127: 870-892. Brooker, R. W., y T. V. Callaghan. 1998. The balance between positive and negative plant interactions and its relationships to environmental gradients: a model. Oikos 81:196-207. Coley, P. D., J. P. Bryant, y F. S. Chapin III. 1985. Resource availability and plant antiherbivore defence. Science 230:895-899. Hawkes, C. V., y J. J. Sullivan. 2001. The impact of herbivory an plant in different resource conditions: A meta-analysis. Ecology 82: 2045-2058. Hilbert, D. W., D. M., Swift, J. K., Detling, y M. I. Dyer. 1981. Relative growth rates and the grazing optimization hypothesis. Oecologia 51: 14-18. Loreau, M., y C. de Mazancourt. 1999. Should plants in resource-poor environments invest more in antiherbivore defence. Oikos 87:195-200. Maschinski, J., y T. G. Whitham. 1989. The continuum of plant responses to herbivory: the influence of plant association, nutrient availability, and timing. American Naturalist 134: 1-19. Thompson, J. N. 1999. What we know and do not know about coevolution: insect herbivores and plants as a test case. Pp. 7-30 in H. Olff, V. K. Brown, y R. H. Drent, editores. Herbivores: between plants and predators. Blackwell, Oxford. 90