Movilidad Bacteriana - Universidad de Granada
Anuncio

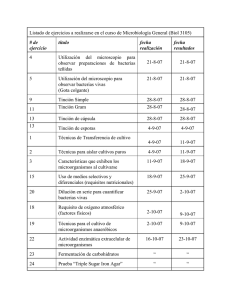
Prácticas Online de Microbiología para Farmacéuticos > | Universidad de Granada Inicio Prácticas de Microbiología Prácticas de Bacteriología Introducción a la microscopía. Técnicas de observación de los microorganismos Movilidad Bacteriana Movilidad Bacteriana Universidad de Granada Objetivos de la práctica Introducción Partes de la práctica : Métodos de Tinción Observación al microscopio Tinción de Gram Tinción de endosporas Tinción de ácido-alcohol resistencia Movilidad Autoevaluación Volver a: Inicio de Prácticas de Bacteriología Volver a: Inicio de Prácticas ¿Como se mueven las bacterias? Aunque hay excepciones el órgano responsable es el flagelo. El flagelo bacteriano solo tiene en común con el flagelo eucariota su función de movilidad. Encontrará información más completa sobre la movilidad de las bacterianas en los apuntes on line del Profesor E. Iañez. La rotación del flagelo en un sentido u otro afecta a la dirección del movimiento de la bacteria. Este puede ser lineal o resultado de una sucesión de carreras o volteretas. 2 En este video de la Society for General Microbiology expuesto en YouTube se explica claramente (en inglés) los diferentes medios de locomoción de las bacterias incluyeno las precauciones que imponen las corrientes y el movimiento browniano en las interpretaciones de las imágenes al microscopio, como se detalla y se aprende en esta práctica \ \¿Qué ventajas aporta la movilidad a las bacterias? El desplazamiento orientado en respuesta a estímulos externos de tipo físico o químico (quimiotaxis). Observación microscópica de la movilidad de las bacterias Se hace con suspensiones en agua sin teñir (preparaciones “en fresco”). Puede hacerse en suspensiones “ entre portaobjetos y cubreobjetos” o en “ gota pendiente”. Como precauciones utilizar un cultivo joven en fase exponencial de crecimiento. Los flagelos se desprenden con facilidad de la célula. Por tanto no extender ni agitar con el asa. Movilidad entre porta y cubreobjetos Si la bacteria está en un medio líquido, depositar una gota sobre el portaobjetos con ayuda del asa en forma análoga a como se hace para preparar una tinción partiendo de cultivos en medio líquido. Si se parte de un cultivo sólido, depositar una gota de agua sobre el portaobjetos. Recoger una alícuota del cultivo y suspenderla en una gota de agua. Puede convenir añadir solución salina estéril e incubar durante 1-2 horas: las bacterias se suspenden en la solución, que después es utilizada como si se tratara de un cultivo en medio líquido. Colocar sobre la preparación un cubreobjetos evitando atrapar aire. No comprimir. Será posible observar la movilidad mientras se mantenga agua entre ambas superficies. Depositar una gota de aceite de cedro sobre el cubreobjetos. Observar con objetivo de inmersión. Ajustar la cantidad de luz bajando el condensador: Al no estar las células teñidas hay poco contraste que hay las células y el agua, un exceso de luz impide observar las células como siluetas oscuras. Resultado Distinguir el movimiento debido a flagelos (caótico e irregular), del movimiento debido a las corrientes (todas las células se desplazan en la misma dirección) y del movimiento browniano ( de las partículas inertes de pequeño tamaño cuando se encuentra suspendidas (movimiento vibratorio e irregular). Al concluir la observación, depositar la preparación en los recipientes destinados al material de deshecho. Imagen o vídeo. Movilidad en gota pendiente Mediante esta técnica se evitan las corrientes, que las preparaciones se sequen pronto. La gota presenta además multitud de planos de enfoque, con lo cual resulta más fácil la observación. Hacer la suspensión bacteriana sobre un cubreobjetos. Parafinar (untar con vaselina) los bordes de la excavación de un portaobjetos de Koch. Con el porta invertido presionar sobre el cubre hasta que se adhiera. Darle la vuelta. Resultado Resultado Observar al microscopio con objetivo de inmersión y condensador bajo. Al concluir desprender el cubreobjetos y depositarlo en los recipientes destinados al material de deshecho. Movilidad sobre medios sólidos. Las bacterias del genero Proteus pueden invadir toda la superficie del medio sólido si no se encuentra muy seca. Este crecimiento invasor es característico de estas bacterias. S. aureus (arriba) crece localizado en la zona de inoculación. Las cepas de Proteus (abajo) invaden toda la superficie del medio (se aprecian las ondas de crecimiento en respuesta al agotamiento de nutrientes)-Este fenómeno dificulta el aislamiento de bacterias (practica numero 4) cuando en la muestra se encuentran estas bacterias. Movilidad en medios semisólidos Si los medios de cultivo no tienen excesiva viscosidad, con relativa frecuencia las bacterias móviles pueden desplazarse en su interior. Se crea una zona de turbidez en la zona ocupada por las bacterias. Sembrar por picadura con ayuda de un hilo de platino un tubo con un medio semisólido. Incubar el tiempo y temperatura necesarios para el desarrollo del microorganismo. Resultado Observar si el crecimiento bacteriano aparece exclusivamente en la zona de la picadura (el recorrido del hilo de platino) -bacteria inmóvil), o en una zona difusa alrededor de ésta (bacteria móvil). Al concluir desprender el cubreobjetos y depositarlo en los recipientes destinados al material de deshecho. Objetivos de la práctica Introducción Partes de la práctica : Métodos de Tinción Observación al microscopio Tinción de Gram Tinción de endosporas Tinción de ácido-alcohol resistencia Movilidad Autoevaluación Volver a: Inicio de Prácticas de Bacteriología Volver a: Inicio de Prácticas | | Accesibilidad | Política de privacidad CEI BIOTIC | © 2016 | Universidad de Granada Universidad de Granada