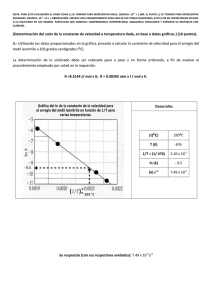
velocidad de reacción
Anuncio

Iniciación a la Química- 2005 1. Clasifique los siguientes Ácido A Ka 1,6.10-3 Determine sus pKas SOLUCIÓN: Orden 1º A 2º B 3º D 4º C Problemas. Capítulo 4 y equil. ácido-base ácidos por orden de fuerza: B C D 9.10-4 2.10-6 3.10-4 pKa 2,8 3,0 3,5 5,7 2. La penicilina, de masa molecular 365 g/mol, es un antibiótico muy utilizado para tratar enfermedades bacterianas y es un ácido débil. Su Ka tiene un valor de 1,7.10-3. Calcule [H+] de una disolución preparada añadiendo agua hasta 725 mL a las siguientes cantidades: a) 0,187 mol; b)127 g. SOLUCIÓN: Penicilina=PenH PenH(aq) +H20(l) Pen-(aq) + H3O+(aq) − + Pen H 3O Ka = [PenH ] Determinación de concentraciones en el equilibrio: a) [Pen]0=0,187mol/0,725 L = 0,258 M [PenH] [Pen-] [H3O+] Inicial 0,258 0 0 Cambio -x x x Final 0,258-x x x x.x = 1,7.10 −3 ; Ka = 0,258 − x Aproximación : 100.Ka = 100. 1,7.10-3 = 0,17 100.Ka < [A]0?; 0,17< 0,258 0,258-x x2 = 0,258 x 1,7.10-3; x= 2,1.10-2 M x=2,1.10-2 =[H3O+] [ ][ ] b) [Pen]0=(127 g/365 g/mol)/0,725 L = 0,480 M [PenH] [Pen-] [H3O+] Inicial 0,480 0 0 Cambio -x x x Final 0,480-x x x Iniciación a la Química- 2005 Problemas. Capítulo 4 y equil. ácido-base x.x = 1,7.10 −3 ; 0,480 − x Por las mismas razones que en el apartado anterior: 100.Ka < [A]0?; 0,17< 0,480 0,480-x x= 2,9.10-2 M=[H3O+] Ka = 3. El ácido barbitúrico (Ka= 1,1.10-4) se emplea en la fabricación de algunos calmantes. Para una disolución de ácido barbitúrico 0.679 M. Calcule: a) [H+]; b) pH, c) [OH-], d)% de ionización SOLUCIÓN: El razonamiento es equivalente al del problema anterior: Ácido barbitúrico= BarH BarH(aq) +H20(l) Bar-(aq) + H3O+(aq) − + Bar H 3O Ka = [BarH ] [BarH] [Bar-] [H3O+] Inicial 0,679 0 0 Cambio -x x x Final 0,679-x x x x.x = 1,1.10 −4 ; Ka = 0,679 − x Aproximación : 100.Ka = 100. 1,1.10-4 = 0,011 100.Ka < [A]0?; 0,011< 0,679 0,679-x x2 = 0,679 x 1,1.10-4; x= 7,5.10-5 M a) x=8,6.10-3 =[H3O+] b) pH= -log 8,6.10-3= 2,1 c) pOH= 14,0-pH= 14,0 -2,1= 11,9 [OH-]=10-11,9= 1,3.10-12 M d) de 0,679 M iniciales se han ionizado 8,6.10-3 % = (8,6.10-3/0,679)x100 = 1,3% el grado de disociación, α = 0,013 [ ][ ] 4. La Ka del NH4+ es 5,6.10-10 . Calcule el pH de una disolución de cloruro de amonio 0,39 M en agua. SOLUCIÓN: Disociación de la sal en agua: NH4Cl(aq) NH4+(aq) +Cl-(aq) El anión cloruro que proviene de un ácido muy fuerte frente al agua, será una base muy débil frente a esta y no aceptará protones de ella en cantidad apreciable. El amonio, cuya base conjugada es débil (amoniaco), actuará como ácido frente al agua con fortaleza apreciable, de forma que hemos de considerar el equilibrio: NH4+ (aq) +H20(l) NH3 (aq) + H3O+(aq) Iniciación a la Química- 2005 Ka = [NH 3 ][H 3O + ] = 5,6.10-10 Problemas. Capítulo 4 y equil. ácido-base [NH ] + 4 Puesto que la sal es totalmente soluble, la concentración inicial de ión amonio = 0,39 M [NH4+] [NH3] [H3O+] Inicial 0,39 0 0 Cambio -x x x Final 0,39-x x x x.x = 5,6.10 −10 ; Ka = 0,39 − x Aproximación : 100.Ka = 100. 5,6.10-10 = 5,6.10-8 100.Ka < [A]0?; 5,6.10-8<<<< 0,39 0,39-x 9 2 x = 0,39 x5,6.10-10; x= 1,5.10-5 M a) x=1,5.10-5 =[H3O+] b) pH= -log 1,5.10-5= 4,8 5. Calcule el valor de Kb de la base conjugada de los a) Aspirina (analgésico) Ka= 3,6.10-4 b) Ibuprofeno (analgésico) Ka = 2,5.10-5 SOLUCIÓN: De forma general: AH (aq) +H20(l) A- (aq) + H3O+(aq) A (aq) +H20(l) AH (aq) + OH-(aq) 2H20(l) H3O+(aq + OH-(aq) siguientes ácidos: -ácido; Ka -base ; Kb Kw Ka x Kb=Kw pKa + pKb=pKw a) pKa= -log(3,6.10-4) = 3,4 14,0 -3,4= 10,6 = pKb Kb = 10-10,6 = 2,5.10-11 b) pKa= -log(2,5.10-5) = 4,6 14,0 -4,6 = 9,4 = pKb Kb = 10-9,4 = 4,0.10-10 6. Calcule el valor de Ka del ácido conjugado de las siguientes bases: a) Morfina (opiáceo) Kb = 7,4.10-7 b) Efedrina, (empleada como descongestionante) Kb= 1,4.10-4 SOLUCIÓN: El razonamiento es idéntico al del problema anterior a) pKb= -log(7,4.10-7) = 6,1 14,0 -6,1= 7,9 = pKa Ka = 10-7,9 = 1,4.10-8 b) pKb= -log(1,4.10-4) = 3,9 14,0 – 3,9 = 10,1 = pKa Ka = 10-10,1 = 7,1.10-11 Iniciación a la Química- 2005 Problemas. Capítulo 4 y equil. ácido-base 7. La codeína (Cod), un analgésico fuerte y adictivo, es una base débil. a) Escriba la reacción que muestra que su comportamiento frente al agua es básico. Represente la molécula de codeína como Cod. b) Si el valor de Ka para su ácido conjugado es 1,2.10-8 ¿cuál es el valor de Kb de la reacción del apartado anterior? c) ¿cuál es el pH de una disolución 0,0020 M de codeína? SOLUCIÓN: a) Cod (aq) +H20(l) CodH+ (aq) + OH-(aq) -base ; Kb b) CodH+ (aq) +H20(l) Cod (aq) + H3O+(aq) -ácido; Ka=1,2.10-8 pKa= -log(1,2.10-8) = 7,9 14,0 – 7,9 = 6,1 = pKb Kb = 10-6,1 = 8,3.10-7 c) [Cod] [CodH+] Inicial 0,0020 0 Cambio -x x -3 Final 2,0.10 -x x x.x = 8,3.10 −7 ; Kb = 2,0.10 −3 − x [OH-] 0 x x Aproximación : 100.Kb = 100. 8,3.10-7 = 8,3.10-5 100.Kb < [A]0?; 8,3.10-5<<<< 0,0020 0,0020-x x2 = 0,0020 x8,3.10-7; x= 4,1.10-5 M = [OH-] pOH= 4,4 pH= 9,6 [H3O+]= 2,4.10-10 M !" 8. Indique si las disoluciones 1 M de estas sales son ácidas, básicas o neutras: a)SrCl2, b) NH4CN, c) KF, d)NaNO3 e) Li2SO3; f) Na3PO4; g) NaHCO3 SOLUCIÓN: Todas son sales solubles. Hay que analizar los iones en disolución y decidir si provienen de ácidos fuertes o débiles o de bases fuertes o débiles. a) Sr2+(aq) + 2Cl-(aq) provienen respectivamente de bases y ácidos muy fuertes, por lo que no alteran el pH de la disolución inicial (agua) b) NH4+(aq)+CN-(aq) que provienen de base y de ácido débil respectivamente. El carácter ácido o básico dependerá de la fortaleza relativa de sus constantes de acidez y basicidad. Si buscamos en las tablas de los libros de texto recomendados encontramos: Ka(NH4+) = 5,6 .10-10 Iniciación a la Química- 2005 c) d) e) f) g) Problemas. Capítulo 4 y equil. ácido-base Kb(CN-)=2,5.10-5 La tendencia del amonio para producir protones en agua es menor que la tendencia del cianuro para producir OH- en agua. Por tanto en cantidades equimolares, como es el caso (la sal es 1:1) la disolución será básica. K+ (aq)+ F- (aq) provienen respectivamente de bases y ácidos muy fuertes, por lo que no alteran el pH de la disolución inicial (agua) Na+ (aq) + NO3- (aq) provienen respectivamente de bases y ácidos muy fuertes, por lo que no alteran el pH de la disolución inicial (agua) 2Li+(aq) + SO32- (aq). El catión litio, como todos los alcalinos y los alcalinotérreos provienen de bases muy fuertes, por lo que su tendencia para reaccionar con agua es mínima. El anión sulfito, proviene del ácido bisulfito HSO3- que no es un ácido fuerte. Hemos de mirar en tablas y ver que la tendencia a reaccionar con H20(l) del anión sulfito para producir bisulfito es 1,6.10-7. Por tanto la disolución será básica. SO32- (aq) +H20(l) HSO3- (aq) + OH-(aq) 3Na+ (aq) + PO43-(aq). Estamos en la misma situación anterior. El catión sodio, no ioniza el agua. Si miramos en tablas la Ka del ácido monohidrógenofosfato, de donde proviene el anión fosfato, veremos que tiene un valor de 3,6.10-13. Lo cual quiere decir que la tendencia del anión fosfato a dar monohidrógenofosfato tiene una constante Kb de 2,8.10-2, relativamente alta. Es decir la disolución será claramente básica, porque la reacción PO43- (aq) +H20(l) HPO42- (aq) + OH-(aq) tiene tendencia a darse. El bicarbonato sódico se disuelve en agua produciendo iones sodio y bicarbonato: Na+ (aq) + HCO3- (aq). Mientras que el catión sodio es estable en agua, el anión bicarbonato es una sustancia anfótera: tanto puede tomar del agua un protón para convertirse en ácido carbónico H2CO3 (aq), con una constante Kb= 2,4.10-8, como puede ceder un protón al agua para convertirse en anión carbonato, CO32- (aq), con una constante de acidez Ka= 4,8.10-11. Si comparamos estos dos números encontramos para el ión bicarbonato que, frente al agua, la tendencia a dar iones OH- es mayor que la tendencia a dar iones hidronio. Por tanto la disolución de esta sal será básica. CINÉTICA QUÍMICA 9. Los siguientes datos se refieren a una reacción hipotética A→ B+C t(s) 0 2,0 4,0 5,0 8,0 10,0 [B] 0 0,100 0,140 0,150 0,165 0,175 a) Represente los datos de la variación de la concentración con el tiempo. b) Dibuje una tangente a la curva obtenida para obtener la velocidad instantánea a los 6 min. c) Calcule la velocidad media en el intervalo de 4 a 8 minutos Iniciación a la Química- 2005 Problemas. Capítulo 4 y equil. ácido-base d) Compare la velocidad instantánea a los 6 min y la velocidad media en el intervalo de los 6 min. [B] velocidad de reacción 0,2 0,18 0,16 0,14 0,12 0,1 0,08 0,06 0,04 0,02 0 Serie1 0 1 2 3 4 5 6 7 8 9 10 11 t(s) a) Pendiente de la tangente a la curva en el punto t=6, es el valor de la derivada de la curva en es punto tg 5- 0,14)/(10,0-2,6) = 4,7.10-3 mol.L-1 s-1= velocidad de reacción instantánea. b) v = (0,165-0,140)/(8,0-4,0) = 6,3 10-3 mol.L-1 s-1 c) No coinciden exactamente. Para determinar velocidades instantáneas mediante ∆[B]/∆t, los intervalos de tiempo han de ser muy pequeños respecto al tiempo total de la reacción. #%$'&(*),+ 10. Una reacción tiene dos reactivos A y B. Determine cual es el orden parcial de la reacción respecto a cada uno de los reactivos y el orden total de la reacción si se tuvieran las siguientes ecuaciones de velocidad: v = k1[A]3; v = k2[A][B] ; v = k3[A][B]2; v = k4[B] En que unidades se expresarían estas constantes de velocidad, si la velocidad se expresa en mol.L-1s-1 SOLUCIÓN: a) Orden parcial respecto a A, 3. Orden total 3 Unidades de k1; (mol/L)-2.s-1 b) Orden parcial respecto a A, 1. Orden parcial respecto a B, 1. Orden total 2 Unidades de k2; (mol/L)-1.s-1 c) Orden parcial respecto a A, 1. Orden parcial respecto a B, 2. Orden total 3 Unidades de k3; (mol/L)-2.s-1 d) Orden parcial respecto a A, 0. Orden parcial respecto a B, 1. Orden Iniciación a la Química- 2005 Problemas. Capítulo 4 y equil. ácido-base total 1 Unidades de k4; s-1 11. Los siguientes datos se obtuvieron para la descomposición en fase gaseosa del acetaldehído. k (L mol-1 s-1) 0,0105 0,101 0,60 2,92 T(K) 700 750 800 850 Represente el lnk frente a 1/T y determine el valor de la energía de activación. Arrhenius 2 1 10 lnk 3 0 -1 1 1,1 1,2 1,3 1,4 1,5 Serie1 -2 -3 -4 -5 1/T (K-1) - Pendiente de la recta -2,23.104 =- Ea/R R= 8,306 J/K.mol Ea= 1,85.105 J/mol =185 kJ/mol 12. Para la reacción HI(g) + CH3I(g)→ CH4(g) + I2(g) la constante de velocidad es 0,28 L mol-1 s-1 a 300 ºC y 0,0039 L mol-1 s-1 a 227 ºC. a) ¿cuál es la energía de activación de la reacción? b) ¿cuál es el valor de la k a 400 ºC? SOLUCIÓN: ln k = ln A − a) ln k1 − ln k 2 = ln0,28-ln0,0039 = 4,27 x Ea RT Ea E E 1 1 − a = a( − ) RT2 RT1 R T2 T1 Ea 1 1 Ea 2,54.10-4 − = R 273 + 227 273 + 300 R 8,306/2,54.10-4 = 1,40.105 J/mol =140 kJ/mol b) ln0,28-lnk400= Ea 1 1 Ea − (-2,59.10-4) = R 273 + 400 273 + 300 R Iniciación a la Química- 2005 1,40.10 5 (2,59.10-4)- ln0,28 = 5,64 8,306 k400 =2,81.102 L mol-1 s-1 lnk400= Problemas. Capítulo 4 y equil. ácido-base