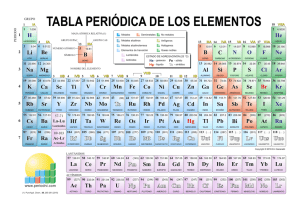
nº oxidacion elementos quimicos
Anuncio
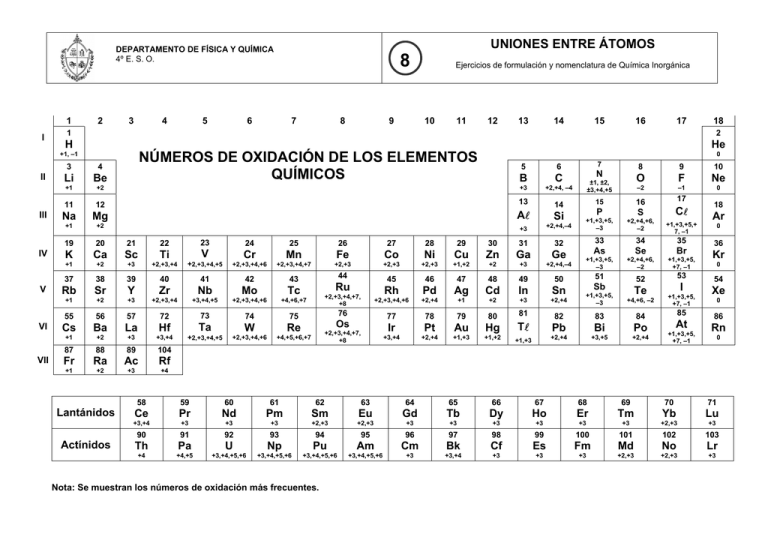
UNIONES ENTRE ÁTOMOS DEPARTAMENTO DE FÍSICA Y QUÍMICA 4º E. S. O. 1 I 2 3 4 III IV V VI VII 6 7 8 9 Ejercicios de formulación y nomenclatura de Química Inorgánica 10 11 12 13 14 15 16 17 18 1 2 H He +1, –1 II 5 8 3 4 Li Be +1 +2 0 NÚMEROS DE OXIDACIÓN DE LOS ELEMENTOS QUÍMICOS 5 6 B C +3 +2,+4, –4 11 12 13 Na Mg AA Si +1 +2 +3 +2,+4,–4 19 20 21 22 23 K Ca Sc Ti +1 +2 +3 +2,+3,+4 Fe Co Ni Cu Zn Ga Ge +2,+3,+4,+5 +2,+3,+4,+6 +2,+3,+4,+7 +2,+3 +2,+3 +2,+3 +1,+2 +2 +3 42 43 Tc +1 +2 +3 +2,+3,+4 +3,+4,+5 +2,+3,+4,+6 +4,+6,+7 55 56 57 72 73 74 75 Cs Ba La Hf Ta W Re +1 +2 +3 +3,+4 +2,+3,+4,+5 +2,+3,+4,+6 +4,+5,+6,+7 87 88 89 104 Fr Ra Ac Rf +1 +2 +3 +4 Lantánidos Actínidos 45 46 47 48 49 50 +2,+3,+4,+7, +8 Rh Pd Ag Cd In Sn +2,+3,+4,+6 +2,+4 +1 +2 +3 +2,+4 +1,+3,+5, –3 +4,+6, –2 76 77 78 79 80 81 82 83 84 Ir Pt Au Hg TA Pb Bi Po +3,+4 +2,+4 +1,+3 +1,+2 +1,+3 +2,+4 +3,+5 +2,+4 Ru Os +2,+3,+4,+7, +8 53 52 Sb Te 18 Ar +1,+3,+5,+ 7, –1 51 Mn Mo +2,+4,+6, –2 +1,+3,+5, +7, –1 Cr 41 +1,+3,+5, –3 CA +2,+4,+6, –2 V Nb S +1,+3,+5, –3 32 40 16 P +2,+4,–4 31 Zr 15 35 30 Y 0 17 Br 29 39 –1 –2 34 28 38 10 Ne Se 27 Sr 9 F 33 26 37 ±1, ±2, ±3,+4,+5 8 O As 25 Rb N 14 24 44 7 I +1,+3,+5, +7, –1 85 At +1,+3,+5, +7, –1 0 36 Kr 0 54 Xe 0 86 Rn 0 58 59 60 61 62 63 64 65 66 67 68 69 70 71 Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu +3,+4 +3 +3 +3 +2,+3 +2,+3 +3 +3 +3 +3 +3 +3 +2,+3 +3 90 91 92 93 94 95 96 97 98 99 100 101 102 103 Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr +4 +4,+5 +3,+4,+5,+6 +3,+4,+5,+6 +3,+4,+5,+6 +3,+4,+5,+6 +3 +3,+4 +3 +3 +3 +2,+3 +2,+3 +3 Nota: Se muestran los números de oxidación más frecuentes.