Impactos sobre la atmósfera. Contaminación
Anuncio

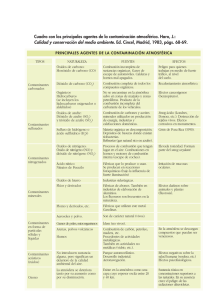
12.- RECURSOS ENERGÉTICOS RELACIONADOS CON LA ATMÓSFERA: ENERGÍA SOLAR Y ENERGÍA EÓLICA. ( se vio en temas anteriores). 12.1.- LA CONTAMINACIÓN DEL AIRE. ( libro de texto página 230) Cualquier condición atmosférica en la que ciertas sustancias o formas de energía alcanzan concentraciones elevadas sobre su nivel ambiental normal como para producir un efecto nocivo para los seres humanos, la vegetación o los animales Los contaminantes pueden ser naturales o artificiales y permanecer en la atmósfera por un tiempo determinado o indeterminado. Igualmente pueden ser sólidos, líquidos o gases. Para estudiar la contaminación debemos saber: 1.- Las fuentes de emisión. 2.- Analizar el comportamiento de esta sustancia en la atmósfera. 3.- Estudiar los efectos que produce. 12.1.A.- LOS CONTAMINANTES MÁS FRECUENTES Y SUS EFECTOS. FUENTES DE EMISIÓN CONTAMINANTES PRIMARIOS: Proceden directamente de la fuente de emisión CONTAMINANTES SECUNDARIOS: Se forman por interacción de los primarios con otros contaminantes o con componentes de la atmósfera. TIPOS GASES Compuestos de Azufre Compuestos de Nitrógeno Compuestos de Carbono Óxidos de Carbono Compuestos de halógenos Oxígeno y oxidantes CONTAMINANTES PRIMARIOS SO2 H2S NO NH3 De C1 y C3 CO2 CO HF HCl CONTAMINANTES SECUNDARIOS SO3, H2SO4, NO2 SO4 = NO3 Aldehídos, cetonas, ácidos Ninguno Ninguno O3 FUENTES DE EMISIÓN Combustión de carburantes que contienen Azufre Combustión de N2 y O2 a alta temperatura Combustión de carburantes de petróleo; uso de disolventes Combustión Industrias metalúrgicas Instalaciones eléctricas de alta tensión, vehículos automóviles. Partículas sólidas procedentes de la trituración de las rocas, de cenizas volcánicas o de partículas arrastradas por el viento. Humos Pequeñas partículas originadas por combustión PARTÍCULAS Suspensiones de líquidos en forma de gotas que se condensan a partir Nieblas de un gas evaporado Nubes de partículas líquidas microscópicas o submicroscópicas Aerosoles suspendidas en el aire. Polvos COMPORTAMIENTO EN LA ATMÓSFERA Son muy variadas y su permanencia es diversa. PARTÍCULAS En algunos casos llegan hasta la estratosfera, pero generalmente son retenidas y arrastradas por las lluvias. Son muy variados y se producen en muchas circunstancias diferentes. Se produce NH4 en pantanos y arrozales, por la descomposición producidas por las bacterias metanogénicas. También en la combustión de la madera, por el uso HIDROCARBUROS de disolventes, combustión de automóviles o incineración de sustancias orgánicas. La importancia proviene de su reacción en cadena. Su permanencia en la atmósfera dura desde varios días hasta meses. Es el más abundante después del dióxido de carbono. MONÓXIDO Se produce por combustión incompleta del carbono. DE CARBONO Se elimina al convertirse en CO2, al pasar a la estratosfera o al incorporarse al suelo. COMPUESTOS DE AZUFRE Son SO2, SO3, SH2, H2SO4, sales y sulfatos. Se forman por combustión de petróleo y carbón, descomposición y combustión de materia orgánica, aerosoles procedentes de la sal marina, emanaciones volcánicas. Se eliminan por el agua de lluvia, por difusión en el suelo o en la vegetación o por sedimentación en forma de sulfatos. Son los responsables de la LLUVIA ÁCIDA. Los diferentes componentes reaccionan entre sí, como se indica en el esquema . FUENTES NATURALES FUENTES ENERGÉTICAS H2S AEROSOLES MARINOS SO2 Se oxida por efecto de O2, O, O3 SO3 Se oxida con sales de Fe, Mn o NH3, o con luz ABSORCIÓN Y ELIMINACIÓN SO4= H2SO4 Reacciona inmediatamente con agua LLUVIA ÁCIDA SEDIMENTACIÓN ELIMINACIÓN POR AGUA DE LLUVIA El NO y NO2 proceden de fuentes naturales o de combustión de carburantes a altas temperaturas. En las ciudades son emitidos por el humo de los coches. COMPUESTOS DE El NO2 también procede de la oxidación del NO. NITRÓGENO El NH3 procede de la descomposición biológica. En la atmósfera se transforman en nitratos y nitritos que son arrastrados por las lluvias. Ver esquema NO FUENTES NATURALES Y COMBUSTIÓN Oxidación en el smog. Oxidación por O3. Oxidación por reacciones acuosas Oxidación en la atmósfera PARTÍCULAS DE NITRATO Y NITRITO NO2 DESCOMPOSICIÓN BIOLÓGICA NH3 Eliminación y arrastre por el agua de lluvia EFECTOS DE LOS CONTAMINANTES EFECTOS LOCALES. FORMACIÓN DE NIEBLAS CONTAMINANTES. SMOG Se forma por la concentración en núcleos urbanos de partículas en suspensión, (hollines, humos), SO2 procedentes de vehículos, calefacciones e industrias y su SMOG combinación con nieblas en situaciones en que la atmósfera posee una elevada SULFUROSO O humedad, vientos en calma y anticiclón. CLÁSICO Es una neblina de color pardo gris sobre la ciudad que produce afecciones respiratorias y agrava los procesos asmáticos. Se produce por la presencia en la atmósfera de oxidantes fotoquímicos ( O3, PAN ( nitrato de peroxiacetileno), Aldehídos), que emanan de las reacciones de los óxidos de Nitrógeno, hidrocarburos y Oxígeno con la energía proveniente de la radiación solar ultravioleta. Este proceso se ve favorecido por las situaciones anticiclónicas, fuerte insolación y vientos débiles que dificultan la dispersión de los contaminantes. Es una especie de bruma que produce irritación ocular, daños en la vegetación y materiales como el cuero y las fibras sintéticas y formación de O3. Las reacciones fotoquímicas se pueden resumir en este esquema: SMOG FOTOQUÍMICO Otros efectos locales son: La reducción de visibilidad ya que los contaminantes absorben o desvían determinadas ondas de la luz visible. Reducción de la radiación solar, Por absorción o desviación de la luz visible e infrarroja. En el siguiente cuadro se exponen todos los demás efectos. Especial atención requiere: CaCO3 + H2SO4 + H2O CaSO4 . H2O + CO2 Caliza + sulfurico+ agua Yeso hidratado + dióxido de carbono. El yeso es soluble en agua, esta reacción es similar a la que produce el ácido carbónico en la naturaleza en el modelado cárstico. El aumento de CO2 en la atmósfera aumenta este efecto. 12.1.B.- FACTORES QUE INTENSIFICAN LA CONTAMINACIÓN LOCAL: INVERSIÓN TÉRMICA, CONDICIONES ATMOSFÉRICA Y CARACTERÍSTICAS GEOGRÁFICAS Y TOPOGRÁFICAS CONDICIONES ATMOSFÉRICAS Las situaciones anticiclónicas dificultan la dispersión de los contaminantes. Las borrascas facilitan la dispersión de los mismos. .- La temperatura del aire y sus variaciones con la altura: ( GVT) Determinan los movimientos de las masas de aire y por tanto las condiciones de estabilidad e inestabilidad. Así mismo estas variaciones dan lugar a inversiones térmicas lo que dificulta la dispersión. .- Los vientos relacionados con la dinámica horizontal atmosférica: En función de sus características, dirección , velocidad y turbulencia sabremos la dirección en que se desplaza el contaminante, la velocidad de dispersión del mismo y las turbulencias provocan acumulación. .- Las precipitaciones: Producen un efecto de lavado, que favorecen la dispersión .- La insolación: Favorece las reacciones de oxidación fotoquímica aumentando la concentración de contaminantes. INVERSIÓN TÉRMICA En apartados anteriores hemos visto como se produce el fenómeno, ahora veremos además en qué circunstancias se suele producir CARACTERÍSTICAS GEOGRÁFICAS Y TOPOGRÁFICAS En las zonas costeras: Se originan brisas que durante el día desplazan los contaminantes hacia el interior, mientras que durante la noche al invertirse la circulación de las mismas las contaminación se desplaza hacia el mar. Es un proceso diario y cíclico. En los valles fluviales y laderas: Durante el día las laderas se calientan y se genera una corriente ascendente de aire caliente, en el fondo del valle se acumula una masa de aire frío originando una situación de INVERSIÓN TÉRMICA que impedirá el movimiento de las masas de aire y dificultará la dispersión de los contaminantes. Durante la noche el suelo cede calor a las masas de aire en contacto y asciende, el lugar es ocupado de nuevo por aire frío por lo que se repite la situación de inversión. Luego las laderas de las montañas impiden la circulación de aire y favorecen la acumulación de contaminantes. La presencia de masas vegetales: Frena la velocidad del viento, facilita la deposición de partículas en las hojas y absorben el CO2 a través de la fotosíntesis, por lo tanto es un factor regulador de la contaminación. La presencia de núcleos urbanos: Influye en el movimiento de las masas de aire ya que disminuyen y frenan su velocidad y forman turbulencias. Aparece el denominado efecto Isla de Calor, debido a la combustión de los automóviles, calefacciones, calor desprendido por el pavimento y edificios. Todo esto favorece la aparición de brisas urbanas. Es una circulación cíclica que dificulta la dispersión de los contaminantes. Aparecen las Cúpulas de contaminantes que se ven incrementadas por los anticiclones. 12.1.C.- MEDIDAS DE CORRECCIÓN DE LA CONTAMINACIÓN ATMOSFÉRICA. .- Programas I+D, para la búsqueda de nuevas fuentes de energía o menos contaminantes. .- Medidas de carácter social; uso más racional, educación, ahorro .-Planificación de usos del suelo, mediante planes de ordenación del territorio. De manera que las industrias se sitúen en lugares idóneos para las poblaciones, MEDIDAS PREVENTIVAS animales, vegetales y seres humanos. .- Evaluación del impacto ambiental para conocer los efectos y establecer las medidas correctoras pertinentes para la minimización del impacto. .- Empleo de tecnologías de baja o nula emisión de residuos en su origen. .- Concentración y retención de partículas con equipos adecuados, separadores de gravedad, filtros de tejido, precipitadores electrostáticos, absorbentes húmedos. Estos métodos recogen contaminantes de la atmósfera, pero hay que prever que se hace con ellos después. .- Sistemas de depuración de gases: Absorción en líquidos o sólidos. MEDIDAS Procesos de combustión de gases. CORRECTORAS Procesos de reducción catalítica. ( Transformación en compuestos no tóxicos por reacciones de reducción). .- Otras medidas pueden ser locales como por ejemplo: Usar chimeneas adecuadas, evitando concentraciones a nivel del suelo, aunque esto no evita la contaminación general. 12.2. LOS GRANDES IMPACTOS GLOBALES. 12.2.A. EL AUMENTO DEL CO2 EN LA ATMÓSFERA Y SU INFLUENCIA EN EL EFECTO INVERNADERO En los últimos 100 anos la población mundial se ha triplicado, la economía se ha multiplicado por 20, el consumo de combustibles fósiles se ha multiplicado por 30 y la expansión industrial por 50. Por el contrario desde el siglo XVIII se han talado 6 millones de Km2 de árboles lo que supone una superficie similar a Europa. Todo esto provoca una acumulación de gases en la atmósfera que pueden provocar un calentamiento del planeta, si bien aún no ha sido demostrado fehacientemente. Como ya hemos visto el CO2, el vapor de agua y otros gases absorben toda la radiación infrarroja procedente del Sol y el 88 % de la emitida por la Tierra. Este efecto es similar al que se produce en un invernadero en el que los cristales o plásticos dejan pasar los rayos solares y éstos al reflejarse pierden energía y quedan atrapados. Gracias al efecto invernadero la Tierra tiene una temperatura que permite la vida alrededor de los 15º C de media, en lugar de los – 18ºC que debería tener por su situación en el sistema solar. La actividad industrial y especialmente la quema de combustibles fósiles han aumentado el contenido de gases de efecto invernadero en la atmósfera, CO2, Vapor de agua, Metano, NO2, NO3, O3, CFC... Los científicos no se ponen de acuerdo acerca de los efectos del llamado CAMBIO CLIMÁTICO Para algunos el problema no será muy grave ya que la propia atmósfera regulará los cambios, de manera que aunque la contaminación aumenta el efecto invernadero, también impide la penetración de radiaciones solares, habiendo así un equilibrio. Si embargo, según los informes científicos del ( IPCC) ( Panel intergubernamental para Cambio Climático), las temperaturas medias globales se elevarían entre 1 y 3,5 grados los próximos 100 años, los que supondría una elevación del nivel del mar de entre 15 y 95 cm. Variará el régimen de lluvias, se producirá un desplazamiento de las franjas climáticas hacía el Norte en las latitudes medias, con lo que España se desertizaría, y el Norte de Europa tendría un clima más templado. Se producirán más ciclones y algunas islas del Pacífico o países como Bangladesh desaparecerán. En 1997 se elaboró el Protocolo de Kyoto, en el que se acordaron plazos y reducciones de emisión de gases a partir de 2005 ó 2010. 84 países firmaron el acuerdo Posteriormente ha habido otras cumbres como la de la Haya en el 2000. Sin embargo no todos los países se ponen de acuerdo en reducir sus emisiones y esto está acabando con muchos de los acuerdos adoptados, incluso los países que ratificaron el acuerdo buscan la manera de saltárselo sin incumplirlo. EEUU es el responsable del 24,5% de las emisiones, mientras que España ha aumentado al menos un 10% sus emisiones desde 1990. ( En el tema nº 1 se entregaron fotocopias del Protocolo de Kyoto y de la Cumbre de la Haya en donde aparecen más detallados los límites aprobados para cada país, las actividades que producen estos gases, los acuerdos adoptados....) Periodo ampliado Mínimo histórico Conocido como la Pequeña era glaciar Máximo histórico al final de los años 50 En la actualidad tiende a aumentar 12.2.B.- LA ALTERACIÓN DE LA CAPA DE OZONO Y SUS CONSECUENCIAS Como hemos visto la mayor parte del Ozono que existe se forma por la acción de la radiación ultravioleta sobre el Oxígeno. El Ozono estratosférico se encuentra entre los 12 y 40 Km de altitud en la Estratosfera. El ozono se forma gracias a la luz u.v. y este a la vez atrapa las radiaciones, lo hace de la siguiente manera: O2 + U.V. 2 O O + O2 O3 + calor O3 + U.V. O2 + O .- Entre los productos químicos que dañan el Ozono se encuentran los Clorofluorocarbonos ( CFC) , los agentes de extinción de incendios (Halones , CFBr), los hidroclorofluorocarbonos (HFC), Bromuro de Metilo, Metilcloroformo (MFC) y el tetracloruro de Carbono. .- Estos se encuentran presentes en los líquidos refrigerantes de frigoríficos y aires acondicionados, aerosoles, líquidos de extinción de incendios y espumas plásticas. .- Los CFC y los Halones son muy estables y pueden tener una vida media de hasta 100 años, esto les permite llegar intactos hasta la estratosfera. .- Una vez allí al ser irradiados por la luz U.V. se descomponen rápidamente liberando átomos de Cloro y Bromo, que producen reacciones fotoquímicas que terminan por destruir el ozono. .- Se calcula que cada átomo de Cloro destruye alrededor de las 100.000 moléculas de Ozono antes de ser neutralizado. Al destruirse el Ozono la luz U.V. puede atravesar la atmósfera sin quedar retenida por lo que aumenta la probabilidad de enfermedades como el cáncer de piel, cataratas, debilitamiento del sistema imnmune... Esto afecta especialmente a aquellas personas que desarrollan su actividad al aire libre. Una disminución del 1% de la capa de Ozono produce una penetración de un 2% más de luz U.V. lo que supone un aumento de entre un 4 a un 6 % del cáncer de piel. La radiación U.V. afecta al ADN y a los procesos de crecimiento y reproducción de muchas especies. Además la radiación U.V. afecta a la vida en el planeta. Se producen cambios en la biodiversidad y en la producción. En los ecosistemas marinos se ven afectados fundamentalmente las bacterias, el fitoplancton, los huevos y larvas, ya que viven más superficialmente y están más desprotegidos. Hay que destacar que un 50% de la biomasa de nuestro planeta está constituída por los organismos acuáticos, por lo que una disminución de su productividad no afectaría gravemente. 12.2.C.- LA LLUVIA ÁCIDA Se descubrió en 1800 en Gran Bretaña, fue el químico Smith quién la bautizó así mientras observaba la lluvia que caía sobre Manchester una tarde de 1853, en plena revolución industrial. Según Smith la acidez de aquellas aguas corroía los metales, desteñía la ropa, e incluso hacía enfermar a las personas y dañaba los vegetales, entonces no se sabía todavía su relación con los humos de las fábricas. Se producen debido a la disolución de sustancias contaminantes en las partículas de agua de las nubes. El resultado es la precipitación de lluvia o nieblas con un alto contenido en ácidos. Se considera lluvia ácida cuando el pH es menor de 5. Los principales agentes contaminantes son el Dióxido de Azufre ( SO2) y los Óxidos de Nitrógeno (NOx). Otros contaminantes son el Ácido clorhídrico HCl y el Amoniaco. Éstos reaccionan con el agua, el Oxígeno y se forma Ácido Sulfúrico ( H2SO4) y Ácido Nítrico ( HNO3). En algunas ocasiones las emisiones son de origen natural : Éste es el caso de: Las erupciones volcánicas que emiten Óxidos de Azufre. Los procesos de descomposición biológica también producen óxidos de Azufre. La acción de las bacterias en el suelo producen Óxidos de Nitrógeno. Las reacciones en las capas de la atmósfera producen también Óxidos de Nitrógeno. La propia lluvia sin contaminar tiene una cierta acidez. Su pH es de aproximadamente 5,6. Esto se debe a la presencia de CO2 que con el agua forma Ácido carbónico. En algunas zonas de Europa central se suelen producir lluvias con una acidez de 4,2. En otros países como por ejemplo España, a veces la lluvia se alcaliniza llegando a valores mayores que la neutralidad pH=7. Esto es debido a la presencia de polvo con partículas de sales de Calcio procedentes del Sahara. El 90% de las emisiones de Azufre y el 95% de las emisiones de Nitrógeno son producidas por la actividad humana: Una de las principales fuentes es la quema de carbón a gran escala para la producción de electricidad. Muchos carbones contienen Azufre, por lo que al quemarlos producen dióxido de Azufre. También producen este contaminante el refinado de aceites y algunos pozos de gas natural. En cuanto a los Óxidos Nitrosos los principales agentes son la combustión a altas temperaturas en automóviles, autobuses, camiones....( un 40%); en generación de electricidad ( un 25%) y en combustión industrial ( 35%). Los principales efectos de la lluvia ácida son: Disuelven los nutrientes y los minerales útiles del suelo, que son arrastrados por el agua de escorrentía. Los bosques de montaña sufren nieblas ácidas que atacan a la capa cerosa de las hojas, esto produce unas manchas de color castaño muy característico. El resultado es la disminución de la fotosíntesis y por tanto el desarrollo. La lluvia ácida puede dañar también las cosechas agrícolas y para solucionarlo hay que añadir caliza al suelo para neutralizar. En algunas ocasiones los efectos de la lluvia ácida quedan enmascarados por otros fenómenos más llamativos, el ataque de insectos, la sequía, las enfermedades...