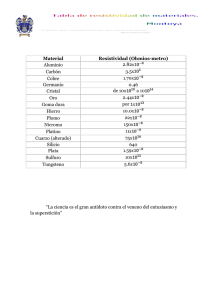
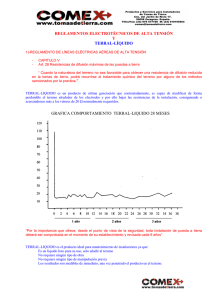
Estudio resistivo de electrolitos
Anuncio

Universidad de Santiago de Chile ESTUDIO RESISTIVO DE ELECTROLITOS UTILIZANDO CELDA HULL. Autores: Christian Hizmeri – Gerardo Cifuentes. Departamento de Ingeniería Química – Departamento de Ingeniería Metalúrgica. Santiago – Chile – 2012 Palabras clave: Corrosión electroquímica, Celda Hull, Resistencia, Resistividad, Electrolito RESUMEN La corrosión se da a lugar en base a fenómenos electroquímicos por lo cual es de vital importancia conocer los electrolitos involucrados, la característica más importante para determinar la agresividad de un electrolito es la resistividad que comúnmente es medida mediante el empleo del método de las 4 puntas. En esta investigación se realiza un estudio resistivo de electrolitos, pero con un método totalmente diferente al tradicional, se utiliza una celda de Hull, que es comúnmente utilizada en estudios de galvanoplastia. Con esta celda se encuentra un modelo matemático que describe la resistividad en función de parámetros iniciales de corriente y voltaje. Todas las muestras utilizadas reflejan un comportamiento fuertemente lineal de la resistencia en función de la distancia y. los valores de resistividad calculados mediante el modelo concuerdan con valores de bibliografía, por lo tanto es posible validar el modelo de resistividad encontrado. ABSTRACT Corrosion is based on electrochemical phenomena, therefore is of vital importance to know the electrolyte involved, the most important characteristic for determining the aggressiveness of an electrolyte is the resistivity which commonly is measured by employing of the method of the 4 electrodes. This research involve a study resistive of electrolyte using a method totally different to the common method, in this case is used a Hull Cell commonly used in electroplating processes. With this cell is possible to find a mathematical model that describes the resistivity as a function of initial parameters of current and voltage. All samples that were used indicate a strong linear relation of the resistance as a function of distance. May be said that the resistivity values calculated by the model are consistent with literature values, therefore is possible to validate the model found. 1 Universidad de Santiago de Chile 1. INTRODUCCIÓN 1.1 La corrosión sales fundidas, líquidos orgánicos, soluciones ácidas, álcalis u otras. 1.2 Electrolitos en la corrosión La corrosión es uno de los problemas más considerables que se encuentran En propietarios y operadores de estructuras estructuras enterradas y sumergidas los metálicas, ya sea si están enterradas, electrolitos sumergidas, aéreas, etc. En el transcurso fundamental de la historia muchas han sido las cinética de los fenómenos que se llevan definiciones que se han entregado sobre a cabo, desde este punto de vista la el fenómeno conocido con el nombre de característica corrosión, siendo la más precisa la que lo determinara si el medio en el cual una describe como un proceso en donde el estructura metálica está inmersa será metal agresivo o no desde el punto de vista de se degrada por objeto de la corrosión electroquímica presentes en la más juegan un de rol termodinámica y importante que reacciones químicas y electroquímicas la corrosión será la resistividad. que se dan lugar en un medio en el que En esta investigación se estudiará el adoptan la tendencia a volver a su comportamiento resistivo de distintos estado natural. electrolitos, sólidos y líquidos, por lo que será Si bien lo fenómenos corrosivos pueden darse a lugar ya sea en estructuras que están aéreas, enterradas o sumergidas, en esta investigación se abordarán las dos últimas debido a que en este tipo de corrosión relevante terrenos tiene el una por ejemplo en presentes, presencia de pH, bacterias resistividad, anaerobias, concentración de oxígeno, etc. Mientras que en el caso los conceptos que permitan relacionar la incidencia de la capacidad resistiva de un electrolito con el desarrollo del fenómeno corrosivo y los posibles métodos de protección. de 1.3 Método de las 4 puntas serán factores importantes la concentración de sales comprender participación electrolito presente, sólidos importante estructuras sumergidas la naturaleza del electrolito puede ser agua de mar, agua potable, Comúnmente resistividad las de mediciones suelos se de realizan mediante el método de las 4 puntas de Wenner. El procedimiento requiere clavar cuatro varillas metálicas en la tierra, sobre una línea, equidistantes. La separación entre las varillas equivale a la profundidad de la resistividad promedio 2 Universidad d de Santiago de Chile del suelo, como se indica en la Figura 1.4 Celda Hull 1.1. Es una celda electrolítica usada La resistividad promedio del suelo está comúnmente en estudios de corrientes en función de la caída de potencial entre en el par central de varillas con la corriente como electroplateado, teado, proceso en el circulando entre las dos varillas externas. cuál, a través de la electricidad, se puede galvanoplastia, vanoplastia, también conocida depositar un metal sobre un electrodo. Para este fin se aplica una diferencia de potencial entre dos placas sumergidas para generar una corriente eléctrica que permitirá electro depositar un metal sobre s el objeto que se ha de galvanizar, (cátodo). Figura1.1: Método de cuatro puntas. Es importante tante que se poseer las placas electródicas en forma encuentren sobre una línea recta y que paralela, como se puede observar en la sean n Figura . Las placas son de acero equidistantes las varillas varill La celda de Hull se caracteriza por no entre sí. La resistencia “R” para cada separación de inoxidable 316L. varillas “a”, es la resistencia desde el nivel de la superficie hasta una profundidad igual a la separación entre varillas. Usando este método, la resistividad del suelo se puede determina determinar de la siguiente forma: ρ 2∗π∗R∗a Donde: Figura 1.2: Celda Hull. La característica de no poseer los • ρ: Resistividad (Ω Ω cm). • R: Resistencia (Ω). al aplicar una diferencia de potencial, a • a: Separación entre varillas (cm). través de un electrolito, se puedan electrodos en forma paralela permite que 3 Universidad de Santiago de Chile obtener distribuciones de corriente, esto A principalmente debido a como se tienen procedimientos realizados para la toma distintas distancias inter electródicas, de muestras experimentales: esto provoca que se presenten resistencias distintas y por ende mayores corrientes en pequeños espacios interelectródicos y menores corrientes en espacios interelectródicos mayores. distintos con a fines los galvanoplastia, absolutamente empleados será por empleada la para determinar un método de medición de resistividad diferente al ya existente (Método de las 4 puntas). 2. estudio fueron utilizadas del país, Viña del Mar y La Serena, y de terreno Hull con el Conectar el terminal positivo de la comportará como ánodo y el terminal negativo al electrodo que se comportará como cátodo. En el cable que une el ánodo con el terminal positivo de la fuente interponer en serie un tester para medir la corriente que está pasando a través de la celda. Ver Figura 2.1. muestras de agua de mar de dos zonas muestras celda los fuente de voltaje al electrodo que se 3. este la describen altura de 10 cm. MATERIALES Y METODOS Para Llenar se electrolito a estudiar alcanzando una 2. En esta investigación la Celda Hull será utilizada 1. continuación sólidas de 3 Encender la fuente de Voltaje fijando una diferencia de potencial entre ánodo y cátodo y anotar este valor, (VF). 4. Leer del tester el valor de la corriente de celda (IC). distintas zonas del país, Viña del Mar, La Utilizando un segundo tester, se Serena y Huasco. En la tabla siguiente 5. se describen los equipos que fueron procede a medir el potencial anódico. utilizados: Para esto se conecta un electrodo de referencia de Cu/CuSO4 al tester, y el Tabla 2.1: Equipos utilizados Equipo Fuente de Corriente continua Multímetro Multímetro Horno otro terminal al ánodo. Para asegurar Marca Modelo MCP Lab Electronics M10-SP305E Digital Multimeter GB Instruments Memmert una óptima lectura del potencial anódico se recomienda posicionar el electrodo de referencia dentro del electrolito y lo más DT-830B cerca del ánodo pero sin que tenga GDT-11 contacto físico con este último. En la - Figura 2.1 se pueden observar los puntos 4 Universidad d de Santiago de Chile “A”, “B” y “C”, estos representan mediciones de potencial anódico. Volver al punto 3, fijar un nuevo 7. voltaje y continuar con los pasos 3 a 7. Considerar nsiderar que al medir muestras sólidas es recomendable comendable tamizar tam previamente las muestras y utilizar un algodón humedecido decido con agua destilada para mejorar el contacto de la muestra con el electrodo de referencia. 3. RESULTADOS Y DISCUSIONES 3.1 Linealidad Figura 2.1: Medición de potencial anódico. De forma análoga puede medirse En la Figura 3.1 se puede observar una el potencial catódico, solo es necesario dependencia lineal entre el valor de cambiar el cable desde el ánodo al resistencia y distancia, el coeficiente de cátodo. Con la diferencia que en el correlación igual a 0,988972 refleja una cátodo se medirán potenciales a lo largo relación fuerte entre ambas variables. variables 6. del electrodo. En la Figura 2.2se 2.2 puede observar que ue los puntos “D”, “E”, “F” y “G” representan mediciones de potencial catódico. Figura 3.1: Resistencia v/s distancia para muestra sólida Viña del Mar. Todas las muestras de terreno y de agua Figura 2.2: Medición de potencial catódico. de mar presentaron la misma relación lineal entre los valores de resistencia y la distancia. 5 Universidad de Santiago de Chile 3.2 Comparación de electrolitos En la Figura 3.2 se puede observar que la muestra de Huasco presenta los A continuación los valores de resistencia en función de la distancia para los 3 electrolitos sólidos estudiados a tres grados distintos de humectación valores de resistencia más altos, luego la muestra de La Serena y por último la muestra de Viña del Mar. La presencia de sales como cloruros o sulfatos, el pH, la presencia de bacterias, entre otras, son características que determinan la capacidad de una especie de conducir la corriente eléctrica, al tratarse de zonas muy alejadas es esperable encontrar una diferencia como la que se puede observar en la Figura 3.2. Figura 3.2: Comparación de electrolitos sólidos a 2.5% de Humedad. De la Figura 3.3 y Figura 3.4 se puede observar claramente la tendencia a disminuir la distancia entre cada una de las rectas con el incremento de humedad. Las pequeñas diferencias en los valores de resistencia calculados se pueden deber a las lecturas de potencial al utilizar el electrodo de referencia. Figura 3.3: Comparación de En la siguiente figura se puede observar la comparación de electrolitos líquidos: electrolitos sólidos a 5% de Humedad. Figura 3.4: Comparación de electrolitos sólidos a 10% de Humedad. Figura 3.5: Comparación de electrolitos líquidos. 6 Universidad de Santiago de Chile En la Figura 3.5 se presentan los valores fuente (VF) con el Potencial a una de resistencia en función de la distancia distancia de 10 centímetros (Pot E1). para las estudiadas. dos Para muestras cada de mar muestra se realizan tres mediciones a diferentes valores de corriente, los valores de resistencia oscilan entre los 0,8 y 5 En la Figura 3.7 se muestra el grafico que permite relacionar el Voltaje de la fuente (VF) con el Potencial a una distancia de 23 centímetros (Pot E3). Ohm, se puede desprender que estos valores no presentan considerables diferencias. Las pequeñas diferencias en los valores de resistencia calculados se pueden deber a las lecturas de potencial al utilizar el electrodo de referencia. 3.3 A Modelo matemático continuación se presentan los resultados que permitieron obtener el Figura 3.7: Voltaje de la fuente (VF) v/s Potencial a 23 centímetros (Pot E3). ajuste matemático que describe el valor A continuación se presenta la ecuación de resistividad en función de parámetros que describe los valores de resistencia iniciales de corriente y voltaje. (R), en función del voltaje de fuente (VF), corriente de celda (IC), y distancia (D): 0,01 ∗ + 0,023 ∗ + 0,644 ∗ − 1,486 El promedio de los errores que se obtuvieron según esta última ecuación Figura 3.6: Voltaje de la fuente (VF) v/s fue igual a 3,87%. De la totalidad de los Potencial a 10 centímetros (Pot E1). datos utilizados solo el 1,5%,(5 puntos), En la Figura 3.6 se muestra el grafico que permite relacionar el Voltaje de la presentan un error mayor al 15%, siendo el valor máximo de estos un 25,1%. Esto permite afirmar que la ecuación de 7 Universidad de Santiago de Chile resistencia describe correctamente los 3.4 Validez del modelo valores obtenidos experimentalmente. Los valores de resistividad de las Al tener la resistencia, la resistividad se muestras obtiene a partir de la siguiente expresión: variables por lo que se hace imposible = solidas pueden ser muy poder comparar los resultados de las ∗ experiencias de laboratorio con valores teóricos para estas muestras, en cambio Donde: las muestras de agua de mar poseen una • ρ: Resistividad (Ω cm). variedad de valores mucho menor. • R: Resistencia (Ω). Según • A: Área transversal (130 cm2). resistividad del agua de mar en distintas • L: Distancia (También “D” en cm) la NACE los valores de zonas del mundo varían entre los 19 Ω cm y los 33 Ω cm. En la Tabla 3.1 se comparan estos valores teóricos de Reemplazando valores: 1,3045 ∗ + 2,992 = resistividad con los calculados a partir del modelo de resistividad. Tabla 3.1: Comparación valores de 83,72 ∗ − 193,18 + ∗ resistividad calculados y teóricos. Según esta expresión para distancias Agua de mar ρ (Ω cm) Calculada ρ (Ω cm) Teórica de resistividad pero para valores muy Viña del Mar 19 [19-33] grandes expresión Viña del Mar 23 [19-33] converge a un mismo valor. Por lo tanto Viña del Mar 22 [19-33] para valores muy grandes de distancia la La Serena 22 [19-33] resistividad queda determinada por: La Serena 20 [19-33] 1,3045 ∗ + 2,992 La Serena 22 [19-33] pequeñas, se obtienen distintos valores de = distancia la En Tabla 3.1 se puede observar que Esta última expresión corresponde al todos modelo de resistividad encontrado en calculados mediante la ecuación están función de parámetros de corriente y todos dentro del rango [19-33] Ω cm. los valores de resistividad voltaje de la fuente. 8 Universidad de Santiago de Chile 4. CONCLUSIONES 4.1 Pruebas de Linealidad Las muestras de agua de mar no presentaron diferencias considerables en los valores de resistencia. Se comprobó que todas las muestras de 4.3 Ajuste de modelo matemático terreno y de agua de mar reflejan un comportamiento fuertemente lineal de la El modelo que describe los valores de resistencia en función de la distancia. resistencia en función de la distancia, voltaje de fuente y corriente de celda, 4.2 Comparación de electrolitos presenta errores de baja consideración de respecto a cálculos experimentales, por electrolitos sólidos se desprende que la lo tanto se puede afirmar que el modelo diferencia entre los valores de resistencia encontrado es válido. se debe principalmente a la naturaleza 4.4 Respecto a la comparación Validez del modelo de cada una de las muestras. Para explicar la razón de tal diferencia hubiese Según resultados en que los valores de sido resistividad necesario realizar un análisis calculados mediante el concuerdan con valores de químico que permitiera determinar la modelo concentración de cloruros, concentración bibliografía, es posible afirmar que el de sulfatos o determinar pH, entre otras modelo características. Esto se escapa a los valores de resistividad en función de los objetivos parámetros de corriente y voltaje de planteados en esta investigación. describe correctamente los celda. Por lo tanto se puede afirmar que el modelo de resistividad encontrado es La tendencia a disminuir la distancia válido. entre cada una de las rectas con el incremento de la humedad se explica debido a que al aumentar la cantidad de agua destilada se logra disolver la totalidad del contenido salino de cada 5. Juang REFERENCIAS M.G. “Corrosion Fontana Engineering”, N. D Greene, MacGraw-Hill. Nueva York 1967. una de las muestras facilitando de esta forma el traspaso de corriente eléctrica a través de la celda. Cortes María Teresa, Ortiz Pablo, “Corrosión”, Apuntes Científicos Uniandinos No 4, Diciembre 2006. 9 Universidad de Santiago de Chile Von Baeckman, W. Schwenk, and Prinz, Texaco Inc. “Cathodic Protection Manual”. Handbook of Cathodic Corrosion Protection – 1°Edicion, New York, 1965. Theory and Practice of Electrochemical Gonzalez, J.A. “Control de la corrosión: Protection Processes, 1997. Estudio y medida por técnicas Robert Baboian, NACE Corrosion Engineers electroquímicas”. C.S.I.C Grafipren, S.A.1° Reference Book, NACE INTERNATIONAL, 3° Edición, Madrid, 1989. Edition, 2002. Manners, E. “Cathodic Protection for Nace International, Corrosion Control of distribution systems: Corrosion prevention Submerged Areas of Permanently Installed and control”, Vol. 9, Enero, 1962. Steel Offshore Structures NACE SP0176, Vila, Gustavo, “Corrosión y control de 2007. corrosión”. Gerardo Cifuentes, Jaime Simpson, Cristian Vargas, Fundamentos de Corrosión Publicaciones Facultad de Universidad Ingeniería. Nacional de Colombia, Bogotá, 1990. y Protección de Materiales. 1°Edición, 2006. Gerardo Cifuentes, Teoría y Práctica de la Electrometalurgia. 1° Edición, 2010. CP-2 Cathodic Protection Technician Course Manual, NACE International, 2006. Nace international, Protection Technologist CP-3 Cathodic Course Manual, 2009. L.Shreir, R.Jarman, G.Burstein, “Corrosion Metal Environment Reactions”, 3ª Edición, Butterworth Heineman, Oxford, 1994. Kemal Nisancioglu, “Cathodic Protection”, Rev.Material Performance, Diciembre 1984. Roe Stommen, “Anode Resistance”. Rev. Material Performance, Marzo 1985. Texas Petroleum Company, “Cathodic Protection Design and application school”. Houston, Octubre, 1985. 10