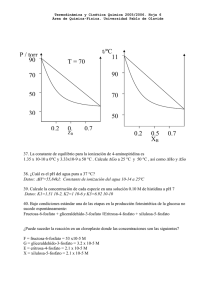
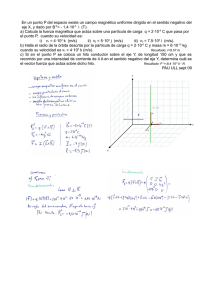
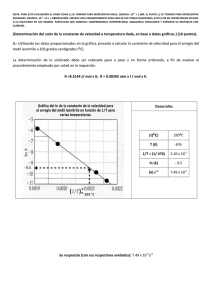
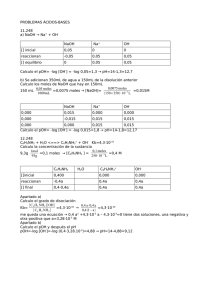
4.- ¿Cuál es la concentración molar de una disolución de nitrato
Anuncio

LA RIOJA / SEPTIEMBRE 99.LOGSE / QUIMICA/ CINETICA Y EQUILIBRIO / CUESTIÓN Nº 4 4.- ¿Cuál es la concentración molar de una disolución de nitrato amónico, cuyo pH es el mismo de una disolución 1,24 ·10-5 M de ácido clorhídrico? Solución: Disolución 1,24·10-5 M de HCl. El HCl es un ácido fuerte, que en disolución acuosa se disocia totalmente. HCl + H2O → H3O+ + ClComo la disociación es total, podemos decir que [H3O+] = 1,24·10-5 Por lo que siendo pH = -log[H3O+], el pH de la disolución de HCl será: pH= -log 1,24·10-5 = 4,9. De tal manera que tendremos una disolución de nitrato amónico de pH = 4,9. El nitrato amónico es una sal soluble que se disocia completamente dando iones amonio e iones nitrato: NH4NO3 → NH4+ + NO3El ión amonio es un ácido fuerte por lo que sufrirá hidrólisis, mientras que el ión nitrato es una base débil que no sufrirá hidrólisis. Hidrólisis del amonio: NH4+ + H2O D NH3 + H3O+ La constante de hidrólisis se calcula a partir de la constante de la base (amoniaco) Este dato no es facilitado por el enunciado del ejercicio. Sabemos que Kb amoniaco = 1,8·10-5 , y que el producto iónico del agua es Kw =10-14 Kh = Kw / Kb Kh = 10-14 / 11,8·10-5 = 5,5·10-10 Aplicando la ley de acción de masas al equilibrio Kh =[NH3]·[H3O+] / [NH4+] Conocemos [H3O+] = 1,24·10-5, para que el pH sea pH = 4,9, y nos consta que en el equilibrio tiene que cumplirse que [H3O+] = [NH3] = 1,24·10-5 M De modo que: [NH4+] = [NH3]·[H3O+] / Kh [NH4+] = (1,24·10-5)2 / 5,5·10-10 = 0,276 M Como la concentración de amonio ha de ser la misma que la concentración de nitrato amónico: [NH4NO3] = 0,276 M www.profes.net es un servicio gratuito de Ediciones SM