La importancia de los factores pronósticos en leucemia aguda
Anuncio

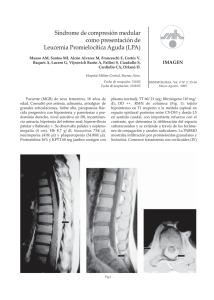
Rivera LR. Pronóstico en leucemia aguda linfoblástica 260 Artículo de revisión Vol. 46, Núm. 4 Octubre-Diciembre 2000 pp 260-266 La importancia de los factores pronósticos en leucemia aguda linfoblástica (LAL) de la población pediátrica en un país en vías de desarrollo Roberto Rivera Luna* RESUMEN ABSTRACT La sobrevida de los niños con LAL se ha modificado favorablemente en los últimos 25 años. Sin embargo, estos cambios se han debido no nada más a tratamientos más racionales, pero en forma muy importante a la identificación de una serie de factores pronósticos que han contribuido a identificar a una población de niños con pronóstico favorable, otro intermedio y un tercero con pronóstico desfavorable. Los factores identificados inicialmente fueron edad, sexo y aquellos que representan gran carga leucémica como visceromegalia por abajo de la cicatriz umbilical. Otros factores son los de laboratorio incluyendo la hemoglobina, cuenta de leucocitos y cuenta de plaquetas. Otros son la elevación de deshidrogenasa láctica y alteraciones de las inmunoglobulinas. La literatura en los años 70 señaló la citomorfología de los linfoblastos como de importancia pronóstica. La identificación de los marcadores de los linfoblastos a través de epifluorescencia y posteriormente con citometría de flujo ha permitido una precisión aun mayor de la estirpe inmunológica de estas células. La descripción de la ploidía, el índice del ADN, las alteraciones citogenéticas y la presencia de alteraciones moleculares han permitido al clínico ofrecer un pronóstico y por ende un tratamiento más selectivo. Rutinariamente en la República Mexicana es difícil que las instituciones que se dediquen a la atención de estas enfermedades las lleven a cabo. De tal manera que deben existir centros de referencia especializados. Since the publication by Sidney Farber in the late 40´s in a group of children with acute lymphoblastic leukemia treated with methotrexate, the outlook for this group of diseases has favorably changed. Initial clinical factors were the first ones with solid grounds, including age and sex. Large organomegaly-liver and spleen-below the umbilical scar have prognostic significance. These later factors were related to leukemia cell burden. Other factors were related initially to hemoglobin under 7 g %, high leukocyte count (> 50,000/mm3) and thrombocytopenia. It was until the mids 70 that the international literature started describing other factors including the cytomorphology of the lymphoblasts, the presence/absence of immunologic markers. The latter markers are identified with monoclonal antibodies thru epifluorescence microscopy and ultimately thru flow cytometry. In the last decade other prognostic factors have been identified including the cell ploidy, DNA index, cytogenetic abnormalities and molecular findings. All have changed the prognosis and treatment of acute lymphoblastic leukemia. Therefore the life expectancy has favorably changed the survival in these children. However in the Republic of Mexico because of the technical and financial limitations it is impossible to run routinely these battery of tests, and therefore there should be specialized referral centers for the optimal diagnosis and care for these children. Palabras clave: Factores pronósticos, leucemia aguda linfoblástica, niños. INTRODUCCIÓN El pronóstico de leucemia aguda linfoblástica ha evolucionado en forma muy significativa desde los finales de los años 401 hasta el momento actual. En una manera inicial se consideró que este padecimiento era mortal a corto plazo2 y por lo tanto la literatura en la década de los 40 y 50 no identificó factores que pudieran influir en el pronóstico de estos niños. edigraphic.com * Subdirector de Hemato-Oncología del Instituto Nacional de Pediatría. Key words: Prognostic factors, acute lymphoblastic leukemia, children. Por otro lado históricamente la sobrevida a largo plazo y curación no ha sido únicamente obra del advenimiento de nuevas drogas para el tratamiento3 de esta enfermedad pero también a la identificación de factores pronósticos.4 Los cuales de manera directa han influido en la sobrevida libre de enfermedad de estos pacientes. El propósito del presente trabajo es efectuar una revisión de la literatura con aquellos trabajos que a nuestro juicio han aportado en forma significativa bases sólidas con relación a los factores pronósticos en LAL de la población pediátrica aunado a los trabajos realizados en el Departamento de Oncología de nuestro Instituto. Rev Inst Nal Cancerol (Mex) 2000; 46 (4). 261 FACTORES Existe una serie de factores los cuales cada uno de ellos tienen un peso específico. Es indudable que muchos de estos parámetros pronósticos no pueden efectuarse rutinariamente en muchas instituciones de la República Mexicana5 en la mayoría de las ocasiones por falta de recursos financieros para la obtención del equipo y en las menos por limitación de personal preparado para llevar a cabo estas pruebas. De esta manera analizaremos en forma somera estos factores. Factores clínicos Dentro de los cardinales se encuentra la edad. Se describió inicialmente que la edad por abajo de 2 y por arriba de 9 años constituía un factor pronóstico desfavorable. Esta observación fue propuesta en la literatura internacional por el grupo cooperativo pediátrico CCG6 y el Dana Farber Cancer Institute.7 Sin embargo, los dos grupos excluyeron la presencia de masa mediastinal-síndrome linfomatoso. Posteriormente el límite de edad varió con base en los trabajos efectuados por el grupo cooperativo POG8 y el St. Judes Childrens Research Hospital,9 de tal manera que la edad quedó como desfavorable por abajo de 1 y por arriba de 10 años. En un análisis prospectivo en un periodo de más de 10 años pudimos corroborar estas observaciones (Figura 1). Sin embargo, quedó plenamente establecido8 que para considerarse de bajo riesgo los niños no deberían tener enfermedad al sistema nervioso central al diagnóstico, sin t(9;22) o t(1;19), con un índice de ADN > 1.16. 100 % 80 60 40 20 0 0 2 4 6 Años Grupos de edad en años (p<0.001): 1-9 + > 10 * < 1 Depto. Oncología, INP. 8 10 12 Figura 1. Sobrevida libre de enfermedad por grupos de edad en niños con leucemia aguda linfoblástica. Otra situación que por un tiempo dejó de ejercer un efecto pronóstico fue el sexo ya que válidamente se llegó a la conclusión que con un buen protocolo de tratamiento la característica desfavorable del sexo masculino desaparecía. Sin embargo, en 1998,10 el grupo cooperativo POG después de evaluar a 3,717 pacientes pediátricos con LAL pre B demostraron que la sobrevida libre de enfermedad en niños fue 38% menor que en las niñas a los 2 y 5 años del diagnóstico. Esta situación se debe al riesgo de infiltración testicular. Otras situaciones sobre todo en la literatura sajona lo han constituido la raza. Algunos grupos cooperativos11 han llegado a la conclusión que un factor desfavorable lo constituye la raza negra y los que describen como aquellos de origen hispánico. Por supuesto dentro de este grupo están los niños mexicanos inmigrantes y los niños México-Americanos. Estos autores han concluido que el problema principal está precisamente en variaciones de la respuesta a la quimioterapia. Otra situación que se ha considerado por algunos12 como factor desfavorable es el estado nutricional de los niños con LAL. A pesar de estos reportes tanto en la experiencia de grupos cooperativos como en la nuestra13 consideramos que todavía no se ha demostrado en estudios prospectivos, bien controlados este hallazgo como un factor pronóstico definitivo. Desde el punto de vista clínico y de pronóstico desfavorable lo constituye la presencia de masa mediastinal, visceromegalias, sobretodo cuando el hígado y bazo rebasan la cicatriz umbilical, así como adenopatías generalizadas. Estas constituyen una carga tumoral además de producir un síndrome de lisis tumoral cuando se inicia el tratamiento. Cada día su peso como factor pronóstico se va debilitando debido al tratamiento de quimioterapia más específico y depurado. Un factor definitivamente desfavorable lo constituye la infiltración al sistema nervioso central 14 la cual puede presentarse en forma asintomática además comúnmente asociarse con masa mediastinal -síndrome de compresión de vena cava superior- e inmunofenotipo T. La infiltración testicular al diagnóstico no guarda una relación pronóstica. edigraphic.com Factores de laboratorio de rutina El segundo factor pronóstico cardinal lo constituye la cuenta de leucocitos al diagnóstico.15 Tanto el grupo cooperativo CCG6 como el POG8 concluyeron que la cuenta de leucocitos totales en sangre periférica al diagnóstico por abajo de 50,000/µL constituye un factor de pronóstico favorable. Sin embargo, en Rivera LR. Pronóstico en leucemia aguda linfoblástica 262 un buen porcentaje de los casos cuando las cuentas están por arriba de este número, además de asociarse con un factor de alto riesgo desfavorable- se asocia con una edad desfavorable (<1 año y >10 años). En aquellos pacientes con cuenta aún más elevadas, especialmente por arriba de 100,000/µL (hiperleucocitosis) la sobrevida es aún más reducida en la experiencia internacional como en la nuestra (Figura 2). En el pasado se mencionó sobre la hemoglobina por abajo de 7 g/dL, la cual al parecer tenía un factor pronóstico favorable,16 sin embargo se ha concluido que carece de valor real en la actualidad. La trombocitopenia (< de 30,000/mm3) se ha considerado como una situación desfavorable y condiciona un factor predisponente en la infiltración al sistema nervioso central.17 Los niveles bajos de IgG al diagnóstico se han asociado con una respuesta deficiente al tratamiento de inducción a la remisión.18 Los niveles séricos bajos de IgG, IgA, IgM al diagnóstico se han correlacionado con una sobrevida libre de enfermedad corta,19 sin embargo al parecer la correlación de un pronóstico pobre se correlaciona más con niveles bajos de IgM.20 Factores de laboratorio de rutina especializada El estudio de médula ósea por aspiración es indispensable para establecer el diagnóstico. Desde los años 70 se describió por vez primera criterios citomorfológicos en la médula ósea de los linfoblastos.21 Tradicionalmente esta clasificación describe a la LAL L1 como la más frecuente en pediatría y con pronóstico favorable. La variedad L3 se describe como la leucemia de células B de mal pronóstico. Sin embargo, en el caso de L2, el grupo cooperativo 100 % 80 60 40 20 0 0 1 2 Años 3 4 5 edigraphic.com Cuenta de leucocitos/mm3 (p < 0.0001): < 10,000 + >10 < 50,000 * >50 <100,000 Depto. Oncología, INP. >100,000 Figura 2. Sobrevida libre de enfermedad en niños con leucemia aguda linfoblástica y cuenta de leucocitos al diagnóstico. Cuadro I. Características de pacientes con LAL de acuerdo a inmunofenotipos. Fenotipo Expresión Antigénica Frecuencia % Pronóstico Pre-B temprana CD19, CD22 CD 79ª, CD10± 50-60 Bueno, sin incluir pacientes con t(9;22) y t(4;11) Pre-B CD19, CD22 CD79a, CD10± cIgm 20-25 Bueno, sin incluir pacientes con t(9;22) y t(4;11) Pre-B CD19, CD22 transicional CD79a, CD10± , cIgm sIgm 3-5 Bueno, sin incluir pacientes con t(9;22) y t(4;11) Células B CD19, CD22 CD79a, CD10± cIgm, sIgm, sIgk ó Igl 2-3 Moderado Células T CD3, CD7, CD5 o CD2 13-15 Malo CCG22 analizó 3,500 pacientes de acuerdo a esta clasificación y definió que aquellos niños que presentaban más de 10% de linfoblastos L2 tenían un pronóstico más desfavorable que aquellos pacientes con L1. Otro factor pronóstico importante es el estudio de médula ósea al día 14 de haber iniciado el tratamiento de inducción a la remisión. La presencia de > de 5% de linfoblastos en médula ósea va a constituir un factor pronóstico predictivo desfavorable independiente de otros factores.23 Las implicaciones de este hallazgo se traducen en un índice menor de respuesta al tratamiento de inducción a la remisión, pero además un índice alto de recaídas. Desde el punto de vista de inmunofenotipo, este estudio es esencial bajo condiciones ideales ya que ofrece no nada más un factor pronóstico (Cuadro I) pero también un tratamiento más racional para cada variedad, de tal manera que es indispensable efectuar un panel de anticuerpos monoclonales en forma rutinaria.24 Las leucemias pre B con sus tres variedades ofrece el mejor pronóstico además de que constituyen las leucemias más comunes. Las leucemias B para algunos25 son las de peor pronóstico, sin embargo en nuestra experiencia y en las de algunos grupos son de pronóstico más desfavorable26 las de inmunofenotipo T. Para el grupo BFM27 el inmunofenotipo T no es un factor pronóstico desfavorable. Se ha señalado que la presencia del antígeno común para LAL (CD10) brinda un pronóstico favorable en Rev Inst Nal Cancerol (Mex) 2000; 46 (4). 100 263 % 80 edigraphic.com 60 40 20 0 nóstico que además se asocian con falla terapéutica especialmente la 9;22.33 Las últimas dos traslocaciones son de tan mal pronóstico que todos los niños con estas alteraciones deben de estratificarse como de alto riesgo independientemente de la edad y cuenta de leucocitos al diagnóstico. La t(9;22) y la t(4;11) representan el 10% de todas las LAL de alto riesgo. Por otro lado se ha señalado por el Hospital San Judas34 que los pacientes con la traslocación 9;22 deben de ser tratados con quimioterapia siempre y cuando la cuenta de leucocitos al diagnóstico sea menor de 25,000/mm3. Cuando la cuenta esté por arriba de 25,000/mm3 al diagnóstico el paciente debe ser sometido a un trasplante alogénico. CD 10 + + CD 100 6 12 18 24 30 36 42 48 54 60 Probabilidad p = 0.06 CD 10+ (n=94), CD 10-(n=25) Rivera-Luna R, et al. Arch Med Res 1997;28:233-239. Figura 3. Sobrevida libre de enfermedad en niños con leucemia aguda linfoblástica pre-B y marcador CD10. comparación con CD10 negativo, sin embargo en LAL pre B nuestro grupo no ha encontrado diferencia en cuanto a sobrevida libre de enfermedad (Figura 3).13 Probablemente la ausencia de CD10 en leucemias T puede brindar un pronóstico más desfavorable.28 Por otro lado, la presencia de los antígenos mieloides CD13 y CD15 en LAL guardan un pronóstico desfavorable29 aun cuando el Hospital de San Judas (SJCRH) menciona que este factor pronóstico se desvanece cuando se utiliza tratamiento de quimioterapia intensa. En el caso de estos antígenos es necesario descartar que no se trate de una leucemia bifenotípica.30 El índice del ADN (ácido desoxirribonucleico) más comúnmente medido a través de citometría de flujo permite medir los linfoblastos que se encuentran en fase S del ciclo celular. De tal manera que cuando el índice es mayor de 1.16 se identifica a los pacientes con hiperdiploidia (> 50 cromosomas) siendo en estos casos una instancia de buen pronóstico31 relacionándose con una mayor sensibilidad de los agentes quimioterápicos fase-específicos. Cuando el índice de ADN está por abajo de 1.16 los pacientes comúnmente presentan hipodiploidia (< 45 cromosomas), sin embargo el peor pronóstico son aquellos pacientes con cerca de haploidia, los cuales representan < del 1% de todos los pacientes con LAL. Factores citogenéticos La traslocación t(12;21) (p12;q22) condicionan la fusión del gen TEL y AML 1 asociándose con un buen pronóstico.32 Las traslocaciones t(8;14), t(1;19), t(9;22), y t(4;11) son alteraciones de muy mal pro- Implicaciones pronósticas de enfermedad residual La reacción de la cadena de la polimerasa (PCR) es una prueba que se ha utilizado para detectar la enfermedad mínima residual (MDR) a través de la aplicación de traslocaciones específicas de células leucémicas, de rearreglos del gene de inmunoglobulinas de cadena pesada o genes de células receptoras T (TCR). La utilización de esta prueba está precisamente al finalizar el tratamiento. Se ha documentado35 que mediciones seriadas de enfermedad mínima residual durante el transcurso de un tratamiento en pacientes con LAL va progresivamente disminuyendo. Esto sugiere que el programa de quimioterapia posee un efecto citorreductivo en aquellos pacientes que permanecen en remisión completa desde el tratamiento de inducción a la remisión hasta finalizar el mismo. Por lo tanto es necesario el admitir que las posibles aplicaciones de esta prueba es predecir la recaída inminente siempre y cuando se efectúe la detección en forma seriada durante el curso de tratamiento. Otros han señalado que también sirve para estratificar grupos de riesgo.36 Es importante saber que una prueba aislada y con niveles altos no indica falla terapéutica pero persistencia de células leucémicas residuales y/o una inminente recaída.37 CONCLUSIONES Se deben de analizar los factores pronósticos para estratificar correctamente a los pacientes y por ende ofrecer un tratamiento quimioterapéutico más racional, con la menor morbiletalidad posiblemente secundaria al tratamiento. De esta manera se podrá conocer un pronóstico más preciso en cada uno de estos niños. Rivera LR. Pronóstico en leucemia aguda linfoblástica 264 Tradicionalmente se acepta que en la actualidad los factores pronósticos más sólidos son la edad y la cuenta de leucocitos. Aunado a estos dos hallazgos se debe incluir el inmunofenotipo, muy importante para el pronóstico está el estudio citogenético y las alteraciones moleculares concomitantes. Con estos parámetros se ha llegado a clasificar los factores de riesgo de cada paciente con LAL, de tal manera que se pueda clasificar a estos pacientes como de riesgo bajo, riesgo intermedio y de alto riesgo38 (Cuadros II y III). Indiscutiblemente que el valor predictivo de todos estos factores se ve anulado si el paciente permanece en remisión continua por más de 24 meses, sin embargo la excepción de alto riesgo permanece en el caso del sexo masculino, edad mayor de 10 años de edad al diagnóstico y médula ósea al día 14.39 A pesar de los grandes avances en la tecnología de las LAL es necesario entender que si bien es cierto, los estudios citogenéticos y los de biología molecular son indispensables para determinar un pronóstico y tratamiento más correcto, en un país Cuadro II. Definición de LAL de bajo riesgo de acuerdo a diferentes grupos. Grupo/ Institución Edad/Leucocitos Otros requisitos POG 1-10 años y <10,000 leucocitos o 3-5 años y < 100,000 o cualquier cuenta de leucocitos con un ADN > 1.16 Sin infiltración al sistema nervioso central, sin t(9;22) o t(1;19), sin leucemia T CCG 2-9 años y <10,000 leucocitos (niñas) o 2-9 años < 10,000 leucocitos y > 100,000 (niños) SJCRH 1-10 años y < 25,000 leucocitos Sin leucemia del sistema nervioso central, sin t(9;22) o t(1;19), sin índice de ADN > 1.16 DFCI 2-9 años y < 20,000 leucocitos Remisión al día 31, sin leucemia del sistema nervioso central, sin masa mediastinal, sin leucemia T, sin t(9;22) Sin síndrome de linfoma edigraphic.com POG: Pediatric Oncology Group, CCG: Childrens Cancer Group, SJCRH: St. Jude Childrens Research Hospital, DFCI: Dana Farber Cancer Institute. Cuadro III. Definición de LAL de riesgo intermedio y alto riesgo de acuerdo a 2 grupos cooperativos. GRUPO CCG Riesgo intermedio: Edad 2 a 9 años, leucocitos 10 a 49,000 o Edad 2 a 9 años, leucocitos < 10,000 en el sexo masculino Alto riesgo: Edad > 10 años ó Cuenta de leucocitos > de 50,000 GRUPO POG Riesgo intermedio: Edad >1 año y <10 años, leucocitos < 50,000, sexo femenino, hiperdiploidía, pre B (los 3 subtipos), índice de ADN > 1.16, líquido cefalorraquídeo con < de 5 linfoblastos al diagnóstico Alto riesgo: Edad <1 año y >10 años, leucocitos > 50,000, sexo masculino, hipodiploidía, inmunofenotipo T o B, t(9;22), t(4;11), t(1;19), índice de ADN < 1.16, líquido cefalorraquídeo > 5 linfoblastos al diagnóstico CCG: Cancer Childrens Group, POG: Pediatric Oncology Group. como México es prácticamente imposible que en forma rutinaria y a nivel nacional se lleven a cabo estos estudios. En un consenso nacional sobre la disponibilidad de pruebas en LAL,5 se encontró que de todas las instituciones hospitalarias nacionales que tratan estos pacientes solo el 16% lleva a cabo estudios de inmunofenotipos y solamente tres instituciones (7%) hospitalarias del Sector Salud efectúan los estudios citogenéticos y de biología molecular. Obviamente que se antojaría decir que estas instituciones fueran centros de referencia para todas estas pruebas, sin embargo son los recursos financieros los que limitan la formación de verdaderos centros, además del número tan elevado de niños con esta enfermedad a nivel nacional. En vista de esta situación es necesario apoyarse en factores pronósticos, los cuales continúan con mucho peso específico al diagnóstico como es la edad, cuenta de leucocitos, masa mediastinal, visceromegalia, enfermedad extramedular, cuenta de plaquetas y citomorfología de FAB en ese orden. Indiscutiblemente que el inmunofenotipo tiene un valor muy importante el cual cada laboratorio debe necesariamente desarrollar la necesidad de utilizarlo en forma rutinaria. Por último, consideramos que el factor pronóstico cardinal una vez habiendo obtenido el diagnóstico correcto y adjudicado al paciente en los factores ya enunciados es el tratamiento. Este debe de llevarse a cabo por personal profesional con experiencia utilizando protocolos sólidos y apoyados Rev Inst Nal Cancerol (Mex) 2000; 46 (4). en experiencias de grupos cooperativos para poder lograr la meta de curación. BIBLIOGRAFÍA 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. 11. 12. 13. 14. 15. 16. Farber S, Diamond LK, Mercer RD et al. Temporary remissions in acute leukemia in children produced by folic acid antagonist, 4-aminopteryl-glutamic acid (aminopterin). N Engl J Med 1948; 238: 787-93. Warren SL. Acute leukemia: A review of the literature and of twenty-eight new cases. Am J Med Sci 1929; 178: 490-6. Schorin MA, Blattner S, Gelber RD et al. Treatment of childhood acute lymphoblastic leukemia: Results of Dana-Farber Cancer Institute/Childrens Hospital ALL Consortium Protocol 85-01. J Clin Oncol 1994; 12: 740-47. Hammond D, Sather H, Nesbit M et al. Analysis of prognostic factors in acute lymphoblastic leukemia. Med Pediatr Oncol 1986; 14: 124-34. Rivera-Luna R. Primer consenso de leucemia aguda linfoblástica pediátrica en México. Rev Invest Clin 1997; 49: 309-16. Tubergen D, Gilchrist G, OBrien R et al. Improved outcome with delayed intensification for children with acute lymphoblastic leukemia and intermediate presenting features. A Children Cancer Group phase III trial. J Clin Oncol 1993; 11: 527-37. Billett AL, Gelber RD, Tarbell NJ et al. Results of Dana Farber Cancer Institute-Consortium Childhood Acute Lymphoblastic Leukemia Protocols. Intl J Ped Hem/Onc 1998; 5: 115-23. Land V, Shuster J, Crist W et al. Comparison of two schedules of intermediate-dose methotrexate and cytarabine consolidation therapy for childhood B-precursor cell acute lymphoblastic leukemia: A Pediatric Oncology Group study. J Clin Oncol 1994; 12: 1939-45. Rivera G, Raimondi S, Hancock M et al. Improved outcome in childhood acute lymphoblastic leukaemia with reinforced early treatment and rotational combination chemotherapy. Lancet 1991; 337: 61-6. Shuster JJ, Wacker P, Pullen J et al. Prognostic significance of sex in childhood B-precursor acute lymphoblastic leukemia: a Pediatric Oncology Group Study. J Clin Oncol 1998; 16: 2854-61. Pollock BH, DeBaun MR, Camitta BM et al. Racial differences in the survival of childhood B precursor acute lymphoblastic leukemia: A Pediatric Oncology Group Study. J Clin Oncol 2000; 18: 813-21. Lobato-Mendizabal E, Ruiz-Arguelles G, Marin-López A. Leukemia and nutrition I. Malnutrition is an adverse prognostic factor in the outcome of treatment of patients with standard-risk acute lymphoblastic leukemia. Leuk Res 1989; 13: 899-08. Rivera-Luna R, Cárdenas-Cardos R, Leal-Leal C et al. B-lineage Acute Lymphoblastic Leukemia of Childhood. An institutional experience. Arch Med Res 1997; 28: 233-39. Bleyer W. Central nervous system leukemia. Pediatr Clin North Am 1988; 35: 332-9. Smith M, Arthur D, Camitta B et al. Uniform approach to risk classification and treatment assignment for children with acute lymphoblastic leukemia. J Clin Oncol 1996; 14: 18-24. Robinson L, Sather H, Coccia P et al. Assessment of the interrelationship of prognostic factors in childhood acute lymphoblastic leukemia. Am J Ped Hem/Onc 1980; 2: 5-13. 265 17. West R, Graham-Pole J, Hardisty R et al. Factors in the pathogenesis of central nervous system leukemia. Br Med J 1972; 3: 311-14. 18. Leiken S, Miller D, Sather H et al. Immunologic evaluation in the prognosis of acute lymphoblastic leukemia. A report from Childrens Cancer Study Group. Blood 1981; 58: 5601-09. 19. Khalifa A, Take H, Cejka J et al. Immunoglobulins in acute leukemia in children. J Pediatr 1974; 85: 788-95. 20. Leiken S, Miller D, Sather H et al. Immunologic factors in the prognosis of acute lymphocytic leukemia. Proc Am Soc Clin Oncol 1980; 21: 372 (abstract). 21. Bennet JM, Catovsky D, Daniel MT et al. Proposals for the classification of the acute leukemias. Br J Haematol 1976; 33: 451-8. 22. Miller D, Krailo M, Bleyer W et al. Prognostic implications of blast cell morphology in childhood acute lymphoblastic leukemia: a report from the Childrens Cancer Study Group. Cancer Treat Rep 1985; 69: 1211-19. 23. Miller D, Coccia P, Bleyer W et al. Early response to induction therapy as a predictor of disease-free survival and late recurrence of childhood acute lymphoblastic leukemia. A report from the Children Cancer Study Group. J Clin Oncol 1989; 7: 1807-15. 24. Rivera-Luna R, Meza-Coria C, Cárdenas-Cardos R et al. Immunophenotypes in Mexican children with acute lymphoblastic leukemia: An experience from a single institution. Intl J Ped Hem/Onc 1996; 3: 57-61. 25. Margolin JF and Poplack DG. Acute lymphoblastic leukemia. In: Pizzo PH. A and Poplack DG eds. Principles and practice of pediatric oncology. Third edition. Philadelphia: Lippincott, 1997: 409. 26. Crist W, Pullen J, Boyett J et al. Clinical and biologic features predict a poor prognosis in acute lymphoid leukemia in infants: A Pediatric Oncology Group Study. Blood 1986; 67: 135-40. 27. Riehm H, Feickert H, Schrappe M, et al. Therapy results in five ALL-BFM sutides since 1970: Implications of risk factors for prognosis. Haematol Blood Transfus 1987;30:139-46. 28. Babusikova O, Hrivnakova A, Cap J et al. Diagnosis and analysis of the clinical course of T-phenotype acute lymphoblastic leukemia. Neoplasms 1988; 35: 683-90. 29. Pui C-H, Raimondi S, Head D et al. Characterization of childhood acute leukemia with multiple myeloid and lymphoid markers at diagnosis and at relapse. Blood 1991; 78: 1327-34. 30. Altman A. Clinical features and biological implications of acute mixed lineage (hybrid) leukemias. Am J Pediatr Hematol Oncol 1990; 12: 123-30. 31. Rubnitz JE, Pui C-H. Childhood acute lymphoblastic leukemia. The Oncologist 1997; 2: 374-80. 32. Rubnitz, Downing JR, Pui C-H et al. TEL gene rearrangement in acute lymphoblastic leukemia: a new genetic marker with prognostic significance. J Clin Oncol 1997; 15: 1150-57. 33. Fletcher JA, Lynch EA, Kimball VM et al. Translocation (9;22) is associated with extremely poor prognosis in intensively treated children with acute lymphoblastic leukemia. Blood 1991; 77: 435-39. 34. Ribeiro RC, Broniscer A, Rivera GK et al. Philadelphia chromosome-positive acute lymphoblastic in children: Durable responses to chemotherapy associated with low initial white blood cell counts. Leukemia 1997; 11: 1493-96. 35. Yokota S, Hansen-Hagge TE, Ludwig WD et al. Use of polymerase chain reaction to monitor minimal residual disease in acute lymphoblastic leukemia. Blood 1991; 71: 331-39. edigraphic.com Rivera LR. Pronóstico en leucemia aguda linfoblástica 266 36. Nizet Y, Mariat P, Vaerman JL et al. Follow up of residual disease (MDR) in B lineage acute leukaemias using a simplified PCR strategy: Evolution of MDR rather than its detection is correlated with clinical outcome. Br J Haematol 1991; 79: 205-10. 37. Yamada M, Wasserman R, Lange B et al. Minimal residual disease in childhood B-lineage lymphoblastic leukemia. N Engl J Med 1990; 323: 448-55. 38. Pui C-H, Crist W. Biology and treatment of acute lymphoblastic leukemia. J Pediatr 1994; 124: 491-03. 39. Chessells J, Hardisty R, Richards S. Long survival in childhood lymphoblastic leukaemia. Br J Cancer 1987; 55: 315-21. edigraphic.com Dirección para correspondencia: Dr. Roberto Rivera Luna Subdirección de Hematología/ Oncología/ Radioterapia Instituto Nacional de Pediatría, SS Av. Insurgentes Sur 3700-C. 04530 México D.F Fax: 55 28 28 32 CE: [email protected] Fecha de recepción: 26/06/00. Fecha de aceptación: 12/07/00.