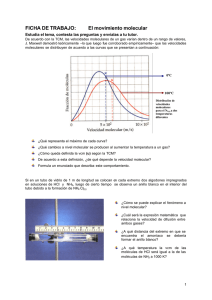
mt - Universidad Nacional del Callao.
Anuncio

UNIVERSIDAD NACIONAL DEL CALLAO FACULTAD DE INGENIERÍA PESQUERA Y DE ALIMENTOS INSTITUTO DE INVESTIGACIÓN DE LA FIPA INFORME FINAL DE INVESTIGACION TEXTO: “PRINCIPIOS DE TRANSFERENCIA DE MASA EN LA INGENIERIA DE ALIMENTOS “ Dra. ISABEL JESÚS BERROCAL MARTÍNEZ (01 de Mayo del 2009 al 30 de Abril del 2011. Resolución Rectoral Nº550-09-R.) 2011 1 INDICE I. INDICE .........................................................................................................................................................2 II. RESUMEN ....................................................................................................................................................6 III. INTRODUCCION ...........................................................................................................................................7 3.1. 3.2. 3.3. IV. EXPOSICIÓN DEL TEMA ..............................................................................................................................7 OBJETIVOS .............................................................................................................................................8 IMPORTANCIA Y JUSTIFICACIÓN DE LA INVESTIGACIÓN .....................................................................................8 MARCO TEORICO.....................................................................................................................................9 CAPITULO I ...........................................................................................................................................................9 TRANSFERENCIA DE MASA EN ESTADO ESTACIONARIO ...................................................................................9 1.1. Introducción ....................................................................................................................................9 1.2. Difusión Molecular en Gases ........................................................................................................11 1.3. 1.4. Difusión Molecular en Sólidos. ........................................................................................................................ 12 Difusión Molecular en Líquidos ....................................................................................................................... 13 CAPITULO II ........................................................................................................................................................15 TRANSFERENCIA DE MASA EN GASES ............................................................................................................15 2.1. Difusión Molecular en Gases........................................................................................................15 2.2. Contra Difusión Equimolar en Gases. ............................................................................................15 2.3. Graficas de Difusión Molecular .....................................................................................................16 2.4. Graficas de Contradifusión Equimolar ..........................................................................................17 CAPITULO III ....................................................................................................................................................18 TRANSFERENCIA DE MASA EN GASES - GAS “A” QUE SE DIFUNDE A TRAVES DE “B” NO DIFUSIVO Y EN REPOSO. ........................................................................................................................................................18 3.1. Transferencia de Masa del Gas A que se Difunde en un Gas B Estacionario ...................................18 3.2. Difusividad de Agua en Aire en Reposo Cuando en el Laboratorio de Humidificación se Coloca una Bandeja......................................................................................................................................................21 3.3. Difusión a Través de un área de Sección Transversal Variable ...........................................................24 CAPITULO IV .......................................................................................................................................................30 COEFICIENTE DE DIFUSION PARA GASES ........................................................................................................30 4.1. Determinación Experimental de Coeficientes de Difusión. ...........................................................30 4.2. Datos Experimentales de Difusividad. ..........................................................................................33 4.3. Predicción de la Difusividad de Gases. ..........................................................................................33 CAPITULO V .......................................................................................................................................................37 DIFUSIVIDAD MOLECULAR EN MEZCLA GASEOSA ..........................................................................................37 5.1. Estados de agregación de la materia ............................................................................................37 5.2. Propiedades Generales de los Gases. ............................................................................................39 5.3. Teoría Cinético-Molecular de los Gases. .......................................................................................39 5.4. Leyes Generales de los Gases Ideales. ..........................................................................................40 5.5. Ley de Boyle-Mariotte. .................................................................................................................41 2 5.6. 5.7. 5.8. 5.9. 5.10. 5.11. 5.12. Ley de Charles-Gay Lussac ............................................................................................................42 Ecuación General de los Gases Perfectos. .....................................................................................45 Ley de Avogadro. ..........................................................................................................................46 Ecuación de Estado de los Gases Perfectos. ..................................................................................47 Mezclas de Gases. Ley de Dalton. .................................................................................................47 Difusión Gaseosa. Ley de Graham. ...............................................................................................50 Estimación de la Difusividad Gaseosa ..........................................................................................52 CAPITULO VI.......................................................................................................................................................59 TRANSFERENCIA DE MASA EN LÍQUIDO .........................................................................................................59 6.1 INTRODUCCION ............................................................................................................................59 6.2 ECUACIONES PARA LA DIFUSIÓN MOLECULAR EN LÍQUIDOS. ......................................................59 6.3 PREDICCIÓN DE DIFUSIVIDADES EN LÍQUIDOS ..............................................................................68 CAPITULO VII .................................................................................................................................................71 TRANSFERENCIA DE MASA EN SOLIDOS ..........................................................................................................71 7.1 INTRODUCCION ............................................................................................................................71 7.2 Empaques Permeables ..................................................................................................................73 7.3 Empaques Impermeables Herméticamente Cerrados ...................................................................73 7.4 Tipos de Difusión en Sólidos..........................................................................................................76 7.5 Indicadores de Transferencia de Masa en Sólidos. .......................................................................76 7.5.1 7.5.2 Concepto de Permeabilidad ............................................................................................................................. 76 Concepto de Solubilidad ................................................................................................................................... 78 CAPITULO VIII ................................................................................................................................................99 TRANSFERENCIA DE MASA EN GELES BIOLOGICOS .........................................................................................99 8.1 Transferencia de Masa en Geles Biológicos. .................................................................................99 8.1 Transferencia de Masa Predictiva en Fluidos no Newtonianos................................................... 103 CAPITULO IX .....................................................................................................................................................109 DIFUSION EN ESTADO NO ESTACIONARIO-DEDUCCION DE LA ECUACION BASICA.......................................... 109 9.1 Difusión en estado no estacionario............................................................................................. 109 9.2 Deducción de la Ecuación Básica................................................................................................ 109 9.4 Difusión en Estado No Estacionario en Diversas Geometrías...................................................... 111 9.5 Transferencia de Masa en Estado no Estacionario en Figuras Esféricas y Cilíndricas. ................ 113 V. MATERIALES Y METODOS...................................................................................................................125 VI. RESULTADOS .......................................................................................................................................126 VII. DISCUSION ..........................................................................................................................................127 VIII. REFERENCIAS BIBLIOGRAFICAS ...........................................................................................................130 IX. APENDICES ..............................................................................................................................................131 X. ANEXOS ...................................................................................................................................................132 3 INDICE DE FIGURAS Fig. 1: Difusión Molecular del Gas A en el Gas B ...................................................................................16 Fig. 2: : Gas A se Difunde en un Gas B desde el Punto (1) al Punto (2) y el Gas B se Difunde en Sentido Contrario hacia el gas A ..........................................................................................................17 Fig. 3: Contradifusión Equimolar ...........................................................................................................17 Fig. 4: Difusión de A a través de B no Difusivo ......................................................................................19 Fig. 5: Difusión de Agua en Aire en un Tanque ......................................................................................23 Fig. 6: Difusión desde una esfera al medio circundante ........................................................................25 Fig. 7: Transferencia de un Líquido Puro en Medio Gaseoso ..............................................................30 Fig. 8: Medición de la Difusividad de Gases con el Método de los Bulbos. ...........................................32 Fig. 9: Relación Presión - Volumen y Temperatura Constante ............................................................42 Fig. 10: Relación Volumen-Temperatura a Presión Constante .........................................................45 Fig. 11: Ley de Las Presiones Parciales de Dalton ................................................................................48 Fig. 12: Difusión Gaseosa. Ley de Graham.............................................................................................51 Fig. 13: Concentraciones en transferencia de masa no estacionarios .................................................113 Fig. 14: Figuras amorfas de transferencia de masa en estado no estacionario ...................................113 Fig. 15: Transferencia de masa en figuras cilíndricas ..........................................................................114 Fig. 16: Transferencia de masa en eje radial y de ordenadas ..............................................................115 Fig. 17: Transferencia de masa en estado no estacionario para figuras cilíndricas ............................117 Fig. 18: Transferencia de masa en estado no estacionario-cilindros con posición de ordenadas .......119 Fig. 19: Transferencia de masa de figuras cilindricas usando planos ..................................................120 Fig. 20: Transferencia de masa en estado no estacionario para figuras cilíndricas ............................122 4 INDICE DE ANEXOS ANEXO 1: COEFICIENTE DE DIFUSIÓN MOLECULAR PARA LÍQUIDOS................................................132 ANEXO 2: COEFICIENTE DE DIFUSIÓN DE GASES A 101.32 kPa DE PRESIÓN .......................................133 ANEXO 3: VOLUMENES DE DIFUSIÓN ATÓMICA PARA EL MÉTODO DE FULLER, SCHETTLER Y GIDDINGS ............................................................................................................................................................135 INDICE DE APENDICES APENDICE 1: Datos de Transferencia de Masa en Estado No Estacionario Gases APENDICE 2: Datos de Transferencia de Masa en Estado No Estacionario Líquidos 5 II. RESUMEN La ingeniería de procesos en alimentos se manifiesta través de los fenómenos de transporte de: transferencia de movimiento o momentum, trasferencia de masa, trasferencia de calor respectivamente, los cuales interaccionan directamente con los sistemas bioquímicos alimentarios durante el proceso, transformación y conservación, haciendo uso de tecnologías limpias y sustentables que cumplan con normas y estándares de calidad sin contaminar el medio ambiente. El presente texto de “Principios de Transferencia de Masa en la Ingeniería de Alimentos “Brinda conocimientos específicos y aplicativos de transferencia de masa en alimentos, teniendo en cuenta las características físico químicas, bioquímicas y funcionales de los alimentos. Se hace el estudio del proceso de migración molecular en los alimentos a partir de la ley de Fick en sus diferentes estados, liquido, solido, gaseoso. Cabe mencionar que las frutas, verduras, carnes, lácteos etc., tienen en su estructura molecular compuestos volátiles predominantes como: ácidos orgánicos, compuestos proteicos volátiles, ácidos grasos volátiles, compuestos orgánicos volátiles, los cuales interactúan sinérgicamente alimento – empaque en su proceso migratorio molecular . Es así que el presente texto comprende: El primer capítulo aborda, la transferencia de masa en estado estacionario, En el segundo capítulo aborda, la transferencia de masa en gases, En el tercer capítulo aborda la transferencia de masa en gases, del A que se difunde a través de B estacionario. En el cuarto capítulo aborda coeficiente de difusión para gases En el quinto capítulo aborda difusividad molecular en mezcla gaseosa En el sexto capítulo aborda transferencia de masa en líquido En el séptimo capítulo aborda transferencia de masa en solido En el octavo capítulo aborda transferencia de masa en geles biológicos En el noveno capítulo aborda Transferencia de masa en estado no estacionario 6 III. INTRODUCCION 3.1. Exposición del Tema Con el avance de la Ciencia, la Tecnología y la Ingeniería de procesos en alimentos se vienen desarrollando flujos, procesos de endogenización tecnológica, con cambios continuos y permanentes en los Sistemas de Trasferencia de Masa específicamente en los procesos, de trasformación y conservación aplicado a la Ingeniería de Alimentos. Como sabemos en el área de Ingeniería de Procesos en Alimentos tiene tres aspectos importantes como son los fenómenos de transporte: 1) trasferencia de movimiento o momentum 2) Trasferencia de Masa y 3) Trasferencia de Calor. Es así que en el presente texto, se da a conocer aspectos específicos de transferencia de masa en alimentos aplicado a sistemas bioquímicos alimentarios, que sirva como material de académico de consulta, de soporte en su formación profesional y guía de trabajo a estudiantes, profesionales, empresarios, comunidad académica de la especialidad, ya que en la facultad los estudiantes no cuentan con textos específicos y aplicativos al área de Transferencia de Masa en Alimentos. Finalmente se puede plantear con la siguiente interrogante: ¿Existe un texto específico y aplicativo al área de Ingeniería de Procesos en Alimentos que desarrolle los principios de trasferencia de masa aplicado a los alimentos? 7 Con el desarrollo de este texto se tendrá una herramienta adecuada para el conocimiento de los principios de trasferencia de masa aplicado a la Ingeniería de Procesos en alimentos para la Solución de problemas que se presenten en los Procesos alimentarios. 3.2. Objetivos 3.2.1. Sistematizar las teorías de Ingeniería de Alimentos para una mejor comprensión por parte del estudiante y todo profesional interesado en los principios de transferencia de masa en los Alimentos. 3.2.2. Desarrollar un texto de: Principios de Trasferencia de Masa en la Ingeniería de Alimentos 3.3. Importancia y Justificación de la Investigación En el desarrollo del texto: ”Principios de Transferencia de Masa en la Ingeniería de Alimentos” es importante porque proporcionará información técnica especializada y actualizada generada por industrias extranjeras, Centros de Investigación y Organizaciones Internacionales. Expondrá modelos aplicativos para ingeniería de alimentos, permitiendo una cabal comprensión de los procesos y de flujos adecuados a las nuevas exigencias internacionales. 8 IV. MARCO TEORICO A continuación se redacta el texto titulado “Principios de Trasferencia de Masa Aplicado a la Ingeniería de Alimentos” obteniéndose información a través de la investigación bibliográfica y de la experiencia en la Cátedra Universitaria del Curso de Ingeniería de alimentos II, en estos 16 años de labor académica. Se redacta por capítulos los cuales se detallan a continuación. CAPITULO I TRANSFERENCIA DE MASA EN ESTADO ESTACIONARIO 1.1. Introducción Envasar los alimentos es una práctica relativamente reciente que persigue alargar la vida comercial de los alimentos. Para ello, es necesario que el alimento no se contamine. El aislamiento es, en este punto, una de las prioridades fundamentales del envase. Se necesita una impermeabilidad adecuada a la humedad, al oxígeno o incluso a la luz; pero, al mismo tiempo, se produce una migración desde los materiales del envase hacia el alimento, por lo que es necesario controlar el tipo y la calidad del envase con el fin de impedir que este fenómeno se traduzca en toxicidad para los consumidores. (RODRIGUEZ, 2006). Trasferencia de masa. Es el fenómeno de transferir gases, líquidos, sólidos a en una dirección de gradiente direccional a través de un medio como sistema determinado. 9 Hay dos modos de transferencia de masa: Transferencia de Masa Molecular. Cuando la masa puede transferirse por medio del movimiento molecular fortuito en los fluidos (movimiento individual de las moléculas), debido a una diferencia de concentraciones. La difusión molecular puede ocurrir en sistemas de fluidos estancados o en fluidos que se están moviendo. Transferencia de Masa Convectiva. Sucede cuando La masa puede transferirse debido al movimiento global del fluido. Puede ocurrir que el movimiento se efectúe en régimen laminar o turbulento. El flujo turbulento resulta del movimiento de grandes grupos de moléculas y es influenciado por las características dinámicas del flujo. Tales como densidad, viscosidad, etc. Usualmente, ambos mecanismos actúan simultáneamente. Sin embargo, uno puede ser cuantitativamente dominante y por lo tanto, para el análisis de un problema en particular, es necesario considerar solo a dicho mecanismo. La transferencia de masa en sólidos porosos, líquidos y gases sigue el mismo principio, descrito por la ley de Fick. Difusión Molecular. Es el movimiento de las moléculas de los componentes de una mezcla debido a la diferencia de concentraciones existente en el sistema. La difusión de las moléculas se produce en la dirección necesaria para eliminar gradiente de concentración. Si se mantiene el gradiente añadiendo continuamente material nuevo a la región de alta concentración y eliminándolo de la región de baja 10 concentración, la difusión será continua. Esta situación se presenta a menudo en las operaciones de transferencia de materia y sistema de reacción (DORAN M., 1998). Difusión Molecular. Es el mecanismo de transferencia de masa en fluidos estancados o en fluidos que están en movimiento, únicamente mediante flujo laminar, aún cuando siempre está presente hasta el flujo turbulento muy intenso (TREYBAL, 1998) . Ejemplos de Procesos de Transferencia de Masa. La trasferencia de masa se da en todos los sistemas bioquímicos alimentarios: -En el proceso tecnológico de enlatados de alimentos -En los procesos tecnológicos de lácteos y derivados -En los procesos tecnológicos de frutas confitadas -En los procesos tecnológicos de tecnología azucarera 1.2. Difusión Molecular en Gases Es el fenómeno por el cual las moléculas de un gas se distribuyen uniformemente en el otro gas. También se establece como la capacidad de las moléculas gaseosas para pasar a través de aberturas pequeñas, tales como paredes porosas, de cerámica o porcelana que no se halla vidriada. Ley de la Difusión Gaseosa 11 Fue establecida por Thomas Graham; quien manifiesta lo siguiente:“En las mismas condiciones de presión y temperatura, las velocidades de difusión de dos gases son inversamente proporcionales a las raíces cuadradas de sus masas moleculares.” Análisis: Llamemos M1 a la masa de las moléculas de una especie y M2 a la masa de las moléculas de otra especie. Entonces, las energías cinéticas promedio de las moléculas de cada gas están dadas por las expresiones: Así mismo, donde V1 y V2 son las velocidades de difusión de los gases que se comparan y d1 y d2 son las densidades. Las densidades se pueden relacionar con la masa y el volumen porque ; cuando M sea igual a la masa molecular y V al volumen molecular, podemos establecer la siguiente relación entre las velocidades de difusión de dos gases y su peso molecular: 1.3. Difusión Molecular en Sólidos. 12 La difusión puede ser definida como el mecanismo por el cual la materia es transportada por la materia. Los átomos de gases, líquidos y sólidos están en constante movimiento y se desplazan en el espacio tras un período de tiempo. En los gases, el movimiento de los átomos es relativamente veloz, tal efecto se puede apreciar por el rápido avance de los olores desprendidos al cocinar o el de las partículas de humo. En los líquidos, los átomos poseen un movimiento más lento, esto se pone en evidencia en el movimiento de las tintas que se disuelven en agua líquida. El transporte de masa en líquidos y sólidos se origina generalmente debido a una combinación de convección (movilización de fluido) y difusión. En los sólidos, estos movimientos atómicos quedan restringidos (no existe convección), debido a los enlaces que mantienen los átomos en las posiciones de equilibrio, por lo cual el único mecanismo de transporte de masa es la difusión. Sin embargo las vibraciones térmicas que tienen lugar en sólidos permiten que algunos átomos se muevan. La difusión de éstos en metales y aleaciones es particularmente importante si consideramos el hecho de que la mayor parte de las reacciones en estado sólido llevan consigo movimientos atómicos; como ejemplo se pueden citar la formación de núcleos y crecimiento de nuevos granos en la recristianización de un metal trabajado en frío y la precipitación de una segunda fase a partir de una solución sólida. 1.4. Difusión Molecular en Líquidos La velocidad de difusión molecular en líquidos es mucho menor que en gases. Las moléculas de un líquido están muy cercanas entre sí en comparación con las de un gas; 13 la densidad y la resistencia a la difusión de un líquido son mucho mayores, por tanto, las moléculas de A que se difunde chocarán con las moléculas de B con más frecuencia y se difundirán con mayor lentitud que en los gases. Debido a esta proximidad de las moléculas las fuerzas de atracción entre ellas tiene un efecto importante sobre la difusión. En general, el coeficiente de difusión de un gas es de un orden de magnitud de unas 10 veces mayor que un líquido. La teoría cinético-molecular de los líquidos está mucho menos desarrollada que la de los gases. Por esta razón, la mayor parte de los conocimientos referente a las propiedades de transporte se han obtenido experimentalmente. Se han elaborado varias teorías y modelos, pero los resultados de las ecuaciones obtenidas aún presentan desviaciones notables con respecto a los datos experimentales. En la difusión de líquidos, una de las diferencias más notorias con la difusión en gases es que las difusividades suelen ser bastante dependientes de la concentración de los componentes que se difunden. 14 CAPITULO II TRANSFERENCIA DE MASA EN GASES 2.1. Difusión Molecular en Gases. Es el fenómeno por el cual las moléculas individuales de un gas A se desplazan a través de otro, se distribuyen en otro gas B por medio de desplazamientos individuales y desordenados de las moléculas. También se establece como la capacidad de las moléculas gaseosas para pasar a través de aberturas pequeñas, tales como paredes porosas, de cerámica o porcelana que no se halla vidriada. La difusión molecular a veces se llama también proceso con trayectoria aleatoria. La difusión molecular (o transporte molecular) puede definirse como la transferencia (o desplazamiento de moléculas individuales a través de un fluido por medio de los desplazamientos individuales y desordenados de las moléculas. Podemos imaginar a las moléculas desplazándose en línea recta y cambiando su dirección al rebotar otras moléculas cuando chocan, las moléculas se desplazan en trayectorias al azar, la difusión molecular a veces se llama también proceso con trayectoria aleatoria (GEANKOPLIS, 1998) . 2.2. Contra Difusión Equimolar en Gases. Es el fenómeno por el cual las moléculas de un gas B se distribuyen en sentido contrario en otro gas A dentro del proceso de difusión molecular. Se muestra un diagrama para dos gases, A y B, a presión total constante P, en dos cámaras grandes, conectadas por un tubo que sirve para que se verifique la difusión molecular en estado 15 estacionario. Una agitación en ambas cámaras mantiene uniformes sus concentraciones. 2.3. Graficas de Difusión Molecular En la figura se muestra esquemáticamente el proceso de difusión molecular. Se ilustra la trayectoria desordenada que la molécula A puede seguir al difundirse del punto (1) al (2) a través de las moléculas de B. Si hay un número mayor de moléculas de A cerca del punto (1) con respecto al punto (2), entonces, y puesto que las moléculas se difunden de manera desordenada ,en ambas direcciones, habrá más moléculas de A difundiéndose de (1) a (2) que de (2) a (1). La difusión neta de A va de una región de alta concentración a otra de baja concentración. Gas A se Difunde en un Gas B desde el Punto (1) al Punto (2) B B B B B (1) B B B B B B B B B B B B B B A B B B B B B B B B B B (2) A B B B B B B B B B B B B B B B B B B B Fig. 1: Difusión Molecular del Gas A en el Gas B B 16 2.4. Graficas de Contradifusión Equimolar La presión parcial PA1 > PA2 y PB2 > PB1. Las moléculas de A se difunden hacia la derecha y las de B hacia la izquierda. Puesto que la presión total P es constante en todo el sistema, los moles netos de A que se difunden hacia la derecha deben ser iguales a los moles netos de B, que lo hacen hacia la izquierda. Si no fuera así, la presión total no se mantendría constante. PA1 PA2 1 2 PB1 PB2 Fig. 2: : Gas A se Difunde en un Gas B desde el Punto (1) al Punto (2) y el Gas B se Difunde en Sentido Contrario hacia el gas A P Total PA1 PB2 PB1 A1 PA2 A2 B1 B2 Fig. 3: Contradifusión Equimolar 17 CAPITULO III TRANSFERENCIA DE MASA EN GASES - GAS “A” QUE SE DIFUNDE A TRAVES DE “B” NO DIFUSIVO Y EN REPOSO. 3.1. Transferencia de Masa del Gas A que se Difunde en un Gas B Estacionario El caso de la difusión de A a través de B, que está estacionario y no se difunde, es una situación de estado estacionario bastante frecuente. En este caso, algún límite al final de la trayectoria de difusión es impermeable al componente B, por lo que éste no puede atravesarlo. Un ejemplo es el que se muestra en la figura (1), para la evaporación de un líquido puro como el benceno (A) en el fondo de un tubo estrecho, por cuyo extremo superior se hace pasar una gran cantidad de aire (B) inerte o que no se difunde. El vapor de benceno (A) se difunde a través del aire (B) en el tubo. El límite en la superficie líquida en el punto 1 es impermeable al aire, pues éste es insoluble en el benceno líquido. Por consiguiente, el aire (B) no puede difundirse en la superficie o por debajo de ella. En el punto 2, la presión parcial PA 2 = 0, pues pasa un gran volumen de aire. Otro ejemplo es la absorción de vapor de NH3 (A) del aire (B) en agua. La superficie del agua es impermeable al aire pues éste es muy poco soluble en agua. De esta forma, y puesto que B no puede difundirse, NB = 0. Para deducir el caso de A que se difunde en B estacionario, en la ecuación general (3.1) se sustituye NB = 0 (GEANKOPLIS, 1998) . 18 PA2 Aire Benceno Líquido Fig. 4: Difusión de A a través de B no Difusivo A continuación se tienen ecuaciones que son utilizadas para ser reemplazadas en la ecuación (3.2) Si se mantiene constante la presión total P, se sustituye: Tenemos otras relaciones: Así, mismo: Algunas de estas ecuaciones se sustituyen en la ecuación (3.2) 19 Donde: 20 Luego se tienen los siguientes valores a ser reemplazados en la ecuación (3.4) + + Reemplazando (9 ) en (7 ) se tiene la Ecuación a partir de la ley de Fick de Transferencia de Masa de un Gas A que se trasfiere en un Gas B estacionario : 3.2. Difusividad de Agua en Aire en Reposo Cuando en el Laboratorio de Humidificación se Coloca una Bandeja Ejemplo: 21 Estimar la difusividad del agua en el aire cuando en el laboratorio de humidificación se coloca una bandeja con agua frente a una corriente de aire. El sistema se encuentra en equilibrio térmicamente a 37 ºC. La presión de vapor en la superficie es 0.064 atmosferas y a una distancia de 3 cm. la bandeja tiene 25 cm. de lado. Hallar la cantidad de gramos de agua que se evapora en 2 horas si la difusividad es de . I. Datos Unidad-Magnitud Difusividad Distancia de Transferencia 3cmt Temperatura 37ºC Presión Parcial en la Superficie Presión Total del Sistema Lado de la Bandeja 25 cm Constante de Gases ºK= ºC + 273,15 II. Planteamiento Se utilizarán las siguientes ecuaciones 22 25 cm cmtc mt Z2 3 cm PA2 Z1 PA1 Fig. 5: Difusión de Agua en Aire en un Tanque III. Solución Se reemplazaran los datos en las ecuaciones siguientes: 23 0,96 Con los datos desarrollados se reemplaza en la ecuación siguiente: 3.3. Difusión a Través de un área de Sección Transversal Variable En los casos de estado estable discutidos, se ha considerado a N A y J *A : como constantes en las integraciones. En dichos ejemplos, el área de sección transversal A m2 a través de la cual se verifica la difusión, es invariable y la distancia z cambia. En algunas situaciones, el área A puede cambiar. Entonces, resulta conveniente definir N A como 24 Donde N A es moles kg de A difundiéndose por segundo o mol kg/seg. En estado estable, N A será constante cuando el área varíe (GEANKOPLIS, 1998). Se considerará el caso de la difusión en un gas hacia o desde una esfera. Esta situación es frecuente en casos de evaporación de una gota de líquido, la evaporación de una bola de naftaleno y en la difusión de nutrientes a un microorganismo de forma esférica en un líquido. En alimentos, se tiene en el caso de vegetales y frutas expuestas al aire donde se va evaporando sus fluidos (gases y líquidos) trátese de ácidos orgánicos volátiles predominantes, en el caso de productos cárnicos semi procesados secos salados también eliminan compuestos orgánicos propios . En la Fig.(6) Siguiente se muestra una esfera de radio r1 fijo en un medio gaseoso infinito. El componente (A) a presión parcial PA1 en la superficie, se está difundiendo en el medio estacionario circundante (B), donde el valor de PA2, A2 a una distancia grande es igual a cero. Se supondrá una difusión de estado estable. El flujo específico N A puede representarse con la Ecuación (3.8) donde A es el área de sección transversal en el punto a una distancia r desde el centro de la esfera. Además, N A es constante cuando se trata de estado estable, NA R2 R1 25 R1 PA1 NA PA2 Puesto que es un caso de A difundiéndose a través de B en reposo, se usará la Ecuación de gas estacionario, en su forma diferencial Igualando N A a : Reemplazando dz por dr Para obtener: Reordenando Donde r2 > r1 e integrando entre r1 y r2 a gran distancia se tiene: ; 26 + + Reemplazando (3.14) en (3.13 ) se tiene: Dándole forma a la ecuación multiplicamos ambos lados x 27 Donde finalmente la ecuación queda: Esta ecuación también puede usarse para líquidos, donde DAB es la difusividad de A en el líquido. EJEMPLO: Difusión Molecular del Acido Málico de Cerezas en el Medio que la Rodea (Aire). En una prueba de conservación de frutas se tomó al azar una cereza que tiene la forma de una esfera con 2 cm de radio, y es expuesta al ambiente en un gran volumen de aire estacionario a 293 ºK y 1.01325x105 Pa (1 atm). Puede suponerse que la temperatura superficial de la cereza es del acido málico volátil de 293 ªK, la presión de vapor a esta temperatura es de 0,498 atmosferas. El valor de DAB del Ac. Málico en aire a 293º K es 4,752 X 10-5 m2/seg. Calcúlese la velocidad de evaporación del acido málico en el aire (superficie). I.Datos Unidad-Magnitud 28 Difusividad Distancia de Transferencia Temperatura (2cmt) ( 2 x 10 -2 mt) (20ºC) (293ºK) Presión Parcial en la Superficie Presión Total del Sistema Constante de Gases ºK= ºC + 273,15 II.Planteamiento Se aplica las ecuaciones siguientes: III.Solucion: Reemplazando en (b) se tiene: 29 Reemplazando en (a ) se tiene : CAPITULO IV COEFICIENTE DE DIFUSION PARA GASES En el presente capitulo se identificarán algunos coeficientes para la Difusión de los Gases 4.1. Determinación Experimental de Coeficientes de Difusión. Se han usado numerosos métodos experimentales para determinar la difusividad molecular de mezclas gaseosas binarias. Algunos de los más importantes son como sigue. Uno de ellos consiste en evaporar un líquido puro en un tubo estrecho haciendo pasar un gas sobre el extremo superior, tal como se muestra en la Figura (7), Se mide entonces la disminución del nivel del líquido con respecto al tiempo y la difusividad se calcula con la ecuación. Z2 PA1 30 Z1 PA1 Las difusividades de los vapores de sólidos tales como naftaleno, yodo y ácido benzoico se han obtenido midiendo la velocidad de evaporación de una esfera. Se usa entonces la Ecuación: En otro procedimiento, dos gases puros a presiones iguales se encierran en secciones independientes de un tubo largo, separados por una partición. La partición se retira con lentitud iniciándose la difusión. Después de transcurrido cierto tiempo se vuelve a introducir la partición y se analiza el gas de cada sección. Uno de los métodos más útiles y comunes es el procedimiento de dos bulbos. El aparato consiste en dos bulbos de vidrio cuyos volúmenes V l y V2 en m3 están conectados por un capilar de área A m 2 y longitud L, de volumen muy pequeño en comparación con V1 y V2, tal como lo muestra la Fig. 8. En V1 se introduce A puro y en V2 B puro, ambos a la misma presión. Se abre la válvula, se deja que la difusión se verifique por cierto tiempo y se cierra otra vez, analizando por separado las mezclas 31 de cada cámara. Las ecuaciones pueden deducirse si se desprecia el volumen capilar y se supone que ambos bulbos siempre tienen concentraciones uniformes. En el caso de difusión de estado cuasi estable en el capilar (GEANKOPLIS, 1998). B V2 C2 Z V1 L A C1 Fig. 8: Medición de la Difusividad de Gases con el Método de los Bulbos. C2 es la concentración de A en V2 al tiempo t, y C1 en V1• La rapidez de difusión de A que pasa a V2 es igual a la velocidad de acumulación en este volumen, El valor promedio C Prom en equilibrio puede calcularse con un balance de materiales en base a las composiciones iniciales y cuando t = 0. Un balance similar después del tiempo t nos da 32 Sustituyendo C1 en la Ecuación (4.5) en la Ecuación (4.6), reordenando e integrando entre t = 0 y t = t , se obtiene la ecuación final: DAB Puede calcularse obteniendo c2 con un muestreo al tiempo t . 4.2. Datos Experimentales de Difusividad. Se muestran algunos valores típicos que van desde trata de una molécula grande), hasta temperaturas ambiente. La relación entre la difusividad en (cuando se , en el caso de H 2 a y es. 4.3. Predicción de la Difusividad de Gases. La difusividad de una mezcla binaria de gases en la región de gases diluidos, esto es, a presiones bajas cercanas a la atmosférica, puede predecirse con la teoría cinética de los gases. Se supone que el gas consiste de partículas esféricas rígidas completamente elásticas en sus colisiones con otras moléculas, lo que implica conservación del ímpetu. 33 Con un tratamiento simplificado, se supone que no existen fuerzas de atracción de repulsión entre las moléculas. La deducción utiliza la trayectoria libre media l , que es la distancia promedio que una molécula recorre entre dos colisiones. La ecuación final es Donde u es la velocidad promedio de las moléculas. La ecuación final que se obtiene después de sustituir las expresiones de u y en (4.9) es aproximadamente correcta, pues predice en forma acertada que DAB es proporcional a l/presión, e incluye de manera aproximada, la predicción del efecto de la temperatura. Un tratamiento más correcto y riguroso debe considerar las fuerzas intermoleculares de atracción y repulsión entre las moléculas, así como los tamaños diferentes de las moléculas de A y B. Chapman y Enskog (H3) han resuelto la ecuación de Boltzmann, que no se basa en la trayectoria libre media , sino que usa una función de distribución. Para resolver la fórmula se tiene que usar una relación entre las fuerzas de atracción y repulsión para cierto par de moléculas. En el caso de un par de moléculas no polares, La función de Leonard-Jones constituye una aproximación bastante razonable. La relación final para predecir la difusividad de un par de gases de moléculas de A y B es: 34 Donde DAB es la difusividad en molecular de , T es la temperatura en ºK, MA es el peso es el peso molecular de B y P es la presión absoluta en atm. El término es un "diámetro promedio de colisión" y , es una integral de colisión basada en el potencial de Lennard-Jones. Diversas referencias proporcionan los valores de La integral de colisión y . es una relación que proporciona la desviación de un gas con interacción al comprobarlo con un gas de esferas rígidas de comportamiento elástico. Este valor sería 1.0 para un gas sin interacciones. La Ec. (4.9) predice difusividades con una desviación promedio de aproximadamente 8% hasta niveles de 1000 ºK. Para una mezcla gaseosa polar-no polar, puede aplicarse la Ec. (4.10) si se usa la constante de fuerza correcta para el gas polar (M1, M2.). Para pares polar-polar, la función de energía potencial de uso común es el potencial de Stockmayer (M2) No se ha incluido el efecto de la concentración de A en B en la Ecuación (4.9). Sin embargo, para gases reales con interacciones, el efecto máximo de la concentración sobre la difusividad es de más o menos 4% . En muchos casos, este efecto es 35 mucho menor, por lo que casi siempre puede despreciarse. La Ec. (4.10) es bastante complicada y con mucha frecuencia no se dispone de las constantes como y tampoco es fácil estimarlas. Debido a esto, se usa con más frecuencia el método semiempírico de Fuller y colaboradores que es más conveniente. Esta ecuación se obtuvo correlacionando muchos datos de reciente obtención y usa los volúmenes atómicos de la Tabla 2, que se suman para las moléculas del gas. Donde sumatoria VA de incrementos de volúmenes estructurales y . Este método puede aplicarse para mezclas de gases no polares o para una combinaci6n polar-no polar. La ecuación muestra que DAB es proporcional a 1 / P y a T 1.75 . Cuando se dispone de un valor experimental de DAB con ciertos valores de y P y se desea obtener el valor de DAB a otros niveles de T y P, es necesario corregir el valor experimental para ajustarlo a los nuevos niveles de T y P. 36 CAPITULO V DIFUSIVIDAD MOLECULAR EN MEZCLA GASEOSA 5.1. Estados de agregación de la materia La materia está constituida por moléculas y estas a su vez integradas por átomos. Las partículas constituyentes de la materia se mantienen unidas entre sí debido a la acción de unas fuerzas llamadas fuerzas intermoleculares que tienen su origen en la acción electrostática que ejercen los núcleos atómicos sobre los electrones de los átomos próximos y viceversa. El valor de estas fuerzas varia con la distancia llegando incluso a ser repulsivas si los átomos están tan próximos que se repelen sus respectivas capas electrónicas. Cuando las fuerzas de atracción se ejercen entre partículas de una misma sustancia se denominan fuerzas de cohesión y si se ejercen entre partículas de distintas sustancias se llaman fuerzas de adhesión. 37 La materia se presenta en la naturaleza en tres estados distintos de agregación: sólido, liquido y gaseoso, caracterizados por las fuerzas de cohesión que actúan en cada caso sobre las partículas del cuerpo. En el estado sólido, las fuerzas de cohesión son relativamente grandes de forma que las partículas del cuerpo, sean moléculas, átomos o iones, se mantiene en posiciones fijas y aunque posean cierto movimiento vibratorio la distancia entre ellas permanece invariable; por eso los sólidos tienen forma y volumen constante. En el estado líquido las fuerzas de cohesión son lo suficientemente débiles como para permitir cierta movilidad a las partículas del cuerpo pero a la vez son lo suficientemente intensas como para mantener entre ellas una distancia media constante. Por eso los líquidos contenidos en recipientes tienen forma variable y volumen constante y en cambio en estado libre adoptan la forma esférica que es aquella que para un volumen determinado les permite ofrecer una superficie mínima. En el estado gaseoso, las fuerzas de cohesión son prácticamente nulas adquiriendo las partículas su máxima movilidad. La distancia entre estas partículas es variable tendiendo a ocupar todo el volumen disponible, por eso los gases tienen forma y volumen variables. 38 Dada su capacidad de fluir los líquidos y los gases reciben el nombre de fluidos al contrario que los sólidos que son rígidos. 5.2. Propiedades Generales de los Gases. Un gas es un fluido que tiende a expandirse hasta ocupar completamente el volumen del recipiente que lo contiene. Las propiedades generales de los gases son las siguientes: Pequeña densidad debida a que en virtud de la ausencia de cohesión entre sus moléculas estas se hallan muy alejadas unas de otras existiendo por ello muy poca masa en la unidad de volumen. Son perfectamente homogéneos e isótropos, es decir, tienen las mismas propiedades en todos sus puntos como consecuencia de la libertad de sus moléculas en todas las direcciones. Tienden a ocupar el máximo volumen (expansibilidad) adoptan la forma y el volumen del recipiente que los contiene. Son muy compresibles debido a la ausencia de fuerzas de repulsión entre sus moléculas. Se mezclan completamente y de manera uniforme cuando están en el mismo recipiente. Pequeña viscosidad aunque no nula ya que las acciones mutuas entre moléculas no son totalmente despreciables. 5.3. Teoría Cinético-Molecular de los Gases. 39 La teoría cinético-molecular ha resultado muy útil para explicar el comportamiento de los gases, los cambios de estado y otros fenómenos importantes. Las ideas principales de esta teoría son las siguientes: Los gases están formados por un número muy grande de partículas extremadamente pequeñas llamadas moléculas. Las distancias entre las moléculas son muy grandes comparadas con el tamaño de las moléculas en si y con las dimensiones del recipiente que las contiene. Las moléculas están en movimiento continuo rectilíneo en todas las direcciones y sentidos. Las fuerzas de atracción o repulsión que ejercen las moléculas entre si son despreciables. Durante su movimiento al azar las moléculas chocan entre sí y con las paredes del recipiente, este continuo bombardeo de las paredes se conoce como presión del gas. Los choques de las moléculas entre sí y con las paredes del recipiente que los contiene son perfectamente elásticos, es decir, sin pérdida alguna de energía. 5.4. Leyes Generales de los Gases Ideales. Se han desarrollado leyes empíricas que relacionan las variables P (presión), V (volumen) y T (temperatura absoluta) con la cantidad de gas en base a experiencias en el laboratorio. Estas variables no son independientes entre sí, 40 sino que cada una de ellas es siempre función de las otras. Para que un gas se pueda considerar ideal ha de cumplir las dos condiciones siguientes: Que el volumen de sus partículas sea nulo. Que no existan fuerzas atractivas entre ellas. 5.5. Ley de Boyle-Mariotte. La ley de Boyle-Mariotte tiene el siguiente enunciado: Para una cierta cantidad de gas a una temperatura constante, el volumen del gas es inversamente proporcional a la presión de dicho gas. PV=K P1=Presión Inicial V1=Volumen Inicial P2=Presión Final V2=Volumen Final 41 Fig. 9: Relación Presión - Volumen y Temperatura Constante 5.6. Ley de Charles-Gay Lussac El francés Jacques Charles Gay Lussac se dio cuenta que 1787, que los gases se expanden con el aumento de la temperatura de forma que V T. En 1802, su también compatriota Josep Louis gay Lussac publico sus observaciones sobre el mismo hecho, aunque con mayor grado de precisión comprobando que al aumentar en un grado centígrado la temperatura de un gas , este experimenta una dilatación de 1/273 partes de su volumen . Hoy la ley de Charles Gay Lussac se enuncia de la siguiente manera: A presión constante el volumen ocupado por un gas es directamente proporcional a la temperatura a la que está sometido. La expresión matemática de esta ley es V=V0 Donde: 42 V0=Volumen del gas inicialmente a 0 ºC V=volumen del gas a la temperatura t Ccoeficiente de dilatación del gas Al representar en una grafica los valores de volumen de un gas frente a distintas temperaturas, se obtiene una línea recta de acuerdo con la expresión matemática de la ley Charles Gay Lussac: Como: T (K) = t (ºC) + 273 La anterior ecuación se trasforma en: De forma general, la expresión de la ley de Charles Gay Lussac en la escala Kelvin de temperaturas para dos estados del gas, ambos a presión constante y caracterizada por 1 y 2 es la siguiente. A partir de la expresión de la ley de Charles Gay Lussac con la temperatura en la escala Celsius, deduce la formula de la ecuación de dicha ley en la escala absoluta o Kelvin de Temperatura (DULCE, 2005) y entonces: 43 Como: T (K) = t (ºC) + 273 t (ºC) = T (K) - 273 T0= 273 0K ; al sustituir la temperatura en la escala de Celsius por Kelvin resulta que: Esta ley manifiesta que: Para una cierta cantidad de gas a una presión constante, el volumen del gas es directamente proporcional a la temperatura de dicho gas. Para una cierta cantidad de gas a un volumen constante, la presión del Gas es directamente proporcional a su temperatura. A continuación se muestra un cuadro donde se resumen los principales factores que intervienen en la ley de Charles a presión constante y en la ley Gay Lussac a volumen constante: 44 Cuadro 1: Factores que intervienen en la ley de Charles-GayLussac A presión constante Temperatura V1= Volumen inicial T1=Temperatura inicial V2 =Volumen Final T2=Temperatura Final en escala Kelvin A P1= Volumen inicial T1=Temperatura inicial P2 =Volumen Final T2=Temperatura Final volumen constante Temperatura en escala Kelvin Fig. 10: Relación Volumen-Temperatura a Presión Constante 5.7. Ecuación General de los Gases Perfectos. Los volúmenes ocupados por una misma masa gaseosa son directamente proporcionales a las temperaturas correspondientes e inversamente proporcionales a las presiones soportables. 45 Donde: P= Presión del Gas V=Volumen del gas R=Constante de Gases Ideales n=Numero de moles 5.8. Ley de Avogadro. Avogadro publico una hipótesis en la que estableció lo siguiente: En las mismas condiciones de presión y temperatura volúmenes iguales de gases distintos contienen el mismo número de moléculas, es decir, a presión y temperatura constante el volumen de un gas es directamente proporcional al número de moles que presenta dicho gas. Para poder comparar el volumen de los gases y aplicar el principio de Avogadro se relacionaran los puntos de referencia de temperatura y presión a los que se denominaran condiciones normales o estándar (T = 273K y P = 1 atm). Se ha calculado experimentalmente que el volumen ocupado por un mol de cualquier gas en condiciones normales es igual a 22.4 Lt. al que se denomina volumen molar de un gas. Como un mol de cualquier sustancia contiene 6.023x10-23 moléculas, estas ocuparan un volumen de22.4 LT. 46 5.9. Ecuación de Estado de los Gases Perfectos. El volumen de un gas varía de manera proporcional con el número de moles y con la temperatura, e inversamente proporcional con la presión. Aplicaciones de la ecuación de estado de los gases perfectos Masa molecular de un gas: Densidad de un gas: 5.10. Mezclas de Gases. Ley de Dalton. Las leyes de los gases ideales se aplican lo mismo a gases individuales que a las mezclas gaseosas. Cuando se mezclan varios gases que no reaccionan químicamente entre sí, cada uno de ellos se comporta como si estuviera solo en el recipiente que los contiene. Dalton propuso que cada uno de los gases de la mezcla se expande hasta llenar el recipiente y ejerce una presión llamada presión parcial que es igual a la que ejercería si estuviese solo en el recipiente. La ley de las presiones parciales de Dalton establece que la presión total de una mezcla de gases es igual a la suma de las presiones parciales de todos los gases que la componen. 47 Fig. 11: Ley de Las Presiones Parciales de Dalton Dalton describió la mezcla de gases perfectos en función de la presión y su composición. Consideremos nA moles de un gas A encerrado en un recipiente de volumen V a la temperatura T. De acuerdo con la ley del gas perfecto, la presión ejercida por ese gas será: Análogamente, para nB moles de un gas B en las mismas condiciones: ¿Qué sucede cuando en el mismo recipiente, y a la misma temperatura, se mezclan los dos gases? Dalton concluyó, a partir de sus experimentos, que ambos gases actúan independientemente sin afectarse mutuamente. Esto es, cada gas ejercerá la presión PA y PB, de manera que la presión total (PT) del sistema será la suma de ambas presiones: 48 La presión que ejerce cada gas (P A y PB) se denominan presión parcial. Retomando la ecuación anterior, y sustituyendo por las definiciones de P A y PB, Reordenando Donde (nA + nB) representa el número total de moles gaseosos, nT La cantidad de materia correspondiente a cada una de las sustancias gaseosas se puede expresar en función de la cantidad total a través de las fracciones molares, x, de acuerdo con: y De donde es viable demostrar que PA= xA.PT y PB= xB.PT Generalizando, para una mezcla de i gases, la presión parcial de cada uno de ellos en la mezcla puede calcularse como: 49 La ley de Dalton se cumple para aquellos gases que se comportan como gases perfectos. Por lo tanto, a la mezcla de gases se le aplica las mismas restricciones que a ellos: es válida para gases perfectos que forman una mezcla poco densa una vez puestos juntos en un recipiente. 5.11. Difusión Gaseosa. Ley de Graham. La difusión es la migración de las moléculas como resultado del movimiento molecular al azar. La difusión de dos o más gases da como resultado el entremezclado de las moléculas y en un recipiente cerrado conduce rápidamente a la formación de una mezcla homogénea. Otro fenómeno relacionado es la efusión consistente en la salida de las moléculas del gas a través de un pequeño orificio o agujero. Todos los gases se difunden rápida y totalmente unos de otros independientemente de su presión, no obstante la velocidad de difusión no es la misma cuando un gas puede escapar de un recipiente; se sabe que la velocidad con que sale depende de su presión. Graham estableció que: Las velocidades de difusión de dos gases distintos son inversamente proporcionales a las raíces cuadradas de sus densidades respectivas. 50 En 1832 el químico escocés Thomas Graham encontró que en las mismas condiciones de temperatura y presión, las velocidades de difusión de las sustancias gaseosas son inversamente proporcionales a la raíz cuadrada de sus masas molares. Este enunciado se conoce ahora como la Ley de difusión de Graham. A pesar de que las velocidades moleculares son muy elevadas, el proceso de difusión requiere bastante tiempo, debido al elevado número de colisiones que experimentan las moléculas en movimiento. Graham encontró que las velocidades de difusión de las sustancias gaseosas es inversamente proporcional a la raíz cuadrada de sus pesos moleculares cuando P y T son constantes. Difusión Gaseosa. Ley de Graham. V1=Velocidad de Efusión del Gas iesimo. M=Masa Molar del Gas iesimo Fig. 12: Difusión Gaseosa. Ley de Graham 51 5.12. Estimación de la Difusividad Gaseosa La difusión es el fenómeno por el que un gas se dispersa con otro , dando lugar a una mezcla .La mezcla gradual de las moléculas de un gas con las de otro , en virtud de sus propiedades cinéticas constituye una demostración directa del movimiento aleatorio de las moléculas . Difusión gaseosa, la mezcla gradual de la molécula de un gas con las moléculas de otro gas en virtud de sus propiedades cinéticas constituye una demostración directa del movimiento aleatorio. A pesar del hecho que las velocidades moleculares son muy grandes, el proceso de difusión en si mismo requiere un periodo relativamente largo de tiempo para completarse. La efusión es el proceso por el cual un gas bajo presión escapa de un recipiente hacia el exterior a través de una pequeña abertura. Se ha demostrado que la velocidad de efusión es directamente proporcional a la velocidad media de las moléculas. 5.12.1 Estimación de la difusividad de una mezcla gaseosa. A través de aire (B) a una atmosfera de presión se difunde butanol normal (A). Usando el método de Fuller y colaboradores estime las difusividades a las siguientes temperaturas y compárelas con los siguientes datos experimentales: a. a 0 b. a 25.9 52 c. a 0 y a 2 atmosferas absolutas I.Datos Caso A: Presión Temperatura Peso Molecular Butanol Peso Molecular Aire Estructura química Butanol Suma de incrementos de volúmenes estructurales del butanol (Volúmenes Atómicos de Difusión) Suma de incrementos de volúmenes estructurales del Aire (Volúmenes Atómicos de Difusión) Temperaturas en grados kelvin y grados Centígrado 1 atmosfera 273 OK 74,1 29 t (OC )=T (OK) – 273 T (OK)= t OC +273 II.Planteamiento Caso A: Sustituyendo en la ecuación de Ecuación de Fuller y Colaboradores: Ecuación de Fuller Donde: T = Temperatura de trabajo del sistema 53 Peso molecular del Butanol Sumatoria de Volumen Atómico de Difusión Peso molecular del Aire Sumatoria de Volumen Atómico de Difusión III.Solución: = 7.73 x 10-6 m2/s Este valor se desvía un 10% del dato experimental de , el cual se hace referencia en (GEANKOPLIS, 1998). Los valores de volúmenes atómicos se hace referencia en la tabla que se muestra en anexos. Para el caso , y al sustitutir en la ecuación de Fuller y colaboradores . La desviación de este valor con respecto a la experimental de Para el caso C: la presión total es de sólo 4%. con el valor calculado en (a) y corregido por la presión A continuación se tiene el cuadro de volúmenes atómicos 54 Cuadro 2: Volumen Atómicos de Difusión para el Método de Fuller ,Schettler y Giddings Incrementos C H O del Volumen de Difusión Atómico y Estructural, V 16.5 C1 19.5 1.98 S 17.5 5.48 Anillo -20.2 Aromático N 5.69 Anillo -20.2 Heterocíclico Volúmenes de Difusión para Moléculas Simples H2 7.07 CO 18.9 D2 6.70 CO2 26.9 He 2.88 N2O 35.9 N2 17.99 NH3 14.9 O2 16.6 H2O 12.7 Aire 20.1 (CCl2F2) 11.8 Ar 16.1 (SF6) 69.7 Kr 22.8 (Cl2) 37.7 Xe 37.9 (Br2) 67.2 Ne 5.59 (SO2) 41.1 Fuente: Reproducido con autorización de E. N. Fuller, P. D. Schettler y J. C. Giddings, Ind. Eng. Chem., 58, 19(1966). Copyright de la American Chemical Society. Los paréntesis indican que el valor solo se basa en unos cuantos datos. 5.13. Difusividad de los Gases a Altas Presiones 55 La ecuación de Fuller aplicada a la estimación de los coeficientes de difusión de una mezcla gaseosa binaria a presión superior a 10 bar, predice un valor excesivamente grande. En primera aproximación se puede corregir el valor de este coeficiente de difusión multiplicándolo por el factor de compresibilidad del gas. DAB = D*AB Z DAB = Coeficiente de difusión mutua D*AB = Coeficiente de difusión mutua calculada por el método de Fuller. Z = Factor de Compresibilidad del gas. Factor de Compresibilidad 1 Propiedades Termodinámicas de los Gases Densidad de Gas Ideal La teoría de gases ideales nos enseña la relación: Donde: P=presión V= Volumen molar T=Temperatura R= constante de los gases Ideales 56 Esta relación se transforma fácilmente para expresar la densidad de un gas ideal: ; P = Densidad del gas ideal, M= Peso Molecular Densidad de Gases Reales Para los Gases Reales P = Densidad del gas real Z = Factor de Compresibilidad Se han propuesto numerosas ecuaciones de estado para expresar el factor de comprensibilidad, obteniéndose precisiones destacables cuando se utilizan ecuaciones específicas para ciertos componentes. 57 58 CAPITULO VI TRANSFERENCIA DE MASA EN LÍQUIDO 6.1 INTRODUCCION La difusión de solutos en líquidos es muy importante en muchos procesos industriales, en especial en las operaciones de separación, como extracción líquido-líquido o extracción con disolventes, en la absorción de gases y en la destilación. La difusión en líquidos también es frecuente en la naturaleza, como en los casos de oxigenación de ríos y lagos y la difusión de sales en la sangre. Resulta evidente que la velocidad de difusión molecular en los líquidos es mucho menor que en los gases. Las moléculas de un líquido están muy cercanas entre sí en comparación con las de un gas, por tanto, las moléculas del soluto A que se difunde chocarán contra las moléculas del líquido B con más frecuencia y se difundirán con mayor lentitud que en los gases. En general, el coeficiente de difusión es de un orden de magnitud 105 veces mayor que en un líquido. No obstante, el flujo específico en un gas no obedece la misma regla, pues es sólo unas 100 veces más rápido, ya que las concentraciones en los líquidos suelen ser considerablemente más elevadas que en los gases. 6.2 ECUACIONES PARA LA DIFUSIÓN MOLECULAR EN LÍQUIDOS. En la difusión en líquidos, una de las diferencias más notorias con la difusión en gases es que las difusividades suelen ser bastante dependientes de la concentración de los componentes que se difunden. 59 A continuación tenemos las ecuaciones o leyes que maneja la transferencia de masa en líquidos: Ecuación de la ley de Fick de Transferencia de Masa Si se tiene las siguientes relaciones que serán usadas en las siguientes ecuaciones: ; Así, mismo: De donde Derivando Se tiene Sustituyendo en la ecuación (5) tenemos 60 Donde: ; sea Luego se tienen los siguientes valores a ser reemplazados en la ecuación (6.3) 61 Reemplazando se tiene: La Ecuación de la ley de Ficks para Líquidos Luego se tiene: Donde: de A+B en Disolución de Acido Acético en Agua para Usarse en Encurtidos 62 En un ensayo experimental a nivel de laboratorio se está preparando disoluciones con acido acético en agua para encurtidos de alimentos y se tiene los siguientes datos: En una solución de Acido Acético (A) y Agua (B) a 282,7 0K se observa que al diluir el Acido Acético en agua la velocidad de migración determina una distancia de transferencia de masa de 2,5cm, la concentración del acido acético en la fase orgánica se mantiene constante y es tal que la concentración de equilibrio del acido acético en agua en un inicio en el Pto (1) es del 4,2% en peso (la Densidad de la solución acuosa en el Pto (1) es y la concentración del acido acético en el agua en el otro extremo es de 2,1% en peso (la Densidad es . La difusividad del acido acético en agua . Hallar el flujo especifico de migración del acido acético en el agua. I.Datos Solución (A) Solución (B) Difusividad Unidad-Magnitud Acido Acético Agua Distancia de Transferencia (2,5cmt) ( 2,5 x 10 -2 mt) Temperatura (16ºC) (289ºK) Concentración de Acido Acético en el 4,20% Punto (1) Densidad del Acido Acético en el Punto (1) Concentración de Acido Acético en el 2,10% 63 Punto (2) Densidad del Acido Acético en el Punto (2) II.PLANTEAMIENTO Se usarán las siguientes Ecuaciones: Ecuación de la Ley de Fick para Líquidos: Ecuación de la Concentración Promedio Molecular Ecuación del Peso Molecular : : Ecuación del Número de Moles Ecuación de la Fracción Mol de A 64 Dimensionando la Ecuación de Peso Molecular de A de A y Número de Moles se tiene: Donde: III.SOLUCION A = Acido Acético ------------- Peso Molecular Acido Acético = 60 B = Agua ------------------------------ Peso Molecular del Agua = 18 Empezamos por el Número de Moles en el Punto (1) 65 Reemplazamos los datos que tenemos: Numero de Moles Totales en el Punto (1) Numero de Moles Totales en el Punto (2) Luego reemplazamos los datos del Número de Moles de A1, A2, B1, B2 respectivamente, en las fracciones molares que a continuación se dan: 66 A continuación se Halla la Concentración Promedio Molecular: Previamente se tiene que hallar los datos del Peso Molecular Promedio el punto 1 y Peso Molecular Promedio en en el punto 2 , respectivamente . 67 Luego reemplazamos en la ecuación de CPM A continuación hallamos el valor de la fracción media Logarítmica Molecular de B. Con los datos obtenidos, reemplazamos en la ecuación siguiente: 6.3 PREDICCIÓN DE DIFUSIVIDADES EN LÍQUIDOS Una de las primeras teorías, la ecuación de Stokes-Einstein, se, obtuvo para una molécula esférica muy grande (A) que se difunde en un disolvente líquido (B) de 68 moléculas pequeñas. Se usó la ley be Stokes para describir el retardo en la molécula móvil del soluto. Después se modificó al suponer que todas las moléculas son iguales, distribuidas en un retículo cúbico y cuyo radio molecular se expresa términos del volumen molar. Donde: DAB es la difusividad en m2/s, T es la temperatura en ºK, U es la viscosidad de la solución en Pa - s ó kg- mol/ s y VA es el volumen molar del soluto a su punto de ebullición normal en m 3/ kgmol. Esta ecuación es bastante exacta para moléculas muy grandes de solutos esferoidales y sin hidratación, de peso molecular 1000 ó más, ó para casos en que VA es superior a 0.500 cm3 / kg- mol en solución acuosa. La ecuación mencionada no es válida para solutos de volumen molar pequeño. Se ha intentado obtener otras deducciones teóricas, pero las fórmulas obtenidas no predicen difusividades con precisión razonable. Debido a esto, se han desarrollado diversas expresiones semiteóricas. La correlación de WilkeChang puede usarse para la mayoría de los propósitos generales cuando el soluto (A) está diluido con respecto al disolvente (B). 69 Donde: MB es el peso molecular del disolvente B, UB es la viscosidad de B en Pa - s ó kg/m- s, VA es el volumen molar del soluto en el punto de ebullición es un “parámetro de asociación” del disolvente: 2.6 para el agua, 1.9 para el metanol, 1.5 para el etanol, 1.O para el benceno, 1.O para el éter, 1.O para el heptano y 1.O para los disolventes sin asociación. Cuando los valores de VA son superiores a 500 cm3/gr-mol se debe aplicar la ecuación (6.7) Cuando el soluto es agua, los valores obtenidos con la ecuación (6.8) deben multiplicarse por el factor de ½.3. La ecuación (6.7) predice difusividades con desviación media de 10 a 15% para soluciones acuosas y aproximadamente del 25% para las no acuosas. Fuera del intervalo de 278ºK a 313 ºK, esta ecuación se debe manejar con precaución. Para sistemas binarios. Geankoplis (G2) analiza y proporciona la ecuación para predecir la difusión en sistemas ternarios, en los que un soluto diluido A se difunde en una mezcla de disolventes, B y C. A menudo este caso se presenta de manera aproximada en los procesos industriales (GEANKOPLIS, 1998). 70 CAPITULO VII TRANSFERENCIA DE MASA EN SOLIDOS 7.1 INTRODUCCION Los materiales poliméricos utilizados como envases, desde el punto de vista de la transferencia de masa, no constituyen con el producto que contienen sistemas totalmente estáticos, sino que forman sistemas dinámicos caracterizados por un intercambio de compuestos de bajo peso molecular entre el envase, su contenido y el entorno que los rodea. Este intercambio consiste en movimiento de moléculas relativamente pequeñas, mediante fenómenos de difusión, adsorción y desorción de gases, vapores y líquidos, que irreversiblemente conducirán a: Un cambio gradual en la composición del producto envasado que puede afectar a su calidad final y aptitud para el consumo, debido a la incorporación (migración) o pérdida 71 de componentes (desorción o permeación), desde su producción hasta el momento de su consumo. Una alteración de las características físico-químicas y mecánicas del material de envase durante la vida útil del producto envasado, bien sea, de pérdida de compuestos de bajo peso molecular presentes en el material polimérico (migración), o por adsorción de sustancias que originalmente estaban en el producto envasado Dada la importancia práctica de estos fenómenos, es razonable la necesidad de estudios de interacción envase-producto para la selección de una material de envase, y para asegurar la protección de las características del producto envasado durante su vida útil (POVEA, 2008). En los envases hay una actividad fisicoquímica continua en la interface del material con el alimento y el medio ambiente. En consecuencia el alimento queda expuesto a ciertas modificaciones químicas que pueden alterar sustancialmente sus características sensoriales o nutricionales y también incorporar residuos tóxicos que pueden hacerlo rechazable. El uso de materiales plásticos para los envases y embalajes debe de cumplir normas básicas de seguridad para evitar posibles contaminaciones o la transferencia o migración de compuestos que alteren las propiedades o seguridad del contenido. Los aditivos plásticos por ejemplo pueden abandonar la matriz polimérica (el plástico propiamente dicho) y contaminar los alimentos en un proceso conocido como migración de sustancias toxicas. La migración es la transferencia de masa entre el 72 material de envase, el material envasado y el entorno.de forma general aumenta con el incremento de la temperatura y con el tiempo de almacenamiento del alimento. En España a través del Real Decreto 118/2003 se establece los límites máximos de migraciones permitidas de los objetos y materiales de plástico hacia los alimentos .El limite global de la cesión de los componente de materiales y objetos de plástico a los productos de alimentos no pueden ser superior a 10 mg/dcm2 de superficie del material como nivel máximo de migración global del material (GIL, 2010). 7.2 Empaques Permeables Los envoltorios permeables al vapor de agua y a los gases, o más permeables al oxigeno que al dióxido de carbono y los que no se ajustan a la superficie del producto, pueden evitar la entrada de microorganismos contaminantes, pero no afectan al crecimiento de los microorganismos que previamente se encontraban en el alimento, Las condiciones intrínsecas de un alimento envuelto en un material muy permeable, son similares a las del producto sin envolver. 7.3 Empaques Impermeables Herméticamente Cerrados El crecimiento y la actividad de microorganismos dentro de un envase depende de: la idoneidad del alimento como medio de cultivo, la temperatura, la aw, el pH, la naturaleza de los gases retenidos dentro del envase y la competencia entre microorganismos. En envases impermeables a los gases, cerrados herméticamente, pero en los que no se han evacuado los gases, la respiración de los tejidos de la carne fresca y de la flora acompañante, hacen que al cabo de poco tiempo se haya consumido gran parte del O 2 73 y haya aumentado el CO2 de la atmósfera en el interior del envase. Al mismo tiempo, va bajando gradualmente el pH, debido al crecimiento de las bacterias lácticas. Estos cambios limitan la velocidad de crecimiento de los organismos aerobios típicamente responsables de la alteración, de forma que la vida media del producto así envasado aumenta si se compara con la del contenido en envase permeable al oxígeno. La evacuación de los gases, en el caso de los envases impermeables y herméticamente cerrados, acentúa los efectos citados. Se puede emplear dióxido de carbono puro o mezclado con aire o nitrógeno, para rellenar el espacio vacío en un envase herméticamente cerrado. El nivel de microorganismos en carnes rojas o en aves, envasadas en una atmósfera compuesta por dos partes de aire y una de CO 2, es mucho menor del que habría en los mismos productos no envasados de esta manera; por esto, la vida del producto se aumenta al doble o al triple de tiempo. La inhibición es aún mayor a bajas temperaturas. El envasado en gas también se usa para mantener un color aceptable en las carnes y productos cárnicos. a) Permeabilidad a los gases Aumenta a partir de nitrógeno (N2), luego el oxígeno (O2) y el anhídrido carbónico (CO2); no obstante la relación entre éstos es diversa en los distintos materiales, y la regla básica de que la permeabilidad para el CO2 es unas 4 veces mayor que para el O2 tiene sólo una validez aproximada. La permeabilidad a los gases es alta en el cloruro de polivinideno (PVDC), el poliéster y en las hojas (laminados) obtenidas de mezclas entre ellos. En 74 contraposición muestran valores bajos las hojas de polietileno (PE), poliestireno (PS) y polipropileno (PP). El nivel de O2 en la atmósfera (21%), nos indica su riesgo para producir oxidación y descomposición, que es un peligro principal. b) Permeabilidad al vapor de agua La baja permeabilidad es necesaria para impedir la deshidratación y las consecuentes pérdidas de peso (Ej. Carnes, productos perecibles). Las hojas de PE y de PVDC, así como el celofán barnizado con cloruro de polivinilideno, son muy poco permeables al vapor de agua, mantiene al producto fresco crocante y seco, mientras que el celofán sin barnizar lo es en gran medida. c) Permeabilidad a los aromas Implica muchos problemas, tanto por su mecanismo en sí, como desde el punto de vista de su medición técnica. No es posible hacer una generalización, pues para la permeabilidad se han de tener en cuenta la composición química de las diversas sustancias aromáticas y la solubilidad de éstas. Existen casos en los que de una mezcla de aromas sólo se difunde intensamente uno de sus componentes a través de la envoltura, mientras que los demás permanecen en el contenido, lo que da lugar a una modificación de las propiedades organolépticas del producto. Aunque generalmente las hojas o laminillas poco permeables a los gases, lo son también, para las sustancias aromáticas; limita esta afirmación lo dicho anteriormente, que algunos aromas se pueden liberar con el vapor de agua. Las laminillas 75 de aluminio desprovistas de poros ofrecen la mejor hermeticidad para la conservación de los aromas. La influencia de los poros sobre la permeabilidad de los gases desempeña un papel de poca importancia en los envases normales no expuestos a una diferencia de presión entre el interior y el exterior, en tanto que los recipientes sometidos al vacío, deberán carecer de poros como condición indispensable. 7.4 Tipos de Difusión en Sólidos. El trasporte de sólido se puede clasificar en dos tipos de difusión: la difusión que sigue la ley de Fick y que no depende primordialmente de la estructura del sólido y la difusión en sólidos porosos, en la que la estructura real y los canales vacios revisten gran importancia. 7.5 Indicadores de Transferencia de Masa en Sólidos. Los principales indicadores de medición de empaques en alimentos a través de la ingeniería de procesos en alimentos son: 7.5.1 Concepto de Permeabilidad Propiedad física del cuerpo que deja pasar a través de él, los fluidos, las radiaciones o líneas de fuerza en un campo magnético. Permeable: (del latín permeare, pasar a través). Se dice del cuerpo que puede ser traspasado por fluidos, radiaciones o líneas de fuerza de un campo magnético; el papel secante es permeable al agua.(LAROUSSE,2004). 76 Permeabilidad: cantidad de gas o vapor (masa o volumen) que atraviesa una película de espesor (Z) por unidad de área, de tiempo y de gradiente de presión o concentración. Existen más de 10 combinaciones de unidades para expresar permeabilidad para los que se han publicado factores de conversión. Una de ellas es: cc×mil/m2×día×atm (ROBERTSON, 2006). Permeabilidad A excepción de las láminas metálicas, no todos los tipos de materiales flexibles protegen con la misma eficacia de las influencias externas, por ejemplo, la celulosa es impermeable al agua pero no a su vapor; el polietileno lo es al vapor del agua; pero poco a los gases u olores extraños, el celofán de bajo contenido en agua es muy impermeable al gas pero no a la humedad; el cartón puede impermeabilizarse mediante un tratamiento superficial con sustancias repelentes al agua; pero que no lo hace impermeable a su vapor (posible presencia de poros). La permeabilidad se mide por la cantidad de gas o líquida que penetra por unidad de tiempo y superficie a condiciones normales o estándar, pero el parámetro que se emplea generalmente no es el gradiente de concentración, uno la diferencia de presión parcial; ambos sin embargo son convertibles. La velocidad de permeación a través del plástico principalmente, depende en gran medida del espesor del material, de la temperatura, de la diferencia de presión en ambas caras y tratándose de celofán, de la humedad relativa también (SALAS, 2009). 77 Unidades de Permeabilidad: Permeabilidad: Participación de la Permeabilidad en la Ley de Fick de Transferencia de Masa (Gases) 7.5.2 Concepto de Solubilidad La solubilidad de un gas Soluto A en un Solido, por lo general se expresa como Para convertir esto a concentración Ca en el sólido en Kg-mol de A/ m3 del sólido en unidades del SI. Unidades de Solubilidad: Solubilidad: Relación de Solubilidad con la concentración en el punto (1) 78 Relación de Solubilidad con la concentración en el punto (2) 7.6 Difusión a través de una Película de Empaque. Entre los materiales termoplásticos que pueden usarse en forma de películas para cocinar o recalentar alimentos tanto en hornos de microondas como en convencionales están las poliamidas (Nylon) y el terftalato de polietileno (PET). Estos polímeros se procesan como películas transparentes y son capaces de soportar temperaturas mayores a 200°C sin fundirse. La ventaja de usar bolsas fabricadas de estos materiales es que tanto agua, sabores y olores del alimento cocinado se conservan dentro de la bolsa sin tocar el recipiente en que se cocinan. Estas bolsas son también utilizadas para hervir alimentos sin que el contacto con el agua provoque que se pierdan minerales y vitaminas solubles (boil-in-the-bag). Aunque estos materiales soporten hasta 200 °C sin fundirse, la temperatura de cocinado sobrepasa la temperatura de transición vítrea (Tg) de ambas poliamidas (5060 °C) en la que obviamente hay un cambio en la conformación del polímero. Además, la solubilidad de los sólidos se incrementa con la temperatura así como el coeficiente de difusión por lo que es de esperar que aumente el potencial de migración de aquellos componentes del material de bajo peso molecular. 79 Por otro lado, la influencia de la temperatura en la migración no se limita sólo a la cantidad de compuestos migrantes sino que también aumentan las identidades de éstos ya que los componentes del plástico pueden evaporarse a ciertas temperaturas o bien, sufrir degradación térmica. Para cumplir con los parámetros de calidad y disminuir el riesgo que el uso de estos materiales pueda provocar contra la salud del ser humano, deben someterse a estudios tanto para identificar los compuestos migrantes como para medir hasta que punto son capaces de ser transferidos hacia los alimentos. A continuación en los tres siguientes cuadros se reportan valores de Migración de Compuestos No-Volátiles de Bolsas de PA6,6 y PA6 Durante el Cocinado de Pollo a 200 0C. Peso de Cada Bolsa: 4.84 (0.03) g. Según (SOTO, 2005). Cuadro 1: Migración de Compuestos no-Volátiles de Bolsas de PA6,6 y PA6 Durante el Cocinado de Pollo a 200 0C. Peso de Cada Bolsa: 4.84 (0.03) g. Compuesto Cíclico (Peso Molecular) Plástico (a) Pollo (b) mg/bolsa (ds) 6.0 (0.22) 16.6 (0.44) 2.0 (0.07) 3.1 (0.08) 13.9 (1.02) 3.7 (0.37) 1.9 (0.39) 3.6 (0.65) 0.8 (0.24) mg/bolsa 1.19 3.83 ND ND 2.41 ND ND ND ND Caprolactama (113) Monómero de PA 6,6 + dímero de PA 6 (226) Trímero de PA 6 (339) Tetrámero de PA 6 (452) Dímero de PA 6,6 (452) Pentámero de PA 6 (565) Hexámero de PA 6 (678) Trímero de PA 6,6 (678) Heptámero de PA 6 (791) a) Promedios de 6 réplicas b) Total del Promedio de 5 Réplicas para Piel, 5 Réplicas para Líquidos 80 Eliminados más una Réplica para Carne. Fuente: Soto Valdez, H. Migración de Componentes de Bajo Peso Molecular de Bolsas de Poliamida, Recomendadas para Hornear Alimentos. Centro de Investigación en Alimentación y Desarrollo, A. C. Hermosillo, Sonora, México. 2005. Cuadro 2. Compuestos Volátiles Identificados en el Material de las Bolsas y su Migración Hacia Pollo (1230(±60) g ) Durante el Cocinado. Peso Cada Bolsa: 4.84 (0.03) g. Material Compuesto g/bolsa (a) (ds) Piel Volátil Líquidos Carne Pollo Entero Ciclopentanona 31740 (1410) ND ND ND ND 2-Ciclopentil 7.60 5.54 17420 (770) 4.0 17.14 ciclopentanona (1.78) (3.74) 2-Etil 1.1 (0.05) ND ND ND ND ciclopentanona Tetradecano 0.4 (0.02) ND ND ND ND Pentadecano 1.2 (0.04) ND ND ND ND Hexadecano 2.6 (0.23) ND ND ND ND Heptadecano 3.2 (0.40) ND ND ND ND Octadecano 3.0 (0.27) ND ND ND ND a) Promedios de 5 repeticiones. (b) Promedios de 5 experimentos de migración, excepto para carne (un experimento). Fuente: Soto Valdez, H. Migración de Componentes de Bajo Peso Molecular de Bolsas de Poliamida, Recomendadas para Hornear Alimentos. Centro de Investigación en Alimentación y Desarrollo, A. C. Hermosillo, Sonora, México. 2005. CuCuadro 3: Migración de Compuestos no-Volátiles de las Bolsas de PA6,6 y PA6 Hacia Pollo Durante el Cocinado . Migrante Molecular) (Peso Jugos Eliminados (a) g/g Caprolactama 2.5 - 4.0 (113) Monómero de PA 6,6 + dímero de PA 8.0 - 24.0 6 (226) Dímero de PA 6,6 8.3 - 17.0 (452) Piel (b) Carne (c) Pollo entero (Deshuesado) (d) 2.5 - 6.7 1.3 1.44 13.0 - 16.1 1.1 3.86 6.4 - 11.6 0.03 2.18 81 Trímero de PA 6,6 <1.1 - 6.5 <1.1 - 7.6 ND ND (678) (a,b) Resultados de 5 réplicas (c) Resultado de un solo análisis (d) Total de los promedios de 5 réplicas para piel, 5 réplicas para líquidos eliminados. Fuente: Soto Valdez, H. Migración de Componentes de Bajo Peso Molecular de Bolsas de Poliamida, Recomendadas para Hornear Alimentos. Centro de Investigación en Alimentación y Desarrollo, A. C. Hermosillo, Sonora, México. 2005. En la investigación que realizo Soto,2005 ; indica que el 16 % de los compuestos novolátiles determinados en las bolsas fue transferido al pollo durante el cocinado. El monómero caprolactama fue el único migrante encontrado, para el cual existen límites de migración establecidos por la Directiva 90/128/EEC. El límite es 15 mg/g de alimento o simulante y el resultado encontrado en esta referencia es (1.44 mg/g de pollo) es un 9.6 % de tal límite. Ecuaciones de Transferencia de Masa en Sólidos Diferenciando e integrando se tiene: Para el Caso de Una Difusión Radial 82 Integrando ambos miembros de la ecuación Ecuación de Transferencia de Masa por Conducción Radial a Través de la Pared de un Cilindro Hueco Solubilidad (magnitud): Relación de la Concentración con la Presión y la Solubilidad Donde: 83 (Atmosferas; mmHg; Pas- seg etc.) Reemplazamos: Si Dimensionamos la Concentración Tendremos lo Siguiente: Ahora, utilizando la ley de Fick de Transferencia de Masa en Sólidos 84 Reemplazamos en las concentraciones CA1 ; CA2 respectivamente por solubilidad y presión se tiene lo siguiente : Dimensionando Tendremos: Relacionando Difusividad y Solubilidad con Permeabilidad Dimensionando Tenemos: Cuando se trata de varios sólidos en serie, tendremos la siguiente ecuación : Donde: 85 Solido Aplicación de Transferencia de Masa en Sólidos: Se tiene a prueba una película conformada por Nylon y Polietileno de 1mm de espesor respectivamente, para un empaque de mantequilla a 30 ºC. La preocupación es evitar la oxidación por lo que se necesita impedir la difusión del oxigeno para evitar las consecuencias negativas de su interacción con las grasas. Si la presión parcial del oxigeno en el exterior es de 2 atmosferas y en el interior casi nula, Calcúlese el flujo de difusión de O2 en estado estable. Usense datos de permeabilidad de tablas .Supóngase que la resistencia a la difusión en el exterior y en el interior de la película es despreciable en comparación con la propia película. I.DATOS: Unidad-Magnitud Permeabilidad Nylon PMNy Permeabilidad Polietileno PMPoliet Espesor ( L) del Nylon 1mm =1x10-3 mt Espesor ( L) del Polietileno Temperatura Presión O2 en exterior 1mm =1x10-3 mt (30ºC) (303ºK) 2 Atmosferas 86 Presión O2 en interior Casi nula Volumen Molar del Gas Condiciones Estándar (1 atmosfera y 273 ºK) ºK= ºC + 273,1 II.PLANTEAMIENTO Cuando se trata de varios sólidos en serie, tendremos la siguiente ecuación : Donde : Solido III.SOLUCION Reemplazando los datos en la ecuación se tiene: 87 Se tiene un recipiente cilíndrico de 5cm de diámetro y 10 cm de longitud, es llenado con 160 cm3, de una bebida especial y tapada con una película de un plástico de espesor de 0,05 cm. después de haber colocado los envases bajo condiciones de almacenamiento a una temperatura de 15 ºC y a una presión de 1 atmosfera y con ventiladores para mantener aireado el ambiente. Al cabo de dos horas se muestreo un frasco observándose que el nivel del liquido no varió significativamente pero si se tuvo una pérdida de peso de 0,11gr. El componente volátil de la bebida tiene una difusividad de a 250C. y a un peso molecular de y una presión de vapor de 0,5 atmosferas a 15 0C. ¿A cuánto deberá aumentar el espesor de la película para disminuir las perdidas en un 80 %?. I.DATOS: Recipiente Cilíndrico Unidad-Magnitud Diámetro = 5cm= 5x10-2 mt Longitud = 10 cmt = 10x10-2 mt Volumen de llenado Espesor Película de plástico Volumen = 160cmt3 0,05 cmt = 0,05 x 10 -2 mt Pérdida de Peso por Transferencia de Masa 0,11gr Difusividad del Componente Volátil de la 88 Bebida Peso Molecular del Componente Volátil Presión de Vapor Interna 0,5 atmosferas Temperatura 15 oC = 288 oC ºK= ºC + 273,1 Solubilidad O2- Caucho Vulcanizado a Temperatura de 288oK (15º C) Volumen Molar II.PLANTEAMIENTO Para resolver el siguiente problema se plantea las Siguientes Ecuaciones: Reemplazando (ii) y (iii) en (i) se tiene la siguiente ecuación: III.SOLUCION Reemplazando los datos en la ecuación , se tiene: 89 En un proceso experimental a nivel de laboratorio se está procesando néctar de cereza inyectado con un gas conservante N 2, en envase de polietileno con una concentración de 14,3% en Grados ºBrix y otra concentración de 12,9% en Grados ºBrix, además se tiene: ; ; ; ; Temperatura del sistema a 298 ºK, Presión Parcial de A 1 = 0,89 atmosferas; Presión Parcial A2=0,64 atmosferas, presión total del sistema Pt=1 atmosferas. El acido orgánico predominante en el néctar es el Acido Málico de PM= 134,09 que va de 0,32% hasta 0,24%. 90 A. Hallar la transferencia de masa en el sistema B. Hallar la concentración intermedia para un espesor de 8,4mm C. Hallar la presión parcial a3 a una distancia de 3,2 mm D. Hallar la grafica Para a) Presiones , b) Concentraciones I.DATOS DE TODO EL SISTEMA Característica Unidad- Magnitud Concentración del Néctar de Cereza en el Punto 1 y 2 Respectivamente. 14,3% en Grados ºBrix 12,9% en Grados ºBrix ; Densidad en el Punto 1 Densidad en el Punto 2 Solubilidad en el empaque Difusividad molecular del néctar en el empaque de polietileno Difusividad molecular del néctar en el gas N2. Difusividad molecular del gas N2 en el empaque de polietileno. Temperatura del sistema Presión parcial del gas A (N2) en el Punto (1). Presión parcial del gas A (N2) en el Punto (2). Peso molecular del Acido orgánico predominante en el néctar (Acido Málico). Concentración del acido málico en el punto (1) y en el punto (2) respectivamente. 298 oK A1 = 0,89 atmosferas A2=0,64 atmosferas 0,32% ; 0,24%. Difusividad molecular del acido Málico en el néctar Difusividad molecular de la sacarosa en agua. Distancia de transferencia de masa 91 Constante de gases ideales Permeabilidad del N2 en Polietileno Volumen Molar del gas en condiciones normales II.PLANTEAMIENTO DEL SISTEMA En el desarrollo del presente problema se hará uso de las siguientes ecuaciones: Ley de Fick de Transferencia de Masa para Sólidos Transferencia de Masa del Néctar en el Polietileno. (LIQUIDO EN EL SOLIDO) Ley de Fick de Transferencia de Masa para Gases Transferencia de Masa del Néctar en el N2. (LIQUIDO EN EL GAS) Ley de Fick de Transferencia de Masa para Gases para Permeabilidad Transferencia de Masa del (PERMEABILIDAD) N2 en el Polietileno (GAS EN EL SOLIDO) Ley de Fick de Transferencia de Masa para Gases para Solubilidad Transferencia de Masa del N2 en el Polietileno (GAS EN EL SOLIDO) (PERMEABILIDAD) 92 III.SOLUCION DEL SISTEMA Para encontrar la transferencia de masa en todo el sistema, previamente se tiene que hallar la transferencia de masas en cada uno de los subsistemas, luego realizar la sumatoria de ellos. A continuación tenemos: A.1.Transferencia de Masa del Néctar en el Polietileno. (LIQUIDO EN EL SOLIDO) Características Unidad- Magnitud Difusividad molecular del néctar en el empaque de polietileno Concentración del 14,3% en Grados 0Brix Néctar de Cereza en el Punto 1. Concentración del 12,9% en Grados 0Brix Néctar de Cereza en el Punto 2. Distancia de transferencia de masa A.2.Transferencia de Masa del Néctar en el N 2. (LIQUIDO EN EL GAS) 93 Características Unidad- Magnitud Difusividad molecular del néctar en el gas N2. Temperatura 298 ºK Presión parcial del gas A A1 = 0,89 atmosferas (N2) en el Punto (1). Presión parcial del gas A A2=0,64 atmosferas (N2) en el Punto (2). Constante de gases ideales Distancia de transferencia de masa Reemplazando en (i) A.3.Transferencia de Masa del N2 en el Polietileno (GAS EN EL SOLIDO) (PERMEABILIDAD) Características Unidad- Magnitud Permeabilidad del N2 en Polietileno Temperatura 298 ºK Presión parcial del gas A (N2) en el A1 = 0,89 atmosferas Punto (1). Presión parcial del gas A (N2) en el A2=0,64 atmosferas Punto (2). Distancia de transferencia de masa Volumen Molar del gas en condiciones normales 94 Reemplazando en (i) A.4.Transferencia de Masa en el Solido Haciendo uso de la Solubilidad N2 en el Polietileno (GAS EN EL SOLIDO) (SOLUBILIDAD). Características Solubilidad en el empaque Unidad- Magnitud Difusividad molecular del gas N2 en el empaque de polietileno. Presión parcial del gas A A1 = 0,89 atmosferas (N2) en el Punto (1). Presión parcial del gas A (N2) A2=0,64 atmosferas en el Punto (2). Distancia de transferencia de masa 95 A.5.Transferencia de Masa del acido Málico en el Néctar (Agua + Azúcar) (SOLIDO_LIQUIDO) Características Unidad- Magnitud Difusividad molecular del acido Málico en el Néctar Distancia de transferencia de masa Partimos desde hallar: El Número de Moles El Peso Molecular 96 58 0,279044 Hallando la Fracción Molar: 97 + 1 Hallado XBM Hallando 98 CAPITULO VIII TRANSFERENCIA DE MASA EN GELES BIOLOGICOS 8.1 Transferencia de Masa en Geles Biológicos. La trasferencia de masa en geles biológicos está representada en el mundo de los alimentos por los procesos de migración de las macromoléculas como las proteínas en diversos sistemas alimentarios. Las macromoléculas en solución con pesos moleculares de decenas de miles o más se solían describir como coloides, pero en la actualidad se sabe que casi siempre producen soluciones verdaderas. El comportamiento de difusión de las macromoléculas en solución depende de su gran tamaño y sus formas, que pueden ser serpenteantes, cilíndricas o globulares (esferas o elipsoides). Además, las interacciones de las moléculas grandes con las pequeñas moléculas del disolvente o de otros solutos, afectan tanto su difusión como la de las moléculas de soluto pequeñas. En los procesos de fermentación, los nutrimentos, azúcares, oxígeno, etc., se difunden en los microorganismos y éstos expulsan los productos de desperdicio y hasta algunas 99 enzimas.asi tenemos los procesos de difusión molecular de los microorganismos en sistemas proteicos, lácteos, geles, sistemas pre-bióticos etc. En los alimentos se pueden evaluar estos procesos de migración molecular mediante técnicas específicas como la electroforesis. Así tenemos: Electroforesis en Geles de Poliacrilamida de Proteínas de Trigo. Las proteínas como otras muchas macromoléculas biológicas poseen grupos químicos ionizables que dotaran a la molécula de una carga eléctrica neta determinada .Dicha carga dependerá del Ph del medio en el que se encuentra la proteína y será normalmente distinta para cada especie molecular. Por consiguiente, si una solución de proteínas es sometida a la acción de un campo eléctrico, las diferentes proteínas migraran a diferente velocidad hacia el polo correspondiente, siendo esta diferente velocidad de migración la base de su separación. Todo ello se lleva a cabo sobre un soporte solido (geles de poliacrilamida) que ejerce una función filtro, lográndose de este modo separaciones con un alto poder resolutivo. En lo que respecta a las proteínas de trigo, la técnica de electroforesis se aplica en dos variantes: la primera de ellas comenzó a utilizarse en los años 70 y ha sido descrita por varios autores (Busshuck y Zilman ,1978: Autran ,1985). Su aplicación se limita al análisis de gliadina que pueden extraerse del grano con alcohol o etilenglicol en aproximadamente una hora, la muestra así extraída se diluye en un medio acido (Ph=3.1), de tal, modo que las gliadinas adquirirán una carga neta positiva. La muestra 100 con las proteínas se deposita sobre un gel de poliacrilamina del 6% y el gel es sometido a la acción de un campo eléctrico. El Tapón en contacto con el gel es también un medio acido de Ph = 3.1. El polo positivo se situará en la parte en se aplicaron las proteínas y el lado opuesto estará ocupado por el polo negativo. Las proteínas dada su carga positiva migraran hacia el polo negativo atravesando el gel a una velocidad proporcional a su carga. Dado que el gel es de poro ancho (6% de acrilamida),la base de la separación de las gliadinas será su carga eléctrica diferente , siendo el efecto filtro del soporte solido despreciable . Finalizada la separación, es desconecta la corriente y los geles se sumergen en acido tricloroacetico para fijar las proteínas, tiñéndose posteriormente con un colorante especifico de proteínas, de este modo se obtiene un diagrama de bandas correspondiente de las diferentes gliadinas. El tiempo necesario para la separación varía según los autores, dependiendo del campo eléctrico aplicado, pero en general se sitúan entre 1 y 5 horas, aunque lo importante en este punto es establecer unas condiciones fijas para todos los análisis para poder hacer comparaciones posteriores entre diferentes geles. La segunda modalidad de electrones utilizada en el análisis de proteínas del trigo es la denominada SDS_PAGE (electroforesis en geles en poliacrilamida con SDS),la novedad de este sistema consiste en la introducción de una sustancia detergente ,el dodcilsulfato sódico tanto en el gel como en la solución de extracción de las proteínas. 101 El SDS se encontrará cargados negativamente y por tanto el conjunto proteína detergente migrará hacia el polo positivo del campo eléctrico. Sé sabe que las proteínas ligan una cantidad de detergente por unidad de masa aproximadamente constante, con lo que su densidad de carga (relación carga/masa) será igual para todas y su separación se deberá, fundamentalmente al efecto filtro ejercido por la poliacrilamida, las proteínas mayores se encontraran más resistencia que las pequeñas desplazándose más lentamente. Se puede comprobar que existe una relación proporcional inversa entre la distancia que recorre una proteína y el logaritmo de su peso molecular. De esta forma, si en el gel se añaden unas proteínas marcadoras del peso molecular conocido, será posible determinar el peso molecular de las proteínas desconocidas sin más que extrapolar en la relación de proporcionalidad inversa antes indicada. Así podría en principio determinarse con gran precisión el peso molecular de las distintas proteínas del trigo e identificarlas por el mismo. Separación de proteínas a diferencia del método anterior esta técnica es posible incluir en la separación las proteínas denominadas gluteninas, que como ya se indico anteriormente están formadas por subunidades de alto y bajo peso molecular y que se unen entre si mediante puentes de desulfuro. El caso de detergente y de agentes reductores (DDT o mercaptoetanol) permite la separación de estas subunidades y su solubilizacion lo que no era posible en el método anterior. De este modo la identificación varietal se basara ahora en criterios más amplios ,no solo en diferencias 102 de gliadinas sino también en gluteninas ,proteínas consideradas en estrecha relación con las propiedades tecnológicas del trigo (CALAVERA, 2004). 8.1 Transferencia de Masa Predictiva en Fluidos no Newtonianos. Ley de Fick de Trasferencia de Masa en Líquidos Tenemos las principales Ecuaciones: Ley de Fick para Líquidos Concentración Promedio Molecular Fraccion Mol Promedio en B: En el caso de geles biológicos se tienen dos sistemas en donde las moléculas pequeñas de los solutos se difunden en sistemas proteicos coloidales. Así Tenemos el Caso de la Sacarosa en la Gelatina Una capa de gelatina en agua de 5mm de espesor y que contiene 5,1% de gelatina en peso a 293 ºK, separa dos soluciones de sacarosa. 103 La concentración de sacarosa en la solución en una de las superficies de la gelatina es constante e igual a 2 gr de sacarosa/100ml de solución y en la otra superficie es de 0,2 gr/100. ¿Calcule el flujo específico de sacarosa en Kg de sacarosa/seg-m2 a través del gel en estado estable? I.DATOS: Unidad-Magnitud Concentración de la gelatina Temperatura Concentración en el punto (1) Concentración en el punto (2) Difusividad de sacarosa a través del gel Distancia de trasferencia de masa Peso Molecular de Sacarosa II.PLANTEAMIENTO DEL EJERCICIO: Se aplicará la siguiente ecuación Identificamos los sistemas 104 A Sacarosa B (Gelatina + H2O) III.Solucion del Problema: Para ello tenemos que hallar los datos de las fracciones molares Fracción Molar de A en el Punto 1 Numero de Moles de A en el Punto 1 Peso Molecular de la Sacarosa en el Punto 1 Reemplazando Datos se Tiene: Fracción Molar de B en el Punto 1 Numero de Moles de B en el Punto 1 105 . Peso Molecular de la (Gelatina + H2O) Reemplazando Datos se Tiene: Luego se Tiene: Numero de Moles Totales en el Punto 1. Reemplazando Datos: Entonces se reemplaza en (1) y en (3): 106 Fracción Molar de A en el Punto 2 Numero de Moles de A en el Punto 2 Peso Molecular de la Sacarosa en el Punto 2 Reemplazando Datos se Tiene: Fracción Molar de B en el Punto 2 Numero de Moles de B en el Punto 2 . 107 Peso Molecular de la (Gelatina + H2O) Reemplazando Datos se Tiene: Si se Tiene que: 99,8 100% X 5,1% ; X = 5,08 Numero de Moles Totales en el Punto 2. Reemplazando Datos: 108 CAPITULO IX DIFUSION EN ESTADO NO ESTACIONARIO-DEDUCCION DE LA ECUACION BASICA. 9.1 Difusión en estado no estacionario Difusión es hacer que un fluido se extienda en todas las direcciones. La difusión es un proceso físico irreversible, en el que partículas materiales se introducen en un medio que inicialmente estaba ausente, aumentando la entropía del sistema conjunto formado por las partículas difundidas o soluto y el medio donde se difunden o disolvente. Difusión en estado no estacionario en un sistema, es el proceso mediante el cual las variables presión, concentración de los fluidos dependen de la variable tiempo. 9.2 Deducción de la Ecuación Básica 109 El procedimiento para deducir la fórmula de difusión en estado no estacionario en una dirección para transferencia de masa es similar al de la ecuación de transferencia de calor. Con referencia La masa se difunde en dirección x en un cubo constituido por un sólido, un gas o un líquido inmóvil, cuyas dimensiones son A x, Ay y AZ. Para la difusión en la dirección x, . --------------------------------------------------------------------(9.1) El termino de es la derivada parcial de (Ca); concentración de a con respecto a X cuando la variable tiempo permanece constante. Donde: Velocidad de Entrada = Velocidad de Acumulación + Velocidad de Salida ______(9.2) Velocidad de Entrada = ___________(9.3) Velocidad de Salida = Velocidad de acumulación de volumen = ------------ (9.5) 9.2, 9. 3, 9.4 se reemplaza en 9.1 y se tiene: 110 _________________________________ (9.6) A continuación tenemos la ley de Fick de trasferencia de masa en estado no estacionario 9.3 Difusión en una placa plana con resistencia superficial despreciable -------------------------------------------------------- (9.9) Con esta ecuación se aplica y se obtiene resultados de m, n en graficas de trasferencia de masa en estado no estacionario para hallar de acuerdo a la figura plana, el nivel de concentración o la difusividad del problema. 9.4 Difusión en Estado No Estacionario en Diversas Geometrías. En este caso a través de las diferentes geometrías amorfas nos permite conocer los diferentes niveles de concentración de: CL1= Concentración del liquido que rodea al producto expresado en CLi= Concentración del liquido en la superficie del producto expresado en 111 Ci= Concentración dentro del producto expresado en Aplicación de las diferentes concentraciones en alimentos: Por ejemplo, en el caso de fruta confitada, el jarabe de 670 brix inicial que rodea a la fruta, representa la concentración CL1 (Concentración del liquido que rodea al producto expresado en ); el jarabe en grados 0 brix que está en la superficie del producto para iniciar su proceso de difusión molecular del jarabe-fruta, representa la concentración CLi (Concentración del liquido en la superficie del producto expresado en ) ; el jarabe en grados 0brix que ya se encuentra dentro de la fruta, representa la concentración(Concentración dentro del producto expresado en ). Sabemos que para la preparación y desarrollo del proceso tecnológico de frutas confitadas previamente se tiene que seleccionar la materia prima a trabajar en este caso puede ser frutas verdes como papaya verde, hortalizas verdes como nabo verde, zanahoria verde etc. previamente se le da el acondicionamiento adecuado, se lava, se pela el producto, luego se coloca en recipientes de agua y sal por un tiempo de 48 horas, posteriormente la materia prima se corta en cubos aproximadamente de 1,5 cm de lado. Por otro lado se prepara el jarabe de azúcar con parámetros de 67º - 70 º grados brix y se le coloca en un deposito. Luego se colocan los cubos de frutas verdes y se cocciona hasta que empiece a difundirse el jarabe en la fruta por espacio de e 112 A continuación tenemos la representación grafica del proceso de difusión molecular basada en las diferentes concentraciones que actúan sobre el alimento en estado no estacionario. Jarabe que rodea a la fruta Jarabe en la superficie de la fruta fruta Concentración dentro De la fruta. CL1 CLi Ci del producto Fig. 13: Concentraciones en transferencia de masa no estacionarios CLi < Ci K<1 CLi> Ci K <1 y Kc = Fig. 14: Figuras amorfas de transferencia de masa en estado no estacionario 9.5 Transferencia de Masa en Estado no Estacionario en Figuras Esféricas y Cilíndricas. Evaluaciones de Transferencia de Masa en Estado no Estacionario Aplicado a al Néctar Saúco Lúcuma a los 18 Meses Transcurridos, Respectivamente: 113 Hallando la transferencia de masa en estado no estacionario en la dirección radial del cilindro (eje X) aplicado a la formulación Nº1 del Néctar Saúco Lúcuma con 11,5 ºBrix de concentración. Se desarrolla para el eje X con una concentración de 11,5 Brix 0.14 mt 0,06 mt Fig. 15: Transferencia de masa en figuras cilíndricas a) Análisis de Concentraciones: C L1 C1 0 Kg mol m3 para T0 inicial 0 C Li C0 0 Kg mol m3 para T0 inicial 0 C i C 0,115 Kg mol m3 para T0 inicial 0 b) Análisis de Distancias: 114 Donde X = inicio al centro del cilindro X 1 = al extremo del cilindro Y 0.14 mt X 0,0 6 mt Fig. 16: Transferencia de masa en eje radial y de ordenadas C) Análisis de Tablas: N = Dato de Posición Relativa N x x1 Donde: X = inicio al centro del cilindro X 1 = al extremo del cilindro Reemplazando: 115 N x 0 0 x1 0,03 M Dab K Kc X 1 M = Dato de Resistencia Relativa Donde: Dab = Difusividad del néctar en el empaque (m 2/seg) K = Coeficiente de distribución de equilibrio (adimensional) Kc = Coeficiente convectivo (m/seg) X1 = Posición Reemplazando: 1,504 x 10 M 9 m2 seg mt 1 x 0,2 x 0,03 mt seg 0.00000025 X = Posición General en la Gráfica X Dab x t X1 2 Donde: Dab = Difusividad del néctar en el empaque (cilindro) 116 T = Tiempo de almacenamiento del producto en el envase X1 = Distancia, radio del cilindro Reemplazando: 1,504 x 10 9 X Luego con el valor de n=0; m2 x 46656000 seg seg 3x10 2 mt 2 77,96 el valor de m=0,00000025 casi cero y para efectos de trabajar en la gráfica, hacemos que m sea igual a cero; con el valor de X= 77,967 el cual es dividido entre 100 para poder entrar a la grafica (De de transferencia de masa en estado no estacionario para figuras cilíndricas) y poder hallar el valor de y. Y 0.0155 0,7799 Fig. 17: Transferencia de masa en estado no X estacionario para figuras cilíndricas 0.5 1.0 1.5 2.0 2.5 3.0 Fig. 18:Grafico de Transferencia de masa no estacionario para figuras cilíndricas 117 Luego tanto el valor de y como de x respectivamente es multiplicado por 100 ya que inicialmente para poder hacer uso de la tabla (Para figuras cilíndricas de transferencia de masa en estado no estacionario) fue dividido entre 100 respectivamente X =77,96 para entrar en la tabla dividimos entre 100 X = 0.779 el cual nos dio un valor de Y = 0,015 Pero para hacer el uso real de valor lo multiplicamos por 100 X = 77,96 y el valor de Y = 1,55 Y 1,55 C1 _ C C1 C0 kgr mol . m3 0 Co 0 0,115 kg 1,55 0 C0 0 0,115 3 mt C0 0,07419 Na Na Kg mol mt 3 Dab dCa dx Dab dCa dx 118 C0 Na Dab dca C x1 xº Na dx Dab C0 C X1 X 0 Na Dab C C0 X1 X 0 Reemplazando Datos: Na 1,504 x 109 11,5 7,41 3x10 3 0 kg mol m3 mt Se tiene la transferencia de masa para el eje radial (Eje X) Na 2,05045 x 10 6 kgmol m2 seg Se desarrolla para el eje Y con una concentración de 11,5 Brix X X= 0,06 mt Y Y = 0,14 Fig. 19: Transferencia de masa en estado no estacionario-cilindros con posición de ordenadas 119 a) Análisis de Concentraciones: C L1 C1 0 Kg mol m3 para T0 inicial 0 C Li C 0 0 Kg mol m3 para T0 inicial 0 C i C 0,115 Kg mol m3 para T0 inicial 0 b) Análisis de Distancias: Donde y = inicio al centro del cilindro y 1 = al extremo del cilindro Y = 0,14 mt mmt X = 0,07 mt mmt Fig. 20: Transferencia de masa de figuras cilindricas usando planos 120 C) Análisis de Tablas: N = Dato de Posición Relativa N y y1 Donde X = inicio al centro del cilindro X 1 = al extremo del cilindro Reemplazando: N X 0 0 X 1 0,07 M = Dato de Resistencia Relativa M Dab K Kc Y1 Donde: Dab = Difusividad del néctar en el empaque (m 2/seg) K = Coeficiente de distribución de equilibrio (adimensional) Kc = Coeficiente convectivo (m/seg) Y1 = Posición Reemplazando: 121 1,504 x 10 9 M m2 seg mt 1 x 0,2 x 0,07 mt seg 0.000000107 X = Posición General en la Gráfica X Dab x t Y1 2 Donde : Dab = Difusividad del néctar en el empaque (cilindro) T = Tiempo de almacenamiento del producto en el envase Y1 = Distancia, radio del cilindro Reemplazando: m2 1,504 x 10 x 46656000 seg seg 9 X 7 x10 2 mt 2 14,32 Luego con el valor de n=0; el valor de m=0,00000000005 casi cero y para efectos de trabajar en la gráfica, hacemos que m sea igual a cero; y con el valor de X= 9,54 el cual es dividido entre 100 para poder entrar a la tabla respectivamente y poder hallar el valor de y. Y 0.78 122 Luego tanto el valor de y como de x respectivamente es multiplicado por 100 ya que inicialmente para poder hacer uso de la tabla fue dividido entre 100 respectivamente X =14,32 para entrar en la tabla dividimos entre 100 X = 0,1432 el cual nos dio un valor de Y = 0,78 Pero para hacer el uso real de valor lo multiplicamos por 100 X = 14,32 y el valor de Y =78 Y 78 78 0 C0 C1 _ C C1 C0 kgr mol . m3 0 Co 0 0,115 kg 0 0,115 3 mt C0 1,47 x 103 Kg mol mt3 123 Dab dCa dx Na dCa Dab Na dx C0 Dab dca Na C dx Na Dab C0 C X1 X 0 Na Dab C C0 X1 X 0 Reemplazando Datos: m2 11,5 0,147 kg 3mol seg m 3 3x10 0 mt 1,504 x 109 Na Se tiene la transferencia de masa para el eje (Eje Y) Na 5,691x10 6 kgmol m2 seg En total la transferencia de masa en todo el sistema del néctar con 11,5 ºbrix será de: 124 Na total Nax Nay Na Total 2,05045 x 10 6 Kg mol m2 seg 5,691 x 10 6 Kg mol m2 seg V. MATERIALES Y METODOS Los materiales utilizados en la presente investigación son las fuentes bibliográficas de libros en la especialidad de ingeniería de procesos en alimentos, información científica a través de medio virtuales (internet); modelos matemáticos de FICK para transferencia de masa. Metodología utilizada en la presente investigación es del tipo descriptiva bibliográfica aplicada al área de ingeniería de alimentos. La metodología para la contratación será la siguiente: 1. Formulación del índice preliminar 125 2. Identificación de la información que sea necesario acopiar, ordenar, sistematizar y además ser materia de análisis. 3. Análisis de la información. 4. Tratamiento de la Información y redacción del índice del texto 5. Revisión, corrección, complementación y redacción del texto. 6. Impresión. 7. Presentación del informe Final. VI. RESULTADOS Los resultados obtenidos en la presente investigación: La transferencia de masa es aplicativa a sistemas bioquímicos alimentarios en pre proceso, proceso y conservación. En el proceso de maduración y conservación de la cereza se tiene la migración molecular del acido málico de la cereza con el medio que la rodea , en este caso en condiciones al ambiente se tiene 126 La transferencia de masa en estados biológicos como geles, coloides, se pueden trabajar en sistemas binarios y de tres componentes. La transferencia de masa se da a través de procesos de migración molecular en sistemas reologicos alimentarios; tal como se ha aplicado a néctares de concentraciones de grados Brix que van de 13 al 15 %. Se ha establecido como límite de migración global válido para todo tipo de productos 10 mg/dm 2 de material ( 60 mg/Kg de alimento). VII. DISCUSION La transferencia de masa aplicada a la ingeniería de alimentos se manifiesta como procesos de velocidad en los que la taza de transferencia de masa se ve influenciada por una fuerza directriz y una resistencia. La fuerza directora se debe principalmente a gradientes de concentración, a gradientes de presión de los fluidos alimentarios que se transmiten respectivamente; y la resistencia se debe al medio a través del cual el material se trasfiere, así como cualquier tipo de interacción entre el medio y el material que se trasfiere. 127 Cuando se considera la transferencia de vapores o de gases, las fuerzas directoras se miden en términos de diferencias de presiones. Pero cuando se trata de sólidos en disolución se mide en términos de diferencias de concentración. Los alimentos como frutas y verduras, lácteos, carnes, huevos, pescados y mariscos, tienen en su estructura bioquímica componentes volátiles orgánicos propios del alimento como los ácidos orgánicos predominantes, ácidos grasos volátiles, aminas volátiles etc. Envasar los alimentos es una práctica que persigue alargar la vida comercial de los alimentos. Para ello, es necesario que el alimento no se contamine. El aislamiento es, en este punto, una de las prioridades fundamentales del envase. Se necesita una impermeabilidad adecuada a la humedad, al oxígeno o incluso a la luz; pero, al mismo tiempo, se produce una migración desde los materiales del envase hacia el alimento, por lo que es necesario controlar el tipo y la calidad del envase con el fin de impedir que este fenómeno se traduzca en toxicidad para los consumidores. En realidad, los envases forman parte de la vida del propio alimento, lo que se ha considerado, con el tiempo, un hecho positivo. Existen envases pasivos y activos. En un envase pasivo tan sólo se pretende aislar (envase tradicional), por lo que lo esencial es cuidar el material y su composición para conocer sus limitaciones y los riesgos potenciales. En esta categoría se incluyen la mayor parte de los envases actuales. Existen innovaciones en los envases pasivos que incrementan la función de barrera, como seleccionar materiales impermeables o de permeablilidad selectiva para que los envases se ajusten a productos que respiran como las frutas, verduras, carnes, pescados. En la mayoría de los casos, las recientes innovaciones están ligadas al coste y a la optimización del desempeño de la función barrera del envase. 128 Por el contrario, los envases activos son algo completamente diferente. En realidad, y en apariencia, son como los clásicos, con una notable diferencia: se empiezan a conocer cómo se comportan los materiales y, aprovechando esa característica de migración, se puede conseguir impregnar el material con alguna sustancia que pueda actuar como conservante, potenciadora de algunas características interesantes del producto o mejoradora del producto desde el punto de vista de la calidad o de la seguridad del mismo. Con excepción de unos cuantos productos, todos los alimentos se deterioran a cierta velocidad después del envasado o durante su almacenamiento. El objetivo de un envase activo, por tanto, no es disminuir la velocidad de deterioro sino conseguir pequeñas modificaciones en el alimento almacenado. Esto implica tanto aspectos de seguridad como aspectos de calidad en alimentos. Factores que deben influir en el envase activo son la seguridad, el sabor, el perfil nutritivo, el contenido, la vida útil y el color, entre otros. El caso de los sistemas interceptores de oxígeno representa el área más desarrollada debido a que el oxígeno es el mayor enemigo en la mayoría de los alimentos y por ello se realizan esfuerzos para reducirlo. Mecanismos como la sorción (absorción del material de vitaminas o de los componentes gaseosos del aroma), la migración de componentes minoritarios de los envases plásticos a los alimentos o, en el caso de las latas, la corrosión, pueden afectar al producto y hacer que su vida útil se acorte. Un clásico ejemplo de la migración es el regusto a plástico que adquiere el agua debido a componentes de la botella de plástico. Se trata de aprovechar los defectos de los envases para convertirlos en una ventaja. Uno de los ejemplos con cierto futuro es el de incorporar a una película de plástico sustancias antioxidantes, de forma que cuando se produzca el fenómeno de la migración el material libere antioxidantes que ayudarían a mantener el producto. 129 No obstante, esto supone aceptar ese fenómeno e incuso potenciarlo, lo que no parece que sea una solución aceptable. Otras opciones son las de incorporar en la matriz del envases sustancias de absorban oxígeno, humedad o sustancias antimicrobianas. En realidad, no existe el envase perfecto. El que es bueno para una cosa puede no ser bueno para otra. Los envases de plástico tienen como desventaja su permeabilidad al oxígeno, lo que lleva a la pérdida de aromas. El cristal es una perfecta barrera al oxígeno, pero en cambio deja pasar la luz, lo que provoca oxidación y cambios en el color del producto. Al metal le afecta la temperatura, lo que da lugar a corrosión interna. El límite global de la cesión de los componentes de materiales y objetos plásticos a los productos alimenticios, conocido como migración, no podrá ser superior a 10 miligramos por decímetro cuadrado de superficie del material u objeto (mg/dm²) como nivel máximo de migración global, si bien, en algunos supuestos, y para determinadas sustancias (se establecen límites específicos. Dicho límite se amplía hasta 60 miligramos de constituyentes liberados por kilogramo de producto alimenticio (mg/kg) en algunos supuestos explícitamente establecidos. Sin embargo, el criterio establecido en la Unión Europea sobre límite máximo de migración (60 mg/kg) no ha sido seguido por otras organizaciones con mercados comunes como Mercosur, donde éste ha sido limitado, en su cota máxima, a tan sólo 50 mg/kg. VIII. REFERENCIAS BIBLIOGRAFICAS 1. BARNES K, SINCLAIR R Y WATSON D. Chemical migration and food contact materials. Woodhead Publishing Ltd. Cambridge. Reino Unido. 2006. 2. CALAVERA, JESUS. 2004. Nuevo Tratado de Panificacion y Bolleria. Segunda Edicion. Madrid : Mundi Prensa, 2004. 130 3. DORAN M., PAULINE. 1998. Principios de Ingenieria de los Bioprocesos. Tercera Edicion. Zaragoza : Acribia S.A., 1998. 4. DULCE, JAVIER BARRIO,JUAN LUIS ANTON,2005. 2005. QUIMICA FISICA. [En línea] 2005. 5. GEANKOPLIS, CHISTIE. 1998. Procesos de Transporte y Operaciones Unitarias. Tercera Edicion . s.l. : Continental S.A., 1998. 6. GIL, HERNANDEZ,ANGEL . 2010. Tratado de Nutricion .Composicion y Calidad Nutritiva de los Alimentos. 2da. Edicion. Madrid : Medica Panamericana, 2010 7. INDECOPI - 2003. NTP Noma Técnica Peruana 209.03 8. Alimento Envasados. Etiquetado, 6 Sexta Edición. 8. INDECOPI - 2003. NTP Noma Técnica Peruana 209.650. Etiquetado Declaraciones de Propiedades, Primera Edición. 9. LEWIS, M. J. Propiedades Físicas de los Alimentos y de los Sistemas de Procesado. Zaragoza España: Editorial Acribia, 2da Edición en Español, 1993. 10. POVEA, GARCERANT, ISMAEL. 2008. Interaccion Entre los Envases Polimericos y el Alimento. 2008. Interaccion Entre los Envases polimericos y el Alimento. . 11. ROBERTSON, G.L. 2006. Food Packaging, Principles and Practices. 2nd. CRC Press: B.R. FL,978. s.l. : CRC.Press., 2006. 12. RODRIGUEZ, JEREZ JUAN. 2006. Consumer.es Eroski. [En línea] 2 de Agosto de 2006. 13. SALAS, VALERIO, WALTER FRANCISCO. 2009. Empaques y Embalajes. Centro de Investigacion de Envases y Embalajes. 2009. 14. SOTO, VALDEZ,H. 2005. Migracion de Componente de Bajo Peso Molecular de Bolsas de Poliamida recomendadas para Hornear Alimentos. Mexico : Centro de Investigacion en Alimentacion y Desarrollo, 2005. 15. TREYBAL, ROBERTO. 1998. Operaciones de Transferencia de Masa. Segunda Edicion . s.l. : Interamericana de Mexico, 1998. IX. APENDICES APENDICE 1: Datos de Transferencia de Masa en Estado No Estacionario Gases Unidad-Magnitud 131 Difusividad Distancia de Transferencia Temperatura 3cmt 370C Presión Parcial en la Superficie Presión Total del Sistema Lado de la Bandeja Constante de Gases 25 cm ºK= ºC + 273,15 APENDICE 2: Datos de Transferencia de Masa en Estado No Estacionario Líquidos X. Unidad-Magnitud Acido Acético Agua XI. Solución (A) Solución (B) Difusividad Distancia de Transferencia Temperatura Concentración de Acido Acético Punto (1) Densidad del Acido Acético en el (1) Concentración de Acido Acético Punto (2) Densidad del Acido Acético en el (2) (2,5cmt) ( 2,5 x 10 -2 mt) (16ºC) (289ºK) en el 4,20% Punto en el 2,10% Punto X. ANEXOS ANEXO 1: COEFICIENTE DE DIFUSIÓN MOLECULAR PARA LÍQUIDOS SOLUTO DISOLVENTE NH3 H2O H2O TEMPERATURA ºC ºK 12 285 15 288 m2/s x 10 cm2/s -9 ó 1.64 1.77 132 O2 H2O H2O H2O H2O H2O H2O H2O H2O H2O H2O CO2 H2 ALCOHOL METILICO ALCOHOL ETILICO ALCOHOL n PROPILICO ACIDO FORMICO ACIDO ACETICO 18 25 25 25 15 10 25 15 25 9.7 25 25 10 10 25 25 25 12 25 25 25 ACIDO PROPIONICO HCl (9gr mol/litro) HCl (2.5 gr mol/litro) ACIDO BENZOICO H2O ACETONA H2O ACIDO ACETICO BENCENO UREA ETANOL AGUA ETANOL KCL AGUA KCL ETILENGLICOL 291 298 298 298 288 283 298 288 298 282.7 298 298 283 283 298 298 298 285 298 298 298 1.98 2.41 2.00 4.80 1.26 0.84 1.24 0.87 1.52 0.769 1.26 1.01 3.3 2.5 1.21 1.28 2.09 0.54 1.13 1.870 0.119 FUENTE: GEANKOPLIS, CHRISTIE. Procesos de Transporte y Operaciones Unitarias, México,: Compañía Editorial Continental S.A.,Tercera Edición ,1998. ANEXO 2: COEFICIENTE DE DIFUSIÓN DE GASES A 101.32 kPa DE PRESIÓN TEMPERATURA SISTEMA Aire - NH3 o C 0 o DIFUSIVIDAD K 273 0.198 133 Aire – H2O 0 273 0.220 25 298 0.260 42 315 0.288 3 276 0.142 44 317 0.177 Aire – H2 0 273 0.611 Aire – C2H5OH 25 298 0.135 42 315 0.145 Aire – CH3COOH 0 273 0.106 Aire - n – hexano 21 294 0.080 Aire – benceno 25 298 0.0962 Aire – tolueno 25.9 298.9 0.086 Aire – n – butanol 0 273 0.0703 25.9 298.9 0.087 H2 – CH4 25 298 0.726 H2 – N2 25 298 0.784 85 358 1.052 H2 - benceno 38.1 311.1 0.404 H2 - Ar 22.4 295.4 0.83 H2 – NH3 25 298 0.783 Aire – CO2 FUENTE: GEANKOPLIS, CHRISTIE. Procesos de Transporte y Operaciones Editorial Continental S.A.,Tercera Edición ,1998. Unitarias, México,: Compañía ANEXO 3: COEFICIENTE DE DIFUSIÓN DE GASES A 101.32 kPa DE PRESIÓN TEMPERATURA SISTEMA H2 – SO2 o o C 50 DIFUSIVIDAD K 323 0.61 134 H2- C2H5OH 67 340 0.586 He – Aire 25 298 0.729 He – n - butanol 150 423 0.587 He – aire 44 317 0.765 He – CH4 25 298 0.375 He – N2 25 298 0.687 He – O2 25 298 0.729 Ar – CH4 25 298 0.202 CO2 – N2 25 298 0.167 CO2 – O2 20 293 0.153 N2 – n - butano 25 298 0.0960 H2O – CO2 34.3 307.3 0.202 CO – N2 100 373 0.318 CH3Cl – SO2 30 303 0.0693 (C2H5)2O - NH3 26.5 299.5 0.1078 FUENTE: GEANKOPLIS, CHRISTIE. Procesos de Transporte y Operaciones Editorial Continental S.A.,Tercera Edición ,1998. Unitarias, México,: Compañía ANEXO 4: VOLUMENES DE DIFUSIÓN ATÓMICA PARA EL MÉTODO DE FULLER, SCHETTLER Y GIDDINGS. Incrementos del volumen de difusión atómico y estructural, v C 16.5 (C1) 19.5 H 1.98 (S) 17.0 O 5.48 Anillo aromático -20.2 135 (N) 5.69 Anillo heterocíclico -20.2 Volúmenes de difusión para moléculas simples, H2 7.07 CO 18.9 D2 6.70 CO2 26.9 He 2.88 N 2O 35.9 N2 17.9 NH 3 14.9 O2 16.6 H 2O 12.7 Air 20.1 (CCl2 F2 ) 114.8 Ar 16.1 (SF6 ) 69.7 Kr 22.8 (Cl2 ) 37.7 (Xe) 37.9 (Br2 ) 67.2 Ne 5.59 (SO2 ) 41.1 Fuente: Reproducido con permiso de E. N. Fuller, P. D. Schettler y J. C. Giddings, Ind Eng. Chem., 58, 19(1966). Copyright de la American Chemical Society. Nota: Los paréntesis indican que el valor sólo está basado en unos cuantos puntos de datos. 136