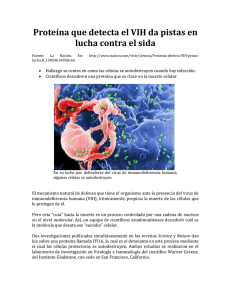
neuropatogénesis en la infeccion por
Anuncio

INMUNOPATOGÉNESIS EN LA INFECCION POR VIRUS DE LA INMUNODEFICIENCIA HUMANA (VIH) ASOCIADO AL COMPLEJO DEMENCIAL. Dr. ALEX RICARDO GONZALEZ MENDOZA. PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS BASICAS ESPECIALIZACION LABORATORIO DE INMUNOLOGIA CLINICA BOGOTA, D.C. 2005. 14 INMUNOPATOGÉNESIS EN LA INFECCION POR VIRUS DE LA INMUNODEFICIENCIA HUMANA (VIH) ASOCIADO AL COMPLEJO DEMENCIAL. Dr. ALEX RICARDO GONZALEZ MENDOZA. Monografía presentada como requisito para obtener el título de Especialista en Laboratorio de Inmunología Clínica. Director científico: Dr. RODOLFO DE LA HOZ. Médico Pediatra Clínica del Country. Master en Microbiología. PONTIFICIA UNIVERSIDAD JAVERIANA FACULTAD DE CIENCIAS BASICAS ESPECIALIZACION LABORATORIO DE INMUNOLOGIA CLINICA BOGOTA, D.C. 2005. 15 Nota de Aceptación: Firma del Director de la Monografía Firma de la Coordinadora de la Especialización Laboratorio de Inmunología Clínica Bogotá, D.C. Noviembre 18 de 2005. 16 NOTA DE ADVERTENCIA Artículo 23 de la Resolución No. 13 de Julio de 1946. La Universidad no se hace responsable de los conceptos emitidos por sus alumnos en sus trabajos de tesis. Solo velará por que no se publique nada contrario al Dogma y a la Moral Católica, y por que las tesis no contengan ataques personales contra persona alguna, antes bien, se vea en ellas el anhelo de buscar la Verdad y la Justicia. 17 Este trabajo lo dedico al Todopoderoso quien me dio la existencia y desde lo alto me ilumina con su sabiduría. A mis padres: GRACIELA MENDOZA Y RICARDO GONZALEZ por la confianza, el amor incondicional y la comprensión que me brindan diariamente. Por haberme ofrecido una educación basada en el respeto y la responsabilidad. Por estar a mi lado en los mejores momentos y llenarme de ánimo en los difíciles. A un ser muy especial que con su cariño ha logrado llenarme la vida de Alegría y Felicidad. A los conmigo Docentes que sus experiencias, e compartieron conocimientos inculcaron y principios éticos profesionales. A mis compañeros por expresarme su afecto y hacerme sentir parte de ellos. Alex Ricardo… 18 AGRADECIMIENTOS Este Proyecto no es solamente el producto de mi labor. Muchas personas prestaron su ayuda en diferentes momentos. A todos ellos les estoy muy agradecido por sus esfuerzos. Estos incluyen: Dr. MARIO FERNANDO ORDOÑEZ, por ampliar mis conocimientos en cuanto a la organización genómica del Virus de la Inmunodeficiencia Humana y las técnicas de Laboratorio Clínico utilizadas en su Diagnóstico. También agradezco al Dr. William Eduardo Atehortua por su asesoría metodológica. Finalmente doy gracias al Dr. RODOLFO DE LA HOZ, Médico Pediatra Clínica del Country, Bogotá, por apoyarme constantemente en la ejecución y dirección de este Proyecto. A la Dra. DIANA PATIÑO, Coordinadora de la Especialización Laboratorio de Inmunología Clínica de la Pontificia Universidad Javeriana de Bogotá, por haber contribuido significativamente en la elaboración del mismo. 19 CONTENIDO Pág. INTRODUCCION. 14 Objetivo General. 15 Objetivos Específicos. 15 Descripción Genera del Problema. 16 Justificación. 16 1. ETIOLOGÍA. 17 2. ORGANIZACIÓN GENÓMICA. 17 3. REPLICACIÓN VIRAL. 19 4. GLICOPROTEINA GP120. 21 5. QUIMIOCINAS. 22 5.1 Los Receptores de Quimiocinas y el Tropismo Viral. 24 5.2 Las Vías de Señalización Interna. 26 6. PATOGENIA DE LA INFECCIÓN. 29 6.1 Infección Primaria. 30 6.1.1 Inmunidad Celular. 31 6.1.2 Inmunidad Humoral. 31 6.2 Período de Latencia. 32 6.3 Reservorios Celulares. 33 6.4 Síndrome de InmunoDeficiencia Adquirida. 34 7. CÉLULAS DENDRÍTICAS. 35 7.1 Participación de las CD en la Infección por VIH-1 . 37 7.2 Interacción Célula Dendrítica – VIH-1: DC-SIGN. 39 8. INMUNOPATOGÉNESIS. 41 8.1 Alteraciones de los Linfocitos T. 42 8.2 Alteraciones de los Linfocitos B. 44 2 8.3 Alteración de los Monocitos/Macrófagos. 45 8.4 Otras Alteraciones. 45 8.5 Anticuerpos Neutralizantes. 46 8.6 Citotoxicidad Celular Dependiente de Anticuerpos. 48 8.7 Linfocitos T Citotóxicos. 49 9. TRASTORNOS DEL SISTEMA NERVIOSO CENTRAL ASOCIADOS AL SIDA. 50 9.1 Características Psiquiátricas. 50 9.1.1 Delirio. 50 9.1.2 Depresión. 51 9.1.3 Psicosis. 51 9.1.4 Manía. 51 9.2 Características Neuropatológicas. 52 9.3 Demencia Asociada al VIH. 53 9.3.1 El Papel Causal de la Gp120 del VIH en la Demencia. 56 9.4 Neuropatogénesis del Complejo Demencial del SIDA. 59 9.5 Autoinmunidad en el Complejo Demencial del SIDA: Mimetismo Molecular. 60 10. DIAGNÓSTICO POR LABORATORIO. 64 10.1 Elisa (Ensayo Inmunoabsorbente ligado a enzimas). 65 10.2 Western Blot. 67 10.3 Recuento de Poblaciones Celulares. 69 10.4 Diagnóstico Diferencial. 71 CONCLUSIONES 72 RECOMENDACIONES 74 BIBLIOGRAFIA. 75 3 LISTA DE TABLAS Pág. Tabla 1. Complicaciones Neurológicas Directas e Indirectas del Virus de la Inmunodeficiencia Humana. 53 4 LISTA DE FIGURAS Pág. Figura 1. Genes del Virus de la Inmunodeficiencia Humana con Referencia de las Proteínas que Codifican. 18 Figura 2. Ciclo Biológico del Virus de la Inmunodeficiencia Humana. 20 Figura 3. Interacción entre la Envoltura Viral, La Proteína CD4 y los Co-receptores CXCR4 y CCR5. 26 Figura 4. Origen y Subpoblaciones de las Células Dendríticas. 36 Figura 5. Estructura del DC-SIGN. 40 Figura 6. Interacción Célula Dendrítica – Virus de la Inmunodeficiencia Humana. 41 Figura 7. Mimetismo Molecular del Virus de la Inmunodefciciencia Humana. 64 Figura 8. Detección del Virus de la Inmunodeficiencia Humana mediante ELISA Directo. 65 Figura 9. Prueba de ELISA Indirecto para la detección de Anticuerpos contra el Virus de la Inmunodeficiencia Humana. Figura 10. Western Blot. 66 68 a) Protocolo de Western Blot. b) Resultado de un Western Blot. Figura 11. Recuento de Células CD3 CD4. a) De un Paciente sano. b) De un Paciente con SIDA. 5 69 GLOSARIO AZT: Zidovudina. C1 – C5: Regiones Constantes de la glicoproteína gp120 del Virus de la Inmunodeficiencia Humana. CC: Quimiocinas que poseen cuatro cisteínas de las cuales dos se encuentran adyacentes en la N-terminal. CD: Célula Dendrítica. CDM: Célula Dendrítica Mieloide. CDP: Célula Dendrítica Plasmocitoide. CDS: Complejo Demencial del SIDA. CL: Célula de Langerhans. CMH: Complejo Mayor de Histocompatibilidad. CPA: Célula Presentadora de Antígeno. CXC: Quimiocinas que poseen cuatro cisteínas que se encuentran separadas por un aminoácido. DAG: Diacilglicerol D-VIH: Demencia Asociada al Virus de la Inmunodeficiencia Humana. ELISA: Inmunoensayo Ligado a Enzimas. GM-CSF: Factor Estimulante de Colonias Granulocitos y Monocitos. Gp120: Glicoproteína de la superficie del Virus de la Inmunodeficiencia Humana con un peso molecular de 120KDa. Gp160: Glicoproteína precursora de la superficie del Virus de la Inmunodeficiencia Humana, la cual se divide intracelularmente en gp120 y gp41. Gp41: Glicoproteína de la superficie del Virus de la Inmunodeficiencia Humana con un peso molecular de 41KDa. 6 HAART: Terapia Antirretroviral Altamente Activa. ICAM: Molécula de Adhesión Intercelular. IFN: Interferon. IL: Interleuquina. InsP3: Inositol trifosfato. LAV: Linfoadenopatía. LTC (CD8): Linfocitos T Citotóxicos. LTCD4: Linfocitos T Ayudadores. LTR: Repeticiones terminales largas. M-CSF: Factor Estimulante de Colonias de Monocitos. MIP: Proteína Inflamatoria de Macrófago. MOR: Movimientos Oculares Rápidos. M-trópicos: Preferencia del Virus de la Inmunodeficiencia Humana para infectar Macrófagos. NK: Células Asesinas Naturales. NLK: Neuroleucina. NMDA: N-metilD-aspartato. PHI: Fosfohexosa Isomerasa. PI3K: Fosfatidilinositol 3-OH cinasa. PIP2: Fosfatidilinositol bifosfato. PKC: Proteína Cinasa C. PLC: Fosfolipasa C. PND: Area Neutralizante Principal del Virus de la Inmunodeficiencia Humana. RT-PCR: Reacción en Cadena de la Polimerasa – Transcriptasa Reversa. SIDA: Síndrome de Inmunodeficiencia Adquirida. SNC: Sistema Nervioso Central. TGF: Factor Transformante del Crecimiento. TNF: Factor de Necrosis Tumoral. 7 T-trópicos: Preferencia del Virus de la Inmunodeficiencia Humana para infectar Linfocitos T. V1 – V5: Regiones Variables de la glicoproteína gp120 del Virus de la Inmunodeficiencia Humana. VIH: Virus de la Inmunodeficiencia Humana. VIP: Péptido Vasoactivo Intestinal. VLCTH – III: Virus Linfotrófico de las células T humanas tipo III. 8 INTRODUCCION El primer reporte oficial del Síndrome de Inmunodeficiencia Adquirida (SIDA) en el mundo tuvo lugar en San Francisco, California, en 1981. Sin embargo, la presencia de una respuesta serológica positiva para el Virus de la Inmunodeficiencia Humana (VIH) en sangre almacenada en Zaire desde 1959, muestra que el virus ya se encontraba en algunas poblaciones humanas por lo menos dos décadas antes. La primera indicación de que el SIDA podría ser causado por un retrovirus apareció en 1983, cuando Barre Sinoussi y colaboradores del Instituto Pasteur aislaron una transcriptasa reversa de un nodo linfoide de un sujeto enfermo de SIDA. En 1986, El comité Internacional en Taxonomía de Virus recomendó dar al virus que ocasionaba el SIDA el nombre de Virus de Inmunodeficiencia Humana (VIH). La identificación del VIH como agente causal del SIDA en 1983 a 1984 fue rápidamente seguida por la caracterización del virus y de las células que infecta. Se acepta la existencia de dos tipos de virus: el VIH-1, ampliamente diseminado en todo el mundo y el VIH-2 con elevada prevalencia en Africa Occidental, cuyo genoma coincide con el VIH-1 en un 40-50%. (Piot P. et al. 1988). La infección por VIH produce un defecto adquirido en la función inmunitaria, que afecta en especial a la inmunidad mediada por células. Los individuos infectados pueden estar asintomáticos o tener enfermedad progresiva relacionada con infecciones oportunistas recurrentes, ciertos cánceres, pérdida grave de peso y degeneración del sistema nervioso central. El tratamiento antirretroviral de alta actividad ha reducido en forma notable la incidencia de infecciones oportunistas y ha mejorado la supervivencia. (Parslow T. et al. 2002). 9 14 Objetivo General: • Revisar literatura actualizada sobre la Inmunopatogénesis Asociada al Complejo Demencial en la Infección por el Virus de la Inmunodeficiencia Humana. (VIH). Objetivos Específicos: • Mencionar las Bases Moleculares, la Organización Genética y la Replicación del Virus de la Inmunodeficiencia Humana (VIH). • Describir el Tropismo del Virus de la Inmunodeficiencia Humana (VIH) y la Complicación Neurológica más común que ocurre en el Síndrome de Inmunodeficiencia Adquirida (SIDA). • Explicar la Patogénesis y las Implicaciones Inmunológicas en la Infección por el Virus de la Inmunodeficiencia Humana (VIH). • Entender la participación de las Células Dendríticas en el control de la Inmunidad en la Infección por el Virus de la Inmunodeficiencia Humana (VIH). • Describir las diferentes Técnicas de Laboratorio utilizadas en el Diagnóstico y Seguimiento de la Infección por el Virus de la Inmunodeficiencia Humana (VIH). 15 Descripción General del Problema: Desde que la epidemia del Síndrome de Inmunodeficiencia Adquirida (SIDA) se describió por primera vez en 1981, ha llegado a ocupar proporciones por encima de 40 millones a nivel mundial. El SIDA afecta todos los sistemas del organismo pero el sistema nervioso central es afectado tempranamente. Por lo tanto, al continuar con la infección del VIH, la frecuencia de las complicaciones neurológicas se va incrementando. Aproximadamente de 30 a 60% de pacientes con SIDA tienen síntomas neurológicos, donde el complejo demencial es la complicación más frecuente en pacientes adultos con SIDA y en el 80 a 90% se pueden encontrar anormalidades neuropatológicas en la autopsia. Las complicaciones neurológicas en general se dividen en primarias o directas del Virus de la Inmunodeficiencia Humana y las secundarias a infecciones oportunistas y neoplasias. Justificación: El propósito de esta revisión es describir las bases moleculares del VIH y su tropismo en el sistema nervioso, especialmente el papel de la región V3 de la glicoproteína gp120 y el papel de los co-receptores celulares del sistema nervioso, así el complejo demencial del VIH como la complicación neurológica más común que ocurre en el SIDA, su etiopatogenia y el mimetismo molecular, que se refiere a la homología que existe entre las proteínas del VIH y del huésped como las neuronas, lo que puede inducir una respuesta autoinmune por el incremento de la proliferación de las células B capaces de reaccionar con antígenos propios. 16 INMUNOPATOGÉNESIS EN LA INFECCION POR VIRUS DE LA INMUNODEFICIENCIA HUMANA (VIH) ASOCIADO AL COMPLEJO DEMENCIAL. 1. ETIOLOGIA. El Virus de Inmunodeficiencia Humana (VIH) es un virus RNA, miembro de la familia Retroviridae, subfamilia Lentiviridae. El VIH es un virus con cubierta que posee la enzima transcriptasa inversa, esta enzima permite que el virus sintetice una copia de DNA a partir de su propio RNA genómico. El VIH antes se denominaba Virus Linfotrófico de las Células T humanas tipo III (VLCTH-III), virus relacionado con Linfoadenopatía (LAV). (Parslow T. et al. 2002). 2. ORGANIZACIÓN GENÓMICA. La organización genética del VIH es compleja, el VIH consta de un núcleo interno, que contiene el RNA genómico, rodeado por una cubierta lipídica. Además de los genes estructurales gag, pol y env, los cuales codifican las proteínas de la cubierta viral, proteínas del núcleo y enzimas virales (transcriptasa inversa, integrasa y proteinasa), respectivamente. (Piot P. et al. 1988). El VIH contiene genes que codifican para proteínas reguladoras como: rev (regulador de la proteína estructural del virion), tat (transactivador) y nef (factor regulador negativo); así como genes que codifican para proteínas que se creen involucradas en la maduración y liberación del virus: vif (factor de infectividad del virion), vpu ( proteína viral U) y vpr (proteína viral R). Basados en el parentesco de 17 las secuencias de nucleótidos y en la diversidad vista entre casos aislados de VIH1 de personas de diferentes países, se ha diseñado una clasificación del VIH-1 en subtipos, designados de la A a la K, los cuales tienen secuencias de genes en la envoltura que varían un 20% o más entre los subtipos. (Parslow T. et al. 2002). El gen env del VIH codifica a un precursor glicoproteico gp160 el cual es dividido intracelularmente al gp120 maduro y a la molécula del gp41, estas proteínas ampliamente glucosiladas son las causantes de la unión a LTCD4 y un receptor de quimiocina sobre la superficie celular y la fusión subsiguiente del virus con la membrana celular. Todos los provirus retrovirales se encuentran flanqueados por secuencias repetitivas llamadas repeticiones terminales largas (LTR). El LTR 5' contiene secuencias de promotor y enhancer esenciales para la transcripción, mientras que el LTR 3' es requerido para la poliadenilación de los transcritos de RNA. (Piot P. et al. 1988). Figura 1. Genes del Virus de la Inmunideficiencia Humana con Referencia de las Proteínas que Codifican. 18 - GAG (Gen antígeno de grupo) p24, y p17: cápsides. p7 y p9: proteínas de la nucleocápside. - ENV (Gen de envoltura) gp120, gp41: glicoproteína de la envoltura (Espículas). - POL (Gen polimerasa) Integrasa (p32). Proteasa (p12). Transcriptasa reversa (p66). El núcleo viral se encuentra constituido por varias proteínas, entre ellas la MA (matriz), la CA (cápside), la NC (núcleo cápside) y la p6, mientras que la envoltura viral se halla constituida por la membrana de la célula huésped, modificada por la inserción de las proteínas gp120 y gp41. Por otro lado, algunas proteínas que cumplen con las funciones enzimáticas esenciales para el virus son la PR (proteasa), la RT (transcriptasa reversa), la IN (integrasa) y la RNAsa. Otras proteínas que se denominan accesorias son importantes para la función del virus, por ejemplo, la Tat, que tiene funciones reguladoras esenciales para incrementar la actividad de la polimerasa (enhancer), y la rev y vpu que indirectamente participan en el ensamblaje del virión. (Frankel A. et al. 1998). 3. REPLICACIÓN VIRAL. Es posible dividir el ciclo de replicación del VIH en varios pasos. El primero de ellos lo constituye la unión de la gp120 tanto a los receptores CD4 como a los receptores de quimiocinas del tipo CC o CxC en las células blanco, los cuales son utilizados por el VIH como co-receptores. Esta unión produce un cambio conformacional en la gp41 que media la fusión de la membrana viral con la 19 membrana de la célula blanco. Seguido a la fusión, la nucleocápside del VIH es internalizada y el RNA viral se transcribe a DNA por la transcriptasa reversa. El DNA viral entonces se integra al genoma de la célula huésped formando un provirus. Este proceso se encuentra mediado por la enzima integrasa. Una vez integrado, el DNA viral se encuentra permanentemente asociado con el DNA de la célula huésped y éste es transmitido a las células hijas cuando la célula se divide. Mientras el provirus permanece en estado de latencia, los genes virales no se expresan y, por lo tanto, el virus es capaz de permanecer indetectable para el sistema inmune del huésped. (Kuby J., 1998). Figura 2. Ciclo Biológico del Virus de la Inmunodeficiencia Humana. 20 La activación proviral inicia la transcripción y los RNAs son transportados del núcleo al citoplasma donde serán traducidos o empaquetados, este último paso es regulado por la proteína rev. Conforme las proteínas virales comienzan a ensamblarse dentro de la célula huésped, la membrana plasmática de la célula huésped se modifica por la inserción de la gp41 y la gp120. Para que las proteínas gp120 y gp41 se inserten en la membrana citoplasmática de la célula huésped, durante la maduración, la gp120 debe ser liberada de los complejos que forma con el CD4 (el receptor celular por el cual el VIH tiene afinidad), el cual es coexpresado con la gp120 en el retículo endoplásmico rugoso, la proteína vpu asiste a este proceso por promover la degradación intracelular del CD4. La gp120 es transportada a la membrana citoplasmática donde nuevamente se previene que se una al CD4, debido a la endocitosis y degradación de este receptor promovida por nef. Es en este momento cuando el RNA viral y las proteínas nucleares son empaquetadas dentro de la membrana citoplasmática de la célula huésped. Conforme la partícula se completa y se libera de la pared celular cubierta con las proteínas gp120 y gp41, el virión alcanza un estado de maduración. (Frankel A. et al. 1998). 4. GLICOPROTEINA GP120. La gp120 es una glicoproteína de la superficie viral con un peso molecular de 120 KDa, la cual está compuesta por cinco regiones variables (V1-V5) y por cinco regiones constantes (C1-C5). Se denominan regiones constantes porque es posible identificarlas siempre con la misma secuencia de aminoácidos. En contraste, las regiones V1 a V5, como su nombre lo indica, presentan un alto grado de variabilidad en sus secuencias de aminoácidos. Las regiones constantes de la proteína forman un núcleo central mientras que las regiones variables con excepción de la V5 son agrupadas mediante puentes disulfuro y forman cuatro 21 asas. En la secuencia de estas asas se encuentran los sitios de reconocimiento para el receptor CD4 y los receptores de quimiocinas. (Poignard P. et al. 2001). El principal receptor celular para el VIH es el receptor CD4, proteína semejante a las inmunoglobulinas que se expresa principalmente en la superficie de los linfocitos T cooperadores y macrófagos primarios. La interacción del receptor CD4 con la gp120 no es suficiente para la entrada del VIH a la célula huésped. La unión de la gp120 con el receptor CD4 produce un cambio conformacional en la gp120, que permite que se exponga una región de su secuencia que se une al receptor de quimiocinas. La unión al receptor de quimiocinas adicionalmente expone a la gp41 facilitando la fusión membranal. Como puede inferirse, la gp120 es de gran relevancia para el proceso de acoplamiento a los receptores celulares, la fusión membranal y finalmente para la infección de la célula huésped. (Turner B. et al. 1999). 5. QUIMIOCINAS. La noción de que un co-receptor es requerido para que progrese la infección por VIH proviene de la observación de que la sola expresión del receptor CD4 no hace susceptibles a las células a la infección por VIH. El hallazgo de que los receptores CD4 recombinantes sólo pueden mediar la unión, la entrada y la infección del virus, sí y sólo sí, el receptor se encuentra expresado en un tipo celular humano. Esto llevó a suponer que la fusión se veía limitada por un cofactor en las células animales. Actualmente sabemos que no se trata de un cofactor, sino de un tipo particular de receptores cuyos ligandos endógenos son las quimiocinas. La primera descripción de estas moléculas data de 1977, cuando Walz, et al. describieron una proteína que era secretada por las plaquetas y que fue denominada factor 4 de las plaquetas. Esta pequeña proteína funcionaba como un 22 factor angiostático y procoagulante. En ese tiempo no se tenía conocimiento alguno sobre la función que podrían jugar sus receptores en la infección por el VIH. (Ashorn P. et al. 1990). Desde entonces, alrededor de 50 proteínas relacionadas con el factor 4 de plaquetas han sido descritas y reconocidas como una familia, la familia de las quimiocinas. Se escogió este nombre debido a que la mayoría de sus miembros son un factor quimiotáctico para los leucocitos y tienen actividad tipo citocina. Sin embargo, actualmente se reconoce su participación en una variedad de funciones que incluyen la angiogénesis, la angiostasis, el reclutamiento celular, la inflamación y el desarrollo del órgano linfoide, entre otras funciones. (Rossi D. et al. 2000). Las quimiocinas se encuentran constituidas por cadenas polipeptídicas simples de 70 a 100 aminoácidos y presentan entre 20 a 95% de homología entre sí. Estas moléculas poseen, además, un número de cisteínas conservadas que ayudan a identificar las moléculas relacionadas. El número de cisteínas conservadas y el número de residuos de aminoácidos entre ellas permite distinguir cuatro subfamilias principales. (Locati M. et al. 1999). En el caso de las quimiocinas o CXC y las ß quimiocinas o CC, éstas poseen cuatro cisteínas de las cuales dos se encuentran adyacentes en la N terminal (CC) o separadas por un aminoácido (CXC). Recientemente dos nuevas familias de quimiocinas han sido descritas. Estas nuevas quimiocinas no cumplen con el esquema general antes descrito para las otras subfamilias. De tal forma que las quimiocinas como la fractalina posee las cuatro cisteínas características de las quimiocinas; sin embargo, presenta tres aminoácidos separando a las cisteínas, por lo que se le reconoce como la familia CX3C. Otro caso particular es el de las quimiocinas como la linfoactina, cuya familia ha sido denominada sólo C, dado a 23 que ésta no posee las cuatro cisteínas características sino sólo dos de ellas, las cuales no se encuentran adyacentes una de la otra, sino ubicadas una en la Nterminal y la otra en el C-terminal. (Ward S. et al. 1998). 5.1 Los Receptores de Quimiocinas y el Tropismo Viral. Como se había revisado, el VIH infecta a la célula, por una fusión mediada por las glicoproteínas de la membrana viral (gp120) que se unen con alta afinidad al receptor CD4. Algunos estudios han mostrado que diferentes linajes del VIH infectan preferentemente distintos tipos celulares. Por ejemplo, algunos de ellos muestran una eficiente capacidad para infectar sobre líneas celulares del tipo T; sin embargo, dicha capacidad sobre macrófagos es muy pobre. Estos virus generalmente forman sincicios (la fusión entre la gp120 de las células infectadas y el receptor CD4 de las células sanas formando una célula gigante multinucleada en la que se funden hasta 500 células T CD4) y se han designado como trópicos de la línea celular T (T trópicos). (Gabuzda D. et al. 1998). En tanto otros linajes del VIH muestran la preferencia opuesta infectando más eficientemente a los macrófagos que a las células T, este tipo de linajes han sido designados macrófagos trópicos (M-trópicos) o no inductores de sincicios. Varios miembros de la familia de receptores de quimiocinas son usados por el VIH junto con el CD4 para entrar a la célula blanco. Los VIH M-trópicos usan predominantemente el receptor de quimiocinas CCR5 como co-receptor, mientras que los VIH T-trópicos usan como co-receptor al CXCR4 (anteriormente llamado fusina). El receptor CCR3 también puede ser utilizado como co-receptor por los virus M-trópicos. El uso de los receptores CCR3 y CCR5 por el VIH para infectar a la microglia hace más eficiente la infección de estas células por los virus Mtrópicos en comparación con los macrófagos-monocíticos residentes en sangre quienes sólo poseen el receptor CCR5. (He J. et al. 1997). 24 A nivel molecular la codificación que determina el tropismo del VIH, así como su eficiencia para la replicación, se encuentra en el gen env. Esta codificación se expresa particularmente en los aminoácidos de la región variable 3 (V3) de la gp120. Algunos aminoácidos en las regiones V1 y V2 de la gp120 y otros de la gp41, que también influyen en el carácter M-trópico. (Donaldson Y. et al. 1994). Es importante notar que en las etapas tempranas de la infección predominan las variantes de VIH M-trópico. Sin embargo, aproximadamente la mitad de aquellos individuos que desarrollan el SIDA muestran un cambio en su fenotipo viral a una forma de virus citopático de eficiente replicación (rápida y alta) del tipo T-trópico. Este cambio en el fenotipo se ha reportado que precede a una acelerada pérdida de linfocitos CD4. (Connor R. et al. 1993). Estos resultados son apoyados por Connor, et al. quienes a través de aislamientos secuenciales en tres pacientes muestran que el VIH utiliza casi exclusivamente al receptor CCR5 en los primeros estadios de la infección. Sin embargo, el virus amplía su uso de receptores para incluir el CCR3, CCR2 y finalmente el CXCR4 durante el progreso de la enfermedad. La habilidad para utilizar el CXCR4 como co-receptor solamente fue observada con virus cuyo fenotipo era del tipo inductor de sincicios y cuya aparición correlacionó con una súbita disminución de células T CD4, así como con la aparición de un deterioro clínico notable. (Connor R. et al. 1997). 25 Figura 3. Interacción entre la Envoltura Viral, la Proteína CD4 y los Co-receptores CXCR4 y CCR5. 5.2 Las Vías de Señalización Interna. Poco se ha estudiado sobre las vías de señalización interna asociada a la estimulación de los receptores de quimiocinas. Actualmente se conoce que los estímulos quimiotácticos inician la respuesta en la célula al unirse a receptores acoplados a proteínas G sensibles a la inhibición por toxina pertusis, sugiriendo que las proteínas asociadas son del tipo Gi o Go. El resultado de la unión ligando-receptor produce la disociación de la proteína G en las subunidades α y ß. La subunidad ß activa a la fosfolipasa C (PLC)-ß y a la fosfatidilinositol 3-OH cinasa (PI3K). La PLC rompe el fosfatidilinositol (4,5) bifosfato [PI(4,5)P2] en inositol (1,4,5) trifosfato [Ins(1,4,5)P3] y diacilglicerol (DAG). El inositol trifosfato produce la liberación de Ca2+ de pozas intracelulares y el diacilglicerol junto con el Ca2+ activan varias isoformas de la proteína cinasa C (PKC). (Baggiolini M., 2000). 26 Así mismo, se ha reportado que la MIP (Proteína Inflamatoria de macrófago) una ß quimiocina, así como la gp120 activan varias tirosinas cinasas. Sin embargo, hasta el momento se desconocen los pasos que preceden a la actividad de estas cinasas. A pesar de que se ha descrito de manera consistente la activación de vías de transducción intracelular que incluyen la activación de las MAP cinasas (MAPK), aún no se conoce con certeza la vía que es activada por la gp120 del virus. (Ganju R. et al. 1998). La descripción detallada de estas vías resulta relevante para el estudio de la demencia asociada al SIDA debido a que varias de ellas se han relacionado tanto con la muerte celular como con la liberación de factores tróficos indispensables para la diferenciación, migración y supervivencia celular. Así mismo, tanto la MAPK como la PKC son mensajeros importantes en procesos tales como el aprendizaje, la memoria y la expresión del sueño de movimientos oculares rápidos (MOR). (Lannuzel A. et al. 1997). La proteína gp120 de la envoltura tiene una estructura secundaria compleja estabilizada por enlaces disulfuro entre residuos conservados de cisteína. Se concentra una extensa variabilidad en 5 áreas discretas del gp120 denominadas V1 a V5, las cuales se encuentran esparcidas entre 5 regiones conservadas, denominadas C1 a C5. (Willey RL. et al. 1989). La región V3 es la tercera área variable de la proteína gp120, formada por un puente disulfuro entre los residuos de Cis 301 y 336. (LaRosa GJ. et al. 1990). Aunque la mayoría de los aminoácidos de la región V3 son variables entre las diferentes cepas del VIH-1, la secuencia Gli - Pro - G l i - Arg en la punta de la región se ha visto altamente conservada entre casos aislados de Europa y Norte América. Varios estudios también han demostrado que el área neutralizante 27 principal (PND) del VIH-1 se encuentra dentro de región V3. Esta región en la punta, altamente conservada, forma un sitio de unión para anticuerpos que pueden inhibir la fusión del VIH-1 con las células y por lo tanto bloquear la infección por el VIH-1. La región V3 ha sido identificada como un área de fusión, y un anticuerpo anti-V3 por sí solo puede prevenir la infección in vitro. Además un anticuerpo anti-V3 pudo proveer protección en 2 chimpancés infectados por el VIH-1. La región V3 también regula el tropismo de las células blanco CD4 positivas y negativas. La selectividad de las cepas del VIH-1 para los diferentes tipos celulares es regulada por interacciones virales entre los receptores celulares y la envoltura viral. (Foley B. et al. 1995). Los virus con tropismo de células T tienden a tener más residuos con cargas positivas, particularmente en ciertas posiciones de la región V3, mientras que los virus con tropismo de macrófagos tienden a tener residuos negativamente cargados en la región V3, incluyendo la tal llamada secuencia consenso V3. (Trujillo JR. et al. 1996). De manera adicional, el VIH-1 también infecta células que no expresan CD4, como las células gliales del cerebro, células neuronales y de la retina, células endoteliales de los capilares cerebrales, fibroblastos de la piel humana, líneas celulares fibroblastoides derivadas de músculo y hueso, células trofoblásticas humanas, células dendríticas foliculares, células epiteliales colónicas, células adrenales fetales, y células carcinomatosas del hígado humano. Se ha descubierto que los virus con tropismo de células T con residuos de cargas positivas en la región V3, parecen regular el tropismo de las neuronas CD4 negativas y de las células epiteliales colónicas. (Trujillo JR. et al. 2000). 28 6. PATOGENIA DE LA INFECCION. La infección por VIH afecta en forma predominante al sistema inmunitario y al cerebro. La característica inmunitaria dominante es la reducción progresiva de la subpoblación CD4 de los linfocitos T, por lo que se invierte la proporción normal CD4:CD8 y en forma inexorable causa inmunodeficiencia. La reducción en los linfocitos CD4 se debe principalmente al tropismo del VIH por estas y otras células que portan CD4, por que la superficie molecular de las células CD4 funciona como receptor para el virus. Los linfocitos CD4 son necesarios para el funcionamiento apropiado del sistema inmunitario. Interactúan con las células presentadoras de antígeno, células B, células T citotóxicas y las células asesinas naturales (NK). Otras células susceptibles a la infección por VIH incluyen monocitos, macrófagos, células microgliales, células de Langerhans y otras células de la medula ósea y células B inmortales. Otras moléculas incluyen los receptores de Fc, receptores de complemento y receptores para galactosil ceramida, los cuales pueden actuar como receptores accesorios para VIH sobre algunos tipos celulares, por ejemplo macrófagos, fibroblastos, astrocitos cerebrales y oligodendrocitos. (Rugeles M. y col. 2004). La pérdida de linfocitos CD4, que es una característica de la infección por VIH, ocurre principalmente como resultado de apoptosis o muerte celular programada. Otros mecanismos que contribuyen a la muerte de células T CD4 no infectadas incluyen la fusión celular con células infectadas con VIH, desarrollo de poros en la membrana celular de los linfocitos infectados conforme los virus de VIH protruyen a través de la superficie celular, la acumulación de DNA viral no integrado en el citoplasma celular y la destrucción de células CD4 no infectadas las cuales se han encontrado sin glicoproteína gp120 de la cubierta de VIH, así como células infectadas con VIH que expresan gp120 a través de clones de linfocitos citotóxicos específicos para gp120. 29 Los linfocitos T activados que expresan CD4, y que se han infectado con VIH son los causantes de la presencia de casi 99% del RNA de VIH en el plasma. Una vez que se desarrollan los linfocitos T citotóxicos y otras respuestas inmunitarias, la carga viral se reduce. Casi nueve meses después de la infección se obtiene un equilibrio entre la respuesta inmunitaria del huésped y el virus; esto se refleja por una concentración plasmática relativamente estable de RNA de VIH, a lo cual se le conoce como punto de equilibrio virológico. Un punto de equilibrio elevado se relaciona con un pronóstico malo y viceversa. La replicación del VIH en los monocitos y macrófagos ocurre con lentitud en comparación a lo que sucede en los linfocitos, con poca respuesta citopatológica. Diversos factores intracelulares y virales pueden influir en la producción de VIH, estos incluyen proteína NFkB que se une a DNA, citocinas como factor de necrosis tumoral α (TNFα), el factor estimulante de colonias de granulocitos monocitos (GM-CSF) y el factor estimulante de colonias de monocitos (M-CSF), con los cuales se ha encontrado que aumenta la replicación de VIH. (Rugeles M. y col. 2004). 6.1 Infección Primaria. Entre los 5 y 11 días después de la infección aumentan los títulos del virus, con niveles de viremia cercanos a 107 copias del RNA viral por mililitro de plasma y con un gran número de células infectadas, lo que refleja la diseminación sistémica del VIH. Luego se detecta una respuesta inmune celular y humoral específica que disminuye el nivel de virus en sangre y el número de células mononucleares de sangre periférica infectadas. El 50-90% de los pacientes infectados con VIH-1 experimenta un síndrome clínico de severidad variable llamado síndrome 30 retroviral agudo, similar a la mononucleosis infecciosa, caracterizado por fiebre, brote y adenopatías, que ocurre entre 2 a 6 semanas después de la infección. Al contacto con el virus, las primeras células en ser infectadas en el tracto genital son los macrófagos y las Células Dendríticas (CD); estas últimas transportan el virus al tejido linfoide regional donde los LT CD4+ activados se infectan. (Rugeles M. y col. 2004). 6.1.1 Inmunidad Celular. La replicación viral durante la infección primaria produce una activación de la repuesta inmune celular caracterizada por un aumento en el número de los LT CD8 activados y por una activación de los LT CD4+. Los LT CD4+ ayudadores, específicos de antígeno, son activados por moléculas del Complejo Mayor de Histocompatibilidad de Clase II (CMH – II) que presentan epítopes proteicos del VIH-1, lo que estimula la secreción de citocinas, aumenta la respuesta de LT citotóxicos específicos y la respuesta humoral, y promueve la integración y la replicación del VIH-1, gracias al efecto de la IL-2. (Rugeles M. y col. 2004). 6.1.2 Inmunidad Humoral. La neutralización del VIH ocurre después de la unión del virus a la célula y se da porque el anticuerpo interfiere entre los enlaces de la gp120 con el receptor celular. Los anticuerpos que unen células NK y monocitos por medio del receptor Fc pueden mediar potencialmente la muerte de células infectadas que expresan gp120 en su superficie, y así contribuir a la eliminación del virus. A pesar que la inmunidad humoral tiene un papel esencial en el control de muchas infecciones vírales, además de ser fundamental para la prevención de futuras reinfecciones, la información acumulada sugiere que este no es el caso para el VIH-1, básicamente por dos razones: la primera es que la mayoría de los anticuerpos que se producen a lo largo de toda la infección no son neutralizantes, y la segunda y tal vez la más importante, es que los anticuerpos que se generan 31 están dirigidos contra epítopes ubicados en la envoltura viral, los cuales presentan una variación constante. Las mutaciones puntuales producen cambios conformacionales que alteran el patrón de glicosilación de la proteína de envoltura, impidiendo que se de una correcta interacción entre el nuevo epítope viral y los anticuerpos preformados, facilitando la evasión de la respuesta inmune. (Rugeles M. y col. 2004). 6.2 Periodo de Latencia. La segunda fase de la infección por VIH-1 es un período asintomático entre la infección primaria y el SIDA y su duración es bastante variable. Como resultado de la respuesta inmune, especialmente la celular, disminuye la viremia, lo que coincide con un período de latencia, durante el cual no se presenta sintomatología asociada a la infección por VIH en el paciente infectado. La carga viral que permanece relativamente estable durante este período predice el tipo de evolución; con menos de 1000 copias por mililitro de sangre, el período de latencia podrá ser más de 10 años, con menos de 200 copias puede no aparecer la enfermedad y aquellos con más de 100000 copias la pérdida de LT CD4+ es rápida y progresiva lo que lleva a que se desarrolle SIDA rápidamente. Durante este período hay una hiperactivación de todas las células del sistema inmune, una producción aumentada de IgG e IgM y los niveles de citocinas en plasma se encuentran elevados; con la progresión de la enfermedad aumentan las concentraciones de TNFα, IL-4 e IL-10. La activación crónica de la vía de señalización del TNFα lleva a un aumento en la transcripción del VIH-1, a una inducción de la apoptosis de células mononucleares y a una supresión de la hematopoyesis. La gp120 es la responsable de inducir en forma directa la secreción de esta citocina por mononucleares. (Rugeles M. y col. 2004). 32 6.3 Reservorios Celulares. Una de las razones por las cuales el virus no es erradicado, a pesar de la fuerte respuesta inmune celular y humoral, es la gran cantidad de reservorios celulares que se establecen durante la infección primaria y en el período de latencia. Este sello característico de la infección por el VIH, se presenta gracias a dos razones esenciales: al ciclo viral complejo, que permite la integración del genoma viral al material genético celular y la amplia distribución de receptores y co-receptores naturales del VIH, que llevan a que la infección no solo de LT CD4+ sino que también afecta diferentes células. El VIH parece haberse adaptado a las características biológicas particulares de estas células, lo cual le permite distribuirse en diferentes tejidos, en diferentes estadíos replicativos, y de esta manera le permite persistir a pesar de la fuerte presión ejercida por la respuesta inmune del hospedero o de la terapia. (Rugeles M. y col. 2004). Desde etapas tempranas de la infección se detecta el VIH en las células del SNC, lo cual constituye un enorme obstáculo para las terapias farmacológicas actuales, gracias a que no penetran eficientemente este sistema. El VIH ingresa a este compartimento anatómico por infección directa de células endoteliales de la barrera hematoencefálica o a la penetración de monocitos circulantes infectados al SNC; una vez allí, las principales células infectadas son la microglia. (Rugeles M. y col. 2004). El reservorio de CD es el menos caracterizado, desde hace ya varios años se conoce que grandes cantidades de virus son capturados por CD, mediante diferentes mecanismos de internalización. (Rugeles M. y col. 2004). 33 6.4 Síndrome de InmunoDeficiencia Adquirida. Después del período de latencia clínica llega un momento en que la respuesta inmune pierde el control total de la replicación viral y se desarrolla el SIDA, que es la fase final de la infección por VIH, la cual se caracteriza por un estado de inmunosupresión profundo. Cuando el número de LT CD4+ alcanza niveles menores a 200 células/ml, los títulos del virus aumentan rápidamente y comienzan a ocurrir las infecciones oportunistas. La disminución de los LT CD4+ puede ocurrir como efecto directo o indirecto de la infección viral. La destrucción directa puede ser producto de la replicación del virus dentro de la célula, ya que hay acumulación del DNA viral no integrado y del RNA viral en el citoplasma, lo cual interfiere con el procesamiento del RNA celular normal. También ocurre por la alta concentración intra y extracelular de gp120, inmunógeno potente que activa macrófagos y linfocitos, induce la secreción de citocinas proinflamatorias e interactúa con moléculas intracelulares de CD4, induciendo la muerte celular por daño de la membrana plasmática por autofusión. (Rugeles M. y col. 2004). La disminución indirecta de los LT CD4+ causada por la infección por VIH, se debe a una disminución en la proliferación y diferenciación de los LT, disminución en la producción de IL-2 y disminución en la expresión del receptor de IL-2. Adicionalmente, diversos estudios han demostrado un incremento de la apoptosis de LT CD4+ y CD8+ en individuos infectados, incluso en células no infectadas. Esto ocurre predominantemente en linfocitos no infectados que se encuentran en cercanía de células infectadas por VIH en los ganglios linfáticos de estos individuos. La muerte de células no infectadas se puede dar por una secreción aumentada de citocinas como TNFα y TGFβ y de la proteína soluble Tat, secretada por las células infectadas; estas moléculas, tienen la capacidad de 34 inducir apoptosis de células no infectadas. La proteína viral nef induce la expresión de FasL en células infectadas, que pueden unir al receptor Fas en células no infectadas e inducir la cascada de caspasas que median la muerte celular programada. (Rugeles M. y col. 2004). 7. CÉLULAS DENDRÍTICAS. Las Células Dendríticas (CD) comprenden una familia variable de tipos de células cuya función principal es la de ser células presentadoras de antígeno (CPA), son células que están encargadas de identificar a los antígenos para iniciar una posterior presentación a los linfocitos T CD4+ y producir una respuesta inmune específica contra el. En general son cuatro sus actividades principales: 1) Captar antígenos ajenos (a través de macropinocitosis, pinocitosis, fagocitosis, internalización por medio de receptores de manosa, etc), y reconocer a los propios. 2) Procesar los antígenos en péptidos para ser asociados con el complejo mayor de histocompatibilidad (CMH) en su superficie. 3) Presentar estos antígenos a células T. 4) Activar la respuesta inmune, lo cual es llevado principalmente, pero no exclusivamente, en la región paracortical de los nódulos linfáticos. (Banchereau J. et al. 2000). Dada su participación central en el control de la inmunidad, las CD son dianas de muchas situaciones clínicas que envuelven a las células T como lo son: transplantes, enfermedades autoinmunes, enfermedades infecciosas, tumores, alergias e inmunodeficiencias. (Banchereau J. et al. 1998). 35 Se encuentran en órganos linfoides y no linfoides, también circulantes en linfa aferente, sangre periférica, mucosas epiteliales las cuales, en su mayoría, están expuestas al medio ambiente con diferentes nombres según su ubicación, pero guardando características y funciones similares entre sí. En órganos linfoides, se les encuentra en las regiones T dependientes de los ganglios linfáticos (zona paracortical) y bazo (zona periarteriolar) donde se les conoce como células interdigitantes. Mientras en órganos no linfoides, las Células Langerhans (CL) son las CD mejor caracterizadas. Por otro lado, en sangre periférica estas células son escasas, ya que representan menos del 2% de las células mononucleares. (Klinkert ME., 1990). Las CD poseen un origen común en médula ósea, generándose por diferenciación bajo ciertos estímulos. Se ha identificado dos subpoblaciones de CD en sangre periférica, las células dendríticas plasmocitoides (CDP) también conocidas como linfoides CD123+ ó células productoras de INFα tipo 1. Y las células dendríticas mieloides (CDM) también conocidas como CD11+, las cuales representan una población heterogénea, la mayoría son CDM1 (capaces de diferenciarse en células de Langerhans) y las CDM2 (carecen de esta capacidad). (Ito T. et al. 1999). Figura 4. Origen y Subpoblaciones de las Células Dendríticas. 36 7.1 Participación de las Células Dendríticas en la Infección por VIH-1. Dentro de la clasificación de las CD, las CL son las principales CPA de la piel (epitelios planos estratificados), como tales cumplen un papel fundamental en la captación de antígenos que penetran a través de la piel como es el caso de algunos virus, en el SIDA, se ha demostrado la presencia de CD conteniendo antígeno viral en biopsias de piel de pacientes infectados. La vagina, cuello uterino, ano y cavidad oral son ricos en CD, lo que constituye, la puerta de entrada para la infección viral. Las CL infectadas migran al tejido conectivo dérmico y presentan el virus a los linfocitos T CD4+ y de allí pasan a ganglios linfáticos. Ellas son capaces de retener largo tiempo el virus, siendo por lo tanto, un reservorio del mismo. (Zambruno G. et al. 1995). Las CD del centro germinativo de los ganglios linfáticos captan al virus circulante los cuales quedan atrapados en la superficie de las mismas, así mismo los linfocitos T CD4+ que transitan a través del tejido linfático son infectados y mueren; para que finalmente el virus liberado se una a anticuerpos específicos y sea recapturado por las CD. También hay virus internalizado en las mismas, permaneciendo en forma latente por largo tiempo, sin embargo, por efecto citopático del virus las CD pueden morir, lo que aumentaría el virus circulante. Estos acontecimientos están asociados a una destrucción de los centros germinativos y a la aparición de infecciones oportunistas. (Lipscomb M. et al. 2002). Uno de los principales procesos patológicos en los cuales las CD están involucradas, es en el proceso de exposición que lleva al virus a la infección primaria del tejido linfoide. Como se ha mencionado, las CD participan en los primeros contingentes de la respuesta inmune contra antígenos, esta es la principal, si no es que la única CPA que se involucra en la respuesta inmune primaria de células T, lo cual ha llevado a revelar su importancia en la infección 37 inicial del VIH-1, en donde el virus entra a la membrana mucosa e interactúa con CD resultando la unión del virus a la células con ó sin infección de estas. La célula entonces migra a la región paracortical del tejido linfoide donde el virus es liberado, comenzando la infección, replicación y expansión del virus en células T CD4+. (Fox CH. et al. 1992). Es conocido que en el SIDA, el sistema inmunológico puede responder de dos formas: por un lado hay una persistente estimulación con adenopatía generalizada, activación de CD8+ y producción de anticuerpos. Y por otra parte, puede haber una importante depleción de CD4+ y el desarrollo de inmunodeficiencia; En ambos procesos, las CD pueden estar involucradas. Las CD humanas, infectadas con bajas dosis de VIH-1 estimulan la proliferación de linfocitos T citotóxicos, y por lo tanto generan una inmunidad protectora contra el virus. Si son infectadas con altas dosis de virus, in vivo o in vitro, fallan en la respuesta estimulante de células T. Por otro lado, la función de las CD puede ser restaurada por el tratamiento con antirretrovirales, estudios realizados en pacientes tratados con Zidovudina muestran que estas células pueden actuar como efectoras o protectoras dependiendo de la dosis de infección. Además, si las CD de pacientes infectados son enfrentadas a linfocitos T citotóxicos de individuos sanos, se produce una respuesta inmune específica contra los péptidos virales; este sistema puede ser utilizado para identificar potenciales inmunógenos para el desarrollo de una vacuna contra VIH-1. (Soilleux E. et al. 2000). En 1992, los investigadores en el Instituto de Investigación Farmacéutica BristolMyers Squibb describieron una glicoproteína en la superficie del tejido placentario humano, que se une a la proteína gp120 de la cubierta del VIH-1. En estudios posteriores, Geijtenbeek y cols., identificaron y redescubrieron en la superficie de las CD inmaduras una proteína receptora que normalmente permite que estas células se unan a los linfocitos T CD4+. Las moléculas estudiadas tanto, por 38 Geijtenbeek como por los investigadores en el Instituto de Investigación Farmacéutica Bristol-Myers Squibb, resultaron ser idénticas. Dicho receptor fue denominado DC-SIGN (del ingles; dendritic cell-specific ICAM-3-grabbing nonintegrin), la cual es una proteína de membrana tipo-II con un dominio extracelular de lectina tipo C (lectina Ca+ dependiente). (Geijtenbeek T. et al. 2000). 7.2 Interacción Célula Dendrítica - VIH-1: DC SIGN. El DC-SIGN es una proteína integral de membrana tipo II de 404 aminoácidos con un extremo carboxilo terminal. Las primeras secuencias revelan que la proteína está organizada en cuatro dominios distintos, un dominio citoplasmático Nterminal, un dominio transmembranal hidrofóbico, una región a-helicoidal y un carbohidrato carboxilo terminal como dominio de reconocimiento. (Gurney Su. et al. 2003). DC-SIGN es expresado solo por células dendríticas localizadas en sitios de exposición a antígenos como tejidos mucosos del intestino (duodeno y colon), vesícula biliar, cérvix, vagina, endometrio, bronquios pulmonares, esófago y mucosa bucal, además de sangre periférica. Todas las lectinas calcio dependiente son proteínas de membrana que actúan como receptores de adhesión a la célula y están involucrados en regulación de las vías de señalización, además de reconocer estructuras específicas de carbohidratos presentes en patógenos. Esta proteína de membrana, funciona como receptor de muchos virus, como el virus del Ébola, citomegalovirus (CMV), virus de hepatitis C (VHC), dengue entre otros; además de bacterias, levaduras y otros parásitos. (Van K. et al. 2003). 39 Figura 5. Estructura del DC-SIGN. El DC-SIGN tiene como función mediar en la unión de las células T con las CD a través de moléculas de adhesión (ICAM-3, moléculas de adhesión intercelular - 3); Además, DC-SIGN también regula la migración trans-endotelial de las células dendríticas, a través del ICAM-2 (moléculas de adhesión intercelular-2), desde el endotelio vascular hasta el tejido linfoide. Se ha encontrado que anticuerpos contra DC-SIGN son capaces de inhibir la migración de las CD y la proliferación de las células T inducida por las CD. Se unen a los lentivirus de primates y humanos; y su expresión afecta de forma importante a la adherencia del virus y a las funciones de transmisión. Por otro lado, existe un receptor homologo del DCSIGN, llamado DC-SIGNR (del ingles, DC-SIGN related) que se expresa en las células endoteliales de los sinusoides de los ganglios linfáticos, sinusoides hepáticos y de las vellosidades placentarias, por lo que se puede especular que tal vez tendría eficacia en evitar la transmisión vertical del VIH-1 y en presentar el virus a los linfocitos TCD4+ en los ganglios linfáticos. (Engering A. et al. 2002). 40 Figura 6. Interacción Célula Dendrítica – Virus de Inmunodeficiencia Humana 1 Al participar en la unión entre las CD y las células T, el DC-SIGN también interviene en la unión entre las células dendríticas y la glicoproteína gp120 del VIH-1, aunque no participa en la entrada del VIH-1 en la célula. El virus utiliza a las CD para que estas lo transporten al tejido linfático y lo presenten a las células T, y de esta forma la DC-SIGN incrementa la infección por VIH-1 de las células T activadas. (Weissman D. et al. 1997). 8. INMUNOPATOGENESIS. A pesar de la inmunosupresión producida por el HIV, en el paciente infectado se generan diversas respuestas inmunológicas específicas que pueden contribuir al largo período asintomático que caracteriza esta infección, manteniendo al virus inhibido. El estudio de la inmunopatogenia de la infección por el VIH no sólo es trascendente para el conocimiento de los mecanismos de esta enfermedad, sino 41 que puede ofrecer alternativas terapéuticas inmunológicas o llevar al desarrollo de una vacuna eficaz. (Sereti et al. 2001). 8.1 Alteraciones de los Linfocitos T. Las alteraciones que se observan en los linfocitos T durante la infección por el VIH son tanto cualitativas como cuantitativas. Las alteraciones cualitativas se hacen aparentes tras la primoinfección y antes de que el descenso de linfocitos T sea evidente. Los estudios sobre linfocitos T de pacientes seropositivos han mostrado un trastorno en el reconocimiento de antígenos solubles (por ejemplo, toxoide tetánico), aunque estas células aún responden a mitógenos como la fitohemaglutinina. Estos estudios también indican que la alteración central se produce en la función de las células colaboradoras y no se debe a una hiperfunción de las células supresoras. Otras anomalías observadas en la infección por el VIH consisten en el descenso de la producción de linfocinas, la disminución en la expresión de los receptores de Interleuquina 2 (IL-2), la disminución de la alorreactividad y la reducción de la capacidad para estimular los linfocitos B. Las alteraciones funcionales de los linfocitos T contribuyen también, probablemente, a la anergia cutánea que se aprecia con la evolución de la enfermedad. (Richman D. et al. 1994). Las alteraciones cuantitativas son el resultado de la depleción progresiva de la subpoblación de linfocitos T colaboradores CD4+, que tras la primoinfección, y de forma paulatina, de cifras normales entre 800 y 1200 células/mm3 alcanzan cifras de 50 o menos durante el curso de la infección. La depleción de las células CD4 no puede atribuirse exclusivamente al efecto citotóxico directo del virus, pues sólo una minoría de estas células se encuentran infectadas incluso en fases avanzadas de la infección. Otros factores que pueden contribuir a la depleción de linfocitos CD4 son los siguientes: 42 a) La formación de sincitios, en que una célula infectada se fusiona por medio de sus glicoproteínas de superficie gp120 con moléculas CD4 de células no infectadas, formando células gigantes multinucleadas. b) Receptor inocente de células CD4 no infectadas que han fijado en sus receptores gp120 libres, volviéndolas vulnerables al ataque inmunitario. c) Infección por el VIH de las células pluripotenciales medulares o depleción tímica producida por el VIH, que da lugar a un descenso de la producción de linfocitos CD4+. d) Mecanismos autoinmunes, en virtud de los cuales anticuerpos con reactividad cruzada o la respuesta inmunitaria celular contra el virus producen la destrucción de células no infectadas. e) Efecto de superantígeno, en que ciertas proteínas víricas producirían la estimulación, y depleción última, de linfocitos T con receptores específicos. f) Apoptosis, en que el virus o sus productos provocaría la muerte celular programada. (Michael N. et al. 1997). Independientemente de los mecanismos de la depleción de los linfocitos CD4, la alteración de la función inmunitaria es tan pronunciada que la cifra total de linfocitos TCD4+ es un factor pronóstico importante de la progresión de la enfermedad. El riesgo de algunas infecciones oportunistas aumenta significativamente cuando la cifra de linfocitos CD4 desciende por debajo de 200/mm3. (Smith M. et al. 1997). Por último, los linfocitos también representan un importante reservorio para la infección persistente. En una persona infectada, se estima que aproximadamente 106 linfocitos CD4 contienen provirus integrado en el genoma de forma latente, susceptible de replicación completa si la célula se activa. Puesto que estas células no expresan proteínas víricas hasta que se activan, el provirus permanece escondido para el sistema inmunológico y no será sensible a los fármacos que inhiben la replicación viral, lo cual representa un obstáculo insalvable para la 43 erradicación del virus. Varios modelos han definido que los linfocitos CD4+ presentan un recambio (turnover) muy elevado desde el inicio de la infección que va a condicionar paulatinamente su descenso en sangre periférica. Estos modelos son la base para el inicio precoz del tratamiento antirretroviral. (Simmons G. et al. 1997). 8.2 Alteraciones de los Linfocitos B. Las alteraciones que se producen en los linfocitos B son también cualitativas y cuantitativas. En las fases precoces de la infección, la alteración más característica consiste en la activación policlonal de los linfocitos B, que clínicamente se traduce en concentraciones elevadas de IgG e IgA, en la presencia de inmunocomplejos circulantes y en un número elevado de linfocitos B en la sangre periférica que segregan inmunoglobulinas espontáneamente. Estas alteraciones no parecen deberse al efecto directo del virus. Aunque las células B pueden expresar escasamente el receptor CD4 y han sido infectadas in vitro, no existen datos concluyentes de que estas células se infecten in vivo. Por tanto, el virus o sus productos deben interaccionar con los linfocitos B no infectados para estimularlos. Otros factores que pueden contribuir a esta estimulación policlonal pueden ser la infección concomitante por otros virus, tales como el citomegalovirus o el virus de Epstein-Barr. Las alteraciones funcionales de los linfocitos B consisten principalmente en la afectación de la producción de anticuerpos ante estímulos antigénicos, que puede estar mediada por la hipofunción de los linfocitos T colaboradores. La vulnerabilidad de los enfermos infectados a padecer infecciones piógenas y la falta de respuesta a la inmunización que muestran estos individuos puede deberse a la alteración de la inmunidad humoral. (Fortin J. et al. 1998). 44 8.3 Alteraciones de los Monocitos/Macrófagos. El VIH infecta células de linaje monocito/macrófago que expresan el receptor CD4 y la molécula co-receptora CCR5. Sin embargo, sólo una minoría de estas células muestra infección productiva in vivo, por lo que la hipofunción de los linfocitos T colaboradores puede contribuir también a las alteraciones observadas en los macrófagos. Asimismo, el VIH infecta y se replica en células progenitoras medulares de la estirpe monocito/macrófago, fenómeno que puede contribuir a la pancitopenia que se observa en muchos de los pacientes seropositivos. Los macrófagos, al contrario que los linfocitos CD4+, son relativamente resistentes al efecto citopático del virus y pueden constituir un reservorio para la persistencia de la infección. Los macrófagos, por otro lado, pueden diseminar la infección por el VIH al sistema nervioso central, atravesando la barrera hematoencefálica. (Lee B. et al. 2001). La capacidad de los macrófagos como célula presentadora de antígenos se ve afectada, en particular, en las fases avanzadas de la enfermedad. Esta alteración puede traducirse en una incapacidad para establecer una respuesta inmunitaria adecuada tanto frente al VIH como a otros patógenos. Estas anomalías parecen deberse a la activación crónica in vivo de los macrófagos, ya sea por viriones completos, proteínas víricas o linfocinas. Por este motivo, puede observarse en pacientes con SIDA una expresión aumentada del receptor de IL-2 e IL-1. (Bobardt M. et al. 2003). 8.4 Otras Alteraciones. Las células natural killer (NK) constituyen un componente esencial en la vigilancia inmunológica contra las células infectadas por virus, las células alogénicas y las células tumorales. Las células NK son linfocitos granulares grandes que 45 reconocen antígenos en las células, con la posterior lisis de estas células. Las células NK son normales en número y desde el punto de vista fenotípico, pero defectivas desde el punto de vista funcional, por lo que no destruyen las células diana. La aparición de fenómenos autoinmunes forma parte del disturbio inmunológico que se produce en los enfermos infectados por el VIH. En la mayoría de los pacientes seropositivos pueden detectarse inmunocomplejos circulantes. Algunas de las manifestaciones clínicas que aparecen en estos enfermos pueden deberse a estos fenómenos. (Rosenberg Z. et al. 1991). 8.5 Anticuerpos Neutralizantes. En diversas infecciones víricas, los anticuerpos neutralizantes producidos por inmunización protegen al individuo frente a posteriores infecciones. El VIH induce la producción de anticuerpos por parte de los linfocitos B frente a las proteínas víricas, y algunos de estos anticuerpos tienen capacidad neutralizante del virus. La respuesta de anticuerpos se observa típicamente entre el mes y los tres meses posteriores a la primoinfección, aunque en circunstancias excepcionales puede tardar más tiempo en desarrollarse. Estos anticuerpos neutralizan directamente el virus libre antes de que penetre en la célula y pierda su envoltura. La diana primaria de los anticuerpos neutralizantes son las glicoproteínas de la envoltura, en particular una estructura en asa dentro de una región relativamente hipervariable de la glicoproteína gp120 denominada "dominio principal de neutralización" (V3 loop), así como frente a epitopos de la región implicada en la fijación al receptor CD4. (Meyaard L. et al. 1994). Los anticuerpos neutralizantes se encuentran presentes durante toda la infección por el VIH y, aunque los títulos son generalmente más bajos en las fases avanzadas de la infección, no ha podido demostrarse una correlación entre los títulos de anticuerpos neutralizantes y la progresión de la enfermedad. Por otro lado, estudios detallados de la primoinfección han puesto de manifiesto que los 46 anticuerpos capaces de neutralizar cepas infectivas del virus aparecen con posterioridad al aclaramiento de la viremia, sugiriendo que otros mecanismos inmunológicos deben ser operativos para el control inicial del virus. Además, se ha demostrado que los anticuerpos de personas infectadas en un momento dado tienen una capacidad neutralizante escasa frente a cepas infectivas del VIH, aunque pueden neutralizar cepas de virus in vitro. Algunos estudios en animales han revelado que los anticuerpos neutralizantes pueden proteger frente a la inoculación del virus, pero estos experimentos se han realizado en situaciones ideales en que se conseguían títulos altos de anticuerpos previamente a la inoculación intravenosa o mucosa del virus (generalmente, con un inóculo bajo). Por tanto, se desconoce si la inducción aislada de anticuerpos neutralizantes puede conferir protección frente a la infección natural por el VIH, pero indudablemente puede ser un tema trascendente para el futuro desarrollo de vacunas. En este sentido, son especialmente relevantes los hallazgos de una investigación reciente, que han puesto de manifiesto que los anticuerpos neutralizantes naturales frente a la proteína gp120 se fijan, en su mayoría, a una región especialmente flexible de esta estructura, por lo que no consiguen "neutralizar" al virus antes de su penetración en la célula. Sólo aquellos anticuerpos que se fijaran de manera estable a la glicoproteína gp120 impedirían la fijación de la misma a su receptor celular. (Oyaizu N. et al. 1995). La capacidad de los anticuerpos neutralizantes para conferir protección frente a la infección por el VIH puede verse afectada, en parte, por el alto grado de variación antigénica que muestra este virus. Esta variación antigénica es particularmente pronunciada en el caso de la gp120, pudiendo aparecer en un sujeto infectado variantes del virus que sean resistentes a la neutralización. También se han descrito variantes del VIH que cambian los residuos de aminoácidos que tienen unidos glúcidos y conforman la cubierta de los glucanos, que es la que al final tiene mayor importancia para la neutralización del virus. Esto tiene también 47 consecuencias importantes en el diseño de vacunas, ya que los anticuerpos neutralizantes generados en respuesta a una única cepa de virus inmunizante neutralizarán solamente cepas de virus estrechamente relacionadas, un fenómeno conocido como "especificidad de tipo". Nuevos estudios han subrayado que los anticuerpos dirigidos contra el complejo de fusión de la glicoproteína gp41 pueden neutralizar virus ampliamente divergentes. La primera línea defensiva en las mucosas está representada por anticuerpos de la clase IgA secretora. Tales anticuerpos secretores se han encontrado en la sangre, saliva y otros líquidos corporales de los sujetos infectados con el VIH, pero queda por determinar su posible papel protector en la respuesta inmunitaria contra esta infección. (Pantaleo G. et al. 1995). 8.6 Citotoxicidad Celular Dependiente de Anticuerpos. Otro mecanismo inmunológico para controlar la diseminación de la infección puede ser la citotoxicidad celular dependiente de anticuerpos. Se trata de un proceso mediante el cual los anticuerpos específicos contra el virus se fijan directamente en proteínas víricas de la superficie de células infectadas, sensibilizando a estas células para ser lisadas por células que se fijan a la porción Fc expuesta del anticuerpo. Las células responsables de esta respuesta son las células NK, que expresan el receptor CD16 para la porción Fc de la IgG. En la mayoría de los enfermos infectados por el VIH se han identificado anticuerpos que pueden mediar esta respuesta. Estos anticuerpos aparecen tras la seroconversión y se mantienen a lo largo del curso de la enfermedad. Se ha postulado que la citotoxicidad celular dependiente de anticuerpos puede limitar la diseminación del virus de célula a célula mediante este mecanismo citotóxico. Sin embargo, la contribución de este proceso inmunológico en la progresión de la enfermedad no está definida. (Berger T. et al. 1991). 48 8.7 Linfocitos T Citotóxicos. Los linfocitos T citotóxicos (LTC) representan un mecanismo protector generado por el individuo frente a diversas infecciones víricas. Los LTC pueden destruir las células infectadas, al reconocer péptidos de 8-9 a.a. de las proteínas víricas presentados en la superficie celular por las moléculas HLA de clase I (A, B y C). El reconocimiento de este complejo (péptido más HLA de clase I) por parte de los LTC lleva a la lisis y a la eliminación de la célula infectada. Aunque lo que define la infección por el VIH es la aparición progresiva de un estado de inmunosupresión profunda, se ha detectado una respuesta vigorosa específica mediada por LTC en la sangre periférica de pacientes seropositivos. Estas respuestas no están sólo dirigidas contra las proteínas estructurales del virus, sino también frente a la transcriptasa inversa y las proteínas reguladoras como vif y nef. Esta respuesta está mediada fundamentalmente por los linfocitos CD8+, que pueden reconocer péptidos del VIH en la superficie de células infectadas junto con moléculas HLA de clase I (A, B y C). En numerosos modelos experimentales de infección viral se ha demostrado un papel protector de los LTC, y existen algunos datos que indican un efecto antiviral de los LTC en la infección por el VIH. En la infección aguda por el VIH, pueden detectarse concentraciones altas de LTC específicos del virus, y su aparición se correlaciona con el control de la viremia. Algunos datos indirectos sugieren que la respuesta de LTC puede retrasar la progresión de la enfermedad. Por ejemplo, los linfocitos CD8+ de sujetos seropositivos inhiben la replicación del VIH en linfocitos CD4 autólogos in vitro. Se ha detectado una capacidad inhibitoria similar en macacos infectados con el virus de la inmunodeficiencia del simio, y la depleción in vivo de estas células se acompaña de un incremento notable de la viremia. En la infección humana por el VIH se observa un descenso de LTC a medida que progresa la enfermedad, lo que puede contribuir al aumento de la viremia en fases avanzadas de la infección. Más recientemente, la aplicación de la citometría de flujo para el estudio de los LTC ha demostrado una correlación 49 inversa entre la respuesta de LTC y la carga viral. Por último, en pacientes infectados «progresores lentos» puede detectarse una vigorosa respuesta de LTC, lo que respalda el papel protector de este mecanismo defensivo. (Ho D. et al. 1989). 9. TRASTORNOS DEL SISTEMA NERVIOSO CENTRAL ASOCIADOS AL SIDA. Desde 1981 y poco después del reconocimiento del SIDA, comenzaron a aparecer reportes sobre una inusual encefalopatía en los pacientes infectados. Este trastorno neurológico se presenta entre 20 y 30% de los pacientes adultos y en 50 a 60% de los pacientes pediátricos. Originalmente se pensó que el síndrome neurológico estaba relacionado con las infecciones oportunistas que subyacen a la infección por VIH. Esta hipótesis cobró relevancia casi inmediata, debido a que otros retrovirus, como el virus de la anemia infecciosa equina o el virus Visna, son capaces de producir encefalopatía en su hospedero. Sin embargo, la teoría del daño directo causado por el virus sufrió un gran revés con el descubrimiento de dos hechos que dificultan esta posibilidad: La cantidad de virus en el cerebro se calcula que es muy pequeña, y el VIH no infecta a las neuronas. (Esta teoría se explica más adelante). (Grant I. et al. 1995). 9.1 Características Psiquiátricas. 9.1.1 Delirio. Es la manifestación psiquiátrica más común de la infección por el VIH en pacientes hospitalizados y en especial en la demencia asociada al VIH. Se caracteriza por un estado confucional de comienzo brusco, agitación, trastornos en la concentración y un lenguaje incoherente. Puede ser causado por uno o varios 50 problemas médicos tales como infecciones oportunistas, reacción tóxica a la medicación, desordenes metabólicos o una lesión primaria en el SNC. (Levy RM. et al. 1993). 9.1.2 Depresión. Estados depresivos han sido descritos hasta en un 76% de los pacientes con la infección por el VIH y depresión mayor en un 10-15%. El VIH afecta estructuras corticales y subcorticales que participan en la modulación del afecto por lo tanto la presencia de depresión sería solamente una reacción emocional a la enfermedad sino una manifestación de la acción del VIH en el SNC. (Navia BA. et al. 1986). 9.1.3 Psicosis. Síntomas psicóticos (ideas delirantes y alucinaciones) son raros en pacientes con VIH y su etiología es difícil de establecer. Síntomas psicóticos por lo general aparecen en el contexto de delirio y estadíos terminales de la demencia asociada a VIH o como síntomas asociados a esquizofrenia, estados paranoides, depresión con características psicóticas o como una reacción a un alto grado de estrés. (Gray F. et al. 1988). 9.1.4 Manía. Se ha descrito en varios pacientes con VIH. El mayor problema metodológico en el estudio de la manía en la infección por VIH es que el comienzo de la infección es coincidente con la edad en que aparecen la mayoría de los trastornos afectivos en la población. Sin embargo, se ha notado que existe una relación entre manía y VIH. La presencia de manía en un paciente con VIH es considerada como un factor de riesgo para el desarrollo de la demencia asociada al SIDA. El uso de agentes antivirales puede causar manía. (Grant I. 1994). 51 9.2 Características Neuropatológicas. El VIH tiene una tendencia a invadir áreas subcorticales del SNC. Kure demostró que la mayor concentración de gp41 estaba en el globo pálido, tálamo, cuerpo estriado y núcleo dentado. Además se ha encontrado una pérdida de neuronas y sinapsis y simplificación de dendritas en áreas del neocortex, especialmente el lóbulo frontal. Este tropismo por áreas frontales subcorticales podría explicar el patrón de déficit en la atención y memoria, dificultad para ejecutar tareas mentales complejas y un enlentecimiento en los procesos de información mental que se observan en individuos con VIH. (Rivera LG. et al. 2001). Las complicaciones neurológicas generalmente se dividen en 2 tipos: Las complicaciones primarias o directas del VIH y las complicaciones indirectas o secundarias a infecciones oportunistas y neoplasias. Las complicaciones directas o primarias incluyen: el complejo demencial del SIDA (CDS), la mielopatía vacuolar, la meningitis aséptica, la neuropatía periférica y la miopatía. (Gildenberg PL. et al. 1993). El complejo demencial del SIDA es la complicación más común del VIH. Aproximadamente entre 40 – 60% de pacientes con SIDA padecen CDS o encefalitis del VIH, y de 3 a 10% de los pacientes presentan el CDS como primer síntoma o manifestación neurológica. (Janssen RS. et al. 1992). 52 Tabla 1. Complicaciones Neurológicas Directas e Indirectas del Virus de la Inmunodeficiencia Humana. Infección primaria del SNC • Trastorno cognitivo-motor menor asociado al VIH (HMCMD). • Complejo demencial asociado al VIH (HAD). • Mielopatía. Infecciones oportunistas secundarias • Aspergillus. • Candida albicans. • Coccidioides immitis. • Criptococo neoformans. • Virus herpes simple. • Micobacterium (atípico). • Micobacterium tuberculosis. • Papovavirus. • Toxoplasma gondii. • Treponema pallidum. • Virus varicela zoster. Neoplasias malignas • Sarcoma de kaposi. • Linfoma primario o secundario del SNC. Accidentes cerebrovasculares 9.3 Demencia Asociada al VIH. La demencia asociada al SIDA se define como un trastorno de la cognición caracterizado por la alteración de diversos procesos tales como la atención, la memoria, el control motor y la percepción sensorial. Esta demencia se presenta en alrededor del 30% de los pacientes adultos y en 50% de los niños infectados con el VIH. Debido a que el VIH no infecta a las neuronas y a que su principal blanco en el cerebro es la microglia, se han sugerido distintas hipótesis que podrían explicar la etiología de la demencia. Por ejemplo, la demencia es el resultado del daño causado por agentes oportunistas que infectan a estos pacientes, o el daño 53 causado por los productos moleculares que las células del hospedero liberan a consecuencia de la infección por VIH, o por el daño que proteínas derivadas del VIH puedan estar causando. En este contexto, los estudios in vitro han sugerido que la glicoproteína gp120 del VIH (VIHgp120), que el virus utiliza para invadir a las células susceptibles, es altamente neurotóxica. La evidencia experimental señala que la VIHgp120 facilita la neurotransmisión glutamatérgica, aumentando la conductancia al Ca2+, además activa a los receptores que ocupan las quimiocinas, incrementando el [Ca2+]i y activando varias vías de señalización interna. Adicionalmente, existe evidencia que sustenta que la VIHgp120 interacciona con receptores al péptido vasoactivo intestinal (VIP). La descripción de estos mecanismos moleculares, obtenidos en preparaciones in vitro, nos ha permitido desarrollar modelos animales en los cuales hemos mostrado que la VIHgp120 también es altamente neurotóxica porque induce diversas anormalidades conductuales, por ejemplo en el modelo en rata. Asimismo, estos modelos nos han brindado la oportunidad de probar la eficacia de algunos fármacos para prevenir los efectos neurotóxicos de la VIHgp120. (Grant I. et al. 1995). Las principales anormalidades histopatológicas en la demencia asociada al SIDA son de 3 tipos: palidez difusa de la sustancia blanca, presencia de células multinucleadas y mielopatía vacuolar. La palidez difusa de la sustancia blanca puede ser identificada en un buen número de pacientes con apariencia normal o con alteraciones subclínicas. Cuando esta palidez se encuentra presente sin células multinucleadas, los cambios inflamatorios son escasos, consistiendo únicamente en algunos linfocitos perivasculares y macrófagos acompañados de astrocitos. (Price R. et al. 1988). Las células multinucleadas son encontradas en subgrupos de pacientes con padecimientos. Por el contrario el diagnóstico de encefalitis por VIH parece ser sensitivo y específico. Si usamos la carga viral en el SNC como marcador se 54 puede diagnosticar con certeza el 90% de los pacientes con Demencia asociada al VIH (D-VIH). (Brew B. et al. 1995). Otro mecanismo de daño neuronal parece ser consecuencia de neurotoxinas liberadas por los macrófagos activados o infectados dentro del SNC o fuera del mismo pero que pueden cruzar la barrera hematoencefálica. Las citocinas liberadas por el VIH tienen un rol fundamental en este proceso de daño cerebral. Altos niveles de citocinas como la IL-1β, IL-6 y el TNFα están presentes en el líquido cefalorraquídeo de pacientes con SIDA. La IL-1β y TNFα producen astrocitosis, y este último aumenta la permeabilidad de la barrera hematoencefálica y produce daño a los oligodendrocitos in vitro. Lipton ha sugerido que una activación de los canales de calcio juega un papel fundamental en el daño celular en la infección por VIH. Las toxinas sintetizadas por los macrófagos estimulan los receptores N-metil-D-aspartato (NMDA), lo que llevaría a una entrada excesiva de calcio a la célula con su consiguiente destrucción. Este proceso libera glutamato, el cual vuelve a activar el receptor NMDA y así el ciclo continúa produciendo un daño neuronal irreversible. (Adler C., 1987). En 1973, Richter había referido algunos casos de demencia como complicación de la adicción a la heroína. En la actualidad se considera que todas las sustancias químicas objeto de adicción, desde la heroína hasta las colas y pegamentos, pueden producir demencia. Numéricamente resulta muy importante la Leucoencefalopatía descrita por Wolters, que se produce tras la inhalación de pirosilato de heroína. Anatomopatológicamente está caracterizada por espongiosis y clínicamente por apatía y bradipsiquia, durante la primera etapa, a la que sigue una segunda fase con signos de afectación piramidal que pueden evolucionar hacia una tetraparesia espástica. Finalmente se instaura un mutismo aquinético y una rigidez de descerebración, previos a la muerte. (Boni J. et al. 1993). 55 La encefalopatía hepática como posible causa de demencia en la infección VIH. En el estudio nosológico de las demencias se considera la Encefalopatía hepática, que está caracterizada por alteraciones cognoscitivas, de la conciencia y de la conducta. La hidrocefalia, aparecida tardíamente en el adulto, es una causa infrecuente de demencia, la cual es debida a hemorragias subaracnoideas, lesiones obstructivas del flujo cefalorraquídeo o en la mayoría de los casos Idiopática. Sobre la apreciación de lesiones corticales tipo Pelagra. Esta enfermedad considerada como uno de los estados carenciales capaz de originar una demencia. En la actualidad, la mayoría de los casos se han descrito en pacientes alcohólicos o con una severa malnutrición, aunque también la relación causal de este proceso con la terapia Isoniacidica está suficientemente contrastada. (Budka H. et al. 1987). 9.3.1 El Papel Causal de la Gp120 del VIH en la Demencia. Una de las proteínas virales relacionadas con el VIH que se ha estudiado con mayor interés es la gp120. Actualmente esta proteína se ha convertido en una de las posibles responsables de la encefalopatía y los déficit cognoscitivos de la demencia asociada al SIDA. Desde 1988 se observó que la gp120 derivada del VIH produce muerte celular en cultivos de neuronas hipocampales a concentraciones tan bajas como 10-12 M. La pérdida de neuronas en cultivo puede llegar a constituir hasta el 51 ± 4% de las células, en relación con el control, después de tres semanas de tratamiento. (Brenneman D. et al. 1988). Varios años después Toggas, et al. observaron el mismo fenómeno en un modelo de ratones transgénicos, los cuales expresaban la proteína gp120 derivada del VIH, cuya secuencia fue insertada bajo el control regulatorio de un gen modificado de la GFAP. Sus resultados muestran una serie de cambios neuronales y gliales que se asemejan a la condición patológica de los pacientes con demencia. 56 Asimismo, observan que la severidad del daño correlaciona directamente con la expresión de la gp120 a nivel cerebral. (Toggas S. et al. 1994). Estos resultados sugieren que el daño neuronal podría ser directamente mediado por la gp120 o por un fragmento de ella. De acuerdo con esta hipótesis, la gp120 o un fragmento de la misma son liberados por los macrófagos infectados o por la microglia. La gp120 así liberada podría facilitar la transmisión glutamatérgica a tal grado que resultara neurotóxica. (Lipton S. et al. 1992). Wu, et al. observan una disminución de la sobrevivencia de células NT (sublínea de células de carcinoma humano, las cuales se diferencian en neuronas después de exponerse a ácido retinoico) al exponerlas a 1 nM de gp120 por 24 horas en cultivos de neuronas libres de células gliales. (Wu P. et al. 1996). Otros autores como Meucci y Miller encuentran evidencias en cultivos de células piramidales del hipocampo incubadas con 200 pM de gp120 que sustentan los hallazgos de Wu, et al. Ellos observan una supervivencia de hasta 70% de las células con respecto al control (muy semejante al porcentaje observado por Wu). Cuando estas células son cocultivadas con células gliales, la sobrevivencia de las neuronas disminuye hasta 30%. De tal forma que, si bien la gp120 puede tener un efecto directo sobre las neuronas, el efecto neurotóxico de la gp120 se ve facilitado por la presencia de células gliales en los cultivos. (Meucci O. et al. 1996). De acuerdo con Lo, et al. la gp120 es capaz de aumentar las concentraciones intracelulares de calcio de células hipocampales en cultivo mediante tres patrones: una corriente única y transitoria de [Ca2+]i que se observa en presencia de gp120; una serie de oscilaciones de [Ca2+]i que requieren la presencia de gp120 y, finalmente, oscilaciones de [Ca2+]i que son iniciadas por gp120 y que persisten mucho tiempo después de que la proteína ha sido removida. (Lo TM. et al. 1992). 57 Lo y su grupo observaron que estas oscilaciones son suprimidas por el uso de bloqueadores de canales de Ca2+ dependientes de voltaje (nitrendipina) o antagonistas del receptor a NMDA. Otra posibilidad consiste en que la gp120 o algún fragmento de ésta, posiblemente liberado por algún macrófago o células de la microglia infectadas, se una a los astrocitos afectando alguna de sus funciones. Por ejemplo, la gp120 puede competir con el péptido vasoactivo intestinal (VIP), por sus receptores en el astrocito. Normalmente el VIP puede influir en la liberación de factores de crecimiento neuronal por parte de los astrocitos, de tal forma que se ha propuesto que la gp120 podría estar interfiriendo con este proceso o algún otro similar, mediado por VIP. (Lipton S. et al. 1992). Otros estudios han mostrado que tanto los viriones de VIH como de manera más específica la gp120, pueden alterar el intercambiador Na+/H+, activar corrientes salientes de K+, así como modificar el flujo de glutamato en astrocitos de rata y humanos. (Benos D. et al. 1994). Estos autores proponen que la alteración de las funciones normales del intercambio Na+/H+ provocaría una alcalinización intracelular y una pérdida de K+ de la célula. La elevación del potasio extracelular y la alcalinización citoplasmática llevaría a una disminución de la recaptura de glutamato, así como a un aumento en su liberación por el astrocito. Adicionalmente, sugieren que un incremento en el potasio extracelular en una superficie extracelular restringida rodeando a los astrocitos y a la neurona podría despolarizar significativamente ambas células (3040 mV). De hecho, grandes cambios (> 35 mM) en el K+ externo pueden resultar de pequeñas pérdidas (1%) de K+ de los astrocitos. La despolarización de la membrana llevaría a la apertura de canales de calcio dependientes de voltaje, alterando la homeostasis del calcio, produciendo eventualmente un aumento en el calcio intracelular. Finalmente, otra posibilidad, con gran apoyo experimental, es la del daño neuronal mediado por macrófagos. Actualmente existe evidencia de que 58 las células monocíticas humanas, como son los macrófagos o la microglia, infectadas con el virus del VIH, secretan factores tóxicos in vitro que llevan a la destrucción neural. Giulian, et al. observan que la exposición de monocitos al VIH-1 produce la liberación de productos tóxicos que llevan a la destrucción de neuronas en cultivo. Giulian y su grupo describen estas sustancias como pequeñas neurotoxinas (no mayores de 2 KDa) que ejercen su acción a través de los receptores a NMDA, y que adicionalmente son estables al calor y resistentes a las proteasas. Posteriormente, esta misma autora realiza otros estudios en los que expone a los monocitos a gp120. Sus resultados muestran que la unión de la gp120 al receptor CD4 de los monocitos es un requisito indispensable para la liberación de pequeñas neurotoxinas de alrededor de 500 Da. (Giulian D. et al. 1990). 9.4 Neuropatogénesis del Complejo Demencial del SIDA. Los mecanismos específicos para la patogénesis del CDS no están muy claros. Los datos actuales sugieren que el VIH-1 pueden inducir degeneración y disfunción neurológica por mecanismos más indirectos que por la infección directa con lisis de células neuronales. (Brenneman DE. et al. 1988). Un estudio ha mostrado que la proteína gp120 del VIH-1 y la proteína recombinante gp120 produce una muerte neuronal significante en cultivos del hipocampo disociados derivados de ratones fetales. (Dreyer EB. et al. 1990). Otros estudios han demostrado también que la proteína recombinante gp120 del VIH-1 incrementa el calcio libre intracelular y produce daño en los ganglios de la retina del roedor y las neuronas hipocámpicas en cultivo. A pesar de que los hallazgos de estos experimentos in vitro son muy interesantes, su relevancia in vivo es incierta. (Gurney ME. et al. 1986). 59 Otra observación fascinante fue hecha en 1986, cuando describieron un factor neurotrópico de 56 kDa en neuronas sensoriales y espinales, llamado Neuroleucina (NLK). La secuencia de aminoácidos de la NLK es particularmente homóloga a una región altamente conservada de la membrana externa de la proteína del VIH-1 (residuos de NLK 403-447, VIH-1 gp120 residuos 238-282). (Lee MR. et al. 1987). Estudios posteriores describen que tanto el VIH-1 como el SIV inhiben a las neuronas sensoriales de los ganglios raquídeos en un medio contenido de NLK. Esta inhibición por el VIH fue debida a la envoltura de la proteína gp120. La secuencia homóloga entre la gp120 y NLK forman parte de la propiedad inhibitoria de la gp120. Controversialmente, en 1988 varios estudios demostraron que la NLK no era una proteína nueva sino que tenia más del 90% de homología a la fosfohexosa isomerasa (PHI). Esta enzima cataliza la conversión de glucosa-6-fosfato a fructuosa-6-fosfato, un paso obligatorio durante la glucólisis. Estos resultados muestran que la NLK es la fosfohexosa isomerasa. (Chaput M. et al. 1988). 9.5 Autoinmunidad en el Complejo Demencial del SIDA: Mimetismo Molecular. Las infecciones retrovirales pueden inducir una respuesta autoinmune por el incremento de la proliferación de las células B capaces de reaccionar con antígenos propios, o a través del sistema antidiotípico (alteraciones de células infectadas que exponen o cambian sus propios antígenos); La integración retroviral puede alterar la estructura y función de los genes del huésped; Además el mimetismo molecular puede ocurrir si existe homología o semejanza entre las proteínas de los virus y del huésped. (Fujinami R. et al. 1989). 60 En un estudio donde se utilizaron más de 600 anticuerpos monoclonales antivirales de 11 diferentes virus, se encontró que el 3.5 % de células especificas reaccionaban con los anticuerpos de órganos de ratones no infectados. (Srinivasppa J. et al. 1986). En otro estudio con un péptido de la polimerasa del virus de la hepatitis B, se encontró homología entre 6 aminoácidos consecutivos de este péptido con la región encefalitógena de la proteína básica de mielina en el conejo y ésta fue capaz de iniciar una enfermedad autoinmune. (Fujinami R. et al. 1985). En otro estudio encontraron secuencias (péptidos) endógenas humanas que fueron similares a las secuencias de la proteasa del VIH-1 y de las proteínas rev y de la glicoproteína 41. (Horwitz M. et al. 1992). Además, se han descrito que los retrovirus presentan mimetismo molecular con las neurotoxinas. Por ejemplo, la proteína nef de los lentivirus de los primates y secuencias de la envoltura del VIH-1 son similares a las neurotoxinas del escorpión. (Tran M. et al. 1991). Las secuencias de la proteína Tat de varios lentivirus (primates) tienen mimetismo molecular con el veneno de las víboras. (Garry R. et al. 1992). Los mecanismos autoinmunes intervienen de manera importante en la patogénesis del SIDA y en las enfermedades neurológicas relacionadas se ha encontrado que los anticuerpos monoclonales anti-gp41 (péptidos sintéticos) del VIH-1 tienen una reactividad cruzada con los astrocitos humanos y de los ratones. En este mismo estudio, mostraron que los anticuerpos de pacientes con CDS también reaccionan con los astrocitos. (Price R. et al. 1988). Otros investigadores han observado resultados muy parecidos utilizando astrocitos primarios y líneas celulares de astrocitos (astrocitomas). (Spehar T. et al. 1994). En el Hospital General de Massachusetts de la Universidad de Harvard, encontraron que la mayor parte de los pacientes con el CDS tienen anticuerpos 61 anti-VIH-1 gp120. En este estudio, en los pacientes con el CDS más severo observamos anticuerpos de la envoltura gp120 del VIH a niveles más altos en el LCR respecto al suero. Es llamativo que estos pacientes no presentaban una carga viral productiva de VIH-1 ni hubo detección de la gp120. Por lo tanto investigamos si la presencia de estos altos niveles de anticuerpos gp120 pudiesen tener un efecto patológico a través de mecanismos como es el mimetismo molecular. Utilizando proteínas de cerebros humanos (post-morterm) no infectados con el VIH-1 estudiaron si se presentaba una reacción cruzada con los anticuerpos de la gp120. Interesantemente se encontró que la región de la envoltura gp120 del VIH-1, denominada V3, presentaba mimetismo molecular con 3 proteínas humanas cerebrales de un peso molecular de aproximadamente 35, 55, y 110 kDa. (Trujillo JR. et al. 1993). Utilizando pruebas de bloqueo con proteína recombinante de gp120, se demostró que las 3 proteínas cerebrales eran específicas a la secuencia o péptido de la región V3 de la gp120. Posteriormente, utilizando pruebas inmunológicas en secciones de tejidos del SNC humano no infectados con el VIH-1 incluidos en parafina, encontraron que las neuronas expresan más comúnmente la proteína similar a la región V3 de la gp120. (Trujillo JR. et al. 1996). Además, observó que los pacientes con demencia severa (n=7/21) presentaron anticuerpos en su LCR que reaccionaban con las mismas proteínas endógenas cerebrales. La reactividad cruzada de anticuerpos específicos del VIH-1 con proteínas celulares sugieren la existencia de autoinmunidad en el SIDA. Utilizando experimentos similares se evidenció el mimetismo molecular entre la región V3 de la gp120 del VIH-1 y los linfocitos CD4+ activados. (Trujillo JR. et al. 1998). De acuerdo con estos hallazgos de mimetismo molecular se sugiere una teoría autoimune en la cual los anticuerpos anti-V3 pueden ocasionar daño a las células del SNC que presentan epítopes parecidos a la región V3 y contribuyen en la neuropatogénesis del CDS. De la misma forma, los hallazgos del mimetismo 62 molecular de los linfocitos CD4+, pueden explicar la disminución de los linfocitos CD4+ en los pacientes con SIDA por un mecanismo indirecto. Para estudiar el origen de las proteínas derivadas del SNC que presentan mimetismo molecular con la región V3 de la gp120 del VIH, se analizó en un Banco de Análisis de Secuencias, la similitud con el péptido V3. Interesantemente identificamos 5 aminoácidos consecutivos, GPGRA, en el protooncogene humano N-myc. Los análisis del ADN del N-myc confirmaron la región homóloga V3. Además los anticuerpos anti-N-myc y anti-V3 reaccionaron (Western blot) con la proteína N-myc. Esta proteína de un peso molecular 65 kDa fue expresada en proteínas de los cerebros humanos y líneas celulares neuronales. (Trujillo JR. et al. 1994). Estudios al futuro ayudarán a dilucidar el papel que juega el protooncogene N-myc en el CDS. Quizás el hallazgo final más importante en la patogénesis de la demencia asociada al VIH es la pérdida de las neuronas a través de un mecanismo llamado apoptosis. Los mecanismos por los cuales se induce la muerte neuronal y/o la apoptosis se desconocen. Basándonos en nuestros hallazgos de mimetismo molecular entre las neuronas y la región V3 de la gp120 del VIH-1, exploramos la posibilidad de que la presencia de anticuerpos anti-V3 pueda inducir daño a la membrana neuronal. Utilizando estudios de apoptosis en las neuronas in vitro encontramos que los anticuerpos anti-V3 inducen apoptosis. Estos cambios apoptóticos ocurren en minutos después de la presencia de anticuerpos en el medio de las neuronas. (Trujillo JR. et al. 2000). 63 Figura 7. Mimetismo Molecular del Virus de la Inmunodeficiencia Humana. 10. DIAGNÓSTICO POR LABORATORIO. Los sujetos con infección por VIH por lo general presentan leucopenia atípica con linfocitosis. En algunos pacientes ocurre trombocitopenia transitoria. Con la progresión de la enfermedad se reduce la cantidad total de leucocitos, con linfopenia asociada, que refleja reducción en el recuento de linfocitos CD4. La hemoglobina y el hematócrito se reducen como resultado de anemia por enfermedades crónicas y presencia de infecciones oportunistas o relacionadas con el tratamiento. (Parslow T. et al. 2002). 64 10.1 Elisa (Ensayo Inmunoabsorbente Ligado a Enzimas). Esta técnica utiliza anticuerpos que se unen covalentemente a las enzimas; de este modo se conservan las propiedades catalíticas de las enzimas y la especificidad de los anticuerpos. Las enzimas de unión típicas utilizadas incluyen peroxidasa, fosfatasa alcalina y β-galactosidasa, que catalizan reacciones cuyos productos son coloreados y pueden medirse en cantidades muy pequeñas. Se han desarrollado dos metodologías de ELISA, una para la detección del antígeno, a partir de una muestra de sangre total o de heces se utiliza ELISA directo. Y la otra para la detección de anticuerpos presentes en el suero del paciente se utiliza ELISA indirecto. (Madigan y col. 1998). Figura 8. Detección del Virus de la Inmunodeficiencia Humana mediante ELISA diecto. 65 Durante las etapas precoces de la enfermedad primaria los anticuerpos contra VIH no se detectan en suero; por lo general aparecen 3 a 4 semanas después de la infección. Los métodos para detectar el antígeno p24 mediante estudios de inmunoabsorbancia ligada a enzimas (ELISA) implican una técnica de disociación en ácido para separar el antígeno del complejo anticuerpo-antígeno, la cual es muy sensible (99%) y muy específica (99% en población de riesgo elevado). (Parslow T. et al. 2002). Figura 9. Prueba de ELISA Indirecto para la detección de Anticuerpos contra el Virus de la Inmunodeficiencia Humana. 66 La reacción en cadena de la polimerasa cuantitativa para transcriptasa inversa (RT-PCR) y los estudios de ramificación de cadena de DNA se utilizan para cuantificar las concentraciones de RNA de VIH en plasma. En pacientes con infección aguda por VIH con anticuerpos no detectables por ELISA, la carga viral plasmática por lo general es muy elevada (>100000 copias/uL). Estas pruebas actualmente no están autorizadas para el diagnóstico de infección por VIH debido a que carecen de especificdad. (Parslow T. et al. 2002). 10.2 Western Blot. El Western Blot ha puesto una enorme influencia clínica en el diagnóstico y confirmación de los casos de SIDA. Es necesario confirmar un resultado positivo en el ELISA mediante Western Blot, debido a que la prueba de ELISA da lugar en ocasiones a falsos positivos. (Madigan y col. 1998). Estudios positivos repetidos de ELISA deben confirmarse con pruebas de inmunotransferencia o, con menor frecuencia, por estudios de inmunofluorescencia. Las pruebas de inmunotransferencia (Western blot) detectan anticuerpos específicos dirigidos contra varias proteínas del VIH. Las proteínas virales purificadas se corren sobre un gel de poliacrilamida, se transfiere a una membrana de nitrocelulosa y después se hace reaccionar con el suero a analizar. Se considera como resultado positivo la presencia de anticuerpos contra al menos 2 o 3 proteínas de importancia del virión (p24, gp41 y gp120/160), y la falta de anticuerpos contra cualquier proteína VIH se reporta como negativa. (Parslow T. et al. 2002). 67 Figura 10. Western Blot. a) Protocolo de Western Blot. b) Resultado de un Western Blot , donde se evidencia la p24 proteína de la cápside, y gp41-45 proteína de la envoltura del virus, tienen valor diagnóstico para el Virus de la Inmunodeficiencia Humana. 68 Los recién nacidos con infección por VIH significan un gran problema para el diagnóstico serológico porque los anticuerpos maternos IgG cruzan la placenta. De esta forma, el recién nacido adquiere anticuerpos contra VIH en forma pasiva, los cuales pueden persistir hasta por 15 meses. La detección de antígeno p24 en suero en lactantes confirma el diagnóstico de infección por VIH. (Parslow T. et al. 2002). 10.3 Recuento de Poblaciones Celulares. La utilización de varios anticuerpos, cada uno marcado con un fluorocromo distinto, puede dar lugar a la identificación simultánea de varios marcadores celulares como CD3+ y CD4+ en pacientes sanos y enfermos de SIDA. El sello distintivo del SIDA es un defecto en la inmunidad mediada por células, característicamente relacionada con una reducción en el número y función de los LTCD4+. Además, el cociente CD4:CD8 se modifica durante la progresión del SIDA. Estos se encuentran separados desde el punto de vista funcional en subgrupos Th1, que producen IFNγ e IL-2 y el subgrupo Th2, el cual produce IL-4, IL6 e IL-10. En la infección avanzada por VIH, el número de células del subgrupo Th1 se reduce en forma notable. (Parslow T. et al. 2002). Figura 11. Recuento de Células CD3 y CD4. a) De un paciente sano. b) De un paciente con SIDA. 69 Las células de sangre periférica se marcan con un anticuerpo monoclonal antiCD4 conjugado con ficoeritrina (FE) y con un anticuerpo monoclonal antiCD3 conjugado con isotiocianato de fluoresceína (FITC). CD3 se expresa en todas las células T y CD4 en los LT ayudadores (LTH). El cuadrante 3 muestra células sin teñir, el cuadrante 1 muestra células teñidas solo con antiCD4, el cuadrante 4 muestra células teñidas solo con antiCD3, y el cuadrante 2 muestra células teñidas con antiCD3 y antiCD4. (Madigan y col. 1998). La determinación de la carga viral es un método más corriente para predecir la gravedad de la enfermedad, la progresión de la misma y el riesgo de muerte. Esta es una medida de cuántas partículas virales reales se encuentran en un milímetro cúbico de sangre. (Parslow T. et al. 2002). Las respuestas de hipersensibilidad tardía suelen ser normales en las fases iniciales de la infección por VIH y se reducen o están ausentes en pacientes con enfermedad avanzada. Las respuesta proliferativas normales in vitro de los linfocitos TCD4 a antígenos solubles (p.ej. toxoide tetánico) y mitógenos (p.ej. fitohemaglutinina) están deteriorados en los individuos infectados con VIH, en especial aquellos con SIDA. (Parslow T. et al. 2002). Otros parámetros inmunitarios anómalos incluyen la reducción en la producción de linfocinas (en particular IL-2, IFNγ) reduciendo la expresión de receptores de IL-2 e incrementando la concentración de complejos inmunitarios circulantes. El incremento en las concentraciones séricas de β2-microglobulina y de neopterina tienen alguna importancia pronóstica para predecir la progresión de SIDA. (Parslow T. et al. 2002). 70 10.4 Diagnóstico Diferencial. La mononucleosis aguda por VIH debe distinguirse de la causada por infección con Virus Epstein-Barr, Citomegalovirus y con menor frecuencia rubéola, sífilis secundaria, hepatitis B, infección por herpesvirus humano tipo 6 y toxoplasmosis. Una vez que hay pruebas de la inmunodeficiencia, se debe tener la certeza de que es un trastorno adquirido y no congénito, y de que no es posible otra explicación para las manifestaciones inmunitarias, trasplantes. (Parslow T. et al. 2002). 71 como cánceres hematológicos o CONCLUSIONES El Virus de la Inmunodeficiencia Humana es un retrovirus con cubierta que posee la enzima transcriptasa inversa, la cual permite que el virus sintetice una copia de ADNA a partir de su propio RNA. El gen env del Virus de la Inmunodeficiencia Humana codifica la glicoproteína precursora gp160, esta se divide intracelularmente en gp120 y gp41. La unión de la gp120 al receptor CD4 y los co-receptores de tipo CC o CXC produce un cambio conformacional en la gp41, donde la nucleocápside del Virus de la Inmunodeficiencia Humana es internalizada y el RNA se transcribe a DNA, mediante la transcriptasa inversa, este DNA viral permanece asociado al DNA de la célula huésped y se transmite a las células hijas cuando se divide. La infección por Virus de la Inmunodeficiencia Humana afecta el Sistema Inmune donde la principal característica es la reducción progresiva de la subpoblación CD4 de los Linfocitos T, lo que conduce a la Inmunodeficiencia. El Sistema Inmune ejerce una fuerte respuesta humoral y celular contra el virus de la Inmunodeficiencia Humana, pero debido a la gran cantidad de reservorios celulares que se establecen en la infección primaria y fase de latencia, el virus no ha logrado ser erradicado, además de alterar la función de las diferentes células que actúan en defensa del organismo. El Delirio, la Depresión, la Psicosis y la Manía son las principales características psiquiátricas que se observan en los trastornos del sistema nervioso central asociado al SIDA. 72 Las complicaciones neurológicas son de dos tipos: las primarias o directas del Virus de la Inmunodeficiencia Humana y las indirectas o secundarias a infecciones oportunistas por Candida albicans o Toxoplasma gondii entre otros, y neoplasias como Sarcoma de Kaposi. El complejo demencial del SIDA es la complicación neurológica más común del Virus de la Inmunodeficiencia Humana donde aproximadamente entre el 40-60% de los pacientes con SIDA la padecen. La demencia asociada al SIDA se define como un trastorno de la cognición caracterizado por la alteración de diversos procesos como la atención, la memoria, el control motor y la percepción sensorial, y sus principales anormalidades histopatológicas son palidez difusa de la sustancia blanca, presencia de células multinucleares y mielopatía vacuolar. Los pacientes infectados con Virus de la Inmunodeficiencia Humana presentan leucopenia atípica con linfocitosis, en algunos casos trombocitopenia, la hemoglobina y el hematocrito se reducen debido a las infecciones oportunistas o el tratamiento. Las pruebas de laboratorio utilizadas para el diagnóstico de infección por Virus de la Inmunodeficiencia Humana son ELISA (Ensayo Inmunoabsorbente ligado a Enzimas) o Western Blot como confirmatoria, mientras que la carga viral y el recuento de linfocitos T CD4 y CD8 son de gran importancia para el seguimiento y evaluar la efectividad del tratamiento en los pacientes infectados con Virus de la Inmunodeficiencia Humana. 73 RECOMENDACIONES Teniendo en cuenta la complicada maquinaria utilizada por el Virus de la Inmunodeficiencia Humana en su ciclo de replicación se recomienda realizar avances en el bloqueo de las diferentes fases del virus, los cuales logren los siguientes objetivos: 1. Evitar la resistencia que se presenta frente a los medicamentos empleados. 2. Conseguir un efecto sinérgico entre los diferentes anti-retrovirales. 3. Disminuir la dosis. 4. Reducir los efectos adversos. 74 BIBLIOGRAFÍA. - ADLER, Cohen. 1987. Psychiatric aspects of AIDS: A biopsychosocial approach. Cap. 29 en AIDS. Acquierd Immunodeficiency Syndrome and other manifestations oh HIV Infection. Wormser GP.Sthal RE, Bottone EJ Eds. Noyes Publications - ASHORN, P., BERGER, E. and MOSS B. 1990. Human immunodeficiency virus envelope glycoprotein CD4 mediated fusion of nonprimate cells with human cells. J Virol. 64(5):2149-2156. - BAGGIOLINI, M. 2000. Reflections on chemokines. Immunol Rev. 177:5-7. - BANCHEREAU, J., BRIERE, F., CAUX , C., DAVOUST, J., LEBECQUE, S., LIU, YJ., PULENDRAN, B. and PALUCKA, K. 2000. Immunobiology of dendritic cells. Annu Rev Immunol. 18:767-811. - BANCHEREAU, J. and STEINMAN, R.M. 1998 Dendritic cells and the control of immunity. Nature. 392:245-52. - BENOS, D., HAHN, B., BUBIEN, J., GHOSH, S., MASHBURN, N., CHAKIN, M., SHAW, G. and BENVENISTE E. 1994. Envelope glycoprotein gp120 of human immunodeficiency virus type 1 alters ion transport in astrocytes: Implications for AIDS dementia complex. Proc Natl Acad Sci USA. 91: 494-498. - BERGER, T.G. and GREENE, I. 1991. Bacterial, viral, fungal and parasitic infections in HIV disease and AIDS. Dermatol. Clin. 9:465-492. - BOBARDT, M.D., SAPHIRE, A.C., HUNG, H.C. et al. 2003. Syndecan captures, protects and transmits HIV to T lymphocytes. Immunity. 18:27-39. - BONI, J., EMMERICH, BS. and LEIB, SL. 1993. PCR identification of HIV-1 DNA sequences in brain tissue of patients with AIDS encephalopathy. Neurology. 43:1813-1817. - BRENNEMAN, D.E., WESBROOK, G.L., FITZEGERALD, S.P., ENNIST, D.L., EIKINS, K.L., RUFF, M.R. and PERT C.B. 1988. Neuronal cell killing by the 75 envelope protein of HIV and its prevention by vasoactive intestinal peptide. Nature. 335:639-642. - BREW, B., RESENBLUM, M., CRONIN, K. and PRICE R. 1995. AIDS dementia complex an HIV-1 brain infection: Clinical virological correlations. Ann Neurol. 38(4): 563-570. - BUDKA, H. and COSTANZI, G. 1987. Brain pathology induced by infection with the human immunodeficiency virus (HIV). A histological and electron microscopical study of 100 autopsy cases. Acta Neuropathol. 75:185-198. - CHAPUT, M., CLAES, V., PORTETELLE, D., CLUDTS, I., CRAVADOR, A., BURNY, A. GRAS H. and TARTAR A. 1988. The neurotrophic factor neuroleukin is 90% homologous with phosphohexose isomerase. Nature. 332:454-455. - CONNOR, R., NOTERMANS, D., MOHRI, H., CAO, Y. and HO, D. 1993. Biological cloning of functionally diverse quasispecies of HIV-1. AIDS Res Hum Retroviruses. 9(6):541-6. - CONNOR, R., SHERIDAN, K., CERADINI, D., CHOE, S. and LANDAU, N. 1997. Change in coreceptor use correlates with disease progresion in HIV-1 infected individuals. J Exp Med. 185(4):621-628. - DONALDSON, Y., BELL, J., HOLMES, E., HUGHES, E., BROWN, H. and SIMMONDS, P. 1994. In vivo distribution and cytopathology of variants of human immunodeficiency virus type 1 showing restricted sequence variability in the v3 loop. Journal of Virology. 68(9):5991-6005. - DREYER, E.B., KAISER, P.K., OFFERMANN, J.T. and LIPTON, S.A. 1990. HIV-1 coat protein neurotoxicity prevent by calcium channel antagonists. Science. 248:364-367. - ENGERING, A., VAN VLIET, S.J., GEIJTENBEEK, T.B.H. and VAN KOOYK, Y. 2002. Subset of DC-SIGN Dendritic Cells in Human Blood Transmits HIV-1 to T Lymphocytes. Blood, September. Vol. 100, No. 5. 1780-1786. 76 - FIGUERAS, Jose Turrent., TALLEDO, Leandro., GONZALEZ, Jose., GONZALEZ, Angel., REMUÑAN, Carmen y QUEVEDO, Luis. Revista Cubana de Medicina Intensiva y Emergencias. Neuro-sida como Diagnóstico Diferencial de Enfermedad Cerebrovascular en Cuidados Intensivos. - FOLEY, B. and KORBER, B. 1995. Los Alamos national laboratory. New Mexico. 77-150. - FORTIN, J.F., CANTIN, R. and TREMBLAY, M.J. 1998. T cells expressing activated LFA-1 immunodeficiency are more susceptible to infection with human virus type 1 bearing host encoded ICAM-1. J. Virol. 72:2105-2112. - FOX, C.H. and COTTLER FOX, M. 1992. The pathobiology of HIV infection. Immunol. Today. 13:353-356. - FRANKEL, A. and YOUNG J. 1998. HIV-1: Fifteen proteins and an RNA. Annu Rev Biochem. 67:1-25. - FUJINAMI, R.S., and M.B.A. Oldstone. 1989. Molecular mimicry as a mechanism for virus induced autoimmunity. Immunol. Res. 8:3-15. - FUJINAMI, R.S. and M.B.A. Oldstone. 1985. Amino acid homology between the encephalitogenic site of myelin basic protein and virus: mechanism for autoimmunity. Science. 230:1043-1045. - GABUZDA, D., HE, J., OHAGEN, A. and VALLAT, AV. 1998. Chemokine receptors in HIV-1 infection of the central nervous system. Immunology. 10:203-213. - GANJU, R., BRUBAKER, S., MEYER, J., DUTT, P., YANG, Y., QIN, S., NEWMAN, W. and GROOPMAN J. 1998. The alfa chemokine stromal cellderived factor 1 alfa, binds to the transmembrane G protein coupled CXCr4 receptor and activates multiple signal transduction pathways. J Biol Chem. 273(36): 23169-23175. - GARRY, R.F. and KOCH, G. 1992. Tat contains a sequence related to snake neurotoxins. AIDS. 6:1541-1560. 77 - GEIJTENBEEK, T.B., TORENSMA, R., VAN,C.J., VLIET, GC., VAN DUIJNHOVEN, ADEMA, G.J., VAN KOOYK, Y. and FIGDOR, C.G. 2000. Identification of DC-SIGN, a novel dendritic cell-specific ICAM-3 receptor that supports primary immune responses. Cell. 100:575-585. - GILDENBERG, P.L., LANGFORD, L., KIM, J.H. and TRUJILLO, J.R. 1993. Stereotactic biopsy in cerebral lesions of AIDS. Acta neurochirurgica. 58:68-70. - GIULIAN, D., VACA, K. and NOONAN, C. 1990. Secretion of neurotoxins by mononuclear phagocytes infected with HIV-1. Science. 250: 1593-1596. - GRANT, I. and MARTIN, A. 1994. neurocognitive disorders associated with HIV infection. New York, Oxford University Press. 3-20. - GRANT, I., HEATON, R. and ATKINSON, J. 1995. Neurocognitive disorders in HIV-1 infection. In: M. Oldstone, and L. Vitkovic (eds). Neurocognitive disorders in HIV-1 infection. Berlin: Springer-Verlag. 11-32. - GRAY, F., GHERARDI, R. and SCARAVILLI, F. 1988. The neuropathology of the acquierd immune deficiency syndrome (AIDS). Brain. 111:245-266. - GURNEY, M.E., APATOFF, B.R., SPEAR, G.T., BAUMEL, M.J., ANTEL, J.P., BANIA, B. and REDER, A.T. 1986. Neuroleukin: A lymphokine product of lectin stimulated T cells. Science. 234:574-581. - HE, J., CHEN, Y., FARZAN, M., CHOE, H. and OHAGEN, A. 1997. CCR3 and CCR5 are coreceptors for HIV-1 infection of microglia. Nature. 385: 645-9. - HO, D., MOUDGIL, T. and ALAM, M. 1989. Quantitation of human immunodeficiency virus type 1 in the blood of infected persons. N. Engl. J. Med. 321:1621-1625. - HORWITZ, M.S., BOYCE J. and FARES A.J. 1992. Novel human endogenous sequences related to human immunodeficiency virus type 1. J. Virol. 66:21702179. - ITO, T., INABA, M., INABA, K., TOKI, J.S., SOGO, S., IGUCHI, T. ADACHI, Y., YAMAGUCHI, K., AMAKAWA, R., VALLEDEAU, J., SAELAND, S., FUKUHARA, S. and IKEHARA, S. A 1999. CD1a+/CD11c+ subset of human 78 blood dendritic cells is a direct precursor of Langerhans cells. J. Immunol. 163:1409-1419. - JANSSEN, R.S., NWANYANUWU, O.C.,SILIK, R.M. and STEHR GREEN, J.K. 1992. Epidemiology of HIV-1 encephalopathy in the United States. Neurology. 42:1472-1476. - JAWETZ, Ernest., MELNICK, Joseph L. y ADELBERG, Edward A. 1996. Microbiología Médica. Manual Moderno. México D.F. Pág. 637-653. - KLINKERT, M.E. 1990. Lymphoid dendritic accesory cells of the rat, Immunol Rev. 117:103-120. - KUBY, J. 1998. Immunology. New York Library of Congress. - LANNUZEL, A., BARNIER, JV., HERY, C., TAN, HV., GUIBERT, B., GRAY, F., VINCENT, JD. and TARDIEU, M. 1997. Human immunodeficiency virus type 1 and its coat protein gp120 induce apoptosis and activate JNK and ERK mitogen activated protein kinases in human neurons. American Neurological Association. 42(6):847-856. - LAROSA, G.J., DAVIDE, J.P., WEINHOLD, K., WATERBURY, J.A., PROFY, A.T., LEWIS, J.A., LANGLOIS, A.J., DREESMAN, G.R., BROSWELL, R.N. and SHADDUCK, P. 1990. Conserved sequences and structural elements in the HIV principal neutralizing determinant. Science. 249:932-935. - LEE, B., LESTIE, G., SOILLEUX, E. et al. 2001. Cis expression of DC-SIGN allows for more efficient entry of human and simian immunodeficiency viruses via CD4 and a coreceptor. J. Virol. 75: 12028-12038. - LEE, M.R., HO, D.D., GURNEY, M.E. 1987. Functional interaction and partial homology between human immunodeficiency virus and neuroleukin. Science. 237:1047-1051. - LEVY, RM. and BERGER, JR. 1993. HIV and HTLV infections of the nervous system. Philadelphia: F.A. Davis co. 47-75. - LIPSCOMB, M.F. and MASTEN, B.J. 2002. Dendritic cells: Immune regulators in health and disease. Physiol. Rev. 82:97-130. 79 - LIPTON, S. 1992. Models of neural injury in AIDS: Another role for the NMDA receptor? TINS. 15(3):75-79. - LO, TM., FALLERT, C., PISER, T. and THAYER, S. 1992. HIV-1 envelope protein evokes intracellular calcium oscillations in rat hippocampal neurons. Brain Research. 594:189-196. - LOCATI, M. and MURPHY, P. 1999. Chemokines and chemokine receptors: Biology and clinical relevance in inflammation and AIDS. Annu Rev Med. 50:425-440. - MADIGAN, Michael T., MARTINKO, John M., y PARKER, Jack. 1998. Brock Biología de los Microrganismos. Prentice Hall. Octava edición. España. Pág. 884-893. - MEUCCI, O. and MILLER, R. 1996. Gp120-induced nuerotoxicity in hipocampal pyramidal neuron cultures: Protective action of TGF-beta1. The Journal of Neuroscience. 16(13):4080-4088. - MEYAARD, L., OTTO, S.A., HOOIBRINK, B. et al. 1994. Quantitative analysis of CD4+ T cell function in the course of human immunodeficiency virus infection: Gradual decline of both naive and memory alloreactive T cells. J. Clin. Invest. 94:1947-1952. - MICHAEL, N.L., Cgang, G., LOUIE, L.G. et al. 1997. The role of viral phenotype and CCR5 gene defects in HIV-1 transmissiion and disease progression. Nature Med. 3:338-340. - NAVIA, BA., JORDAN, BD. and PRICE, RW. 1986. The AIDS dementia complex. I. Clinical features. Ann Neurol. 19:517-524. - OYAIZU, N. and PAHWA, S. 1995. Role of apoptosis in HIV disease pathogenesis. J. Clinical Immunol. 15:217-231. - PANTALEO, G. and FAUCI, A.S. 1995. New concepts immunopathogenesis of HIV infection. Annu Rev. Immunol. 13:487-512. 80 in the - PARSLOW, Tristram G., STITES, Daniel P., TERR, Abba I. e IMBODEN, John B. 2002. Inmunología Básica y Clínica. Manual Moderno. 10ª Edición. México D.F. Pág. 751-766. - PHIMISTER, EG. 2003. In search of a better HIV vaccine. The heat is on. N Engl. J. Med. 348:643-644. - PIOT P., PLUMMER, F., MHALU, F., LAMBORAY, JL., CHIN, J. and MANN, J. 1988. AIDS: An international perspective. Science. 239:573-579. - POIGNARD, P., OLLMANN, E., PARREN, P. and BURTON, D. 2001. Gp120: Biological aspects of structural features. Annu Rev Immunol. 19:253-274. - PORTAS, Adriana. Revista Argentina de Clínica Neuropsiquiátrica. Trastornos psiquiátricos asociados a la infección HIV Parte I. - PORTEGIES, P. y ROSENBERG, N. 1998. Complejo Demencial Asociado al SIDA, Diagnóstico y Opción Terapéutica. CNS Drugs. 9(1):32-40. - PRICE, R.W., BREW, B., SIDTIS, J., ROSENBLUM, J., SCHECK, A.C. and CLEARY, P. 1988. The brain in AIDS: central nervous system HIV-1 infection and AIDS dementia complex. Science. 239:586-592. - PRICE, R., BREW, B., SIDTIS, J., ROSENBLUM, M., SCHECK, A. and CLEARY P. 1988. The brain and AIDS: Central nervous system HIV-1 infection and AIDS demential complex. Science. 239:586-592. - RICHMAN, D.D. and BOZZETTE, S.A. 1994. The impact of syncytium inducing phenotype of human immunodeficiency virus on disease progression. J. Infect. Dis. 169: 968-974. - RIVERA, L.G., NOVITSKY, V.A., TRUJILLO, J.R., LAVALLE, C., CANO, C., RAMOS, J.E., FLORES, L., LOPEZ, P., VANNBERG, F., TAMEZ, R., RODRIGUEZ, C. and ESSEX, M. 2001. HIV-1 subtype B is a predominant AIDS virus in Mexico. AIDS Res. HUM. Retrovirus. 17:87-92. - ROSENBERG, Z.F. and FAUCI, A.S. 1991. Immunopathogenesis of HIV infection. FASEB J. 5:2382-2390. 81 - ROSSI, D. and ZLOTNIK, A. 2000. The biology of chemokines and their receptors. Annu Rev Immunol. 18:217-242. - RUGELES, Maria Teresa. y PATIÑO, Pablo Javier. 2004. Inmunología Una Ciencia Activa. Tomo II. Biogenésis Fondo Editorial. Medellín. Pág. 369-388. - SERETI, I., LANE, H.C. 2001. Immunopathogenesis of human immunodeficiency virus: Implications for immune based therapies. Clin Infect. Dis. 32:1738-1755. - SIMMONS, G., CLAPHAM, P.R., PICARD, L. et al. 1997. Potent inhibition of HIV-1 infectivity in macrophages and lymphocytes by a novel CCR5 antagonist. Science. 276:276-278. - SMITH, M.W., DEAN, M., CARRIGTON, M. et al. 1997. Contrasting genetics influence of CCR2 and CCR5 variants on HIV-1 infection and disease progression. Science. 351:14-18. - SOILLEUX, E., BARTEN, J.R. and TROWSDALE, J. 2000. Cutting edge: DCSIGN; a related gene, DC-SIGNR; and CD23 form a cluster on 19p13. J. Immunol. 165:2937-2942. - SPEHAR, T. and STRAND, M. 1994. Cross reactivity of anti human immunodeficiency virus type 1 gp41 antibodies with human astrocytes and astrocytoma cells lines. J. Virol. 68:6262-6269. - SRINIVASAPPA, J., SAEGUSA, B.S., PRABHAKAR, M.K., GENTRY, M.J., BUCHMEIER, T.J., WIKTOR, H., KOPROWSKI, M.B., 1986. Oldstone and A.L. Notkins.Molecular mimicry: frequency of reactivity of monoclonal antiviral antibodies with normal tissues. J. Virol. 57:397-401. - STEBBING, Justin., GAZZARD, Brian and DOUECK, Daniel. 2004. The New England Journal of Medicine. Where Does HIV Live? Volume 350:1872-1880. - SU, VS, KB GURNEY and LEE, B. 2003. Sugar and Spice: Viral Envelope-DCSIGN Interactions in HIV Pathogenesis. Current HIV Research. Vol. 1 No.1. 8789. 82 - TOGGAS, S., MASLIAH, E., ROCKENSTEIN, E., RALL, G. and MUCKE, Cal. 1994. Central nervous system damage produced by expression of the HIV-1 coat protein gp120 in transgenic mice. Nature. 367: 188-93. - TRAN, M.K., FREDJ, G. and MAURISSON, G. 1991. Molecular mimicry between HIV-1 gp120 third variable loop V3 and arthropod (scorpion and spider) neurotoxins, whose receptor is a sodium channel (Abstract). Presented at the 4th International Workshop on Therapeutic Trials in Cancer and AIDS. París. - TRUJILLO, J.R., McLANE, M.F., DELAMONTE, S., NAVIA, B., BRAIN, J.D. and ESSEX, M. 1996. Molecular mimicry in HIV-1 neuropathogenesis: human antibodies that bind to gp120 V3 loop and human brain proteins. J. Neurovirology. 2:21 - TRUJILLO, J.R., McLANE, M.F., LEE, T.H. and ESSEX, M. 1993. Molecular mimicry between human immunodeficiency virus type 1 gp120 V3 loop and human brain proteins. J. Virology. 67:7711-7715. - TRUJILLO, J.R., ROGERS, R.A. and BRAIN, J.D. 1998. Share antigenic epitopes on the V3 loop of HIV-1 gp120 and proteins on activated human T cells. Virology. 246:53-62. - TRUJILLO, J.R., McLANE, M.F. and ESSEX, M. 1994. Molecular mimicry between the V3 loop of HIV-1 gp120 an the neuronal protooncogene N-myc. Neurology. 44:396. - TRUJILLO, J.R., ESSEX, M. and BRAIN, J.D. 2000. HIV-1 Molecular mimicry and neuronal apoptosis. J. Neurovirology. 6:257. - TRUJILLO, J.R., WANG, W.K., ESSEX, M. and LEE, T.H. 1996. Identification of envelope V3 loop as a determinant of CD4 negative neuronal cell tropism for HIV-1. Virology. 217:613-617. - TRUJILLO, J.R., GOLETIANI, N.V., BOSCH, I., KENDRICk, C., ROGERS, R., TRUJILLO, E.B., ESSEX, M. and BRAIN, J.D. 2000. The T tropic sequence of the V3 loop is critical for HIV-1 infection of CXCR4 positive colonic HT29 83 epithelial cells. JAIDS Journal of Acquired Immune Deficiency Syndromes. 25:1-10. - TURNER, B. and SUMMERS, M. 1999. Structural biology of HIV. J Mol Biol. 285(1): 1-32. - VAN KOOYK, Y. and GEIJTENBEEK, T.B.H. 2003. DC-SIGN: Escape Mechanism for Pathogens. Nature reviews, Immunology, September. Vol 3: 697-709. - WARD, S. and WESTWICK, J. 1998. Chemokines: Understanding their role in T-lymphocyte biology. Biochem J. 333: 457-70. - WEISSMAN, D. and FAUCI, A. 1997. Role of Dendritic Cells in Immunopathogenesis of Human Immunodeficiency Virus Infection. Clinical Microbiology Reviews. 358-367. - WU, P., PRICE, P., DU, B., HATCH, W. and TERWILLIGER, E. 1996. Direct cytotoxicity of HIV-1 envelope protein gp120 on human NT neurons. Neuroreport. 7(5): 1045-9. - YANG, OO. 2003. Will be able to spot an effective HIV-1 vaccine? Trends in Immunology. 24:67-72. - ZAMBRUNO, G., GIANNETTI, A., BERTAZZONI, U. and GIROLOMONI, G. 1995. Langerhans cells and HIV infection. Immunol Today. 11:520-524. 84