Document
Anuncio
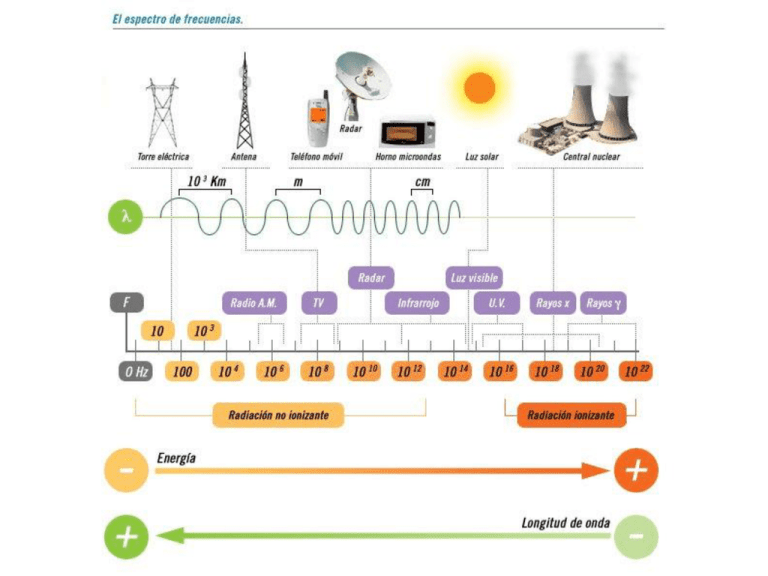
Espectroscopia: estudio de la radiación electromagnética emitida u absorbida por las sustancias. De importancia vital para la identificación y caracterización de compuestos. • EL DESCUBRIMIENTO DEL NÚCLEO ATÓMICO • • El modelo atómico planetario • Este modelo de átomo sería inestable, por que los electrones emitirían radiación al estar sujetos a una aceleración. No obstante esto, haremos algunos cálculos sobre este modelo. • • En este modelo, un electrón de masa m, con carga –e y con velocidad v giraría alrededor del núcleo, con carga Ze. La energía total sería la energía cinética del electrón Ec 1 mv 2 2 (1) más la energía potencial eléctrica V qq' r reemplazando q = Ze y q’ = -e Ze 2 V r (2) Sumando (1) y (2) obtenemos la energía total 1 2 Ze 2 E E c V mv 2 r (3) Las líneas de puntos representarían el movimiento del electrón en ausencia de fuerzas (rectilíneo). Como en cada punto de su trayectoria se ejerce una fuerza central sobre él, se mueve en círculo. El electrón está sujeto a un movimiento acelerado, pues se ejerce sobre él una fuerza eléctrica perpendicular a su movimiento alrededor del núcleo. Fe ma (4) donde a es la aceleración centrípeta v2 a r (5) y Fe la fuerza coulombiana de atracción entre el núcleo y el electrón Ze 2 Fe 2 r (6) Sustituyendo (5) y (6) en (4) Ze 2 mv 2 2 r r Simplificando una r Ze 2 mv 2 r (7 ) Esta es la ecuación fundamental del modelo planetario, que expresa la relación entre las velocidades y los radios de las órbitas electrónicas. Mientras menor es el radio mayor es la velocidad del electrón. Comparando con las ecuaciones (1) y (2), es claro que la ecuación fundamental del modelo planetario puede expresarse como una relación entre la energía cinética y la potencial V 2 Ec (8) Expresión conocida como “teorema virial” El teorema virial nos permite escribir la energía total en función sólo de la cinética o sólo de la potencial. 1 E Ec V Ec 2 Ec Ec mv2 2 (9) o bien Ze 2 E E c V V / 2 V V / 2 2r (10) Cálculos con el modelo planetario a) a) Calcule la energía total, en aJ, para el átomo de hidrógeno en el modelo planetario si r = 1 Å b) b) ¿Cuál sería la velocidad del electrón? c) c) Calcule el radio al que giraría el electrón del átomo de hidrógeno si fuera a una velocidad de 1 × 106 m/s. a) a) Emplearemos la ecuación (10) con Z=1 Ze2 (8.99 109 Nm2 / C2 )(1)(1.60211019 C) 2 E 2r 2(110-10 m) E 1.154 10 18 J -1.154 aJ b) b) De la ecuación (9) 2(1.154 10 18 J) 2E 1 / 2 v( ) 1.592 10 6 m/s -31 m 9.1 10 kg c) c) Despejando r de la ecuación (7) Ze 2 (8.99 10 9 Nm 2 / C 2 )(1)(1.6021 10 19 C) r mv 2 (9.1 10 -31 kg)(1 10 6 m/s) 2 r 2.53 1010 m 2.53A ¿Cuál es la frecuencia a la que gira el electrón en el modelo planetario? La frecuencia se define como el número de ciclos que da el electrón en la unidad de tiempo y puede calcularse como la velocidad angular (en radianes/s) entre 2 (número de radianes por ciclo): f rad/s rad/ciclo 2 (11) La velocidad angular está relacionada con la velocidad lineal por la ecuación: v r Dividiendo entre r2 la ecuación (7), obtenemos Ze 2 r3 v2 m 2 r De donde 1/ 2 v Ze 3 r mr 2 Sustituyendo esta ecuación en (11), alcanzamos finalmente 2 1/ 2 1 f 2 Ze 3 mr (12) a) Calcule la frecuencia orbital de un electrón en el átomo de hidrógeno para r = 1 Å b) Repita el cálculo para r = 2 Å a) d) Indique qué sucede con r, v y f si E decrece o si E crece. a) a) Respuesta f 2.533 1015 s -1 b) b) Respuesta f 8.956 1014 s-1 c) c) Con las ecuaciones desarrolladas, podríamos arribar a la siguiente tabla de valores E (aJ) -0.5769 -1.1537 r (Å) 2 1 v × 10-6 (m/s) 1.126 1.592 f × 10-14 (s-1) 8.956 25.33 Por lo tanto que si E decrece (y el átomo pierde energía) r también decrece (se acerca al núcleo), pero v y f crecen. Por el contrario si el átomo gana energía, el electrón se aleja del núcleo y orbita más lentamente. El problema de este modelo es que el electrón emite radiación electromagnética de una frecuencia igual a la frecuencia a la que oscila el electrón, f. Por ejemplo, si orbita a 2 emite radiación de frecuencia 8.9561014 s–1(cercana al violeta). Pero debido a ello pierde energía, con lo cual orbita ahora a menor radio. A ese nuevo radio vuelve a emitir radiación, ahora de mayor frecuencia (ultravioleta), con lo cual orbita a menor radio, hasta que se precipite sobre el núcleo. El modelo planetario clásico predice que el átomo es inestable. Niels Bohr no desechó el modelo planetario del átomo, sino que incluyó en él restricciones adicionales. Para empezar, negó el resultado clásico de que una partícula cargada emitiría radiación al acelerarse. Bohr extendió al átomo el resultado de la cuantización del cuerpo negro de Planck: “El proceso de absorber o emitir radiación por un átomo sólo puede realizarse discontinuamente. La cantidad de energía radiada, Er (de frecuencia ) debe ser igual a nh. Er nh con n 1,2,3... “Cuando el átomo no absorbiera ni emitiera radiación, se encontraría en un estado estacionario con una energía, E, constante.” Bohr consideró un proceso en el que inicialmente núcleo y electrón estuvieran infinitamente separados y en reposo, hasta alcanzar un estado estacionario de energía E. Er ( E Ei ) E Al enlazarse un electrón desde el infinito hasta un estado estacionario, Bohr sugirió que se emitía una radiación homogénea cuya frecuencia era igual a la mitad de la frecuencia orbital del electrón f. La siguiente suposición de Bohr fue que dicha energía radiante consistiría de una sola frecuencia , que sería exactamente la mitad de la frecuencia a la que orbitaría el electrón en su estado estacionario final. Er E nh nhf 2 Colocando ahora la frecuencia en función de la energía de la ecuación (13) 1/ 2 3/ 2 nh 2 ( E ) E 2 1/ 2 2 Ze m De donde podemos despejar E como 2 2 2 Z 2e 4 m E con n 1,2,3,... n2h2 (14) La cual es la expresión del modelo de Bohr para la energía de los estados estacionarios del átomo de hidrógeno. Para calcular los radios de las órbitas del modelo de Bohr, hacemos uso de la ecuación (10) del modelo planetario Ze2 E 2r (10) De donde n2h2 r 2 4 Ze2 m (15) Y, de la ecuación (9) del modelo planetario obtenemos el valor de v: 1 E mv2 2 (9) como 2E v m 1/ 2 2 Ze 2 v nh (16) La variable de movimiento que adquiere la expresión cuantizada más simple es la cantidad de movimiento angular: Lr p Que para un movimiento circular es un vector perpendicular a la trayectoria, de magnitud L = mvr Para el modelo de Bohr, sustituyendo r y v de las ecuaciones (15) y (16), obtenemos: 2 Ze 2 L mvr m nh n 2 h 2 h 2 n 2 2 4 kZe m (17) Vemos que la cantidad de movimiento angular es, simplemente, un múltiplo entero de la constante de Planck entre 2. El modelo vía la cuantización de la cantidad de movimiento angular A partir de 1913, al darse cuenta de la simpleza de la expresión de la cuantización del momentum angular, Bohr propuso un modelo atómico con postulados. PRIMER POSTULADO. Los átomos monoelectrónicos (H, He+, Li2+, Be3+,…) están constituidos por un núcleo, de carga Ze, con masa M, y por un electrón que gira alrededor de él en una órbita circular de radio r, con carga –e y masa m. SEGUNDO POSTULADO. La cantidad de movimiento angular, L, del átomo está cuantizada. De los infinitos movimientos orbitales posibles, de acuerdo con el primer postulado, sólo son posibles aquellos para los cuales el momentum angular sea un múltiplo entero de h/2. El primer postulado introduce en el modelo la masa reducida del sistema electrón–núcleo Mm M m Para el átomo de hidrógeno, para el cual el núcleo (protón) pesa 1836.1 veces los que el electrón: 1836.1m 2 H 0.9994557m 1837.1m La ecuación de fuerza=masa x aceleración queda ahora como: Ze2 r v 2 (1) Pero en esta ocasión no es como en el modelo planetario, donde v y r toman infinitos valores, pues debe cumplirse el segundo postulado, que representa una segunda ecuación con r y v como variables vr n h 2 (2) La resolución simultánea de las ecuaciones (1) y (2) nos lleva a las ecuaciones del modelo de Bohr EL MODELO DE BOHR El modelo vía la cuantización de la cantidad de movimiento angular Se obtienen cambios menores respecto a las ecuaciones del modelo original, ya presentadas, tomando el lugar de la masa del electrón, m: n2h2 rn Ze 2 (3) 2 2 2 Z 2 e 4 En n2h2 2 Ze 2 vn nh Ln h 2 (5) (2) (4) El éxito del modelo de Bohr se da al reproducir la ecuación de Rydberg para el espectro del átomo de hidrógeno. TERCER POSTULADO. Las órbitas determinadas por el segundo postulado son estacionarias, es decir, el átomo no radía cuando se encuentra en una de ellas. Sólo cuando el átomo cambia de un estado (1) con mayor energía a otro (2) con menor, se emite radiación monocromática cuya frecuencia vale E n1 E n 2 h Empleando la ecuación (4) para En y la ecuación c Llagamos a la siguiente expresión para los números de onda de la radiación emitida en el espectro de emisión del hidrógeno: 2 2 2 Z 2 e 4 1 1 n 2 n 2 ch 3 1 2 De donde la constante de Rydgerg se identifica como 2 2 2 Z 2 e 4 RH 10967748 m -1 3 ch La cual es prácticamente igual al valor de la constante: RH = 10967758.1 m-1








