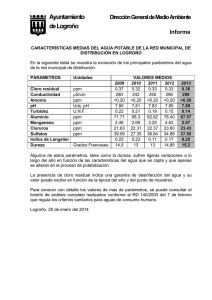
informe final_texto - Universidad Nacional del Callao.
Anuncio

II).- RES UMEN El objetivo del desarrollo del presente Texto Universitario titulado: “OPERACIONES Y PROCES OS DE TRATAMIENTO DE AGUA CRUDA PARA LA OBTENCION DE AGUA POTABLE”, es que tenga utilidad como texto de consulta, dentro de la formació de los estudiantes de de la Carrera de Ingeniería Química, así como bién a los interesados en el tema, constituyendo un complemento a las enseñanzas impartidas en el aula. Para el desarrollo del presente texto se ha basado en la consulta de la Bibliografía que se indica en los Referenciales que contiene el presente texto, así como también en la experiencia profesional del autor obtenida en las diferentes empresas del rubro durante las visitas técnicas hechas con los est diantes, para que también el estudiante pueda aplicarlos conociendo la teoría y la parte experimental. El texto comprende los siguientes capítulos: Capitulo I : Ciclo Hidrológico del Agua . Capitulo II : Biología de las Aguas. Capitulo III : Calidad y Características del agua Potable. Capitulo IV : Tratamiento de Potabilización del Agua. Capítulo V : Coagulación Floculación Capítulo VI : Sedimentación Capítulo VII : Filtración : 1 III).- INTRODUCCION El desarrollo del presente texto se adecúa a las características que se necesita en el campo de la Ingeniería Química, donde su contenido en el cual se establecen la base de conocimi ntos, aptitudes y habilidades que más adelante los aplicarán en su queha iario de su vida profesional así como durante su época estudiantil. Basado en la experiencia profesional se definen los co ceptos básicos en forma metodológica y clara entendible por el estudiante. Tomando como criterio principal las características de las aguas así como sus principales análisis químicos necesarios para su respectivo tratamiento, tales como propiedades físicas, dureza, alcalinidad, oxígeno disuelto, sólidos disueltos, cloruros, demanda bioquím de oxígeno, demanda bioquímica de nitrógeno y otros que sean necesarios, de tal manera se determina el proceso a seguir durante el tratamiento respectivo para la potabilización del agua. Sabemos que el agua cruda, siempre llega a contaminarse por diferentes medios, así como el aire, efluentes altamente contaminados, efluentes domésticos, industriales, relaves mineros, que contiene cianuros, metales pesados, etc., razón por la cual se ne que realizar siempre los análisis respectivos. Se hace conocer los ntes reactivos químicos que se utilizará durante los análisis químicos para 2 establecer las características del tipo de agua a tratar, tanto como la dosificación de éstos. Conociendo las características del agua, se determina y se diseña el proceso para el tratamiento del agua, conociendo el flujo, y sus principales características a fin de establecer el tamaño de Planta, considerando los equipos, tanques, materiales y las re pectivas operaciones que se han de desarrollar. Finalmente, se establece el diagrama de flujo para todo el sistema de potabilización del agua y que durante el desarrollo se hagan los controles necesarios de calidad para todos los parámet os de procesos y operaciones. El estudiante estará familiarizado con la diferentes ecuaciones y leyes que controlan la calidad del producto así como también la solución de problemas. 3 IV).- MARCO TEORICO CAPITULO I 1. CICLO HIDROLOGICO DEL AGUA . OBJETIVOS : Ø Tener conocimiento de las diferentes calidades de agua cruda, teniendo en cuenta sus orígenes. Ø Diferenciar por su contenido de cada una de las aguas existentes para su tratamiento respectivo. Ø Conocer que tipo de tratamiento debe darse para su res ctiva potabilización. 1.1 CICLO DEL AGUA Desde sus inicios de ta existencia de la Tierra, uno de los elementos que es importante para la vida humana y todos los seres vivientes, se han mantenido sin variación y constante desde la aparición de la humanidad, ha sido el agua bajo sus tres estados: sólido, líquido y gaseoso. El agua de la Tierra - que constituye la hid ros fera - se distribuye en tres reservorios principales: los océanos, los continentes y la atmósfera, entre los cuales existe una circulación continua - el ciclo del ag ua o c iclo hidro ló g ico . El movimiento del agua en el ciclo hidrológico es mantenido por la energía radiante del sol y por la fuerza de la gravedad. El ciclo 4 hidrológico se define como la secuencia de fenómenos por medio de los cuales el agua pasa de la superficie terrestre, en la fase de vapor, a la atmósfera y regresa en sus fases liquida y sólida. La transferencia de agua desde la superficie de la Tierra hacia la atmósfera, en forma de vapor de agua, se debe a la evap oración directa, a la trans p iración por las plantas y animales y por s ub limación (paso directo del agua sólida a vapor de agua). La cantidad de agua movida, dentro del ciclo hidrológi o, por el fenómeno de sublimación es insignificante en relación a las cantidades movidas por evaporación y por transpiración, cuyo proceso conjunto se denomina ev apotrans piración EL CICLO HIDROLÓGICO DEL AGUA Fig. ? 1.1 5 El vapor de agua es transportado por la circulación atmosférica y se condensa luego de haber recorrido dis ancias que pueden sobrepasar los 1,000 km. El agua condensada da ugar a la formación de nieblas y nubes y, posteriormente, a la precipitación. En nuestro medio la corriente peruana de Humboldt transpo vapores producidos por los rayos solares sobre las aguas del m , hacia las cordilleras, donde se condensan y precipitan en forma lluvias o en forma sólida que son las nieves (estructura cristalina) o granizos (estructura granular), y estos a su vez forman los ríos, lagos y durante la escorrentía el agua se va contaminando con diferentes lementos. El agua que precipita en tierra puede tener varios destinos. Una parte es devuelta directamente a la atmósfera por evaporación; otra parte escurre por la superficie del terreno, escorrent superficial, que se concentra en surcos y va a originar las líneas de agua El agua restante se infiltra, esto penetra en el interior del suelo; esta agua infiltra puede volver a la atmósfera por evapotranspiración o profundizarse hasta alcanzar las capas freáticas. Tanto el escurrimiento superficial como el subterráneo van a alimentar los cursos de agua que desaguan en lagos y en océanos. La escorrentía superficial se presenta siempre que hay precipitación y termina poco después de haber terminado la precipitaci . Por otro lado, el escurrimiento subterráneo, especialm e cuando se da a través de medios porosos, ocurre con gran lentitud y sigue alimentando los cursos de agua. Así, los cursos 6 agua alimentados por capas freáticas presentan unos caudale más regulares. Los procesos del ciclo hidrológico discurren en la atmósfera y en la superficie terrestre por lo que se puede admitir dividir el ciclo del agua en dos ramas: aérea y terrestre. El agua que precipita sobre (os suelos va a repartirse, a su vez, en tres grupos: una que es devuelta a la atmósfera por evapo trans pirac ió n y dos que producen escurrimiento s uperficial y s ubterráneo . Esta división está condicionada por varios factores, u de orden climático y otros dependientes de las características ísicas del lugar donde ocurre la precipitación. 1.2 CLASES DE AGUA: En referencia a las clases de agua que existen en la naturaleza se consideran los siguientes: 1.- Agua de lluvia 2.- Agua de río 3.- Agua de manantial 4.- Agua subterránea 5.- Agua de laguna 6.- Agua termal 7 7.- Agua potable 8.- Agua desionizada 9.- Agua destilada 10- Agua Residual 11.- Agua doméstica 12.- Agua blanda 13.- Agua industrial 14.- Agua destilada, bidestilada, tridestilada. 15.- Agua Osmótica 1.2.1 AGUA DE LLUVIA: El agua de lluvia a través por su paso por la atmósfera disuelve el CO2 (corrosivo); el O2 (corrosivo), polvos (sulfuro de Fe) y algunos microorganismos. 1.2.2 AGUA DE RIO: Recibe el agua previamente de las minas que votan en el relave, ácidos inorgánicos. También metales pesa s, Cd, Cr. También sólidos en suspensión, aguas servidas, acidas. Contaminantes de efluentes electrolíticas, efluentes 8 de curtiembres conteniendo Cromo, compuestos orgánicos, componentes nitrogenados, etc. 1.2.3 AGUA DE POZO: Agua que no tiene sólidos en suspensión, totalmente clara cristalina, no tiene CO2 raras veces en bajo contenido. 1.2.4 AGUA DE MANANTIAL: Posiblemente sea blanda, porque probablemente en su camino se ha encontrado con aluminatos. 1.3 TURBIDEZ: Sólidos en suspensión que llegan al agua tanto finos como gruesos. Se miden en ppm en un rango de 0 -60000 ppm. Ejm: El agua de pozo tiene 0 ppm de turbidez. El agua de rio turbulento tiene 60000 ppm de turbidez, (Rió Huallaga, Marañón, Ucayali). El agua de Sedapal tiene de 15 a 20 partes por millón (pp ) de turbidez. 1.4 COLOR Se mide con unidades comparativas con una muestra patrón. El H2O disuelve ó saca el color de la materia orgánica generalmente de las plantas. En las bebidas gaseosas se usan 10 unidades de color. 9 1.5 DUREZA: La dureza se expresa como dureza permanente, temporal y a la suma de las dos se expresa como dureza total, la dureza está dada por las sales de Ca y Mg en sus combinaciones como sulfatos, como carbonatos ( esto da la dureza permanente). La fuerza temporal lo dan los bicarbonatos ( cuando se ca enta el bicarbonato nos da el CO2 ), se mide en partes por millón. 1.6 ACIDEZ INORGÁNICA: Producido por las minas, en sus desechos de aguas servidas, arrojan H2 S04 (corrosivo), también las chimeneas de algunas fábricas producen H2 S04 generándose la acidez por las lluvias. 1.7 FLUOR: El flúor es un elemento relativamente abundante en la naturaleza y forma compuestos con la mayoría de los elementos, excepto los gases nobles helio, argón y neón. Su nombre fue sugerido a Sir Humphry Davy por A. Ampere en 1812. Sin embargo, fue posible aislarlo a principios del siglo XX, trabajo realizado por Ferdinand Fréderic Henri Moissan, Premio Nobel en 1906. El problema era que este elemento es el más electronegativo y, por lo tanto, su ion es el más difícil de oxidar. El flúor es un elemento muy tóxico y reactivo. Muchos de sus 10 compuestos, en especial los inorgánicos, son también t icos y pueden causar quemaduras severas y profundas.En muchos países, el fluoruro se agrega intencionalmente al suministro de agua, pasta dentífrica y a veces otros productos para revenir las caries. Se ha sabido durante mucho tiempo que la ingesta de fluoruros en forma excesiva tiene efectos tóxicos seri s. Por eso los científicos están debatiendo ahora si fluorar el a ua confiere un beneficio a largo plazo. El fluoruro fue utilizado por primera vez en la prevención de caries en la década de 1940, y su ectividad es defendida en dos áreas: 1. El fluoruro inhibe las enzimas que producen ácidos en s bacterias de la placa dental. Esta observación es váli pero algunos científicos creen ahora que el impacto dañino del fluoruro en otras enzimas útiles pesa más que el efecto beneficioso de la prevención de caries. 2. Los iones de fluoruro se ligan a los iones del calcio, fortaleciendo ei esmalte del diente en los niños.A continuación explicaremos químicamente lo que sucede en el segundo punto: La hidroxíapatita, cuya fórmula es Ca5 (P04)3 OH, es un fosfato básico de calcio y forma parte de los dientes. Un cristal de hidroxíapatita puede variar su composición mediante un proceso de intercambio iónico. Los iones 11 hidroxilo pueden intercambiarse con iones fluoruro pudiendo modificar, de este modo, un tercio del total de los iones originales. También es posible reemplazar los iones hi oxilo por iones carbonato. El ion calcio puede ser intercambiado por ion magnesio. Cuando los iones que se incorporan al cristal son iones fluoruro, el cristal resultante es m cho menos soluble que la apatita sin flúor. Se ha demostrado que 1 ppm de iones fluoruro en el agua potable hace disminuir las caries dentales en forma ostensible. Los cristales de hidroxíapatita del esmalte tienen la forma de prismas hexagonales cuyo diámetro es aproximadamente de 0,05 A2. Son más largos que los cristales de hidroxíapatita de la dentina y del cemento. El “streptococo mutans” e el principal microorganismo de la flora bacteriana, cuyas enzimas metabolizan rápidamente los hidratos de carbono, en especial la sacarosa. Los ácidos orgánicos, subprod s de este metabolismo bacteriano, disminuyen el pH a 5,4. Este es el nivel crítico que incide en la disolución de los cristales de hidroxiapatita. Se produce la ruptura del esmalte: 5Ca+2 + 3PO4 - 3 + OH- Ca5(PO4)3 OH 5Ca+2 + 3PO4 -3 + 2OH- + 5H+ = 2Ca+2 + 3CaHPO4 2H2 O Según la teoría de la quelación, el anión lactato se coordina con el calcio formando estructuras queladas. 12 10F ---------------- 5CaF2 + 3P04+3 + OHSe puede decir que los iones de lactato tienen la capa idad de solubilizar la apatita de los dientes. Ahora bien, cua do se ingiere fluoruro en concentraciones bajas (1 ppm), la hidroxiapatita se transforma en fluorapatita según la siguiente reacción: Ca5(P04)3 OH + F Ca5(P04)3F + OH- El valor límite permisible en el agua de bebida es de ,5 mg/Lt. Como máximo para que no se a tóxico. Se ha demostrado que un rango de 0,5 ppm de fluoruro a 20°C y 1,5 ppm a 10°C, son las concentraciones óptimas para proteger la dentadura de población infantil. Las concentraciones superiores tienen efecto acumulativos en los tejidos provocando el envenenamiento crónico conocido como fluorisis. 1.8 S ÍLICE : (S iO2 ) Fo to N° 1.1 : Cris tal de la hidroxiapatita Fuente :www.inteligenciaartificial.cl/ciencia/biologia/bioquimica/fluor_agua_potable.htm 13 Rango de 0 - 100 ppm. Es un elemento indispensable para la formación del CALICHE, (que son incrustaciones vitreas muy duras que se encuentran en las tuberías de los interca bíadores de calor, en las calderas, etc.). 1.9 FIERRO : Fe El Fe se encuentra se encuentra generalmente en las aguas subterráneas como bicarbonatos. El % máximo de Fe debe contener el agua es de 0.3 ppm. 1.10 ClNa y CIK: Son sales solubles, pero en altas concentraciones se precipita y producen vapor húmedo (barros). La presencia de estas sales malogran la calidad del agua. 1.11 CO2 : Es sumamente corrosivo, la cantidad máxima es de 50 ppm. El CO2 es un aliado del O2 y destruyen todos los equipos. Ejemplo: el agua de río contiene entre 40 y 50 ppm.; el agua de pozo puede estar entre 0 a 50 ppm. 14 1.12 INCRUS TACIONES O CALICHE Sulfatos de calcio y magnesio o también silicatos de calcio y magnesio pueden estar acompañados de hidróxidos de cal magnesio. Fig . ? 1.2 AGUA CALICHE 900 °F ACERO Q El acero sufre recalentamiento, debido a la formación 1.13 caliches Incrus tació n La formación de incrustaciones en el interior de las calderas suelen verse con mayor frecuencia que lo esti do conveniente. El origen de las mismas está dado por las sales presentes en las aguas de aporte a los generadores de vapor, las incrustaciones formadas son inconvenientes debido a qu poseen 15 y una conductividad térmica muy baja y se forman con mucha rapidez en los puntos de mayor transferencia de temperatura. Por esto, las calderas incrustadas requieren un mayor gradiente térmico entre el agua y la pared metálica que las calderas con las paredes limpias. Otro tema importante que debe ser considerado, es la falla de los tubos ocasionadas r sobrecalentamientos debido a la presencia de depósitos, lo que dada su naturaleza, aíslan el metal del agua que los rodea pudiendo así sobrevenir desgarros o roturas en los tubos de la unidad con los perjuicios que ello ocasiona. Las sustancias formadoras de incrustaciones son principalmente el carbonato de calcio , hidróxido de magnes io, s ulfato de calcio y s ílice, esto se debe a la baja solubilidad que presentan estas sales y algunas de ellas como es el caso del sulfato de calcio, decrece con el aumento de la temper ura. Estas incrustaciones forman depósitos duros muy adhere es, difíciles de remover, algunas de las causas más frecuentes de este fenómeno son las siguientes: Excesiva concentración de sales en el interior de la u idad. • El vapor o condensado tienen algún tipo de contaminación. • Transporte de productos de corrosión a zonas favorables para su precipitación. • Aplicación inapropiada de productos químicos. 16 Las reacciones químicas principales que se producen en el agua de calderas con las sales presentes por el agua de apo te son las siguientes: Ca ++ + 2 HCO3 - Ca+ + + SO4 = CO3 Ca + CO2 + H2 O SO4 Ca++ + SiO3 = - Mg+ + + 2 CO3 H CO3 Mg + CO2 + H2 O ++ (HO)2 Mg + CO2Mg CO3 Mg + 2H2O 1.13.1 SiO3 Ca + SiQ3 —> S¡O3 Mg EFECTOS : Trabaja como aislante del calor (pérdida de energía calorífica). Retiene el calor produciendo tensiones térmicas. EL CALICHE SE PRES ENTA EN DOS FORMAS : a).- Duro : formado por sulfatos de Ca y Mg b).- Blando: Producido por la dureza temporal cuando el bicarbonato se descompone CANTIDAD DE CLORUROS EN LA NEBLINA CUANDO PRECIPITA COMO LLUVIA: DISTANCIA DE LA COSTA PPm. 30 Km 5-7 50 Km 2-3 150 km 0.5 17 TUBOS CON FORMACION DE INCRUSTACIONES Foto 1.2 Fuente: http://www.tecoad.com/cont/dff.shtml 18 CAPITULO II 2. BIOLOGIA DE LAS AGUAS OBJETIVOS : Ø Antes de un tratamiento de agua debe hacerse el análisis microbiológico de las aguas a fin de eliminarlos sobre todo los elementos patógenos para el hombre Ø Conocer métodos de eliminación de los microorganismos se va eliminar Ø Hacer los análisis respectivos para conocer los contenidos tanto de sólidos como sólidos disueltos con el objeto de obtene una dureza de acuerdo a las normas de salud. 2.1 CONTAMINACIÓN POR MATERIA ORGÁNICA Y MICROORGANISMOS La mayoría de la materia orgánica que contamina el agua procede de desechos de alimentos, de aguas negras domé cas y de fábricas y es descompuesta por bacterias, protozoar os y diversos organismos mayores. Ese proceso de descomposición ocurre tanto en el agua como en la tierra y se lleva a cabo mediante reacciones químicas que requieren oxígeno para transfo sustancias ricas en energía en sustancias pobres en en gía. El oxígeno disuelto en el agua puede ser consumido por la fauna acuática a una velocidad mayor a la que es reemplazado desde la atmósfera, lo que ocasiona que los organismos acuáticos compitan por el oxígeno y en consecuencia se vea afectada la di tribución de la vida acuática. Una medida cuantitativa de la contaminación del agua por materia orgánica (sirve como nutriente y requiere oxígeno 19 para su descomposición) es la determinación de la rapidez con que la materia orgánica nutritiva consume oxígeno por la descomposición bacteriana y se le denomina Demanda Bioquímica de Oxígeno (DBO). La DBO es afectada por la temperatura del medio, por las clases de microorganismos presentes, por la cantidad y tipo de elementos nutritivos presentes. La DBO de una muestra de agua expresa la cantidad de miligramos de oxígeno disuelto por cada litro de agua, que se utiliza conforme se consumen los desechos orgánicos por la acción de las bacterias en el agua. La demanda bioquímica de oxígeno se expresa en partes por millón (ppm) de oxígeno y se determina midiendo el proceso de reducción del oxígeno disuelto n la muestra de agua manteniendo la temperatura a 20 °C en periodo de 5 días. Una DBO grande indica que se requiere una gran cantidad de oxígeno para descomponer la materia orgánica contenida en el agua. El agua potable tiene una DBO de 0.75 a 1.5 ppm de oxígeno y se considera que el agua está contaminada si la DBO es mayor de 5 ppm. Las aguas negra municipales contienen entre 100 y 400 ppm pero los desechos industriales y los agrícolas contienen niveles de DBO del orden de miles de ppm. La reducción de los niveles de DBO se hace mediante tratamiento de aguas n gras. 2.2 VALORES TÍPICOS DE DEMANDA BIOQUÍMICA DE OXIGENO PARA AGUAS DE DIFERENTES CALIDADES DE AGUA: 20 Tipo d e ag ua DBO mg /L Agua potable 0.75 a 1.5 Agua poco contaminada 5 a 50 Agua potable negra municipal Residuos industriales 100 a 400 5 00 a 10 000 A la descomposición de la materia orgánica en presenci de oxígeno se le llama aerobiosis y es el proceso más eficiente para liberar la energía de la materia orgánica. Por ejemplo, la aerobiosis de la glucosa (C6 H12O6 ) se puede representar mediante la ecuación química: C6 H12 O6 + 6CO2 6H2O DH = - 3600 Cal/g La descomposición aeróbica de las proteínas que contienen nitrógeno y azufre (representadas por la fórmula gener (CxHyOzN2S ) se puede representar mediante la ecuación química no balanceada: CO2 + H2 O + NH4 * + S O42- CxHyOzN2 S + O2 Proteína + oxigeno bióxido de carbono + agua + ion amonio + ion sulfato DH = - 5090 cal/g Cuando la materia orgánica que contamina al agua se ha agotado, la acción bacteriana de la desoxigenación de contaminadas oxida 21 al ion amonio, proceso s aguas denominado nitrificación, se puede representar mediante la ecuaci química iónica: 2 H+ + H2 0 + NO3” NH4 * + 2 O2 ion amonio + oxígeno ion hidrógeno + agua + ion nitrato DH = - 4350 cal/g A los procesos de descomposición bacteriana anaeróbica (en ausencia de oxíg eno) de la materia o rg ánica s e le llama anerobío s is . A la des co mpo s ición anaeróbica (por enzimas producidas por levaduras) de los carbohidratos o azúcares se le llama fermentación y a la descomposición bacteriana anaeróbica de las proteínas se le llama putrefacción. La fermentación de un azúcar por enzimas de levaduras, por ejemplo de la glu se puede representar en términos generales, mediante la ecuación química: C6 Hi2 O6 + enzimas de levadura —> 2 CO0 + 2 CH3-CH2 -OH Glucosa Alcohol etílico o etanol La putrefacción de las proteínas puede representarse mediante la ecuación química no balanceada: CxHyOzN2 S + H2 O —bacterias —> CO2 + CH4 + H2 S + NH4* Pro te ina + ag ua —> dióx ido de carbo no + me tano + s ulfuro de hidró g e no + io n amon io DH = - 368 cal/g 22 Se puede observar que se libera mayor cantidad de energía en la aerobiosis que en la putrefacción. En el proceso de putrefacción, como el metano es insol ble en agua se libera en forma de gas. El sulfuro de hidrógeno es un gas incoloro, de mal olor (a huevo podrido) y tóxico (en concentraciones de 5 % es nocivo para la vida), por lo que la putrefacción desprende olor fétido y los peces y otros animales que requieren oxigeno no pueden vivir en aguas contaminadas donde ocurra la putrefacción (se le considera la forma peor de contaminación bacteriana). 2.3 CONTAMINACIÓN DEL AGUA POR MICROORGANISMOS PATÓGENOS Por regla general, se considera que el agua es aceptab para beber si: 1).- Contiene menos de 10 bacterias intestinales en cada litro de agua; 2).- 3).- Si no presenta mal sabor, olor, color o turbiedad; Si no contiene impurezas químicas en concentraciones q puedan ser peligrosas para la salud del consumidor; 4).- Si no son corrosivas con respecto al sistema de conducción del agua, y 5).- Si no provienen de sistemas acuíferos sujetos contaminación por aguas negras u otros contaminantes. 23 a El hombre vive en relación íntima con los microorganismos sobre su piel y en su sistema digestivo. En estado de salud, los humanos y los microbios viven juntos para beneficio mutuo. Sin embargo, algunas personas sa viven en armonía con organismos que pueden resultar patógenos para otros. Por ejemplo, algunas personas están adaptadas a las aguas con bacilos que provocan disente en otras personas Las bacterias coliformes son microorganismos inofensivos para el hombre y residen en su intestino g ueso y abundan en la materia fecal. Forman parte de los desec os de las aguas negras y no se desarrollan en el agua, de manera que un recuento de las bacterias coliformes constituye un indicio del grado de contaminación de es s aguas. Se considera que el número de microorganismos portadores de enfermedad en el agua es proporcional al número total de microorganismos y que una cantidad total baja representa un menor riesgo de contraer una enfermedad. Sin embargo, se han dado casos en que enfermedades virales han sido trasmitidas por aguas que cumplen estrictamente con las normas de control de bacterias. Por consiguiente, la presencia de que cualquier impureza típica de las aguas negras, inclusive si no son perjudiciales en sí mismas, implica que el agua en que se encuentran no deja de ser fuente peligrosa de enfermedad. 24 El agua contaminada puede estar sucia, mal oliente, ser corrosiva, de mal sabor o poco apta para lavar la con ella. Sin embargo, para el hombre el efecto más perjudicial del agua contaminada ha sido la transmisió de enfermedades por microorganismos que pueden habitar en ella. Por ejemplo, la fiebre tifoidea causada por la bacteria salmonella typhi, el cólera causada por la bacteria Vibrio cholerae (1), la disenteria provocada por parásitos como las amibas Entamoeba histolitica (2) y la bacteria Shigella, la gastroenteritis causada por virus, bacterias y protozoarios, la hepatitis infecciosa causada por el virus de la hepati y la poliomielitis causada por el virus de la poliomielitis. Foto ? 2.1 Foto N° 2.2 Vibrio cholerae (1), Entamoeba histolitica (2) Fuente: http://www.sagan-gea.Org/hojared_AGUA/paginas/16agua.html 25 2.3.1 LLUVIA El agua de lluvia a través por su paso por la atmósfer arrasa los microorganismos que hay en suspensión, el agua superficial ( ríos, lagos, arroyos, etc.) es por natur za un portador de materia orgánica, en estado natural o en descomposición contiene dentritos ( orina, heces ) de humanos y animales. Se pueden encontrar organismos en el agua, desde vertebrados hasta virus. Los organismos pertenecientes al reino vegetal que tienen mayor interés desde el punto de vista de tratamiento de aguas son las algas y las bacterias. 2.3.2 ALGAS : Las algas viven en agua dulce muy especialmente en las lagunas de oxidación, son microscópicas. Las algas contiene clorofilas y solo viven a una profundidad hasta donde penetran los rayos solares. Las algas a menudo tienen colores que lo catalogan. 2.3.3 CLAS IFICACIÓN 1. Clo ro fíc eas : Son de color verde hay especies monocelulares y multicelulares que dan al agua olores ícticos (olor pescado). 2. Las ciano fíceas : 26 Son de color azula verdoso son unicelulares y multicelulares, dan al agua olores muy desagradables, producen por su abundancia una nata que obstruyen la oxigenación del agua. 3. Bas ilacrios fícea ó diato meas : Son células mono celulares con un color amarillo verdoso y dan olores aromáticos o sino ícticos. 2.3.4 BACTERIAS S UPERIORES : Otros organismos que nos interesan son las bacterias en el reino animal. Las bacterias superiores: Son del género: 1. Bac teria S phaerotilus Creno thyny: Están relacionados con el Fe y Mn en el agua. 2. Bac terias Bagg iatoa: Están relacionados con los grupos sulfurosos. 2.3.5 BACTERIAS INFERIORES : Son los patógenos del hombre,, tenemos los coliformes y los streptococos. Tenemos las bacterias coliformes y streptococos que se utilizan como índice 27 contaminación fecal. Los organismos más importantes en el reino animal pueden ser los patógenos y entre ellos los más importantes son los Endamoeba Histolíptica que produce la amodiacis o disentería amibiana. 2.4 COLIMETRIA: Es un método de investigación de gérmenes del tipo de coliformes fecales. La contaminación fecal de las agua se aprecia determinando la presencia de microbios cuyo ambiente natural es el intestino del hombre y de los animales. La presencia de Coliformes.Perteneciente a la familia enterobacteriácea que son bacilos gran negativo de crecimiento anaerobio no esporulado que fermentan rápidamente la lactosa ( 2 4 - 48 horas) con producción de gas que determina la calidad del agua. El resultado se expresa como número más probable (NMP) de gérmenes del tipo de coli por 100 ce. de agua. Un agua potable de buena calidad no d be tener más de 1 a 2 gérmenes por 100 ce. como término medio e l mes. Es decir que la muestra de agua debe cumplir las condiciones desde el punto de vista bacteriológico, lo siguiente: 1.- Límite de la frecuencia con que aparecen el grupo coliforme. 2.- La densidad de bacilos de este grupo debe cumplir con l siguiente: a) Cada muestra debe tener 5 tubos con proporciones de 10 mi cada uno. 28 b) Frecuencias: no más del 10 % debe presentar presencia del grupo coliformes por cada mes. C) Densidad: no más del 5 % de tubo muestra de tres unidades positivas. Ejemplo: Determinar si el agua de una muestra cuyo análisis bac eriológico corresponde a 100 muestras de 5 tubos de 100 ce. cada no de agua. Solución: Tubos positivos por muestra 0+ - 1+ - 2+ - 3+ - 4+ - 5+ Número de muestras 90 -4 -2 -2 -1 -1 1.2 colis por 100 ce. Frecuencia: 4x1 + 2x2 + 2x3 + 1x4 + 1x5 = 23 tubos % de tubos positivos: 100 x 23 / 500 = 4.5 % < 10 % ….conforme. 3 Densidad: 2 + 1 + 1 = 4 4 % de muestra: 4 x 100/100 = 4 < 5 % ....El agua es buena o sana. 5 Bacilos en 100 cc.. Tabla 2.1 Ne g ativo 5 4 3 2 1 0 Pos itivo 0 1 2 3 4 5 5 porc ione s de 10 c c Menor de 2.2 2.2 5.1 9.2 16.0 Más de 16 Fue nte: Elabo ración propia NUMERO DE POS ICIONES 29 NMP 2.5 TECNICA DEL METODO PRES UNTIVO: Demostrar que el agua tiene presencia de gérmenes fermentados de lactosa. Se realiza mediante la siembra de tres tubos mediante el caldo de lactosa en tubos con una campana invertida que permita acumular gas y leer en el tubo. Ag ua con tratamiento de clo ro : 1.- 5 tubos ( 50 ce de caldo de lactosa ) con 100 cc de agua 2.- 1 tubo ( 10 ce de caldo de lactosa ) con 1 cc de agua. 3.- 1 tubo (10 cc de caldo de lactosa ) con 0.1 cc de agua. Ag ua no clo rada: 1.- 5 tubos ( 50 ce de caldo de lactosa ) con 10 ce de agua 2,- 5 tubos ( 10 ce de caldo de lactosa ) con 1 ce de agua. 3.- 5 tubos (10 ce de caldo de lactosa ) con 0.1 ce de gua. Pro c edimiento : 1. Se agita el frasco que contiene el agua. 30 2. Colocar en gradillas los tubos de caldo de lactosa. 3. Con una pipeta estéril 4. Rotular los tubos de la serie con las números de la muestra. 5. Incubar a 37 °C por 24 horas, si resulta negativo incu ar otras 24 horas. 6. Lectura de tubos positivos y cálculo del número probable de gérmenes en 10 cc. 2.6 TOMA DE MUESTRA: La cantidad de agua requerida como muestra es mínimo 2 litros. Al tomar la muestra se debe tener cuidado de q ésta sea representativa del agua problema, cuanto menos tiempo transcurra la toma y el análisis serán satisfactorias los resultados. 2.6.1 Tiempo s máximo s para el anális is de la mues tra de agua: • Agua no contaminada: 72 horas : agua de las cañerías, aguas claras. • Agua sospechosa : 48 horas: agua de pozos, aguas turbias. • Agua contaminada : 12 horas, aguas negras, río Rímac, baño. Se registra el tiempo transcurrido entre la toma de muestra y el análisis. Para recolectar las muestras se usan botellas de vidrio o de plástico con tapas esmeriladas en lo posible. Las botellas de la muestra hay que lavarlas 31 cuidadosamente , luego se usa soluciones de ácido sulf rico y dicromato de K, luego se hace un concienzudo enjuague con agua destilada. En la toma de muestra para estudio bacteriológico es conveniente frascos de vidrio que estén completamente esterilizados preferible de boca ancha. En el interior se coloca una pequeña cantidad de hiposulfito de sodio pa a neutralizar el CI2 residual que puede contener el agua y que pueda variar el contenido bacteriano en el momento de la toma de muestra. Ejemplo : 1.- Una llave de servicio, se elige de uso continuo, no presente ninguna anomalía (llave mal cerrada ) 2- Una llave de goteo. S e pro cede a : 1. Escurrir el agua, luego se procede a lavar la boca, luego se dejaescurrir el agua por dos minutos. 2. Se cierra y flamea con un mechero de algodón por algunos segundos. 3. Se abre la llave y se deja escurrir el líquido por 2 minutos. 32 4. Se coloca en el frasco de agua dejando un espacio de por lo menos de 1 ce en la parte inferior de la tapa y al nivel del líquido. 2.6.2 PROCEDIMIENTO PARA LA TOMA DE MUESTRA El frasco previamente limpio y estéril como se ha indicado anteriormente y abierto la boca, se toma por base, se introduce boca abajo a una profundidad de 10 cm y luego se mueve en avance ascendente. 33 CAPITULO III 3.- CALIDAD Y CARACTERISTICAS DEL AGUA POTABLE 3.1 Co ns tituyentes Químico s del agua Producen 4 efectos: 3.1.1 PRODUCEN S OLAMENTE ALCALINIDAD: Carbonato de potasio K2CO3 Bicarbonato de potasio KHCO3 Carbonato de sodio CO3Na Bicarbonato de sodio Mg(HCO3) 2 Todas estas sales disueltas en al agua producen alcalinidad. 3.1.2 PRODUCEN DUREZA CARBONATADA Y ALCALINIDAD Carbonato de calcio CaCO3 Bicarbonato de calcio Ca(HCO3) 2 Carbonato de magnesio MgCO3 Bicarbonato de magnesio Mg(HCO3)2 Es tas s ales d is ueltas en el ag ua p rod ucen d urez a temp oral. 34 3.1.3 PRODUCEN CALIDAD S ALINA Y DUREZA NO CARBONATADA: 1).- Calidad s alina: cuando el contenido de iones es muy alta. 2).- Dureza no carbo natada: dureza permanente. Sulfato de calcio : CaS04 Cloruro de calcio : CI2Ca Nitrato de calcio : (N03)2Ca Sulfato de magnesio: MgS04 Cloruro de magnesio: MgCI2 Nitrato de magnesio : (N03)2 Mg 3.1.4 PRODUCEN CALIDAD S ALINA PERO NO DUREZA: Sulfato de potasio K2 S04 Cloruro de potasio CIK Nitrato de potasio KNO3 Sulfato de sodio Na2 S04 Cloruro de sodio CINa Nitrato de sodio NaN03 3.1.5 S US TANCIAS QUE PRODUCEN ACIDEZ EN EL AGUA: Que son usados en el tratamiento de agua: Sulfato ferroso : FeS04 Sulfato de aluminio Acido sulfúrico : : Al2 (S04)3 H2S04 (En ciertos especiales 35 tratamientos 3.1.6 CANTIDADES MÁXIMAS DE S US TANCIAS QUÍMICAS EN DIS OLUCIONES INDICADOS POR INTERNACIONALES LIMITES : en ppm. S US TANCIAS Cloruros 250 Cromo hexavalente como Cr 0.05 Fenol 0.001 Sulfatos 250 Sólidos totales 500 Arsénico (como As) 0.05 Cobre 1.0 Fluoruros (inorgánicos) 3.0-mejor 1.5 Plomo : como Pb 0.05 Hierro: como Fe 0.3 Manganeso:: omo Mn 50.0 Setenio ( como Se ) 0.01 Zinc ( como Zn ) 50 Detergentes 0.5 Bario ( como Ba ) 1.0 Cadmio ( como Cd ) 0.01 Nitrato ( como N ) 10.00 Extracto filtrable por carbón Soluble en cloroformo 36 0.2 NORMAS 3.2 CONS UMO DE AGUA POTABLE: El consumo de agua se ha establecido en base a una estadística de uso por persona durante el día, de tal manera que las cantidades son un promedio: 1.- Consumo de baño de tina 2.- Consumo de baño de ducha 3.- Consumo de inodoro por persona 23 Lts. 4- Consumo de lava manos 45 Lts / hora 5.- Consumo en lavadero de laboratorio 6.- Consumo de riego de jardín con manguera de 3/8" de diámetro 9.5 Litros/ baño 9 Lt/min. 37 Lts / hora 26 Lts/min. 7.- Consumo de agua para lavado de automóvil 300 Lts. 8.- Consumo básico por persona 75 Lts. 3.3 DUREZA DEL AGUA: Se denomina dureza del agua a la concentración de compuestos minerales que hay en una determinada cantidad de agua, en particular sales de magnesio y calcio, carbonatos, bicarbonatos, cloruros, sulfatos y ocasionalmente nitratos de calcio y magnesio. Son éstas las causantes de la dureza del a ua, y el grado de dureza es directamente proporcional a la concentración de sales alcalinas. La dureza es indeseable en algunos procesos, tales como el lavado doméstico e industrial, provocando que se consuma más jabón, al producirse sales insolubles. 37 En calderas y sistemas enfriados por agua, se producen incrustaciones en las tuberías y una pérdida en la eficiencia de la transferencia de calor. Además le da un sabor indeseable al agua potable. Grandes cantidades de dureza son indeseables por razones antes expuestas y debe ser removida antes de que el ag a tenga uso apropiado para las industrias de bebidas, lavanderías, acabados metálicos, teñido y textiles. La mayoría de los suministros de agua potable tienen un promedio de 250 g/Lt de dureza. Niveles superiores a 500 mg/l son indeseables para uso doméstico. Se calcula, genéricamente, a partir de la suma de las concentraciones de calcio y magnesio existentes (miligramos) por cada litro de agua; que puede ser expresado en concent iones de CaC03. Es decir: Dureza (mg/l de CaC03) = 2,50 [Ca++] + 4,16 [Mg++]- Donde: • [Ca++]: Concentración de ion Ca++ expresado en mg/l. • [Mg++]: Concentración de ion Mg++ expresado en mg/l. Los coeficientes se obtienen de las proporciones entre el peso molecular del CaC03 y los pesos moleculares respectivos: 100/40 (para el Ca++)¡ y 100/24 (para el [Mg++]). 38 La forma más común de medida de la dureza de las aguas es por titulación con [EDTA]. Este agente complejante te valorar tanto la concentración de Ca como la de Mg. 3.3.1 TIPOS DE DUREZA La dureza del agua tiene una distinción compartida entre dure za temporal (o de carbonatos) y dureza permanente (o de no-carbonatos). 1).- Dureza Temporal: Está determinada por el contenido de carbonatos y bicarbonatos de calcio y magnesio y puede ser eliminada al hervir el agua o por la adición del hidróxido de calcio [Ca(OH)2 ] CaCO3(S)) + H2O + CO2(g) ^Z^Ca(HC03)2(aq) El carbonato de calcio es menos soluble en agua caliente que en agua fría, así que hervir (que contribuye a la formación de carbonato) se precipitará el bicarbonato de calcio fue a de la solución, dejando el agua menos dura. Los carbonatos pueden precipitar cuando la concentración de ácido carbónico disminuye, con lo que la dureza temporal disminuye, y el ácido carbónico aumenta puede aumentar la solubilidad fuentes de carbonates, como piedras calizas, con lo que la dureza temporal aumenta. Todo esto está en relación co el 39 pH de equilibrio de la calcita y con la alcalinidad de los carbonatos. Este proceso de disolución y precipitación es el que provoca las formaciones de es talag mitas y es talactitas . 2).- Dureza pe rmanente: Esta dureza no puede ser eliminada al hervir el agua, stá determinada por todas las sales de calcio y magnesio e carbonatos, bicarbonatos y/o cloruros en el agua, que solubles mientras sube la temperatura hasta pto n más cierta temperatura luego la solubilidad disminuye conforme aumenta la temperatura. Puede ser eliminada utilizando el méto o SODA (sulfato de sodio). 3)- Grado s de dureza de l agua Las medidas de dureza o grado hidrotimétrico del agua son: Ø Grados de dureza inglesa: ( grados Clark ) equivale a grados de CaC03 por galón o parte por 70,000. Ø Grados de dureza Francés : son parte de CaC03 por 100,000. Ø Grados de dureza Alemán : son partes de CaO por 100,000. Ø Grados de dureza Americano : es igual a una parte de CaCO3 por 1'000,000. 40 CUADRO DE EQUIVALENCIAS DE LA DUREZA Tabla ? 3.1 UNIDAD PP m Una parte por millón Un grano/ US galón 1 17.1 14.3 Grano s / US Grado s Grado s Grado s g aló n Clark Frances e s Alemanes Un grano/ Imperial-gl Un grado Francés 10.0 Un grado alemán 17.9 0.058 1.0 0.829 0.07 1.20 1.00 0.10 1.71 1.43 0.56 0.958 0.80 0.583 1.044 0.70 1.24 1.00 1.78 0.56 1.00 Fuente: Elabo rac ión pro pia > 1 galón Imperial ( Británico ) = 4.546 Litros. > 1 galón USA = 3.785 Litros 3.3.2 Interpretación de la Dureza: Dureza como CaCQ3 0-75 75-150 150-300 > 300 Interpretación agua suave agua poco dura agua dura agua muy dura 41 En agua potable: El límite máximo permisible es de 300 mg/l de dureza. .En agua para calderas : El límite es de 0 mg/l de dureza. . 3.3.3 Campo de Aplicació n El análisis de la dureza total en muestras de aguas es utilizado en al industria de bebidas, lavandería, fabricación de detergentes, acabados metálicos, teñido y textiles. Además en el agua potable, agua para calderas, etc. Principio s Este método está basado en la cuantificación de los iones calcio y magnesio por titulación con el EDTA y su posterior conversión a Dureza Total expresada como CaCO3 3.3.4 Pro cedimiento : La muestra de agua que contiene los iones calcio y magnesio se le añade el buffer de PH 10, posteriormente, se le agrega el indicador ericromo negro T ( ENT ), que hace que se forme un complejo de color púrpura, enseguida se procede a titular con EDTA (sal disódica) hasta la aparición de un color azul. 42 3.3.5 Reacc iones químicas que s e g ene ran: Ca2+ + Mg 2+ + Buffer pH 10 Ca2++ Mg2++ ENT [ Ca-Mg--ENT] [Ca-Mg-ENT] + EDTA complejo púrpura [Ca-Mg-EDTA] + ENT color azul 3.3.6 Interferenc ias . En la tabla se encuentra la lista de la mayor parte de las sustancias que interfieren. Sí existen más de una sustancia que interferentes, los límites dados en la tabla pueden variar. La turbidez se elimina por filtración. Interferencias Con, máx. sin interferir Aluminio 20 ppm Cadmio * Cobalto 100 ppm Cobre 50 ppm Fierro(+3) 50 ppm Fierro (+2) 50 ppm Plomo * Manganeso 1 ppm Níquel 100 ppm Zinc * Polifosfatos 10 ppm 43 * 3.3.7 Si están presentes son titulados como dureza. Materiales y Reactivo s : El método empleado para la cuantificación de la Dureza Total es un método volumétrico por lo que no se requie aparatos especiales. 1).- Materiales • 2 matraces volumétricos de 100 ml • cápsula de porcelana • 1 soporte con pinzas para bureta • Matraces erlenmeyer de 125 ml. • 1 pipeta de 10 ml. • 2 frascos goteros de 100 ml 2).- Reactivo s Ø Solución Buffer PH 10 : Disolver 6.56 gr. de NH4 CI y 57 ml de NH4OH en agua destilada y aforar a 100 mi. Ø Solución: Negro de Eriocromo T : Disolver 0.5 g de Eriocromo negro T y 4.5 gr. de clorhidrato de hidroxilamina en 100 mi de etanol. Ø Solución De EDTA (sal disódica) 44 Disolver 2 gr de EDTA (sal disódica) más 0.05 gr de MgCI2 .6H20 en agua destilada y aforar a 1000 mi. Ø Solución de CaCI2 0.01 N Disolver 0.5 gr de CaC03 secado a 110 ° C durante 2 horas y disolverlo en 10 ml de HCI 3N y aforar a 1000 ml con agua destilada. 3.3.8 Es tandarización La estandarización del EDTA (sal disódica) se hace de siguiente manera: v Colocar 5 ml de solución de CaCI2 en un matraz Erlenmeyer de 125 ml. v Añadir 5 gotas de solución buffer de pH 10 y 3 gotas de indicador de negro de ericromo T, aparece un color púrpura en presencia de iones de calcio y magnesio, y se proce a titular con la solución de EDTA cuya normalidad se desea conocer, se termina hasta la aparición de un color azul. 3.3.9 Cálculo de la normalidad del EDTA: La Normalidad del EDTA se calcula así: V1 x N1 N2 = --------------------V2 Dónde: N2 = Normalidad del EDTA 45 V1 = ml de solución de CaCI2 N1 = Normalidad de la solución de CaCI2 V2 = ml gastados de EDTA 3.3.10 Ø Pro ce dimiento : Colocar 5 ml de la muestra de agua en un erlenmeyer de 125 ml. Ø Agregar 5 gotas de buffer PH 10 . Ø Añadir 3 gotas de negro de ericromo T. Ø Titular con EDTA (sal disódica) 0.01 N . Ø Vire de púrpura a color azul. 3.3.11 Cálculo s 46 Se utiliza la siguiente relación: Vx N x 1000 meq/l Ca+2 y Mg+2 = ---------------------------ml de muestra Donde : V = ml gastados de EDTA N = Normalidad del EDTA a) Cálcu lo s para Magne s io : meq/l Mg+2 = [meq/l (Ca+2 y Mg+2)] - (meq/l Ca+2 ) b) Cálculo s para dureza total: Expres ada co mo ppm de CO3 Ca : mg/l de Dureza Total = [ meq/l ( Ca+2 y Mg+2 )] c) Cálculo s para dureza de Calcio : Expres ada c o mo ppm de CO3 Ca : mg/l Dureza de Calcio = ( meq/l Ca+2 ) d) Cálculo s para Dureza de Mag nes io : Expres ada c o mo ppm de CaC0 3 mg/l de Dureza de Magnesio = ( meq/l Mg +2) 47 3.3.12 PROCEDIMIENTO EXPERIMENTAL: a) Muestra tomada: 50 ml_ de agua de chorro b) Agregar en 3 erlenmeyers de 250 ml_, c) luego se agrega 1 ml_ de solución buffer y 2 gotas de negro ericromo T a cada erlenmeyer. d) Posteriormente, ya con la bureta llena y enrazada con solución de EDTA (ácido etilendiamino tetra acético) s procedió a realizar la titulación hasta que cada muest vire de vino tinto a un color azul marino. Se realiza dos muestras. 3.3.13 CÁLCULOS Para la mues tra ? 1 NEDTA = 0,0278 N Vol. de agua = 50 mL Vol. de EDTA gastado = 2,6 Masa eqv. = 50 Equ CaC03 = NEDTA x Vol. de EDTA gastado Equ CaC03 = 0,0278 N x 0,0026 L = 0,0000722 gr/L de la muestra = Equ CaC03 x Masa eqv. gr/L de la muestra = 0,0000722 x 50 gr/L de la muestra = 0,00361 gr./L 48 Dureza del agua (ppm) = 0,00361 x 1000 / 0,05 = 72.2 pm Dureza del agua (ppm) = 72,2 ppm Para la mue s tra ? 2 NEDTA = 0,0278 N Vol. de agua = 50 mL Vol. de EDTA gastado = 2,5 Masa eqv. = 50 Equ CaC03 = Equ CaCOs NEDTA x Vol. de EDTA gastado = 0,0278 N x 0,0026 L = 0,0000695 gr/L de la muestra = Equ CaCo3 x Masa eqv. gr/L de la muestra = 0,0000695 x 50 gr/L de la muestra = 0,003475 gr./L Dureza del agua (ppm) = 0,003475 x 1000 / 0,050 = 69.5 ppm Dureza del agua (ppm) = 69,5 ppm Dureza promedio del agua = 72,2 + 69,5 = 70,85 ppm CONCLUS IONES : Observando los resultados obtenidos en esta práctica podemos concluir que el agua de chorro utilizada posee una cantidad muy pequeña de impurezas, esto se ve reflejado en los valores obtenidos de dureza los cuales, según la tabla de interpretación, están en los niveles aptos para el consumo humano, es decir que posee canti des pequeñas de CaC03, el cual es el indicativo principal de la dureza del agua 49 RES ULTADOS Y ANÁLIS IS Mues tra Vo l. de agua (ml) Vol. de EDTA (ml) Equivale nte s de CO3Ca g/l de CO3Ca e n agua 1 50 2,6 7,22x10-5 3,61x10-3 2 50 2,5 6,95x10-5 3,475x10-3 Dure za promedio de l agua (ppm) 70,85 Tabla 3.2 Fuente:http://www.sagan-gea.org/hojared AGUA/paginas/16agua.html Como se puede observar en la tabla de resultados, la dureza del agua es muy pequeña de acuerdo a la siguiente interpretación : En agua potable : El límite máximo permisible es de 300 mg/l de dureza. Pudiendo inferir que aunque no se realizo la determinación de la dureza para el agua destilada, ésta, por lógica debe ser menor a la obtenida en esta práctica. 3.3.14 As pecto s químic os : El mayor porcentaje de sustancias químicas contenidas en el agua de consumo La mayoría de las sustancias químicas presentes en el agua de consumo son potencialmente peligrosas para la salud sólo después d na exposición prolongada (durante años, más que meses). La excepción principal es el nitrato. Generalmente, los cambios en la calidad del agua se producen de forma progresiva, excepto en el caso de las sustancias que se vierten o 50 tran de forma esporádica a corrientes de aguas superficiale o subterráneas, procedentes, por ejemplo, de vertederos contaminados. En algunos casos, el agua puede contener grupos de sustancias químicas procedentes de fuentes relacionada , por ejemplo, los subproductos de la desinfección (SPD) y p de no ser necesario establecer normas para todas las sustancias para las que existen valores de referencia. Sí se practica la cloración, es probable que los principales SPD sean lo trihalometanos, cuyo componente principal es el clorof , asi como, en algunas ocasiones, los ácidos cloroacéticos. En ciertos casos, el control de las concentraciones de cloroformo y, en caso pertinente, de ácido tricloroacético también proporcionará un grado de control adecuado de ros subproductos de la cloración. 3.3.15 Peligro s de tipo químico en el ag ua de cons umo Se ha demostrado que cierto número de contaminantes químicos causan efectos adversos para la salud de las personas como consecuencia de una exposición prolongada por el agua de consumo. Ciertas sustancias consideradas peligrosas para la salud afectan a la aceptabilidad del agua de consumo de modo que, por lo general, conllevarían el rechazo del agua 51 que contiene concentraciones bastante menores que las consideradas peligrosas para la salud. Conviene clasificar los contaminantes químicos en función de su importancia, para que se considere la inclusión de los más importantes en las normas y programas de monitoreo nacionales. Los conocimientos locales acumulados a lo largo del tiempo mediante la experiencia práctica son extremadamente valiosos. No obstante, pueden surgir problemas importantes, incluso crisis, si abunda la presencia de sustancias químicas muy peligrosas para la salud pero se desconoce porque efecto sobre la salud es a largo plazo, causado por una exposición crónica, no una exposición breve. Tal ha sido el caso del arsénico en aguas subterráneas en Bangladesh y Bengala Occidental, por ejemplo. Los contaminantes químicos del agua de consumo se pueden clasificar de varias maneras; sin embargo, la m s adecuada es considerar la fuente principal del contaminante, es decir, agrupar las sustancias químicas en función del factor que se puede controlar con mayor eficacia. Esta clasificación facilita el desarrollo de métodos concebidos para evitar o reducir al mínimo la contaminación, en lugar de métodos basados primordialmente en la medi ión de las concentraciones de contaminantes en las aguas finales. 52 Por consiguiente, en estas Guías, las sustancias químicas se dividen en seis grupos principales en función de su origen, como se muestra en el cuadro 3.1. Es posibl ue las categorías no estén siempre bien delimitadas. El grupo de contaminantes de origen natural, por ejemplo, comprende muchas sustancias químicas inorgánicas presentes en el agua de consumo como consecuencia de su liberación, por la acción de la lluvia, de rocas y suelos, algunas de las cuales pueden convertirse en un problema cuando existe perturbación medioambiental, como en las zonas mineras. 3.3.16 Guías de la OMS para la calidad del ag ua potab e Uno de los grandes problemas a nivel mundial es la calidad del agua potable, tanto en los países desarrollados más aun en los países subdesarrollados, incluso debido a los cambios climáticos en nuestro globo terrestre cada vez escasea la disponibilidad del agua.Es uno de los probl mas para la salud, para la agricultura, que en algunos lugares la lluvia era abundante, hoy escasea produciéndose la destrucción de las plantaciones. Otro de los problemas es el crecimiento demográfico razón por la cual hay mayor necesidad para su consumo humano. 53 Otros problemas son la contaminación cada vez mayor sobre todo de las grandes industrias químicas, mineras los agentes infecciosos, la contaminación radiológica, emp esas que se dedican a la electrólisis, empresas textileras, etc. La OMS elabora normas internacionales relativas a la calidad del agua y la salud de las personas en forma de guías en las que se basan reglamentos y normas de países de odo el mundo, en desarrollo y desarrollados. 3.4 CARACTERÍSTICAS QUIMICAS .Además de cumplir sobre las cantidades máximas de sustancias de sustancias químicas en disolución según las Normas Internacionales indicadas anteriormente el agua tratada con intercambio iónico por cualquier otro tratamiento químico debe cumplir con los siguientes requisitos: La alcalinidad a la fenolftaleína y al CaC03 + 0.4 veces la alcalinidad total, esta condición limita el pH a 10.6 °C. La alcalinidad en carbonato normal expresados en partes por millón (ppm). La alcalinidad de CaC03 normal es función de las concentraciones de iones [H]+ y de la alcalinidad total y para que no exceda del valor de 120 ppm. debe mantenerse la alcali dentro de los límites indicados en la siguiente tabla pH respectivos. 54 ad total, res de Tabla ? 3.3 Valores de pH 8.0 a 9.6 8.0 a 9.7 8.0 a 9.8 8.0 a 9.9 8.0 a 10.0 8.0 a 10.1 8.0 a 10.2 8.0 a 10.3 8.0 a 10.4 10.5 a 10.6 Límite para Alcalinidad Total 400 ppm como CaC03 360 ppm como CaC03 300 ppm como CaC03 260 ppm como CaC03 230 ppm como CaC03 210 ppm como CaC03 190 ppm como CaC03 180 ppm como CaC03 170 ppm como CaC03 160 ppm como CaC03 Fue nte : Hutc hins o n (1957). Es to s v alo re s s e de te rminan e n e l agua a 25 °C. 3.5 CARACTERÍS TICAS FÍS ICAS : Color, Turbidez, olor, Sabor y temperatura. 1) COLOR: Es la impresión ocular producido por las materias en el agua . El agua debe ser incoloro. Se determina el color por comparación con colores patrones según la escala de platino cobalto que toma como unidad de color la producida por 1 mg de Platino en fo de ion Cl- Platinado por 1 litro de agua. El límite es de 20 ppm. Según normas internacionales. 2) TURBIEDAD: Se debe esencialmente a materias en suspensión se mide mediante un instrumento llamado turbidímetro aceptando como unidad la que produce en peso una parte de sílice, tierras diatomeas o tierras de Fuler en un millón de partes (ppm) de agua. El índice máximo de agua pura debe ser de 10 ppm según Normas Internacionales. 55 3) OLOR : Es la impresión producida en el olfato por las materia volátiles contenidas en el agua. S abo r Es la sensación de gusto que producen las materias contenidas en el agua. Los o lo res pueden s er producidas por: > Materia orgánica descompuesta. > Organismos vivos > Gases o combinaciones de ellos. > Residuos industriales. El olor se mide por el ensayo del olor insipiente que consiste en diluir el agua hasta que el olor desaparezca. Se requiere diluir 25 mi de agua problema en agua sin olor hasta completar 250 ce olor insipiente es igual a 10. El agua pura no debe tener o or ni sabor. 4) TEMPERATURA: Se estima que una temperatura del agua entre 5 y 15 °C es agradable al paladar. 3.6 PARÁMETROS FIS ICO-QUIMICOS : ALCALINIDAD Definimos alcalinidad como la capacidad del agua para neutralizar ácidos o aceptar protones. Esta representa la suma de las bases que pueden ser tituladas en una muestra de agua. Dado que la alcalinidad de aguas superficiales está determi da generalmente por el contenido de carbonatos, bicarbonatos e hidróxidos, ésta se toma como un indicador de dichas especies iónicas. No obstante, algunas sales de ácidos débiles mo boratos, silicatos, nitratos y fosfatos pueden también contribuir a la alcalinidad 56 de estar también solución presentes. Estos iones negativos en están comúnmente asociados o pareados con iones positivos de calcio, magnesio, potasio, sodio y otros cationes. El bicarbonato constituye la forma química de mayor contr bución a la alcalinidad. Dicha especie iónica y el hidróxido son particularmente importantes cuando hay gran actividad fotosintética de algas o Tabla ? 3.4 RANGOS DE ALCALINIDAD ALCALINIDAD RANGO BAJ A MEDIA ALTA (mg/L CaC03) < 75 - 150 > 150 Fuente: Dato s to mado s de Ke vern (1989) cuando hay descargas industriales en un cuerpo de agua. La alcalinidad, no sólo representa el principal sistema amortiguador del agua dulce, sino que también desempeña un rol principal en la productividad de cuerpos de aguas naturales, sirviendo como una fuente de reserva para la fotosíntesis. Históricamente, la alcalinidad ha sido utilizada como un indicador de la productividad de lagos, donde niveles de alcalinidad altos indicarían una prod ctividad alta y viceversa (Tabla 3.4). Dicha correlación se debe en parte a que la disponibilidad del carbono es mayor en lagos alcalinos y también al hecho de que las rocas sedimentarias que contienen carbonatos, a menudo contienen 57 también concentraciones relativamente altas de nitróge o y fósforo, (en comparación con el granito, otras rocas ígneas y regiones donde el lecho rocoso ha sido desgastado y lavado, los cuales generalmente contienen bajas concentraciones de estos s nutrientes limitantes y del CaCO3). El sistema de alcalinidad tiene interacciones importantes con los procesos de fotosíntesis y respiración celular. Veamos en primer término las reacciones de equilibrio que describen la interacción de CO2 y H2O. (Figura 3.1). Fig . 3.1 Fig ura 3.1: Equilibrio que des criben la interacción de Fuente: Dato s to mado s de Kevern (1989). 58 H2O. Dado que la concentración de ácido carbónico (H2 CO3) es generalmente baja, las primeras dos ecuaciones se combinan para formar el equilibrio descrito en la ecuación #3. Determinando los valores de las constantes de disociación K1 y K2 (las cuales varían con la temperatura y el pH), podemos calcular las concentraciones relativas de los componentes de estas ecuaciones de equilibrio. La figura 3.2 y la bla 3.2 ilustran cómo el por ciento de composición de dichos componentes varía con el pH. Efecto del pH en el po r ciento de co mpo s ición d e es pecies de bió xido de carbono en agua. Fig ura 3.2 59 Es evidente que las proporciones de las especies iónicas de bióxido de carbono son alteradas significativamente po mbios en pH. A un pH < 6, CO2 es la especie dominante. A valores de pH entre 7 y 9, HCO3 - predomina, mientras que CO3 2- comienza a aumentar su concentración significativamente a valores de pH > 9. Fuente: Datos tomados de Hutchinson (1957) El sistema de alcalinidad tiene interacciones importantes con los procesos de fotosíntesis y respiración. Dichas interacciones se ilustran en la figura 3.3 donde aparecen combinadas la primera y segunda disociaciones de ácido carbónico. 60 Efecto s de Pro ce s o s Metabó lic os e n la alc alinidad Fig . 3.3 Fuente: Datos to mado s de Hutchins on 1957 Durante el proceso de fotosíntesis se consume CO2 desplazándose el equilibrio descrito en la figura 3.3 hacia la derec a, causando a su vez que el pH aumente. El aumento en pH se debe a que la baja en concentración de CO2 libre ocasiona a su vez una disminución en la concentración del ion hidronio (H+) y por ende un aumento en pH. Dicho efecto lo podemos apreciar al analizar las reacciones equilibrio que describen la interacción de CO2 y H2O (Figura 3.1: ecuaciones 1 - 3). Si las concentraciones de C02 libres disminuyen, entonces disminuyen también las concentraciones de H+ como lo establece la ecuación #3 y la constante de disociación K1. En adición, si el equilibrio descrito en la figura 3.2 se desplaza hacia la derecha durante periodos intensos de fotosíntesis, entonces la concentración de carbonato K2. sgún el CO2 es incorporado a fotosíntesis, su concentración en agua puede ser restituida por difusión 61 molecular de CO2 atmosférico al agua o puede ser repuesto por el sistema de alcalinidad a través de la disociación de bicarbona o (ecuación #1). En aguas con alta productividad, el proceso fotosintético puede agotar los niveles de CO2 libre, a tal punto que el crecimiento de plantas acuáticas se ve limitado y el pH puede alcanzar valores mayores de 9 ó 10. Por otro lado, los procesos de respiración aerobia y anaerobia eneran CO2, el cual, dependiendo de su concentración, puede desplazar el eq ibrio descrito en la ecuación #1 hacia la izquierda, causando que el pH disminuya. La actividad fotosintética puede redundar en la precip tación de carbonato de calcio (CaCO3), si la concentración de carbonato aumenta lo suficiente como para exceder la constante de solubilidad de carbonato de calcio (Ksp a 25°C = 10-8.35). Esa es una situación muy común en lagos de alta productividad con una alta alcalinidad, donde puede observar una cubierta blanquizca sobre la superficie de estruct ras vegetales y sobre el sedimento. Cuando la actividad del proceso de respiración excede la actividad fotosintética (se produce CO2 por respiración aerobia y anaerobia) disminuye la concentración de carbonato a t punto que los depósitos de carbonato de calcio se disuelven en el ag a. El CaCO3 puede ser producido también por procesos abióticos en lagos que reciben afluentes de manantiales con una alcalinidad alta, supersaturados con CO2. Una vez el afluente entra al lago, el CO2 se libera a la atmósfera (ecuación #1). El equilibrio se desplaza hacia la derecha, aumentando así la concentración de carbonato, a tal punto que excede el Ks de CaCO3 y se 62 precipita. Dichos lagos se caracterizan por presentar ulos blancos finos suspendidos en la columna de agua, los cuales pueden causar turbidez en el agua. 3.6.1 Orig en de carbo n ates y bicarbo natos en agua dulce: Los carbonatos y bicarbonatos presentes en cuerpos naturales de agua dulce se originan generalmente del desgaste y disolución de rocas en la cuenca que contienen carbona os tales como la piedra caliza. A pesar de que la piedra caliza no es muy soluble en agua pura, su disolución es promovida por l presencia de C02 disuelto en el agua (C02 atmosférico o C02 generado en sedimentos ricos en materia orgánica). El C02 reacciona con el agua para generar pequeñas cantidades de ácido carbónico, el cual disuelve entonces las rocas de carbonato en la cuenca, lo que a su vez contribuye a la alcalinidad del agua (Figuras 3.4 Fig . 3.4 63 5). Lagos ubicados en regiones donde abunda la roca caliza presentan una alcalinidad alta, al igual que una capacidad amortiguadora alta. En regiones donde el lecho rocoso á compuesto mayormente de granito y otras rocas ígneas pobres en carbonatos, generalmente encontramos lagos y corrientes con una alcalinidad baja y una pobre capacidad amortiguadora. Dichos cuerpos de agua son a menudo más susceptibles al impacto de la lluvia acida. Otras zonas donde encontramos lagos y co rientes con baja alcalinidad son áreas que reciben una precipitación abundante. En dichas áreas la mayoría de los carbonatos expuestos y disponibles se han disuelto y han sido lavados a lo largo del tiempo. 64 3.6.2 Orig en de carbo n ates y bicarbo natos en agua de m r: El CO2 atmosférico se difunde al agua de mar, combinándose químicamente con el agua para producir el ion de bicarbonato y un ion de hidronio, tal y como ocurre en agua dulce (Figura 3.6). El bicarbonato se disocia para pro ucir carbonato e hidronio. El carbonato se combina con calcio para producir carbonato de calcio. Este último se puede precipitar depositándose en el lecho marino, removiendo así CO2 del agua de mar. Sí el pH del agua de mar baja significativamente, dichas reacciones pueden revertir hacia la formación de CO2. Fig . 3.6 Orig en de bicarbonato y c arbo nato en el ambie nte marino . Fuente: Datos tomados de Hutchinson (1957). El efecto del pH sobre el por ciento de composición de las especies de carbono que integran el sistema de alcalinidad, es básicamente el mismo para agua dulce y para agua salada. No 65 obstante, se observa una diferencia pequeña, aunque consistente, entre el patrón de curvas para agua dulce y el de agua salada (Figura 3.7). Observamos que el por ciento de composición de bicarbonato o carbonato, a un pH dado, es mayor en el gua salada que en agua dulce. El grado de disolución de un ion en una solución donde hay iones comunes a éste es menor al que se obse va en agua pura (efecto del ion común). En este caso, el gra de disolución de un ion que no es común (bicarbonato) a l s presentes en la solución (agua de mar), es mayor al que se observa en agua pura (efecto salino o efecto del ion no-común) (Petrucci, 1989). La explicación para este fenómeno es que según aumenta la concentración iónica total de una solución, las atracciones interiónicas cobran mayor importancia, promoviendo éstas la solubilidad de sales no comunes en la solución. 66 Fig . 3.7 Fuente : Petrucci 1989 La solubilidad de CO2 (gas) es afectada ligeramente por cambios en salinidad y en pH. No obstante, dado que el CO2 puede reaccionar con agua para formar bicarbonato y dado que el bicarbonato es no-volátil y muy soluble en agua, la cantidad de material potencialmente convertible a CO2 es afectada significativamente por cambios en pH y en salinidad. Mecanismo de amortiguación de pH del sistema de alcalinidad: En los rangos de pH de cuerpos de agua na urales no 67 contaminados (agua dulce pH = 7.0; agua de mar pH = 8.1 ) el sistema de alcalinidad actúa de la siguiente forma: Ø Si añadimos un ácido, este es neutralizado de acuerdo a las siguientes reacciones: H + (ácido) + CO3 2H+(ácido ) + HCO3 - HCO3 H2 CO3 CO2 + H2 O Ejemplo: Si añadimos ácido sulfúrico al agua, este será neutralizado de acuerdo a la siguiente reacción: H2 S O4 + 2CaCO3 H2S O4 + Ca(HCO3)2 CaS O4 + Ca(HCO3 )2 CaS O4 + H2 CO3 H2 S O4 + Ca2 + + CO3 2- CaS O4 + H2 O + CO2 CaS O-4 + H2 O + CO2 Sí añadimos base, esta será neutralizada de acuerdo a las Siguientes reacciones: OH- (bas e) + HCO3 - CO3 2 - + H2 O OH- (bas e) + H2 CO3 HCO32 - + H2 O Ejemplo: Si añadimos hidróxido de sodio (NaOH) al agua, éste será neutralizado de acuerdo a la siguiente reacción: 68 2NaOH + H2 CO3 NaHCO3 + H2 O NaOH + NaHCO3 - NaCO3 + H2 O 2NaOH + H2 CO3 NaC03 + 2H2O Es conveniente recordar que la capacidad amortiguadora del sistema de alcalinidad tiene sus límites. Una vez la entrada de áci o base sobrepasa las concentraciones de bicarbonato, el siste a de alcalinidad no puede absorber el exceso de ácido o base. 3.6.3 Aplicación: En adición a servir como un indicador de la productividad de cuerpos de agua naturales, el valor de alcalinidad es utilizado en la interpretación y control del tratamiento de aguas clar s y aguas usadas. Aguas usadas crudas de origen doméstico tienen una alcalinidad menor de o ligeramente mayor que el suministro de agua potable. El sobrenadante de digestores anaerobios que ncionan adecuadamente presentan valores de alcalinidad en el rango de 2000 a 4000 mg de carbonato de calcio (CaCO3 )/L. Por otro lado, valores de alcalinidad en exceso sobre as concentraciones de metales alcalino-térreos (Be, Mg. Ca, Sr. Ba y Ra) son importantes para determinar si un abasto o fue puede ser utilizado para irrigación de suelos. 69 e agua 3.6.4 Co ncepto s teó rico s de la meto do log ía utilizada para medir alcalinidad: La alcalinidad se expresa como alcalinidad de fenoftaleína o alcalinidad total. Ambas formas se dete minan por titulación con ácido sulfúrico. Un cambio de color por un indicador da el punto final. También se puede detectar con un metro de pH. La titulación se hace en dos fases: alcalin idad d e fe noftale ína (titulamos la muestra hasta un pH de 8.3) y a lcalinidad total (titulamos la muestra hasta un pH de 4.5 utilizando anaranjado de metilo, bromocresol verde o una mezcla de bromocresol verde y rojo metilo como indicador) (Figura 3.8). Titulación de agua para determinar alcalinidad de feno lftaleína y alcalinidad total. Fig . 3.8 Fuente: Petrucci 1989 70 Según añadimos ácido, se produce una caída gradual en el pH hasta llegar a 8.5. A partir de ese punto se bserva una caída rápida en el pH con una inflexión pobremente definida alrededor del punto de equivalencia de 8.3. En este punto la mayor parte del CO3 2- se ha convertido a HCO3 - y el color de la fenolftaleína cambia de rosado a incoloro. Con la adición de más ácido se produce una disminución gradual del pH, hasta que lleg a otro punto de inflexión alrededor del pH 4.5. Este punto corresponde a la conversión de la mayor parte del HCO3- a H2CO3 y CO2 - Aquí el color del indicador anaranjado de metilo cambia de ama o a rosa salmón. Los resultados obtenidos de las determinaciones de alcalinidad de fenolftaleína y alcalinidad total prove n un método para la clasificación estequiométrica de las tres principales formas de alcalinidad presentes en aguas superficiales (bicarbonato, carbonato e hidróxido), asumiendo la ausencia de ácidos débiles inorgánicos u orgánicos (Ej.: silicio, fosfórico y bórico). Dicha clasificación también presupone la incompatibilidad entre la alcalinidad de hidróxidos y la alcalinidad de bicarbon Dado que los cálculos están basados en una relación estequiométrica, los resultados de alcalinidad no representan concentraciones reales de iones, particularmente cuando el pH es mayor de 10 (pH > 10). El esquema de clasificación establece que: 71 1. La alcalinidad de carbonato (CO32) está presente cuando la alcalinidad de fenolftaleina no es cero, pero es menor que la alcalinidad total [T > P 0]. 2. La alcalinidad de hidróxidos (OH) está presente si la alcalinidad de fenolftaleina es mayor que la mitad de la alcalinidad total [P > 1/2 T]. 3. La alcalinidad de bicarbonato (HCO3) alcalinidad de fenolftaleina es menor esta presente si la de la mitad de la alcalinidad total [P < 1/2 T]. Estas relaciones pueden ser calculadas utilizando el siguiente esquema: Dado que: P = alcalinidad de fenolftaleina T = alcalinidad total 1. Seleccione el valor más pequeño entre (P) y (T - P). Entonces la alcalinidad de carbonato (CO32-) será igual a dos veces el valor más pequeño. 2. Cuando el valor más pequeño es P, el balance (T - 2P) es bicarbonato. 3 Cuando el valor más pequeño es (T - P), el balance (2P - T) es hidróxido. 72 Todos los resultados se expresan como CaCO3 (mg/L). La conversión matemática de los resultados se ilustra en la Tabla 3.4 Re lac ione s de alc alinidad. Tabla 3.4 RESULTADOS ALCALINIDAD ALCALINIDAD CONCENTRACIÓN DELA DE HIDROXIDO DE CARBONATO DE TITULACIÓN (CaC03) (CaC03) BICARBONATO (Ca C0 3) P=0 0 T P < 1/2T Ü 2P T-2 P P = 1/2 T 0 2P 0 P > 1/2T 2P- T 2(T- P) 0 p, | T 0 0 Fue nte : Tomado del APHA (1992) Los cálculos descritos en la Tabla 3.2 están basados en las siguientes premisas: Ø La fenolftaleína presenta un color rosado sólo si OHy/o CO32- están presentes. Ø El rojo-anaranjado presenta un color amarillo sólo si HCO3- está presente. Ø Durante la titulación con el ácido, cualquier C032presente se convierte primero a HCO3 . Ø La alcalinidad de fenolftaleína mide todo el hidróxido presente y la mitad (1/2) de la alcalinidad producida por carbonato (CO3 2-). 73 Ø La alcalinidad de rojo-metilo mide la alcalinidad de bicarbonato inicial y la mitad del carbonato, de estar éste presente. 74 CAPITULO IV 4.- TRATAMIENTO DE AGUA POTABLE 1. Fuentes de abastecimiento. 2. Captación 3. Medida de gasto. 4. Desarenado. 5. Predecantador previa coagulación. 6. Aireación. 7. Coagulación y floculación. 8. Sedimentación. 9. Filtros de arena (lenta, rápida y a presión). 10. Ablandamiento. 11. Estabilización del agua. 12. Desinfección del agua - Cloración - lodación. 13. Control de olor y sabor. 14. Fluoración. 15. Remoción de Hierro y Manganeso 4.1 FUENTES DE ABASTECIMIENTO Entre las fuentes más importantes podemos citar: los r os, lagos, aguas subterráneas, aguas de mar, etc. 75 4.1.1 RÍOS : Para determinar el gasto de agua de un curso superficial se afora en las diferentes épocas estacionales con el fin de conocer la variación del caudal se debe considerar las cifras estadísticas en 20 ó más años. 4.1.2 LAGOS : Se debe de considerar las pérdidas por evaporación y filtración y calcular su volumen aproximado medio anual las pérdidas por evaporación y filtración es de 12 a 15 % volumen promedio anual. 4.1.3 AGUAS S UBTERRÁNEAS : El volumen de aguas subterráneas no debe sobrepasar la cantidad que ingrese, se puede agotar, se debe tener cuidado del nivel estático. El promedio de valores del nivel estático nos puede permitir fijar una extracción máxima. 4.2 CAPTACION: La captación de agua de una fuente puede de hacerse aprovechando la diferencia de nivel del terreno ( cota ) o por impulsión ( bombas). 76 Fig . 4.1 Cota Al ser el agua uno de los compuestos con mayor importancia para el ser humano, éste se ve obligado a quitarle a la madre naturaleza, una vez más, uno de sus frutos más valioso el líquido vida. La captación es el punto inicial del sistema de abastecimiento, entendiendo por sistema de abastecimiento el conjunto de elementos y procesos técnicos que garantiza que el agua llegue desde el lugar de captación al punto de consumo en con ciones correctas tanto en calidad como en cantidad. El origen del agua que suministramos a la población puede ser variado: Ø Aguas de precipitación, lluvia o nieve. Ø Aguas superficiales, ríos, lagos, embalses. Ø Aguas subterráneas, pozos y manantiales. Por tanto, el hombre se sirve del agua existente en la naturaleza para consumirla y utilizarla, pero es evide determinadas características químicas, físicas y bioló ue debido a del agua, ésta no puede ser utilizada de forma directa, y es por eso que dicha agua requerirá de una serie de correcciones y tratamientos que eliminen aquellas partículas o sustancias perjudiciales para el hombre. 77 Dentro de las operaciones en la captación tiene que se r todos los sólidos mayores, donde se encontrará : bolsa plásticas, troncos, muchos sólidos, mucha contaminación, compuestos orgánicos y productos químicos industriales, razón por la cual se tiene que procesar para obtener agua potable consumible. 4.3 MEDIDA DE GAS TO Es medir cuánta agua se va a sacar de este recurso. Para los cálculos aproximados se utilizará la siguiente ecuación: Q = FxS xV Donde : Q = Gasto : m/seg S = Sección : m2 V = Velocidad del agua : m/seg. F = Factor F = 0.85 Canales de paredes limpias. F = 0.80 Canales de paredes rugosas. F = 0.75 Canales de paredes de tierra. Estas fórmulas se cumplen para canales de 50 m como mí una caída o pendiente 78 o y con 4.3.1 DIAGRAMA DE MEDIDA DE GASTO Fig . ? 4.2 4.3.2 TABLA DE VALORES PARA MEDIDA DE GASTO: Tabla ? 4.1 H : (cm) Q: Lts/ Seg H : (cm) Q: Lts/ Seg 4 0.4 20 24.0 5 0.8 21 27.0 6 1.2 22 32.0 7 1.8 23 34.0 8 2.5 24 38.0 g 3.3 25 42.0 10 4.3 26 47.0 11 5.6 27 52.0 12 6.9 28 56.0 13 8.5 29 64.0 14 11.0 30 67.0 15 12.0 31 75.0 16 14.0 32 78.0 17 16.0 33 83.0 18 19.0 34 91.0 19 21.0 35 95.0 79 H : (cm) Q: Lts/ Seg 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 106.0 113.0 121.0 128.0 135.0 140.0 156.0 162.0 171.0 184.0 194.0 206.0 216.0 228.0 239.0 4.4 AIREACIÓN: Se mejora las características físicas y químicas del agua mediante el intercambio de gases y otras sustancias vo átiles en el aire. La aireación puede s er natural o artificial: 4.4.1 Aireación Natural: Puede es la que se efectúa por contacto del aire con e agua en los ríos, lagos, etc. 4.4.2 Aireació n Artificial: Se puede hacer aireaciones gravitacionales de caída de agua mediante cascadas o con aireadores con inyección de aire por el fondo del tanque, en forma de burbujas. La cantidad de aire que se requiere en este último es de 1 m3 de aire por 1 m3 de agua tratada, los tanque no deben ser mayor3.60 m de altura y el tiempo de retención 20 minutos. 4.4.3 TIPOS DE AIREADORES 80 4.5 PROCESO DE ABLANDAMIENTO: Cuando el agua contiene una cantidad significante de calcio y magnesio, es llamada agua dura. El agua dura es conocida por taponar las tuberías y complicar la disolución de detergentes en agua.El ablandamiento del agua es una técnica que sirve para eliminar los iones que hacen a un agua ser dura, en la mayoría de los casos iones de calcio y magnesio. En algunos casos iones de hierro también causan dureza del agua. Iones de hierro pueden también ser eliminados durante el proceso de ablandamiento. El mejor camino para ablandar un agua es usar una unidad de ablandamiento de aguas y conectarla directamente con el suministro de agua. Los ablandadores de agua son específicos intercambiadores de iones que son diseñados para eliminar iones, los cuales están cargados positivamente. Los ablandadores mayormente el nan los iones de calcio (Ca2+) y magnesio (Mg2) Calcio y magnesio son a menudo referido como minerales duros. 4.5.1 ABLANDAMIENTO CAL S OS A EN CALIENTE: La pequeña solubilidad de CaCO3 y Mg(OH)2 y la formación de CO3= básicos complejos limitan la reducción de drenaje logrado por el proceso de ablandamiento en frío. 81 La solubilidad de estos minerales decrecen según aumenta la temperatura y además el proceso reactivo se identifica al mismo tiempo y de un modo rápido. Por ot parte disminuye la viscosidad del agua reduciéndose grandeme e a la temperatura de 150 a 200 °F , lo cual favorece una rápida sedimentación de los precipitados. Estas son las prin ipales razones para el empleo del ablandador en caliente. El proceso ablandador convencional en proceso cal-sosa en caliente al operar con vapor es cargado a una presión de 5 lb/ft2 y a unas temperatura de 150 °F, suele dar unas dureza total en el efluente de salida a 1 ppm. 4.5..2 VENTAJAS : Las ventajas po s itivas s on : a).- Economizan muchos productos químicos. b).- La temperatura a la que trabajan producen la descomposición de los HCO3= ahorrándose cal y también se usa menos CO3 Na2 y esto implica una alcalinidad más baja que junto con una dureza inferior se vuele a traducir en una menor purga en las calderas. La temperatura óptima queda limitado a unos 150 °F pero en algunos casos para evitar el enfriamiento con tanques cerrados se trabaja a 200 – 230 °F, últimamente se está trabajando de una temperatura de 255 a 274 °F. 82 Un punto que no se debe olvidar en este proceso de ablandamiento en caliente es la acción disolvente de las aguas alcalinas calientes sobre las arenas por las que se debe usar filtros con antracita pero nunca las silíceas (arena). Hay varios tipos de instalaciones pero se difieren unos de los otros en los métodos adoptados para lograr lo siguiente: 1.- La preparación de los reactivos . 2.- La proporción entre los reactivos y el agua 3.- La mezcla entere los reactivos y el agua. 4.- La sedimentación y filtración de los precipitados. 4.5.3 PRINCIPALES REACCIONES QUE SE PRODUCEN : En una instalación debe efectuarse convenientemente y de ser posible en forma automática la proporción de os reactivos de tal manera que las concentraciones permanezcan invariables . En una instalación la mezcla debe ser rápida y completa, la capacidad del tanque debe pe ir una amplia capacidad de permanencia de por lo menos 2 horas, a fin de que los reactivos terminen por completo. 83 de ablandamiento se El proceso de ablandamiento con cal – soda (Ca(OH)2 – Na2CO3 ) precipita la dureza del agua. En este proceso se llevan a cabo las siguientes reacciones, las cuales se deben de tener en consideración para estimar las cantidades cal y soda necesarias para el ablandamiento. 1. CO2 + Ca(OH) 2 ? CaCO3 + H2O 2. Ca (HCO3) 2 + Ca (OH) 2 ? 2CaCO 3 + 2H2O 3. Mg (HCO3)2 + Ca (OH) 2 ? CaCO 3 + MgCO3 + 2H2O 4. MgCO3 + Ca(OH) 2 ? Mg(OH) 2 + CaCO3 5. 2NaHCO3 + Ca(OH) 2 ? CaCO 3 + Na2CO3 + 2H2O 6. MgSO4 + Ca(OH) 2 ? Mg (OH) 2 + CaSO4 7. CaSO4 + Na2CO3 ? CaCO3 + Na2SO4 4.6 Méto do de intercambio iónico Este método es una aplicación de un antiguo proceso que desde hace años se ha usado para suavizar el agua domé El sistema funciona mediante el intercambio de iones de u a solución con los iones de carga similar de una resina. Cuando se utiliza el intercambio iónico para recuperar plata el complejo de tiosulfato de plata, de carga negativa, que se encuentra en el agua lavado o en una mezcla de aguas de lavado residuales, se intercambia con el anión de la resina. A esto se le llama paso de agotamiento, y se realiza haciendo fluir la solución a través de una col contiene la resina. 84 na que Se utilizan tres sistemas comunes de intercambio iónico : el intercambio iónico convencional, la precipitación in situ y el circuito electrolítico de intercambio iónico (combinación de los dos primeros métodos). 4.6.1 Intercambio iónico co nvencional La unidad de intercambio iónico colecta la plata del blanqueador-fijador. Después se relava con tiosulfato de amonio [(NH4)2S2O3)] y, luego se desplata electrolíticamente. El efluente que sale de la unidad de desplatado se usa entonces para la siguiente etapa de relavado. 4.6.2 Intercambio iónico co n precipitación in s itu Se utiliza ácido sulfúrico diluido para que la plata se precipite en los trozos de resina como sulfuro de plata, en vez de extraerla con un regenerador. La resina puede usarse en muchos ciclos sin que pierda su capacidad de recuperar plata. Cuando finalme te la pierde (al cabo de seis meses a un año), o cuando la p s insuficiente para que la recuperación sea costeable, la resina se envía a un refinador de plata, que la incinera para extraer el metal. 85 4.7 TRATAMIENTO COMBINADO DE CAL CON ABLANDADOR DE AGUA POR INTERCAMBIO DE BASE. Una excelente combinación para el tratamiento de aguas para calderas es el empleo de cal en el proceso de eliminación de dureza temporal seguida de un tratamiento de intercambio de b se. Este proceso combinado elimina la desventaja de una alta alcalinidad del contenido de CO2 en el líquido caliente, debido a la conversión de los bicarbonatos y por otra parte este tratamiento con cal reduce el total de sólidos en el líquido, en la proporción de cal eliminada. Una desventaja es que las reacciones caliza son muy le s, se aconseja un filtro de arena intermedio y agregar para la precipitación retardada el metafosfato sódico para estabilizar el agua tratada con cal, a fin de que el carbonato cálcico no se separe de la solución hasta que lleguen a las calderas. Se recomienda en este caso cuando se usa cal zeolitas orgánicos pues estas resisten reacciones y cuando el se trata con metafosfato sódico se puede eliminar con bonato que n lavado ácido. Por ejemplo si queremos tratar 50 galones / min. con 200 ppm de bicarbonato (HCO3) : 50 galones / minuto 200 ppm de bicarbonato HCO3 86 Peso equivalente de cal : 37.1 Peso equivalente de bicarbonato : 61 200 / 61 ppm = 3.27 ppm. 3.27 x 37.1 = 121 al 9º % de cal. Al 100 % = 134 ppm. 120 ppm 134 ppm 1 lb 1000 galones 1.11 lbs. por cada 1000 galones 50 galones / minuto x 60 min. / h = 3000 galones / hora 3000 x 2 (2 horas por ser muy lenta la reacción de cal) = 6000 galones. 1.11 x 3000 / 1000 = 3.33 lb de cal / hora 1000 ppm /175 = 5.84 gramos / galón 50 x 1440 = 72200 galones 72200 galones x 5.84 gr / galón = 421.648 gr . min. 421.648 / 3000 = 14 pie3 de resina 4.8 S is tema electro lítico e intercambio iónico co mbinado s Este método usa un sistema electrolítico para la recuperación primaria, y un sistema de intercambio iónico con preci para desplatar aún más el efluente. 87 n in situ INTERCAMBIO IONICO: Existen 4 tipos de resinas más comunes, sus reacciones típicas son las siguientes: Reacciones de Intercambio Catiónico de Acido fuerte 4.9 con Anodo de H2 SO4 : a).- R2S O3 H + NaOH R2 S O3 Na + H2 O b).- R2 S O3 H + NaCl R2 S O3 Na + HCl c).- (R2 S O)2 Ca + 2NaCl 2R2 S O3 H + CaCl2 Ablandamiento con s oda caus tica en lug ar de cal: En lugar de cal puede utilizarse también soda cáustica n el sistema de ablandamiento: (HCO3)2Ca + 2 NaOH CaCO3 + Na2CO3 + H2 O El caso más apropiado para el uso del NaOH como agente ablandador en lugar de cal es aquel en la que el agua natural presenta a temperatura mayor que la permanente cuando ocurre la soda añadida se convierte en Na2CO3 o para reaccionar con los carbonatos. 4.10 TRATAMIENTO CON ALUMINATO S ODICO: En el método cal- soda para mejorar el tratamiento y eliminar el magnesio residual se emplea el aluminato sódico. Este producto con las sales de magnesio forman el aluminato de magnesio con un precipitado floculento (reacciona con 88 floculante) que tiene un poder floculante único. También se elimina la sílice en forma de aluminio silicato insoluble de Ca ó Mg. Tabla N° 4.2 DUREZA CLORUROS S ULFATOS BICARBONATOS 0 - 3 h o ras 0 - 3 ho ras 0 - 3 ho ras 1.9 2 a 0.14 ppm 1.96 a 0 .09 ppm 1.9 a 0.1 ppm Mg (Mag ne s io ) Fuente: Elabo ración propia Se usa 0.5 ppm de aluminato sódico: Composición de Na (3) hasta Na (1) Na 3 AlO3 .NaHAlO3 .NaH2 AlO3 En la industria y solo para uso industrial y no para alimentación ó bebidas se usa el método de cal – Bario para ello se utiliza CO3 Ba ó hidrácido de Bario, en este proceso se agrega cal al agua, después de haber pasado por un lecho de carbonato de Bario. Esta sal es poco soluble pero es lo bastante insoluble para causar la precipitación de todos los sulfatos presentes; produciendo sulfato de Bario, una sustancia que es más insoluble que todos los demás conocidos: SO4 Ca + CO3Ba SO4Ba + CO3Ca SO4 Na + CO3Ba SO4Ba + CO3Na 89 Fig . 4.5 Fue nte : http://www.dwc -water.co m/e s /te c nologias /s c ale -rus t-c orros ion-re mo val/inde x.html ABLANDADOR DE AGUA 4.11 Es tabilizac ió n de l ag ua. El índice de estabilización es igual a dos veces el pH d – pH agua. Si el agua tiene un valor de índice de estabilidad menor de 6 forma una capa protectora de CO3 Ca en cambio si es mayor de 7 tiene propiedades corrosivas . 90 4.11.1 CUAL ES EL S IGNIFICADO DEL pH EN EL AGUA: La acidez se refiere a la presencia del H+, el H2O se disocia débilmente en en H+ y OH- existiendo una relación constante entre ellas, la cual es función de la temperatura. Así por ejemplo a la temperatura de 25 °C el producto de la concentración molar del H+ por la concentración molar de OHes de 10-14. ( H+ + OH- ) = K = 10-14 gramos mol / litro a 25 °C. En la relación con la acidez se ha definido el término pH al logaritmo del recíproco de la concentración del + expresado en ion gramo/litro: 4.11.2 pH = log 1/H+ = - log H+ log H+ + log OH- = - 14 log H+ - log OH- = 14 p H+ = 14 + pOH- INDICE DE S ATURACION: También es bueno recordar que el pH es una función logarítmica y que un agua de pH 6.5 y 4 es 10, 100 y 1000 veces más ácida que un agua de pH igual a 7. El índice de saturación se define como la diferencia entre el pH del agua y el pH correspondiente a la 91 saturación con carbonato de Ca se llega a las siguientes conclusiones : cuando es positivo, el agua es incrusta e (precipitación de una película de CaCO3 ; cuando es negativo el agua es corrosivo. 4.11.3 INDICE DE ES TABILIDAD Es igual a : dos veces el pH ind. - ph agua. Si el agua tiene un valor de índice de estabilidad menor de 6 for na capa protectora de CaCO3 , en cambio si es mayor de 7 tiene propiedades corrosivas. También es bueno recordar que el pH es una función logarítmica y que un agua de pH 6, 5 y4 es 10, 100 y 1000 más ácido que un agua de pH igual a 4.12 DES INFECCION DEL AGUA 4.12.1 CLORACION Se entiende por desinfección del agua aquel método que permite la destrucción de los agentes capaces de producir infección mediante la aplicación directa de medios físicos o químicos aunque existen métodos microbianos (esporas) que no son afectados por métodos corrientes de desinfección. Desde hace muchos años hasta la actualidad prácticamente solo la cloración es el método que se ut za para la desinfección del agua. Tras largos años de est 92 o se ha concluido que el cloro y sus compuestos son activos desinfectantes para la destrucción de la flora bacteriana y en especial la de origen entérico (diarreas). 4.12.2 PRINCIPALES RAZONES PARA S U US O: 4.12.3 1.- Fácil aplicación. 2.- Bajo costo. 3.- Efecto inocuo en el hombre. 4. - Facilidad para mantener el cloro residual. 5.- Una efectiva acción. VENTAJAS : 1.- Se pueden aplicar en las diferentes atapas del proceso de purificación. 2.- La coagulación se hace más efectiva especialmente enagua con color café. 3.- Retarda la descomposición de los lodos acumulados en los estanques de sedimentación y reduce la producción de olor y sabor. 4.- La pre cloración controla el crecimiento de las algas y reduce la coagulación microbiana en los filtros de arena. 93 4.12.4 EL CLORO El gas es 2.5 veces más pesado que el aire a T y Presión normales, cuando se escapa tiende a estacionarse en lugares bajos. El cloro se vende en botellas y en cilindros, estos cilindros cuando se cargan no se llenan completamente cloro líquido, sino que se deja un volumen para el cloro gaseoso de tal manera que los respectivos volúmenes en un momento dado están regulados por la temperatura del medio ambiente sin originar presión excesiva. Los cilindros nunca deben calentarse por medio eléctricos, llama, que sobrepasen los 52 °C. La aplica n de cloro se hace a través de dosificadores. Es posible aplicar soluciones de hipoclorito, en ambos casos las cantidades son pequeñas ya que un cloro resi ual mínimo de 0.05 ppm es suficiente para asignar la calid d en cierto tipo de agua. El cloro es irritante para la mucosa, garganta, nariz y pulmones y en suficiente concentración puede causar accidentes y la muerte . 94 Tabla N° : 4.3 EFECTOS QUE OCAS IONA EL GAS CLORO EN EL HOMBRE : ppm DE CLORO EN EL AIRE Apenas percibido 3.5 Irritación en la garganta 15.1 Tos 30.2 Peligroso por 30’ de 40 – 60 exposición Fatal a corta exposición 1000 ( 0.1 % ) Fuente: Elabo ración propia A Temperatura normal el gas seco no reacciona con el Pb, Fe Cu, pero la humedad lo hace altamente corrosivo. Una de las principales desventajas de la cloración es que el cloro es venenoso y puede llagar a ser peligroso a las operaciones. De ello el peligro es muy ligero ya que todos los fabricantes de aparatos de cloración prestan especial atención a este peligro y proporcionan defensas especiales, la misma caceta de cloración suele estar colocados a c erta distancia de los edificios centrales. En todo caso la sensación de ahogo que produce el gas cloro hará enseguida aviso e cualquier peligro que pueda existir, no se debe permitir que el cloro se humedezca porque aumenta su corrosividad. 95 4.12.5 FACTORES QUE INFLUYEN EN LA ACCION DEL CLORO: La acción bactericida del Cl depende una serie de variables que tiene gran importancia en el rendimiento: a.- Naturaleza de los organismos que ha de destruir. b.- Grado de concentración de estos microorganismos. c.- Tiempo de contacto entre el desinfectante y los microorganismos. d.- Concentración y composición de los agentes químicos liberados en el agua. e.- Temperatura del agua. f.- Concentración y composición de las impurezas presentes en el agua. (Ej.: algas). 4.12.6 g .- pH del agua. h.- Tipo de agua a tratar. QUIMICA Y DINAMICA DE LA CLORACION: Cl2 + H2 O HClO + HCl 96 HClO : Acido débil, se desioniza y se descompone en : cloro activo que destruye las bacterias. Cuando el gas cloro se disuelve en el agua para lograr una solución acuosa tal como la que se aplica al agua para desinfectarla. HCLO.El ácido es débil y se descompone en H+ y ClO- . Estas ecuaciones son reversibles y dependen el pH del agua predominando el ácido hipocloroso de bajo pH.Los agent s desinfectantes son el HClO y el y el ion ClO- siendo mucho más activo el HClO. Las proporciones relativas del HClO y el ion CLO- son funciones del pH. Cuando no se echa cloro en forma de s sino como sólido (sal). Ca(ClO4) = Ca ++ + 2ClO- CLO- + H+ = HClO Se ha definido como cloro combinado disponible al cloro que existe en el agua en combinación química con el amoníaco o compuestos orgánicos nitrogenados. Sólo se ha estudiado la capacidad de desinfectante del cloro (cloro aminas), el cual tiene una capacidad oxid nte menor que el cloro libre. 97 Las cloraminas pueden ser: monocloraminas (NH2Cl), dicloraminas (NHCl2) y tricloraminas (NHCl3). La cantidad y tipo depende del pH. Sobre pH 8.5 solo existe monocloraminas, entre 4.4 y 5 sólo dicloraminas y deba de 4.4 apenas tricloraminas. 4.12.7 DEMANDA DE CLORO: Es la diferencia entre la cantidad de Cl agregado y la cantidad de cloro residual (libre y combinado disponible) después de un período determinado. Por cloración libre residual se entiende la aplicación l cloro al agua para producir directamente o a través de la distribución del amoníaco en cloro libre y residual y que se puede mantener en el sistema de distribución. La cantidad práctica de cloro requerido para lograr destruir el amoníaco libre en el agua es de 10 a 25 veces más cloro que la cantidad del amoníaco en el agua debido a la presencia de materia libre orgánica, de tal manera que la dosis de cloro son ordinariamente de 2 a 5 ppm y algunas veces de 20 a 30 ppm y para algunas aguas negras de 50 a 200 ppm. La demanda de cloro de un agua depende de muchas variables pero se puede pensar en términos generales en las clases de aguas siguientes: 98 4.12.8 DEMANDA DE CLORO EN LAS AGUAS NEGRAS : Ø Agua negra cruda para controlar olor 10.0 ppm. Ø Agua negra sedimentada 8.00 ppm Ø Efluente de estanque séptico 5 a 7 ppm Ø Efluentes de tratamiento en el proceso de barros activados 4.12.9 3.00 ppm DOS IS DE CLORO LIBRE PARA MATAR EL E. COLI y E. TYPHOS A EN FUNCION DE pH y TEMPERATURA: Tabla N° 4.4 Org anis mo pH Dos is de Cl2 T° C Ø min para Matar 100 % libre ppm E. Coli 7 0.05 20 - 25 1 E. Coli 7 0.04 2-5 3 E. Coli 8.5 0.07 20 - 25 10 E. Coli 8.5 0.07 2-5 20 E. Coli 9.8 0.15 20 - 25 10 E. Coli 9.8 0.72 2-5 10-20 E. Typhosa 7.0 0.06 20 - 25 10 E. Typhosa 7.0 0.08 2-5 10 E. Typhosa 9.8 0.16 20 - 25 10 E. Typhosa 9.8 0.4-0.74 2-5 10 99 4.12.10 CANTIDAD DE CLORO LIBRE Y CLORAMINA PARA DES TRUIR EN 15 MINUTOS 100 % DE EBERTHELLA TYPHOS A EN UN CULTIVO: Tabla N° 4.5 pH ppm de Clo ro libre Ppm de c loramina libre 6.5 0.04 1.5 8.5 0.06 1.8 10.5 0.40 1.8 4.12.11 DOS IS DE CLORO LIBRE: La cantidad de Cl2 que se aplican al H2O son superiores a la dosis de desinfectantes propiamente dicho debido a la demanda de Cl2 y cloro residual. Es buena práctica mantener Cl2 residual libre de 0.2 a 0.3 ppm después de 10 minutos de contacto. 4.12.12 CONTROL DE LA CLORACION: El método más usado para determinar la cantidad de cloro residual emplea como indicador la ortotolidina que es compuesto difenil – diamino – dimetilo, de fórmula : [ NH2 CH3C6H3 ]2 con agregado de arsenito de sodio AsNa inmediatamente dentro de los 5 segundos, después de agregado la ortotolidina que reacciona con el Cl2 que origina un color amarillo verdoso cuya intensidad depe de de su concentración y la cantidad de Cl2 presente. Existen 100 discos o soluciones normales indicadores de la cantida de Cl2 4.13 IODACION: La aplicación del Iodo en el agua se inicia en el año de 1963 en Florida EE.UU. El proceso consiste en el lavado en contracorriente de una capa de cristales de Iodo colocado en un dosificador, tendiente a obtener una solución madre co ntrada que se diluye en el consumo de agua que se a los servicios. El tiempo de contacto en el dosificador es de 3.8 a 4.0 minutos, con una concentración de185 mg/lt. La temperatura del agua varía entre 12 a 18 °C. En un experimento realizado, la concentración media del iodo logrado en el agua tratada fue de 0.48 mg/lt, con una gua conteniendo 1 colibacilo por 10 cc. 4.13.1 S OLUCIONES ACUOS AS DE IODO: Se usa una mezcla de 5 % de I puro, 10 % IK y 85 % de H2 O, para la desinfección basta agregar 2 gotas por litr de H2 O se mezclan por agitación y se dejan en reposo durante 20 minutos 101 4.14 CONTROL DE OLOR Y S ABOR. Las causas de olor, color y sabor en el agua se agrupan en dos grandes tipos: Naturales y originados por el hombre. En el primer tipo se incluyen algas, ajos, vegetación descomposición, lino orgánicos, minerales en descompos ción y las generadas por el hombre, las aguas negras y las aguas residuales . 4.14.1 METODOS PARA ELIMINAR EL OLOR: Hay dos métodos para eliminar el olor: 1).- Méto do Preventivo : Las algas son la causa más frecuente é importante para la producción del olor y sabor desagradables, requisito indispensable para el desarrollo de las algas es la luz solar. Se usa como medida preventiva el SO4 Cu pudiéndose usar dosis de hasta 12 ppm por lo que tendríamos 3 ppm. pe Cu en el H2O que estarían entre los estándares, luego se puede usar el Cl2 que destruye muchos micro organismos que no han sido 102 eliminados por el SO4Cu, también el carbón activado que se basa en el oscurecimiento de las aguas y que esto hace imposible la vida de las algas. 2).- Méto do Co rrectivo : Co agulación: Se utiliza la aireación, coagulación, carbón activado, Cl2 en combinación con NH3 , ozono, dióxido de cloro. 3) Aireación: Siempre se debe inyectar aire para mejorar el sabor y el color originado por la falta de O2 y presencia de gases indeseadas. 6.4.2 Ayudan a la eliminació n de co lo r, s abo r del H2 O. 1.- Carbó n Activado : Es una de las sustancias más empleadas para el control de olor, color y sabor en el tratamiento de agua. Para efectos de adsorción elimina las impurezas de olor, color y sabor en el agua hasta que alcance el equilibrio. 103 2..- Clo ració n: El cloro libre por su poder oxidante, oxida muchos compuestos y produce olor y sabor. 4.14.3 EFECTOS DEL Cl2 EN EL AGUA S OBRE DIFERENTES ORGANISMOS Y S ABORES QUE ES TOS ORIGINAN: Tabla N° 4.7 Organis mo Po r c c . Dos is de Cloro Org anis mos Sabor H2O Cl2 ppm res id. l: pm dis tribuc ión e liminado Symura 1 – 25 0.3 0.2 – 0.1 Si SI Symura 50 – 10 0.5 – 0.7 0.2 Si SI Symura 200 0.7 – 0.9 0.3 Si SI Uroglena 2000 0.5 0.1 Si SI Dynobryan 500 0.5 0.1 Si SI Uroglena 6000 0.5 0.1 Si SI Asteriorela 1350 0.7 0.2 Si (50 %) No Alfanizomenan 1500 0.7 - 0.8 0.2 Si (50 %) No 4.14.4 S us tancias que tienen clo ro libre en po rcentajes : Hipoclorito de sodio tiene : 15 % de cloro libre. Hipoclorito de calcio tiene: 70 % de cloro libre. (4 – 2 gotas /litro de agua) 104 Cal clorada tiene : 35 % de cloro libre. (4 – 2 gotas /litro de agua). El cloro se agrega en fase líquida y gaseosa. 4.14.5 HIPOCLORITO DE S ODIO: Es un producto para blanquear la ropa, se vende en el mercado en forma líquida, suele contener de 3 a 5 % de cloro libre. Si se quiere utilizar se tiene que diluir al 1 % , se toma 250 cc. y se agregan 750 cc de agua, se tendrá un solución al 1 %, esta solución se agrega de 2 a 4 gotas por litro, se agita y se deja reposar por 20 minutos. Hay soluciones que tienen de hasta 15 % de cloro libre par usos especiales. 4.14.6 HIPOCLORITO DE CALCIO : Compuesto blanco que generalmente se encuentra en estado de polvo con 70 % de cloro libre, a 1 litro de agua se agrega 15 gramos de hipoclorito de calcio y se obtiene una solución de una concentración aproximada de 1 %. 4.14.7. CAL CLORADA: Es un, polvo blanco, que puede tener hasta 35 % de cloro libre. El oxicloruro de calcio es el constituyente principal del cloruro de cal o cal clorada cuyo compuesto reacciona con el agua originando cloro libre. 105 En 1 litro de agua se agrega 35 gramos de cal clorada obteniendo una titulación de 1 % aproximado. Tanto en el hipoclorito como en la cal clorada se debe agregar de 3 a 4 gotas por litro de agua. 4.14.8 DETERMINACION DEL CLORO ACTIVO EN S OLUCION DE HIPOCLORITO DE S ODIO: REACTIVOS : Yoduro de potasio: ………………….. 2 grs. H2SO4 al 25 % ........………………. 15 cc Tiosulfato : 0.1 N Na2S2 O3 ….………… Solución indicador de almidón : 0.5 grs. de almidón se disuelve en 100 cc de H2O caliente. % de Cl activo = V g as tado ( 0.00355 ) ( 1000 ) / Pes de 1 cc de mu es tra (ClONa) PROCEDIMIENTO: Ø Pesar 1 cc de muestra de ClONa y disolverlo en 100 cc de agua destilada. Ø Tomar 100 cc de esta solución y mezclarla con 150 cc de H2O destilada y 2 gr de IK mas 15 cc de H2SO4 al 25 % . Ø Titular con el Na2 S2O3 0.1 N a un color amarillo pálido, luego añadir 2 cc de solución de almidón , 106 seguir titulando hasta que el color azul desaparezca, leer el volumen gastado (Vg). 1) PRIMER CAS O: Se tiene una solución de ClO- con una solución de 25 % de Cl2 libre. Se quiere preparar una solución de 2 % de ClO- por litro de H2 O Hipoclorito = % de Cl2 libre en nueva solución x 1000 / % de Cl2 libre en en cc., en solución primitiva. Ejemplo: 2 x 1000 / 25 = 80 cc. Solución final = 80 cc + 920 cc. = 1000 cc ó 1 lit o de hipoclorito. 2) S EGUNDO CAS O: Que cantidad de ClO- de 60 % de Cl2 libre debe agregarse a un estanque de 2000 m3 para obtener 2 ppm de cloro libre. Hipoclorito en cc = Vo lumen del H2 O expres ado en Lts . x ppm reque rido / %d e Cl Libre x 10 primitiva s o lu ción = 2000000 x 2 ppm / 60 x 10 = 6.6 3) TERCER CAS O: Se tiene una solución de hipoclorito al 2 % de Cl libre del cual se agregan 2 gotas a 4 litros de 107 H2O. Se pregunta cuantas ppm de cloro libre se han agregado. ppm de Cl libre = Hipoclorito en cc x % de Cl libre x 10 primitiva sol / Volumen de H2 O en Lts. ppm = 2 /20 x (2x10) / 4 = 0.5 ppm. ( considerar 20 gotas = 1 ml ). ppm de Cl = 2 gotas / 4 lts. x1ml/20 gotas x 1 gr / 1 ml x 2 gr Cl/100 gr x 1000 mg/ 1 gr = 0.5 ppm. Otra fo rma: Si 20 gotas < > 1 ml. , 2 gotas = 0.1 ml. Luego: ppm = 0.1 ml. X 0.02/4 x 103 ml. = 10-1 x 2 x 10-2 /4 x 103 = 1 / 2 x 106 = 0.5 ppm. 4.15 FLUORACION: La influencia del F- ha sido ha sido estudiado por muchos investigadores en cantidades de 1 – 0.5 ppm. no se producen alteraciones fisiológicas, una dosis sub letal sería ingerir agua con 115 ppm de F - suponiendo un consumo de 2 litros de agua por día. 108 De las investigaciones realizadas se puede decir que e efecto del F- es positivo cuando se consume durante la formación de diente, es decir desee que nace el niño hasta los 10 a s; esta protección ha sido muy importante porque parece que dura toda la vida. También se puede decir que el agua que contiene F- podría reducir las caries en un 40 – 60 % . Los compuestos químicos usados para la fluoración son: FNa, (SiF6 Na2), (F6H2Si) . Las dos primeras son polvos, y el tercero líquido. Los equipos para fluorar el agua son similares a los dosificadore de cualquier sustancia química, siendo los siguientes dosificadores: a).- Dosificadores en solución. b).- Dosificadores en seco. Se recomienda primero fluorar y luego clorar. 4.16 REMOCION DE Fe y Mn EN AGUA: El Fe y el Mn pueden presentarse como sales inorgánicas solubles en combinaciones inorgánicas de óxidos hidratados coloidales. La concentración de Fe y Mn por lo general pasa de 5 a 3 ppm respectivamente, sin embargo ocasionalmente suele darse concentraciones mayores. 109 Los compuestos de Fe y Mn en aguas naturales con ausencia de oxígeno son estables y permanecen en solución especial a bajo pH. Hay tres métodos para eliminar el Fe y el Mn : a) Proceso de ablandamiento con cal. b) Proceso de oxidación. c) Proceso de intercambio de base. 4.17 Pro ces o d e ab landamiento co n cal: Se utiliza para aguas que necesitan ser ablandadas ó en casos especiales estabilizadas se puede eliminar el Fe y Mn en suficientes cantidades como para subir el pH a un valor super or a 8.3 (el cual depende de varios factores: contenido de y Mn, alcalinidad, coagulantes empleados, etc.). Se precisa un pH 9.4 para eliminar el Mn en agua relativamente blandas. Los óxidos hidratados de Fe y Mn se eliminan efectivamente por coagulación y filtración. 4.18 PROCESO DE OXIDACION: Se usa la aireación con doble propósito, subir el pH (eliminación de CO2) incrementar el O2 disuelto. 4 Fe + 8HCO3 - + 2 H2 O 4 Fe(OH)3 + 8 CO2 + O2 110 Cuyo efecto hace disminuir la solubilidad del Fe y del Mn, en la práctica el agua se hace pasar a través de camas o hos de contacto con piedras trituradas con coke u otros mater ales.Los lechos tiene una profundidad que varían de 1.80 a 3.0 m para carga de 26 a 58 L/min. Trabajan como filtros purificadores. Variando el tamaño de 1.5 a 2 pulgadas. La acumulación de Fe y Mn en la superficie de contacto se elimina por un lavado rápido. El proceso de eliminación de Fe y Mn abarca : Aireación + lecho de contacto + coagulación + sedimentación + filtración. Los compuestos de Fe y Mn en combinación orgánica necesitan una oxidación previa con Cl con permanganato de potasio u otro oxidante.El ciclo sería: Oxidación materia orgánica + aireación + lecho de contacto + coagulación + sedimentación + filtración 4.19 PROCES O DE INTERCAMBIO DE BAS E.La zeolita del tipo natural u otros intercambiadores p utilizarse para eliminar el Mn en el agua sin exponerl den al O2 , se pasa por la zeolita de calcio la cual se regenera con cloruor dr sodio cuando no es necesario ablandar el agua. Las concentraciones de Fe y Mn par este tipo de intercambio no debe ser super or a 1 ppm y 111 debe ser agua clara. También se utiliza zeolita de Mn que es un producto fácil de utilizar y oxidado con permanganato de potasio son muy eficaces para eliminar el Fe y el Mn: NaZ MnCl2 = MnZ + ClNa MnZ 2KMnO4 = K2Z.MnO.Mn2 O7 . Este material actúa en el proceso como una fuente permanente de oxígeno precipitando al Fe y Mn como óxidos hidratados. Los precipitados que se acumulan en el lec o de zeolita son alimentados por lavado, la regeneración se efectúa por una solución de KMnO4 al 0.60 % se requiere 0.6 Kg de KMnO4 por Kg de Mn eliminado. También se puede usar la zeolita en función sódica regenerándose con ClNa cuando se requiere tener agua blanda. 4.20 TRATAMIENTO DE AGUA PARA LA INDUSTRIA: El problema de la dureza del agua para el uso de las fábricas produjo el proceso cal-sosa para poder salir al paso de ésta situación por los años 1940, se empezó a utilizar este proceso, utilizando lechada de cal en una concentración del 10 La cal reacciona con los HCO3- formando CaCO3 e hidrato magnésico, ambos insolubles, por lo que se deposita en los tanque sedimentación, según las siguientes ecuaciones: (CO3H) 2Ca + (OH)2Ca 2 CaCO3 112 + 2H2O de (CO3H) 2 Mg + 2(OH)2Ca (OH)2 Mg + 2 CaCO3 + 2H2O La dureza permanente debido a sulfuros, sulfatos cloruros y nitratos cálcicos y magnésicos se tratan con Na2 CO3 , así las sales se convierten en depósitos insolubles según las siguie es ecuaciones: SO4Ca + CO3Na2 CaCO3 + SO4Na2 Quedando en el agua una sal sódica, ejemplo NaCl. La dureza permanente de las sales de Mg, tales como SO4= pueden desaparecer con equivalente de sal sódica cal pero producen una cantidad y esta tiene que ser reduci con Na2CO3 Ejemplo: MgSO4 + Ca(OH)2 Mg(OH)2 + CaSO4 En el proceso cal sosa, estos productos químicos se combinan de tal forma que dan las reacciones mencionad y así se eliminan la dureza temporal como la permanente. Se sue n añadir un exceso de estos productos químicos a fin de que las reacciones químicas de ablandamiento llegan a un final conveniente y dar luego agua blanda y una dureza de 40 ppm. Este proceso es ll mado en frío porque las reacciones se realizan a temperatura ambiente . 113 La detención del agua con los reactantes se hace como mínimo en 90 minutos. 4.21 PREPARACION DE LOS REACTIVOS: A veces se utilizan los reactivos en forma de polvo seco que son convenientes para las instalaciones que trabajan de modo intermitente. En la mayoría de los casos se emplean como soluciones o suspensiones en agua en un depósito a la altura del suelo la que se bombea al suelo. 4.21.1 MEDICION DE LOS REACTIVOS . Cada carga de agua que pasa se añade una cantidad definida de reactivo . Se puede agregar o graduar la cantidad de reactivo, ablandamiento alterando la proporción de agua que pasa al mecanismo de medida, también variando las concentraciones de los reactivos ó combinando la cantidad de reactivos añadidos. 4.21.2 MEZCLA Y PRECIPITACIÓN: Los reactivos y el agua fluyen juntos hacia el tanque de reacciones quedando convenientemente mezclados, conteniendo después en el tanque de sedimentación y reactantes. 114 4.21.3 CLARIFICADO Y FILTRADO: La separación de los precipitados, siempre se debe hacer que el agua fluya hacia arriba y los sólidos hacia abajo y la velocidad durante la sedimentación no excedan a 6 pies/hora. Siempre se presenta precipitados en el agua de salida que hay que eliminar y el agua se debe pasar po filtros. Un detalle que no debe olvidarse es la disolución de parte del sílice, esto ocurrirá ciertamente si el líquido alimentado claramente alcalino, si se utiliza filtros de arena el pH debe mantenerse por debajo de 10, de otro modo el sílice disuelto puede reaccionar en las calderas con la dureza residual del agua para formar incrustaciones sílicas. 4.22 EJEMPLO DE ANALIS IS DE AGUA : AGUA DE POZO: Total de minerales disueltos : 0.00 ppm Materia orgánica : 0.00 ppm Sólidos en suspensión : 5.00 ppm Extracto de solvente : 0.00 ppm pH : 7.7 Alcalinidad a la fenolftaleína : 0.00 ppm Alcalinidad al anaranjado de metilo : 205 ppm Alcalinidad al hidróxido como CO3Ca : 0.00 ppm 115 Sodio y Potasio como Na : 38 ppm Bicarbonato como HCO3 : 250 ppm Carbonato como CO3 : 0.00 ppm Cloruro como Cl- : 11.00 ppm Sulfato como SO4 : 132 ppm Nitrato como NO3 : 0.00 ppm Dióxido de carbono como CO2 : 10.00 ppm Turbidez : 5 Características físicas de la muestra : Clara ppm En relación a los datos experimentales obtenidos, realizar los cálculos siguientes: 1.- Cálcu lo de lo s equivalentes por millón ( e.p.m.): a) b) Magnesio (Mg) = 31.0 ppm Peso molecular = 24.3 ppm Valencia = Peso equivalente = 2 24.3/2 = 12.15 p.e. 31 ppm / 12.15p.e. = 2.55 e.p.m. Calcio (Ca) 6.2 ppm = Peso molecular Valencia = 40.1 = 116 2 c) Peso equivalente = 6.2 ppm / 20.05 = S odio (Na) = 38.00 ppm Peso molecular e) f) 0.309 e.p.m. = 23.00 Valencia d) 40.1/2 = 20.05 p.e. = 1 Peso equivalente = 23/1 = 38 ppm / 23 p.e. 1.65 e.p.m. = 23 p.e. Bic arbonato (HCO3) = 250 ppm Peso molecular = 61, Valencia Peso equivalente = 61/1 250 ppm / 61 p.e. = 4.09 e.p.m. S ulfato (S O4 )= = 1 = 61 p.e. = 138 ppm Peso molecular = 96.06 Valencia = 2 Peso equivalente = 96.06/2 = 48.03 p.e. 138 ppm/48.03 p.e. = 2.87 e.p.m. Clo ruro s (Cl-) Peso molecular Valencia = 11 ppm = 35.46 = 117 1 Peso equivalente = 11 ppm / 35.46 p.e. = 2.- 35.46/1 = 35.46 p.e. 0.31 e.p.m. Cálculo s expres ando co mo c arbo nato de Calcio : CO3 Ca: Peso molecular Valencia a) = 100.1 = 2 Ca: Peso equivalente CO3Ca/Peso equivalente Ca = 50.1 / 20.05 = 2.5 veces 62 ppm (de tabla) x 2.5 = 155 ppm como c rbonato de calcio. b) Mg : Peso equivalente CO3Ca/Peso equivalente Mg = 50.1/12.15 = 4.12 veces 31 ppm (de tabla) x 4.12 = 127.7 ppm como carbonato de calcio. c) Na: Peso equivalente CO3Ca/Peso equivalente Na = 50.1/23 = 2.17 veces 38 ppm (de tabla) x 2.17 = 82.5 ppm como carbonato 3.- calcio. Cálculo s expres ado s co mo bicarbonato s : Bicarbonatos: 50.1 / 61 = 0.82 veces 250 (de tabla) x 0.82 4.- = 205 ppm como CO3 Ca. Cálculo s expres ado s co mo S ulfato s (S O4) = : Sulfatos (SO4) = = 118 50.1 / 48.03 = 1.04 veces 1.04 x 138 (de tabla) 5.- = 144 ppm como CO3Ca. Cálculo s e xpres ado s co mo cloruro s : Cloruros (Cl-) = 50.1 / 35.46 = 1.412 veces. 11 ppm (de tabla) x 1.412 6.- = 15.5 ppm. Calculando al 90 %de apro ximación: a).- Bic arbonato s : 250 ppm / 61 p.e. = 4.1 e.p.m. b).- Ca(OH)2 : Peso molecular Valencia : 74.1 : 2 Peso equivalente : 74.1 / 2 = 37.05 37.05 x 4.1 e.p.m. = 152 ppm al 90 % Al 100 % 168.8 ppm. 120 ppm ……………. 1 lb …………1000 galones 168.8 ppm = 1.4 lb de cal por cada 1000 galones de agua. c ).- S ulfato s (S O4 )= : 138 ppm (de tablas ) 138 ppm / 48.03 = 2.87 e.p.m. d).- Na 2 CO3 : Peso molecular Valencia = = 119 106 2 Peso equivalente = 53 x 2.87 120 106 / 2 = = 53 p.e. 152 al 90 % ppm………1 lb……………..1000 galones 168.8 ppm……1.4 lbs de Na2 CO3 po r c/1000 g alo nes de agua. TABLA N° 4.8 DATOS EXPERIMENTALES ppm co mo CO3 Ca p.e. ppm Cationes Anio nes Cationes Anion es Mg 12.15 31 2.54 ---------- 127 ----------- Ca 20.05 62 3.10 ---------- 155 ----------- Na 23 38 1.64 ---------- 83 ----------- Bicarbonato s 61 250 ------------ 4.10 ------------ 205 S ulfato s 48.03 138 ------------ 2.87 ------------ 144 Clo ruro s 35.45 11 ------------ 0.31 ------------ 15 7.28 7.28 365 365 TOTAL Alrededor de 70 años atrás se sintetizó las resinas or tiene la propiedad de cambiar los iones de calcio por nicas que dio. Esta resina es llamada Estireno, que es un catión más utilizada y est se basa en : NaZ (re s ina) + S O4 Ca S O4 Na + CaZ La reacción constituye la base sobre la que se fundame ablandamiento de agua para alimentar la caldera y que muchísimo la dureza del agua. 120 en el de reducir CAPITULO V 5. COAGULACION FLOCULACION: La operación de coagulación y floculación se lleva a cabo siempre que previamente se ha realizado el desarenado y pre decantado, para luego aplicar el proceso de coagulación y floculación s decir cuando el agua a tratar ya está libre de partículas mayores y paraqué pueda actuar los productos químicos que se utilice 5.1 DES ARENADORES Son proyectadas para eliminar la grava fina y las pied ecillas que arrastra el agua en los canales tiene generalmente forma rectan ular y están construidas de tal manera de reducir la velocidad del agua para que sedimenten las partículas incluyendo la arena, se puede diseñar para reducir la turbidez de aproximadamente de 6000 a 4000 pm. Con un tiempo de retención de 15 minutos y una velocidad del agua de 0.10 m/seg para que decanten arena fina hasta de 0.1 mm de diámetro 5.2 PRE DECANTADORES : Se utilizan para el agua turbia que se quiere clarific pueden ser de forma rectangular y con dimensiones que permiten un pe o de retención de 1 hora y ½ a 2 hora y ½ . Por ejemplo, una unidad p de tener de 73 m de largo por 23 m de ancho con una profundidad de 3.20 m, con un tiempo de retención de 1 hora 50 minutos, y esta unidad tiene una capacidad de 570 Lts/Seg. 121 5.3 COAGULACIÓN: La coagulación, es el proceso mediante el cual se produce la desestabilización de las partículas en suspensión por neutral ión de carga al reaccionar con una sustancia química de carga contraria Fig . 5.1 El objeto es facilitar la sedimentación de partículas namente divididos al estilo o al estado coloidal mediante el agregado de sustancias químicas. 5.4 ETAPAS DE LA COAGULACIÓN: a. Agregados de sustancias químicas. b. Mezcla o difusión. c. Floculación. Cuando se agrega un coagulante al agua para precipitar ó remover la turbiedad y el color, se producen dos fases antes que el floculo esté en condiciones de sedimentar. 122 5.4.1 PRIMERA FAS E: El coagulante al disolverlo se disocia en iones, si se usa AI2(S O4)3, se degrada en iones positivos trivalentes Al+3 los cuales reducen las cargas negativas del color o turbiedad, por otro lado los iones reaccionan con la alcalinidad l agua dando óxidos hidratados de aluminio con carga positiva que neutralizan las cargas negativas del color o turbiedad; concluyéndose que en ésta primera etapa se requiere una mezcla activa y turbulenta. Cuando se ha producido la neutralización de la mayor parte de los coloides Al+3 ó (OH)se forma un microflóculo que no sedimenta. 5.4..2 S EGUNDA FAS E: Mediante la agitación leve se incrementa el tamaño del floculo por absorción por cuanto se ha generado una superficie activa, los micro flóculos se transforman lentamente en flóculos susceptibles de sedimentar. 5.5 AGENTES COAGULANTES: Lo s principales co agulantes s on: a.- ALUMBRES : 1. Sulfato de aluminio cristalizado AI2(S04)3 (es tal vez el más utilizado). 2. Alumbre potásico ó sulfato de aluminio y potasio : AI2 (S O4) 3 K2 S O4 .24H2 O. 123 3. Alumbre amónico o sulfato de aluminio y amonio: AI2 (S O4) 3 . (NH3 )2 S O4 .24H2 O. 4. El aluminato de sodio: b.- Na2 AI2 O4 . S ALES DE HIERRO: 1. Sulfato ferroso : SO4Fe.7H2 O. 2. Cloruro férrico: CI3Fe ( se puede obtener como líquido con 42 % de H2O y 14 % de Fe, sal cristalizado ; CI3Fe.6 H2O con 20 % de Fe ; sal anhidra CI3 Fe con 39 % de Fe ); es una sustancia química muy corrosiva. 3. Sulfato férrico Fe2(SO4 )3 varia desde 62 % de Fe2(SO4) 3 a sal anhidra con un promedio de de 25 % de Fe, es una sustancia corrosiva. 4. Sulfato y cloruro férrico : Fe2(SO4)3 CI3Fe.7 H2O ( ésta se obtiene por oxidación del sulfato ferroso con cloro ). Algunas reacciones químicas que se generan durante el proceso de la floculación: 1. AI2 (S O4 )314H2 O + 3Ca(HCO3 )2 2AI(OH)3 + 3CaSO4 + 6CO2 + 14Hz O 2.- AI2 (S O4 )314H2 O + 6NaHCO3 2AI(OH)3 (floc ) + 3NaS O4 + 6CO2 + 14Hz O 3.- AI2 (S O4 )314H2 O +3Na 2CO3 2AI(OH)3 (flo c ) + 3NaS O4 + 3CO2 + 14HzO 124 4.- AI2 (S O4 )314H2 O +3NaOH 5.- AI2 (S 0 4 )3 14H2 0 + 3Ca(OH)2 c- 2AI(OH)3 (floc ) + 3NaS O4 + 14HzO 2AI(OH)3 (floc ) + 3CaS O4 + 14Hz O LOS POLIELECTROLITOS : Son sustancias orgánicas que solo se utilizan en casos especiales porque los costos son altos. 5.6 FACTORES QUE INFLUYEN EN LA COAGULACIÓN: a). Clases de coagulantes. b) Cantidad de coagulantes. c). Cantidad y características del color y turbiedad. d) Características químicas del agua. e). Concentración del ion H* en el agua. f.) Tiempo de mezcla y floculación, temperatura del agua. g). Violencia de la agitación. h). Presencia de un nucleoyde. En la práctica las clases de la serie óptima de la coa ación debe experimentarse , se utiliza el llamado Jar – Test ( prueba de jarras ) que consiste en un equipo compuesto por una s rie de vasos que contienen el agua problema dentro de los cuales gi an paletas a velocidad controlable. En estas pruebas se varían o cambian los coagulantes, os tiempos, el pH, etc. dejando luego un reposo de 10 a 15 minutos 125 donde se fija la dosis a la mejor proporción. La te m p eratura d e l agua in fluye e n e l tie m p o de coagulación, as í una misma muestra de agua con el mismo floculante y las mismas condiciones de temperaturas uno de 1 °C y la otra de 20 °C el tiempo para formar un bue floculo en el segundo caso es de la mitad del tiempo que es ne ario para coagular a un grado centígrado. Así mismo se mejora la coagulación o la presencia de partículas mayores (nucleoydeo) caso que se utiliza frecuentemente en aguas muy claras. FLOCULACION: Es un proceso físico para incrementar las interaccione las micro partículas haciéndola cada vez de mayor tama entre (flocs), facilitando la sedimentación. Para ello se necesita una agitación lenta. FLOCULANTE: Producto químico que se añade después de la coagulación para mejorar el tamaño, la resistencia Y la densidad de los fóculos COAGULACION - FLOCULACION Son operaciones que ayudan a la sedimentación de las suspensiones que se han formado, para ser eliminadas 126 EQUIPOS DE COAGULACION FLOCULACION Fuente: Elabo ración propia. Fue nte : Elabo ración propia 127 Fuente : Elabo ración propia 128 Fig . N° 5.6 5.8 APLICACIONES DE LOS PROCES O DE COAGULACIÓN Y FLOCULACION EN LAS INDUS TRIAS : 5.8.1 EN LA INDUSTRIA PAPELERA: Generalmente sus efluentes son ácidas no biodegradables (lignina), que son neutralizados con sosa y su tratamiento es con sulfato de aluminio y polielectrolitos. 129 5.8.2 EN LOS EFLUENTES PROVENIENTES DE LAS OPERACIONES Y PROCES OS EN LA MINERÍA: Tales como: agua de relaves , que contiene en la mayoría de los casos, ácidos y cianuros, metales pesados, sólidos (arcilla), que para su tratamiento tiene que neutralizarse y precipitar con cal. 5.8.3 EN LA CURTIEMBRE: Los efluentes derivados de las industrias de la curtiembre son altamente contaminados con grasa, sólidos, metales como el cromo, que durante el proceso ocurre Ja eliminación de la DQO. 5.8.4 EN LA INDUSTRIA TEXTIL: Debido a los contaminantes de los colorantes sintéticos se tiene una alta carga de las DQO, razón por la cual tiene que tratarse con oxido de calcio y polielectrolitos. 5.8.5 EN LOS PROCES OS ELECTROLÍTICOS : TALES COMO EL ZINCADO, COBREADO, NIQUELADO , CROMADO, PLATEADO, DORADO Y OTROS : Durante el proceso de la electrólisis intervienen muchas sustancias químicas, que contaminan el agua especialme e 130 el cromo y los cianuros, los que tiene que precipitars el cromo en forma de hidróxido. 5.9 UNIDADES DE FLOCULACION Después que las sustancias químicas han sido uniformemente difundidos a través de una agitación violenta ( un minuto ) se requiere un periodo de acondicionamiento por medio de una agitación suave, la velocidad óptima varía entre 0.15 a 0.45 m/seg. con periodo de floculación de 15 a 45 minutos. 5.10 DOS IFICADORES DE S US TANCIAS QUÍMICAS Hay dos sistemas: en seco y en disolución en las dosif en seco. 5.10.1 DOS IFICADORES EN SECO: Las sustancias químicas granuladas que se dosifican directamente al consumo o gasto total o de otra manera a un volumen pequeño de agua la cual se disuelve y se inyecta a la masa de agua a tratar. Los dosificadores pueden ser gravimétricos y volumétri os, Los dosificadores gravimétricos pueden manejar partícu mayor variación de tamaño de partículas en cambio los con sificadores volumétricos necesitan que las partículas deben ser más pequeñas. 131 Los sistemas de dosificación en seco se usa con gran éxito en AI2 (S O4 )3, Fe 2(S O4)3 cal y ceniza de sosa. Los dosificadores en solución requieren que las sustancias sean previamente disueltas en concentraciones de 1 a 6 % generalmente tiene mecanismos agitadores para conservar la uniformidad de la mezcla 132 CAPITULO VI : 6 S EDIMENTACION : El objeto de la sedimentación es eliminar las partículas suspendidas en el agua y se basa en la atracción gravitacional donde las partículas más pesadas tienden a sedimentar. VELOCIDADES DE SEDIMENTACIÓN DE PARTÍCULAS EN EL AGUA: Tabla 6.1 0-Partículas. (mm) 10 1.0 0.5 0.1 0.08 0.05 0.015 0.005 0.0015 0.001 0.0001 0.00001 Orden de Long. Veloc. de sed.m/s 1000 100 50 8 6 2.9 0.35 0.098 0.0835 0.00154 0.0000154 0.000000154 Grava Arena gruesa Arena gruesa Arena gruesa Arena fina Arena fina Arena fina Limo Limo Bacterias Part.de arcilla Part. coloidal 6.1 FACTORES QUE AFECTAN AL S EDIMENTADOR: a) Número de estanques. b) Largo del estanque. c) Ancho del estanque. d) Profundidad efectiva del estanque. e) Velocidad de flujo. 133 Tiempo.sed.1ft30cm 0.3 seg 0.3 seg 0.3 seg 38 seg 38 seg 38 seg 38 seg 33 minutos 33 minutos 35 horas 230 días 63 años DISEÑO DEL 6.2 f) Volumen para almacenamiento de lodos. g) Método de remoción de lodos. h) Sistema de Entrada. i) Sistema de salida. j) Dispositivos. OTROS FACTORES QUE S E DEBE CONS IDERAR: a) Tamaño de partículas. b) Peso específico de las partículas. c) Tendencia de las partículas en coagularse. d) Viscosidad y temperatura del agua. e) Efectos eléctricos. f) Actividades biológicas. g) Métodos de operación. Las dimensiones y tipos de estanques de sedimentación las características de las aguas, las cuales pueden ser: penden de 1. Propósito (que puede ser por remoción de cascajo y are a, se elimina con coagulación o sin ella). 2. Dirección del escurrimiento (flujo continuo en paralelo, en serie o por recirculación). 3. Tipos de remoción de lodos (limpieza hidráulica, mecánica o combinada). 4. Construcción (estanque abierto o cerrado). 5. Forma (circulares o rectangulares). 134 La velocidad promedio para el agua en los tanques de sedimentación es de 0.65 m/min. , con un tiempo de retención de 3 horas aproximadamente. La profundidad recomendable es de 3.70 m. El rendimiento normal de un sedimentador debe ser de 8 % a 90 % y la turbiedad residual con coagulantes 50 ppm. TANQUES CIRCULARES DE S EDIMENTACION: a) Alime ntación Central b) Alimentación perimetral Fig . N° 6.1 Fuente: Ro n Crites - Geo rge Tchobanog lo us 6.3 La s edimentación: Es el proceso por el cual el material sólido, transportado por una corriente de agua, se deposita en el fondo del río, embalse, canal artificial, o dispositivo construido especialmente para tal fin. Toda corriente de agua, caracterizada por su caudal, 135 velocidad y forma de la sección tiene una capacidad de transportar material sólido en suspensión. El cambio de alguna de estas características de la corriente puede hacer que material transportado se sedimente; o el material existente en l fondo o márgenes del cauce sea erosionado. En el presente ejemplo emplearemos un sedimentador discontinuo del tipo I, y dependiendo de la suspensión veremos hasta cuatro zonas diferenciadas (A, B, C, D). Zo na D: zona de sedimento, las partículas más pesadas con mayor velocidad de sedimentación son los primeros en posarse. Zo na de tran s ición : poco definida; sobre el material sedimentado se observan canales por donde asciende el luido desplazado por los sólidos depositados desde la zona al comprimirse D. Zo na C: la concentración no es uniforme, y los tamaños diferentes. Zo na B: la concentración es uniforme, casi igual a la c oncentración inicial (Co). Zo na A: líquido claro. Mientras continúa la sedimentación, las alturas de cada zona varían A, B crecen, C, D disminuyen al final quedan so punto donde B y C desaparecen llamado Punto Crítico de 136 Ay D Punto Crítico de S edimentación a partir de este punto ocurre solo compactación de los sólido con una velocidad sum mente lenta, conocido también como sedimentación retardada. S EDIMENTACION DIS CONTINUA Fig ura 6.2 Fue nte: http://www.unino rte.edu.co /extens iones /IDS /Po nenc ias /po nencias %2014 %20o c tubre/pres entacio n %20jo s ep %20ribe s /s edimentacion.pdf 137 6.4 RELACIONES Y FORMULAS DECALCULO PRINCIPALES S EDIMENTACIÓN BAJO LA ACCIÓN DE LA FUERZA DE GRAVEDAD 6.4.1 Para describir en forma criterial el procedimiento de sedimentación de una partícula esférica en un medio inmóvil y no delimitado pueden aplicarse los criterios de similitud: de Arquímedes , Ar; de Lyaschenko, Ly y de Reynolds. La forma más cómoda de dependencia criterial resulta: Ly = f (Ar). En el llamado régimen laminar la sedimentación cuando , cuando los valores Ar < 3,6, Ly < 2.10-3 , Re < 0,2, Stokes obtuvo teóricamente la siguiente fórmula para la velocidad de sedimentación Wsed ( en m/s), de una partícula esférica: 2 Wsed = d (? – ?m ) g / 18µm (6.1) Para la sedimentación de una particular en el medio gaseoso la fórmula (6.1) se simplifica: W sed = d2 ? g / 18µm (6.2) Ya que en este caso se puede despreciar ?m, en comparación con ?. 138 Donde : en las ecuaciones 6.1 y 6.2 d es el diámetro de la partícula esférica, en m. ? la densidad de la partícula, Kg/m3 . ?m la densidad del medio, Kg/m3. µm el coeficiente dinámico de viscosidad del medio, Pa.s.[ o sea, N.s/m2, o bien Kg/(m.s)]. 6.4.2 La determinación de la velocidad de sedimentación de una partícula esférica unitaria en el medio inmóvil no del ado empleando el método generalizado y adecuado para cualq r régimen de sedimentación, se efectúa del modo siguiente: Se determina el criterio de Arquímedes: Ar = Ga ? ? / ?m = Re2/Fr.( ? – ?m)/ ?m = = d2 (? – ?m) g ?m / µ2m (6.3) Donde Ga = Re2 /Fr, es el criterio de Galileo.. Para la sedimentación en el medio gaseoso: Ar = d2 ? ?m g / µ2m (6.4) A partir del valor hallado del criterio de Ar se determina el criterio de Re o el criterio de Ly (F ig. 6.3 ): 139 Ly = Re3 /Ar = ReFr ?m / ? – ?m = W3sed ?2m / µm(? – ?m) g (6.5) O bien si el medio es un gas: Ly = W3sed ?2m / µm.g. ? (6.6) Después se calcula la velocidad de sedimentación: Wsed = Re. µm / ?m.d (6.7) O bien : Wsed = [ Ly µm (? – ?m)g / ?2m] 1/3 (6.8) 6.4.3 S EDIMENTADOR DE ACCION CONTÍNUA Fig . 6.3 140 6.4.4 Diagram a de Equivalencias : Re, Ar, Ly Fig . 6.4 141 CAPITULO VII : 7 FILTRACION Se define, como el proceso por el cual se separa la ma eria suspendida mediante el paso del agua a través de una c pa porosa , las agitaciones pueden ser natural y artificial; la infiltración de agua fluvial en el terreno y discurrimientos de aguas subterráneas son procesos naturales de filtración. La filtración artificial se realizan por filtros de arena y estas pueden ser filtros lentos, rápidos y a presión, además es bueno señalar que existen filtros de membrana fabricados con resinas org nicas como las melaminas que tiene diferentes porosidades, encontrándose en el mercado filtros de 20, 10, 5 y hasta de 0.25 mieras de porosidad, existiendo aun membranas de acuerdo a la calidad de agua que se desea producir mediante el proceso de osmosis inversa. 7.1 FILTROS LENTOS DE ARENA: Los filtros lentos de arena o por gravedad se utilizan para tratamiento de aguas ligeramente turbia y generalmente sin coagulantes, estos filtros están constituidos por un estante de una capa de arena de 0.60 a 1.0 m de espesor y soportados por una capa de graba ( cuarzo, piedras, etc.). de 0.3 a 0.4 m, bajo la capa de graba existe un sistema de drenaje colector de agua filtrada. 142 La tasa de filtración es de 1.3 a 6.5 lts/m2 x minuto. Los filtros lentos utilizan arena de 0.35 a 0.5 mm de tamaño. Los filtros lentos pueden trabajar desde días a meses entre ciclo y luego debe ser lavada su arena. Estos filtros tienen alto rendimiento bacteriano y en cierto grado ayudan a eliminar en cierta proporción el sabor el olor. En la actualidad son pocos utilizados siendo reemplazados po cierto tipo de filtros. FILTRO LENTO DE ARENA Fig . 7.1 0.032 a 0.160 g l/min Fuente : S EDAPAL 1.- Alimentación del agua decantada a filtrar 2.- Deflector o Distribuidor del agua. 3.- Lecho de arena (filtro de arena). 4.- Toberas . 143 5.- Cámara colectora de agua filtrada. 6.- Ingreso de agua de lavado. 7.- Ingreso de aire de lavado. 8.- Salida del agua limpia filtrada. 7.2 FILTROS RÁPIDOS DE ARENA: Procesa agua pre tratada, la coagulación y sedimentación deben considerarse como procesos esenciales previas. Estos filtros están constituidos por un tanque que contiene una capa de arena de 0.6 a 0.7 m. de espesor, soportado por graba de una altura de 0.3 a 0.4 m. y de granulometría creciente hacia abajo. En el fondo se instala un sistema de drenaje para recolectar el filtrado. La altura del agua sobre la arena debe ser constante y tener una altura de 1.2 m como mínimo, la arena tiene un tamaño de 0.4 0.5 mm. Y la grava varía desde 3 " a 1/16" . La tasa d filtración es de 80 a 120 lts/m2 x minuto, el ciclo es de 24 a 72 horas y se debe lavar a menudo el material filtrante con inversión del flujo del agua a sea el agua limpia circula de abajo hacia arriba duran más o menos. 144 10 minutos La filtración rápida se usa para controlar la calidad l agua desde el punto de vista físico y químico así como determinar el color, olor y sabor. 7.3 FILTROS A PRES IÓN: Estos filtros se rigen por los mismos principios que l filtros lentos y rápidos. La arena, grava y sistema de drenaje están colocados sobre un tanque de acero en forma cilíndrica. El agua se hace pasar a presión y los espesores de arena y grava son similares a los del filtro rápido y la velocidad van desde 80 a 120 lts/m2 x minuto. 145 V.-- MATERIALES Y METODOS Primeramente se ha tenido que recopilar muchos datos y luego tener que ordenar toda la información obtenida, sobre todo tomar como base la experiencia en planta así como también mi experiencia omo docente del curso Tratamiento de aguas. Dentro de la currícula de la Escuela Profesional de Ingeniería Química, de la Facultad de Ingeniería Química de la Universidad Nacional del Callao, está contenido el resente curso. Para el desarrollo del curso se ha utilizado la metodo ogía de la deducción inducción, experimentación de tal forma que ea entendible por parte de los alumnos para obtener los abjetivos propue os. El procedimiento que se ha tomado en cuenta para el de arrollo del presente texto ha sido de interacción con los estudiantes El método que se aplicara en el desarrollo del texto es integrador en los conocimientos. El contenido que se va a elaborar en los diferentes ca ulos planteados involucran los siguientes aspectos: Ø Determinar los objetivos que que se propone alcanzar. Ø Definir los conceptos y fundamentos teóricos relaciona os al tratamiento adecuado de las aguas crudas, formulando pri cipios de fácil aplicación comprensión . 146 Ø Desarrollar casos ilustrativos, con aplicación de diferentes reactivos químicos de tal forma que se pueda aplicar e los diferentes procesos de tratamiento. Ø Generar soluciones a problemas de tratamiento de aguas ra observar el grado de captación de los, participantes. Ø Desarrollar diferentes diagramas de procesos y operaci para el tratamiento de aguas. VI RES ULTADOS El principal resultado del trabajo desarrollado es el Texto Universitario Titulado “Operaciones y Pro ces o s de Tratamiento de Agua Cruda pa la Obtención de Ag ua Potable”, cuyo contenido ha sido desarrollado en cuatro capítulos en forma clara y precisa que es de fácil entendimiento y asimilación por parte del estudiante universitario de Ingeniería Química., . El resente texto, contiene aspectos teóricos que conlleva al entendimiento de las principales operaciones y procesos de tratamiento de aguas crudas , que se puede aplicar en las diferentes etapas, desde el inicio de la captación, desarenado, pre-cloración, así como también el agregado de los reactivos químicos com son los coagulantes y floculantes. También se precisa el tratamiento microbiológico, a fin de eliminar todos los elementos patógenos al hombre. Finalmente, el producto que es el agua debe ser de alt lidad para el consumo humano que se encuentre dentro de o parámet os de control de calidad que se encuentra en las normas de calidad del agua. 147 VII DIS CUS ION El texto universitario: “Operacio nes y Pro ce s o s de Tratamie nto d e Ag ua Cruda para la Obte nción de Agua Po table”, que es el resultado de la investigación realizada tiene una presentación de f il entendimiento clara y ordenada teniendo en cuenta que el estudiante pueda aplicarlas en el futuro así como en las diferentes industrias dado q hoy en día es necesario inclusive recuperar los efluentes de los diferentes procesos industriales. § Actualmente no existen mucha bibliografía disponible para los estudiantes debido básicamente al factor económico, razón por la cual se les hace difícil adquirir textos importados. § Conforme avanza la tecnología moderna, también las ope procesos de tratamiento de aguas va cambiando, en algu iones y s textos se aplican ciertas metodologías que en nuestro medio no se dispone, haciendo por lo tanto difícil el entendimiento de ciertos conceptos. El objetivo del presente Texto por los temas tratados que se aplican en las operaciones y procesos de tratamiento de aguas, es brindar una obra de consulta para los estudiantes universitarios, donde encontrarán conceptos claros y sencillos de entender, los que está considerados en el Sílabo del curso y que está contenido en la actual cur Química. 148 ula de Ingeniería VIII REFERENCIALES 8.1.- VERGARA YAYON, FRANCISCO. Tratamiento de Aguas Industriales – 8.2 LETTERMAN, RAYMOND. Calidad y Tratamiento del Agua - Manual de Suministros de Agua Comunitaria -American Water Works Association:- Mc Graw Hill Profesional . 3ra. Edición. .2002. 8.3 CRITES , RON - TCHOBANOGLOUS , GEORGE. Tratamiento de Aguas Residuales - - Me Graw Hill - 2001. 8.4 ROMERO ROJAS , JAIRO ALBERTO. -Tratamiento de Aguas Residuales -Editorial . Escuela Colombiana de Ingeniería . Primera Edicón -Enero 2000. 8.5 PINTO ALCARRAZ, G. – A.AGUIRRE PILLACA R. - ABURTO, CALIXTO. Programa de Medio Ambiente Costero Antartico - Dirección de Hidrografía y Navegación de la Marina de Guerra del Perú:.- 1999. 8.6 ROMERO ROJAS , JAIRO ALBERTO . Potabilización del Agua / 3ra. Edición / Editorial Escuela Colombiana de Ingeniería _ Alfaomega Grupo Editor S.A> de CU. _ 1999. 8 .7 NALCO - Manual de Aguas.-. Su naturaleza, tratamiento y aplicaciones. Tomo III. Me Graw-Hill. 1989. 8 .8 Tratamiento y Depuración de Aguas Residuales - Melca. 149 8.9 S HEPPARD T. POWELL. Acondicionamiento de Aguas para ia Industria. Centro Regional de Ayuda Técnica . Agencia para el Desarrollo Internacional (AID) México . 1966 8.10 UNDA O., FRANCIS CO . Teoría y Diseño de Plantas de Tratamiento de Agua Potable. - Departamento de Publicaciones de la Universidad Católica de Chile- 1963. 8.11 BRUCE BILLINGS – VAUGHAN, JONES . Demand - Forecasting Urban Water American Water Works Association - 6666 W. Quincy Ave. Denver Colorado CO 80235. - 1996 8.12 S PIELMAN, L.A. & QUIGLEY, J.E. A motion picture study of floe breakup. American Chemical Society National Meeting / Louisiana, Mar. 20-27, 1997. 8.13 BILLINGS BRUCE - VAUGHAN JONES - Forecasting Urban Water Demand - American Water Works Association -6666 W. Quincy Ave. Denver Colorado CO 80235 - 1996 8.14 BROWN & LE MAY BURS TEN. Química, la ciencia ce ntral, Prentice Hall Iberoamericana.- 1993 8.15 ES COBAR, ALFONS O; S ILVA, ISMAEL; KAWAS O, JORGE; ZACARÍAS , AUGUS TO; PALACIOS , HERNÁN - Informe Misión de Funcionarios de Sedapal a USA.- Lima; SEDAPAL;. 207,86 p. Mus. S EDAPAL-CDIE 8.16 ARRIS UEÑO ARIS PE, JOS É.- Conducción Huampani Atarjea: análisis de la situación actual y ventajas del proyecto..- 1983.-S EDAPAL-CDIE.- 1987 7.17 RODIER, J. - Análisis de las aguas - Ed. Omega. Barcelona. 1981. 150 8.18 M. SERRANO MEDRANO - RODRIGUEZ CAS TRO, J.A. Determinación de alcalinidad y acidez en aguas en el laboratorio de Ing niería Sanitaria y Ambiental. 8.19 PACHECO S AN JOS E. LABORATORIOS A y A. Análisis de laboratorio proporcionados personalmente por la doctora victoria Pacheco. San José, 1980 Asesor de Tratamiento del Agua, CEPIS, OPS/OMS). 8.20 American Society for testing and Materials. Annual book of Standards Determinación de dureza en agua. Método ASTM D 1126-92 - Año:. 1994 8.21 LIMA. ES AL & OPS CEPIS . Standard methods for the examination of water and waste water -publicado por la APHA. Determinación de Dureza en aguaMétodo Ampliación de la planta de tratamiento La Atarj a; estudio preliminar. Lima, Empresa de Saneamiento de lima, 1978 . 89.22 ANDREU-VILLEGAS, R. & LETTERMAN, R.D.. Optimizing flocculator power input. Journal of the environmental Engineering 102 (EE2): 251-262, Apr. 1976. 8.23 AMES , R. Optimizing the slow mix velocity gradient at the south water filtration plant. Chicago, Bureau of water, s.d. Report N 6. 8.24 MAIS CH GUEVARA, ERNESTO- Problemas de hidráulica en plantas de tratamiento de agua potable y desagüe.- Lima; JICA; 1990. 3v.[817] p. Ilus., planos. El CIÉ tiene los tomo 2 y 3. Estudio realizado para SEDAPAL. 151 8.25 DEGRÉMONT..- Manual técnico del agua - Seine; Degrémont; 1959. 546 p. Ilus.- S EDAPAL-CDIE INTERNET: 1 - - Copyright 1998-2005 Lenntech Agua residual & purificación del aire Holding B.V.Rotterdamseweg 402 M 2629 HH Delft, Holanda España México Estados Unidos Chile Perú Argentina. 2.- webdelprofesor.ula.ve/ingenieria/csalas/.../intercambio_ionico.pdf 3.- ww.monografias.com/trabajos5/aguacald/aguacald. shtml#incrustacion 4.- http://es.wikipedia.org/wiki/Dureza del agua. 5.- http://www.sagan-gea.org/hojared_AGUA/paginas/16agua.html 6.- http://www.who.int/water_sanitation_health/dwq/gdwq3_es_fulllJowsres.pdf 7.-http://www.dwc-water.com/es/tecnologias/scale-rust-corrosionremoval/index.html 8..www.interagua.com.ee/extranet/modules.php?name=News&file=article&sid= 97 - 32k 9.- www.aquapurificacion.com/agu a-municipal.htm - 48k 10.- www.miliarium.com/Monografias/PHN/Cic lo _hidro lo g ico .asp 11.-http://www.fortunecity.es/expertos/profesor/171/agua.ht 152 APENDICE 153 S ILABO DEL CURS O: TRATAMIENTO DE AGUAS 154 UNIVERS IDAD NACIONAL DEL CALLAO FACULTAD DE INGENIERIA QUIMICA ESCUELA PROFES IONAL DE INGENIERIA QUIMICA S ILABO 1. DATOS GENERALES : 1.1 ASIGNATURA 1.2 CODIGO 1.3 SEMESTRE ACADEMICO 1.4 CICLO ACADEMICO 1.5 CREDITOS 1.6 HORAS TEORICAS 1.7 HORAS PRACTICAS : TRATAMIENTO DE AGUA S : IG 309 : 2011-A : SEXTO : 03 : 02 : 03 1.8 DURACION : 17 1.9 PRE-REQUISITO : ANALISIS QUIMICO UANTITATIVO 1.10 PROFESOR : ING. ROBERTO LAZO AMPOSANO. 1.11 HORARIO SEMANAS : TEORIA: MIERCOLES: 11,12. LABORATORIO : MARTES GH.90G : 11,12,13 JUEVES 2. GH: 91G : 11,12,13 . S UMILLA: Procedencia del agua natural. Principales impurezas del agua. Proceso cal-sosa. Tratamiento general del agua. Normas de aceptación según su uso. Pasos del tratamiento en general. Correc 155 de dureza. Desmineralización. Desaireación por métodos químicos y físicos. Necesidades del tratamiento del agua. Peligros del agua blanda. 3. OBJETIVOS : OBJETIVO GENERAL: Dotar al estudiante de las herramientas necesarias para que pueda realizar operaciones y diseñar equipos adecuados para el tratamiento de aguas , de tal manera que al final del rso haya adquirido una capacitación en el diseño aplicando los riterios y características del equipo. 3.2 OBJETIVOS ES PECIFICOS : 3.2.1 Identificar los diferentes métodos que puedan realizarse en el tratamiento de aguas, así como en la sedimentación, floculación, filtración y otras operaciones. 3.2.2 Determinar las variables de operación y el conocimiento de los equipos que se utilizan en las diferentes operaciones de tratamiento. 3.2.3 Determinar los diferentes reactivos de purificación de las a uas y usos en la industria. 4. CRONOGRAMA ANALITICO: PRIMERA S EMANA: 4.1. Ciclo Hidrológico: Fuentes de agua disponible. 4.2. Constituyentes Químicos del agua. 4.3. Biología del agua. S EGUNDA SEMANA 4.4. Colimetría 4.5. Demanda Bioquímica de Oxígeno 156 4.6. Problemas TERCERA S EMANA 4.7. Características físicas, químicas y bacteriológicas de agua potable. 4.8. Plantas de Tratamiento de Agua. 4.9. Fuentes de Abastecimiento. 4.10. Medida de Gasto. CUARTA S EMANA - QUINTA S EMANA 4.11. Desarenado - Predecantadores. 4.12. Aereación. 4.13. Coagulación. 4.14. Filtración. S EXTA S EMANA. 4.16. Desinfección del agua. 4.17. Cloro - Cloraminas. 4.18. Soluciones de iodo. 4.19. Control de olor y sabor. S EPTIMA SEMANA: Primer Examen Parcial. OCTAVA SEMANA - DOCEAVA SEMANA. 4.20. Fluoración. 4.21. Remoción de hierro y manganeso. 4.22. Significado del pH en el agua. 4.23. Proceso cal-sosa en frío. 4.24. Ablandamiento del agua : cal-sosa en caliente. TRECEAVA S EMANA - QUINCEAVA SEMANA. 157 4.26. Ablandamiento cal-bario. 4.27. Tratamiento de aluminato sódico con cal-sosa. 4.28. Ablandador de agua con intercambio de iones. 4.29. Análisis de agua. Interpretación y cálculo. 4.30. Agua pura - Desmineralizadores de una y dos camas. 4.31. Tratamiento de agua para la alimentación de calderas. 4.32. Tratamiento de Aguas Industriales DIECIS EIS AVA S EMANA: S egundo Examen Parcial. DIECIS IETEAVA S EMANA: Examen Sus tituto rio . 5. PROCEDIMIENTOS DIDACTICOS El desarrollo del curso se llevará con exposiciones ma istrales y grupales, para el tratamiento de temas específicos. Debiendo hacer las respectivas exposiciones cada uno de los integrantes del grupo de trabajo. Se hará intervenciones orales como escritas c n la participación de los Alumnos en la pizarra, para que tengan una eval ción por su participación activa y dinámica en clases. 6. EQUIPOS Y MATERIALES : En el presente ciclo se utilizará equipo multimedia que ya se disponen instalados en todas las aulas: Se utilizará el Power Point, también se utilizará tizas, separatas, videos, presentación de casos particulares de operaciones, tanto para las clases magistrales como para las exposiciones de los grupales. 7. EVALUACION. 6.1 PROCEDIMIENTO DE EVALUACION: 158 trabajos 6.1.1. Prácticas de pizarra y visitas a empresas industriales. En el presente ciclo se ha programado hacer la visita en el es de Setiembre a la empresa SEDAPAL , siendo de carácter obligatorio para todos los estudiantes que están matriculados en el curso. Se evaluará el informe presentado por pr cticas y la exposición tanto grupal como individual, obteniendo un promedio general. 6.1.2 Se tomarán dos exámenes parciales y un sustitutorio (E1, E2, Es), que puede ser reemplazada por cualquiera de los dos parciales de más bajo puntaje. 6.1.3 Promedio Final: E1 + Pm E2(Es) + PLV = = 10.5 3 6.2 REQUIS ITOS PARA LA APROBACION DEL CURS O: Para la aprobación del curso, el alumno tendrá que haber cumplido con el 100 % de prácticas de pizarra, la visita a la empresa programada y con todas las evaluaciones correspondientes, tales como la presentación de la vis ta y rendir los exámenes, obteniendo un promedio final de Pm = 10.5 7. FUENTES DE INFORMACION : 7.1 Manual del Agua para uso Industrial. - México. 7.2 Tratamiento de Aguas Industriales. - Vergara Yayón Francisco. 7.3 Manual de Aguas.- NALCO. 159 7.4 Tratamiento de Agua Industrial. - A.S.T.M. 7.5 Tratamiento y Depuración de Aguas Residuales.- Melca. 7.6 Química del Agua. JENKINS. 6.7 Teoría y Diseño de Plantas de Tratamiento de Agua Pota le. Francisco Unda O. Departamento de Publicaciones de la Universidad Católica de Chile- 1963. 7.8 Acondicionamiento de Aguas para la Industria. Sheppard T. Powell - Centro Regional de Ayuda Técnica . Agencia para el Desarrollo Internacional (AID) México . 1966 7.9 Forecasting Urban Water Demand - Bruce Billings - Vaughan Jones - 1996 - American Water Works Association - 6666 W. Quincy Ave. Denver Colorado CO 80235. 7.10 Programa de Medio Ambiente Costero Antártico - Dirección de Hidrografía y Navegación de la Marina de Guerra del Perú: G. Pinto Alcarraz, A. Aguirre Pillaca,R. Calixto Aburto.- 1999. 7.11 Tratamiento de Aguas Residuales - Ron Crites Tchobanoglous Mc Graw Hill - 2001 7.12 Calidad y Tratamiento del Agua - Manual de Suministros de Agua Comunitaria -American Water Works Association - Raymond Letterman - Mc Graw Hill Profesional 2002. 7.13 Potabilización del Agua / 3ra. Edición / Jairo Alberto Romero Rojas / Editorial Escuela Colombiana de Ingeniería _ Alfaomega Grupo Editor S.A> de C.U. _ 1999. 160 7.14 Tratamiento de Aguas Residuales – R.S. Ramalho – Editorial Reverté S.A: - Barcelona Bogotá – Buenos Aires – Caracas – M´éxico.3ra. Edición – Mayo 2003 INTERNET: 1.- Copyright 1998-2005 Lenntech Agua residual & purificación del aire Holding B.V.Rotterdamseweg 402 M 2629 HH Delft, Holanda España México Estados Unidos Chile Perú Argentina. Ing . ROBERTO LAZO CAMPOS ANO CIP 8850 161 A N E XO S 162 1.- PREOCUPANTE DIAGNÓS TICO S OBRE EL AGUA EN EL PERÚ La crisis del agua a nivel mundial, la gestión del recurso hídrico que deben cumplir el Estado, el empresariado y el usua el papel quedaron plasmados en el foro “Liderazgo impostergable en la gestión del recurso hídrico en el Perú”, organizado por el Comité de Desarrollo Sostenible de la Cámara de Comercio Americana del Perú (AmCham) y Amanco Perú. Se trataron temas como el Desarrollo del Perú en el Marco de la Gestión del Agua, a cargo de Fernando Cilloniz, Gerente General de la Asociación Civil Información, además de La Problemática del Agua en el Agro Peruano, por Abelardo De la Torre, Consultor de INRENA. De la Torre ofreció un preocupante diagnóstico sobre el recurso hídrico en nuestro país, donde se indicó que los ríos de la vertiente del Pacífico, donde se asienta el 70% de la población peruana, descargan 1,8 % del total nacional, del cual sólo se aprovecha un 47%. Enfatizó que los problemas fundament les de la gestión del agua en el Perú comprenden las incoherencias e incompatibilidades en la legislación vigente y la falta de una normatividad transec orial de gestión, lo que dispersa y debilita a la autoridad de agua. Recalcó la debilidad técnica y legal de la Autoridad Nacional del Agua. El especialista propuso que, para la gestión del agua, era necesaria la formación de capacidades en Gestión Integrada de Recursos Hídricos (GIRH), crear la autoridad de Aguas Multisectorial a nivel nacional y capacitar funcionarios responsables en la toma de decisiones técnico normativas de nivel nacional y especialistas en GIRH. Por su parte, Guido Bocchio, representante del Confiep, en su presentación Ley de Aguas en el Perú, ofreció el marco legal acerca de toda la legislación existente sobre el 163 recurso hídrico y la importancia de la participación de todos los sectores en una Nueva Ley de Aguas que está en el seno del Congreso en pleno debate. 2.- PROYECTO DE LEY DE AGUAS EN EL PERU Mediante Decreto Supremo No. 122-2002-PCM, de fecha 5 de diciembre del 2002, se creó la Comisión Técnica Multisectorial encargada de elaborar un Proyecto de Ley de Aguas a ser concerta o con todos los sectores involucrados en el uso del agua La Comisión se instaló el 10 de enero del 2003 y luego de cuatro mese de trabajo ha considerado de vital importancia la prepublicación de te proyecto y poder así recibir los aportes y comentarios de la ciudadanía. La Comisión decidió utilizar el anteproyecto de Ley de Aguas prepublicado el 26 de julio del 2001 como base inicial del trabajo de una Secretaría Técnica que ha venido elaborando el proyecto Además, se acordó que el proyecto incorporaría explícitamente pri cipios y lineamientos de política para el manejo sostenible del agua. Para la elaboración de este proyecto de Ley de Aguas se han tenido en cuenta las siguientes normas generales: La Constitución Política del Perú; la Ley Orgánica para el Aprovechamiento Sostenib de los Recursos Naturales; la Ley Orgánica de los Gobiernos Regionales; la Ley Marco de Modernización de Gestión del Estado; el Código del Medio Ambiente y los Recursos Naturales, así como normas sectoriales. La Constitución señala en el artículo 66º lo siguiente: “Los recursos naturales son Patrimonio de la Nación y Estado es soberano en su aprovechamiento, fijándose por Ley Orgá condiciones de su aprovechamiento. 164 las 3.- CALCULOS S EGÚN LAS NORMAS DE INDECOPI: Caudal Datos: Población: 175 863 habitantes Consumo diario por persona: 100L L = 17586300 L hab 1m 3 m3 17586300 Lx = 17586.3 1000 L dia 175863 habx100 17586.3m 3 − − − − − −45% Q − − − − − −100% Q= 100 45 x17586.3m 3 = 39080.66 Do s ificac ió n Se tomara como base de calculo 1000 m3 como caudal que ingresa al Osmosis Inversa, del proceso sale el 99.2% de agua pura y el 0.8% que resta es agua con sales. a. Nitratos 165 mg 1000 L x1000 m3 x x0.8% = 80000 mg L 1m3 mg 1000 L = 10 x1000 m 3 x = 1x10 7 mg 3 L 1m NO3( ag uademar ) = 10 NO3( necesa rio ) NO3( ag regado ) = NO3 ( necesario ) − NO3( agua dem ar ) = 1x10 − 80000 = 9.92 x10 mg 7 6 b. Dureza ( Calcio y Magnesio) Ca +2 ( aguademar ) = 0.41 g x kg aguademar 1000 mg 1g kg aguademar x1.02819 Laguademar x1000 m 3 x 1000 L 1m 3 x 0.8% Ca +2 ( aguademar ) = 3.3725 x10 6 mg Ca +2 ( necesario ) = 100 Ca +2 ( agregado ) = Ca mg L x1000 m 3 x +2 ( necesario ) Mg ( aguademar ) = 1.29 − Ca g kg aguademar x 1000 L 1m 3 = 1 x10 8 mg +2 ( aguademar ) 1000 mg 1g = 1 x10 8 − 3.3725 x10 6 = 9.6628 x10 7 mg x1.02819 kg aguademar Laguademar x1000 m 3 x 1000 L 1m 3 x 0.8% Mg ( aguademar ) = 1.0611x10 mg 7 Mg ( necesario ) = 50 mg L x1000 m 3 x 1000 L 1m 3 = 5 x10 7 mg Mg ( agregado ) = Mg ( necesario ) − Mg ( aguademar ) = 5 x10 7 − 1.0611 x10 7 = 3.9389 x10 7 mg C. Flúor F( aguademar ) = 0.001 g kg agu ademar x kg aguademar 1000 mg 1000 L x1.02819 x1000m 3 x x 0.8% 1g Laguademar 1m 3 F( aguademar ) = 8225.52 mg mg 1000 L x1000 m3 x =1.5 x106 3 L 1m = F( necesario ) − F( aguademar ) =1.5 x10 6 − 8225.52 = 1.4918 x10 6 mg F( necesario ) =1.5 F( agregado ) 166 8.1 LABORATORIO DE ANALIS IS FIS ICO LABORATORIO DE ANALIS IS FIS ICO - QUIMICOS DE AGUAS Es te lab oratorio utiliz a técnicas convencionales p ara realiz ar s us d eterminac iones fís ico - q uímic as en mues tras amb ientales o d e la ind us tria en general. Los anális is p ue d en realiz ars e en las s iguientes matrices : EFLUENTES (2 gal) AGUAS LIMPIAS (1 gal) AGUAS INDUSTRIALES (2 gal) AGUAS MARINAS (2 gal) Parám etros Dete rm inable s : Fosfatos Sulfatos Nitritos Sólidos susp. Fijos Nitratos Sólidos susp. Volátiles N-amoniacal Sólidos sedimentables Sulfitos DQO Hierro-soluble (DB0)5 Coliformes totales OD CO2 Fenoles Sulfuros Aceites y grasas Clorofila Detergentes PH Cloro activo Temperatura Cianuros Color H2 S 167 Turbidez Sólidos total Conductividad Sólidos disp. total Alcalinidad total Sólidos disp. Fijos Alcalinidad Carbonatos Sólidos disp. Volátiles Alcalinidad bicarbonatos Sólidos susp. Totales Dureza total Caudal Dureza cálcica Granulometría Dureza magnésica Densidad Cloruros Humedad Cloro Residual Muestreo Simple Muestreo Compuesto 8.2 Mue s tras : La cantidad de mues tras que hay que tom ars e , e l tipo d env ase para tom ar la mues tra, as í c om o la pres e rv ación de la ism a, de pe nde de l parám e tro a analizars e : AGUAS RES IDUALES (e flue nte s , aguas ne gras , ag uas gris e ) d = días Poli = Polietileno h = horas Pres. = Ptreserverante Vid. = Vidrio Al.= Tapa con papel aluminio 168 Prot. Luz = Protegido de la * = Lavado con KH2 PO4 min.= minutos Luz Plast. = Plástico 0.03N Refr. = Refrigeración AGUAS CLARAS TIEMPO MAXIMO FRAS COS P ARAMETROS TIPO CAPACIDAD (L) pH AMBIENTE DE Plast. ó Vida ANTES DEL PRES ERVACION ANALIS IS 0.05 Temperatura Refrigeración in situ Ref. y Prot. Luz in situ 15 min. Turbiedad Plast. ó Vida 0.05 Ref. y Prot. Luz 24 h Cloro Residual Plast. ó Vida 0.5 Ref. y Prot. Luz inmediato Plast. ó Vida 0.2 Ref. y Prot. Luz lo más pronto Cloruros Plast. ó Vida 0.1 Clorofila Plast. ó Vida 1 Ref. y Prot. Luz 48 h Color Plast. ó Vida 0.05 Ref. y Prot. Luz 48 h Dureza Plast. ó Vida 0.1 Ref. y Prot. Luz 48 h Sulfatos Plast. ó Vida 0.2 Sólidos Plast. ó Vida 1 Alcalinidad: T, Car. Bi. Refrigeración Refrigeración Refrigeración ......................... 28 d 7d NOTA: No s e ne c es ita pre s e rv ante , s i las mue s tras lle gan al io e n 6 horas ó ante s . Para los anális is arriba indic ados s e nece s ita como m ínim o 1 galón de agua. El galón que se utilice para te ne r la m ue s tra de be s e r nue vo, o lavado c on ácido y lue go con agua de s tilada. 169 Prot. Luz = Protegido de la d = días Car. = Carbonatos Luz h = horas Refr. = Refrigeración min.= minutos Vid. = Vidrio Plast. = Plástico T. = Total Bi. = Bicarbonatos Mue s tre o Es im portante te ne r e n cue nta que se e l re s ultado de un anális is de pe nde de la form a y e l lugar e n donde s e toma la mue s tra, por lo que para garantizar la im parcialidad de los m is mos , e s pre fe rib e que e l pe rs onal de laboratorio s e a quie n tom a la mue s tra, la pre s e rve y t porte al laboratorio. La ide ntific ación de la mue s tra se hace de com ún ac ue rdo con e l clie nte . S i e l clie nte es e l que re aliza e l mue s tre la Ins titución se re s pons abiliz a únic ame nte de los anális is y re c hazará llas m ues tras que lle gue n en m alas condicione s de pre s e rvac ión. TIEMPO FRAS COS AMBIENTE DE P ARAMETROS MÁXIMO ANTES Ti po C apaci da d (L ) PRES ERVACION ANALIS IS DBO Vid. ó Poli 1 Refr. y Prot.Luz 18 h 1 Refr. y Prot.Luz 24 h Wincker OD Vid. Refr., Prot.Luz y DQO Vid. ó Poli 0.1 24 h + Pre Cloro Residual Polietileno 0.5 Vid. y Al. 1 Refr. y Prot.Luz inmediato Refr. y Aceites y Grasas 72 h Preservante Fenoles Vid. y Al. 0.5 170 Refr. y inmediato Preservante Plast. ó Sólidos 1 Refrigeración 7d Vida Plast. ó Refr. y Sulfuros 0.5 Vida 7d Preservante Plast. ó pH 0.05 Refrigeración in situ ........ * ..................... in situ 15 min 0.5 Refrigeración 3d 0.2 Refrigeración lo más pronto 0.2 Refrigeración lo más pronto 0.2 Refrigeración 3h Vida Plast. ó Temperatura Vida Plast. ó Detergentes Vida Plast. ó Nitritos Vida Plast. ó Nitratos Vida Plast. ó Coliformes Fecales Vida Plast. ó Refr. y Namoniacal 0.2 Vida 7d Preservante 171 172 DIAGRAMA DE FLUJO DE TRATAMIENTO DE AGUA DE RIO 173