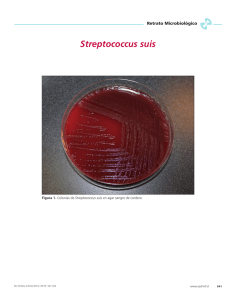
brucelosis porcina
Anuncio

CAPÍTULO 2.6.2. BRUCELOSIS PORCINA RESUMEN La brucelosis en cerdos está causada por Brucella suis. Se trata de una infección bacteriana que tras una bacteriemia inicial, causa lesiones inflamatorias crónicas en los órganos reproductores de ambos sexos, con localización y lesiones ocasionales en otros tejidos. Las especies de Brucella suis abarcan cinco biovariedades, pero la infección en los cerdos se debe a las biovariedades 1, 2 o 3 de B. suis. La enfermedad causada por las biovariedades 1 y 3 es similar, mientras que la debida a la biovariedad 2 difiere de la 1 y la 3 en su rango de hospedadores, su distribución geográfica limitada y su patología. La biovariedad 2 raramente es patogénica para el hombre, mientras que la 1 y la 3 son muy patogénicas y causan una enfermedad grave. La brucelosis porcina es de amplia incidencia; sin embargo, por lo general, su prevalencia es reducida a excepción de Sudamérica y el sureste asiático, donde la prevalencia es mayor. En algunas zonas, se ha llegado a establecer la infección por B. suis en cerdos silvestres o asilvestrados (los métodos de diagnóstico recomendados para los cerdos silvestres o asilvestrados son los mismos que para los cerdos domésticos). Varias biovariedades de B. suis causan infecciones en otros animales, tales como renos, caribúes, liebres y varias especies murinas y, ocasionalmente, en vacas y perros. Las infecciones debidas a Brucella suis en animales diferentes al cerdo se recogen en el Apéndice que aparece al final de este capítulo. Como signos de la enfermedad en las cerdas destacan el aborto en cualquier fase de gestación y el nacimiento de lechones muertos o débiles. En los verracos, el signo más destacado es la orquitis y pueden estar afectados los órganos sexuales secundarios. Brucella suis puede estar presente en el semen, a veces, en ausencia de signos clínicos. La transmisión durante la monta es más común que en el caso de la brucelosis en rumiantes. En ambos sexos, pueden verse afectados los huesos y especialmente las articulaciones y las vainas de los tendones, lo que causa cojera y, a veces, parálisis. Los cerdos son susceptibles a la infección artificial con B. abortus y B. melitensis, pero son escasos los informes de enfermedad natural en cerdos causada por cualquiera de estos organismos. Normalmente, en el hombre la infección está confinada a aquellas personas que, por su ocupación, están en contacto con los cerdos, y a los trabajadores de laboratorio. La capacidad de B. suis para colonizar las ubres bovinas con la consiguiente aparición en la leche significa que tiene el potencial de ser un riesgo serio para la salud humana. Identificación del agente: Brucella suis se aísla fácilmente a partir de cerdos vivos mediante el cultivo de los productos del nacimiento y a partir de los canales mediante el cultivo de los órganos y ganglios linfáticos. Se dispone de medios selectivos para el cultivo de muestras contaminadas. En la naturaleza, B. suis se encuentra de modo invariable en la fase lisa (la apariencia en medio sólido es típica de las brucelas lisas). Las biovariedades porcinas aglutinan con el antisuero monoespecífico A y no con el antisuero M. Se puede efectuar la identificación definitiva de las especies y biovariedades mediante pruebas de fagotipificación y pruebas bioquímicas, preferiblemente llevadas a cabo en laboratorios especializados. Pruebas serológicas: Hasta la fecha, ninguna de las pruebas serológicas tradicionales ha resultado ser completamente fiable en el diagnóstico rutinario de los cerdos individuales. Se utilizan sobre todo para identificar las piaras infectadas. Las pruebas recomendadas con propósitos de comercio internacional son un enzimoinmunoensayo (ELISA) indirecto y uno competitivo. Las pruebas del antígeno brucelar tamponado (BBATs), p. ej. la prueba de aglutinación tamponada en placa (BPAT) y la prueba de rosa de bengala (RBT), se consideran pruebas alternativas con propósitos de detección o pruebas para el estudio de piaras completas. También se ha Manual de la OIE sobre animales terrestres 2004 835 Capítulo 2.6.2. — Brucelosis porcina desarrollado un ensayo de polarización de fluorescencia. La prueba alérgica cutánea también es útil para identificar piaras infectadas. Requisitos para las vacunas y los materiales de diagnóstico: La vacuna con la cepa 2 de Brucella suis se emplea para inmunizar cerdos en China (República Popular). Es necesaria la confirmación de los resultados obtenidos en China con la vacuna de la cepa 2 antes de recomendar su uso general. En otros países, el trabajo experimental ha demostrado que la vacuna Rev.1 de B. melitensis posee un poder de protección de las ovejas frente a B. melitensis superior al de la cepa 2 de B. suis. No se dispone de datos suficientes para concluir que la vacuna con la cepa RB51 de B. abortus sea eficaz para proteger a los cerdos frente a la exposición a B. suis. En la práctica, todavía no se ha encontrado un producto de aceptación general. Se ha descrito la preparación, la prueba y la utilización de un alérgeno estabilizado, el brucelizado (o fracción F de la brucelina). A. INTRODUCCIÓN La brucelosis porcina es una infección causada por las biovariedades 1, 2 o 3 de Brucella suis. Es propia de muchos países en los que se crían cerdos. En general, la prevalencia es baja, pero en muchas zonas, tales como Sudamérica y el sureste asiático, la prevalencia es mucho mayor. La brucelosis porcina puede ser un problema serio pero no reconocido actualmente en muchos países. En estados sureños de los EE.UU. y en Queensland, Australia, se han descrito infecciones debidas a la biovariedad 1 de Brucella suis en cerdos silvestres. En Queensland, se han detectado varias infecciones humanas en personas que cazan o manejan material procedente de cerdos silvestres (16). Generalmente, la enfermedad se transmite por consumo de alimentos contaminados mediante productos del nacimiento y/o aborto y de las secreciones uterinas. Es normal que los cerdos coman las membranas y los fetos abortados. Con mucha frecuencia también se produce la infección durante la monta y, esto tiene implicaciones para aquellas personas que practican la inseminación artificial. En los cerdos y en los rumiantes, tras una bacteriemia inicial, B. suis coloniza las células del tracto reproductor de ambos sexos. En las hembras, invade las placentas y los fetos, en tanto que en los machos, la invasión tiene lugar en una o más de las siguientes zonas: testículos, epidídimos, vesículas seminales y/o glándulas bulbo uretrales. Las lesiones en los machos, que casi siempre son unilaterales, comienzan con una hiperplasia que puede progresar hasta la formación de abscesos; la etapa final se caracteriza por esclerosis y atrofia. En varias articulaciones se puede presentar artritis y a veces espondilitis. El aborto es la manifestación más común de la brucelosis en las cerdas, lo que sucede muy tempranamente o en cualquier momento de la gestación. Con frecuencia la secreción vaginal no es evidente y puede parecer un caso de infertilidad más que de aborto. En los machos, es más probable que la brucelosis sea persistente, con lesiones en el tracto genital que a menudo provocan interferencias con la actividad sexual, que pueden ser temporales o permanentes. El verraco puede excretar brucelas en el semen sin ninguna anormalidad aparente en los órganos sexuales o interferencia con la actividad sexual. En ambos sexos, pueden estar inflamadas las articulaciones y las vainas de los tendones, es posible que provoque cojera y, ocasionalmente, parálisis posterior. Una proporción significativa de cerdos y cerdas se recuperará de la infección, con frecuencia en unos 6 meses, pero muchos permanecerán infectados de forma permanente. La brucelosis causada por la biovariedad 2 de B. suis difiere de la infección causada por las biovariedades 1 y 3 en cuanto a la variedad de los hospedadores, la distribución y la patología. En brotes recientes en Europa, han estado implicados cerdos silvestres como fuente de transmisión de la biovariedad 2 a cerdos criados al aire libre (7). Además de porcinos silvestres, la liebre europea (Lepus capensis) también actúa de reservorio de la biovariedad 2 de B. suis y se considera que es una posible fuente de transmisión para el ganado doméstico (1, 7). Históricamente, la biovariedad 2 ha tenido una distribución geográfica extensa entre Escandinavia y los Balcanes (1). La biovariedad 2 de Brucella suis causa lesiones miliares en los tejidos, particularmente en los reproductores, que con frecuencia llegan a ser purulentas. Hasta la fecha sólo se ha descrito en una ocasión que la biovariedad 2 cause brucelosis humana. Las biovariedades comunes de B. suis (1 y 3) son patógenos humanos serios y es necesario tomar precauciones cuando se maneja y elimina material potencialmente infeccioso. Esto es especialmente cierto en el laboratorio después de cultivar el microorganismo, ya que se incrementa de forma considerable su número. En los laboratorios la manipulación de los cultivos o de material contaminado procedente de animales infectados se debe realizar bajo condiciones estrictas de bioseguridad para manipular sin riesgo este peligroso agente zoonósico. En cuanto a bioseguridad, se recomienda un nivel de contención 3 o superior, tal y como se describe en el Capítulo I.1.6. Seguridad humana en el laboratorio de microbiología veterinaria. 836 Manual de la OIE sobre animales terrestres 2004 Capítulo 2.6.2. — Brucelosis porcina B. TÉCNICAS DE DIAGNÓSTICO En la brucelosis porcina, los métodos de cultivo son al menos tan sensibles como las pruebas serológicas (4). Como el producto de casi todas las explotaciones de crías de cerdos pasa por los mataderos, los métodos de vigilancia (serología y cultivo) pueden aplicarse de manera efectiva a ese nivel. En muchas zonas, la cría del cerdo tradicional está siendo reemplazada o acompañada por el desarrollo de unidades comerciales mayores, por eso aumenta el uso de la inseminación artificial. Por consiguiente, la inseminación artificial que emplea verracos libres de brucelosis puede resultar una ayuda valiosa en el control de la brucelosis porcina, pues, obviamente, el uso inadvertido de semen infectado podría causar un daño incalculable. 1. Identificación del agente Las muestras óptimas para el cultivo bacteriológico y los métodos para el procesamiento de muestras son similares a los descritos en el Capítulo 2.3.1. Brucelosis bovina. Los métodos selectivos y estándares utilizados para otras especies de Brucella son adecuados para B. suis (véase Capítulo 2.3.I. Brucelosis bovina). La adición de suero no es esencial, pero el medio basal que contiene suero al 5% es un medio satisfactorio, tanto para el aislamiento como para el mantenimiento de los cultivos y la tipificación. No es necesaria la adición de CO2 a la atmósfera. En la naturaleza B. suis se presenta siempre en la forma lisa y las colonias son indistinguibles de otras brucelas lisas descritas en el Capítulo 2.3.1. Brucelosis bovina. Las biovariedades 1, 2 y 3 de B. suis tienen todas el antígeno dominante de superficie A, y el crecimiento se puede identificar de manera preliminar mediante la aglutinación en porta con el suero monoespecífico anti-A. La identificación confirmativa de las especies y biovariedades se debería realizar en un laboratorio de referencia especializado. Los laboratorios de referencia de la OIE para la brucelosis están indicados en el Cuadro de la Parte 3 de este Manual de animales terrestres. La confirmación de las especies y biovariedades depende de pruebas de fagotipificación, de producción de H2S (únicamente la biovariedad 1 produce H2S), y de crecimiento en presencia de colorantes. Algunas especies de la biovariedad 1 de B. suis son atípicas por el hecho de que crecen en medios que contienen 20 µg/ml de fucsina básica. La mayoría de las cepas de B. suis resultan inhibidas en presencia de safranina O a una concentración de 1/10.000, mientras que B. suis reacciona más rápidamente en la prueba de la ureasa que B. abortus o B. melitensis. La prueba metabólica de la oxidasa es una prueba adicional, que puede usarse para diferenciar B. suis de otras especies lisas de Brucella. Se dispone de técnicas de genética molecular basadas en la reacción en cadena de la polimerasa (PCR) que emplean cebadores específicos y permiten diferenciar B. suis de otras especies lisas de Brucella (3, 18). Sin embargo, estos ensayos de PCR no pueden distinguir las biovariedades de B. suis, ni han sido totalmente evaluadas ni estandarizadas. Se ha determinado la secuencia genómica completa de 3,3 Mb de la cepa 1330 de B. suis y tiene una estructura cromosómica y un contenido génico similar al de la cepa 16M de B. melitensis (14). El conocimiento de la secuencia de B. suis será valioso para la investigación básica de la taxonomía, la virulencia y los antígenos protectores de B. suis y puede ser de ayuda en el desarrollo de nuevas pruebas diagnósticas. 2. Pruebas serológicas Ninguna de las pruebas serológicas convencionales utilizadas para el diagnóstico de la brucelosis porcina es fiable para el diagnóstico individual en porcino . Un problema significativo es el hecho de que las crías destetadas de más de 2–3 meses de edad son susceptibles a la infección con B.suis, pero es muy limitada su respuesta anticuerpos aglutinantes a la infección de. Estas pruebas convencionales utilizan antígenos que dependen del lipopolisacárido (LPS) liso para su actividad. Debido a que comparten la cadena polisacarídica “O”, tales antígenos reaccionan igual que el LPS de Yersinia enterocolitica serotipo 0,9 y, por tanto, no tienen la capacidad de distinguir entre los anticuerpos de estas dos infecciones. La infección en cerdos por Yersinia enterocolitica no es común en algunas zonas (21). Los estudios sugieren que son similares las sensibilidades y especificidades del ensayo del antígeno tamponado y acidificado en placa, de la prueba con 2-mercaptoetanol, del enzimoinmunoensayo indirecto (I-ELISA), del ELISA competitivo (C-ELISA) y del ensayo de polarización de fluorescencia (FPA) (13). A veces el suero porcino también puede contener anticuerpos inespecíficos, que posiblemente sean de la clase IgM, lo que reduce en gran medida la especificidad de las pruebas serológicas convencionales, especialmente la prueba de aglutinación del suero (SAT). Además, el complemento porcino interactúa con el complemento de cobaya lo que Manual de la OIE sobre animales terrestres 2004 837 Capítulo 2.6.2. — Brucelosis porcina produce una actividad pro-complementaria que reduce la sensibilidad de la prueba de fijación del complemento (CFT). Para la CFT se han descrito niveles de sensibilidad tan bajos como del 38% (15) y del 49% (17); por tanto, esta prueba no se puede recomendar para el diagnóstico de la brucelosis en cerdos individuales. Para fines internacionales y otros fines comerciales, tales como la adquisición de verracos, es más importante conocer el estado de la enfermedad de la piara y del área en la que está situada la piara que las pruebas en animales individuales. A pesar de esto, la Unión Europea y algunos otros países todavía insisten en que sólo se debería permitir cruzar las fronteras internacionales a los cerdos cuyo suero muestre un título de aglutinación inferior a 30 Unidades Internacionales (IU) por ml y un resultado de la CFT de menos de 20 ICFTU (unidades internacionales de la CFT). • Sueros de referencia Los estándares de referencia primaria son aquéllos frente a los que se comparan y calibran otros estándares. Actualmente se están desarrollando estos estándares y los laboratorios de referencia nacional podrán disponer de ellos cuando estén completos. Los reactivos biológicos que se utilizan en los ensayos C-ELISA e I-ELISA para el diagnóstico de la brucelosis porcina están disponibles en cantidades pequeñas con fines de investigación o estandarización1. a) Enzimoinmunoensayo (prueba prescrita para el comercio internacional) • ELISA indirecto Se han desarrollado ELISAs indirecto y competitivo para el diagnóstico de la brucelosis en cerdos individuales y para el muestreo de grandes cantidades de sueros. Estas técnicas prometen ser más eficaces que cualquier otra prueba mencionada más arriba y la C-ELISA parece ser mejor para distinguir reacciones de anticuerpos debidas a la infección con Y. enterocolitica serotipo 0,9 de las debidas a la infección con Brucella sp. El método del I-ELISA se describe con detalle en el Capítulo 2.3.1. Brucelosis bovina, sin embargo, deberían utilizarse anticuerpos monoclonales específicos para la IgG porcina conjugada con peroxidasa de rábano picante. • ELISA competitivo Los procedimientos del C-ELISA para la detección de anticuerpos porcinos frente a Brucella sp. (11) son idénticos a los empleados para la detección de anticuerpos bovinos frente a B. abortus descritos en el Capítulo 2.3.1. Este ensayo es capaz de eliminar algunas reacciones debidas a Y. enterocolitica serotipo 0,9 y a otros anticuerpos de reacción cruzada, tales como las IgM, que tienen afinidad por los epítopos de Brucella menor que la de los anticuerpos monoclonales utilizados en el ensayo. Se recomienda el C-ELISA como prueba confirmativa ya que su sensibilidad y especificidad superan las de las pruebas de aglutinación. b) Ensayo de polarización de fluorescencia (prueba alternativa para el comercio internacional) El FPA para la detección de anticuerpos porcinos frente a Brucella sp. es en esencia el mismo que el descrito para bóvidos (para más detalles, véase el Capitulo 2.3.1); la dilución del suero puede variar dependiendo de la validación con las muestras locales, pero con frecuencia se utiliza una dilución 1/25 para la prueba en tubo y 1/10 para la prueba en placa (11). Es una técnica simple para medir la interacción antígeno/anticuerpo y puede llevarse a cabo tanto en el laboratorio como en el campo. Este ensayo puede ayudar a eliminar algunos resultados de reactividad por la exposición a Y. enterocolitica serotipo 0.9 y a otros anticuerpos de reacción cruzada. Los sueros porcinos liofilizados tienden a incrementar la actividad de fondo en este ensayo. Se puede utilizar el FPA como prueba de detección y/o confirmación. c) Pruebas del antígeno brucelar tamponado (prueba alternativa para el comercio internacional) Se recomiendan como pruebas alternativas con fines de detección o como pruebas para piaras completas, las pruebas del antígeno brucelar tamponado (BBAT), p. ej. la prueba de la tarjeta, la prueba de aglutinación de rosa de bengala en placa (RBT) o la prueba de aglutinación en placa con antígeno tamponado (BPAT). En el Capítulo 2.3.1. Brucelosis bovina, se describe la preparación y estandarización de los antígenos de las BBATs y los métodos para realizar las pruebas. Todas las biovariedades de B. suis que afectan a los cerdos tienen el mismo antígeno A inmunodominante, como la mayoría de las biovariedades de B. abortus, lo que hace que los antígenos de B. abortus resulten apropiados para probar los sueros porcinos. 3. Otras pruebas 1 Se puede obtener del Laboratorio de Referencia de la OIE para la Brucelosis en el Instituto de Investigación de Enfermedades Animales, 3851 Fallowfield Road, Nepean, Ontario K2H 8P9, Canadá. 838 Manual de la OIE sobre animales terrestres 2004 Capítulo 2.6.2. — Brucelosis porcina a) Pruebas alérgicas (de hipersensibilidad) Las pruebas alérgicas se han utilizado ampliamente para el diagnóstico de la brucelosis en piaras de Europa del Este, en los países que antes formaban parte de la Unión de Repúblicas Socialistas Soviéticas (URSS) y en la República Popular de China. La especificidad es muy elevada; sin embargo, la sensibilidad de la prueba alérgica es similar a la de las pruebas serológicas (BBATs) y no es fiable para el diagnóstico individual. Algunos animales infectados que son sero-negativos, reaccionan de manera positiva a la prueba cutánea, y viceversa. Así, donde sea practicable, resultará útil realizar ambas pruebas. Como el principio activo de la prueba alérgica es una proteína, no debería haber reacción cruzada con Y. enterocolitica serotipo 0.9, al menos en teoría, y se desconoce si existe alguna demostración de esta reacción cruzada. Para el diagnóstico se han utilizado muchos alérgenos diferentes, pero uno que es simple de preparar, que se ha utilizado con efectividad como prueba de grupo en cerdos, y que todavía se utiliza en algunos países es un hidrolizado ácido, a veces llamado brucelizado o fracción F de la brucelina. A pesar de contener algún polisacárido, esta preparación no induce la aparición de aglutininas ni de anticuerpos fijadores del complemento ni sensibiliza a los animales (9). El método para preparar la fracción F de la brucelina (Sección C2), es decir, la hidrólisis ácida, provocará el aumento de una cantidad sustancial de polisacárido O en el sobrenadante, de modo que esto no ayuda a diferenciar los anticuerpos de Yersinia respecto a los de Brucella. En la Sección C2 se indica un método de preparación. Como un agente diagnóstico porcino, se inyectan por vía intradérmica 0,2 ml del alérgeno en la piel situada en la base de la oreja. La lectura de la reacción se lleva a cabo después de 48 horas. Una reacción positiva muestra eritema sobre una piel no pigmentada y una inflamación edematosa. En reacciones graves también puede haber alguna necrosis. Más recientemente, se ha desarrollado la brucelina INRA para ser utilizada en rumiantes; se desconoce si se ha utilizado en cerdos. En su preparación se emplea una cepa rugosa, de modo que se evita la presencia del LPS liso. La preparación, la prueba y el uso de la brucelina INRA se describen con detalle en el Capítulo 2.3.1. Brucelosis bovina. C. REQUISITOS PARA LAS VACUNAS Y LOS MATERIALES DE DIAGNÓSTICO Se han efectuado numerosos intentos de desarrollar una vacuna con el fin de inmunizar a los cerdos frente a B. suis. Sólo ha encontrado cierta aceptación un producto para uso de campo: la vacuna preparada a partir de la cepa 2 de B. suis (S2) se ha utilizado ampliamente en el sur de la República Popular de China. Hasta la fecha no parece que se haya utilizado en animales distintos al cerdo, probablemente porque se ha demostrado que confiere una protección menor en las ovejas frente a B. melitensis que la vacuna Rev.1 (20). No se dispone de datos suficientes para concluir si la vacuna de la cepa RB51 de B. abortus es eficaz para proteger al ganado porcino de la exposición a B. suis. C1. Vacuna de la cepa 2 de Brucella suis La S2 es una cepa atenuada de manera natural, estable y lisa de la biovariedad 1 de B. suis. Muchos estudios han fracasado en la detección de cualquier característica que distinga la S2 de las cepas de campo de la biovariedad 1, a excepción del nivel de virulencia, el cual, como se estima por su persistencia en ratones y cobayas, es mucho menor que el medio de la cepa de campo. Se ha demostrado el nivel bajo de virulencia y su estabilidad mediante pases en cerdas gestantes y verracos (22). La vacuna S2 se puede administrar por vía oral; por ejemplo, en la República Popular China con frecuencia se mezcla con la comida, aunque se advierte que la comida fermentada inactiva rápidamente la vacuna. La vacunación oral podría ser una posibilidad atractiva para el control de la brucelosis en los cerdos silvestres. Los experimentos de desafío en ambos sexos han demostrado de manera apreciable niveles de infección menores en los animales vacunados comparados con los control no vacunados, incluso en cerdas desafiadas con el semen infectado. Para la vacunación oral, se necesitan dosis de alrededor de 2 ×1010 y normalmente se administran dos dosis en un intervalo de aproximadamente dos meses. Se dice que los anticuerpos producidos en respuesta a la vacunación oral desaparecen en unos 6 meses después de la vacunación. Liang Xingxian (10) informa que en la Provincia de Guangdong en el sur de China, se ha controlado la brucelosis porcina mediante una combinación de pruebas serológicas anuales de los grupos de crianza con la eliminación de los animales sero-positivos y la vacunación de los animales sero-negativos. En 1985, la tasa de animales reactivos fue del 10%; en 1987 cayó hasta el 1,2% y no se han encontrado verracos reactivos en los 4 años posteriores hasta 1991. Antes de aceptar la vacuna S2 para uso general, debería investigarse cuidadosamente su inocuidad e inmunogenicidad según las condiciones propias de cada país. 1. Control del inóculo Manual de la OIE sobre animales terrestres 2004 839 Capítulo 2.6.2. — Brucelosis porcina Se dispone de cultivos liofilizados del inóculo para la producción experimental y el uso de las vacunas S2 procedentes de instituciones reconocidas2. Este material liofilizado se puede propagar mediante cultivo en agar nutritivo o en agar tripticasa soja durante 2–3 días para producir lotes del inóculo que no es conveniente subcultivar más de 3 veces desde el cultivo original. Cualquier país interesado en la introducción de esta vacuna debería organizar experimentos de desafío adecuados y ensayos de campo en los cerdos. 2. Método de producción La vacuna S2 se produce en fermentadores empleando los mismos procedimientos y medios a los descritos para la cepa 19 de B. abortus (S19) (véase Capítulo 2.3.1. Brucelosis bovina). Sin embargo, para la propagación de la vacuna S2 en medio sólido, se prefiere el agar nutritivo o el agar tripticasa soja al medio de agar patata. 3. Control del proceso y prueba posterior El control del proceso, el control de lotes y las pruebas sobre el producto final son las mismas que para B. abortus S19. Con respecto a la longitud de la inmunidad, se recomienda una revacunación anual. C2. Bruceliado (fracción F de la brucelina) a) Preparación i) Se cultiva una cepa lisa de Brucella (p. ej. B. suis) en medio solidificado con agar o en un fermentador. ii) Las células desarrolladas en medio sólido se recogen en solución salina normal (0,15 M NaCI). iii) Se precipitan por centrifugación y se resuspenden hasta alcanzar la densidad de 50–100 × 109 células/ml en solución salina normal. iv) Se añade ácido hidroclórico 1 N y se ajusta el pH hasta 1.2–2.0. Se incuba a temperatura ambiente durante 90 minutos. v) Después de autoclavar a 120°C durante 25 minutos, se deja toda la noche en el autoclave. vi) Las células se separan por centrifugación. vii) Se ajusta el pH del sobrenadante hidrolizado hasta 6.8–7.0. Se calienta en un baño de agua a 80°C durante 30 minutos. viii) Se pasa a través de un filtro estéril. ix) Se estima el contenido de nitrógeno del hidrolizado concentrado. Se ajusta el contenido de nitrógeno proteico a 25–30 mg/100 ml. x) Se comprueba que está estéril. La falta de toxicidad se comprueba inyectando de tres a cinco ratones con 0,5 ml. La potencia se puede probar en cobayas sensibilizados comparándola con la de un producto de potencia conocida. Se pueden sensibilizar los cobayas mediante inyecciones repetidas de B. suis muerta en adyuvante incompleto de Freund (2). b) Utilización de campo Como agente diagnóstico porcino, se inyectan por vía intradérmica 0,2 ml del alérgeno en la piel de la base de la oreja. La lectura de la reacción se realiza después de 48 horas. Una reacción positiva muestra eritema en la piel no pigmentada y una inflamación edematosa. En las reacciones graves también puede haber alguna necrosis. 2 840 Se puede obtener del Instituto Nacional para el Control de los Productos Veterinarios y Farmaceúticos del Ministerio de Agricultura, 30 Baishiqiao Road, Beijing 100081, China (República Popular), o de VLA Weybridge, New Haw, Addlestone, Surrey KT15 3NB, Reino Unido. El suministro a partir del laboratorio Weybridge necesita el permiso previo de la Organización Mundial de la Salud. Manual de la OIE sobre animales terrestres 2004 Capítulo 2.6.2. — Brucelosis porcina APÉNDICE: INFECCIONES DE BRUCELLA SUIS EN ANIMALES DISTINTOS AL CERDO 1. Brucelosis rangiferina La biovariedad 4 de Brucella suis provoca una enfermedad grave en los renos y los caribúes (Rangifer tarandus y sus diferentes subespecies) a lo largo de la región ártica, Siberia, Canadá y Alaska (12). Algunos de estos animales son domésticos, otros son salvajes y migratorios. Rangifer tarandus es muy susceptible a la infección por B. suis, caracterizada por fiebre, depresión y varios signos locales, tales como aborto, retención de placentas, mamitis, a veces con secreciones sanguinolentas, mastitis, bursitis y orquitis. En la región ártica, la biovariedad 4 de B. suis constituye una zoonosis seria (5). Puede trasmitirse al hombre por contacto directo o a través del consumo de leche y otros productos procedentes de los renos, calentados de modo inadecuado. La médula ósea, que en esta región se considera una exquisitez especial, también constituye una fuente de infección para el hombre. Los métodos descritos anteriormente para el aislamiento y la identificación de B. suis en muestras de cerdo son aplicables de igual modo a la biovariedad 4 de B. suis para las muestras de reno. La biovariedad 4 crece bien en todos los medios habituales para el cultivo de Brucella. Además, reacciona positivamente tanto con los sueros monoespecíficos A como M. Para los pruebas serológicas, se ha descrito que la prueba de aglutinación en tubo es satisfactoria, considerándose diagnósticos los títulos a partir de 1/20. Asimismo, se ha utilizado la CFT, pero en los renos no se ha establecido la interpretación clínica de estas pruebas. Se ha intentado de modo experimental, sin conseguir un resultado preciso, la vacunación de los renos con la vacuna S19 de B. abortus, o, alternativamente, empleando la vacuna 45/20 de B. abortus con adyuvante. En el caso de la S19, la reacción a la vacunación es bastante grave y en los animales vacunados sólo se puede demostrar la inmunidad frente al desafío con dosis muy pequeñas de la biovariedad 4 de B. suis. Gall et al. (6) han comparado varias pruebas serológicas y concluyen que los valores de especificidad para la BPAT y la CFT que utilizan sueros de reno/caribú son menores que los de los I-ELISA, C-ELISA y FPA, mientras que los valores de sensibilidad son similares en todas las pruebas. 2. Infección por Brucella suis en otras especies no porcinas Existen dos tipos diferentes de situación epidemiológica con respecto a la infección por B. suis en otras especies no porcinas. En el primer caso, la infección por B. suis en animales que no son los hospedadores naturales de la infección se produce a través de la ingestión de materiales contaminados o por la cohabitación con los hospedadores naturales infectados. Por ejemplo, los lobos y los zorros árticos pueden contraer la biovariedad 4 de B. suis a partir de los renos; los perros y los roedores, tales como las ratas y ratones, pueden adquirir otras biovariedades de B. suis por la cohabitación con hospedadores infectados. Las vacas pueden resultar infectadas por la cohabitación con ganado porcino silvestre. Invariablemente, las bacterias que infectan son las biovariedades bien definidas de la especie del hospedador natural. En el segundo caso, resultan infectadas algunas especies de vida libre que son hospedadores naturales de B. suis o se infectan por bacterias relacionadas con B. suis. Un ejemplo corresponde a la llamada brucelosis murina de la antigua URRS, en donde algunos roedores pequeños se infectan con la biovariedad 5 de B. suis. Se han descrito otras situaciones similares en Queensland, Australia, y en Kenia. En los tres casos, están implicadas cepas de B. suis con diferentes características, y al menos en uno de los casos es difícil de clasificar. La brucelosis causada por la biovariedad 2 de B.suis es quizás un caso especial. El reservorio de la infección es el cerdo silvestre (Sus scrofa) que vive en la misma zona (7, 8), o la liebre europea (Lepus capensis) (19), o los dos. Históricamente, la infección por la biovariedad 2 ha estado confinada a una zona entre Escandinavia y los Balcanes. El cerdo doméstico criado al aire libre en esta zona tiene mayor riesgo para la trasmisión de la biovariedad 2 a partir de los vectores de vida silvestre. Después de invadir las piaras de cerdos domésticos, probablemente la biovariedad 2 se extiende tan rápidamente como la 1 o la 3. La enfermedad en las liebres se caracteriza por la formación de nódulos de un tamaño que varía desde el de una semilla de mijo hasta el de una cereza o incluso mayor; con frecuencia estos nódulos llegan a ser purulentos. Además, pueden presentar una localización muy variada, en ocasiones subcutánea o intramuscular, en el bazo, hígado o pulmón y en los órganos reproductores de ambos sexos. Sorprendentemente, la función corporal de la liebre puede no verse afectada. Normalmente, las investigaciones serológicas en las especies no porcinas se llevan a cabo con fines de encuestas. En estas circunstancias particulares, la especificidad es más importante que la sensibilidad. En este caso se recomienda la CFT, aunque la prueba de aglutinación en placa con antígeno brucelar tamponado puede ser útil debido a su simplicidad. En muchas investigaciones previas, se ha utilizado la prueba de aglutinación en tubo, aparentemente de modo satisfactorio. Sin embargo, en las especies no porcinas puede ser problemática la Manual de la OIE sobre animales terrestres 2004 841 Capítulo 2.6.2. — Brucelosis porcina interpretación de los resultados serológicos. En el caso de encontrar muestras supuestamente positivas, después de la detección mediante pruebas serológicas se debería realizar un estudio de investigación bacteriológica. En las investigaciones bacteriológicas realizadas en estas situaciones, en las que los organismos infecciosos pueden tener características inusuales, se aconseja duplicar el cultivo en medios selectivos empleando medio simple suplementado con suero al 5% y ampliar la investigación incubando los cultivos en una atmósfera que contenga CO2 al 10%. Las colonias que parezcan debidas a Brucella se pueden identificar de modo preliminar mediante la tinción de Gram, con pruebas de aglutinación en porta con sueros monoespecíficos A y M y mediante suero anti-cepas rugosas de Brucella (Capítulo 2.3.1 Brucelosis bovina). La biovariedad 5 de Brucella suis es inusual por el hecho de que reacciona con el suero monoespecífico M y no con el A. Es mejor llevarla a cabo la identificación posterior en un laboratorio especializado. REFERENCIAS 1. ALTON G.G. (1990). Brucella suis. En: Animal Brucellosis, Nielsen K. & Duncan J.R., eds. CRC Press, Boston, EE.UU. 2. ALTON G.G., JONES L.M., ANGUS R.D. & VERGER J.M. (1988). Techniques for the Brucellosis Laboratory. INRA, Paris, Francia. 3. BRICKER B.J. & HALLING S.M. (1994). Differentiation of Brucella abortus bv. 1, 2 and 4, Brucella melitensis, Brucella ovis, and Brucella suis bv. 1 by PCR. J. Clin. Microbiol., 32, 2660–2666. 4. FERRIS R.A., SCHOENBAUM M.A. & CRAWFORD R.P. (1995). Comparison of serologic tests and bacteriologic culture for detection of brucellosis in swine from naturally infected herds. J. Am. Vet. Med. Assoc., 207, 1332–1333. 5. FORBES L.B. (1991). Isolates of B. suis biotype 4 from animals and humans in Canada, 1982–1990. Can. Vet. J., 32, 686–688. 6. GALL D., NIELSEN K., FORBES L., COOK W., LECLAIR D., BALSEVICIUS S., KELLY L., SMITH P. & MALLORY M. (2001). Evaluation of the fluorescence polarization assay and comparison to other serological assays for detection of brucellosis in cervids. J. Wildl. Dis., 37, 110–118. 7. GODFROID J. & KASBOHRER A. (2002). Brucellosis in the European Union and Norway at the turn of the twentyfirst century. Vet. Microbiol., 90, 135–145. 8. GODFROID J., MICHEL P., UYTTERHAIEGEN L., DE SMEDT C., RASSENEUR F., BOELAERT F., SAEGERMAN C. & PATIGNY X. (1994). Brucellose enzootique a Brucella suis biotype 2 chez le sanglier (Sus scrofa) en Belgique. Ann. Med. Vet., 138, 263–268. 9. JOINT FOOD AND AGRICULTURE ORGANIZATION OF THE UNITED NATIONS (FAO)/WORLD HEALTH ORGANIZATION (WHO) EXPERT COMMITTEE ON BRUCELLOSIS (1986). Sixth Report. Technical Report Series 740. WHO, Ginebra, Suiza. 10. LIANG XINGXIAN (1991). The prevalence, prevention and control of swine brucellosis in Guangdong Province, China. Document AGU/BRU/92/21 Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO), Roma, Italia. 11. NIELSEN K., GALL D., SMITH P., VIGLIOCCO A., PEREZ B., SAMARTINO L., DAJER A., ELZER P. & ENRIGHT F. (1999). Validation of the fluorescence polarization assay as a serological test for the presumptive diagnosis of porcine brucellosis. Vet. Microbiol., 68, 245–253. 12. ORLOW E.S. (1963). Brucellosis in reindeer. Proceedings of the 17th World Veterinary Congress, Hanover, Alemania, 1, 585–588. 13. PAULO P.S., VIGLIOCCO A.M., RAMONDINO R.F., MARTICORENA D., BISSI E., BRIONES G., GORCHS C., GALL D. & NIELSEN K. (2000). Evaluation of primary binding assays for presumptive serodiagnosis of swine brucellosis in Argentina. Clin. Diagn. Lab. Immunol., 7, 828–831. 14. PAULSEN I.T., SESHADRI R., NELSON K.E., EISEN J.A., HEIDELBERG J.F., READ T.D., DODSON R.J., UMAYAM L., BRINKAC L.M., BEANAN M.J., DAUGHERTY S.C., DEBOY R.T., DURKIN A.S., KOLONAY J.F., MADUPU R., NELSON W.C., AYODEJI B., KRAUL M., SHETTY J., MALEK J., VAN AKEN S.E., RIEDMULLER S., TETTELIN H., GILL S.R., WHITE O., SALZBERG S.L., HOOVER D.L., LINDLER L.E., HALLING S.M., BOYLE S.M. & FRASER C.M. (2002). The Brucella 842 Manual de la OIE sobre animales terrestres 2004 Capítulo 2.6.2. — Brucelosis porcina suis genome reveals fundamental similarities between animal and plant pathogens and symbionts. Proc. Natl Acad. Sci. EE.UU., 99, 13148–13153. 15. PRIADI A., CHASANAH U., HIRST R.G., EMMINS J.J., VAN DER GIESSEN J. & SEOROSO M. (1995). Development of an enzyme-linked immunosorbant assay (ELISA) for detecting antibody to Brucella suis in porcine sera. Penyakit Hewan., 17, 66–70 (Vet. Bull., 56, abstract 7528). 16. ROBSON J.M., HARRISON M.W., WOOD R.N., TILSE M.H., MCKAY A.B. & BRODRIBB T.R. (1993). Brucellosis: reemergence and changing epidemiology in Queensland. Med. J. Aust., 159, 153–158. 17. ROGERS R.J., COOK D.R., KETTERER P.J., BALDRODCK, F.C., BLACKALL P.J. & STEWART R.W. (1989). An evaluation of three serological tests for antibody to Brucella suis in pigs. Aust. Vet. J., 66, 77–80. 18. SIFUENTES-RINCON A.M., REVOL A. & BARRERA-SALDANA H.A. (1997). Detection and differentiation of the six Brucella species by polymerase chain reaction. Mol. Med., 3, 734–739. 19. SZULOWSKI K., IWANIAK W., PILASZEK J., TRUSZCZYNSKI M. & CHROBOCINSKA M. (1999). The ELISA for the examination of hare sera for anti-Brucella antibodies. Comp. Immunol. Microbiol. Infect. Dis., 22, 33–40. 20. VERGER J.M., GRAYON M., ZUNDEL E., LECHOPIER P. & OLIVER-BERNARDIN V. (1995). Comparison of the efficacy of Brucella suis strain 2 and Brucella melitensis Rev.1 live vaccines against a Brucella melitensis experimental infection in pregnant ewes. Vaccine, 13, 191–196. 21. WRATHALL A.E., BROUGHTON E.S., GILL K.P.W. & GOLDSMITH G.P. (1983). Serological reactions to Brucella species in British pigs. Vet. Rec., 132, 449–454. 22. XIE XIN (1986). Orally administrable brucellosis vaccine: Brucella suis strain 2 vaccine. Vaccine, 4, 212–216. * * * NB: Existen laboratorios de referencia de la OIE para la Brucelosis porcina (véase la Cuadro de la Parte 3 de este Manual de animales terrestres o consúltese la página Web de la OIE para conseguir la relación más actualizada: www.oie.int). Manual de la OIE sobre animales terrestres 2004 843