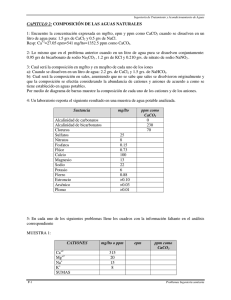
Peso molecular de un gas
Anuncio
Universidad Católica de la Santísima Concepción Facultad de Ciencias Curso : Gases en el mar Código : CQM 123 Determinación del peso molecular de un gas Fecha : 1 de Octubre de 2004 Resumen En este laboratorio se determino tanto las presiones parciales de un gas en particular, mediante un manómetro de rama abierta y todo esto a temperatura constante, también logramos determinar eso si experimentalmente el peso molecular del gas , por medio de la densidad del gas, a diferentes mediciones de presión, lo cual nos llevo a obtener un resultado de : 23.70 grs/mol, que acercándolo al peso molecular del gas mas cercano en la tabla periódica, nos da que el gas utilizado fue : nitrógeno. Cálculos y Resultados Tabla de datos obtenidos en el laboratorio hx 30.4 20.1 10.7 5.3 3.2 22.9 hy 30.4 20.1 10.7 5.3 3.2 22.9 Masa balón + gas(g) 135.0970 135.1772 135.2512 135.2967 135.3162 135.1556 Masa gas(g) P gas (atm) D gas (grs/lt) D/p 0.0554 0.1356 0.2096 0.2551 0.2746 0.114 0.20 0.47 0.72 0.86 0.92 0.40 0.205 0.50 0.78 0.94 1.01 0.42 1.03 1.06 1.08 1.09 1.11 1.05 Temperatura: 19ºC P.barométrica: 76.1 cmHg vol. Balon: 270 ml = 0.27 lts Grafico n° 1 y = mx + b m = y2 − y1 x2 − x1 pendiente intercepto valor de y cuando X = 0 m = 0.122 b= 0.99 R= 0.959 1 a T = Cte. PM = 0.99 grs/lt * 0.082 lts atm. * 292 ºK atm ºK mol PM = 23.70 grs/mol 28 grs/mol Nitrogeno (gas) Discusión y Conclusión El valor obtenido como peso molecular del gas buscado, presento una leve desviación del valor real que se pensaba obtener, esto puede deberse a una mala manipulación de los instrumentos empleados, o simplemente a una mal toma de los datos encontrados, que por lo tanto afectarían en los resultados finales, pudiendo disminuir o aumentar el valor final de los resultados.− Se puede concluir que en la determinación del peso molecular de un gas influyen muchos factores, tanto químicos como físicos. Se pudo observar que la densidad y la presión tanto parcial del gas como la presión atmosférica del aire son factores importantes a la hora de determinar características de los gases, y que la temperatura también juega un rol importante en estos resultados. Se logro comprender que cuando se realizan cálculos ideales, o sea lo que se pretendería obtener como resultados(idealidad) no siempre corresponde a lo que se encuentra si lo llevamos a un trabajo experimental (realidad) y tratamos de obtener los mismos valores que en la idealidad nos dieron, observando que los resultados obtenidos de la forma experimental siempre serán menores, que los resultados obtenidos de forma ideal, ya que en estos resultados (ideales) no se proveen futuros inconvenientes ni factores externos que nos impidan tener las condiciones ideales con las cuales obtuvimos aquellos cálculos.− Bibliografía Guía para la PSU 2003 ( ciencias) N° 19 La tercera PM= d/p * R*T 2