SVC 2015 2 Archivo
Anuncio

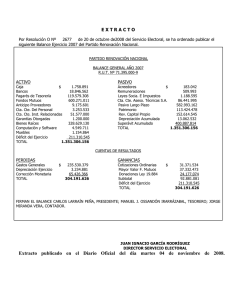
Sistemas de varios componentes Diagramas de fase de sistemas de varios componentes Sistemas de varios componentes pv = p1 + p2 x2,v < 1 x1,v < 1 x2,l < 1 x1,l < 1 mezclas ideales diagramas presión-composición 1.- pv vs. composición fase líquida (solución): pv = p1 + p2 pv = p°1 x1,l + p°2 (1 − x1,l ) pv = p°1 x1,l + p°2 − p°2 x1,l pv = x1,l (p°1 − p°2 ) + p°2 p p°1 pv = p1 + p2 p1 p°2 p2 0 x1, l 1 Sistemas de varios componentes 2.- pv vs. composición fase vapor: pv = p1 + p2 x2,v < 1 x1,v < 1 x2,l < 1 x1,l < 1 pi = pT xi según Dalton p1 = p°v x1,l en la solución p1 p°1 x1,l ⟹ x1,v = = pv x1,l (p°1 − p°2 ) + p°2 distribuyendo y despejando x1,l en función de x1,v x1,l p°2 x1,v = x1,v (p°2 − p°1 ) + p°1 p p°1 pv = x1,l (p°1 − p°2 ) + p°2 p°1 p°2 pv = x1,v (p°2 − p°1 ) + p°1 p°2 0 x1, l 1 x1,v p°1 x1,l = p°2 + (p°1 − p°2 )x1,l Sistemas de varios componentes x1,v p°2 + x1,v (p°1 − p°2 )x1,l = p°1 x1,l x1,v p°2 = p°1 x1,l − x1,v (p°1 − p°2 )x1,l x1,v p°2 = x1,l [p°1 −x1,v (p°1 − p°2 )] x1,l = reemplazando en: pv = x1,l (p°1 − p°2 ) + p°2 pv = pv = pv = x1,v p°2 x1,v p°2 = p°1 + x1,v (p°1 − p°2 ) p°1 + x1,v (p°2 − p°1 ) x1,v p°2 (p°1 − p°2 ) + p°2 p°1 + x1,v (p°2 − p°1 ) x1,v p°2 p°2 − p°1 + p°2 p°1 + (p°1 − p°2 )x1,v p°2 p°1 + x1,v (p°2 − p°1 ) p°2 p°1 + x1,v p°2 p°2 − x1,v p°2 p°1 + x1,v p°2 p°1 − x1,v p°2 p°2 p°1 + x1,v (p°2 − p°1 ) Sistemas de varios componentes T = cte p L pv p°1 V p°2 0 x1, l 1 x1, l x1, v a una dada p composición fase líq. ≠ composición vapor en soluciones ideales el vapor es más rico en el componente más volátil Sistemas de varios componentes disminución isotérmica de la presión desde pi a pf T = cte p pl L F=2 p°1 F=1 p°2 0 F=C–P+2 C = 2 y T = cte ⇒ F=3–P V F=2 pv x1, l 1 líquido a la pl, o pi, de composición x1l vapor a la pv, o pf, de composición x1v= x 1l Sistemas de varios componentes disminución isotérmica de la presión desde pi a pf T = cte p L p°1 p p°2 V 0 x1, l x1, v 1 líquido a la p de composición x1l en equilibrio con vapor más rico en el componente más volatil (x1,v) Sistemas de varios componentes disminución isotérmica de la presión desde pi a pf T = cte p L p°1 p p°2 V 0 x1, l x1, v 1 líquido a la p de composición x1l en equilibrio con vapor más rico en el componente más volatil (x1,v) Sistemas de varios componentes disminución isotérmica de la presión desde pi a pf T = cte p L p p°2 p°1 V 0 x1, l x1, l x1, v 1 vapor a la p de composición x1v en equilibrio con líquido más rico en el componente menos volatil (x1l) Sistemas de varios componentes problema 9 guía soluciones 9.- A 300 K, p0tolueno = 32,06 mmHg y p0benceno = 103,01 mmHg. Una mezcla líquida ideal se compone de 3 moles de tolueno y 2 moles de benceno. a) Si la presión sobre la mezcla a 300 K disminuye, ¿a qué presión se forma el primer vapor? b) ¿Cuál es la composición del primer vestigio de vapor formado? c) Si la presión disminuye aún más, ¿a qué presión desaparece el último vestigio de líquido? d) ¿Cuál es la composición del último vestigio de líquido? e) ¿Cuál será la presión, la composición del líquido y la composición del vapor cuando se ha evaporado 1 mol de la mezcla? Sistemas de varios componentes a) ¿ a que presión se forma el primer vapor? una mezcla líquida ideal se compone de 3 moles de tolueno y 2 moles de benceno T = 300 K xbc,l p 2 = = 0.4 5 p? 103,01 mmHg L p? V 32,06 mmHg p? = p°2 + (p°1 − p°2 )xbc,l p? = 32,06 + 103,01 − 32,06 0,4 mmHg p? = 60,44 mmHg 0 0,4 xbc, l 1 bc Sistemas de varios componentes b) ¿cuál es la composición del primer vestigio de vapor formado? p°1 p°2 pv = x1,v (p°2 − p°1 ) + p°1 T = 300 K p? = 60.44 = p p°1 p°2 𝑥? (p°2 − p°1 ) + p°1 x? = 0,68 103,01 mmHg L p? V 32,06 mmHg 0 0,4 x? xbc,v = 0,68 xtol,v = 0,32 1 bc Sistemas de varios componentes c) si la presión disminuye aún más, ¿a qué presión desaparece el último vestigio de líquido? T = 300 K p°1 p°2 pv = x1,v (p°2 − p°1 ) + p°1 p? = p°1 p°2 0,4 (p°2 − p°1 ) + p°1 p? = 44,25 mmHg p 103,01 d) ¿cuál es la composición del mmHg último vestigio de líquido? L V p? 32,06 mmHg 44,25 mmHg = p°2 + p°1 − p°2 x?bc,l xbc,l = 0,17 0 x? 0,4 1 bc xtol,l = 0,83 Sistemas de varios componentes e) ¿Cuál será la presión, la composición del líquido y la composición del vapor cuando se ha evaporado 1 mol de la mezcla? T = 300 K ntotales = 5 ntot.vapor = 1 ⟹ ntot.líquido = 4 regla de la palanca p 103,01 mmHg L p? 32,06 mmHg a b V b ntot liq = =4 a ntot vap xbc vap − 0,4 ntot liq = =4 0,4 − xbc liq ntot vap xbc vap = 2 − 4 xbc liq 0 x? 0,4 x? 1 bc xbc,vap pbc p°bc xbc,l = = p? p°tol + (p°bc − p°tol )xbc,l Sistemas de varios componentes xbc vap = 2 − 4 xbc liq xbc,vap pbc 103,01 xbc,l = = p? 32,06 + (103,01 − 32,06)xbc,l −283,8 xbc liq 2 − 89,3x bc liq + 64,12 = 0 xbc liq = 0.34 xbc vap = 2 − 4 ∗ 034 = 0,62 p? = 32,06 + 103,01 − 32,06 0.34 p? = 56,18 mmHg Sistemas de varios componentes mezclas ideales diagramas temperatura-composición p = cte T = cte T p p°1 L F=2 T°2 F=1 V p°2 0 V x1, l F=2 1 0 x1, l L T°1 1 Sistemas de varios componentes calentamiento isobárico desde Ti a Tf p = cte T Tf T°2 líquido a la Tl, o pi, de composición x1l V L T°1 Ti 0 x1, l 1 vapor a la Tf, de composición x1v= x 1l Sistemas de varios componentes calentamiento isobárico desde Ti a Tf p = cte T Tf T°2 V Teb L T°1 Ti 0 x1, l x1, v 1 líquido a la Teb de composición x1l en equilibrio con vapor de composición x1v Sistemas de varios componentes calentamiento isobárico desde Ti a Tf p = cte T Tf T°2 V T L T°1 Ti 0 x1, l x1, v 1 líquido + vapor a la T. Equilibrio de líquido de composición x1l con vapor de composición x1v Sistemas de varios componentes calentamiento isobárico desde Ti a Tf p = cte T Tf T°2 V T L T°1 Ti 0 x1, l x1, v 1 vapor de composición x1v a la T en equilibrio con líquido de composición x1l destilación fraccionada. Sistemas de varios componentes en la columna de fraccionamiento se producen un gran número de condensaciones y revaporizaciones sucesivas. T comp. 2 en el balón -T p = patm +T T2o V líquido en el balón con comp. x1* 0 L T1o x1* x1 1 comp. 1 en el destilado (erlenmeyer) Sistemas de varios componentes Tarea : Las siguientes mezclas tienen comportamiento muy próximo al ideal: 1-propanol/2-propanol Br-metano/I-metano hexano/heptano a) Busque las presiones de vapor y puntos de ebullición de los componentes puros. Realice en forma esquemática el correspondiente diagrama presión vs. composición y temperatura vs. composición en cada caso. b) Si realiza la destilación fraccionada de las citadas mezclas, cuál componente recuperará en el destilado y cuál en el balón en cada caso? Suponga que la extensión de la columna de fraccionamiento contiene la cantidad adecuada de platos. Sistemas de varios componentes mezclas reales diagramas p vs. comp. y T vs. comp destilación fraccionada con leves desvíos de la idealidad la destilación fraccionada cursa con características similares a la de las mezclas ideales Ej.: desvíos positivos p T = cte p1o L p = cte T T2o V V p2o 0 L x1 1 0 o 1 T x1 1 Sistemas de varios componentes ✓Aplicaciones: destilación de petróleo 20°C 70°C 140°C petróleo 190°C 400°C 270°C 320°C 333°C 350°C gas productos químicos (disolventes) combustible vehículos querosene diesel combustible calefactores lubricantes ceras asfalto Sistemas de varios componentes con desvíos significativos de la idealidad desvíos positivos (fuerzas repulsivas st-sv) p T = cte T L L V o 1 p V p = cte T2o o 2 p V T1o V L L 0 x 1 Azeot x1=1 mezclas con máxima pv 0 x 1 Azeot x1=1 azeótropos de temperatura de ebullición mínima destilación fraccionada de mezclas que forman azeótropos T Sistemas de varios componentes o 2 T V azeótropo Teb mínima p = cte o 1 T V L L 0 x1 A, l x1,l < x1Azeot comp. 2 en el balón x 1 Azeot x1,l > x1Azeot mezcla azeot en el destilado (erlenmeyer) x1 1 x1 B, l comp. 1 en el balón Sistemas de varios componentes Desvíos negativos (fuerzas atractivas st-sv) p p2o 0 T = cte o 1 p L V L V x 1 Azeot x1 =1 mezclas con mínima pv T p = cte V T2o 0 V L L x 1 Azeot T1o x1 =1 azeótropos de temperatura de ebullición máxima Tarea: Cómo cursará la destilación fraccionada de estas mezclas? Sistemas de varios componentes azeótropos más conocidos sistema (°C) agua composición (%) 4 Teb sust pura (°C) 100 etanol 96 78,3 cloroformo 87 61 metanol 13 64,7 agua 79,7 100 HCl 20,3 -80 Teb azeót (°C) 78,1 53,4 108,5 Sistemas de varios componentes Diagramas de fase de sistemas de varios componentes equilibrio líquido-líquido en sistemas de dos componentes parcialmente miscibles componentes totalmente miscibles: siempre es solución, ej: agua + etanol componentes parcialmente miscibles: solución o más de una fase, ej: agua + 1butanol Sistemas de varios componentes ↑T ⇒↑miscibilidad Ej.: B y C dos líquidos parcialmente miscibles T p = cte una fase aparición fase 2 Partiendo de C puro a y agregando B T' Tc, temperatura crítica de disolución desaparición fase 1 dos fases x x x b c x d fase 2 fase 1 C puro 0 B puro xB 1 Sistemas de varios componentes enfriando una solución con composición xB desde T’ T F = 2 – P +2 T' una fase F=2 p = cte F=3–P p = cte F=1 T '' T ''' dos fases 0 composiciónB en fase 1 xB composiciónB en fase 2 xB = 1 Sistemas de varios componentes Otros ejemplos T ↑T ⇒↓miscibilidad ↑T ⇒ ↑ y ↓ miscibilidad agua/trietilamina agua/nicotina T p = cte p = cte 210°C dos fases 20°C dos fases 0 0,4 xB una fase 60°C una fase 1 0 0,6 xB 1 Sistemas de varios componentes Diagramas de fase de sistemas de varios componentes equilibrio sólido-líquido en sistemas de dos componentes miscibles en fase líquida e inmiscibles en fase sólida Sistemas de varios componentes Ej.: B y C dos sustancias miscibles en todas la proporciones en fase líquida, completamente inmiscibles en fase sólida. Partiendo de C puro y agregando B. T p cte F=3-P sl. C+B T fuo s B F=0 F=2 T fuo s , C disolución líquida C+B en todas las proporciones F=1 b x a x sól. C + sl. C+B c x sól. B + sl. C+B F=1 F=1 sól. B + sól. C d 0 xB a xB b xB xB eu c xB = 1 a sólido C y solución B,C x con composición x B a b solución B,C con x composición x B b c sólido B y solución B,C x con composición x c B mezclas de B y C sól. en ≠ proporc. d punto eutéctico, pueden coexistir B y C sól. con sl. eu B,C composición x B Sistemas de varios componentes Enfriando una sl. de B y C de composición xBa desde una Ta T p cte a sl. C+B Ta T fuo s B T fuo s , C Tb, aparece B sól.⇒ comienza a solidificar la sl. b 0 Tc, sól. B + sl. B+C composición xB,c sól. C + sl. C+B c sól. B + sól. C d Td, sól. B + sól. C + sl eutec, xB,cu (T cte hasta desaparición del eut.) e Te, B y C sól.en proporción xB,a x B ,c x B ,a x B ,e u sól. B + sl. C+B xB = 1 eutecticos muy empleados agua/NaCl (23%) Tfus–21 C agua/NaBr (40%) Tfus –28 C soldadura de plomero: Pb + Sn Sistemas de varios componentes Diagramas de fase de sistemas de varios componentes equilibrio líq-líq en sistemas de tres componentes Sistemas de varios componentes representación gráfica ⇒ F=3–P haciendo p y T ctes F = 3 – P +2 Si P = 1 ⇒ F = 2 ⇒ la representación gráfica requiere al menos de la fracción molar (o fracción en peso) de dos de los comp. rectangular existen dos tipos de representaciones: triangular 0 % BA 100 % A xA d xA,d 0 triángulo equilátero de h = 1 xC,d 100 % B xB,d xB xC,d = 1 – (xB,d + xA,d ) B 0%C xB,d d xA,d 0%A 100 % CC xC,d + xB,d + xA,d = 1 Sistemas de varios componentes ejemplo A 0 27 %B 100 %A 20 80 40 60 60 40 37 %A 80 20 100 %B B 0 0 20 40 36 %C 60 80 100 %C C Sistemas de varios componentes diagrama triangular Ej.: propilenglicol sistema aceite/agua/propilenglicol 0% aceite 100% prop F=2 p y T ctes una fase dos fases 100% aceite aceite 0% agua F=1 0% prop agua 100% agua Sistemas de varios componentes coordenadas rectangulares polietilenglicol (%P/P) Ej.: sistema polietilenglicol (PEG)/dextrano (Dx) /agua xPEG,fase1 F=1 p y T ctes dos fases xPEG,fase2 una fase xDx,fase1 F=2 xDx,fase2 dextrano (%P/P)