Aminas, Alcoholes, Fenoles y Fenoles y Eteres Aminas Obtención
Anuncio

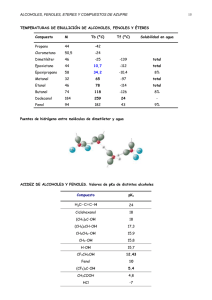
Aminas Se caracterizan por la presencia de N con el par de electrones disponible Aminas, Alcoholes, Fenoles y Eteres Son los únicos compuestos orgánicos básicos Clasificación por sustitución Primarias (1 grupo R) Secundarias (2 grupos R) Terciarias (3 grupos R) Clasificación por la naturaleza del R Alifáticas Aromáticas Heterocíclicas Cátedra de Química Orgánica Dra Miriam Martins Alho Obtención de Aminas Obtención de Aminas •Reducción de nitrilos •Sustitución nucleofílica RX NH3 R NH2 LiAlH4 RX RX R NR3 R2 NH Difícil de controlar R H O NH2 R H Al H NH2 R' R H O R NHR' NO2 Li R R N R' R CH2 NH2 •Reducción de Nitrocompuestos Aromáticos •Reducción de amidas O CN N H H2 / Pt o Me / H+ NH2 Me = Sn, Zn, Fe Válido también para nitrocompuestos alifáticos R" NR'R" Dra Miriam Martins Alho Dra Miriam Martins Alho 1 Basicidad de las Aminas Basicidad de las Aminas pKa NH3 = 9.25 pKa CH3CH2NH2 = 10.7 pKa PhNH2 = 4.6 Las aminas aromáticas son menos básicas que el amoníaco N H3C H H N-H2 + H+ NH3 Sustituyentes atractores disminuyen la basicidad, los donores la 4.6 aumentan [H2N-] [H+] Ka = [H3N] pKa NH3 = 9.25 pKa CH3CH2NH2 = 10.7 Las aminas alifáticas son más básicas que el amoníaco pKa (CH3CH2)2NH = 11.0 pKa (CH3CH2)3N = 10.8 Dra Miriam Martins Alho Aminas en la Naturaleza H3C COOH COOH H2N H H2N H Fenilalanina N 5.2 1.0 1.0 NO 2 NH2 5.3 OCH 3 Las aminas heterocíclicas son básicas si no usan sus electrones para aromatizar el ciclo Dra Miriam Martins Alho Alcoholes, Fenoles, Eteres N H Fenoles: grupo –OH unido a carbono sp2 COOH H2N H NH Histidina N Porfirinas:: Hemoglobina, clorofila Porfirinas Productos de putrefacción (por descomposición Asparagina N N H NH2 Aminoácidos: Aminoácidos: Unidades estructurales de las proteínas Alanina NH2 Están influenciadas por otros sutituyentes en el anillo. Putrescina HN Alcoholes: grupo –OH unido a carbono sp3 de los aminoácidos) Arginina R R" R' Cadaverina Alcaloides:: Compuestos conteniendo nitrógeno, generalmente solubles en Alcaloides R medios ácidos Cocaína R" R' Nicotina Atropina Eteres: dos grupos unidos por oxígeno. N Morfina O H O H • • Todos poseen - sobre el oxígeno • Los alcoholes y los fenoles presentan interacciones por puente de hidrógeno • Los éteres sólo son aceptores de puente hidrógeno => menor p. eb. Los alcoholes, éteres y fenoles están polarizados 2 Acidos o básicos? Alcoholes y Fenoles: Fenoles: Acidez Pueden actuar como bases (en el sentido de Lewis) frente a compuestos ácidos (próticos o de Lewis) pero no son básicos de por sí Carga concentrada en un único átomo sin posibilidad de deslocalización el anión generado no es estable B: = NaNH2, NaH H H+ O+ R H O R H B: O- R Pueden actuar como bases (en el sentido de Lewis) y ácidos como (en el sentido de Bronsted) frente a una base suficientemene fuerte pero no presentan características ácido base de por sí. El anión se estabiliza por resonancia B: = NaOH, KOH También se genera el alcóxido por reacción redox con Na metálico B: = NaNH2, NaH Clasificación Alcoholes: Obtención de alcoholes Fuentes Industriales RCH2OH alcoholes primarios R1 R2CHOH R1R2R 3COH alcoholes secundarios alcoholes terciarios Eteres: simétricos asimétricos cíclicos O Síntesis a partir de alquenos: Acción biológica: • Hidratación en medio ácido • Fermentación de bagazo de caña y/o jugos de fruta. • Formilación y reducción • Reducción de ácidos grasos Oxiranos o epóxidos Oxetano Tetrahidrofurano (THF) Tetrahidropirano • Fermentación de almidón (obtención de etanol) O 1,4-dioxano 3 Obtención de Alcoholes Obtención de alcoholes - A partir de Halogenuros de Alquilo Métodos de Laboratorio HO R X R OH A partir de halogenuros de alquilo Por SN1 y SN2 A partir de alquenos Para alcoholes 1rios y algunos 2rios. Hidratación Oximercuración Oximercuración--desmercuración Hidroboración A partir de derivados carbonílicos Reactivo de Grignard Reducción de aldehídos, cetonas y derivados de ácidos carboxílicos Para alcoholes 3rios, y algunos 2rios. Hay transposiciones y pérdida de asimetría Obtención de alcoholes Obtención de alcoholes Por oximercuraciónoximercuración-desmercuración Por hidratación de alquenos Orientación tipo Markovnikov Varios productos Intermediario catiónico Mezclas de estereoisómeros Transposición de cationes => el producto principal puede no ser el deseado deseado.. Orientación tipo Markovnikov Intermediario cíclico => No hay transposiciones El agua ataca por la cara opuesta => la adición es anti anti.. El Hg se intercambia por H por reducción con NaBH4 Se trabaja con sales de Hg y se produce Hg Hg°° 4 Obtención de alcoholes Obtención de alcoholes A partir de grupos Carbonilo Por hidroboración R Mg+ X- Reacción de Grignard Ataque concertado al carbonilo. La adición es syn (por la misma cara) Se genera un nuevo centro asimétrico No se genera actividad óptica En ésteres entran dos alquilos por carbonilo: Transferencia de hidruro seguida por oxidación e hidrólisis. Orientación tipo anti anti--Markovnikov La adición es syn (por la misma cara) No existen transposiciones Obtención de alcoholes Reacciones de los alcoholes A partir de grupos Carbonilo Reducción Aldehídos, cetonas, ésteres Principales reacciones de los alcoholes Agente Reductor Oxidación Alcoholes se transforman en aldehídos, cetonas o ácidos carboxílicos Deshidratación H2O se pierde agua para generar un alqueno Sustitución se convierte el alcohol en buen nucleófugo y se sustituye por un nucléofilo adecuado Alquilación Se convierte al alcohol en un nucleófilo y se lo usa en reacciones de SN Acilación formación de ésteres 5 Reacciones de los alcoholes Oxidación Oxidación: Menos oxidado RCH3 < RCH2OH < RCHO < RCOOH Reacciones de los alcoholes Oxidación: Sales de Cr(VI) o Mn(VII) Menos oxidado RR’CH2 < RR’CHOH < RCOR’ productos de degradación Para alcoholes primarios RR’R”CH < RR’R”COH productos de degradación Los alcoholes primarios pueden oxidarse hasta ácidos carboxílicos, sin fragmentar la molécula O Los alcoholes secundarios pueden oxidarse hasta cetonas. Oxidaciones posteriores fragmentan la molécula Los alcoholes terciarios no pueden oxidarse sin fragmentar la molécula Reacciones de los alcoholes Deshidratación: el grupo hidroxilo es mal nucleófugo, por lo tanto, la deshidratación no puede hacerse sin antes convertirlo en un buen grupo saliente (para alcoholes 3rios, 2rios, bencílicos y alílcos). Por mecanismo E1 R OH Reacciones de los alcoholes Sustitución: el grupo hidroxilo puede sufrir reacciones de SN1 o SN2. Por SN1: Protonación del hidroxilo Formación del carbocatión (paso lento, hay rotaciones y pérdida de configuración, transposiciones) Atque del Nu – Reaccionan mejor los alcoholes terciarios, bencílicos y alílicos. + Productos principales R+S El medio de reacción debe tener poca cantidad de agua (para disminuir la reacción inversa) La protonación se realiza con H2SO4 (c) en caliente, o bien con ácidos no acuosos (p-TSA) Hay catión intermediario => Hay trasposiciones Hay pérdida de estereoquímica El producto mayoritario es el alqueno más sustituído. Por SN2: Se utiliza para obtener halogenuros de alquilo primarios y secundarios sin transposiciones 6 Reacciones de los alcoholes Alquilación: El grupo hidroxilo puede actuar como nucleófilo, preferentemente cuando está cargado negativamente (como alcóxido). - Na° RO Na + + H2 Reacción redox ROH Síntesis de Williamson - RO Na - + Na NH 2 - RO Na + + + R'X ROR' + NaX + NH 3 Reacción ácido-base Fenoles: alcoholes muy particulares... Presentan características ácidas débiles (se disuelven en soluciones de hidróxidos pero no en bicarbonato) Pueden utilizarse como nucleófilos en Síntesis de Williamson, pero no sufren SN. Reaccionan por SEA en el anillo. Son fácilmente oxidables por acción del aire Acilación (formación de ésteres): El grupo hidroxilo puede actuar como nucleófilo, aún sin carga negativa, sobre derivados activados de ácidos carboxílicos. O O + ROH X halogenuro de acilo OR éster Obtención de fenoles Fuentes industriales Fuentes industriales A partir de halogenuros o ácidos sulfónicos - SO3 Na Obtención de fenoles A partir de isopropilbenceno (cumeno) + NaOH (aq), 300°C - O Na + OH H + Cl NaOH, 360°C 300atm. 7 Obtención de fenoles Eteres: obtención Síntesis de laboratorio Deshidratación ácida de alcoholes Sirve para obtener éteres simétricos y se lleva a cabo en exceso de alcohol. H 2SO4 / calor ROR + H2 O Existe competencia con la 2 ROH eliminación La reacción de formación de sales de diazonio es muy versátil y permite obtener otros compuestos aromáticos cuya síntesis por otros medios es altamente dificultosa, como por ejemplo, los fluorbencenos. Síntesis de Williamson (en medio básico) Síntesis de Williamson - RO Na + + R'X ROR' + NaX Alcoximercuración de alquenos La formación de la sal de diazonio se debe llevar a cabo a temperatura controlada en caso de que se la desee utilizar para otra síntesis, ya que si la temperatura se eleva, da automáticamente el fenol. NaBH4 + ROH + Hg(CF3 COO)2 OR Hg(CF3COO) OR H Eteres: reacciones Son compuestos relativamente inertes. Reaccionan por escición de la unión C-O-C en presencia de ácidos en un mecanismo concertado (tipo SN2) o bien en un proceso de dos etapas (tipo SN1). - + X R2OH + R1 HX O R1 R2 R1X rápida H lenta + O R1 R2 lenta H - X R1 OR2 XR1 + R2OH 8