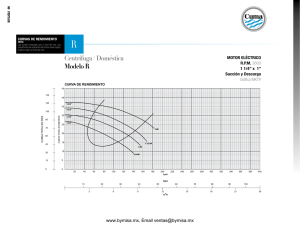
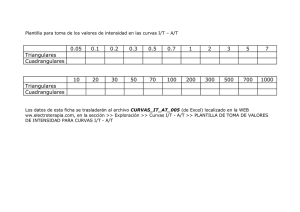
Curvas Intensidad
Anuncio

Curvas Intensidad-Potencial TEORIA DE LA ELECTROLISIS EMPLEANDO LAS CURVAS DE INTENSIDAD – POTENCIAL Los fenómenos que ocurren en una electrólisis suelen ser muy complejos, porque por lo general no se producen a un a velocidad finita a causa de dos razones principales: • Las reacciones electroquímicas tienen lugar a una velocidad finita, que puede variar en algunos casos. • Las reacciones electroquímicas pueden producirse solamente en la medida que las sustancias electrolizadas que van desapareciendo son reemplazadas en la superficie del electrodo. El transporte de materia en la superficie del electrodo tiene lugar también a velocidad limitada. CURVAS i = f(E). (Caso de un reductor u oxidante solo) red ox + e (Caso de un reductor u oxidante solo) EA y EC representan potenciales anódico y catódico εA y εC representan los potenciales anódico y catódico de equilibrio i es la intensidad de corriente re d ox + e Cuando aumentamos el potencial EA del ánodo se observa como la intensidad de corriente de electrólisis aumenta. Cuando se trata de una reacción catódica se consideran las intensidades como negativas En este caso cuando aumentamos en valor absoluto ( i ), el potencial EC del cátodo disminuye por debajo del potencial de equilibrio, εC. Nota: Las curvas i = f (E) tanto para un oxidante o un reductor dado, varían con la naturaleza química y física del electrodo, su forma, dimensiones y con la actividad del oxidante o del reductor. SISTEMAS RAPIDOS Y SISTEMAS LENTOS Se considera un sistema lento aquel cuyas curvas i =f(E) son las representadas en la siguiente figura: Sistema lento Las corrientes anódica y catódica son demasiado pequeñas para el valor de Eeq. Si se desea oxidar un reductor de un sistema lento a una velocidad notable, hay que aumentar un potencial suficiente hasta superar el valor de Eeq de otra manera será imposible realizar la oxidación, en este caso, se tendrá: (E – Eeq) Esta diferencia de potencial se denominará sobretensión anódica Sistema rápido Se considera un sistema rápido aquel que sigue el siguiente comportamiento en las curvas i = f(E) Sistema rápido En este caso se observa que para oxidar el reductor con la misma velocidad que en el caso anterior, es suficiente con aumentar el valor de E, tan solo un poco, es decir pasar de E a Eeq, por lo que la sobretensión es muy pequeña: E1 - Eeq Por tanto la oxidación puede realizarse muy rápidamente. LOS SISTEMAS RAPIDOS SE LES DENOMINA SISTEMAS REVERSIBLES Y LOS SISTEMAS LENTOS SISTEMAS IRREVERSIBLES Nota: estos adjetivos de reversibilidad e irreversibilidad solo deben ser empleados cuando los sistemas son verdaderamente reversibles o irreversibles CURVAS i = f (E). (Caso de un reductor u oxidante en un mismo par) Consideremos el caso de la siguiente ecuación : red ox + e • Las curvas de i = f (E) componente separadamente. • Supongamos que ambas simultáneamente: suelen trazarse para cada formas, ox y red están presentes (Caso de un reductor u oxidante en un mismo par) (Caso de un reductor u oxidante en un mismo par) Si suponemos que el sistema se comporta como un sistema lento, figura (a), vemos que no existe un potencial en el que las dos reacciones se den simultáneamente a una velocidad apreciable. •Si por el contrario suponemos un sistema rápido, se observa que para un potencial E1, la oxidación de red se produce a una velocidad finita, i1, mientras que al mismo tiempo, el ox es reducido a una velocidad determinada i2. •El potencial de equilibrio corresponde a una corriente nula i = i1+ i2=0 •En este punto de valor de potencial, la composición de la disolución no cambia ya que la velocidad de oxidación es igual a la de reducción. CURVAS i = f(E). (Caso donde están presentes varias sustancias oxidables y reducibles) Cuando se tiene este caso, entonces se trazan las curvas i f(E) de forma separada para cada uno de los componentes. La mayoría de las veces y en ausencia de reacciones químicas entre las sustancias presentes en la disolución la corriente resultante de las oxidaciones y de las reducciones de los diferentes compuestos es la suma algebraica de las corrientes relativas de oxidación y la de reducción de cada una de las sustancias tomadas separadamente. CURVAS i = f(E). (Caso donde están presentes varias sustancias oxidables y reducibles) Curvas típicas de i= f(E) para dos compuestos, cuando uno es oxidante y el otro reductor y además se encuentran en el mismo medio Para un potencial E1, puede verse que red1 es oxidado con una velocidad i1 Mientras que la velocidad de reducción de ox2 viene dada por i2 CURVAS i = f(E). (Caso donde están presentes varias sustancias oxidables y reducibles) La corriente global viene dada por: en este caso | i1 | > | i2 | (valores positivos) la corriente total es positiva i = i1 + i2 (curva de trazo continuo) En este caso | i1 | > | i2 | (valores positivos) la corriente total es positiva lo que significa que predominará la oxidación El electrodo actúa como ánodo, pero esto no impide que se produzca simultáneamente una reacción de reducción en este electrodo CURVAS i = f(E). (Caso donde están presentes dos electrodos) CURVAS i = f(E). (Caso donde están presentes dos electrodos) Puede darse el caso de que estén ambos electrodos sumergidos en dos disoluciones separadas tan solo por una pared porosa Si se aplica una tensión entre ambos electrodos ΔE de modo que las intensidades sean iguales y de signo contrario, podemos encontrar entones los potenciales EA y EC.