Tema 1.2 Introducción a las disoluciones: diluidas, saturadas y
Anuncio

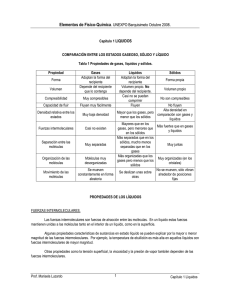
UNIDAD 1 La materia y sus cambios Tema 1.3 Propiedades características de las sustancias: físicas, organolépticas, químicas; intensivas y extensivas. NMLV 1 Propiedades de las sustancias • Organolépticas Con nuestros sentidos • Físicas Muestra intacta • Químicas Muestra que reacciona • Intensivas Independientes de la masa • Extensivas Dependientes de la masa 2 Propiedades organolépticas • Son aquellas características físicas que tiene la materia y que se pueden percibir a través de nuestros sentidos. • Su estudio es importante en las ramas de la ciencia en las que es habitual evaluar inicialmente las características de un material sin la ayuda de instrumentos científicos. • Ejemplos: Olor, color, sabor, textura. Las propiedades físicas de la materia son aquellas características propias de la sustancia, que al ser observadas o medidas no producen nuevas especies químicas (no cambia ni la identidad ni la composición), por ejemplo: Masa, volumen, forma cristalina, temperatura de fusión, temperatura de ebullición, densidad, viscosidad, tensión superficial, presión de vapor, solubilidad, dureza, brillo, maleabilidad, ductilidad, conductividad (sonora, térmica, eléctrica), etcétera. ¿Qué es un cambio físico? Aquellos en que se conservan las sustancias originales 4 En cambio… Las propiedades químicas de la materia son aquellas que sólo pueden observarse o medirse cuando una sustancia se transforma en otra sustancia, por ejemplo: Reactividad frente al oxígeno, al agua o a los ácidos; flamabilidad, corrosividad. ¿Qué es un cambio químico? Aquellos en que se transforman las sustancias originales. 5 Otra clasificación para las propiedades de las sustancias • Propiedades intensivas No dependen del tamaño del material que se esté analizando. Son cualidades independientes de la cantidad que se trate, es decir no dependen de la masa de la muestra. Ejemplos: densidad, temperatura de fusión, temperatura de ebullición, solubilidad, forma cristalina, viscosidad, etc. 6 Otra clasificación para las propiedades de las sustancias • Propiedades extensivas Son cualidades que dependen de la cantidad de masa, son aditivas, se cuantifican para toda la cantidad de materia en el sistema, es decir cambian de valor al cambiar la extensión de la muestra. Ejemplos: volumen, masa, energía, cantidad de sustancia (moles). 7 Unidades SI En 1960 se llegó a un acuerdo internacional que especificaba un grupo de unidades métricas para emplearse en las mediciones científicas. Estas unidades se denominan unidades SI, que es la abreviatura de Système International d’Unités. El sistema SI tiene siete unidades fundamentales de las cuales se derivan todas las demás. 2009, Prentice-Hall, Inc. Masa y Volumen • MASA: medida de la cantidad de materia que hay en un objeto. • VOLUMEN: es una magnitud definida como la extensión en tres dimensiones de una región del espacio. Es una magnitud derivada de la longitud, ya que se halla multiplicando la longitud, la anchura y la altura. El volumen de un cubo está dado por su longitud al cubo (longitud)3. Por tanto, la unidad SI fundamental del volumen es el metro cúbico (m3), el volumen de un cubo que tiene 1 m por lado. En química, es común utilizar unidades más pequeñas como el centímetro cúbico, cm3 (que a veces se escribe cc). Otra unidad de volumen de uso común en química es el litro (L), que equivale a un decímetro cúbico (dm3). El litro es una unidad métrica que no es una unidad SI. 10 Densidad • La densidad es la relación que existe entre la masa de una sustancia y el volumen que ocupa. • = masa/ volumen . Unidades: g/cm3 y g/mL y g/ L para gases. • Normalmente en las tablas de densidades se reporta la temperatura a la cual se determinaron, ya que los volúmenes de los objetos pueden cambiar con ella. • En el S.I. la densidad se expresa como = kg/ m3 11 Densidad de algunos materiales Material Temperatura (°C) Densidad (g/cm3) Pb 20 11.3 Ag 20 10.4 Cu 20 8.5 Fe 20 7.7 Al 20 2.7 H2O (S) 0 0.917 H2O (l) 4 1.0 H2O (l) 25 0.997 Etanol 25 0.791 Glicerina 25 1.26 Hg 20 13.6 He 20 0.000178 H2 20 0.000089 O2 20 0.00143 H2O (g) 100 0.000596 12 Ejercicio • Una pieza metálica cuya masa es de 194.3 gramos se coloca en una probeta que contiene 242 mililitros de agua. La nueva lectura del líquido es de 260.5 mililitros. De acuerdo con lo anterior, ¿cuál es la densidad de la muestra? ¿de qué metal puede tratarse? Solubilidad • Es la máxima cantidad de una sustancia que se disuelve en una cantidad determinada de otra, a una T específica. • Cuando una disolución contiene la cantidad máxima de soluto que se puede disolver a esa temperatura, se dice que está saturada. • La mayoría de los sólidos son más solubles conforme aumenta la temperatura (ver siguiente diapositiva). • Con respecto a los gases, las solubilidades son mucho menores: la solubilidad del oxígeno en agua a 1 atm y 20 ºC es de 0.04 g/L, pero si la T aumenta la cantidad de oxígeno disuelto disminuye. • La solubilidad de los gases aumenta con la presión, por ejemplo cuando destapamos una bebida gaseosa (la presión interior disminuye) el CO2 disuelto se libera en forma de burbujas. 14 15 Tensión superficial . En el interior de un líquido las moléculas están rodeadas de otras moléculas iguales a ellas y cada una ejerce y siente fuerzas de atracción en todas direcciones, sin embargo las moléculas de la superficie, sólo son atraídas hacia abajo por las demás moléculas de su especie. 16 Tensión superficial . • Como consecuencia la superficie se reduce al mínimo, lo que hace que el líquido se comporte como si tuviera una piel. • Este efecto permite colocar una aguja en la superficie del agua y a algunos insectos caminar en el agua aunque la densidad de tales objetos sea mayor que la del agua. Debido a esa tensión es que las gotas de agua son esféricas. 17 • Las unidades de la tensión superficial son fuerza por unidad de área. Líquidos Tensión superficial (J/m2) Mercurio 4.6x10-1 Agua 7.29x10-2 Etanol 2.23x10-2 Benceno 2.89x10-2 Glicerol 6.34x10-2 18 Presión de vapor • Los líquidos siempre tienden a evaporarse. • Las moléculas de un líquido se mueven a diferentes velocidades, en un momento dado algunas de ellas, las que están en la superficie del líquido, poseen la energía para vencer las fuerzas de atracción de sus vecinas y escapar a la fase gaseosa. • Conforme un líquido se evapora, se forma una fase gaseosa en su superficie que se va desprendiendo. • Si el líquido está en un recipiente abierto, eventualmente se evaporará en su totalidad. 19 Presión de vapor • Pero si el líquido está en un recipiente cerrado, ese gas se acumula y ejerce una presión conocida como presión de vapor. • Es la presión ejercida por la fase gaseosa, cuando se igualan en un proceso dinámico tanto el proceso de evaporación como el de condensación. Mientras más se eleve la temperatura, más vapor habrá y mayor será la presión que ejerza. • 20 Cuanto más débiles son las fuerzas de atracción, mayor es el número de moléculas que pueden escapar y mayor es la presión de vapor. 21 • Al igual que los líquidos, los sólidos tienen una presión de vapor determinada a cierta temperatura, aunque es pequeña en comparación con la de los líquidos. • Los sólidos con presión de vapor elevada subliman fácilmente. 22 Temperatura de fusión • Es la temperatura a la cual una sustancia en estado sólido y en estado líquido presentan la misma presión de vapor. Temperatura de ebullición • Es la temperatura a la cual la presión de vapor de una sustancia líquida se iguala con la presión del entorno. • A la T ebull, las partículas del líquido tienen la suficiente energía como para contrarrestar las fuerzas atractivas y sobreponerse a la presión que ejerce la atmósfera sobre la superficie del líquido. Temperaturas de fusión (oC) Temperaturas de ebullición (oC) Fe 1530 Cu 1083 Ca 851 NaCl 801 CH3COOH 17 H2O 0 CCl4 - 23 Hg - 39 CH3CH2OH -117 Fe 2735 Cu 2595 Ca 1487 NaCl 1413 CH3COOH 118 H2O 100 CCl4 76 Hg 357 CH3CH2OH 78 O2 - 219 CH4 - 182 Cl2 - 101 O2 - 183 CH4 - 164 Cl2 - 34 Viscosidad • Es la resistencia de un líquido a fluir, a mayor viscosidad el líquido fluirá más lentamente. • La viscosidad tiene que ver con la facilidad con que las moléculas del líquido puedan moverse con respecto a otras, por lo tanto depende de las fuerzas de atracción entre las moléculas y de la estructura que tengan dichas moléculas. • La viscosidad disminuye a medida que aumenta la temperatura. • Para determinar la viscosidad , se mide el tiempo que transcurre al fluir cierta cantidad de un líquido a través de un ducto. La unidad de la viscosidad es el poise que equivale a 1 g/cm-s. 26 El líquido más viscoso fluye más lentamente. 27 De las anteriores ¿qué propiedades nos permiten identificar a un material? Las PROPIEDADES FÍSICAS INTENSIVAS y las PROPIEDADES QUÍMICAS INTENSIVAS Resolver colección de ejercicios U1 Trabajaremos en la revisión de sus respuestas y dudas la próxima clase, no es para entregar.