Diapositiva 0
Anuncio

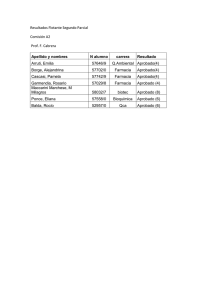
Procedimientos y tiempos de aprobación en España: Benchmarking Europeo Miguel Martinez Jorge Director Offering Development 15/03/2016 0 Agenda • Estructura del Sistema Nacional de Salud • Análisis 1 del mercado oncológico hospitalario en España • Procedimiento de aprobación en España de fármacos oncológicos • Tiempos de aprobación en España y Benchmarking Europeo • Conclusiones Estructura del Sistema Nacional de Salud 2 El SNS proporciona acceso universal a la sanidad en España pero está descentralizado en 17 regiones A nivel nacional, el MSSSI es el responsable de la determinación de las políticas nacionales sanitarias España por Comunidades Autónomas (y distribución • El sistema se financia principalmente a través de los impuestos generales, que se recaudan a nivel central y posteriormente se distribuyen a las distintas CCAA en un ratio per capita • Cada región es responsable de la gestión de su presupuesto en el área de la sanidad, de acuerdo con las políticas nacionales • En el modelo sanitario español, los fármacos oncológicos se concentran en el sector hospitalario • Cada CCAA asigna un presupuesto anual a cada uno de sus hospitales, en relación al gasto en los años anteriores • Actualmente tenemos en España 769 hospitales (158.256 camas) de los cuales 208 son privados poblacional1) ≥ 5 millones de habitantes 3-1 millones de habitantes <1 millón de habitantes SNS: Sistema Nacional de Salud MSSSI: Ministerio de Sanidad, Servicios Sociales e Igualdad CCAA: Comunidades Autónomas Fuente: 1. INE, datos poblacionales 2015 (http://www.ine.es/inebaseDYN/cp30321/cp_inicio.htm). Población total española ≈46.5 millones de habitantes. 3 Análisis del mercado oncológico hospitalario en España 4 Los fármacos oncológicos suponen hoy día un 18,5% del mercado hospitalario nacional a PVL (PPG 14,1%) Las terapias dirigidas y la inmuno-oncología suponen el mayor peso de la innovación, tanto en número como en valores (PVL), destacando tumores hematológicos, mama y melanoma Oncología en Hospitales (Consumo Mill € PVL) Últimos lanzamientos en onco-hematología* Consumo 14,1% 1.800 1.500 1.200 900 600 5,0% 4,4% 4,1% 300 1,8% 0 2011 2012 Crecimiento 2013 2014 2015 ONCOLOGIA * Se han registrado 28 nuevas moléculas desde 2013, 5 desde enero de 2016 5 Se prevé que el crecimiento se mantenga en los próximos años debido al lanzamiento de nuevas moléculas e indicaciones Fcos. no dirigidos Fcos. dirigidos Fcos. dirigidos Activos sobre cualquier célula, no solo tumoral, especialmente sobre aquellas con alta tasa de crecimiento. Acción dirigida sobre células tumorales que expresan un determinado marcador. Biosimilares Perfil de efectos adversos distinto a los no dirigidos. Inmuno oncológicos Llegan los primeros biosimilares de Fcos. Biológicos dirigidos Aparecen Fcos. dirigidos a estimular el sistema Inmune para combatir al tumor. Al no ser terapias dirigidas a un tumor determinado se está estudiando su utilidad en diferentes tumores, sólidos y hematológicos. Posibles próximos lanzamientos Oncología • Ca. mama: • Ca. pulmón • • • Ramucirumab, Pembrolizumab*, Atezolizumab*, Entinostat, Alectinib, Ceritinib Melanoma • Cobimetinib,Trametinib, Talimogene • Carcinoma basocelular • Próstata: • • Vismodegib Cabozantinib *Fármacos inmuno-oncológicos 6 Ca. Colorrectal • Ca. renal • Ca. vejiga • Ca. tiroides • Ca. cabeza y cuello • Neuroblastoma • Velaparib, Palbociclib, Pembrolizumab* Biosimilares Hematología • • • • • • LLA • LNH • Linfoma de células T periféricas • Mieloma múltiple Ramucirumab, Pembrolizumab* Cabozatinib, Nivolumab* Lenvatinib, Cabozantinib Dinutuximab • Ponatinib, Blinatumomab • Copanlisib • Pembrolizumab*, Atezolizumab* Talimogene, Pembrolizumab* • • • Belinostat • Carfilzomib, Ixazomib, Panobinostat, Vorinostat, Plitidepsina, Elotuzumab, Daratumumab • Ponatinib LMC Rituximab, trastuzumab, cetuximab Procedimiento de aprobación en España de fármacos oncológicos 7 El procedimiento de aprobación y acceso a fármacos se divide en 3 niveles e involucra numerosos pasos y agentes La autorización de comercialización puede obtenerse de forma centralizada o descentralizada Ministerio de Sanidad, Servicios Sociales e Igualdad Sociedades Científicas Nacional Agencia Española del Medicamento y Productos Sanitarios, AEMPS Autorización de Comercialización Instituto de Salud Carlos III Assessment Agency Sociedad Española de Farmacia Hospitalaria (SEFH) GEDEFO Regional 8 Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, (DGCBS)** Subdirección General de Medicamentos y Productos Sanitarios (SGCMPS) Valoración del precio y rembolso Agencia de valoración regional* Local Leyenda: GENESIS Decisor Comisión Interministerial de Precios de los Medicamentos (CIPM) Fijación del precio final Autoridades Sanitarias Regionales Comité Autonómico* Centros de salud Influenciador IPT*** Comité Farmacias Precio Rembolso Hospitales públicos/ centros de especialidades Farmacia Hospitalaria Comisión de Farmacia Market Access Hospitales privados Farmacia Hospitalaria Comisión de Farmacia *No presente en todas las regiones **Anteriormente conocida como Dirección General de Farmacia y Productos Sanitarios (DGFPS) ***IPT: Informe de Posicionamiento Terapéutico El primer paso incluye la obtención de la autorización de comercialización y la aprobación de precio/reembolso Este proceso puede durar varios meses Ministerio de Sanidad, Servicios Sociales e Igualdad Sociedades Científicas Nacional Agencia Española del Medicamento y Productos Sanitarios, AEMPS Autorización de Comercialización Instituto de Salud Carlos III Assessment Agency Sociedad Española de Farmacia Hospitalaria (SEFH) GEDEFO Regional 9 Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, (DGCBS)** Subdirección General de Medicamentos y Productos Sanitarios (SGCMPS) Valoración del precio y rembolso Agencia de valoración regional* Local Leyenda: GENESIS Decisor Comisión Interministerial de Precios de los Medicamentos (CIPM) Fijación del precio final Autoridades Sanitarias Regionales Comité Autonómico* Centros de salud Influenciador IPT*** Comité Farmacias Precio Rembolso Hospitales públicos/ centros de especialidades Farmacia Hospitalaria Comisión de Farmacia Market Access Hospitales privados Farmacia Hospitalaria Comisión de Farmacia *No presente en todas las regiones **Anteriormente conocida como Dirección General de Farmacia y Productos Sanitarios (DGFPS) ***IPT: Informe de Posicionamiento Terapéutico Una vez autorizada la comercialización es necesario además pasar trámites a nivel regional e incluso local Todo ello hace que pueda retrasarse en el tiempo el acceso al fármaco por parte del paciente, incluso con variación entre fármacos, Comunidades Autónomas y hospitales Ministerio de Sanidad, Servicios Sociales e Igualdad Sociedades Científicas Nacional Agencia Española del Medicamento y Productos Sanitarios, AEMPS Autorización de Comercialización Instituto de Salud Carlos III Assessment Agency Sociedad Española de Farmacia Hospitalaria (SEFH) GEDEFO Regional 10 Dirección General de Cartera Básica de Servicios del Sistema Nacional de Salud y Farmacia, (DGCBS)** Subdirección General de Medicamentos y Productos Sanitarios (SGCMPS) Valoración del precio y rembolso Agencia de valoración regional* Local Leyenda: GENESIS Decisor Comisión Interministerial de Precios de los Medicamentos (CIPM) Fijación del precio final Autoridades Sanitarias Regionales Comité Autonómico* Centros de salud Influenciador IPT*** Comité Farmacias Precio Rembolso Hospitales públicos/ centros de especialidades Farmacia Hospitalaria Comisión de Farmacia Market Access Hospitales privados Farmacia Hospitalaria Comisión de Farmacia *No presente en todas las regiones **Anteriormente conocida como Dirección General de Farmacia y Productos Sanitarios (DGFPS) ***IPT: Informe de Posicionamiento Terapéutico A nivel regional encontramos además distintos procedimientos de acceso a fármacos innovadores La determinación del acceso hospitalario está pasando en algunas regiones de un sistema descentralizado (aún mayoritario en oncología) a un sistema centralizado a nivel CC.AA. 2 1 3 4 5 • En las regiones con acceso descentralizado la decisión de incluir el fármaco en la guía farmacoterapéutica del hospital se toma en la Comisión de Farmacia 6 7 8 9 11 16 12 10 13 15 14 Acceso descentralizado Acceso mixto Acceso centralizado • En las regiones con acceso mixto la prescripción debe estar alineada con la decisión regional y a su vez aprobada por la Comisión de Farmacia de cada hospital 17 Fuente: Las políticas farmacéuticas de las CCAA, JR Luis-Yagüe Sánchez; Accesibilidad y equidad en el acceso a la innovacion terapeutica (Mayo 2015), FARMAINDUSTRIA; Estudio SEOM sobre el acceso a fármacos en Oncología Médica en las Comunidades Autónomas (2015) (n = 77 hospitales) 11 • En las regiones con acceso centralizado la prescripción debe ser aprobada por una comisión regional. En este contexto surgen los IPT, con el fin de agilizar los trámites y promover la equidad en el acceso entre regiones A pesar de ello y dado su carácter actual no vinculante, existen barreras que hacen que las condiciones finales de prescripción sean muy heterogéneas y restrictivas Selección de productos DGFPS/CIMP decide que productos aprobados por la EMA/AEMPS son candidatos a ser evaluados por un IPT, de forma previa a la negociación de P&R Sólo se realizan IPT para fármacos seleccionados Redacción del IPT Aprobación final del IPT Aprobación el IPT final por el comité, que será utilizado en las negociaciones de P&R AEMPS + 2 regiones (rotatorias) El Comité está formado por: Cada uno de los 3 agentes redacta un borrador del IPT siguiendo la misma metodología y finalmente se consensua un solo texto basado en los 3 anteriores • • • El contenido se basa principalmente en datos de EECC Representante de la AEMPS Representante de DGFPS Representantes 2 regiones (rotatorias) ¿Qué información incluye el IPT? • • • • IPT: Informe de Posicionamiento Terapéutico. Fuente: http://www.aemps.gob.es/cima/fichasTecnicas.do?metodo=detalleForm 12 Evaluación clínica Perfil del fármaco (farmacología, eficacia y seguridad) Posicionamiento en el algoritmo de tratamiento (puede incluir restricciones vs la indicación aprobada) Target de población El IPT es distribuido a la DGFPS, el CIMP y a las regiones Tiempos de aprobación en España y benchmarking europeo 13 El informe SEOM realizado en 2015 pone de manifiesto diferencias en tiempos de aprobación a nivel de las CC.AA. Se detecta heterogeneidad en el periodo de duración de las distintas etapas desde la autorización por la AEMPS de un fármaco oncológico hasta la prescripción al paciente Tiempo transcurrido desde fecha fijación del PR hasta primera prescripción de los fármacos oncológicos analizados para el abordaje del cáncer de pulmón y el cáncer de mama en una muestra de hospitales Fuente: Estudio SEOM sobre el acceso a fármacos en Oncología Médica en las Comunidades Autónomas (2015) 14 Dicho informe estima una mediana de 24 meses (rango 0-74) desde la aprobación de un fármaco a su 1ª prescripción Los numerosos pasos y agentes involucrados en el proceso de aprobación y acceso de fármacos oncológicos hace que el procedimiento, en algunos casos, dure varios meses Fuente: Estudio SEOM sobre el acceso a fármacos en Oncología Médica en las Comunidades Autónomas (2015) Los tiempos de acceso son actualmente un tema muy sensible dado que en ocasiones la aparición de nuevos tratamientos hace variar significativamente el esquema de tratamiento elegido para los pacientes oncológicos 15 En EU5 encontramos diferencias en los tiempos de aprobación de P&R entre países, siendo Alemania el más rápido Se encuentran también diferencias en lo que respecta a los fármacos financiados, según el criterio de evaluación de cada país • El procedimiento y los tiempos de aprobación de P&R en cada país condicionan los tiempos de acceso • La innovación que aporta el fármaco, su impacto económico (precio, volumen de pacientes a tratar...) y la necesidad de tratamientos para un determinado tipo de pacientes no cubiertos también pueden condicionar los tiempos de acceso • El contexto económico difícil de los últimos años y la presión presupuestaria puede haber tenido impacto en este tiempo, especialmente en fármacos de alto coste • Alemania concede reembolso automático a los fármacos con aprobación centralizada a nivel EMA, aunque posteriormente la opinión de GBA tendrá un impacto en la negociación del precio • UK permite precio libre y el rembolso se decide a criterios de coste-efectividad. Aún presentando un acceso rápido, las ventas son marginales hasta que no llega la evaluación de SMC/NICE. El consumo registrado puede deberse a una aprobación rápida por el SMC o al uso puntual en algunos hospitales Fuente: IMS MIDAS Database (2009-2014) . Se estableció el primer consumo del producto como el primer acceso al mismo (algunos de ellos estaban oficialmente comercializados antes de esa fecha). Se incluyeron: marcas y medicamentos innovadores. Se excluyeron: genéricos, reformulaciones y biosimilares Estudio: Comparing Time to Sales and Time to Access across Geographies and Product Types. Walter Colasante, Tushar Karkhanis, Ines Font, Johannes Scholz 16 Los distintos tiempos de acceso responden a la filosofía del establecimiento del P&R y a los procedimientos de cada país Alemania permite un rápido acceso, pero revisa el PVL fijado tiempo después País España Procedimiento de aprobación de P&R y acceso AEMPS P&R (AIFA) Si financiación fuera del GRD HAS R (Comisión de la P Acceso (Hospitales para Transparencia) (CEPS/CEEPS (HAS)) algunos fármacos) Reino Unido Evaluación rápida SMC Pueden restringir indicaciones vs FT Eficacia clínica comparada Beneficio clínico Sólo tienen en cuenta “hard end points” (ej. OS) No restringen indicaciones vs FT Coste-efectividad (coste por QALY) Umbrales definidos de coste por QALY Restricción de indicaciones según coste por QALY. PAS Efectividad vs “standard of care” BfArM P&R + Re-evaluación P&R (IQWiG, GBA) Acceso Fcos i.v. en Hosp FT: Ficha técnica; P:precio; R:reembolso: P&R:precio y reembolso. Nota: tiempos ilustrativos, no reales Fuente: IMS Concise Guide. 2015 update.. Impacto presupuestario Pueden restringir indicaciones vs ficha técnica Acceso (SMC/NICE, Regiones (CCG), Hospitales) Alemania 17 Impacto presupuestario Acceso (Regiones, Hospitales) Francia P&R Eficacia y Seguridad Eficacia y Seguridad AIFA MHRA Base de la negociación del precio Acceso (Regiones, Hospitales) P&R (DGFPS, CIPM) Italia Sist de evaluación de decisión de financiación Nuevo PVL : Autorización de comercialización Tienen en cuenta “end points” como OS o en su defecto otros como PFS, mejora de comorbiidades, calidad de vida…) : Primera prescripción Beneficio clínico No restringen indicaciones vs FT El acceso en el área de especialidades parece ser más rápido, especialmente en oncología, posiblemente por la innovación España muestra tiempos > vs el resto de EU5, probablemente debido a su procedimiento de aprobación de P&R y acceso, especialmente para fármacos de alto impacto económico Fuente: IMS MIDAS Database (2009-2014) . Se estableció el primer consumo del producto como el primer acceso al mismo (sin embargo algunos de ellos estaban oficialmente comercializados antes de esa fecha). Se incluyeron: marcas y medicamentos innovadores. Se excluyeron: genéricos, reformulaciones y biosimilares Estudio: Comparing Time to Sales and Time to Access across Geographies and Product Types. Walter Colasante, Tushar Karkhanis, Ines Font, Johannes Scholz 18 Con independencia del sistema de fijación de P&R, el precio medio al lanzamiento en oncología es similar en EU5 Sin embargo, posteriormente este precio se negocia en los distintos países, situación en la cual las diferencias en el precio se acentúan EU5 (2010-2014) Coste mensual del tratamiento normalizado por US Precio medio de fabricante normalizado por US • Las negociaciones pueden darse a distintos niveles: nacional, regional, hospital • En algunos casos las negociaciones implican la firma de acuerdos innovadores Fuente: IMS-MIDAS Database. Se incluyeron fármacos oncológicos lanzados en US and ex-US entre 2005-2013: Adcetris, Arzerra, Avastin, Bosulif, Erivedge, Giotrif, Iclusig, Inlyta, Jakavi, Jevtana, Nexavar, Perjeta, Pomalyst, Revlimid, Sprycel, Stivarga, Sutent, Tafinlar, Tarceva, Tasigna, Torisel, Tyverb, Vectibix, Votrient, Xalkori, Xtandi, Yervoy, Zelboraf y Zytiga. Estudio: The magic triangle – price, speed to market and volume for oncologics (2014 updated analysis). Walter Colasante, Joanne Clark, Ignacio Lions, Ross Alexander, Paolo Bassignana, Richard D´Mello; Update on the exUS Evolving Oncology P&MA Landscape. Carla Niven, Anna Szerb 19 En Alemania desde la aprobación de la ley AMNOG, tras la negociación, el PVL en onco disminuye de media un 24% El modelo Alemán es transparente y se publica el precio negociado, a diferencia de en otros países de EU5 Negociación del precio en Alemania Fuente: Lauer Taxe 20 Conclusiones 21 Conclusiones ESPAÑA • El SNS proporciona acceso universal a la sanidad pero está descentralizado en 17 regiones • Los numerosos pasos y agentes involucrados en el proceso de aprobación y acceso de fármacos oncológicos hacen que el proceso medio dure unos 24 meses (rango 0 – 74 meses) • Pese a la llegada de los IPT no se ha conseguido agilizar los trámites ni lograr la equidad en el acceso entre las distintas regiones EU5 22 • Se encuentran diferencias en los tiempos de acceso entre países, diferencias directamente ligadas a la filosofía de la fijación del P&R y al procedimiento de acceso establecido • Con independencia del sistema de fijación de P&R, el PVL medio al lanzamiento en oncología es similar, aunque con las negociaciones posteriores las diferencias se acentúan • Alemania es el país con menor tiempo de acceso y el único país de EU5 que hace público el precio negociado (de media un 24% por debajo del original) Aumento de la innovación Gestión tradicional Los mecanismos tradicionales no son suficientes para gestionar la innovación de forma eficiente 23 La presión presupuestaria continuará en aumento Adaptación de los sistemas La colaboración entre las administraciones y los laboratorios es clave para garantizar el acceso de los pacientes a las terapias innovadoras Nuevos mecanismos son necesarios y se seguirán introduciendo para gestionar la innovación ¿Qué nuevos mecanismos aparecerán en España? ¿Cómo pueden los laboratorios colaborar con la administración para desarrollar soluciones que mejoren el acceso de forma sostenible? Procedimientos y tiempos de aprobación en España: Benchmarking Europeo Miguel Martínez Jorge Director Offering Development 15/03/2016 24