Válvula Lotus™ - FAQs
Anuncio

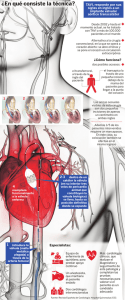
Preguntas frecuentes: El sistema valvular aórtico Lotus™ I. El dispositivo y sus características 1. ¿Qué es el sistema valvular aórtico Lotus™? El sistema valvular aórtico Lotus es una tecnología para el implante de la válvula aórtica transcatéter (TAVI) de segunda generación, que consiste en una prótesis valvular de tejido premontada, incorporada a una endoprótesis y precargada en un sistema de colocación mediante catéter, que permite la orientación y colocación percutánea precisa de la válvula. Esta válvula aórtica de colocación percutánea por vía transfemoral se despliega mediante un sistema de expansión mecánica controlada. Ha sido diseñada para el tratamiento de los pacientes con estenosis valvular grave y sintomática, y ofrece a los médicos un total control a lo largo de la intervención de TAVI mediante características como el elemento Adaptive Seal™, diseñado específicamente para minimizar la incidencia de las fugas paravalvulares, que constituyen un factor estadísticamente significativo de predicción de mortalidad. 1,2,3 Además, los médicos pueden volver a colocar o extraer la válvula incluso después de haber finalizado su colocación y antes de liberarla. 2. ¿Cómo se ha diseñado el sistema valvular aórtico Lotus™? El diseño del sistema valvular Lotus™ tiene como objetivo ofrecer a los médicos un mejor control de la válvula durante toda la intervención de TAVI, permitiendo una colocación precisa de la misma, así como la posibilidad de reposicionarla o volver a extraerla previamente a su liberación, incluso una vez colocada, cuando esto fuera necesario. 3. ¿Qué es la estenosis valvular aórtica y a cuántas personas afecta? La estenosis valvular aórtica consiste en una disfunción de la válvula de la aorta, una de las cuatro válvulas que controlan el flujo de sangre al interior y al exterior del corazón. La estenosis valvular aórtica es un proceso de engrosamiento y endurecimiento de la válvula, que puede dar lugar a un estrechamiento anormal de la apertura de la válvula aórtica, y una reducción del flujo sanguíneo. La estenosis aórtica es una enfermedad progresiva, mortal y cara, que afecta aproximadamente al 3 % de los mayores de 65 años 4 y al 5 % de los mayores de 75 5. 4. ¿Qué es el implante de válvula aórtica transcatéter (TAVI) y cuáles son sus posibles ventajas? El implante de la válvula aórtica transcatéter (TAVI) es un tratamiento mínimamente invasivo que constituye una alternativa a la valvuloplastia quirúrgica convencional. Se realiza sin detener el corazón y sin necesidad de derivación cardiopulmonar, y podría ser la única alternativa terapéutica viable para los pacientes considerados no aptos para la valvuloplastia 1 SH-183107-AB MAY2014 Español aórtica quirúrgica, o aquellos en los que se considera que la cirugía cardíaca comporta un riesgo elevado. El sistema valvular Lotus™ ha sido diseñado para ofrecer un control total a los médicos durante la totalidad de la intervención de TAVI, y minimizar al mismo tiempo las fugas paravalvulares mediante su tecnología Adaptive Seal™. Además, es posible reposicionar la válvula, recolocarla o volver a extraerla incluso una vez colocada, si esto fuera necesario. 5. ¿Qué pacientes son aptos para recibir el sistema valvular aórtico Lotus™? En Europa, el sistema valvular aórtico Lotus™ cuenta con la certificación CE para el tratamiento de los pacientes sintomáticos con estenosis aórtica calcificada grave para quienes la valvuloplastia quirúrgica convencional comporte un alto riesgo. En EE.UU., Lotus™ se encuentra aún en fase de investigación y, en virtud de las leyes vigentes, su uso está limitado al contexto de la investigación y no se encuentra disponible en el mercado. 6. ¿Cuándo recibió el sistema valvular Lotus™ la aprobación del marcado CE en Europa? El sistema valvular Lotus™ recibió la aprobación del marcado CE en 2013, con base en los resultados del programa de estudios clínicos REPRISE, para la evaluación de la seguridad y el rendimiento del dispositivo, así como del éxito en su colocación. II. Programa de estudios clínicos y datos clínicos disponibles 7. ¿Cuál es el estudio clave del sistema valvular Lotus™ y cuál es su objetivo? El sistema valvular aórtico Lotus™ se está estudiando actualmente en el programa de ensayos REPRISE (REpositionable Percutaneous Replacement of Stenotic Aortic Valve through Implantation of Lotus™ Valve SystEm), que consiste en las fases REPRISE I, REPRISE II y cohorte de extensión REPRISE II, además de un ensayo IDE adicional previsto (REPRISE III). También se evaluará la válvula Lotus en un estudio de postcomercialización llamado RESPOND. El estudio clave, cuyos resultados sirvieron como base para la aprobación del marcado CE en 2013, fue el denominado REPRISE II, un estudio prospectivo, con un solo grupo de tratamiento, multicéntrico, que se llevó a cabo en 14 centros en Australia, Francia, Alemania y el Reino Unido. Este estudio fue diseñado para evaluar la seguridad y el rendimiento del sistema valvular Lotus™ y contó con la participación de 120 pacientes sintomáticos con valvulopatía aórtica grave en quienes se consideraba que la valvuloplastia quirúrgica representa un riesgo elevado. El ensayo REPRISE II se va a ampliar, con la inscripción de 130 pacientes más en 16 centros en Australia y Europa. En EE.UU. va a llevarse a cabo el estudio REPRISE III, como apoyo para la solicitud de aprobación de la FDA. 8. ¿Cuántos pacientes han recibido el implante del sistema valvular Lotus™ hasta ahora? En el programa de ensayos clínicos REPRISE actualmente en curso, se ha implantado el sistema valvular Lotus™ a un total de 261 pacientes con estenosis valvular aórtica grave. 2 SH-183107-AB MAY2014 Español De ellos, once se inscribieron en el REPRISE I y 120 en el REPRISE II. 130 van a inscribirse en la cohorte adicional del REPRISE II. 9. ¿Cuál era el criterio principal de valoración del estudio REPRISE I y cuáles fueron los resultados? El criterio principal de valoración en este ensayo de factibilidad, prospectivo y con un solo grupo de tratamiento, se definió como el éxito en el implante del dispositivo, sin reacciones adversas cardiovasculares ni cerebrovasculares graves durante la hospitalización y hasta que el paciente recibiera el alta, o bien hasta los siete días siguientes a la intervención, lo que antes ocurriera. Las reacciones adversas cardiovasculares o cerebrovasculares graves durante la hospitalización incluían la muerte, el infarto de miocardio, un ictus grave o la necesidad de recurrir a la cirugía o repetir la intervención debido a una disfunción relacionada con la válvula. Los datos del ensayo REPRISE I demostraron la colocación satisfactoria del sistema valvular Lotus™ en todos los pacientes, sin que se produjeran fugas paravalvulares moderadas ni graves tras la colocación de la prótesis ni en el momento del alta. En un 91 % de los pacientes (10 de los 11) no se observaron reacciones adversas cardiovasculares ni cerebrovasculares graves intrahospitalarias. Se produjo un ictus, pero ningún fallecimiento. 6 10. ¿Cuál era el criterio principal de valoración en cuanto a rendimiento y seguridad en el estudio REPRISE II para la aprobación del marcado CE y cuáles fueron los resultados? El criterio principal de valoración en cuanto al rendimiento era el gradiente medio de presión de la válvula aórtica a los 30 días, en comparación con un objetivo de rendimiento de 18 mmHg, y dicho criterio fue alcanzado en los 120 pacientes, tal como se anunció en la Conferencia TCT de 2013. El gradiente medio de presión de la válvula aórtica a los 30 días, de 11,5 ± 5,2 mmHg fue significativamente (P < 0,001) menor que los 18 mmHg del objetivo de rendimiento. 7 El resultado del criterio de valoración principal de seguridad, definido como la mortalidad por cualquier causa a los 30 días, fue del 4,2 %. Además, se logró con éxito el acceso vascular, el implante y la colocación de la válvula Lotus™, así como la extracción del sistema de colocación en los 120 pacientes, sin que se produjeran casos de regurgitación paravalvular aórtica grave a los 30 días. En la valoración llevada a cabo por un laboratorio independiente se notificó un solo caso de regurgitación moderada (las fugas paravalvulares moderadas y graves se asocian a un aumento de la mortalidad). En 5,2% de los pacientes, la regurgitación se consideró despreciable y en un 78,4% no se observó ningún grado de regurgitación paravalvular a los 30 días. No se dieron casos de implantes fuera del estudio, de derivación cardiopulmonar de urgencia, embolización valvular, colocación de una válvula en otra, ni posicionamiento ectópico de la válvula. 3 SH-183107-AB MAY2014 Español 11. ¿Qué resultados se han publicado con el sistema valvular Lotus™ a los tres meses de seguimiento del estudio REPRISE II? Al cabo de 90 días, un 85,4% de los pacientes no presentaba regurgitación paravalvular aórtica. 8 Tampoco se observaron casos de fuga paravalvular grave en ningún paciente. Se observaron dos casos de regurgitación paravalvular aórtica moderada (2,1%), mientras que en un 12,5% de los pacientes la regurgitación paravalvular aórtica se consideró de grado leve. El gradiente medio de la presión valvular aórtica se mantuvo bajo y estable (11,5 ± 5,4 mmHg), mientras que la tasa de ictus discapacitante a los 90 días fue del 2,5%. 12. ¿Qué datos a largo plazo se han publicado del programa de ensayos REPRISE? En EuroPCR 2013 se publicaron los datos de 1 año del ensayo REPRISE I, que demostraron la continuidad de la seguridad y el rendimiento del dispositivo durante un año, sin que se observaran reacciones adversas graves atribuibles al mismo (según la definición del Valve Academic Research Consortium – VARC). No se observó regurgitación aórtica paravalvular moderada ni grave en ningún paciente. 9 13. ¿Cuándo se espera recibir más resultados de los ensayos REPRISE? En la reunión del ACC de 2014 se presentaron los datos correspondientes a 3 meses del ensayo REPRISE II con los 120 pacientes inscritos, los cuales siguieron demostrando el rendimiento y seguridad generales del sistema valvular aórtico Lotus™, sin que se observara regurgitación paravalvular aórtica en un 85% de los pacientes. Se presentarán resultados posteriores en congresos próximos este año, como el EuroPCR o el PCR London Valves. Sobre Boston Scientific Boston Scientific transforma las vidas de las personas mediante soluciones médicas innovadoras que mejoran la salud de los pacientes en todo el mundo. Somos una empresa con más de 30 años de liderazgo internacional en el sector de la tecnología médica y contribuimos al avance del campo biocientífico, ofreciendo una amplia gama de soluciones de alto rendimiento, dirigidas a cubrir las necesidades de los pacientes y reducir los costes sanitarios. Para obtener más información, visítenos en www.bostonscientific.com o síganos en Twitter o Facebook. Contactos con los medios de comunicación Dina Hurtado García Health Economics & Public Affairs España +34 6291 294 31 [email protected] 4 SH-183107-AB MAY2014 Español Referencias bibliográficas 1 Kodali SK et ál. Two-Year Outcomes after Transcatheter or Surgical Aortic-Valve Replacement. NEJM 2012;366:1685, http://www.nejm.org/doi/full/10.1056/NEJMoa1200384 (consultado el 22 de abril de 2014). 2 Tamburino C et ál. Valvular Heart Disease. Circ 2011;123:299, http://circ.ahajournals.org/content/123/3/299.full (consultado el 22 de abril de 2014). 3 Abdel-Wahab M et ál. Aortic regurgitation after transcatheter aortic valve implantation: incidence and early outcome. Results from the German transcatheter aortic valve implantation registry. Heart 2011;97:899, http://www.ncbi.nlm.nih.gov/pubmed/21398694 (consultado el 22 de abril de 2014). 4 Lindross M et ál. Epidemiological studies estimate the prevalence of AS at 5% in subjects over the age of 75 years. J Am Coll Cardiol 1993;21-1220-5. 5 Lester SJ, Heilbron B, Gin K et ál. The natural history and rate progression of Aortic Stenosis. Chest 1998;113:1109-14. 6 Datos presentados por el catedrático Ian Meredith en el congreso EuroPCR de 2012 en París, Francia. 7 Datos presentados por el catedrático Ian Meredith en la conferencia Transcatheter Cardiovascular Therapeutics (TCT) de 2013 en San Francisco, EE.UU. 8 Datos presentados por el catedrático Ian Meredith en la Sesión Científica Anual de 2014 del American College of Cardiology (ACC) en Washington, EE.UU. 9 Datos presentados por el catedrático Ian Meredith en el congreso EuroPCR de 2013 en París, Francia. 5 SH-183107-AB MAY2014 Español