4.- La aspirina o ácido acetilsalicílco, AH, es un ácido monoprótico
Anuncio

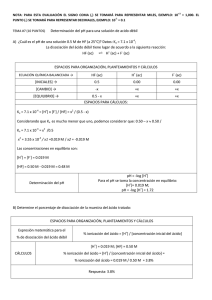
EXTREMADURA / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A / CUESTIÓN 4 4.- La aspirina o ácido acetilsalicílco, AH, es un ácido monoprótico débil, cuya fórmula es C9 H8 O4 , que está disociada un 3,2% a 293 K. a) Hallar el pH de una disolución preparada disolviendo totalmente, a 293 K, un comprimido de aspirina de 0,500 gramos en un poco de agua, hasta tener 0,1 litros de disolución. (1 punto) b) c) La constante de ionización del ácido acetilsalicílico a esa temperatura. (1 punto) Solución: Primeramente se calcula la concentración de la disolución preparada, utilizando para ello la masa de aspirina disuelta, su masa molecular, y el volumen de disolución logrado: Mm C9 H8 O4 = 180 g n aspirina = m / Mm n aspirina = 0,500 / 180 = 2,7·10-3 moles V disolución = 0,1 L M = moles soluto / V disolución M = 2,7·10-3 / 0,1 = 0,027 M a) Se escribe el equilibrio de disociación del ácido acetilsalicílico HA, con su concentración inicial, y la del equilibrio (dada por el grado de ionización en tanto por uno) a = 3,2 % = 0,032 HA + [ ]inicial [ ]disoc. [ ]equil. H2 O D 0,027 0,027· 0,032 0,027 · (1 – 0,032) [H3 O+] equil = 0,027 · 0,032 = 8,64·10-4 pH = -log [H3 O+] pH = -log (8,64·10-4) = 3 www.profes.net es un servicio gratuito de Ediciones SM H3 O+ -0,027 · 0,032 + A- -0,027 · 0,032 EXTREMADURA / SEPTIEMBRE 99. LOGSE / QUÍMICA / CINÉTICA Y EQUILIBRIO / OPCIÓN A / CUESTIÓN 4 b) La constante de ionización de un ácido débil monoprótico se define como: Ka = [H3 O+] · [A- ] / [HA] Sustituyendo por los valores de las concentraciones en el equilibrio, se tiene: Ka = (8,64·10-4 ) ·(8,64·10-4 ) / [0,027 · (1 – 0,032)] Ka = 2,85·10-5 www.profes.net es un servicio gratuito de Ediciones SM