urgencias
Anuncio

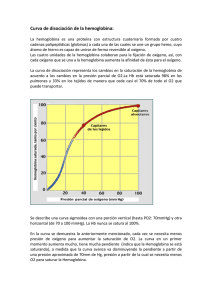
CÓMO UN PACIENTE COMÚN SE TRANSFORMA EN UNO DE CUIDADOS INTENSIVOS URGENCIAS PONENTES: MANU BARCENA Licenciada en veterinaria por la Universidad Autónoma de Barcelona en 1998.Desde entonces trabajo en el Hospital Veterinari Molins con especial interés en la medicina interna y los cuidados intensivos. Mi interés por los críticos me ha llevado en diversas ocasiones a asistir a congresos internacionales de cuidados intensivos. He escrito artículos en revistas nacionales y me han invitado a dar ponencias en diferentes ocasiones. CARLOS TORRENTE Licenciado en veterinaria por la Universidad Autónoma de Barcelona (UAB) en 1995. Profesor asociado del Departamento de Medicina y Cirugía Animal y responsable del Servicio de Medicina Intensiva del Hospital Clínic Veterinari de la UAB. Máster en Medicina Veterinaria y Sanidad Animal por la UAB en 2009. Miembro del comittee for Standards of Practice de EVECCS. Ha realizado estancias y cursos de formación en diferentes universidades e instituciones privadas de Europa, EEUU y Canadá . Ha realizado publicaciones, ponencias y comunicaciones en congresos nacionales e internacionales de la especialidad, siendo sus principales áreas de interés : los desórdenes ácido-base , la regulación hemodinámica y el manejo ventilatorio del paciente crítico. Actualmente está desarrollando su tesis doctoral centrada en el estudio de las implicaciones de la hipoalbuminemia en el paciente crítico. 2 CONTENIDO: MECANISMOS QUE DESCOMPENSAN A LOS ENFERMOS Desequilibrios inflamatorios, hemostáticos, renales, translocaciones bacterianas… INDICADORES DE PROBLEMAS Hipotensiones, bradi y taquicardias, anemias, hipo e hiperglucemias, aumento de proteínas de fase aguda… SOLUCIONES SIMPLES Y COMPLEJAS Profilaxis mediante control de la presión en anestesia, analgesia en la UCI, respiración asistida… PATOLOGÍA DE CUIDADOS INTENSIVOS Fallo renal, trombosis, síndrome de respuesta inflamatoria sistémica, sepsis… El monográfico intentará explicar los mecanismos por los que se descompensan los pacientes que manifiestan una enfermedad "simple" o "compleja". Mediante el conocimiento de estos mecanismos se explicarán las diferentes maneras de prevenir esta cascada de fatales acontecimientos, qué parámetros se deben monitorizar para prever el futuro de nuestro paciente y poder tomar decisiones terapéuticas más acertadas, e incluso aconsejar el traslado a una unidad de cuidados intensivos en caso de no disponer de ella. Por último, se dedicará un tiempo a explicar cómo afrontar el tratamiento de estos pacientes en una unidad de cuidados intensivos, una vez ya se ha declarado la enfermedad/síndrome secundaria al daño inicial. 3 CÓMO UN PACIENTE COMÚN SE TRANSFORMA EN UNO DE CUIDADOS INTENSIVOS. Manu Bárcena Hospital Veterinari Molins Cuando tenemos a un animal sano que es sometido, por ejemplo, a una cirugía rutinaria, como puede ser una limpieza de boca, nos resulta extraño que su estado pueda empeorar hasta llegar a morirse. Por su camino hacia la muerte el animal ha podido sufrir diferentes enfermedades. En la mayoría de estos casos podríamos haber intervenido para evitar el empeoramiento del paciente e incluso su fatal desenlace. Hay diferentes mecanismos homeostáticos que se ven alterados en nuestros animales enfermos o sometidos a intervenciones,…. El estudio de la fisiología nos servirá para conocer por qué fallan y casan la enfermedad. Oxigenación / Perfusión A nadie se le escapa que mantener una buena oxigenación de los tejidos es fundamental para no dañar irreversiblemente al organismo. En el mantenimiento de la ventilación-oxigenación interviene el sistema nervioso central (SNC) y sistema nervioso periférico (SNP), la caja torácica y la pleura, todo el árbol respiratorio (vías altas, bronquios, bronquiolos), los alveolos, el líquido intravascular con los eritrocitos que contienen hemoglobina (transportadora del oxígeno) y un sistema cardiovascular que sea capaz de mover toda la sangre hasta hacer llegar la hemoglobina a los tejidos.Una vez allí la hemoglobina abandonará al oxígeno para intracelularmente, gracias a la función de la mitocondria, participar en la fosforilación oxidativa que proporcionará energía a la célula. La ventilación es el proceso mecánico que causa flujo de gas hacia dentro y fuera de los pulmones. No todo el flujo gaseoso en el sistema respiratorio alcanza áreas de intercambio gaseoso, por eso la ventilación total (VT) es la suma de la ventilación alveolar (VA), donde ocurre intercambio gaseoso, y ventilación del espacio muerto (VD), donde no ocurre intercambio gaseoso. VT = VA + VD El espacio muerto son aquellas áreas anatómicas que normalmente no están envueltas en intercambios gaseosos y aquellos alveolos que están ventilados pero no reciben flujo sanguíneo pulmonar. El oxígeno inspirado (FiO2) en la atmósfera es transportado hasta los alveolos pulmonares mediante el proceso de la ventilación alveolar. En el alveolo pulmonar es donde se produce el intercambio de gases entre el pulmón y la sangre. El surfactante es fundamental en esta función por que se encarga de mantener el alveolo “abierto” lo que le confiere la máxima superficie para intercambio gaseoso. Hay diferentes procesos que impiden el buen funcionamiento del alveolo como son todas aquellas que ocupan o colapsan el alveolo (infección, edema, cáncer, atelectasia). El A-a cuantifica la eficiencia del proceso de intercambio gaseoso. Cuando el oxígeno entra en el torrente sanguíneo es transportado por la hemoglobina. Varias circunstancias pueden afectar a la capacidad de transportar oxígeno de la hemoglobina. Las propiedades fisiológicas de la hemoglobina a la hora de transportar 4 oxígeno están expresadas en la curva de disociación de la oxihemoglobina que representa la relación fisiológica entre la hemoglobina y el oxígeno. Porcentaje saturación hemoglobina Curva de disociación de la hemoglobina Presión parcial de O2 La hemoglobina tiene habilidad para cambiar su afinidad por el oxígeno; este proceso desvía la curva de la oxihemoglobina. De esta manera, factores como la academia, hipertermia, hipercarbia y aumento de 2,3-Difosfoglicerato (2,3-DFG) de los eritrocitos desplazan la curva hacia la derecha, indicando una disminución de la afinidad de la hemoglobina por el oxígeno y un aumento de liberación a los tejidos. Otros factores como la alcalemia, hipotermia, hipocarbia y disminución de 2,3-DPG desplazan la curva hacia la izquierda, indicando un aumento de la afinidad de la hemoglobina por el oxígeno y una menor liberación de éste a los tejidos. Menor liberació n de O2 a los tejidos (más afinidad) Mayor liberación de O2 a los tejidos (menos afinidad) Alcalosis Hipotermia Disminución de 2,3-DPG eritrocitario Acidosis Hipertermia Aumento PCO2 Aumento 2,3-DPG (anemia) Frecuentemente, los fallos en la oxigenación vienen derivados por problemas con la perfusión, en la mayoría de los casos, y por problemas en el alveolo pulmonar. En lo que respecta a la perfusión tenemos que tener en cuenta que el número de hemoglobina sea suficiente (que no exista una anemia limitante) y que dicha hemoglobina sea funcional. La hemoglobina tiene una curva de afinidad por el oxígeno sigmoidea por lo que a bajar concentraciones de oxígeno la afinidad es pequeña siendo su saturación máxima a una presión de O2 de 75-80mmHg. 5 A veces, aunque haya suficientes eritrocitos el líquido intravascular o la tensión de los vasos son insuficientes para transportarlos. En estos casos, la aplicación de un régimen de fluidoterapia será lo más indicado. La fluidoterapia tiene que ser agresiva y suficientemente rápida para evitar lesiones por isquemias. Dependiendo de la presión arterial, las proteínas totales y el estado de hidratación del animal escogeremos cristaloides (casi siempre la primera opción) o coloides artificiales o naturales. La cantidad dependerá del estado del animal llegando a poder ser hasta de 30cc/Kg/h en 15 minutos y repetirlo hasta en 2-3 ocasiones o introducir un coloide para mantener el cristaloide intravascular. En aquellos casos en que haya una anemia severa utilizaremos sangre entera o concentrado de eritrocitos para ayudar a la oxigenación de los tejidos. Si el déficit de perfusión se debe más a una falta de tono vascular que a una falta de líquido intravascular debemos utilizar vasopresores a la vez que indagamos si dicha atonía no tiene que ver con una hipoglucemia, por alteraciones electrolíticas importantes o por un hipoadrenocorticismo. En estos casos será necesaria una terapia particular (glucosado en caso de hipoglucemias, minidosis de corticoide para los Addison,…) Una vez tenemos un flujo sanguíneo adecuado (output cardíaco) y un buen tono vascular el oxígeno llegará a la célula para ser transformado en la mitocondria mediante la fosforilación oxidativa en energía. En condiciones normales, las células sólo utilizan un 25% del O2 que llega a ellas. No se puede medir la entrega de oxígeno a la célula (DO2) pero podemos cuantificarla mediante la siguiente fórmula matemática: DO2 = Q x CaO2 DO2= oxígeno entregado a la célula Q = output cardíaco CaO2 = contenido de oxígeno sanguíneo Ni que decir tiene, que todos los procesos en los que sospechemos una falta de oxigenación debemos, antes que nada, proporcionar oxígeno a nuestro paciente y asegurarle una buena perfusión. Para la monitorización de la perfusión/oxigenación podemos valorar signos clínicos, datos paramétricos, laboratoriales y de imagen. Dentro de la observación de signos clínicos miramos el color de las mucosas, el tiempo de relleno capilar, la calidad del pulso, la temperatura de las extremidades, el grado de distensión venosa (periférica y yugular), la presencia de edemas y el estado mental. El control de la presión arterial es fundamental aunque sabemos que pacientes que mantienen una presión arterial correcta pueden estar hipoperfundidos por lo que nunca debe ser el único método de control de la perfusión. La utilización del Doppler o de métodos oscilométricos nos facilitan una medida indirecta de la presión arterial. La presió arterial que se controla mediante Doppler es la sistólica (que debe ser superior a 80mmHg para evitar problemas isquémicos posteriores). Hay autores que captan mediante un cambio en el sonido la presión arterial diastólica y de esta manera pueden calcular la presión arterial media (PAM) que siempre debería estar por encima de 60 mmHg. 6 PAM = PAS-1/3 (PAS-PAD) PAS= presión arterial sistólica PAD= presión arterial diastólica Los análisis que nos pueden indicar problemas en la perfusión o las alteraciones analíticas que pueden generar alteraciones en el tono vascular y debemos corregir son el hematocrito y proteínas totales, la hemoglobina, la albúmina, la glucosa y los electrolitos. El lactato es el producto del metabolismo anaeróbico. Hay dos tipos de lactato, el A (hipóxico) y el B (no hipóxico). El lactato tipo B no es causado por una mala perfusión si no por un déficit en la función oxidativa de la mitocondria asociada a enfermedades como la diabetes mellitus, intoxicación por etilenglicol, sepsis, síndrome de respuesta inflamatoria sistémica (SIRS),… Aquellos que dispongan de aparato de gasometría podrán también tener una muy buena información de la perfusión/oxigenación mediante la interpretación del déficit de base. Dentro de los controles paramétricos que valoran la oxigenación caben destacar la pulsioximetría y la capnografía. La pulsioximetría es un método sencillo y no invasivo para valorar la saturación de oxígeno (SaO2). Nos servirá en animales que respiren aire ambiental. Cuando la medición del pulsioxímetro esté por debajo de 95% debemos empezar a preocuparnos ya que se relaciona con un la presión arterial de oxígeno (PaO2) de 80mmHg y por debajo de 92-90% la hipoxemia es crítica (PaO2<60mmHg). Si el pulsioxímetro nos dibuja la gráfica de pletismografía podremos valorar si hay flujo estable como para que la medición sea correcta. Debemos evitar hacer lecturas con pulsioximetría en zonas pigmentadas de la piel, en estancias muy luminosas y en zonas del animal que se muevan con la respiración. Las zonas elegidas normalmente son los labios, lengua (difícil en animales despiertos), vulva,… Si nuestro paciente estuviera tan mal que necesita ser intubado y mantenido anestesiado sería muy buena opción conectarle el capnógrafo para que nos informe de la capacidad ventilatoria mediante el control del ETCO2. Hay un gran interés en utilizar la capnografía en animales no intubados y hay estudios que intentan correlacionar los valores en animales con mascarilla. En mi opinión, dichos estudios todavía no son suficientemente conclusivos para la utilización de capnigrafía sin intubación. Inflamación sistémica También merece especial interés, cuando hablamos de síndromes que nos pueden conducir a cuidados intensivos, la respuesta inflamatoria sistémica. Hay diferentes teorías para explicar por qué una respuesta en principio beneficiosa para el organismo como es la respuesta sistémica, se acaba convirtiendo en un problema para el paciente. Algunos autores defienden la teoría del “second hit” 1 que indica que si tras un daño menor que puede quedar localizado sobreponemos otro daño (por ejemplo una anestesia tras un traumatismo) podemos causar un exceso de células y mediadores inflamatorios que convierten la respuesta local en generalizada. Otros autores dicen que puede ser tras un solo daño pero continuado en el tiempo. Sea de la manera que sea, es uno de los síndromes más importantes en cuanto a gravedad se refiere ya que todavía no se conoce ninguna droga capaz de frenar, una vez está instaurado, esta cadena de acontecimientos. Para la prevención de la respuesta 7 inflamatoria sistémica es necesario una buena monitorización y estabilización del animal a la vez que evitar daños añadidos como malnutrición, hipotermias,… Hemostasia Si queremos mantener la oxigenación de los tejidos es fundamental que no haya ningún tapón plaquetario en los vasos y que tampoco se produzcan hemorragias que podrían disminuir gravemente el flujo sanguíneo. En los últimos años ha cambiado un poco la manera de entender la cascada de la coagulación. Si el sistema antiguo nos sigue sirviendo para explicar la analítica hemostática la nueva manera de explicar la hemostasia o modelo celular es más apropiado y más cercano a la realidad. La hemostasia primaria hace referencia a las plaquetas, endotelio y factor de Von Wilebrand. En los animales críticos es frecuente que se vea afectada la hemostasia primaria (trombocitopenia, vasculitis) aunque no siempre se transforma en daños visibles. Las plaquetas pueden adherirse directamente a la matriz de colágeno subendotelial, fibronectina y otras glicoproteínas y proteoglicanos. Aunque la adhesión más eficiente ocurre cuando se libera el factor de Von Willebrand del endotelio activado y cubre el colágeno subendotelial para formar unos puentes específicos entre el colágeno y el receptor tipo glicoproteínas de las plaquetas (GPIb). En este punto y sin más estimulación, las plaquetas dentro del agregado secretan el contenido de sus cuerpos densos y alfa-gránulos y producen sustancias como el tromboxano para acelerar la hemostasia. El ADP liberado desde los gránulos densos desencadena la unión del fibrinógeno al receptor plaquetario GPIIb-IIIa, resultando en la formación de puentes de fibrinógeno que enlazan plaquetas en un agregado que empezaba a soltarse. La contracción plaquetar consolida este agregado en un tapón denso, el cual cubre el área dañada. Cuando el daño vascular es mínimo, el tapón plaquetar sólo puede cubrir el defecto. Si no, el colágeno expuesto y los fosfolípidos de las plaquetas agregadas promueven la hemostasia secundaria. En el modelo antiguo de coagulación, por lo que se refiere a la hemostasia secundaria (en la que intervienen los factores de coagulación) nos encontrábamos con una vía extrínseca y una intrínseca que convergían en una vía común. Con el paso del tiempo, los científicos se dieron cuenta que la falta de algunos factores era más importante clínicamente que la falta de otros. Esta situación, que no se explicaba bajo el concepto clásico de cascada hemostática, es la que hizo investigar las conexiones entre las distintas vías. Según el modelo celular el mayor estímulo para la coagulación in vivo es la exposición del factor tisular (FT). Tras la formación del complejo FT/FVIIa en las superficies dañadas que expresan FT pasan dos importantes eventos: 1. Se activa el FX 2. Se activa el FIX permitiendo un by-pass de la fase de contacto o extrínseca a la vía intrínseca de la “coagulación clásica”. El FXa permanece localizado sobre las superficies de las células dañadas para iniciar la formación de una pequeña cantidad de trombina, esta trombina es poca para convertir cantidades suficientes de fibrinógeno a fibrina pero sin embargo, lo que sí hace es activar las plaquetas y factores V, VIII, XI y XIII sobre las superficies que expresan factor tisular. Las plaquetas activadas, a su vez, proporcionan el sustrato (superficie fosfolipídica) para la formación del complejo tenasa intrínseco (FIXa:FVIIIa:Ca2+ y fosfolípido) que permite la activación adicional de más FXa. La activación iniciada por la trombina de estos diferentes factores causa una amplificación 8 de las reacciones para generar grandes cantidades de trombina que participará en la conversión de fibrinógeno a fibrina. Modificado a partir de Zachary and McGavin: Pathologic Basic of Veterinary Disease. 5ed. 2011 Mosby Activación plaquetas La monitorización de los desórdenes hemostáticos parte de la observación de las mucosas para buscar petequias, equimosis o hemorragias. La analítica hemostática en la mayoría de los casos se debe hacer seriada para poder interpretar la evolución del paciente. Es habitual que el recuento plaquetario vaya disminuyendo en los animales 9 críticos. En cuanto al tiempo parcial de protrombina y a la ACT debemos recordar que se ven afectados por la inflamación por lo que no siempre su aumento implica dificultad para coagular. El dímero-D es un producto de degradación de fibrina que se puede utilizar, en casos de ser negativo, para casi excluir la posibilidad de trombosis. La determinación de la actividad de la antitrombina (ATA) es un análisis útil en animales críticos. Se sabe que cuando la ATA<60% hay un riego importante de trombosis y que cuando es inferior a 30 la situación es crítica. Siendo la trombina tan importante en el proceso de formación del coágulo se entiende que uno de los tratamientos más discutidos, en cuanto a tromboembolismos se refiere, sea la heparina (cofactor de la antitrombina). La heparina aumenta la efectividad de la antitrombina hasta mil veces pero es importante conocer que, al tratarse de un cofactor, necesita de la presencia de antitrombina para ser útil. La heparina de bajo peso molecular (LMWH) tiene una vida más larga y una “clearance” más controlada que la heparina no fraccionada por lo que se recomienda sobre ésta. Se monitoriza mediante niveles de ACT o con PTT permitiendo hasta un aumento de 1,5 veces su valor máximo. La dosis de dalteparina para perros y gatos es 100-150UI/kg/12-24h. También es usual utilizar antiagregantes plaquetarios que pueden darse juntamente con la heparina. Los antiagregantes plaquetarios que se utilizan en veterinaria son el ácido acetil salicílico y el clopidogrel. El ácido acetil salicílico inhibe permanentemente la ciclooxigenasa. De esta manera, inhibe la formación de tromboxanos que son los más potentes agregantes plaquetarios durante aproximadamente 5 días que es la vida media de las plaquetas. La dosis de ácido acetilsalicílico es 1mg/kg/24h en perros y 5mg/gato/72h en gatos. El ADP de la plaqueta tras unirse a un receptor induce un aumento de Ca2+ que ocasiona el cambio de conformación que expone el receptor GP IIb-IIIa para el anclaje posterior de fibrinógeno y otras plaquetas. El clopidogrel impide la unión del ADP a su receptor evitando así la agregación plaquetaria. La dosis de clopidogrel es 19mg/gato/24h en gatos y 2mg/kg/24h en perros. Monitorización / Tratamiento La monitorización permite una detección precoz de desequilibrios metabólicos o fisiológicos a la vez que minimiza el riesgo de alteraciones iatrogénicas. Una monitorización óptima consta de observaciones clínicas, datos analíticos y paramétricos y en caso de ser necesario pruebas de imagen. Respiratorio Los parámetros físicos que se observaran son el color de las mucosas, la frecuencia y patrón respiratorio, la posición que toma el paciente e incluso si tiene un estado mental disminuido. En cuanto a la auscultación pulmonar tiene que ser profunda y de todas las zonas del tórax y vías respiratorias altas. Si los sonidos captados mediante auscultación no son correctos sería necesario realizar pruebas de imagen. Para valorar la oxigenación utilizaremos datos paramétricos como la pulsioximetría y capnografía de las que ya hemos hablado anteriormente. La determinación de lactato y/o de exceso de base nos indica si el animal ha estado hipoperfundido. Si la causa del déficit de oxigenación es falta de eritrocitos o fluidos intravasculares la determinación del hematocrito y las proteínas nos lo indicará. 10 Mediante la gasometría arterial valoramos la ventilación (PCO2) y la oxigenación (PaO2, A-a, F/P) a la vez que nos informa de la posible compensación metabólica. La extracción de sangre arterial se realiza en la arteria femoral o en la tarsal. La determinación debe ser inmediata por lo que debemos tener el analizador de gases en nuestro centro. Por supuesto, la extracción debe ser sin incorporar aire en la jeringa. Aunque siempre se había considerado la necesidad de heparinizar la muestra, últimamente se ha considerado inútil esta práctica. Para el análisis de la muestra tenemos que tener en cuenta el siguiente diagrama: pH Acidemia pH PaCO2 Alcalemia pH PaCO2 HCO3- Acidosis respiratoria Acidosis metabólica Alcalosis respiratoria HCO3- Alcalosis metabólica En un estudio más profundo sobre la gasometría deberíamos estudiar los desequilibrios mixtos que son aquellos que se dan por alteraciones respiratorias y metabólicas primarias, además de las compensatorias. Con la gasometría arterial valoramos la ventilación mediante la PaCO2 y la oxigenación mediante la PaO2, la diferencia de O2 Alveolo-arteria (A-a), el ratio P/F y la regla del 120 (PaO2+PaCO2>120mmHg) A-a= 150-1.2(PaCO2)-PaO2 P/F= PaO2/FiO2 Valores normales de gases sanguíneos en perro y gato. Perro Gato pH 7.41 (7.35-7.46) 7.39 (7.31-7.46) PaCO2 37 (32-43) 31 (26-36) PaO2 92 (80-105) 107 (95-115) Bicarbonato 22 (18-26) 18 (14-22) Déficit de base -2 (+1 a -5) -5 (-2 a +8) Small Animal Critical Care Medicine Silverstein and Hopper. Saunders Los casos de hipocapnia (PaCO2<25mmHg) o hiperventilación pueden ser debidos a miedo, dolor, ansiedad y fiebre aunque también se generan por alteraciones del parénquima pulmonar. Sin embargo, los casos de hipercapnia (PaCO2> 60mHg) 11 pueden ser causados por depresión del sistema nervioso o el sistema neuromuscular , obstrucciones de vías altas, alteraciones a nivel pleural, atelectasia o alteraciones terminales del parénquima pulmonar. Una vez hemos descartado las causas no respiratorias debemos valorar la presencia o no de hipoxemia (PaO2<80mmHg o <60mmHg en casos más graves). Las causas de hipoxemia se pueden clasificar en aquellas que cursan con una disminución de la FiO2, hipoventilación, patologías que dificultan el intercambio gaseoso o alteraciones hemodinámicas(anemia, bajo tono vasomotor,arritmias,…). Los problemas que dificultan el intercambio gaseoso, a su vez, se clasifican en problemas en la barrera de difusión (raros), shunts y desequilibrios ventilación-perfusión (los más frecuentes). Para el clasificar en estos diferentes grupos los procesos que generan hipoxemia podemos utilizar el siguiente esquema: HIPOXEMIA A-a Anormal Normal Respuesta a 100% O2 NO respuesta 100% O2 paO2 flujo 28%O2 Shunt derechaizquierdo Aumento >50mmHg Problema difusión Aumento <50mmHg PCO2 normal o disminuido PCO2 aumentado Disminución FiO2 Hipoventilación Veterinary Clinics of North America vol 38 nº3 Desequilibrio V/Q El tratamiento de las enfermedades hipoxémicas siempre pasa, lógicamente, por la administración de oxígeno. Si la causa de la hipoxemia es un fallo hemodinámico se deberá corregir (transfusiones, vasopresores, antiarritmicos,…). Es importante valorar la ventilación y corregirla en caso de no ser adecuada (vaciado de líquido pleural, traqueostomía, ….). En ocasiones es necesario ventilar artificialmente al paciente a la vez que se oxigena. Algunas enfermedades pulmonares no permiten la correcta difusión de los gases por lo que se recomienda un ventilador de intensivos con presión positiva. Con todo y esto, no todas las enfermedades de nuestros pacientes pueden corregirse con los medios de que disponemos y aquellos casos graves, como los síndromes de distrés respiratorio agudo (ARDS) terminan muriendo. Gastrointestinal El tejido linfoide asociado al intestino (GALT) incluye las placas de peyer, linfocitos intraepiteliales, células linfoides de la lámina propia e IgA y se encarga del 70% de la inmunidad total del individuo y de la integridad de la barrera intestinal. No debemos 12 olvidar que hay entre 300 y 500 especies de bacterias diferentes en el intestino por lo que podemos imaginar la protección que debe tener el tejido intestinal para mantener dichas bacterias en su lumen y que no lleguen al torrente sanguíneo. En prevención de la colonización de patógenos intervienen, además del GALT, el peristaltismo, el ácido y el moco. El animal crítico está inmunosuprimido por lo que está predispuesto a infecciones secundarias. Por otro lado, su balance energético y proteico es negativo ya que se encuentra en un estado catabólico. Las drogas vasoactivas predisponen a la hipoxia luminal, los opioides al ileo paralítico y los antibióticos destruyen la flora intestinal. Si el animal no come una dieta enteral se producen atrofias de las vellosidades intestinales. Por estos y otros motivos, es fundamental que el paciente coma una parte de su dieta por vía enteral, al igual que debe estar bien alimentado en cuanto a energía y proteínas se refiere. Esta será la mejor forma de evitar las translocaciones bacterianas. Para monitorizar el buen funcionamiento del sistema gastrointestinal podemos observar la presencia de vómitos y/o diarreas, dolor abdominal, cambio en aspecto de las heces, timpanismo y auscultación de borborigmos. Las analíticas que se relacionan directamente con el sistema gastrointestinal son las proteínas, electrolitos, albúmina y lipasa pancreática específica. Lo más importante a valorar mediante métodos de imagen es el movimiento intestinal y la presencia de líquido libre en el abdomen. El objetivo del tratamiento es que el intestino no se pare y se mantenga la integridad del intestino. Para este fin remarcar la importancia de la nutrición enteral o en su defecto de la administración oral de glutamina o arginina. A veces, es necesario la utilización de procinéticos siendo la más utilizada la metoclopramida en infusión (12mg/kg/día). La utilización de antiácidos debe ser restringida a los casos estrictamente necesarios ya que disminuye la defensa natural del organismo contra los patógenos intestinales. Cardiovascular Para monitorizar el sistema cardiovascular tenemos que utilizar los parámetros que hemos nombrado en la monitorización de la perfusión/oxigenación. También debemos fijarnos en otros signos clínicos como la frecuencia cardíaca, auscultación cardiopulmonar, patrón, frecuencia y esfuerzo respiratorio. Además de valorar la presión arterial y la presión venosa central podemos realizar un electrocardiograma para saber la viabilidad eléctrica del corazón. El gasto cardíaco y la contractibilidad se pueden valorar utilizando ecocardiografía. Los análisis de sangre que utilizamos son los mismos que hemos nombrado para la perfusión/oxigenación. En lo que se refiere a la frecuencia cardíaca debemos recordar la presencia de taquicardias por causa no cardiovascular como el dolor, ansiedad. En casos de anemia severa también tendremos una taquicardia compensadora. La taquicardia siempre se asocia con estadíos iniciales del shock, aunque en gatos no se cumple esta premisa y se presentan chocados y con bradicardia incluso intensa. Algunos mediadores de la inflamación se ha descubierto que provocan una disminución de la contractibilidad miocárdica. Por este motivo, animales de cuidados intensivos pueden tener déficits de contractibilidad hasta llegar a fracciones de 13 acortamiento < 30%. Acidosis metabólica, sepsis, hipoxia, hipotermia, hipocalemia e hipoglucemia son otras alteraciones que ocasionan disminución de la contractibilidad. Las arritmias en los animales graves no son raras aunque no suelen tratarse a menos que comporten inestabilidad eléctrica o dificultad de perfusión lo cual ocurre pocas veces en aquellos animales que no tenían enfermedad cardíaca previa. Si la monitorización cardiovascular nos indica que puede existir un problema en estos órganos el tratamiento debe ser inmediato ya que están directamente relacionados con la perfusión/oxigenación y su falta de funcionalidad puede generar un daño mayor. La oxigenación es el tratamiento primero juntamente con el restablecimiento del tono vascular en caso de que no exista y de los fluidos. Para restablecer el tono se utilizan vasopresores como la dopamina (>5microg/kg/min) y(o dobutamina (5microg/kg/min). Si la causa del bajo tono fuera déficit de eletrolitos o glucosa se debe restablecer. Se debe monitorizar muy frecuentemente para saber si estamos consiguiendo mejorar el estado de oxigenación de los tejidos. Neurológico El sistema nervioso tiene una demanda energética (glucosa) y de oxígeno elevada. Tiene un sistema de autoregulación que mantiene constante el flujo sanguíneo cerebral entre 50 y 150mmHg. El paciente común cuyo estado de salud se complica con alteraciones neurológicas suele ser por alteraciones en la perfusión/oxigenación o por la presencia de trombosis y/o hemorragias. La monitorización, además de los patrones de perfusión/oxigenación consiste en la observación de los patrones respiratorios, reflejos del tronco del encéfalo (tamaño y reactividad pupilar, posición del globo ocular, nistagmos espontáneos, reflejo oculovestibular, reflejo corneal), movilidad del animal y una exploración neurológica completa. Para valorar el estado mental del paciente se ha desarrollado una escala de gran utilidad que todos utilizamos para valorar la evolución del animal. Esta medida es la Escala de Glasgow modificada que utilizando unas simples preguntas puede definir el estado mental del paciente. Como las respuestas pueden ser un poco subjetivas es importante que la escala la realice siempre la misma persona o grupo reducido de personas. Por lo que se refiere analítica laboratorial que nos pueda ser útil para el seguimiento de la salud neurológica de nuestro paciente realizaremos, otra vez, los análisis para valorar la perfusión/oxigenación entre los que destacan el lactato y el hematocrito y proteínas, juntamente con los electrolitos y la glucosa (ya que sus desequilibrios pueden afectar a la función neurológica). Aquellos casos en los que la exploración física nos demuestre un problema neurológico la analítica hemostática nos ayudará a sospechar de una trombosis o una hemorragia. La analítica hemostática es fundamental en aquellos animales que por su enfermedad o naturaleza estén predispuestos a coagulopatías. Una vez hemos localizado la lesión podemos someter al paciente a un estudio de imagen (resonancia magnática y/o tomografía). 14 Renal El riñón es el responsable de la excreción orgánica, de la regulación hidroeléctrica, osmolaridad, concentración de electrolitos, ácido-base y presión arterial. También secreta hormonas y puede realizar la gluconeogénesis. Cuando hablamos de equilibrio hídrico deberíamos separar entre lo que significa la volemia y la hidratación ya que ambas se monitorizan distinto y se tratan diferente. La volemia hace referencia al líquido intravascular. Se monitoriza mediante la observación del color de las mucosas, el tiempo de relleno capilar, la frecuencia cardíaca, calidad del pulso, temperatura de las extremidades, presión arterial y presión venosa central. Sin embargo, la hidratación hace referencia al líquido localizado en el intersticio. Podemos monitorizar la hidratación mediante la humedad de las mucosas, la prueba del pliegue cutáneo, la determinación del hematocrito y proteínas y la obtención del peso corporal seriado. Tanto para restablecer la volemia como la hidratación será necesaria la utilización de la fluidoterapia aunque en cada uno de los casos el tipo de suero será diferente. En caso de deshidratación severa siempre se deben administrar cristaloides en primera instancia para no deshidratar más el intersticio, mientras que si hay una hipovolemia podemos utilizar cristaloides para empezar pero casi siempre deberemos continuar con coloides para mantener al cristaloide en el espacio intravascular. Las combinaciones de cristaloide con coloide son muy útiles para estados críticos. Por supuesto, para elegir entre los diferentes sueros tendremos que saber las deficiencias que presenta el paciente (electrolitos, albúmina, proteínas totales, hemoglobina,…). En aquellos animales que posean suficiente fluido en su espacio intravascular e intesticial pero no tengan tono vascular se deberán utilizar drogas para tal fin. Las más utilizadas son la dopamina y dobutamina, minidosis de córticos, mineralocorticoides y desmopresina. La monitorización renal consiste en la observación de los parámetros de perfusión/oxigenación y la aparición de edemas, así como la cuantificación del output urinario (lo normal es 1-2ml/kg/h) y la observación de la orina al microscopio (la cristaluria aparece antes que la azotemia en el fallo renal). El análisis de la orina incluyendo la aparición de glucosuria o el ratio proteína/creatinina así como la microalbúmina son fundamentales para la detección precoz de problemas renales. Más tarde, en el transcurso de la enfermedad, aparecerá la azotemia. La enfermedad renal una vez se detecta se tiene que tratar agresivamente. Si el animal todavía fabrica orina debemos aumentar el régimen de fluidoterapia vigilando que el output urinario aumenta y no hay ni aumento de peso ni aparición de edemas. La administración de hipotensores es importante para no perpetuar el daño renal, en caso de no estar azotémico el enalaprilo puede servir para este efecto. También podemos utilizar benzaprilo, amlodipino, diltiazem,… Si el paciente está oligúrico deberemos utilizar manitol y/o furosemida (mejor en infusión contínua). 15 Metabólica/Endocrina Glucosa La hipoglicemia puede ocurrir rápida e inesperadamente en un paciente críticopor lo que se debería monitorizar la glucosa cada 12 horas. Cuando el animal está hipoglicémico su tono vasomotor suele estar deprimido. El tratamiento se debe instaurar inmediatamente aunque la infusión de glucosa se realizará lentamente para no provocar un choque osmótico. Aunque se puede dar glucosa oral en los casos graves es mejor infundirla con el suero endovenoso. El desarrollo de una hipoglicemia en un paciente crítico debería hacernos considerar la posibilidad de una sepsis. Estudios en humana han demostrado que la hiperglucemia en pacientes críticos aumenta la mortalidad y morbilidad. Aunque estos estudios no se han hecho en veterinaria se aconseja mantener una glucemia entre 80-140 mg/dl. Albúmina La albúmina tiene multitud de funciones en el organismo. Algunas de las que más nos importan en el animal grave es su capacidad para transportar medicamentos y anestésicos, su control sobre la presión oncótica y su efecto antitrombótico. Tampoco debemos olvidar que es una proteína de fase aguda negativa por lo que los animales que tienen inflamaciones severas verán disminuída su albúmina drásticamente. En casos de hipoalbuminemia podemos ver edemas. El animal deberá ser sometido a una transfusión de albúmina o en su defecto a la administración de coloides de elevado peso molecular. En estos pacientes también es importante el control de la coagulación ya que están predispuestos a trombosis. Electrolitos El control electrolito de los animales hospitalizados es fundamental para una buena monitorización. La mayor parte de las alteraciones electrolíticas no provocan signos clínicos evidentes y menos cuando todavía la alteración no es drástica. Por este motivo la monitorización debe ser analítica. Cuando el paciente no tenía enfermedades previas los desequilibrios electrolíticos severos que más encontramos en la hospitalización son hipocalemia (sobre todo en gatos), hipomagnesemias e hipocalcemias, aunque otros tipos de alteraciones también se pueden dar. Ácido-base La identificación correcta de alteraciones ácido-base puede ayudar a identificar la enfermedad subyacente primaria y/o ayudar a elegir la terapia adecuada para el paciente. La posibilidad de una alteración ácido-base debe considerarse cuando la historia o la fisiopatología de la enfermedad del paciente son sugestivas de ello o bien cuando se encuentran alteraciones en el CO2 total o los electrolitos (Na+, K+, Cl-) en el perfil bioquímico. 16 El clínico debe primero considerar el pH del paciente. La evolución del pH a menudo facilita la respuesta a la cuestión de si existe o no una alteración ácido-base. Si el pH se encuentra fuera del rango de normalidad, existe una alteración ácido-base. Si el pH se encuentra dentro del rango de normalidad puede o no existir una alteración ácidobase. Si el paciente está acidémico y la concentración de HCO3- plasmático se encuentra reducida, existe una acidosis metabólica. Si el paciente está acidémico y la PaCO2 está aumentada, existe una acidosis respiratoria. Si el paciente está alcalémico y la concentración de HCO3- plasmático se encuentra aumentada, existe una alcalosis metabólica. Si el paciente tiene una alcalemia con la PaCO2 reducida, se trata de una alcalosis respiratoria. Estas relaciones se encuentran en la siguiente tabla. pH Acidemia pH Alcalemia pH PaCO2 PaCO2 HCO3- Acidosis respiratoria Acidosis metabólica Alcalosis respiratoria HCO3- Alcalosis metabólica Valores normales de gasometría venosa Perro pH 7.35 ± 0.02 PaCO2 42 ± 5 PaO2 55 ± 10 Bicarbonato 22 ± 2 TCO2 23 ± 2 Déficit de base -2 ± 2 + Anion Gap (AG). Small Animal Critical Care Medicine Silverstein and Hopper. Saunders + - - (Na +K )-(Cl +HCO3 ) Los principales cationes del líquido extracelular son el sodio, potasio, calcio y magnesio; los principales aniones son el cloruro, bicarbonato, proteínas plasmáticas, aniones ácidos orgánicos (incluyendo el lactato), fosfatos y sulfatos. La suma de los cationes que se suelen determinar (Na+, K+) excede la suma de los aniones determinados comúnmente (Cl-,HCO3-), y esta diferencia es lo que se llama Anion Gap 17 El concepto de Anion Gap suele emplearse como una ayuda para diferenciar las causas de acidosis metabólica. En las acidosis orgánicas (cetoacidosis diabética, acidosis láctica) la concentración de HCO3- debería reducirse de forma recíproca con el incremento en la concentración de aniones ácidos orgánicos, y la concentración sérica de cloruro no debería cambiar (acidosis metabólica normoclorémica). El AG en esta situación está aumentado. El AG puede ser útil en la identificación de alteraciones ácido-base mixtas. El AG se ve influenciado por hipoalbuminemias severas e hiperfosfatemias. Valores normales: SIG Perro: AG=12-24 mEq/L Gato: AG= 13-27 mEq/L Perro SIG = (Alb) x 4,9 – AG Gato SIG = (Alb) x 7,4 – AG Tiene la misma función que el AG pero no está influenciado por la Albúmina. Sí lo está por la hiperfosfatemia severas. Valores normales: Perro y Gato SIG= 0- (-5) mEq/L Bibliografía 1. The veterinary ICU book. W.E. Wingfield. M.R. Raffe. Teton NewMedia 2002 2. Small animal critical care medicine. D.C.Silverstein. K. Hopper. Saunders.2009. 3. Manual of trauma management in the dog and cat. K. J. Drobattz. M.W. Beal. R.S. Syring. Willey-Blackwell. 2011. 4. Fluid, electrolyte and acid-base disorders in small animal practice. DiBartola. Saunders Elsevier, 2006 5. Pathologic Basic of Veterinary Disease. Zachary and McGavin. 5ed. Mosby. 2011 6. Organ failure in critical illness. Veterinary clinics of North America. Vol 41. Nº 4. Julio 2011. Saunders 7. Advances in fluid, electrolyte, and acid-base disorders. Veterinary clinics of North America. Vol 38. Nº 3. Mayo 2008. Saunders 18