[A]0 / mol dm-3
Anuncio
![[A]0 / mol dm-3](http://s2.studylib.es/store/data/006155808_1-cfd959f37e28781ddf7596e63ada14f3-768x994.png)
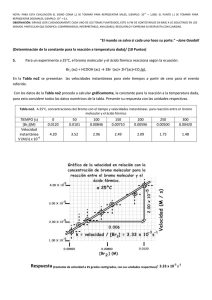
Respuestas Serie 2 (Cinética Química) Profesor: Jorge Peón Peralta 1. La reacción 2A + B → C + D se estudió experimentalmente obteniéndose los siguientes datos. [A]0 / mol dm-3 0.01 0.01 0.03 [B]0 / mol dm-3 0.02 0.08 0.02 v0/ mol dm-3s-1 2.4 × 10-6 9.6 × 10-6 7.2 × 10-6 Utilizando los datos que se te proporcionan responde a las siguientes preguntas. a) ¿Cuál es la ley experimental de velocidad de esta reacción? V= d[C]/dt = k [A][B]. Nótese que la velocidad se incrementa por exactamente el mismo factor que el incremento de la concentración de ambas especies. b) ¿Cuál es el orden total de la reacción? Orden global: 2 , orden respecto a cada reactivo: 1. c) ¿Cuál es el valor de la constante de velocidad de la reacción? (no olvidar indicar las unidades correctas) k= v/[A][B] = 0.012 M-1 s-1 d) Esquematiza el comportamiento esperado para las gráficas de [A] vs. tiempo y [B] vs. tiempo cuando las concentraciones de estas especies son iguales a t=0. ¿Qué forma funcional tienen estas curvas? Son decaimientos hiperbólicos, idénticos entre sí. e) Si realizaras un experimento en el cual la concentración de B estuviera en exceso, entonces deberías esperar que una gráfica de logaritmo de la velocidad de la reacción vs. ln[A] fuera una línea recta en donde la pendiente y la ordenada al origen corresponderían a ___-k __ y ____ ln[A]0 ______, respectivamente. f) ¿La ecuación de velocidad experimental sugiere que se trata de una reacción elemental? (Si/No). ¿Porque? No, porque la ecuación de velocidad no refleja la estequiometría de la reacción (si fuera elemental, el orden respecto a A seria 2 y el respecto a B, 1). g) Indica si alguno(s) de los siguientes mecanismos es consistente con la ecuación de velocidad experimental. Justifica tu respuesta derivando la ecuación de velocidad para cada uno de los mecanismos que se te proporcionan. El producto que define la velocidad de reacción es C. i. k1 2A → I k2 I+B→C+D donde k2 >> k1 considera tanto la aproximación del paso lento como la aproximación del estado estacionário. ii. k1 A+B→I +D k2 I→ C donde k1 << k2, considera tanto la aproximación del paso lento como la aproximación del estado estacionário. 1 iii. 2A k→ I+D para k1 >> k2 k2 C I+B→ k1 iv. A + B ⇄ I k-1 para k-1 y k-1 >> k2 k2 D+ I→C v. k1 A+B⇄ k-1 I k2 I→C vi. A ⇄ I1 k-1 k2 para k-1 y k-1 >> k2 I1 + B → I2 + D k3 I2 + E → C Asume que k3 es mucho mayor que todas demás constantes y aplicar la aproximación respectiva del paso lento. Además: considerar k1 y k-1 >> k2. 2. Para el siguiente esquema de reacción : k1 A → P1 k2 A → P2 Indica cuál es la relación entre k1 y k2 (es decir, el valor de k1 / k2) en las reacciones indicadas en las siguientes gráficas. Brevemente justifica tu respuesta. 1 P2 0.9 1 1 0.9 0.9 0.8 0.8 0.7 0.7 0.6 0.6 0.5 0.5 0.4 0.4 A 0.3 0.2 P1 0.1 0 0 20 40 60 80 100 A P1 0.8 P1 0.7 0.6 0.5 P2 0.3 0.2 0.2 0.1 0.1 0 0 0 20 40 60 A 0.4 0.3 80 100 P2 0 20 40 60 80 Recuerda que para este esquema el cambio en la concentración de [P1] y [P2] en función del tiempo, está dado por las siguientes ecuaciones. k1 [ P1 ] [ A]0 1 e ( k1 k 2 )t k1 k 2 [ P2 ] k2 [ A]0 1 e ( k1 k 2 )t k1 k 2 Respuesta de [P1]/[P2] = k1/k2 (que se puede observar de las ecuaciones): 1er grafico: k1/k2 = 0.1/0.9 = 0.111 2º grafico: k1/k2= 0.66 / 0.33 = 2 3er gráfico: k1/k2= 0.9 / 0.1 = 9 100 3. Considera el siguiente mecanismo de reacción con pasos auto-catalíticos. A + B => 2 A con constante de velocidad k1 B + C => 2 C con constante de velocidad k2 C + A => P con constante de velocidad k3 Escribe las expresiones para las derivadas temporales de la concentración de todas las especies. Respuesta 4. Considere el reactivo A que da origen a una mezcla de productos P1 y P2 en reacciones paralelas con: k1 1.40x10 -3 s -1 y k 2 8.7x10 -3 s -1 tres concentraciones para un experimento con A0 3.7 x10 4 . Calcule las M cuando: a. t 80 s b. At P1 t c. Se ha formado la mitad de la cantidad final de P2. Respuesta a. t 80 s At 80 A0 exp k1 k 2 t At 80 3.7 x10 4 M exp 1.40x10 -3 s -1 8.7x10 -3 s -1 80 s At 80 1.6 x10 4 M P1 t 80 k1 A0 1 exp k1 k 2 t k1 k 2 P1 t 80 1.40x10 -3 s -1 * 3.7 x10 4 M 1 exp 1.40x10 -3 s -1 8.7x10 -3 s -1 80 s -3 -1 -3 -1 1.40x10 s 8.7x10 s P1 t 80 2.8x10 3 M P2 t 80 k2 A0 1 exp k1 k 2 t k1 k 2 P2 t 80 8.7x10 -3 s -1 * 3.7 x10 4 M 1 exp 1.40x10 -3 s -1 8.7x10 -3 s -1 80 s 1.40x10 -3 s -1 8.7x10 -3 s -1 P2 t 80 1.8 x10 4 M b. At P1 t A0 exp k1 k 2 t k1 A0 1 exp k1 k 2 t k1 k 2 exp k1 k 2 t k1 k1 exp k1 k 2 t k1 k 2 k1 k 2 exp k1 k 2 t k1 k1 exp k1 k 2 t k1 k 2 k1 k 2 k1 exp k1 k 2 t 1 k1 k 2 exp k1 k 2 k1 k1 k 2 k1 2k1 k 2 k1 k1 k 2 t ln 2 k1 k 2 k1 ln 2k1 k 2 t k1 k 2 1.40x10 -3 s -1 ln -3 -1 -3 -1 2 1.40x10 s 8.7x10 s t 1.40x10 -3 s -1 8.7x10 -3 s -1 t 208.5 s At 208.5 A0 exp k1 k 2 t At 208.5 3.7 x10 4 M exp 1.40x10 -3 s -1 8.7x10 -3 s -1 208.5 s At 208.5 4.5x10 5 M P1 t 208.5 k1 A0 1 exp k1 k 2 t k1 k 2 P1 t 208.5 1.40x10 -3 s -1 * 3.7 x10 4 M 1 exp 1.40x10 -3 s -1 8.7x10 -3 s -1 208.5 s -3 -1 -3 -1 1.40x10 s 8.7x10 s P1 t 208.5 4.5 x10 5 M P2 t 208.5 k2 A0 1 exp k1 k 2 t k1 k 2 P2 t 208.5 8.7x10 -3 s -1 * 3.7 x10 4 M 1 exp 1.40x10 -3 s -1 8.7x10 -3 s -1 208.5 s -3 -1 -3 -1 1.40x10 s 8.7x10 s P2 t 208..5 2.8 x10 4 M c. Se ha formado la mitad de la cantidad final de P2. P2 t k2 A0 1 exp k1 k 2 t k1 k 2 a tiempo infinito se tiene la concentración final de P2 k2 A0 k1 k 2 P2 t P2 t 8.7x10 -3 s -1 * 3.7 x10 4 M 3.2 x10 4 M -3 -1 -3 -1 1.40x10 s 8.7x10 s A tiempo infinito se ha formado 3.2x10-4 M concentración de P2 es 1.6 x10-4 M. P2 t . Entonces la mitad de la k2 A0 1 exp k1 k 2 t al despejar el tiempo se obtiene: k1 k 2 P k k 2 ln1 2 t 1 A k 0 2 t k1 k 2 1.6x10 -4 s -1 1.40x10 -3 s -1 8.7x10 -3 s -1 ln1 3.7 x10 4 Mx8.7x10 -3 s -1 t 1.40x10 -3 s -1 8.7x10 -3 s -1 t 68.6 s At 68.6 A0 exp k1 k 2 t At 68.6 3.7 x10 4 M exp 1.40x10 -3 s -1 8.7x10 -3 s -1 68.6 s At 68.6 1.9 x10 4 M P1 t 68,6 k1 A0 1 exp k1 k 2 t k1 k 2 P1 t 68.6 1.40x10 -3 s -1 * 3.7 x10 4 M 1 exp 1.40x10 -3 s -1 8.7x10 -3 s -1 68.6 s 1.40x10 -3 s -1 8.7x10 -3 s -1 P1 t 68.6 2.5 x10 5 M P2 t 68.6 k2 A0 1 exp k1 k 2 t k1 k 2 P2 t 68.6 8.7x10 -3 s -1 * 3.7 x10 4 M 1 exp 1.40x10 -3 s -1 8.7x10 -3 s -1 68.6 s -3 -1 -3 -1 1.40x10 s 8.7x10 s P2 t 68.6 1.6 x10 4 M 2 I C 5. Para la reacción A B k1 k k 1 Muestre que en ciertas condiciones (indicar lo que es kobs): d C k obs AB dt d[C]/dt = k2[I], con I en equilibrio con A + B : [I] = Keq [A][B] Substituyendo en d[C]/dt d[C]/dt = k2Keq[A][B]. kobservada= k2*Keq = k2*k1/k-1 esto se observaría sí k1 y k-1 son mucho mayores que k2 ya que con esto, el intermediario I se mantiene todo el tiempo en equilibrio con A + B. Es decir, aunque se vaya consumiendo I, el equilibrio es tan rápido que siempre se recupera la relación : Keq = [I] / [A][B] 6. Considere la reacción de descomposición de N2O5: obs 2 N 2 O5 k 4 NO2 O2 Experimentalmente se encontró que la ley de velocidad para esta reacción es: d O2 k obs N 2 O5 dt Para la reacción anterior se propone el siguiente mecanismo: k1 NO2 NO3 N 2O5 k 1 k2 NO2 NO3 NO NO2 O2 k3 NO3 NO 2 NO2 Demuestre que este mecanismo es consistente con la ley de velocidad. Considere la aproximación del estado estacionario tanto para NO como para NO3 . Indique a qué equivale la kobservada. Aplicando la aproximación del estado estacionario para NO d NO k 2 NO2 NO3 k 3 NO NO3 0 dt k 2 NO2 NO3 k 3 NONO3 NO k 2 NO2 k3 Aplicando la aproximación del estado estacionario para NO3 d NO3 k1 N 2 O5 k 1 NO2 NO3 k 2 NO2 NO3 k 3 NO NO3 0 dt NO3 k1 N 2 O5 NO k 2 NO2 k 1 NO2 k 2 NO2 k 3 NO Sustituir k3 Se obtiene: NO3 k1 N 2 O5 k 1 NO2 k 2 NO2 d O2 k 2 NO2 NO3 dt Sustituyendo NO3 se obtiene: d O2 k1 k 2 N O k 1 2k 2 2 5 dt k obs k1 k 2 k 1 2k 2 k2 k 3 NO2 k3 k1 N 2 O5 k 1 NO2 k 2 NO2 k 2 NO2 7. La ley de velocidad para la reacción descrita por: obs 2H 2 2 NO k N 2 2H 2 O Es: d N 2 2 k obs H 2 NO dt Demuestre que el siguiente mecanismo es consistente con la ley de velocidad. k1 N 2O2 NO NO k 1 k2 H 2 N 2O2 N 2O H 2O k3 H 2 N 2O N 2 H 2O Considere la aproximación del estado estacionario para el N2O y la aproximación de un equilibrio previo entre el N2O2 y el NO (1ª reacción). Respuesta d N 2 k 3 H 2 N 2 O dt Aplicando la aproximación del estado estacionario d N 2 O k 2 H 2 N 2 O2 k 3 H 2 N 2 O 0 dt k 2 H 2 N 2 O2 k 3 H 2 N 2 O N 2 O k 2 N 2 O2 k3 Aplicando la aproximación del pre-equilibrio K equil N 2 O2 NO2 N 2 O2 N 2 O2 K equi NO2 reemplazando k 2 en N 2 O k N 2 O2 3 Se obtiene: N 2 O k 2 K equi NO2 k3 reemplazando N 2 O en d N 2 k 3 H 2 N 2 O dt d N 2 2 k 2 K equi H 2 NO dt k obs k 2 K equi 8. Muestre que el siguiente mecanismo para la reacción obs 2 NO Br2 k 2 NOBr Es consistente con la ley de velocidad observada experimentalmente: d NOBr 2 k obs NO Br2 dt Mecanismo k1 N 2O2 NO NO k 1 Equilibrio previo k2 N 2O2 Br2 2 NOBr Lenta Respuesta Aplicando la aproximación del pre-equilibrio: K equil N 2 O2 NO2 N 2 O2 N 2 O2 K equi NO2 reemplazando Se obtiene d NOBr 2 2k 2 K equi NO Br2 dt k obs 2k 2 K equi en d NOBr 2k 2 N 2 O2 Br2 dt 9. Verifique si cada uno de los siguientes mecanismos es consistente con la ley de velocidad observada: d NO2 2 k obs NO O2 dt N 2O2 a. 2 NO k1 k1 N 2O2 O2 2 NO2 k2 Equilibrio Lenta Respuesta (a) d NO2 2k 2 N 2 O2 O2 dt Aplicando la aproximación del pre-equilibrio: K equil N 2 O2 NO2 N 2 O2 N 2 O2 K equi NO2 reemplazando d NO2 2 2k 2 K equi NO O2 dt k obs 2k 2 K equi NO3 b. NO O2 k1 k 1 NO3 NO 2 NO2 k2 Equilibrio Lenta Respuesta (b) d NO2 2k 2 NO3 NO dt Aplicando la aproximación del pre-equilibrio: K equil NO3 NOO2 en d NO2 2k 2 N 2 O2 O2 dt NO3 NO3 k equi NO O2 reemplazando en d NO2 2k 2 NO3 NO dt d NO2 2 2k 2 k equi NO O2 dt k obs 2k 2 k equi 1 2 NO2 Elemental c. 2 NO O2 k Respuesta (c) d NO2 2 2k1 NO O2 dt k obs 2k1 8. La reacción entre dióxido de nitrógeno y monóxido de carbono, NO2(g) + CO(g) → NO(g) + CO2(g), ocurre de acuerdo al siguiente mecanismo de reacción donde se puede aplicar la aproximación del paso lento: 2 NO2(g) → NO3(g) + NO(g) lento con k1 NO3(g) + CO(g) → NO2(g) + CO2(g) rápido con k2 a) Expresa la velocidad de aparición (o desaparición) de cada especie (es decir, la derivada temporal de la concentración de cada especie en función de la concentración de las demás especies). b) Escribe de nuevo estas expresiones en términos de la presión parcial de cada especie como función de las presiones parciales de las demás especies. c) ¿Cuál será la ecuación de velocidad experimental que deberías encontrar si se aplica la aproximación del paso lento? Expresa tu respuesta tanto como una dependencia de las concentraciones como de las presiones parciales. Respuesta