FISIOLOGIA y FISIOPATOLOGIA LINFATICA.
Anuncio

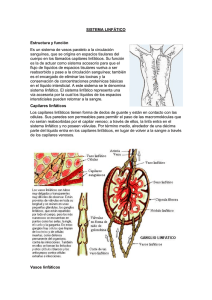
FISIOLOGIA y FISIOPATOLOGIA LINFATICA. JUAN CARLOS KRAPP Dr. En Medicina Presidente Sociedad Argentina de Flebologia y Linfologia. Servicio de Flebología - Hospital Militar Central Virrey del Pino 2428 2do “14” ( 1428) Ciudad de Buenos Aires [email protected] Fisiología. Para lograr un concepto racional sobre fisiología y fisiopatología linfática, metodología de estudio y posibilidades terapéuticas en el linfedema, es necesario tener un conocimiento completo de los componentes que conforman el sistema linfático. Para imaginarnos el sistema linfático, debemos pensar en "Unidad Circulatoria Funcional" o "Histangion", que está integrado por la conjunción de un capilar arterial, un capilar venoso, linfáticos iniciales y el interticio. Es a este nivel donde se realizan todos los procesos de la micro circulación. Los elementos más pequeños de este sistema, son los Linfáticos Iniciales , estos se encuentran inmersos en el espacio interticial . El líquido y las proteínas filtradas al mismo llega a ellos a través de los canales prelinfáticos . Los linfáticos iniciales son muy similares al sector venoso de la micro circulación sanguínea, esencialmente la única diferencia real entre los linfáticos iniciales y los capilares venosos, es que los primeros tienen uniones disponibles para ser abiertas. Están constituidos por una sola capa de células endoteliales planas unidas entre si y a los tejidos por delgadas fibrillas ( elementos de sostén) y su longitud es de 0,5mm. La especial disposición de las células planas favorece el llenado o vaciamiento a través de las uniones intercelulares y este mecanismo se encuentra facilitado por la contracción de las bandas de fijación, las que reaccionan a los cambios hísticos de presión ( presión tisular total ) y a los cambios endolinfáticos. Las células están unidas entre si por "uniones abiertas" y "uniones cerradas o estrechas". El primer tipo de uniones permite la entrada de macromoléculas, células y agua, mientras que las uniones cerradas, solamente permiten el paso de iones y agua. Existe un tercer mecanismo de ingreso a la luz endolinfática que es la entrada de moléculas en forma de vesículas a través de la pared celular. Estas pueden agruparse entre si y formar lo que Casley-Smith llama Sinfósomas. Las vesículas , pasan a través de la pared celular cuando la presión es positiva y los vasos linfáticos están actuando como conductores. La capacidad de las uniones intercelulares para poder ser abiertas está facilitada por: 1 la falta relativa de dispositivos de adhesión entre las células endoteliales, la tenue membrana de base y por la adhesión de fibrillas a los exteriores de los endotelios. La apertura y el cierre de las uniones que forman el capilar inicial, está influido por la presión tisular total, y los cambios de Ph producidos en el intersticio. Estas aperturas intercelulares varían desde 30 micrones a varios cientos de ellos. Los capilares linfáticos iniciales, una vez constituidos se anastomosan entre si formando redes periféricas de origen, las que a su vez originan pequeños vasos más estructurados llamados por Cordeiro precolectores, los que están constituidos por una pared más espesa, con un endotelio y una capa de fibras musculares y elásticas difusas. Los precolectores, son pequeños segmentos vasculares que unen las redes linfáticas iniciales o periféricas a los "vasos colectores". Estos elementos de estructura parietal completa integrada por tres capas, íntima, media y adventicia, poseen repliegues valvulares que orientan la circulación linfática en forma centrípeta. Estos serán prenodales o postnodales y se encuentran topográficamente acompañando a los vasos sanguíneos dando formación a las corrientes linfáticas que llegarán a los colectores terminales evacuando su contenido al torrente venoso. Figura 1 Microanatomía Linfática – Linfático Inicial – Intercambio de elementos con el insterticio. 1234567- Uniones Cerradas – Ingreso de agua y iones Uniones Abiertas - Ingreso de Proteinas y Celulas Vesículas. Sinfosomas. Ingreso de gases a traves de la membrana. Fibras o bandas de fijación. Células de sostén. 2 Figura 2 Microanatomia Linfática – Formación de las redes y corrientes linfáticas 1- Linfático Inicial. 2. Red Periferica. 3. Precolectores. 4. Colectores. 5. Ganglio Linfático . 6. Canales Prelinfáticos. 7. Espacio Intersticial. La principal función del sistema linfático es reabsorber, evacuar, y devolver a la circulación sanguínea, aquellos cuerpos plasmáticos que en forma continua abandonan los capilares sanguíneos. Secundariamente en los individuos normales, otra de las funciones es el transporte de líquidos, función que pasa a tener relevante importancia en los estados patológicos, ya que este sistema actúa como una válvula de seguridad, evacuando el exceso de líquidos que ingresan al intersticio. La Producción de linfa comienza en el linfático inicial . La particular disposición de las células planas que lo forman, favorece el llenado o vaciamiento de los mismos a través de las uniones intercelulares. La infiltración acuosa del intersticio, tiende a abrir la luz linfática por la tensión de las fibrillas, facilitando así la reabsorción de los líquidos y macromoléculas proteicas. Este mecanismo es facilitado por las bandas de fijación, que reaccionan a los cambios de presión a nivel hístico y endolinfático. Estas bandas son delgados filamentos que van desde la célula endotelial linfática a las fibras colágenas adyacentes. Cordeiro-Baracat sostienen que la contracción y relajación de estas bandas estaría regulada por los metabolitos y el Ph resultante de las transformaciones químicas de sustancias llevadas por la circulación arterial El Procedimiento Mecánico de la formación de la linfa es explicado por Casley-Smith quién describió "la bomba de fuerza linfática", que lleva su nombre. Dicha bomba de tipo mecánico y funcional, consta de tres fases con una importante participación de las fibrillas o bandas de fijación que permiten la apertura y cierre de las uniones celulares. Estas miofibrillas serían de dos clases: de 50 A y de 100 A de longitud. 3 En el primer estadio o fase I de la bomba, se efectúa el llenado, este se produce cuando las fibrillas de 100 A se relajan y se abren las células del capilar linfático por contracción sinérgica de las de 50 A. En ese momento en el intersticio hay más presión coloideosmótica que en el linfático y de esta forma entra la macromolécula y por osmosis arrastra agua hasta que la presión coloideosmótica en el capilar linfático supera a la del intersticio. En este momento las células del capilar se cierran por una acción inversa de las miofibrillas (las de 100 A se contraen y las de 50 A se relajan) y por difusión sale agua hacia el intersticio hasta que se igualan las presiones en ambos compartimientos. En este momento se pasa a la fase II o de equilibrio. A partir de aquí comienza la fase III, ésta, es cuando el linfático se contrae y la linfa pasa al linfangión superior produciendo el vaciado del anterior. Todo este mecanismo de formación de la linfa está condicionado al intercambio de líquidos y proteínas que sucede entre los capilares y el intersticio. De acuerdo a los conceptos de Starling, la presión hidrostática en el capilar arteriolar es mayor que la presión osmótica permitiendo la salida de elementos a su través ( filtración) y en el capilar venoso se equilibran las fuerzas disminuyendo la presión hidrostática (de 32 mm de Hg a 12 ), persistiendo la presión osmótica ( 25 mm de Hg ) por lo que se establece lo que se considera una fuerza de reabsorción. La filtración efectiva corresponde a la que se realiza a través del sistema linfático, que normalmente absorbe lo que no puede recuperarse por el capilar venoso. En siglas y conceptos modernos y condiciones normales esta se expresa por la siguiente ecuación enunciada por White : K ( Pc -Pt) - (IIp-IIt) ( 35 – 5 ) -( 26 – 1) 30 - 25 =+-5 K Coeficiente de filtración. + Pc Presión Hidrostática del capilar. Pt Presión Hidrostática de los tejidos. Iip Pres. Oncot. Plasmat. Iit Pres. Oncot. Tejidos. 5 35 5 26 1 La linfa así producida, inicia su transporte por medio de un bombeo progresivo en el que intervienen las válvulas endolinfáticas. Estas delimitan entre una y otra un sector llamado Linfangión y la acción de las mismas impiden el reflujo, siendo esta la fuerza motora más importante para transportar la linfa. La contracción o pulsación activa del Linfangión, ocurre con una frecuencia de 6 a 12 veces por minuto, comportándose como un corazón periférico. Este sector posee en su 4 pared fibras musculares e inervación simpática, lo que le permite tener actividad propia. Otros factores adyuvantes para la progresión linfática son, la contracción de los músculos vecinos, los movimientos respiratorios y las pulsaciones arteriales. Estos actúan por compresión de la pared vascular linfática. Son factores de progresión también las variaciones de presión externas como los cambios de posturas y/o los masajes. En lo que respecta a la "formación" de la linfa, es importante recordar la ecuación que dice; "Cuando hay mayor formación que reabsorción se produce el Edema". Se denomina Carga Proteica con Función Linfática o Lynphatic Load, a aquella cantidad de proteínas que han de ser evacuadas por el sistema linfático en la unidad de tiempo. Según estudios efectuados por Foldi, este transporte de proteínas desde el intersticio a la corriente sanguínea es de aproximadamente 100 gs en 24 horas. La cantidad de linfa transportada a través del conducto torácico en un día, es de alrededor de 2000 cc, pero el volumen efectivo reabsorbido es mayor, ya que no todo el líquido que ingresa a través de los capilares linfáticos, vasos y ganglios, van a desembocar al confluente yugulosubclavio. En el trayecto recorrido, parte de este líquido se reabsorbe por vía sanguínea a través de las comunicaciones venosas existentes en los ganglios. La concentración proteica en la linfa periférica es de 1,5 gr/100 ml, de 3,5 gr/100 ml en el hígado y de 3-4 gr/100 ml en el conducto torácico. Tratándose de los miembros, la cantidad de linfa que es reabsorbida por el sistema linfático en condiciones normales es sumamente pequeña en relación a los 1500 a 2000 ml que diariamente se vuelcan en el torrente sanguíneo. Fisiopatologia. Cuando nos encontramos con una deficiencia en el sistema linfático, es decir ante una determinada patología linfática , la carga proteica con función linfática es normal, pero el sistema linfático no esta en condiciones de reabsorber y evacuar las proteinas que se filtran ininterrumpidamente de los capilares sanguíneos. Posteriormente al tratamiento quirúrgico del Ca. de mama, en el que se haya efectuado mastectomía radical ú otra técnica, ó alguna otra patología que incluya vaciamiento axilar, con sección de vasos linfáticos superficiales y profundos, se produce una reducción del flujo linfático del miembro correspondiente en una cantidad que oscila entre el 40 al 60 %. La posibilidad que despues de esta intervención haya pacientes que no desarrollen linfedema a corto ó largo plazo, más alla de la linfostasis latente, que en todos se encuentra presente, a dado pie a teorías sobre mecanismos de compensación que vamos a analizar. 5 1- Regeneración del sistema linfático. Trabajos experimentales sobre la capacidad de Regeneración que posee el sistema linfático han sido tema de estudio y publicación desde hace muchos años. En 1926, Reichert y más tarde Howard y Danese en 1964 , comprobaron la regeneración del tejido linfático. Este estudio experimental consistió en la sección total de las partes blandas de la pata de un perro a excepción de la arteria, vena y nervio, suturando luego por planos. El seguimiento posterior realizado entre 2 días y 14 meses, demostró regeneración linfática superficial a los 4 días y profunda a los 8. En los exámenes posteriores , se pudo demostrar la unión de los colectores principales y en algunos casos sin evidencia del corte. Clínicamente el edema distal a la sección, comenzó el 2do día, alcanzando su máxima expresión al 4to y desapareciendo al 8vo día. Gray , en 1940 , luego de cortar segmentos de linfático mayores, notó que los estímulos para la regeneración, son la sección y/o el aumento de la presión linfática. Se originan así pequeñas prolongaciones ( brotes o gemación ) cuya extensión puede estar condicionada por el tejido cicatrizal postoperatorio y por la unión con otros vasos.En su trabajo estudió los pedículos y colgajos observando el aumento del tamaño y alteración de los vasos más pequeños a medida que se iban adaptando a las nuevas condiciones de la presión endolinfática. Como conclusión, indica que los vasos existentes, son la única fuente potencial para el desarrollo de más linfáticos y que los vasos colaterales, no tienen la capacidad funcional postregenerativa de los troncos mayores. Figura 3 Esquema de J. H. Gray – Estudio Experimental de Reneneración Linfática. 1) Seccion directa: anastomosis por brotes de terminal a terminal. 2) Doble sección de un segmento en forma directa: reparación iguan al anterior. 3 y 4) Restauración por medio de un colgajo pediculado conteniéndo linfáticos. El crecimiento de los brotes linfáticos se realiza hacia los troncos linfáticos aproximados. 5) Falta de un segmento linfatico: Restauración por capilaridad entre los terminales y linfaticos adyacentes. 6 2)Teorías de Foldi. a) Mecanismo de Respuesta Celular : Este procedimiento consiste en que ante la presencia de un edema rico en proteínas, se produce un aumento en la afluencia de Mastocitos al lugar los que abandonan los capilares sanguíneos llegando al intersticio y transformándose en macrófagos,absorben las plasmoproteinas mediante micropinocitosis. Este mecanismo se encontraría alterado cuando el edema se hace crónico, disminuyendo esta capacidad de respuesta celular. b) Restablecimiento del drenaje por Circulación Colateral : El drenaje podría compensarse inicialmente por restablecimiento de circulación colateral, hecho discutido, por no haberse demostrado fehacientemente y solo se presume como explicación hacia la compensación inicial, según Foldi podría concretarse de tres formas: Crecimiento de nuevas vías desde las zonas bloqueadas con establecimientos de uniones linfovenosas. Anastomosis de vías linfolinfáticas, a partir de la apertura de vías preexistentes no funcionantes en estado normal y que a partir del establecimiento de la hipertensión endolinfática se hipertrofiarían y cumplirían esta misión. Existencia de Comunicaciones Linfovenosas Funcionantes que incrementan su actividad. 3) Existencia de corrientes derivativas o compensatorias del Miembro Superior sin estación ganglionar axilar: La corriente Cefálica, que se encuentra en un 80% de casos conformada en la mayoría de los casos por 1 o 2 vasos. La corriente Escapular Posterior, presente en un 30% ( Ciucci ) a 70% de los casos (Caplan). La corriente Radio-Húmero-Cervical, encontrada en el 2% de casos, está formada por 1 solo vaso linfático.(Ciucci ) De acuerdo a los trabajos de investigación anatómica realizados por Ciucci y Caplan, la existencia de estas 3 vías de drenaje linfático sin estación ganglionar, aunque no son constantes en elevado número de pacientes, podrían compensar de alguna manera por un tiempo el drenaje linfático del brazo. Esto sería una variación, estrictamente individual en cada paciente y explicaría el porqué del desarrollo de linfedema en algunos pacientes y en otros solamente se encuentra limitado a un pequeño aumento del volumen del brazo. 7 8