Guía de Repaso 19: Sólidos líquidos y gases
Anuncio

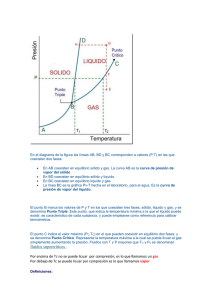
Termodinámica y Máquinas Térmicas Prof. Faber ______________________________________________________________________ Guía de Repaso 19: Sólidos líquidos y gases 1- a) ¿Cuáles son las magnitudes que determinan la fase en la cual se presenta una sustancia? b) Cite dos formas de hacer que un líquido pase al estado gaseoso. 2- La figura de este ejercicio representa las estructuras internas de dos sustancias solidas, A y B. a) ¿Cuál se presenta en forma de cristal? b) ¿Cómo se denomina la estructura de la sustancia B? c) ¿Cuál de los dos podría ser la del vidrio? A B 3- a) ¿Por qué un sólido presenta una forma propia y no sucede lo mismo con los líquidos? b) ¿Qué sucede con la estructura de un sólido cristalino cuando pasa al estado líquido? c) ¿Por qué un gas tiende a ocupar todo el volumen del recipiente que lo contiene, mientras que eso no sucede con un líquido? 4- Dé el nombre del cambio de fase que se produce en cada uno de los fenómenos que se describen a continuación: a) Un pedazo de hielo se derrite al sacarlo del congelador. b) La ropa mojada se seca cuando se pone al sol. c) Un trozo de naftalina “desaparece” en el interior de un armario d) La superficie externa de una botella de cerveza muy fría, se cubre de gotitas de agua en los días húmedos. 5- Explique cuales son las similitudes y diferencias entre el diamante y el grafito. Dibuje sus estructuras cristalinas. Termodinámica y Máquinas Térmicas Prof. Faber ______________________________________________________________________ Guía de Repaso 20: Fusión y Solidificación 1- Una moneda de plata posee una masa de 100 g. Consultando la tabla responda: a) Al calentar la moneda ¿a qué temperatura empezará a fundirse? b) Si al alcanzar dicha temperatura el suministro de calor se interrumpe, ¿se fundirá la moneda? Explique. 2- Considere la misma moneda del ejercicio anterior. a) Al llegar al punto de fusión, ¿cuál es la mínima cantidad de calor que debe cederse a la moneda para que se funda por completo? b) Mientras que la moneda recibe calor durante la fusión ¿qué le sucede a su temperatura? c) Inmediatamente después de suministrar el calor calculado en a) ¿cuál será la temperatura de la plata líquida resultante de la fusión? 3- Un trozo o terrón de azufre, de masa igual a 200g. Se encuentra a una temperatura de 119 °C. Consulte la tabla y responda: a) Si suministramos 650 cal a esta porción ¿qué masa de azufre se fundirá? b) Entonces ¿cuál será la temperatura final del azufre sólido? ¿Y la del líquido? ¿Por qué? 4- a) En el ejercicio anterior ¿cuál es la mínima catidad de calor que deberíamos proporcionar para fundir totalmente el trozo de azufre? b) Si hubiéramos suministrado 3.000 cal a dicha porción, ¿la temperatura final del azufre sería mayor o igual a 119°C? Explique. 5- Un recipiente refractario que contiene 10 g. de platino líquido, es sacado de un horno a 2.000 °C, y puesto en contacto con aire ambiente cuya temperatura es de 25 °C por lo cual empieza a perder calor. a) ¿A qué temperatura empezará a solidificarse el platino? b) Mientras cambia al estado sólido, ¿su temperatura aumenta, disminuye o es igual? c) Durante su solidificación ¿sigue cediendo calor al ambiente? 6- Considerando el platino mencionado en el ejercicio anterior: a) ¿Qué cantidad de calor libera hacia el medio ambiente durante el proceso de solidificación? b) ¿Cuál es la temperatura del platino sólido en el instante en que termina la solidificación? c) Después de cierto tiempo, ¿cuál será la temperatura final del platino? ¿Por qué? Puntos de fusión y calores latentes a 1 atmósfera de presión Sustancia Punto de fusión (°C) Calor Latente (cal/g) Platino 1775 27 Plata 961 21 Plomo 327 5,8 Azufre 119 13 Agua 0 80 Mercurio -39 2,8 Alcohol etílico -115 25 Nitrógeno -210 6,1 Termodinámica y Máquinas Térmicas Prof. Faber ______________________________________________________________________ Guía de Repaso 21: Vaporización y condensación 1- Como se sabe, uno acostumbra a soplar sobre la superficie de un líquido caliente para que se enfríe más rápido. a) Al hacer esto ¿qué sucede con la rapidéz de evaporación del líquido? b) Explique entonces, por que al proceder de esta manera logramos hacer que el líquido se enfríe mas pronto. 2- Cierto volúmen de éter se halla contenido en un frasco abierto, de cuello estrecho. Un volúmen igual de este líquido es derramado en una superficie lisa y horizontal, extendiéndose sobre ella. ¿En cual de los dos casos el líquido se secará más pronto? Explique. 3- Cierta cantidad de Hg, es calentada por medio de una flama. Consulte la tabla y responda: a) ¿A qué temperatura entrará en ebullición el Hg? b) Al seguir suministrando calor al Hg, ¿qué pasa con su temperatura mientras se encuentra en ebullición? c) Se observa que fue necesario suministrar 3,9 x 10 4 cal durante la ebullición, para vaporiza totalmente el Hg. Calcule, entonces, el valor de la masa de este líquido. d) Inmediatamente después de proporcionar al líquido el calor mencionado en c), ¿cuál será la temperatura del vapor de Hg resultante de la vaporización? 4- a) Es común observar que en los días lluviosos, cuando dentro de un automóvil cerramos las ventanillas, los cristales se empañan. Explique. b) Para desempañar el parabrisas algunos automóviles cuentan con un ventilador desempañante. Explique porque resulta eficaz este procedimiento. 5) Una masa de 100 g de alcohol etílico se encuentra en estado sólido a una temperatura de -115 °C. Se sabe que el calor específico del alcohol, cuando está en fase líquida, tiene un valor de 0,5 cal/g.°C. Consultando las tablas de esta guía y de la anterior, calcule la menor cantidad de calor que debe sumnistrarse al alcohol sólido para transformarlo totalmente en vapor. (Orientarse con el ejemplo de la teoría). Puntos de ebullición y calores de vaporización a 1 atmósfera de presión Sustancia Punto de ebullición (°C) Calor de vaporización (cal/g) Mercurio 357 65 Yodo 184 24 Agua 100 540 Alcohol etílico 78 204 Bromo 59 44 Nitrógeno -196 48 Helio -269 6 Termodinámica y Máquinas Térmicas Prof. Faber ______________________________________________________________________ Guía de Repaso 22: Influencia de la Presión en los Cambios de Fase 1- Se sabe que el hierro, como la mayoría de las sustancias, tiene un comportamiento característico. Con esta información, responda: a) Una barra de hierro ¿aumenta o disminuye su volúmen al fundirse? b) Entonces, ¿el hierrro líquido, tiene una densidad mayor o menor que la del mismo metal en estado sólido? c) Así, una barra de hierro sólido ¿se hunde o flota al colocarla en el hierro líquido? 2- El punto de fusión del hierro es de 1.535 °C a un presión de una atmósfera. Al calentar una barra de este metal, que está sometida a una presión de 500 atmósferas ¿se fundirá por arriba o por debajo de los 1.535 °C? 3-a) Algunas rocas mustran grietas o porosidades que permiten la infiltración del agua. En las regiones de clima muy frío, se observa que dichas rocas, en el invierno, se fragmantan en varias partes. Explique por qué sucede esto. b) Tomando en cuenta la respuesta del inciso anterior, ¿puede concluir que la densidad del hielo es menor o mayor que la del agua? c) Entonces comprendería por qué los icebergs flotan en el mar? 4-a) En su ciudad, ¿la presión atmosférica es mayor, menor o igual a 76 cmHg? b) Entonces, el punto de fusión del hielo, ¿es mayor, menor o igual a 0°C? 5-a) En la tabla de la guía de fusión y solidificación, se informa que el alcohol entra en ebullición 78 °C. ¿Será posible calentar cierta cantidad de alcohol hasta 100 °C sin que entre en ebullición?¿Cómo? b) Se observa que en cierta ciudad el agua colocada en una olla abierta entra en ebullición a 95 °C. Consultando la tabla de esta guía, diga la altitud de esta ciudad. Puntos de ebullición del agua a diversas altitudes Altitud (m) Presión atmosférica (cmHg) Punto de ebullición del agua (°C) 0 76 100 500 72 98 1000 67 97 1500 64 95 2000 60 93 2500 56 92 9000 24 70 Termodinámica y Máquinas Térmicas Prof. Faber ______________________________________________________________________ Guía de Repaso 23: Sublimación, diagrama de fases Todos los ejercicios se refieren al diagrama de fases del CO2, que corresponde a la figura del gráfico (no está trazado a escala uniforme) 1- a) Si el CO2 estuviera sometido a una presión de 50 atm y a una temperatura de -80°C, ¿en qué fase se encuentra? b) Cierta masa de CO2, en las mismas condiciones de temperatura y de presión que su salón de clases (aproximadamente 1 atm y 20°C), ¿en qué fase se hallará? 2- a) Un tanque contiene CO2 líquido, a una presión de 56 atm. Al calentarlo y manteniendo constante la presión que se ejerce sobre él, ¿a qué temperatura empezará a vaporizarse el CO2? b) ¿A qué presión y temperatura debemos someter al CO2 para que sea posible encontrarlo simultáneamente en las tres fases? 3- a) Considere un trozo de hielo seco a una presión de 3 atm. Manteniendo constante esta presión y calentando dicho trozo, cambiará de fase al llegar a cierta temperatura. ¿Cuál será este cambio de fase? b) Para que al calentarlo se produzca la fusión de un trozo de hielo seco ¿qué condición debe satisfacer la presión a la cual está sometido? 4 Un recipiente contiene una mezcla de CO2 en los estados sólido, líquido y gaseoso, con los tres en equilibrio. a) La temperatura se maniene constante y se aumenta la presión ejercida sobre la mezcla. ¿En que fase, entonces, se presentará toda la masa de CO 2? b) Responda a la pregunta anterior suponiendo que la presión se mantiene constante y aumenta la temperatura. c) ¿Qué debería hacerce para que el CO2 pase totalmente al estado líquido? Termodinámica y Máquinas Térmicas Prof. Faber ______________________________________________________________________ Guía de Repaso 24: Comportamiento de un Gas Real 1- Considere un gas, contenido en un recipiente, a alta presión y baja temperatura. Al duplicarse isotérmicamente la presión de este gas, se verifica que su volúmen no se reduce a la mitad. Suponiendo que no haya habido fuga de gas ¿qué explicación daría a este hecho? 2- a) Explique, con sus propias palabras, lo que se entiende por presión de vapor. b) Cierta masa de vapor de agua se encuentra a 20°C. ¿Cuál es la presión que se debe ejercer en este vapor para condensarlo? (Consulte la tabla al pie de la presente). c) Conteste la pregunta anterior suponiendo que el vapor esté a 100°C. 3- Una garrafa de gas para cocina, herméticamente cerrado, contiene gas licuado en equilibrio con su vapor. a) La presión de gas en la garrafa ¿es mayor, menor o igual a su presión de vapor? b) Se abra la válvula de la garrafa y se deja escapar cierta masa de gas. Al cerrarse nuevamente la válvula, la presión del gas en el interior de la garrafa ¿será mayor, menor o igual al valor de la presión inicial? Explique lo que ocurrió. 4- Durante muchos años los científicos trataron de licuar el gas helio, sin éxito. Indique la causa de esta dificultad, sabiendo que la temperatura crítica del helio es de -268°C, o sea 5°K (la temperatura crítica mas baja entre todas las sustancias). 5- La temperatura crítica del agua es de 374°C. Si tuviéramos agua en ebullición en un recipiente abierto, ¿debemos decir que desprende vapor de agua, o gas de agua? 6- Un cuarto a 40°C contiene vapor de agua a una presión parcial de 12,6 mmHg. a) ¿A que valor debería reducirse la temperatura dentro del cuarto a fin de que este vapor se condense (punto de rocío)? b) Si se mantiene la temperatura a 40°C y se aumenta la humedad del cuarto, ¿cuál sería el valor de la presión parcial cuando el ambiente estuviera saturado de vapor? 7- ¿Cuál sería el valor de la humedad relativa del aire en el cuarto mencionado en el ejercicio anterior, en las condiciones mencionadas en la pregunta a)? ¿Y en la b)? 8- Determine la humedad relativa del aire en el cuarto mencionado en el ejercicio 6, en las condiciones iniciales allí indicadas. 9- Considere un ambiente caliente y seco, en el cual la temperatura es de 60°C y la humedad relativa del aire es del 30%. ¿Cuál es la presión parcial del vapor de agua en ese ambiente? Termodinámica y Máquinas Térmicas Prof. Faber ______________________________________________________________________ Presión de vapor de agua Temperatura (°C) Presión de vapor (mmHg) Temperatura (°C) Presión de vapor (mmHg) 0 4,6 60 150 5 6,5 80 355 10 8,9 100 760 15 12,6 120 1490 20 17,5 140 2710 40 55,1