temas 16-21 - Universidad Nebrija
Anuncio

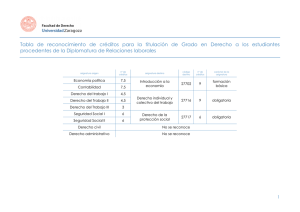
“TEMAS 16-21” Noviembre 2005 Belén Molina Sánchez UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 1 DIAGRAMAS DE EQUILIBRIO DE FASES • Sistema: porción del universo que ha sido aislada de tal modo que sus propiedades pueden ser estudiadas. •Microconstituyente: aquello que es observable a nivel microscópico. • Fase: es un microconstituyente: • Parte homogénea de un sistema separable del resto a través de una barrera de separación (físicamente diferenciable de las demás). • Porción de un sistema material homogéneo y separado físicamente. • Una sustancia pura puede presentarse en tres fases: sólida, líquida y gaseosa: Tienen una misma estructura o arreglo atómico. Tienen la misma composición química. Tienen las mismas propiedades físicas. Presentan una interfase definida con cualquier otra fase que la rodee. • Componente: elementos o compuestos químicos que entran a formar un sistema. • Grados de libertad (F): número de variables (temperatura, presión y composición) que se pueden variar independientemente sin que tenga lugar cambio de fase. • Regla de las fases (ley de Gibs): da una relación entre los componentes (C), las fases (P) y los grados de libertad (F) cuando la presión es aproximadamente igual a 1 atm: P → C −F +1 • El número de fases no puede superar nunca al número de componentes más 1. • Cuando en un sistema en equilibrio se alteran las fases, el equilibrio se pierde. El sistema evoluciona de forma que neutralice la alteración. Así en un enfriamiento se produce una expulsión de energía y en un calentamiento se absorbe energía. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 2 DIAGRAMAS DE EQUILIBRIO DE FASES • Un diagrama de fase es un mapa que describe las fases presentes en un material en función de variables termodinámicas. Se suponen condiciones de enfriamiento y calentamiento muy lentas. • Para especificar por completo el estado de un sistema en equilibrio, es necesario especificar tres variables independientes: temperatura, presión y composición. Si se supone que la presión permanece constante, el diagrama de equilibrio indicará los cambios estructurales debidos a la variación de temperatura y composición. • Existen dos tipos de solubilidad: • Solubilidad ilimitada: se produce una fase sólida. Ej: cobre + níquel. • Solubilidad limitada: uno de los componentes puede disolverse hasta cierto límite en el otro. Se producen dos o más fases sólidas. Ej: cobre + zinc. • Es posible que no exista solubilidad entre dos materiales. • Se estudian los diagramas de fase binarios (dos componentes o C=2). Aplicando la regla de las fases: F → C − P + 1 • Si el número de fases presentes es 3 no hay ningún grado de libertad. • Si el número de fases presentes es 2 hay un grado de libertad, el sistema evoluciona fijando la temperatura con concentraciones únicas a esa temperatura. • Si el número de fases presentes es 1 hay dos grados de libertad, el sistema puede coexistir a cualquier temperatura y concentración. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 3 DIAGRAMAS DE EQUILIBRIO DE FASES Microestructura de una sola fase correspondiente al molibdeno puro 200x UNIVERSIDAD ANTONIO DE NEBRIJA Microestructura de dos fases correspondiente a la perlita hallada en un acero con 0.8% en peso de C 500x ASIGNATURA: MATERIALES I 4 DIAGRAMAS DE EQUILIBRIO DE FASES • Diagrama de fase PT del agua pura: • Diagrama de fase PT del hierro puro: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 5 DIAGRAMAS DE EQUILIBRIO DE FASES • El estudio de la fases viene dado por las curva de enfriamiento. • Curva de enfriamiento de un metal puro o un compuesto químico: • Formación de diagramas de fase a partir de las curvas de enfriamiento: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 6 DIAGRAMAS DE EQUILIBRIO DE FASES • Coordenadas de los diagramas de fases: • Los diagramas se grafican con la temperatura (en grados centígrados) como la ordenada y la composición de la aleación (como porcentaje en peso) como la abcisa. • Si una aleación está formada por el elemento A y el elemento B, el porcentaje en peso de cada uno será: • La información que se puede obtener en un diagrama de fases es: • Mostrar qué fases están presentes a diferentes composiciones y temperaturas en condiciones de enfriamiento lento (equilibrio). • Indicar la solubilidad en estado sólido y en equilibrio de un elemento (o bien de un compuesto) en otro. • Indicar la temperatura a la cual una aleación que se ha enfriado en condiciones de equilibrio comienza a solidificar así como el rango de temperatura en el que ocurre la solidificación. • Indicar la temperatura a la cual empiezan a fundirse las diferentes fases. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 7 DIAGRAMAS DE EQUILIBRIO DE FASES • Tipos más importantes de diagramas de fases: • Componentes completamente solubles en estado líquido: • Completamente solubles en estado sólido (tipo I) • Insolubles en estado sólido: la reacción eutéctica (tipo II) • Parcialmente solubles en estado sólido: la reacción eutéctica (tipo III) • Formación de una fase intermedia de fusión congruente (tipo IV) • La reacción peritéctica (tipo V) • Componentes parcialmente solubles en estado líquido: la reacción monotéctica (tipo VI). • Componentes insolubles en estado líquido e insolubles en estado sólido (tipo VII). • Transformaciones en estado sólido: • Cambio alotrópico • Orden-desorden • La reacción eutectoide • La reacción peritectoide UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 8 DIAGRAMAS DE EQUILIBRIO DE FASES • Tipo I: dos metales completamente solubles en los estados líquido y sólido: como los dos metales son completamente solubles en el estado sólido, el único tipo de fase sólida formada será una solución sólida sustitucional. Los dos metales tendrán generalmente el mismo tipo de estructura cristalina y diferirán en sus radios atómicos en menos del 8%. Punto de fusión de B Punto de fusión de A UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 9 DIAGRAMAS DE EQUILIBRIO DE FASES • El diagrama consta de dos puntos, dos líneas y tres áreas: • Los puntos TA y TB representan los puntos de fusión de los dos metales puros. • La línea superior se llama línea liquidus y la inferior se llama solidus. • El área por encima de la línea liquidus es una región monofásica (solución líquida homogénea). El área por debajo de la línea de solidus es también una región unifásica (solución sólida homogénea). Entre la línea de solidus y liquidus hay una región bifásica (mezcla de una solución líquida y una sólida). Liquidus: temperatura a la cual el líquido empieza a solidificar en condiciones de equilibrio Solidus: temperatura durante la solidificación de una aleación a la cual solidifica la última parte de la fase líquida • Las aleaciones no tienen una temperatura de solidificación (o fusión) definida. Solidifican en un rango de temperaturas. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 10 DIAGRAMAS DE EQUILIBRIO DE FASES • A partir de los diagramas de fases se obtiene también la composición química de cada fase a una temperatura específica: • Si la aleación contiene sólo una fase, la composición de esta fase es igual a la composición de la aleación. • Si la aleación tiene dos fases, la composición se encuentra así: • A partir de los diagramas de fase se obtiene la cantidad de cada fase con respecto a la masa total de la aleación utilizando la regla de la palanca. • Se traza una línea vertical que representa la aleación y una línea horizontal a la temperatura requerida. • La línea vertical dividirá a la horizontal en dos partes cuyas longitudes son inversamente proporcionales a la cantidad de las fases presentes. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 11 DIAGRAMAS DE EQUILIBRIO DE FASES • Regla de la palanca: Distancia _ B * 100 Distancia _ A + Distancia _ B Distancia _ A %∞ = * 100 Distancia _ A + Distancia _ B %L = UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 12 DIAGRAMAS DE EQUILIBRIO DE FASES • Equilibrio de masas: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 13 DIAGRAMAS DE EQUILIBRIO DE FASES • Aplicación de la regla de las fases: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 14 DIAGRAMAS DE EQUILIBRIO DE FASES • Microestructuras: Todo líquido Cristales de SS1 en una matriz de L1 Sólido policristalino (Sssystem) UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 15 DIAGRAMAS DE EQUILIBRIO DE FASES • Microestructuras: 100% líquido (Lsystem) 10% SS1 en una matriz de L1 40% SS2 en una matriz de L2 90% SS3 en una matriz de L3 100% sólido (SSsystem) UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 16 DIAGRAMAS DE EQUILIBRIO DE FASES • Ejemplo diagrama de fase del sistema NiO-MgO: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 17 DIAGRAMAS DE EQUILIBRIO DE FASES • Ejemplo diagrama de fase del sistema Cobre-Níquel: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 18 DIAGRAMAS DE EQUILIBRIO DE FASES • Tipo II: dos metales completamente solubles en estado líquido y completamente insolubles en estado sólido: • Cada metal disminuye el punto de fusión del otro. • La línea liquidus debe mostrar un mínimo, conocido como punto eutéctico. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 19 DIAGRAMAS DE EQUILIBRIO DE FASES • El diagrama está formado por cuatro áreas: • El área arriba de la línea liquidus es una solución líquida homogénea de una sola fase, ya que los dos metales son solubles en estado líquido. • Las áreas restantes son de dos fases. • En estas aleaciones ocurre la reacción eutéctica: Líquido → sólido1 + sólido2 Enfriamiento • La reacción eutéctica se da a una temperatura fija llamada temperatura eutéctica. • Un sólido eutéctico tiene una forma diferente a las otras fases de la aleación, por lo que se considera una fase del material: se solidifican alternativamente A y B puros, resultando una mezcla muy fina (mezcla eutéctica) UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 20 DIAGRAMAS DE EQUILIBRIO DE FASES • Diagrama de fase tipo eutéctico: Etapas en el enfriamiento lento de una aleación 80A-20B UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 21 DIAGRAMAS DE EQUILIBRIO DE FASES • Microestructuras: Todo líquido (Leutéctico) Cristales de A en una matriz de L1 Cristales de B en matriz de L2 Microestructura eutéctica, fina capas alternadas de A y B UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 22 DIAGRAMAS DE EQUILIBRIO DE FASES • Ejemplo diagrama de fase del sistema aluminio-silicio: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 23 DIAGRAMAS DE EQUILIBRIO DE FASES • Tipo III: dos metales completamente solubles en el estado líquido, pero sólo parcialmente solubles en el estado sólido. •Cuando la solubilidad es parcial, el diagrama de fase es diferente: • La línea de solubilidad describe cuánto de un componente puede disolverse en otro. • Al cruzar la línea de solubilidad durante el enfriamiento se da la precipitación de una de las fases. • En estas aleaciones ocurre también la reacción eutéctica. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 24 DIAGRAMAS DE EQUILIBRIO DE FASES • Varias microestructuras características de distintas regiones: Todo líquido (Leutéctico) Cristales de α3 en una matriz de L1 Cristales de β1 en una matriz de L2 Sólido policristalino (α1) Microestructura eutéctica, finas capas alternas de α2 y β2 UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 25 DIAGRAMAS DE EQUILIBRIO DE FASES • Evolución de la microestructura durante el enfriamiento lento de una composición eutéctica: 100% líquido (Leutéctico) Microestructura eutéctica, finas capas alternadas de α1 y β 1 Microestructura eutéctica, finas capas alternadas de α2 y β2* * Las únicas diferencias con respecto a la microestructura de T1 son las composiciones de fase y las cantidades relativas de cada fase. Por ejemplo, la cantidad de β será proporcional α: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 26 DIAGRAMAS DE EQUILIBRIO DE FASES • Evolución de la microestructura durante el enfriamiento lento de una composición hipereutéctica: 100% líquido (Lsystem = 80%B) 10% β1 en matriz de L1 67% β2 (=90% B) en matriz de L2 (=60% B) 67% β3 (=90% B) en matriz de microestructura eutéctica = 17%α3 (=30% B) + 83%β3 (=90% B) UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 27 DIAGRAMAS DE EQUILIBRIO DE FASES • Evolución de la microestructura durante el enfriamiento lento de una composición hipoeutéctica: 100% líquido (Lsystem = 40%B) 10% α1 en matriz de L1 10% β1 en matriz de L1 67% α2 (=30% B) en matriz de L2 (=60% B) 67% α3 (=30% B) en matriz de microestructura eutéctica = 83%α3 (=30% B) + 17%β3 (=90% B) UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 28 DIAGRAMAS DE EQUILIBRIO DE FASES • Microestructuras de dos composiciones que evitan la reacción eutéctica: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 29 DIAGRAMAS DE EQUILIBRIO DE FASES • Ejemplo diagrama de fase del sistema estaño-plomo: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 30 DIAGRAMAS DE EQUILIBRIO DE FASES • Tipo IV: la fase intermedia de fusión congruente. •Cuando una fase cambia en otra isotérmicamente (a temperatura constante) y sin ninguna modificación en composición química, se dice que es un cambio de fase congruente o una transformación congruente. • Las fases intermedias son congruentes porque son únicas y se presentan entre las fases terminales en un diagrama de fase. • Si la fase intermedia tiene un reducido intervalo de composición, como sucede en los compuestos intermetálicos y los compuestos intersticiales, entonces se representa en el diagrama con una línea vertical y se indica con la fórmula del compuesto. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 31 DIAGRAMAS DE EQUILIBRIO DE FASES • Tipo V: la reacción peritéctica. • En la reacción peritéctica un líquido y un sólido reaccionan isotérmicamente para formar un nuevo sólido al enfriarse. • La reacción peritéctica se expresa como: Líquido + sólido1 → sólido2 Enfriamiento Fase intermedia de fusión congruente Diagrama de equilibrio que muestra una aleación intermedia que es un compuesto intermetálico estequiométrico (AxBy) donde x e y están definidos UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 32 DIAGRAMAS DE EQUILIBRIO DE FASES • Tipo V: la reacción peritéctica. Diagrama de equilibrio Ti-Ni que muestra varios compuestos intermetálicos el TiNi es un compuesto intermetálico no estequiométrico (AxBy) donde x e y no están definidos, el compuesto se representa como un campo (solución sólida secundaria) UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 33 DIAGRAMAS DE EQUILIBRIO DE FASES • Diagrama de fase que muestra la formación de una fase intermedia de fusión incongruente por una reacción peritéctica: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 34 DIAGRAMAS DE EQUILIBRIO DE FASES • Microestructuras del sistema peritéctico: Cristales de B en una matriz de L1 Sólido policristalino (compuesto AB) UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 35 DIAGRAMAS DE EQUILIBRIO DE FASES • Ejemplo diagrama de fase del sistema hierro-Fe3C: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 36 DIAGRAMAS DE EQUILIBRIO DE FASES • Tipo VI: dos líquidos parcialmente solubles en el estado líquido: la reacción monotéctica. • Hasta ahora se ha supuesto que había solubilidad completa en estado líquido, sin embargo es posible que sobre cierto intervalo de composición se formen dos soluciones líquidas no miscibles entre sí. • La reacción monotéctica se expresa como: Líquido1 → líquido 2 + sólido Zona de miscibilidad Enfriamiento El punto C se conoce como punto monotéctico UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 37 DIAGRAMAS DE EQUILIBRIO DE FASES • Tipo VII: dos metales insolubles en el estado líquido y sólido. • Ejemplo diagrama de fase del sistema aluminio-plomo: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 38 DIAGRAMAS DE EQUILIBRIO DE FASES • Transformaciones en estado sólido: • Alotropía: diversos metales pueden existir en más de un tipo de estructura cristalina, dependiendo de la temperatura. El hierro, el estaño, el manganeso y el cobalto son algunos ejemplos. •Transformación orden-desorden: al formarse una solución sólida de tipo sustitucional los átomos de soluble generalmente no ocupan ninguna posición específica, sino que están distribuidos al azar en la estructura reticular del solvente. Se dice que la aleación está en una condición “desordenada”. Algunas de estas soluciones si se enfrían lentamente sufren un arreglo de los átomos. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 39 DIAGRAMAS DE EQUILIBRIO DE FASES • Transformaciones en estado sólido: • La reacción eutectoide: semejante a la reacción eutéctica, pero no incluye al líquido: Sólido1 → sólido 2 + sólido3 Enfriamiento UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 40 DIAGRAMAS DE EQUILIBRIO DE FASES • Microestructuras: Sólido policristalino (γευτεχτοιδε) Microestructura eutéctica, nódulos de tamaño fino de γ1 en una matriz de β1 Microestructura eutéctica, finas capas alternas de α1 y β2 UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 41 DIAGRAMAS DE EQUILIBRIO DE FASES • Transformaciones en estado sólido: • La reacción peritectoide: semejante a la peritéctica, pero no incluye el líquido. Sólido1 + sólido 2 → sólido3 Enfriamiento UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 42 DIAGRAMAS DE EQUILIBRIO DE FASES • Resumen de las posibles reacciones de un diagrama en equilibrio: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 43 DIAGRAMAS DE EQUILIBRIO DE FASES • Reglas de diagramas binarios: • En cada región de equilibrio pueden coexistir como mucho dos fases. • Con excepción de la fase líquida, todas las regiones de fase única están ocupadas por fases sólidas. • Cuando se atraviesa una línea oblicua, el número de fases se reduce a una. • Toda región cuyo contorno esté limitado por una línea horizontal contiene dos fases. • Las regiones de dos fases limitadas por la misma horizontal no contienen más que tres fases asociadas dos a dos. • La región de equilibrio de dos fases puede quedar dividida en zonas por las verticales que parten de puntos singulares en la líneas horizontales (eutéctico, eutectoide...) Las fases que coexisten en las zonas de una misma región son las mismas pero están distribuidas de forma diferente. • La línea de solidus está por debajo de la de liquidus. • Toda horizontal que corta al solidus corta al liquidus y las concentraciones de los puntos de intersección son los que necesariamente deben contener las fases líquidas y sólidas a esa temperatura. • Un punto de conjunción del liquidus y solidus indica una concentración en la que se verifica la transformación a temperatura constante. • Toda línea horizontal en el solidus indica una temperatura a la que se verifica la solidificación de todo el líquido residual de aleación a temperatura constante. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 44 DIAGRAMAS DE EQUILIBRIO DE FASES • Reglas de diagramas binarios: • Toda rama vertical en el solidus indica la existencia de una fase pura, sea metal o compuesto químico. • Toda rama inclinada en el solidus indica la existencia de una solución sólida. • La intersección de una rama de solidus horizontal con una inclinada de temperaturas inferiores indica la existencia de un punto de tránsito en la rama horizontal. • En la reacción reversible se forma un compuesto químico si la rama es vertical y una solución sólida extrema si es inclinada, siendo en ambos casos la concentración de ambas fases la correspondiente al punto de intersección. • En toda reacción durante la solidificación las fases que intervienen están sobre una rama horizontal o su concentración y la fase intermedia da lugar a las extremas. • Los compuestos pueden ser: • Estequiométricos: AxBy con x e y definidos. • No estequiométricos: AxBy con x e y no definidos. • Los compuestos también se pueden clasificar: • De fusión congruente: L AxBy • De fusión incongruente: Peritéctica: L + S1 • Peritectoide: S1 + S2 • UNIVERSIDAD ANTONIO DE NEBRIJA AxBy AxBy ASIGNATURA: MATERIALES I 45 DIAGRAMAS DE EQUILIBRIO DE FASES • Diagrama reales: los diversos tipos de diagramas de equilibrios expuestos se combinan de muchas maneras para formar diagramas reales. • Ejemplo diagrama de fase del sistema aluminio-cobre: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 46 DIAGRAMAS DE EQUILIBRIO DE FASES • Ejemplo diagrama de fase del sistema aluminio-magnesio: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 47 DIAGRAMAS DE EQUILIBRIO DE FASES • Ejemplo diagrama de fase del sistema zinc-cobre: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 48 DIAGRAMAS DE EQUILIBRIO DE FASES • Ejemplo diagrama de fase del sistema óxido de aluminio-óxido de silicio: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 49 DIAGRAMAS DE EQUILIBRIO DE FASES • Ejemplo diagrama de fase del sistema óxido de aluminio-óxido de magnesio: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 50 DIAGRAMAS DE EQUILIBRIO DE FASES • Ejemplo diagrama de fase del sistema óxido de calcio-óxido de zirconio: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 51 DIAGRAMAS DE EQUILIBRIO DE FASES • Curva de enfriamiento de una aleación con x% de A es la representación de la temperatura en función del tiempo, indicando las transformaciones que van teniendo lugar. • Diagrama de solidificación de una aleación con x% de A es la representación del porcentaje de cada fase presente a cada temperatura UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 52 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • El hierro es un constituyente fundamental de algunas de las más importantes aleaciones. • En una forma casi pura, conocida como hierro dulce, se usa en alcantarillas, material para techos y conductos. Contiene aproximadamente 0.012% de carbono, 0.017% de manganeso, 0.005% de fósforo, 0.025% de azufre y pequeñas trazas de silicio. • El hierro es un metal alotrópico. • Curva de enfriamiento para el hierro puro: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 53 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • El acero se obtiene de mezclar hierro y carbono. • Las fases presentes en el acero son: • Ferrita α: es hierro con estructura BCC. La ferrita es dúctil y magnética. • Austenita γ: es hierro con estructura FCC. Es menos dúctil que la ferrita. Es no magnética. • Cementita (Fe3C): es un compuesto intermetálico, llamado también carburo de hierro. Es una fase muy dura y frágil. • Perlita: es la fase que resulta de la reacción eutectoide del acero: Austenita( γ ) → Ferrita(α ) + Cementita(Fe3C) Enfriamiento Perlita • El sólido eutectoide tiene una estructura laminar parecida a la del sólido eutéctico. • Los aceros pueden dividirse en tres tipos: • Aceros hipoeutectoides: %C < 0.77 • Aceros eutectoides: %C = 0.77 • Aceros hipereutectoides: %C > 0.77 UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 54 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Diagrama hierro-carburo de hierro (cementita): Los aceros tienen un porcentaje en carbono máximo de 2% Los hierro colados tienen un porcentaje de carbono entre 2 y 4,3% Hay tres líneas horizontales que indican reacciones isotérmicas UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 55 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Diagrama hierro-carburo de hierro: Definición de las estructuras: * Cementita (carburo de hierro): fórmula química Fe3C contiene 6.67% de C por peso. Compuesto intersticial duro y frágil. * Austenita: es el nombre dado a la solución sólida γ. Es una solución sólida intersticial de carbono disuelto en hierro γ (FCC). Tiene baja tenacidad. No es estable a temperatura ambiente. Bajo ciertas condiciones se puede obtener. * Ledeburita: mezcla eutéctica de austenita y cementita. Contiene 4.3% de carbono. * Ferrita: es el nombre dado a la solución sólida α. Es una solución sólida intersticial de una pequeña cantidad de carbono (hasta 0.008% C a temperatura ambiente) en hierro α (BCC). Es la estructura más suave. UNIVERSIDAD ANTONIO DE NEBRIJA * Perlita: mezcla eutectoide que contiene 0.8% de C. Es una mezcla muy fina de ferrita ASIGNATURA: MATERIALES I 56 y cementita. EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Microestructuras: Microestructura de austenita 500x Microestructura de ferrita 100x UNIVERSIDAD ANTONIO DE NEBRIJA Microestructura de perlita 2500x Microestructura de perlita 17000x ASIGNATURA: MATERIALES I 57 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Líneas de temperatura crítica: • La líneas crítica en calentamiento es siempre mayor que la línea crítica en enfriamiento. • Las líneas críticas en calentamiento se llaman AC y las líneas críticas en enfriamiento Ar. • Los puntos críticos son: • A1: línea eutectoide teórica (723 ºC) • Ar1: fin de la transformación de austenita a perlita • Ac1: inicio de la transformación de perlita a austenita • A3: línea teórica de separación entre las regiones (α + γ) y γ • Ac3: final de la disolución de la ferrita en austenita • Ar3: comienzo de la segregación de la ferrita desde la austenita • Acm: línea teórica de separación de (γ + Fe3C) y γ • Accm: fin de la disolución de la cementita en austenita • Arcm: comienzo de la precipitación de la cementita desde la austenita UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 58 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • El acero hipoeutectoide está formado por una mezcla de ferrita más perlita: 0.77 − %C %α = * 100 0.77 − 0.022 %C − 0.022 %perlita = * 100 0.77 − 0.022 • La perlita está formada por una mezcla de ferrita y cementita. 6.67 − 0.77 * 100 = 88.7% 6.67 − 0.022 0.77 − 0.022 %Fe3C _ en _ perlita = * 100 = 11.3% 6.67 − 0.022 %α _ en _ perlita = • La cantidad total de ferrita que contiene el acero se forma en dos etapas: • Arriba de 727 ºC. Se llama ferrita proeutectoide. • A 727 ºC como parte de la perlita. Se llama ferrita eutectoide. 6.67 − %C * 100 6.67 − 0 %C − 0 %total _ Fe 3C = * 100 6.67 − 0 %total _ ferrita = UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 59 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • El acero hipereutectoide está formado por cementita y perlita: %C − 0.77 * 100 6.67 − 0.022 6.67 − %C %perlita = * 100 6.67 − 0.077 %cementita = • El acero eutectoide está formado por 100% perlita: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 60 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 61 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Evolución microestructural de una fundición blanca: Todo el carbono se encuentra combinado bajo la forma de cementita γ2 en una matriz de microestructura eutéctica (islas de γ + Fe3C) Islas de Fe3C (de la eutéctica) + perlita (α + Fe3C, del eutectoide) UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 62 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Evolución de la microestructura de un acero eutectoide: Microestructura eutéctica, finas capas alternadas de α y Fe3C UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 63 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Evolución de la microestructura durante el enfriamiento lento de un acero hipereutectoide: Cementita proeutectoide en los bordes de grano de γ Cementita proeutectoide + perlita UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 64 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Evolución de la microestructura durante el enfriamiento lento de un acero hipoeutectoide: Ferrita proeutectoide en los bordes de grano de γ Ferrita proeutectoide + perlita UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 65 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Diagrama hierro-carbono: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 66 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Evolución de una microestructura de una fundición gris: γ2 en matriz de microestructura eutéctica (γ + láminas de C) Láminas de C (de las reacciones eutécticas y eutectoide) en una matriz de ferrita UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 67 EL SISTEMA HIERRO-CARBONO: MICROESTRUCTURAS • Variación de las propiedades mecánicas de una aleación en función del tanto por ciento de carbono presente: UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 68 EL SISTEMA HIERRO-CARBONO: INFLUENCIA DE LOS ELEMENTOS DE ALEACIÓN • Aluminio: • Es el mejor medio para desoxidar y desnitrurizar. • Tiene una influencia muy favorable sobre el envejecimiento. • En pequeñas proporciones restringe el crecimiento de grano. • Al combinarse con el nitrógeno forma un compuesto de gran dureza, con lo que se usa en los aceros para nitrurar. • Aumenta la estabilidad de la fase ferrítica por lo que se usa para aceros aleados resistentes a altas temperaturas. • Carbono: • Es el elemento aleante más importante del acero y el que tiene la mayor influencia. • Aumenta la resistencia mecánica y las propiedades de dureza, pero disminuye la ductilidad, forjabilidad, soldadura y propiedades de corte. • Cromo: • Aumenta la dureza y resistencia (a razón de 8 a 10 kg/mm2 por 1% de cromo) y reduce la resistencia al choque y reduce mínimamente la elasticidad. • Con un alto contenido en cromo se consiguen aceros inoxidables. • Con el carburo forma aceros de alta resistencia al desgaste. • Las propiedades de soldadura empeoran notablemente con el aumento de cromo. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 69 EL SISTEMA HIERRO-CARBONO: INFLUENCIA DE LOS ELEMENTOS DE ALEACIÓN • Cobre: • Aumenta la resistencia y el límite elástico, reduciendo la dilatación. • Aumenta la resistencia a la corrosión atmosférica. • Hidrógeno: • Es el un elemento dañino ya que causa fragilidad debido a la reducción de la elasticidad y la estricción, sin incremento del límite elástico ni de la resistencia. • Favorece la formación de grietas. • Manganeso: • Mejora las propiedades de resistencia del acero, estando su elasticidad poco influida. • Tiene buena influencia en las propiedades de forjado y soldabilidad. • Un alto contenido en manganeso en presencia de carbono aumenta resistencia al desgaste substancialmente. • Con hasta un 3% de manganeso la resistencia de los aceros aumenta cerca de 10 kg/mm2 por cada porcentaje. Con un contenido de entre 3 y 8% el incremento es más lento y con un 8% disminuye. El límite elástico se comporta de manera similar. • Aumenta substancialmente la profundidad de temple. • Todos los aceros comerciales contienen entre 0.3 y 0.8% de manganeso para reducir óxidos y sulfuros. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 70 EL SISTEMA HIERRO-CARBONO: INFLUENCIA DE LOS ELEMENTOS DE ALEACIÓN • Molibdeno: • Mejora la resistencia y tiene influencia positiva en las propiedades de soldabilidad. • Es frecuentemente usado en combinación con el cromo. • En combinación con el cromo y níquel, el molibdeno produce altos límites elásticos y resistencias. • Se usa en los aceros rápidos y aceros para alta temperatura, en aceros inoxidables austeníticos, aceros cementados y templados y para la reducción de la fragilidad. • Nitrógeno: • En los aceros austeníticos estabiliza la estructura incrementando la dureza y especialmente el límite elástico y las propiedades mecánicas a altas temperaturas. • Produce un alto endurecimiento superficial por la formación de nitruros durante el proceso de nitruración. • Es perjudicial por la reducción de la resiliencia durante el proceso de temple de endurecimiento. • Causa envejecimiento y fragilidad azul aumentando la posibilidad de corrosión intergranular en aceros no aleados o de baja aleación. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 71 EL SISTEMA HIERRO-CARBONO: INFLUENCIA DE LOS ELEMENTOS DE ALEACIÓN • Níquel: • Incrementa la resistencia de los aceros, aunque menos que el silicio o el manganeso, disminuyendo la elasticidad mínimamente. • Con más de un 10% de níquel el acero se vuelve frágil. • Asegura buena resiliencia, especialmente cuando el acero contiene también cromo. • Los aceros al cromo-níquel son inoxidables y resistentes al calor. • No afecta a las propiedades de soldabilidad. • Incrementa la resistencia al choque de los aceros estructurales considerablemente, especialmente a bajas temperaturas. • Es apropiado para el uso en aceros austeníticos, aceros resistentes a la corrosión y aceros templados y cementados para mejorar su resiliencia. • Oxígeno: • Es perjudicial para el acero, pero su influencia depende del tipo y composición de los componentes, así como de la forma y distribución. • Las propiedades mecánicas, especialmente la resistencia al impacto disminuyen en la dirección transversal, mientras que la tendencia a la fragilidad de envejecimiento aumenta. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 72 EL SISTEMA HIERRO-CARBONO: INFLUENCIA DE LOS ELEMENTOS DE ALEACIÓN • Fósforo: • Hay varias clases de fósforo, blanco, rojo, negro... • En general es perjudicial para el acero por lo que se intenta mantener el contenido en fósforo entre 0.03 y 0.05%. • Azufre: • Produce fragilidad. • Se permiten contenidos entre 0.025 y 0.03%. • Silicio: • Como el manganeso, el silicio está presente en todos los aceros, ya que el hierro usado en la fabricación contiene una variable cantidad del mismo. • Aumenta la resistencia mecánica, la densidad (especialmente en los aceros fundidos). • La elasticidad está mínimamente influenciada, mientras que la resistencia se incrementa alrededor de 10 kg/mm2 por cada porcentaje de silicio y el límite elástico aumenta de una manera similar. • Los aceros con un alto contenido en silicio tienen tendencia a formar una estructura de grano grueso. • Un alto contenido en silicio (14%) permite al acero resistir ataques químicos, pero no podrá ser forjado. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 73 EL SISTEMA HIERRO-CARBONO: INFLUENCIA DE LOS ELEMENTOS DE ALEACIÓN • Titanio: • Metal muy duro, gran formador de carburos. • Predominante en los aceros austeníticos resistentes a la corrosión intercristalina. • Produce afinamiento de grano. • Vanadio: • Pequeñas adiciones mejoran la dureza en caliente y reduce el crecimiento de grano. • Es favorable para aceros estructurales y de herramienta. • Es un fuerte formador de carburos. • Aumenta la resistencia y el límite elástico. • Se prefiere en combinación con el cromo en aceros estructurales y resistentes al calor. UNIVERSIDAD ANTONIO DE NEBRIJA ASIGNATURA: MATERIALES I 74