Clase 1 - Departamento de Física
Anuncio

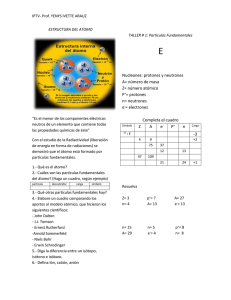
Curso de Radioactividad y Medio Ambiente Dr. Leonardo Errico Dra. Maria Luciana Montes Departamento de Física, Facultad de Ciencias Exactas - UNLP [email protected] [email protected] Durante el siglo pasado, las aplicaciones de la física nuclear han tenido efectos muy grandes sobre la especie humana y la sociedad; algunos fueron benéficos y otros catastróficos. Muchas personas tienen opiniones muy firmes sobre ciertas aplicaciones como bombas y reactores. En el caso ideal, esas opiniones deberían basarse en la comprensión y no en los prejuicios o en las emociones, por lo que esperamos que esta materia ayude a alcanzar ese ideal. Un poco de historia La idea de que la materia está formada de átomos data de los antiguos griegos. Siglo IV A. C, Demócrito, Leucipio: Demócrito: si una sustancia pura se cortara en pedazos cada vez más pequeños, finalmente se obtendría la pieza más pequeña de esa sustancia que ya no se podría dividir más. Especulaban con que la materia no era un continuo, que debía haber una mínima unidad indivisible, a la que denominaban átomo. Proponen al átomo como el constituyente elemental de la materia. Un poco de historia Demócrito desarrolló la “teoría atómica del universo”, concebida por su mentor, Leucinio (como todas las teorías filosóficas griegas, no apoya sus postulados mediante experimentos, sino que se explica mediante razonamientos lógicos). La materia no es más que una mezcla de elementos originarios con las características de: - Inmutabilidad - Eternidad - Individuales, - Homogéneos - Incompresibles e indivisibles - Entidades infinitamente pequeñas y, por tanto, imperceptibles para los sentidos: Átomos ( término griego que significa "que no puede cortarse“). Los átomos se diferencian solo en forma y tamaño, pero no por cualidades internas. Las propiedades de la materia varían según el agrupamiento de los átomos. Un poco de historia Por convención, el color; por convención, lo dulce; por convención, lo amargo; pero en la realidad, átomos y espacio vacío. Democrito, fragmento 9 (citado por Sexto Empírico en Adversus Mathematicus VII 135) En la actualidad, la teoría atómica es universalmente aceptada. Sin embargo, la evidencia experimental en su favor se generó principalmente en los siglos XVIII, XIX y XX, y gran parte de esa evidencia se obtuvo a partir del análisis de reacciones químicas. Un poco de historia Principios del siglo XIX, John Dalton: Basado en los trabajos de Proust y Lavoisier supuso que la materia estaba constituida por pequeñas unidades de materia (átomos), que eran indestructibles y que existían tantos tipos de átomos como elementos simples existían. El paso fundamental que da Dalton es: “Si los elementos fueran compuestos de pequeñas partículas (átomos según los griegos), un dado compuesto siempre contiene la misma combinación de estas partículas”. Y propone otro principio que puede ser explicado en términos de átomos (ley de las proporciones múltiples). Un poco de historia Dalton pensaba en términos de átomos, pero no de moléculas. En 1808 Dalton publica su teoría: - Cada elemento está formado por pequeñas partículas (átomos) - Los átomos de un dado elemento son idénticos. Los átomos de diferentes elementos son distintos de forma fundamental. -Los compuestos se formas por combinación de átomos. Un dado compuesto siempre tiene el mismo número relativo de tipos de átomos. -Las reacciones químicas involucran el reacomodamiento de átomos. Los átomos no cambian, se combinan de diferente forma. -También propone la primera lista de masas atómicas, aunque con errores (falla al considerar al agua como HO). Un poco de historia Modelo atómico de Dalton: Un poco de historia 1897, Joseph John Thomson (Premio Nobel 1906) Estudia los fenómenos de descarga eléctrica en gases y los rayos catódicos . Determina que los rayos estaban formados por partículas y determina la relación carga masa de los mismos. El nombre de «electrón» (del griego ambar) para estas partículas fue propuesto posteriormente por el físico irlandés George Francis FitzGerald Basado en esto Thomson dedujo que en el átomo debía haber cargas positivas además de las negativas, a fin de mantener la neutralidad eléctrica del átomo. En 1886 Eugen Goldstein ya había advertido que también había rayos que se emitían desde el ánodo, descubriendo así los rayos anódicos o canales, los cuales tiene carga positiva, que podía ser mayor a la del electrón (su trabajo pasó desapercibido) . Un poco de historia Un poco de historia 1910,Robert Millikan (Premio Nobel 1923) Inspirado en los experimentos previos de Thomson y Townsed logra determinar la carga del electrón estudiando el movimiento de gotas de aceite cargadas en un campo eléctrico. La carga eléctrica no es una magnitud continua. El valor de la carga del electrón obtenido es 1,6x10-19 C. Un poco de historia En su experimento roció gotas muy finas de aceite entre dos placas paralelas. Mantuvo una diferencia de potencial VAB entre las placas. Algunas de las gotas de aceite adquirieron carga negativa por efecto de la fricción o la ionización del aire circundante por medio de rayos x o radiactividad. Este valor, junto con el valor de e/m obtenido por Thompson 15 años antes permite determinar la masa del electrón. Un poco de historia En 1910 las cosas estaban así: - J. J. Thomson había descubierto el electrón y medido su relación de carga a masa (1897). - En 1910, Millikan había hecho sus primeras mediciones de la carga del electrón. El tamaño de los átomos era del orden de 10-10 m, y todos los átomos, excepto el hidrógeno, contenían más de un electrón.. Distribución de masa y carga en el átomo?. Modelo atómico de Thomson: Esfera con carga positiva, del orden de 10-10 m de diámetro, con los electrones incrustados en ella como las pasas en una gelatina más o menos esférica. Un poco de historia 1911, Ernest Rutherford (Premio Nobel 1908) Los primeros experimentos cuyo objeto era sondear la estructura interior del átomo fueron realizados entre 1910 y 1911 por Ernest Rutherford y dos de sus alumnos: Hans Geiger y Ernest Marsden, en la Universidad de Manchester, Inglaterra. Intento de contrastación del modelo de Thomson. Partículas alfa (de una masa casi ocho mil veces mayor que la del electrón, y una carga dos veces mayor, pero positiva) contra una lámina de oro de 0,00005 cm de espesor (unos 2000 átomos de oro de espesor). Estudiar la desviación que sufrían las partículas después de atravesar la lámina. Un poco de historia Las partículas alfa se registraban en pantallas de ZnS, que tiene la propiedad de que emite un destello luminoso cuando es golpeado por una partícula cargada. Resultado: Algunas partículas alfa fueron dispersadas casi 180°, esto es, casi directo hacia atrás Un poco de historia Simulación de la dispersión de partículas alfa de 5.0 MeV, por un núcleo de oro. Las curvas de dispersión concuerdan con los datos experimentales de Rutherford, si se considera un radio de 7.0x10-15 m para un núcleo de oro. Un modelo con un radio mucho mayor no se ajusta a los datos. Conclusión: el átomo está «casi vacío», con su masa y carga (+) concentradas en una región (núcleo) de radio del orden de 10-14 m (cienmilésima parte del radio atómico). Los electrones deberían estar en ese espacio vacío, atraídos por la carga positiva del núcleo y dando vueltas alrededor de él igual que los planetas en torno al Sol. El núcleo esta formado por protones y Rutherford predijo la existencia del neutrón. Un poco de historia Qué significa realmente « el átomo está casi vacío» con su masa y carga concentradas en un núcleo de 10-14 m? Un poco de historia Modelo atómico de Rutherford: Un poco de historia El descubrimiento de Rutherford del núcleo atómico originó una duda importante: ¿Qué mantenía a los electrones con carga negativa a distancias relativamente grandes del núcleo tan pequeño con carga positiva, a pesar de su atracción electrostática? De acuerdo con la teoría electromagnética clásica, toda carga que acelera irradia energía. Por tanto, la energía de un electrón en órbita debería disminuir en forma continua, su órbita debería contraerse cada vez más, y rápidamente describiría una espiral hacia el núcleo. Un poco de historia 1913, Niels Bohr (Premio Nobel 1922) Para resolver este problema, Bohr hizo una propuesta revolucionaria. Postuló que un electrón en un átomo puede moverse en torno al núcleo en ciertas órbitas estables, circulares, sin emitir radiación, al contrario de las predicciones de la teoría electromagnética clásica. Modelo atómico de Bohr: Un poco de historia Un poco de historia 1918 Rutherford encontró que cuando se disparan partículas alfa contra un gas de nitrógeno, sus detectores de centelleo mostraban signos de núcleos de hidrógeno. Rutherford determinó que el único sitio del cual podían provenir estos núcleos era del nitrógeno y que por tanto el nitrógeno debía contener núcleos de H. Por estas razones Rutherford sugirió que el núcleo de hidrógeno, que para la época se sabía que su número atómico era 1, debía ser una partícula fundamental. Antes que Rutherford, Eugene Goldstein, había observado rayos compuestos de iones cargados positivamente. Luego del descubrimiento del electrón por J.J. Thompson, Goldstein sugirió que puesto que el átomo era eléctricamente neutro, el mismo debía contener partículas cargadas positivamente. Goldstein usó los rayos canales y pudo calcular la razón carga/masa. Encontró que dichas razones cambiaban cuando cambiaba los gases que usaba en el tubo de rayos catódicos. Lo que Goldstein creía que eran protones resultaron ser iones positivos. Sin embargo, sus trabajos fueron largamente ignorados por la comunidad de físicos. Un poco de historia Dificultad: Puesto que la carga positiva del núcleo del átomo es igual a la carga negativa total de los electrones de dicho átomo, el núcleo contiene varios protones (tantos como electrones tiene el átomo). Al estar cargados positivamente, ¿Por qué se mantienen fuertemente unidos dentro del núcleo? Para resolver este problema Rutherford supuso que en el núcleo atómico, además de los protones, debía haber otras partículas sin carga eléctrica. Planteó esta idea en una conferencia ante la Royal Society (1920). Los protones y las partículas neutras debían ejercerse fuerzas atractivas de una nueva naturaleza y de gran intensidad para explicar la estabilidad del núcleo a pesar de la repulsión eléctrica entre los protones. Esta hipótesis es compatible con el hecho de que la masa del átomo de hidrógeno es aproximadamente la suma de las masas del electrón y el protón. Sin embargo, la masa de todos los demás átomos es mayor que la suma de las masas de sus protones más sus electrones. Un poco de historia 1930, Walther Bothe y H. Becker descubren que si partículas alfa emitidas por el polonio inciden sobre materiales livianos, se producía una radiación particularmente penetrante. En un primer momento se pensó que eran rayos gamma, aunque estos eran más penetrantes que todos los rayos gammas hasta ese entonces conocidos. Además, los detalles de los resultados experimentales eran difíciles de interpretar sobre estas bases. 1932, Irène Joliot-Curie y Frédéric Joliot mostraron que esta radiación desconocida, al golpear parafina u otros compuestos que contenían hidrógeno, producía protones. Eso no era inconsistente con la suposición de que eran rayos gammas de la radiación, pero un detallado análisis cuantitativo de los datos hizo difícil conciliar la ya mencionada hipótesis. Un poco de historia 1932, James Chadwick realizó una serie de experimentos de los que obtuvo unos resultados que no concordaban con los que predecían las fórmulas físicas: la energía producida por la radiación era muy superior y en los choques no se conservaba el momento. Para explicar tales resultados, era necesario optar por una de las siguientes hipótesis: o bien se aceptaba la no conservación del momento en las colisiones o se afirmaba la naturaleza corpuscular de la radiación. Como la primera hipótesis contradecía las leyes de la física, se optó por la segunda. Con ésta, los resultados obtenidos quedaban explicados pero era necesario aceptar que las partículas que formaban la radiación no tenían carga eléctrica. Tales partículas tenían una masa muy semejante a la del protón, pero sin carga eléctrica, por lo que se pensó que eran el resultado de la unión de un protón y un electrón formando una especie de dipolo eléctrico. Posteriores experimentos descartaron la idea del dipolo y se conoció la naturaleza de los neutrones. Un poco de historia 1896 Descubrimiento de la radiactividad 1900 Clasificación de las partículas de acuerdo con la capacidad de penetrar en la materia e ionizar el aire, , , (Rutherford) 1911 Tamaño nuclear ~ 10-4 ó 10-5 veces el de átomo 1 a 10 fm 1919 (Becquerel) (1 fm = 10-15 m) Descubrimiento de los protones Primera observación de una desintegración artificial. (Rutherford) (Rutherford) Un poco de historia 1928 Penetración de las partículas a a una barrera de potencial Tratamiento mecánico – cuántico (Gamow, Gurney y Condon) 1930 - Transformación de los núcleos. Emisión de fotones 1932 – Descubrimiento del neutrón Descubrimiento del positrón (Bethe y Bocker) (Chadwick) (Anderson) Observación de la primera reacción nuclear utilizando partículas aceleradas artificialmente (Cockcroft y Walton) Inicio de la Física Nuclear Moderna Un poco de historia 1895, Roentgen, radiación X, expansión de los usos médicos de la radiación. 1896, Henri Becquerel, descubre el uranio. 1905, Einstein, teoría de la relatividad 1890 1900 1910 1920 1930 1940 1950 1960 1970 1980 1990 2000 2010 1900, Thomson, q/m del electrón 1898, polonio, radio 1903, Premio Nobel de Física: Antoine Henri Becquerel, Pierre y Marie Curie por la radiactividad. Un poco de historia 1928, el Congreso Mundial de Radiología, crea la Comisión Internacional de Protección Radiológica (ICRP) 1932 El positrón es descubierto por Anderson. 1930 Dirac predice la existencia del positrón. 1890 1900 1910 1920 1930 1940 1950 1960 1970 1980 1990 2000 2010 1903-1919, partículas fundamentales 1945, bombas atómicas al final de la II Guerra Mundial, con enormes pérdidas humanas. 1956, primera gran central de energía nuclear, Calder Hall, en el Reino Unido. Un poco de historia Modelo de un átomo Un poco de historia Esquema de niveles de energía atómicos + 9/2 EC 2.83 d 111 In 1/2+ El núcleo 0.12 ns 1 85 ns 245 keV 5/2+ 171keV 7/2+ 111 Cd 2 estable Esquema de niveles de energía nucleares El núcleo Cada átomo contiene un núcleo extremadamente denso con carga positiva, que es mucho más pequeño que el tamaño general del átomo, pero que contiene la mayor parte de su masa. Describiremos algunas propiedades generales importantes de los núcleos y de la fuerza nuclear que los mantiene unidos. La estabilidad o inestabilidad de un núcleo en particular está determinada por la competencia entre la fuerza nuclear de atracción entre protones y neutrones, y las interacciones eléctricas de repulsión entre los protones. Los núcleos inestables decaen o se desintegran, transformándose en forma espontánea en otras estructuras, a través de diversos procesos de decaimiento. El núcleo Las reacciones nucleares que alteran las estructuras pueden inducirse también mediante el impacto de una partícula o de algún núcleo sobre otro núcleo. Hay dos clases de reacciones de interés especial: la fisión y la fusión. No podríamos sobrevivir sin los 3.90x1026 de watts que produce un reactor cercano de fusión, que es nuestro Sol. El núcleo materia: átomos, unidos entre sí por enlaces químicos átomo: electrones + núcleo A Z XN núcleo: neutrones + protones N = número de neutrones Z = número de protones A = N +Z (número atómico) (número másico) El núcleo La unidad de masa atómica (uma) se define como: 1/12 parte de la masa de un átomo de 12C. Un mol de 12C contiene un número de Avogadro de átomos (6,02x1023 átomos) una masa exactamente igual a su peso atómico. Entonces: masa de un átomo de 12C =12 g / 6,02 x 1023 = 1,99x10-23 g/átomo 1 u = 1,66053886 x 10-27 kg E=mc2 1 uma = 931,48 MeV y tiene El núcleo me = 9,109x10-31 kg = 0,000549 uma mp = 1,672x10-27 kg = 1,007594 uma mn = 1,675x10-27 kg = 1,008986 uma El núcleo A Z XN Isótopos: átomos con igual Z y diferente A y N Elemento Isóbaros: igual A diferente Z Isótonos: igual N, diferente A y Z 204 80 82 132 53 78 53 79 I mezcla natural de isótopos 204 131 Hg P b 30 14 32 16 S 16 16 31 P 15 16 Isómeros: igual N, A y Z, diferentes estados energéticos (t1/2 > ms) 137mBa, 137Ba I El núcleo El núcleo Composición de algunos nucleídos El núcleo Masas de átomos neutros, para algunos nucleídos ligeros. El núcleo La estructura electrónica de un átomo, que es la responsable de sus propiedades químicas, está determinada por la carga Ze del núcleo. Los diversos isótopos de un elemento suelen tener propiedades físicas lígeramente diferentes, como sus puntos de fusión y de ebullición, y sus velocidades de difusión. Los dos isótopos comunes del uranio, con A = 235 y 238, se separan a escala industrial aprovechando las distintas velocidades de difusión del hexafluoruro de uranio (UF6), que es gaseoso, cuando contiene los dos isótopos del uranio. Tamaño, forma y otras propiedades los núcleos son casi esféricos si el 57 Z 71 elipsoides Q (momento cuadrupolar) Tamaño, forma y otras propiedades Densidad nuclear Tamaño, forma y otras propiedades Tamaño, forma y otras propiedades Experimento de dispersión de electrones R ~ (1,07 ±0,02) A1/3 fm t ~ (2,3 ±0,3) fm R = radio (electromagnético) t = espesor de la superficie Experimento de dispersión de neutrones R = 1,4 fm A1/3 * R A1/3 4r03 A V 1.12 x10 45 A m 3 3 R = radio (fuerza nuclear) la densidad es la misma en todos los núcleos = 1.4918 kg/m3 Tamaño, forma y otras propiedades 12C R= 2,7 fm = m/ V = m/ (4/3 ) R3 = 12 uma x 1,66x10-27 (kg/uma)/ (4/3 ) x (2,7x10-15 m)3 =2x1017 kg/m3 Sistemática de Z y N No todas las combinaciones de neutrones y protones forman núcleos estables De unos 2500 nucleídos conocidos sólo 264 son estables 158 49 53 4 Z Z Z Z par N par impar N par par N impar impar N impar Los demás son estructuras inestables que se desintegran para formar otros nucleídos, emitiendo partículas y radiación electromagnética mediante un proceso llamado radiactividad. La escala de tiempos de esos procesos de decaimiento va desde una pequeña fracción de microsegundo hasta miles de millones de años Z > 83 y A > 209 desintegración espontánea Sistemática de Z y N Gráfica de Segré que muestra el número de neutrones y el número de protones para nucleidos estables. Sistemática de Z y N Gráfica tridimensional de Segré para nucleidos ligeros hasta Z=22 (titanio). La cantidad graficada en el eje z es (M-A)c2, donde M es la masa del nucleido expresada en u. Esta cantidad se relaciona con la energía de enlace para cada nucleido. Sistemática de Z y N Cada línea azul perpendicular a la línea N=Z representa un valor específico del número de masa A= 5+N. . La mayor parte de las líneas de A constante sólo pasan por uno o dos nucleídos estables; esto es, en general hay un intervalo muy pequeño de estabilidad para determinado número de masa. Los puntos de la gráfica de Segré que representan nucleídos estables definen una región relativamente delgada de estabilidad. Sistemática de Z y N Para bajas masas, las cantidades de protones y neutrones son aproximadamente iguales, N~Z. La relación N/Z aumenta en forma gradual al aumentar A, hasta aproximadamente 1.6 para nucleídos de masa grande, debido a la influencia creciente de la repulsión eléctrica de los protones. Sistemática de Z y N Los puntos a la derecha de la región de estabilidad representan nucleidos que tienen demasiados protones en relación con los neutrones, para ser estables. En esos casos gana la repulsión, y el núcleo se divide. A la izquierda están los nucleidos con demasiados neutrones en relación con los protones. En esos casos, la energía asociada con los neutrones está desbalanceada con la asociada a los protones, y los nucleidos decaen en un proceso que convierte los neutrones en protones. La gráfica muestra también que no hay un nucleído con A>209 o con Z > 83 que sea estable: Un núcleo es inestable si es demasiado grande. También se observa que no hay nucleído estable con Z=43 (tecnecio) o 61 (prometio). Masas y energía de enlace masa del átomo ≠ masa del núcleo+masa e- Be- Bátomo = MN c2 + Z.me c2 – MA c2 BN = Z mp c2 + N mn.c2 – MN c2 Bátomo keV; BN MeV El núcleo más simple es el del hidrógeno, que es un protón. Después viene el núcleo 2H, el isótopo del H con número de masa 2, que se llama por lo general deuterio. Su núcleo consiste en un protón y un neutrón enlazados para formar una partícula llamada deuterón. Una medida importante de lo fuertemente unido que está enlazado un núcleo es la energía de enlace por nucleón, EB/A. Con (2.224 MeV)/(2 nucleones)=1.112 MeV por nucleón, el 2H tiene la mínima energía de enlace por nucleón de todos los núclidos. Masas y energía de enlace Casi todos los nucleídos estables, desde los más ligeros hasta los más masivos, tienen energías de enlace del orden de 7 a 9 MeV por nucleón. BN A BN/A = 8.3 MeV BN/A = cte Saturación de las fuerzas nucleares La fuerza nuclear La fuerza que une a los protones y neutrones en el núcleo, a pesar de la repulsión eléctrica de los protones, se denomina fuerza nuclear fuerte. - Independiente de la carga; neutrones y protones se enlazan y el enlace es igual para los dos. - Corto alcance, del orden de las dimensiones nucleares, 10-15 m. Dentro de este alcance, la fuerza nuclear es mucho más intensa que la eléctrica (si no, el núcleo nunca sería estable). - La densidad casi constante de la materia nuclear y la energía de enlace por nucleón casi constante de nucleidos más grandes demuestran que determinado nucleón no puede interactuar en forma simultánea con todos los demás nucleones de un núcleo, sino sólo con los que tiene en su cercanía inmediata. Esto es distinto de las fuerzas eléctricas, en donde cada protón en el núcleo repele a todos los demás (saturación). - La fuerza nuclear favorece el enlace de pares de protones o neutrones con espines opuestos, y de pares de pares, esto es, un par de protones y un par de neutrones, cada uno con espín opuesto. Por consiguiente, la partícula alfa, formada por dos protones y dos neutrones, es un núcleo de estabilidad excepcional para su número de masa. La fuerza nuclear 1930 Modelo de la gota líquida, 1928 por George Gamow, físico estadounidense de origen ruso, y desarrollado después por Niels Bohr BN y N constantes 1935 fórmula semiempírica de Weizsacker BN = [a1 A + a2 A superficie 2/3 – a3 A electrostático a1c2 = 15.7 MeV a2c2 = 17.8 MeV a3c2 = 0.712 MeV -1/3 Z2 – a4 (A-2Z)2 A-1 ± a5 A-1] c2 mecano-cuántico empírico a4c2 = 23.6 MeV a5c2 = 132 MeV ó 0 MeV