Oxidación de aldehídos y cetonas
Anuncio
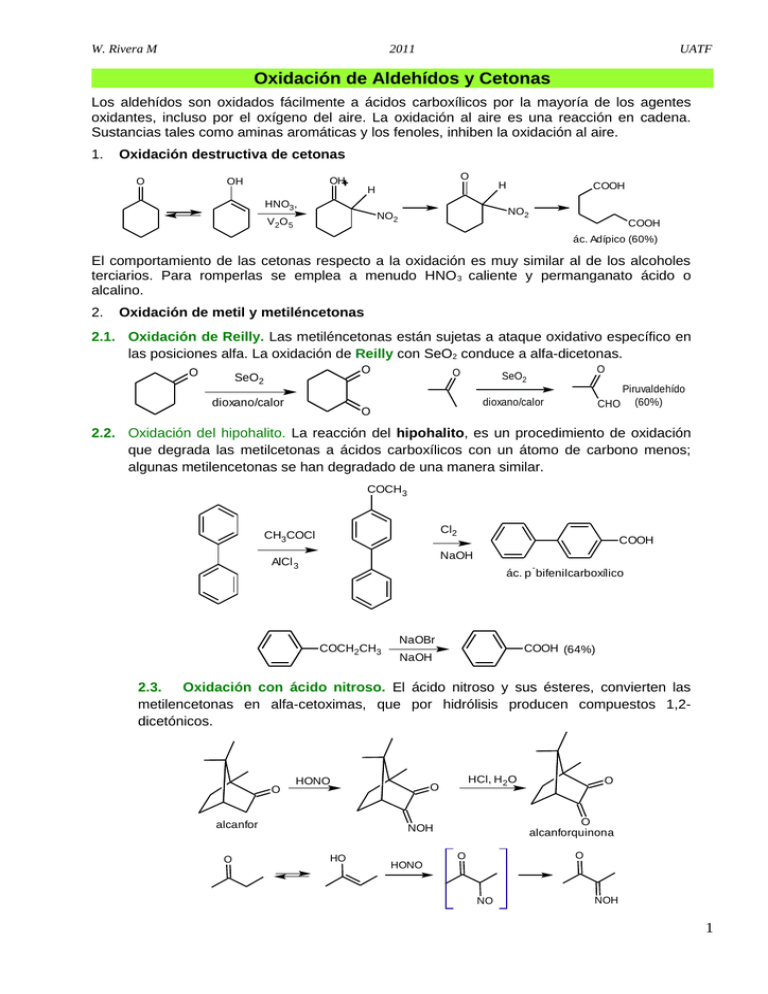
W. Rivera M 2011 UATF Oxidación de Aldehídos y Cetonas Los aldehídos son oxidados fácilmente a ácidos carboxílicos por la mayoría de los agentes oxidantes, incluso por el oxígeno del aire. La oxidación al aire es una reacción en cadena. Sustancias tales como aminas aromáticas y los fenoles, inhiben la oxidación al aire. 1. Oxidación destructiva de cetonas O OH OH O H H HNO3, NO2 NO2 V 2O 5 COOH COOH ác. Adípico (60%) El comportamiento de las cetonas respecto a la oxidación es muy similar al de los alcoholes terciarios. Para romperlas se emplea a menudo HNO 3 caliente y permanganato ácido o alcalino. 2. Oxidación de metil y metiléncetonas 2.1. Oxidación de Reilly. Las metiléncetonas están sujetas a ataque oxidativo específico en las posiciones alfa. La oxidación de Reilly con SeO2 conduce a alfa-dicetonas. O O SeO2 dioxano/calor O O SeO2 dioxano/calor O CHO Piruvaldehído (60%) 2.2. Oxidación del hipohalito. La reacción del hipohalito, es un procedimiento de oxidación que degrada las metilcetonas a ácidos carboxílicos con un átomo de carbono menos; algunas metilencetonas se han degradado de una manera similar. COCH3 Cl2 CH3COCl COOH NaOH AlCl 3 - ác. p bifenilcarboxílico COCH2CH3 NaOBr COOH (64%) NaOH 2.3. Oxidación con ácido nitroso. El ácido nitroso y sus ésteres, convierten las metilencetonas en alfa-cetoximas, que por hidrólisis producen compuestos 1,2dicetónicos. O HONO alcanfor O HCl, H 2O O O alcanforquinona NOH HO HONO O O O NO NOH 1 W. Rivera M 2011 UATF 2.4. Selenóxidos intermedios. El selenóxido formado a partir del litioenolato de la ciclohexanona con cloruro de fenilselenio, se elimina fácilmente, lo que produce un alfabeta insaturado carbonilo, compuestos de amplio uso en síntesis orgánica. OLi O O SePh PhSeCl Ph O + Se H2 O2 O - - PhSeOH THF H 2.5. Formación de Lactamas a partir de cetonas. En realidad el método se dá en dos etapas, en la primera se forma la hdroxilamina, que luego es tratada en medio ácido para producir la transposición de Beckmann y formar la lactama, O N NH2OH/H 2SO 4/NH 3 OH O - H2SO4 ó NH3/H 2O 2, TS I NH - ó NH3/O 2, M AIPO 2.6. Oxidación de Rubottom. JOC 1978, 43, 1588 OTMS O LDA, TMSCl 3. O TMSO O Oxidación de aldehídos a ácidos carboxílicos (con Ag2O) CHO COOH Ag 2O JACS 1982, 104, 5557 Ph 4. OH H2 O mCPBA Ph Formación de nitrilos a partir de aldehídos (reacción de Schmidt) H H R HN3 O RCN H2SO 4 + R N H O 5. Oxidación de aldehídos Tetrahedron 1997, 54, 401 con Oxona, (peroximonosulfato potásico). oxone RCHO acetona/H 2O RCOOH 6. Amidación oxidativa de aldehídos. Una amidación oxidativa suave y eficiente de los aldehídos alifáticos y aromáticos, utiliza las sales de amina hidrocloruradas e hidroperóxido de terc-butilo como oxidante en presencia de un catalizador de cobre y plata. (W.-J. Yoo, C.-J. Li, J. Am. Chem. Soc., 2006, 128, 13064-13065). O R H + 1,5 eq R'NH2.HCl 1 mol% CuI, 1 mol % AgIO 3 MeCN, 40ºC, 6 h 7. O 1.1. eq. tBuOOH (70% ac) 1.1. eq. CaCO 3 R N R' H Alfa-hidroxilación de enonas 2 W. Rivera M 2011 • UATF Hidroxilación asimétrica. O O HO NaN(SiMe3) 2, THF MeOOC Tetrahedron 1991, 47,173 MeOOC OMe OMe (67%) N S O • O O Con acetato de manganeso (III). O O 8. Synthesis 1990, 119 y TL 1984 25, 5839, AcO Mn(AcO) 3, AcOH Hidroxilación de enolatos de cetonas, ésteres y lactonas. • Con reactivos de Molibdeno. MoOPH [MoO5. Piridina (HMPA)]. JOC 1978, 43,188 O O O O 6-O Mo O O L L - R' R' R R O R' R THF, -78º C OH L: ligante ( PHAL ó AQN) • Con el Reactivo de Murray (Dioxiranos). Reviews : Chem , Rev. 1989, 89, 1187; ACR 1989, 27, 205; Org. Syn. 1996, 74, 91. Oxida los sulfuros a sulfóxidos y sulfonas Oxida las aminas a amina-N-oxidos Oxida los aldehídos a ácidos carboxílicos Produce la Hidroxilación de enolatos: O KHSO5 O "oxone" Este reactivo permite epoxidar, olefinas O 1) LDA 2) Cp2TiCl2 3) OH JOC 1994, 59, 2358 O O O O 9. Oxidación de sililenol éteres y enol carbonato de enonas. TL 1995, 36, 3985 O O OTMS Pd(AcO) 2 CH3CN 3 W. Rivera M 2011 O O UATF O O O OTIPS Pd(AcO) 2 (NH4) 2Ce(NO3) 6 Ph 10. Oxidación de enolatos con oxaziridinas. O N R1 R3 Tetrahedron 1989, 45, 5703; Chem. Rev. 1992, 92, 919 R2 O O O R Ph DMF, 0ºC CH3CN base R R R1 O PhO2S R1 O Ph O R1 N R R1 + PhSO2N=CHPh OH NSO2Ph Ph O O Se puede preparar el siguiente subproducto, con R1 buenos rendimientos si se PhSO2N=CHPh R1 utilizaría una oxaziridina Ph NHSO2Ph voluminosa como la oxaziridina del alcanfor. Oxidación de α, β-insaturado aldehídos a α, β-insaturado ácidos. R + R 11. Para esta Interconversión de grupo funcional se utiliza los iones clorito. Tetrahedron 1981, 37, 2091. NaClO2 NaH2PO 4 OBn t - HClO2 BuOH, H 2O OBn OBn OH CHO - - H O Cl O 12. • COOH - Epoxidación de α, β-insaturado cetonas, aldehídos y ésteres Un nuevo y simple método se describe para la oxidación en un solo paso de α, β-enonas al 1,4-enediones con buenos rendimientos. Para ello se utiliza t-butilhidroperoxido como oxidante estequiométrico y el 20% de Pd (OH)2 sobre carbono como catalizador. Los mismos reactivos se han utilizado para convertir cetales de etileno de α, β-enonas a cetales monoetilenglicol correspondientes de 1,4-enediones.( J.-Q. Yu, E. J. Corey, J. Am. Chem. Soc., 2003, 125, 3232-3233). 5 mol % Pd(OH) 2/C(20%) Y R R 1 Y 5 eq. tBuOOH, 0.5 eq. K 2CO3 CH2Cl2 4 - 24ºC, 36 - 72 h R R 1 O Y : O, -OCH 2ch2O - EóZ 4 W. Rivera M 2011 En condiciones básicas, catalizado por triton B. UATF O O tBuOOH triton B, C 6H6 JACS 1958, 80, 3845 • O (CH2)n (CH2)n La adición catalítica asimétrica de grupos alquilo a cetonas en condiciones altamente concentradas y libre de solventes permite la disminución en la carga de catalizador en un factor de 2 - a 40 veces en comparación con las condiciones de reacción estándar empleando tolueno y hexano. 0.5 mol % O O O S O NH NH S O - R 1 OTi(O iPr) 3 + OH Me 2Zn 1 - 1.2 eq. Ti(O -iPr) 4 libre de dolvente, rt, 44 - 45 h 2 eq. n R HO n 4 eq TBHP OH R 5.5. M en decano 1 O n El uso cíclico de enonas conjugadas, sin disolventes, además de la adición asimétrica de alquilos es seguida de una epoxidación diastereoselectiva del enlace olefínico con solución 5,5 M decano en solución de terc-butil hidroperóxido, generándose epoxi alcoholes.( S.-J. Jeon, H. Li, P. J. Walsh, J. Am. Chem. Soc., 2005, 127, 16416-16425.) • En condiciones básicas suaves con mCPBA COOMe O COOMe mCPBA, NaHPO 3 O TL. 1988, 23, 2793 O H H O • O Una reacción catalítica de epoxidación asimétrica de diferentes ésteres α, β-insaturados a través de una adición conjugada de un oxidante con un catalizador quiral de ytrio – biphenildiol como ligante, produce los correspondientes α, β-epoxi ésteres con un rendimiento de hasta 97%.(H. Kakei, R. Tsuji, T. Ohshima, M. Shibasaki, J. Am. Chem. Soc., 2005, 127, 8962-8963). 2 - 10 mol % O ( 1 : 1 : 1) R R : alquil, aril • ligando: - catalizador (ligando)/Y(O iPr) 3/Me 3As=O OEt 1. 2 eq TBHP (4M en tolueno) O R O O OEt O O Ms 4 Aº, THF, rt, 20 - 71 h Se ha desarrollado con éxito un proceso eficiente de peroxidación y epoxidación enantioselectiva, de sustratos cetonas alfa, beta – insaturadas con hidroperóxidos, 5 W. Rivera M 2011 UATF catalizados por quinina. Este método abre nuevas posibilidades en la síntesis asimétrica de peróxidos y epóxidos quirales. (X. Lu, Y. Liu, B. Sun, B. Cindric, L. Deng, J. Am. Chem. Soc., 2008, 130, 8134-8135.) O R R 1 + OR" 0.1 eq catalizador 1.2 eq O 0.3 eq. TFA HOOR" R Tolueno 0 a 23ºC, 2 - 24 h MeO catalizador: O R 1 H2N N H R" : C(CH 3) 3, C(CH 3) 2Ph N 13. Epoxidación de Henbest. Epoxidación dirigida por un grupo polar. O O Ph N H Ph N H mCPBA altamente selectivo O OAc OAc OAc mCPBA O OH + mCPBA O OH OH O + O 10 : 1 Selección de diastereoisómeros 1 : 4 Selección de diastereoisómeros Para los sistemas acíclicos, la epoxidación de Henbest, suele ser menos selectiva 14. Oxidación de Baeyer–Villiger de cetonas a ésteres y lactonas. Vía la inserción de oxígeno con peróxidos y perácidos. (Ácido m-Cloroperbenzoico, ácido peracético, peróxido de hidrógeno, etc). O H O O Cl O NO2 O O R1 R1 R2 HO O Ar O O • Organic Reactions 1993, 43, 251 Comprenhensive Organic Synthesis 1991, vol 7, 671. O O 2N O H O H O R2 O R1 O R2 + ArCOOH Ar La migración de R hacia uno de los oxígenos en el intermediario formado, es concertada con la ruptura simultánea del enlace O-O. No hay pérdida de la estereoquímica del sustrato 6 W. Rivera M 2011 O UATF HOOC HO O CHO HO mCPBA O O OH COOH O • O O HO HO La aptitud migratoria de los grupos sigue aproximadamente la capacidad del grupo, para estabilizar la carga positiva, de modo que el siguiente orden es perfectamente demostrable: 3º > 2º > bencil = fenil > 1º >> metil JACS 1971, 93, 1491 O O mCPBA (80%) O Tetrahedron Lett, 1977, 2173 Tetrahedron Lett, 1978, 1385 7
