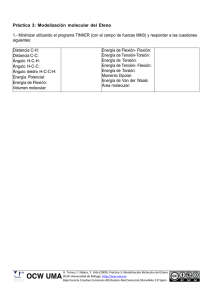
Reacciones de condensación
Anuncio

Herramientas de la Química Orgánica Herramientas de la Química Orgánica La acidez de los hidró hidrógenos en α a carbonilos Reacciones de condensación María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 1 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Los hidrógenos en α a carbonilos: carácter ácido (I) O δ− C C María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra El anión que resulta (anión enolato) estabiliza su carga por la proximidad del oxígeno, por resonancia. La carga negativa se reparte entre el C en α y el oxígeno. base O H Los electrones del enlace H-C son atraídos por el carácter positivo del carbono carbonílico, por lo que está debilitado y el protón es fácilmente extraíble por una base δ+ Herramientas de la Química Orgánica Los hidrógenos en α a carbonilos: carácter ácido (II) Los hidrógenos en posición α a un grupo carbonilo tienen un cierto carácter ácido (casi como los protones OH de un alcohol), debido a la proximidad del carbonilo. H C - C C C H C H CH3CH2CH3 CH3COCH3 CH3CHO CH3CH2OH • Los aniones enolato, obtenidos a partir de aldehídos y cetonas con H en α, actúan como nucleófilos y pueden atacar al carbono electrofílico de otros aldehídos y cetonas, dando lugar a reacciones de 19 17 15.9 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra C centro negativo nucleó nucleófilo H H C CH R centro positivo electró electrófilo • necesidad de existencia de H en posición α • necesidad de catálisis • posibilidad de condensaciones aldólicas mixtas •consideraciones sobre reactividad relativa como centro positivo y negativo C H anión enolato María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra O R Consideraciones OC 4 Herramientas de la Química Orgánica condensación - H Reacciones de condensación: condensación aldólica (I) Reacciones de condensación (I) C C anión enolato pKa ≈ 50 Compuesto 3 O- O Herramientas de la Química Orgánica O 2 5 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 6 1 Herramientas de la Química Orgánica Reacciones de condensación: condensación aldólica (II) Obtención de un aldol (molécula en la que coexisten un carbonilo y un alcohol) a partir de compuestos carbonílicos R1 C H H C R3 R1 H C R3 C H C R2 C O R4 orden H C R3 C H OH R1 C H C R4 H C O CH R1 H 7 H C R2 C H R4 R3 C H H C H C C C H R2 OH R1 CH C O C H R2 O R3 H C H R4 O C O H C R4 O R3 CH CH R3 C R4 O C R2 R1 CH CH R4 R2 O C H María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 8 Herramientas de la Química Orgánica Reacciones de condensación: la autocondensación, ejemplos O O - CH + OH- O H3C C R4 R2 Reacciones de condensación: condensación aldólica (IV), mecanismo en medio básico H3C C H R2 R1 Herramientas de la Química Orgánica C H2 O OH R3 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra H R1 H C H R4 R2 OH Reacciones de condensación: condensación aldólica (III) OH R1 OH R3 O O H C Herramientas de la Química Orgánica H2C CH O - CH H2C CH O- O C H CH + HOH H3C O- O C H CH OH O H3C C H CH + OH- María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 9 Herramientas de la Química Orgánica Reacciones de condensación: vías sintéticas a partir de aldol, ejemplos María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 10 Herramientas de la Química Orgánica La reacción de Cannizzaro Los aldehídos que carecen de H en posición α al ser tratados en medio básico, pueden sufrir una reacción simultánea de oxidación y reducción, obteniéndose el alcohol y el ácido correspondientes (transferencia de un hidruro a otro C=O) tomado de http://www.cem.msu.edu/~reusch/OrgPage/VirtualText/ María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 11 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 12 2 Herramientas de la Química Orgánica Herramientas de la Química Orgánica Los hidrógenos en α a carboxilos: carácter ácido (I) Los hidrógenos en posición α a un grupo carboxilo tienen un cierto carácter ácido (casi como los protones OH de un alcohol), debido a la proximidad del carboxilo. La acidez de los hidró hidrógenos en α a carboxilos María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 13 H O C C δ− Los electrones del enlace HC son atraídos por el carácter positivo del carbono carboxílico, por lo que está debilitado y el protón es fácilmente extraíble por una base OR δ+ María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica Los hidrógenos en α a carboxilos: carácter ácido (II) 14 Herramientas de la Química Orgánica Reacciones de condensación en carboxilos (I) Al extraer el protón mediante una base, se obtiene el anión enolato, que está estabilizado por resonancia • Los aniones obtenidos a partir de carboxilatos con H en α, actúan como nucleófilos y pueden atacar a carbono electrofílico de otros carboxilatos, o carbonilos de aldehídos y cetonas, dando lugar a reacciones de condensación O - C O C C - C OR OR anión María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 15 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra Herramientas de la Química Orgánica O R H C C---OR Obtención de β-cetoésteres grupo saliente R Consideraciones Herramientas de la Química Orgánica Reacciones de condensación (III) : la condensación de Claisen, obtención de β-cetoésteres Reacciones de condensación en carboxilos (II) centro negativo nucleó nucleófilo 16 centro positivo electró electrófilo • necesidad de existencia de H en posición α • necesidad de catálisis • posibilidad de condensaciones mixtas •consideraciones sobre reactividad relativa como centro positivo y negativo María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra CH3COOC2H5 1º NaOC2H5/HOC2H5 CH3COOC2H5 2º H3O+ CH3CO-CH2COOC2H5 acetoacetato de etilo 17 CH3COCH2COOC2H5 + CH3CH2OH CH3CO positivo CH2COOC2H5 negativo María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 18 3 Herramientas de la Química Orgánica Reacciones de condensación (III) : la condensación de Claisen, mecanismo HOC2H5 O O H - C H2 - C H2C C Herramientas de la Química Orgánica Reacciones de condensación (III) : la condensación de Claisen cruzada, 1 Obtención de un β-cetoester (molécula en la que coexisten un carbonilo y un carboxilo) a partir de compuestos carboxílicos OC2H5 OC2H5 OC2H5 H3C R1 C H3C - O O C C H2 H3C C OC2H5 - O C C H2 O C R1 OC2H5 OC2H5 OC2H5 Herramientas de la Química Orgánica Reacciones de condensación (III) : la condensación de Claisen cruzada, 2 O R1 R3 C C R2 R2 O R3 C C R1 R2 CH OR’ R4 H C OR’ O R1 C C R4 O C R3 H C O C R3 OR’ H C R4 C OR’ R3 O R1 C C R4 O C R3 OR’ H C OR’ orden R4 R3 C C O R1 C C R4 R2 O C OR’ María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 20 Herramientas de la Química Orgánica Reacciones de condensación: vías sintéticas a partir de Claisen, ejemplos O OR’ O C OR’ R2 O R1 C CH OR’ C H C C R2 R4 R3 C R3 OR’ R4 O H C C R4 H C R1 O H C R2 19 María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra H C H C R2 OC2H5 O O O O R2 O C María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra OR’ 21 tomado de http://www.cem.msu.edu/~reusch/OrgPage/VirtualText/ María Font. Dpto. Química Orgánica y Farmacéutica. Sección de Modelización Molecular. Universidad de Navarra 22 4